Method Article
Децеллюляризованные каркасы, полученные из яблока, для инженерии костной ткани in vitro и in vivo
В этой статье
Резюме
В этом исследовании мы подробно описываем методы децеллюляризации, физической характеристики, визуализации и имплантации in vivo биоматериалов растительного происхождения, а также методы посева и дифференцировки клеток в скаффолдах. Описанные методы позволяют оценить биоматериалы растительного происхождения для применения в инженерии костной ткани.
Аннотация
Биоматериалы из целлюлозы растительного происхождения используются в различных приложениях тканевой инженерии. Исследования in vivo показали замечательную биосовместимость каркасов из целлюлозы, полученной из природных источников. Кроме того, эти каркасы обладают структурными характеристиками, которые имеют отношение к нескольким тканям, и они способствуют инвазии и пролиферации клеток млекопитающих. Недавние исследования с использованием децеллюляризованной ткани яблочного гипантия продемонстрировали сходство размера пор с размером пор трабекулярной кости, а также его способность эффективно поддерживать остеогенную дифференцировку. В настоящем исследовании также был изучен потенциал целлюлозных каркасов, полученных из яблок, для применения в инженерии костной ткани (BTE) и оценены их механические свойства in vitro и in vivo . Преостеобласты MC3T3-E1 были высеяны в целлюлозные каркасы, полученные из яблок, которые затем были оценены на предмет их остеогенного потенциала и механических свойств. Окрашивание щелочной фосфатазой и ализариновым красным S подтвердило остеогенную дифференцировку в скаффолдах, культивируемых в дифференцировочной среде. Гистологическое исследование показало обширную клеточную инвазию и минерализацию скаффолдов. Сканирующая электронная микроскопия (СЭМ) выявила минеральные агрегаты на поверхности скаффолдов, а энергодисперсионная спектроскопия (ЭДС) подтвердила наличие фосфатных и кальциевых элементов. Однако, несмотря на значительное увеличение модуля Юнга после дифференцировки клеток, он оставался ниже, чем у здоровой костной ткани. Исследования in vivo показали клеточную инфильтрацию и отложение внеклеточного матрикса в децеллюляризованных каркасах, полученных из яблок, после 8 недель имплантации в кальварию крыс. Кроме того, сила, необходимая для удаления каркасов из костного дефекта, была аналогична ранее зарегистрированной нагрузке при переломе нативной пяточной кости. В целом, это исследование подтверждает, что целлюлоза, полученная из яблок, является многообещающим кандидатом для применения в заушных аппаратах. Тем не менее, несходство между его механическими свойствами и свойствами здоровой костной ткани может ограничить его применение сценариями с низкой нагрузкой. Для улучшения механических свойств целлюлозных лесов, полученных из яблок, может потребоваться дополнительная структурная реконструкция и оптимизация.
Введение
Большие костные дефекты, вызванные травмой или заболеванием, часто требуют трансплантатов биоматериала для полной регенерации1. Современные методы, предназначенные для улучшения регенерации костной ткани, регулярно используют аутологичные, аллогенные, ксеногенные или синтетические трансплантаты2. Для аутологичной костной пластики, которая считается «золотым стандартом» трансплантации для исправления больших костных дефектов, кость извлекается у пациента. Тем не менее, эта процедура трансплантации имеет ряд недостатков, включая ограничения по размеру и форме, доступность тканей и заболеваемость в месте забора материала3. Кроме того, процедуры аутологичной трансплантации подвержены инфекциям в области хирургического вмешательства, последующим переломам, образованию гематомы в месте забора или реконструкции, а также послеоперационным болям4. Инженерия костной ткани (BTE) является потенциальной альтернативой традиционным методам костной пластики5. Он сочетает в себе структурные биоматериалы и клетки для построения новой функциональной костной ткани. При разработке биоматериалов для заушных аппаратов крайне важно сочетать макропористую структуру, химический состав поверхности, способствующий прикреплению клеток, и механические свойства, близкие к свойствам нативной кости6. Прошлые исследования показали, что идеальный размер пор и модуль упругости для биоматериалов, используемых в заушных материалах, составляют примерно 100-200мкм7 и 0,1-20 ГПа соответственно, в зависимости от места пересадки8. Кроме того, пористость и взаимосвязь пор каркасов являются критическими факторами, влияющими на миграцию клеток, диффузию питательных веществ и ангиогенез8.
BTE показала многообещающие результаты с различными биоматериалами, разработанными и оцененными в качестве альтернативы костным трансплантатам. Некоторые из этих биоматериалов являются остеоиндуктивными материалами, гибридными материалами и усовершенствованными гидрогелями8. Остеоиндуктивные материалы стимулируют развитие новообразованных костных структур. Гибридные материалы состоят из синтетических и/или природных полимеров8. Усовершенствованные гидрогели имитируют внеклеточный матрикс (ВКМ) и способны доставлять необходимые биологически активные факторы для содействия интеграции костной ткани8. Гидроксиапатит является традиционным материалом и распространенным выбором для заушных заушных аппаратов благодаря своему составу и биосовместимости9. Биоактивное стекло является еще одним типом биоматериала для БТЭ, который, как было показано, стимулирует специфические клеточные реакции для активации генов, необходимых для остеогенеза10,11. Биоразлагаемые полимеры, в том числе полигликолевая кислота и полимолочная кислота, также широко используются в заушных материалах12. Наконец, натуральные полимеры или полимеры природного происхождения, такие как хитозан, хитин и бактериальная целлюлоза, также продемонстрировали обнадеживающие результаты для BTE13. Однако, несмотря на то, что как синтетические, так и натуральные полимеры имеют потенциал для заушных слуховых аппаратов, разработка функционального каркаса с желаемой макроструктурой, как правило, требует обширных протоколов.
И наоборот, нативные макроскопические целлюлозные структуры могут быть легко получены из различных растений, и наша исследовательская группа ранее продемонстрировала применимость каркасов на основе целлюлозы, полученных из растений, для различных реконструкций тканей. Действительно, после простой обработки поверхностно-активным веществом мы использовали присущую растительному материалу структуру, подчеркнув его потенциал в качестве универсального биоматериала14. Кроме того, эти каркасы на основе целлюлозы могут быть использованы для применения в культуре клеток млекопитающих in vitro 14, являются биосовместимыми и поддерживают спонтанную подкожную васкуляризацию 14,15,16,17. Как наша исследовательская группа, так и другие продемонстрировали, что эти скаффолды могут быть получены из конкретных растений в зависимости от предполагаемого применения 14,15,16,17,18,19,20. Например, сосудистая структура, наблюдаемая в стеблях и листьях растений, обнаруживает поразительное сходство со структурой, обнаруженной в тканях животных19. Кроме того, целлюлозные каркасы, полученные из растений, могут быть легко сформированы и подвергнуты поверхностным биохимическим модификациям для достижения желаемых характеристик16. В недавнем исследовании мы включили солевой буфер во время процесса децеллюляризации, что привело к усилению прикрепления клеток, наблюдаемому как в условиях in vitro, так и in vivo 16. В этом же исследовании мы продемонстрировали применимость целлюлозных скаффолдов растительного происхождения в композитных биоматериалах путем отливки гидрогелей на поверхность скаффолдов. В недавних исследованиях было показано, что функционализация скаффолдов растительного происхождения повышает их эффективность18. Например, исследование, проведенное Fontana et al. (2017), показало, что адгезия дермальных фибробластов человека поддерживалась децеллюляризованными стеблями, покрытыми RGD, в то время как стебли без покрытия не проявляли такой способности18. Более того, авторы также продемонстрировали, что модифицированная смоделированная жидкость организма может быть использована для искусственной минерализации децеллюляризованных стеблей растений. В более поздних исследованиях мы изучили концепцию механочувствительного остеогенеза в целлюлозных скаффолдах растительного происхождения и оценили их потенциал для BTE17,20. Кроме того, Lee et al. (2019) использовали скаффолды растительного происхождения для культивирования костноподобных тканей в условиях in vitro 21. Проведя всестороннюю оценку различных растительных источников, авторы определили, что скаффолды, полученные из яблок, являются наиболее оптимальными для культивирования и дифференцировки индуцированных плюрипотентных стволовых клеток человека (ИПСК). Кроме того, авторы предположили, что структурные и механические характеристики лесов, полученных из яблок, играют ключевую роль в их пригодности для использования по назначению. Будучи первыми каркасами растительного происхождения, реализованными в приложениях тканевой инженерии, яблочные каркасы, как было показано, обладают поразительно похожей архитектурой на человеческую кость, особенно с точки зрения их взаимосвязанных пор размером от 100 до 200 мкм и диаметром14,21.
В настоящем исследовании мы дополнительно изучили потенциал целлюлозных скаффолдов из яблок для заушных ушей и провели анализ их механических свойств как in vitro, так и in vivo. Несмотря на то, что были проведены исследования потенциала яблочных скаффолдов для заушных ушных ушей 17,20,21, их механические свойства были недостаточно изучены. Результаты показали дикую инвазию и остеогенную дифференцировку преостеобластов MC3T3-E1, высеянных в каркасы, которые культивировали в дифференцировочной среде в течение 4 недель. Модуль Юнга этих скаффолдов составил 192,0 ± 16,6 кПа, что было значительно выше, чем у пустых скаффолдов (скаффолдов без засеянных клеток) (31,6 ± 4,8 кПа) и клеточных скаффолдов, культивируемых в недифференцированной среде (24,1 ± 8,8 кПа). Тем не менее, следует отметить, что модуль Юнга здоровой костной ткани человека обычно находится в диапазоне 0,1-2 ГПа для трабекулярной кости и примерно 15-20 ГПа для кортикальной кости8. Тем не менее, после 8-недельной имплантации в дефект головного мозга грызуна, засеянные клетками каркасы, по-видимому, были хорошо интегрированы в окружающую кость, о чем свидетельствует средняя пиковая сила 113,6 Н ± 18,2 Н в тестах на выталкивание, что аналогично ранее зарегистрированной нагрузке на перелом нативной пяточной кости22. В целом, результаты, полученные в ходе этого исследования, показывают значительные перспективы, особенно для приложений, не несущих нагрузки. Тем не менее, целлюлозные каркасы, полученные из яблок, в настоящее время не обладают необходимыми механическими свойствами для точного соответствия окружающей костной ткани в месте установки имплантата. Следовательно, требуется дальнейшая разработка, чтобы раскрыть весь потенциал этих лесов.
протокол
Протоколы экспериментов были рассмотрены и одобрены Комитетом по уходу за животными Университета Оттавы.
1. Подготовка строительных лесов
- С помощью мандолинного слайсера нарежьте яблоки McIntosh (Canada Fancy) ломтиками толщиной 8 мм. Нарежьте ткань гипантия яблочных долек на квадраты размером 5 мм х 5 мм.
- Поместите квадратные образцы в 0,1% додецилсульфат натрия (SDS) на 2 дня.
- Промойте децеллюляризованные образцы деионизированной водой и инкубируйте их в течение ночи при комнатной температуре (RT) в 100 мМ CaCl2 для удаления оставшегося поверхностно-активного вещества.
- Стерилизуют образцы (т.е. скаффолды) в 70% этаноле в течение 30 минут, промывают их деионизированной водой и помещают в 24-луночный культуральный планшет перед посевом клеток.
2. Посев клеточных культур и каркасов
- Храните клетки MC3T3-E1 Subclone 4 в чашках, обработанных клеточными культурами диаметром 10 см, в условиях клеточной культуры (37°C во влажной атмосфере, содержащей 95% воздуха и 5%CO2).
- Приготовьте питательную среду для клеток, изготовленную из минимально необходимой среды Eagle - альфа-модификации (α-MEM), дополненную 10% фетальной бычьей сывороткой (FBS) и 1% пенициллином/стрептомицином.
- Отделите клетки от культуральных чашек путем трипсинизации (0,05% трипсина-ЭДТА), как только они достигнут 80% слияния.
- Центрифугируют клеточную суспензию при 200 x g в течение 3 мин. Аспирируют надосадочную жидкость и ресуспендируют клетки в α-MEM со скоростью 2,5 x10,7 клеток на мл.
- Пипетку 40 мкл аликвоты клеточной суспензии наносят на поверхность скаффолдов и дают клеткам прилипнуть в течение 1 ч в условиях клеточной культуры. Затем добавляют по 2 мл питательной среды в каждую культуральную лунку культуральной планшетки.
- Пополняйте питательную среду каждые 2-3 дня в течение 14 дней.
- Приготовьте среду для дифференцировки, добавив 50 мкг/мл аскорбиновой кислоты и 4 мМ фосфата натрия к ранее описанной питательной среде клеток.
- Индуцируют дифференцировку клеток MC3T3-E1 путем инкубации скаффолдов в дифференцировочной среде в течение 4 недель. Пополняйте средство каждые 3-4 дня. Параллельно инкубируют скаффолды в недифференцируемой питательной среде (т.е. среде без добавок для индуцирования дифференцировки) в течение того же времени, с тем же графиком смены среды, чтобы служить отрицательным контролем.
3. Измерение размера пор с помощью конфокальной лазерной сканирующей микроскопии
- Промойте децеллюляризованные яблочные каркасы фосфатно-солевым буфером (PBS).
- Инкубируют скаффолды в 1 мл 10% (v/v) калькофторного белого пятна в течение 25 мин в темноте при RT.
- Промойте скаффолды (n = 3) PBS и отобразите три случайно выбранные области на каркасе с помощью высокоскоростного резонансного конфокального лазерного сканирующего микроскопа (CLSM) с 10-кратным увеличением с использованием канала DAPI следующим образом:
- Конфигурация лазерно-эмиссионного фильтра: 405 нм (лазер); 425-475 нм (излучение)
- Отрегулируйте мощность лазера и детектор вручную, чтобы обеспечить оптимальное получение изображения. Получите z-стек из 20 изображений с шагом 5 мкм.
- С помощью программного обеспечения ImageJ обработайте и проанализируйте конфокальные изображения следующим образом:
- Используйте функцию Z-Проецировать на максимальную интенсивность для создания изображения и примените функцию Найти края , чтобы выделить край пор.
- Обведите поры вручную с помощью инструмента «Произвольное выделение ».
- Подгоните каждую пору в виде эллипса, измерьте длину большой оси, соберите все измерения (всего 54 в данном исследовании - 6 в 3 случайно выбранных областях для каждого каркаса) и вычислите среднюю длину.
4. Анализ распределения клеток с помощью конфокальной лазерной сканирующей микроскопии
- Промыть клеточные каркасы, культивируемые в недифференцированной или дифференцировочной среде, три раза PBS. Зафиксируйте каркасы 4% параформальдегидом на 10 мин.
- Тщательно промыть каждый каркас деионизированной водой, промыть ячейки раствором Тритона-Х 100 в течение 5 мин и снова промыть ПБС.
- Скаффолды инкубируют в 1 мл 1% периодической кислоты в течение 40 мин и промывают деионизированной водой14,16.
- Инкубируют скаффолды в 1 мл раствора, содержащего 100 мМ метабисульфита натрия и 0,15 М соляной кислоты, с добавлением 100 мкг/мл йодида пропидия. Полностью погрузите строительные леса в раствор.
- Промойте скаффолды PBS и окрасьте клеточные ядра, инкубируя скаффолды в растворе DAPI 5 мг/мл в течение 10 мин в темноте. Тщательно промойте еще раз и поместите каркасы в PBS перед визуализацией.
- Изображение трех случайно выбранных поверхностей трех различных ячеечных каркасов с высокоскоростным резонансным CLSM при 10-кратном увеличении с использованием каналов DAPI и TRITC следующим образом:
- Конфигурация лазерно-эмиссионного фильтра:
DAPI: Лазер: 405 нм; Излучение: 425-475 нм
TRITC: Лазер: 561 нм; Излучение: 570-620 нм - Отрегулируйте мощность лазера и детектор вручную, чтобы обеспечить оптимальное получение изображения. Получите z-стек из 20 изображений с шагом 5 мкм.
- Конфигурация лазерно-эмиссионного фильтра:
- Используйте программное обеспечение ImageJ для обработки конфокальных изображений и создания максимальной проекции по оси Z для анализа изображений с помощью функции Z-Project to Maximum Intensity .
5. Анализ щелочной фосфатазы
- Промыть клеточные каркасы, культивируемые в недифференцированной или дифференцировочной среде, три раза PBS. Закрепите каркасы 10% нейтральным буферизованным формалином в течение 30 минут. Закрепите пустые скаффолды (скаффолды без засеянных ячеек), чтобы они служили отрицательным контролем.
- Приготовьте раствор для окрашивания 5-бром-4-хлор-3'-индолифосфата и нитросинего тетразолия (BCIP/NBT), растворив одну таблетку BCIP/NBT в 10 мл деионизированной воды.
- Неподвижные каркасы промыть 0,05% раствором Tween и окрасить раствором BCIP/NBT в течение 20 мин при RT. Вымойте окрашенные каркасы 0,05% раствором Tween и храните их в PBS перед визуализацией.
- Изображение окрашенных лесов с помощью 12-мегапиксельной цифровой камеры.
6. Анализ отложения кальция
- Промыть клеточные каркасы, культивируемые в недифференцированной или дифференцировочной среде, три раза PBS. Закрепите каркасы 10% нейтральным буферизованным формалином в течение 30 минут. Закрепите пустые скаффолды (скаффолды без засеянных ячеек), чтобы они служили отрицательным контролем.
- Приготовьте 2% раствор для окрашивания ализарина красного S (ARS).
- Неподвижные скаффолды промыть деионизированной водой и окрасить их раствором ARS в течение 1 ч при RT. Промойте окрашенные каркасы деионизированной водой и храните их в PBS перед визуализацией.
- Изображение окрашенных лесов с помощью 12-мегапиксельной цифровой камеры.
7. Минерализационный анализ
- Промыть клеточные каркасы, культивируемые в недифференцированной или дифференцировочной среде, три раза PBS. Закрепите каркасы 4% параформальдегидом в течение 48 ч. Закрепите пустые скаффолды (скаффолды без засеянных ячеек), чтобы они служили отрицательным контролем.
- Обезвоживают образцы в растворах, содержащих концентрацию этанола, увеличивая с 50% до 100%, как описано ранее23.
- Выполняйте сканирующую электронную микроскопию (СЭМ) и энергодисперсионную спектроскопию (ЭДС) для анализа минеральных агрегатов следующим образом:
- Высушите образцы с помощью сушилки в критической точке, следуя протоколу производителя24.
- Нанесите 5-нм золотое покрытие на каркасы с помощью устройства для нанесения золотого напыления в соответствии с протоколомпроизводителя 25.
- Изображение поверхности скаффолдов с помощью сканирующего электронного микроскопа, установленного на 3 кВ, при 85-кратном увеличении.
- Выполните ЭЦП, настроив сканирующий электронный микроскоп на напряжение 15 кВ. На трех случайно выбранных участках для каждого каркаса получите спектры EDS для анализа состава минеральных агрегатов.
8. Измерения модуля Юнга
- Извлеките засеянные клетками каркасы из соответствующей инкубационной среды и немедленно протестируйте образцы.
- Используя изготовленный по индивидуальному заказу одноосный компрессионный аппарат, оснащенный тензодатчиком 1,5 Н, сжимайте каркасы (n = 3 на условие) с постоянной скоростью 3 мм·мин-1 до максимальной деформации сжатия 10% от высоты леса.
- Определите модуль Юнга по наклону линейной части кривых зависимости напряжения от деформации. В настоящем исследовании модуль упругости определялся между 9% и 10% деформацией.
9. Анализ клеточной инфильтрации и минерализации с помощью гистологии: скаффолды in vitro
- Промывают клеточные каркасы, культивируемые в недифференцированной или дифференцировочной среде, три раза PBS.
- Зафиксируйте засеянные клетками каркасы 4% параформальдегидом в течение 48 ч перед повторной суспензией в 70% этаноле для хранения.
- Гистология:
ПРИМЕЧАНИЕ: В настоящем исследовании вся гистологическая подготовка (встраивание, срезы и окрашивание), описанная на следующих этапах, была выполнена Центром гистологии Луизы Пеллетье (Университет Оттавы).- После обезвоживания и погружения в парафин образцы разрезают на последовательные отрезки толщиной 5 мкм, начиная с 1 мм внутри каркасов, и устанавливают срезы на предметные стекла микроскопа.
- Окрасьте срезы гематоксилином и эозином (H&E) или красителями по Коссе (VK).
- Изображение срезов с помощью диагонального микроскопа при 40-кратном увеличении (n = 1 скаффолд в недифференцируемой среде и n = 2 скаффолда в дифференцированной среде в настоящем исследовании).
- С помощью программного обеспечения ImageJ можно визуально оценить инфильтрацию клеток (окрашивание H&E) и минерализацию (окрашивание VK).
10. Модель дефекта железа крысы
- Получите экспериментальные протоколы, проверенные и одобренные местным комитетом по уходу за животными.
- Подготовьте круглые (диаметром 5 мм и толщиной 1 мм) децеллюляризованные каркасы в соответствии с разделом 1, описанным выше, и с помощью 5-миллиметрового биопсийного пуансона.
- Выполняйте двустороннюю трепанацию черепа в соответствии с установленным протоколом26 следующим образом:
- Обезболивайте крыс-самцов Спрэга-Доули изофлураном, сначала на 3%, пока они не потеряют сознание, а затем на 2-3% на протяжении всей процедуры.
- Обнажите надкостницу и череп, разрезав вышележащую кожу лезвием скальпеля. Удалите надкостницу.
- Создать двусторонние дефекты в обеих теменных костях с каждой стороны сагиттального шва с помощью бормашины, оснащенной трепаном диаметром 5 мм, при постоянном орошении 0,9% NaCl.
- Очистите окружающую кость 0,9% NaCl, чтобы удалить любые костные фрагменты.
- Поместите круглые децеллюляризованные каркасы в дефекты.
- Закройте вышележащую кожу швами 4-0.
- Обеспечьте крысам неограниченный доступ к еде и воде и ежедневно наблюдайте за ними.
- Через 8 недель после имплантации усыпляют крыс ингаляциейСО2 и перфорацией грудной клетки в качестве вторичной меры эвтаназии.
- Чтобы обнажить череп и извлечь имплантаты, удалите кожу, покрывающую череп, с помощью лезвия скальпеля.
- Разрежьте череп по лобной и затылочной костям, а также по бокам обеих теменных костей с помощью бормашины, чтобы полностью удалить верхнюю часть черепа.
11. Испытание на выталкивание
- Подключите одноосное компрессионное устройство (с тензодатчиком 445 Н) к USB-модулю сбора данных.
- Подключите модуль сбора данных к компьютеру, оснащенному программным обеспечением для сбора данных.
- Сразу после извлечения черепа поместите каждый образец (n = 7 имплантатов от 4 животных в настоящем исследовании) на держатель образца одноосного компрессионного устройства так, чтобы дорсальная сторона кости была обращена вверх.
- Опустите поршень со скоростью 0,5 мм/мин до легкого касания извлеченного имплантата.
- Начните испытание, опустив поршень через имплантат до полного выталкивания при одновременном сжатии с постоянной скоростью 0,5 мм/мин с помощью программного обеспечения для сбора данных.
- Запишите пиковое усилие на кривой зависимости силы от смещения с помощью программного обеспечения для сбора данных.
12. Анализ клеточной инфильтрации и минерализации с помощью гистологии: скаффолды in vivo
- Извлеченную кальварию и имплантаты зафиксируют в 10% нейтральном буферном формалине в течение 72 ч перед повторной суспензией в 70% этаноле для хранения.
- Гистология:
ПРИМЕЧАНИЕ: В настоящем исследовании вся гистологическая подготовка (встраивание, секционирование и окрашивание), описанная на следующих этапах, была выполнена компанией Accel Labs (Монреаль, Квебек, Канада).- Разрежьте образцы (погруженные в метилметакрилат) на секции толщиной 6 мкм на трех разных уровнях (сверху, снизу и ближе к центру) и закрепите их на предметных стеклах микроскопа.
- Окрасьте срезы трихромом H&E или трихромом Массона-Гольднера (MGT).
- Изображение срезов с помощью микроскопа-сканера предметных стекол при 40-кратном увеличении (4 эксплантата от 2 животных в настоящем исследовании).
- С помощью программного обеспечения ImageJ можно визуально оценить клеточную инфильтрацию (окрашивание H&E) и осаждение коллагена (окрашивание MGT).
Результаты
Измерение размера пор, распределение клеток и минерализация in vitro (Рисунок 1 и Рисунок 2)
Полное удаление нативных клеточных компонентов каркасов тканей яблони было достигнуто после обработки скаффолдов SDS и CaCl2 (рис. 1А). Каркасы имели высокопористую структуру, что было подтверждено с помощью конфокальной микроскопии. Количественная оценка изображений показала, что средний размер пор составляет 154 мкм ± 40 мкм. Распределение пор по размерам варьировало от 73 мкм до 288 мкм. Однако большинство пор находились в диапазоне от 100 мкм до 200 мкм (рис. 1C).
После 4-недельного периода культивирования в дифференцировочной среде на клеточных каркасах были обнаружены обширные белые минеральные отложения (рис. 1А). Скаффолды, содержащие клетки, имели непрозрачную белую окраску, что указывает на минерализацию, которая не наблюдалась в пустых скаффолдах (скаффолдах без засеянных клеток). Кроме того, анализ с помощью конфокальной лазерной сканирующей микроскопии выявил однородное распределение клеток внутри скаффолдов (рис. 1B).
Каркасы, засеянные или не засеянные клетками, окрашивали BCIP/NBT и ARS для анализа активности и минерализации ALP соответственно (рис. 1D). Окрашивание BCIP/NBT выявило существенное увеличение активности ЩФ (обозначенное ярко-фиолетовым цветом) в клеточных каркасах, культивируемых в дифференцировочной среде, в отличие от пустых скаффолдов или клеточных каркасов, культивируемых в недифференцированной среде. Аналогичным образом, клеточные каркасы, культивируемые в дифференцирующей среде, демонстрировали более интенсивный красный цвет при окрашивании ARS, что указывает на большую минерализацию по сравнению с пустыми каркасами или клеточными каркасами, культивированными в недифференцированной среде. В пустых скаффолдах наблюдалось фоновое окрашивание, возможно, из-за присутствия CaCl2 в протоколе децеллюляризации.
Для анализа клеточной инфильтрации и минерализации на скаффолдах проводили окрашивание (H&E и VK), а для дальнейшей оценки минерализации использовали SEM и EDS (рис. 2). Окрашивание H&E (рис. 2A) показало хорошую клеточную инфильтрацию в клеточных каркасах, культивируемых в недифференцировочной или дифференцировочной среде. Множественные ядра были видны на периферии и по всей поверхности каркасов. Наличие коллагена также наблюдалось в скаффолдах бледно-розового цвета. Кроме того, окрашивание VK, проведенное на скаффолдах после 4 недель культивирования в дифференцирующей среде, показало, что стенки пор были окрашены, в то время как отложения кальция были обнаружены только вдоль внешних краев стенок пор в каркасах, культивируемых в недифференцированной среде, и могли быть результатом абсорбции кальция во время децеллюляризационной обработки. Локализованная минерализация на поверхности клеточных каркасов, культивируемых в дифференцировочной среде, в течение 4 недель наблюдалась методом СЭМ-анализа (рис. 2Б). В частности, на периферии пор наблюдались залежи полезных ископаемых, напоминающие сфероидальные агрегаты. В отличие от этого, минеральные агрегаты не наблюдались на пустых скаффолдах или клеточных каркасах, культивируемых в течение 4 недель в недифференцированной среде. Отчетливые характерные пики, соответствующие фосфору (P) и кальцию (Ca), наблюдались в спектрах EDS выбранных областей интереса, в частности, на месторождениях минералов, наблюдаемых на клеточных каркасах, культивируемых в течение 4 недель в дифференцировочной среде (рис. 2B).
Биомеханический анализ in vitro (рис. 3)
Модуль Юнга клеточных каркасов измеряли через 4 недели культивирования в недифференцировочной или дифференцировочной среде (n = 3 для каждого условия эксперимента). Его сравнивали с модулем Юнга пустых скаффолдов (скаффолдов без затравочных ячеек) (рис. 3). Не наблюдалось существенных различий в модуле между пустыми скаффолдами (31,6 кПа ± 4,8 кПа) и клеточными каркасами, культивируемыми в недифференцированной среде (24,1 кПа ± 8,8 кПа; p = 0,88). Напротив, была отмечена существенная разница между модулем пустых скаффолдов (31,6 кПа ± 4,8 кПа) и клеточных каркасов, культивируемых в дифференцировочной среде (192,0 кПа ± 16,6 кПа; стр . < 0,001). Кроме того, наблюдалась достоверная разница (p < 0,001) между модулями Юнга клеточных каркасов, культивируемых в недифференцировочных и дифференцировочных средах. На дополнительном рисунке 1 показана типичная кривая зависимости напряжения от деформации для расчета модуля Юнга.
Биомеханические показатели in vivo и регенерация костной ткани (рис. 4 и рис. 5)
Хирургическая трепанация черепа была проведена в общей сложности на 6 крысах линии Спрэга-Доули. В обеих теменных костях черепа с помощью трепанового бора были созданы двусторонние дефекты диаметром 5 мм, а в дефекты железа имплантированы целлюлозные каркасы из яблок без затравленных клеток (рис. 4А). Через 8 недель после имплантации животных усыпили, а верхняя часть их черепов была собрана и обработана либо для механического тестирования, либо для гистологического анализа.
Основываясь на визуальной оценке, каркасы, по-видимому, были хорошо интегрированы в окружающие череп ткани. Для количественной оценки интеграции скаффолдов (n = 7) в кальварию хозяина были проведены механические испытания на выталкивание. Измерения проводили с помощью одноосного компрессионного устройства (рис. 4Б) сразу после эвтаназии животных. Результаты показали, что пиковая сила составила 113,6 Н ± 18,2 Н (табл. 1).
Для оценки клеточной инфильтрации и отложения внеклеточного матрикса в имплантированных скаффолдах был проведен гистологический анализ (рис. 5). Окрашивание H&E выявило клеточную инфильтрацию в порах каркаса и признаки васкуляризации, о чем свидетельствует наличие кровеносных сосудов внутри каркасов. Кроме того, окрашивание МГТ продемонстрировало наличие коллагена в каркасах.
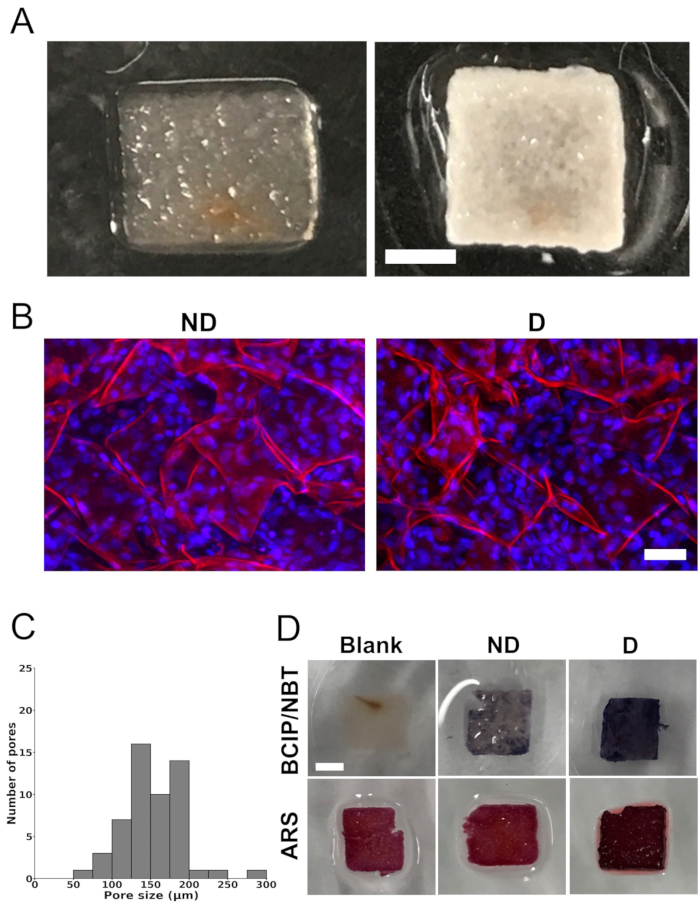
Рисунок 1: Изображения каркаса, распределение пор по размерам и минерализация in vitro . (A) Репрезентативные фотографии целлюлозного каркаса, полученного из яблока, после удаления нативных клеток и поверхностно-активного вещества (слева) и каркаса, засеянного клетками MC3T3-E1 после 4 недель культивирования в среде остеогенной дифференцировки (справа). Масштабная линейка представляет собой 2 мм. (B) Репрезентативные изображения конфокального лазерного сканирующего микроскопа, показывающие засеянные клетки в целлюлозных каркасах, полученных из яблок, после 4 недель культивирования в недифференцированной среде («ND») или среде остеогенной дифференцировки («D»). Масштабная линейка соответствует 50 мкм. Окрашивание проводили на каркасах для целлюлозы (красный) с использованием йодида пропидия и для клеточных ядер (синий) с использованием DAPI. (C) Распределение пор по размерам децеллюляризованных целлюлозных каркасов, полученных из яблок, перед посевом клеток MC3T3-E1, по максимальным проекциям по оси Z конфокальных изображений. Анализ был проведен в общей сложности на 54 порах в 3 различных скаффолдах (6 пор в 3 случайно выбранных областях интереса на каждый скаффолд). (D) Репрезентативные изображения каркасов, окрашенных 5-бром-4-хлор-3'-индолифосфатом и нитросиним тетразолием (BCIP/NBT) для оценки активности щелочной фосфатазы (ЩФ) и ализариновым красным S (ARS) для визуализации отложения кальция, указывающего на минерализацию (масштабная линейка = 2 мм - относится ко всем). Скаффолды, помеченные как «пустые» (скаффолды без засеянных клеток), не показали окрашивания BCIP/NBT, что указывает на отсутствие активности ЩФ. С другой стороны, клеточные каркасы, культивируемые в дифференцировочной среде («D»), демонстрировали более высокую активность ЩФ, на что указывает более интенсивный синий цвет, по сравнению с клеточными каркасами, культивируемыми в недифференцированной среде («ND»). При окрашивании ARS как пустые скаффолды, так и скаффолды, культивируемые в недифференцируемой среде («ND»), демонстрировали более светлый оттенок красного по сравнению со скаффолдами, культивированными в дифференцирующей среде («D»). Наличие осаждения кальция в скаффолдах, культивируемых в дифференцировочной среде («D»), было проиллюстрировано интенсивным темно-красным цветом. Каждый анализ проводился на трех разных скаффолдах (n = 3). Эта фигура была адаптирована с разрешения Leblanc Latour (2023)27. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Анализ гистологии, сканирующей электронной микроскопии (СЭМ) и энергодисперсионной спектроскопии (ЭДС) скаффолдов in vitro . (А) Репрезентативные изображения верхних гистологических срезов скаффолдов. Покрытые парафином каркасы были разрезаны на участки толщиной 5 мкм, которые были окрашены гематоксилином и эозином (H&E) для визуализации клеточной инфильтрации или фон Коссой (VK) для визуализации минерализации внутри каркасов. Скаффолды были инфильтрированы клетками MC3T3-E1, о чем свидетельствует синее (ядра) и розовое (цитоплазма) окрашивание, видимое на периферии и по всей поверхности скаффолдов. Коллаген (бледно-розовый) также был виден (увеличенная вставка "H&E - D"). Минерализация наблюдалась только на периферии стенок пор в скаффолдах, культивируемых в недифференцированной среде («НД»). Стенки пор в каркасах, культивируемых в дифференцирующей среде («D»), были полностью окрашены в черный цвет. Анализ проводили на одном каркасе, культивированном в недифференцируемой среде («НД»), и на двух скаффолдах, культивируемых в дифференцирующей среде («D») (масштабная линейка для снимков с меньшим увеличением = 1 мм, масштабная линейка для снимков с большим увеличением = 50 мкм). (B) Репрезентативные микрофотографии, полученные с помощью спектров SEM, а также EDS. Скаффолды подвергались покрытию золотым напылением и визуализировались с помощью полево-эмиссионного сканирующего электронного микроскопа при напряжении 3,0 кВ (масштабная линейка = 100 мкм - относится ко всем). Спектры ЭДС были получены на каждом скаффолде. Пики фосфора (2,013 кэВ) и кальция (3,69 кэВ) обозначены на каждом спектре ЭДС. Как SEM, так и EDS выполнялись на трех разных скаффолдах. Бланк: скаффолды без засеянных ячеек. Эта фигура была адаптирована с разрешения Leblanc Latour (2023)27. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Модули Юнга скаффолдов in vitro после 4 недель культивирования в недифференцирующей среде (ND) или дифференцировочной среде (D). Данные представлены в виде среднего значения ± стандартной ошибки среднего значения (SEM) трех реплицированных выборок для каждого условия. Статистическая значимость (* обозначает p<0,05) определяли с помощью одностороннего дисперсионного анализа (ANOVA) и post-hoc критерия Тьюки. Бланк: скаффолды без засеянных ячеек. Эта фигура была адаптирована с разрешения Leblanc Latour (2023)27. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Фотография каркаса до имплантации и тест на выталкивание через 8 недель после имплантации: (A) Репрезентативная фотография каркаса до имплантации; (B) Одноосное компрессионное устройство, используемое для испытаний на выталкивание, с тензодатчиком, обозначенным звездочкой (*), и образцом, обозначенным стрелкой. Эта фигура была адаптирована с разрешения Leblanc Latour (2023)27. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Гистологический анализ скаффолдов in vitro . Репрезентативные изображения гистологических срезов незасеянных скаффолдов через 8 недель после имплантации. Срезы окрашивали либо гематоксилином и эозином (H&E) для визуализации клеток, либо трихромом Массона-Гольднера (MGT) для визуализации коллагена. Стрелка указывает на эритроциты. Видно наличие коллагена (масштабная линейка = 1 мм и 200 мкм для левой и правой вставок соответственно). Эта фигура была адаптирована с разрешения Leblanc Latour (2023)27. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Номер образца | Пиковое усилие (Н) |
| 1 | 92.8 |
| 2 | 162.7 |
| 3 | 140.3 |
| 4 | 135.7 |
| 5 | 37.7 |
| 6 | 157.8 |
| 7 | 67.9 |
| Значить | 113.6 |
| СЭМ | 18.2 |
Таблица 1: Измеренное пиковое усилие при испытаниях на выталкивание.
Дополнительный рисунок 1: Типичная кривая зависимости напряжения от деформации для расчета модуля Юнга. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Несколько исследований in vitro и in vivo продемонстрировали биосовместимость целлюлозы растительного происхождения и ее потенциальное использование в тканевой инженерии 14,15,16,18,19,20, в частности, для проведения остеогенной дифференциации 20,21. Целью настоящего исследования было дальнейшее изучение потенциала целлюлозных скаффолдов из яблок для заушных ушей и оценка механических свойств этих скаффолдов как in vitro, так и in vivo.
Для исследований in vitro клетки преостеобластов (MC3T3-E1) были высеяны в каркасы после удаления нативных клеток из ткани яблока. Клетки MC3T3-E1 обычно используются для исследования биоминерализации внеклеточного матрикса 28,29,30. Затем скаффолды культивировали в течение 4 недель в остеогенной дифференцировочной или недифференцировочной среде. Результаты показали, что клетки пролиферировали и подверглись дифференцировке внутри каркасов, особенно при культивировании в дифференцировочной среде, что подчеркивает потенциал целлюлозных каркасов, полученных из яблок, для поддержки развития костной ткани. Клеточные ядра были обнаружены в большом количестве в порах каркаса, что подтверждает наблюдения, о которых сообщалось в более ранних исследованиях 14,15,16,17,20,21. Более того, как и в случае с предыдущими результатами14 и другой группы21, средний диаметр пор каркаса составлял ~154 мкм, причем большинство пор имели диаметр от 100 мкм до 200 мкм (рис. 1C). Эти размеры согласуются с идеальным диапазоном размеров пор (100–200 мкм), который, как известно, способствует росту костей7.
Анализ окрашивания показал более высокую активность ЩФ после 4-недельного периода культивирования в дифференцировочной среде. На поверхности клеточных каркасов, культивируемых в дифференцировочной среде, наблюдалось больше отложений кальция по сравнению как с пустыми каркасами, так и с клеточными каркасами, культивируемыми в недифференцированной среде. Аналогичные результаты наблюдались с дифференцированными ИПСК в яблочных скаффолдах21. Несмотря на то, что в настоящем исследовании было качественно оценено наличие ЩФ, для количественного анализа могут быть проведены дополнительные анализы. Гистологическая оценка скаффолдов дополнительно подтвердила, что инфильтрированные остеобласты минерализовали скаффолды после дифференцировки. Примечательно, что периферия конструктов, культивируемых в недифференцируемой среде, также была окрашена ВК. Остаточный CaCl2 в скаффолдах, возможно, вызвал это неспецифическое окрашивание, наблюдаемое на периферии после децеллюляризации. Для дальнейшей оценки минерализации был проведен качественный анализ снимков СЭМ. После культивирования в дифференцировочной среде клеточные каркасы демонстрировали признаки минерализации ECM. Минеральные агрегаты были видны на поверхности каркаса, особенно по краям пор. Эти наблюдения согласуются с предыдущими исследованиями с использованием ECM30 и скаффолдоврастительного происхождения 21. Эти агрегаты отсутствовали на поверхности лесов без засеянных клеток. EDS-анализ агрегатов выявил наличие высоких уровней P и Ca, что позволяет предположить наличие апатита. Следует отметить, что, хотя протокол, описанный в настоящем исследовании, позволяет визуализировать клеточную инфильтрацию и наличие минерализации, он не позволяет оценить их прогрессирование с течением времени. Для полной оценки этого прогрессирования необходимо провести гистологический анализ в несколько временных точек. Кроме того, потребуется дальнейший анализ для количественной оценки клеточной инфильтрации и минерализации как на поверхности, так и по всему каркасу. Наконец, в то время как элементный состав месторождений полезных ископаемых был определен с помощью EDS, для получения информации о кристаллической структуре наблюдаемых месторождений могут потребоваться другие методы характеризации, такие как рентгеновская дифракция (XRD).
Модуль Юнга скаффолдов был достоверно выше после культивирования в дифференцировочной среде (примерно в 8 раз). Напротив, модуль упругости скаффолдов, культивируемых в недифференцированной среде, напоминал таковой у пустых скаффолдов (скаффолдов без засеянных клеток), аналогично результатам, полученным в предыдущем исследовании с яблочными скаффолдами20. Несмотря на более высокий модуль Юнга скаффолдов, культивируемых в дифференцировочной среде, он оставался значительно ниже, чем у естественной кости (0,1–2 ГПа для трабекулярной кости и от 15 до 20 ГПа для кортикальной кости)8, губчатого аллотрансплантата (3,78 ГПа)31, аллопластических трансплантатов из полиэфирэфиркетона (3,84 ГПа)31, титана (50,20 ГПа)31 и кобальт-хромового сплава (53,15 ГПа)31 Имплантаты. Таким образом, строительные леса в их нынешнем составе могут не подходить для несущих применений. Следует отметить, что модуль Юнга дает информацию о жесткости материала. Тем не менее, предел текучести также может быть рассмотрен для обеспечения более широкого понимания механических свойств лесов.
Затем децеллюляризованные яблочные каркасы имплантировали в 5-миллиметровые двусторонние дефекты железа критического размера у крыс (n = 6 животных). Тесты на выталкивание (на 7 эксплантах), проведенные для оценки интеграции каркасов в кальварию хозяина, показали, что средняя пиковая сила составила 113,6 Н ± 18,2 Н, что аналогично нагрузке на перелом, о которой сообщалось ранее для пяточной кости (127,1 ± 9,6 Н)22, что позволяет предположить, что каркасы хорошо интегрировались в окружающую костную ткань. Следует, однако, отметить, что тест на выталкивание дает информацию только о границе раздела между каркасом и окружающими тканями. В предыдущих исследованиях испытания на выталкивание сочетались с испытаниями на вдавливание, чтобы обеспечить более широкое понимание механических свойств интерфейса кость-имплантат и самого каркаса22. Кроме того, двусторонние дефекты более склонны к несоосности с плунжером32. Правильное размещение эксплантата черепа, модели с одним дефектом или дополнительной системы зажима на универсальном испытательном устройстве потенциально может предотвратить смещение32.
Таким образом, это исследование подтвердило, что целлюлозные каркасы, полученные из яблок, могут способствовать адгезии и пролиферации преостеобластов. Кроме того, минерализация происходила в клеточных каркасах, культивируемых в дифференцировочной среде, что приводило к увеличению модуля Юнга каркаса. Однако модуль упругости оставался значительно ниже, чем у натуральной кости. Интересно, что сила, необходимая для смещения имплантированных целлюлозных каркасов, полученных из яблока, была сопоставима с нагрузкой на перелом черепной кости и других типов каркасов, ранее использовавшихся для BTE22. Наконец, как и в предыдущих отчетах, клетки проникли в имплантированные каркасы и отложили коллаген. В целом, это исследование демонстрирует потенциал целлюлозных каркасов, полученных из растений, для применения в заушных аппаратах. Эти результаты согласуются с предыдущим исследованием, проведенным другой исследовательской группой, что еще раз подтверждает пригодность целлюлозных каркасов растительного происхождения для заушных целей21. Тем не менее, разница в жесткости каркасов по сравнению с трабекулярной или кортикальной костью подчеркивает важность разработки композитных биоматериалов, которые могут более точно соответствовать механическим свойствам естественной кости. Поэтому, несмотря на растущий интерес к использованию строительных лесов растительного происхождения для заушных целей, их использование может быть ограничено ненесущими приложениями. Какмы показали ранее, реинжиниринг целлюлозных каркасов растительного происхождения путем химической модификации или разработки композитов с другими биологическими/синтетическими полимерами может иметь важное значение для несущих приложений.
Раскрытие информации
Заявление о конфликте интересов: M.L.L., M.T. R.J.H., C.M.C., I.C. и A.P. являются изобретателями по патентным заявкам, поданным Университетом Оттавы и компанией Spiderwort Inc. в отношении использования целлюлозы растительного происхождения для заушных применений. M.L.L., R.J.H., C.M.C. и A.P. имеют финансовые интересы в Spiderwort Inc.
Благодарности
Финансирование этого проекта было предоставлено Советом по естественным наукам и инженерным исследованиям Канады (NSERC) (грант на открытие) и Фондом Ли Ка Шина. M.L.L. получил поддержку от программы Ontario Centers of Excellence TalentEdge, а R.J.H. получил стипендию для аспирантов NSERC и стипендию для выпускников Онтарио (OGS).
Материалы
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | ThermoFisher | D1306 | DAPI |
| Alizarin red S | Sigma-Aldrich | A5533 | ARS |
| Ascorbic acid | Sigma-Aldrich | A4403 | Cell Culture |
| Calcium Chloride | ThermoFisher | AA12316 | CaCl2 |
| Calcofluor White | Sigma-Aldrich | 18909 | |
| Dental drill | Surgical tool | ||
| Ethanol | ThermoFisher | 615095000 | |
| Fetal bovine serum | Hyclone Laboratories | SH30396 | FBS |
| Formalin | Sigma-Aldrich | HT501128 | 10% Formalin |
| Goldner's trichrome stain | Sigma-Aldrich | 1.00485 | GTC |
| Hematoxylin and eosin stain | Fisher Scientific | NC1470670 | H&E |
| High-speed resonant confocal laser scanning microscope | Nikon | Nikon Ti-E A1-R | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| ImageJ software | National Institutes of Health | ||
| Irrigation saline | Baxter | JF7123 | 0.9% NaCl |
| MC3T3-E1 Subclone 4 cells | ATCC | CRL-2593 | Pre-osteoblast cells |
| McIntosh apples | Canada Fancy grade | ||
| Methyl methacrylate | Sigma-Aldrich | M55909 | Histological embedding |
| Minimum Essential Medium | ThermoFisher | M0894 | α-MEM |
| Paraformaldehyde | Fisher Scientific | O4042 | 4%; PFA |
| Penicillin/Streptomycin | Hyclone Laboratories | SV30010 | Cell Culture |
| Periodic acid | Sigma-Aldrich | 375810 | |
| Phosphate buffered saline | Hyclone Laboratories | 2810305 | PBS; without Ca2+ and Mg2+ |
| Propidium iodide | Invitrogen | p3566 | |
| Scanning electron microscope | JEOL | JSM-7500F FESEM | SEM and EDS |
| Slide scanner microscope | Zeiss | AXIOVERT 40 CFL | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166 | SDS |
| Sodium metabisulphite | Sigma-Aldrich | 31448 | |
| Sodium phosphate | ThermoFisher | BP329 | |
| Sprague-Dawley rats | Charles-River Laboratories | 400 | Male |
| Sutures | Ethicon | J494G | 4-0 |
| Trephine | ACE Surgical Supply Co | 583-0182 | 5-mm diameter |
| Triton-X 100 | ThermoFisher | 807423 | |
| Trypsin | Hyclone Laboratories | SH30236.02 | Cell Culture |
| Tween | Fisher Scientific | BP337 | |
| Universal compression Device | CellScale | UniVert | |
| Von Kossa stain | Sigma-Aldrich | 1.00362 | Histology |
Ссылки
- Schmitz, J. P., Hollinger, J. O. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clinical Orthopaedics and Related Research. 205, 299-308 (1986).
- Yu, X., Tang, X., Gohil, S. V., Laurencin, C. T. Biomaterials for bone regenerative engineering. Advanced Healthcare Materials. 4 (9), 1268-1285 (2015).
- Parikh, S. N. Bone graft substitutes: Past, present, future. Journal of Postgraduate Medicine. 48 (2), 142-148 (2002).
- Silber, J. S., et al. Donor site morbidity after anterior iliac crest bone harvest for single-level anterior cervical discectomy and fusion. Spine (Phila Pa 1976). 28 (2), 134-139 (2003).
- Amini, A. R., Laurencin, C. T., Nukavarapu, S. P. Bone tissue engineering: recent advances and challenges. Critical Reviews in Biomedical Engineering. 40 (5), 363-408 (2012).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. Journal of Biomechanical Engineering. 122 (6), 570-575 (2000).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Bose, S., Roy, M., Bandyopadhyay, A. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnology. 30 (10), 546-554 (2012).
- Yoshikawa, H., Myoui, A. Bone tissue engineering with porous hydroxyapatite ceramics. Journal of Artificial Organs. 8 (3), 131-136 (2005).
- Fu, Q., Saiz, E., Rahaman, M. N., Tomsia, A. P. Bioactive glass scaffolds for bone tissue engineering: state of the art and future perspectives. Materials Science & Engineering. C, Materials for Biological Applications. 31 (7), 1245-1256 (2011).
- Xynos, I. D., Edgar, A. J., Buttery, L. D. K., Hench, L. L., Polak, J. M. Ionic products of bioactive glass dissolution increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochemical and Biophysical Research Communications. 276 (2), 461-465 (2000).
- Kroeze, R., Helder, M., Govaert, L., Smit, T. Biodegradable polymers in bone tissue engineering. Materials. 2 (3), 833-856 (2009).
- Venkatesan, J., Vinodhini, P. A., Sudha, P. N. Chitin and chitosan composites for bone tissue regeneration. Advances in Food and Nutrition Research. 73, 59-81 (2014).
- Modulevsky, D. J., Lefebvre, C., Haase, K., Al-Rekabi, Z., Pelling, A. E. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS One. 9 (5), e97835(2014).
- Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Biocompatibility of subcutaneously implanted plant-derived cellulose biomaterials. PLoS One. 11 (6), e0157894(2016).
- Hickey, R. J., Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Customizing the shape and microenvironment biochemistry of biocompatible macroscopic plant-derived cellulose scaffolds. ACS Biomaterials Science & Engineering. 4 (11), 3726-3736 (2018).
- Hickey, R. J., Leblanc Latour, M., Harden, J. L., Pelling, A. E. Designer scaffolds for interfacial bioengineering. Advanced Engineering Materials. 25, 2201415(2023).
- Fontana, G., et al. Biofunctionalized plants as diverse biomaterials for human cell culture. Advanced Healthcare Materials. 6 (8), 1601225(2017).
- Gershlak, J. R., et al. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials. 125, 13-22 (2017).
- Leblanc Latour, M., Pelling, A. E. Mechanosensitive osteogenesis on native cellulose scaffolds for bone tissue engineering. Journal of Biomechanics. 135, 111030(2022).
- Lee, J., Jung, H., Park, N., Park, S. H., Ju, J. H. Induced osteogenesis in plants decellularized scaffolds. Scientific Reports. 9 (1), 20194(2019).
- Zhao, J., et al. Enhanced healing of rat calvarial defects with sulfated chitosan-coated calcium-deficient hydroxyapatite/bone morphogenetic protein 2 scaffolds. Tissue Engineering. Part A. 18 (1-2), 185-197 (2012).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. In: Modern Electron Microscopy in Physical and Life Sciences. , 161-186 (2016).
- tousimis Critical Point Dryers - Samdri®-PVT-3D. , https://tousimis.com/critical_point_dryers/detail.html?Pid=8755B (2022).
- Leica EM ACE200 Vacuum Coater. , https://www.leica-microsystems.com/products/sample-preparation-for-electron-microscopy/p/leica-em-ace200/ (2023).
- Spicer, P. P. Evaluation of bone regeneration using the rat critical size calvarial defect. Nature Protocols. 7 (10), 1918-1929 (2012).
- Leblanc Latour, M. Cellulose biomaterials for bone tissue engineering [dissertation]. , Department of Physics, Faculty of Science, University of Ottawa, Ottawa, Canada. (2023).
- Kodama, H. -A., Amagai, Y., Sudo, H., Kasai, S., Yamamoto, S. Establishment of a clonal osteogenic cell line from newborn mouse calvaria. Japanese Journal of Oral Biology. 23 (4), 899-901 (1981).
- Wang, D., et al. Isolation and characterization of MC3T3-E1 preosteoblast subclones with distinct in vitro and in vivo differentiation/mineralization potential. Journal of Bone and Mineral Research. 14 (6), 893-903 (1999).
- Addison, W. N., et al. Extracellular matrix mineralization in murine MC3T3-E1 osteoblast cultures: An ultrastructural, compositional and comparative analysis with mouse bone. Bone. 71, 244-256 (2015).
- Heary, R. F., Parvathreddy, N., Sampath, S., Agarwal, N. Elastic modulus in the selection of interbody implants. Journal of Spine Surgery. 3 (2), 163-167 (2017).
- Lawson, Z. T., et al. Methodology for performing biomechanical push-out tests for evaluating the osseointegration of calvarial defect repair in small animal models. MethodsX. 8, 101541(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены