Method Article
用于体外和体内骨组织工程的脱细胞苹果衍生支架
摘要
在这项研究中,我们详细介绍了植物基生物材料的脱细胞、物理表征、成像和 体内 植入方法,以及支架中细胞接种和分化的方法。所描述的方法允许评估用于骨组织工程应用的植物基生物材料。
摘要
植物来源的纤维素生物材料已被用于各种组织工程应用。 体内 研究表明,由天然来源的纤维素制成的支架具有显着的生物相容性。此外,这些支架具有与多种组织相关的结构特征,它们促进哺乳动物细胞的侵袭和增殖。最近使用脱细胞苹果蒺菌组织的研究表明,其孔径与小梁骨的孔径相似,并且能够有效支持成骨分化。本研究进一步研究了苹果衍生纤维素支架在骨组织工程(BTE)应用中的潜力,并评估了其 体外 和 体内 力学性能。将 MC3T3-E1 成骨前细胞接种在苹果来源的纤维素支架中,然后评估其成骨潜力和机械性能。碱性磷酸酶和茜素红 S 染色证实了在分化培养基中培养的支架的成骨分化。组织学检查显示整个支架上有广泛的细胞侵袭和矿化。扫描电子显微镜(SEM)显示支架表面有矿物聚集体,能量色散光谱(EDS)证实了磷酸盐和钙元素的存在。然而,尽管细胞分化后杨氏模量显着增加,但仍低于健康骨组织。 体内 研究表明,在大鼠颅骨中植入 8 周后, 脱细胞的苹果衍生支架内的细胞浸润和细胞外基质的沉积。此外,从骨缺损中移除支架所需的力与先前报道的自体颅骨骨折负荷相似。总体而言,这项研究证实了苹果衍生的纤维素是BTE应用的有前途的候选者。然而,其机械性能与健康骨组织之间的差异可能会限制其在低承重情况下的应用。可能需要进行额外的结构重新设计和优化,以增强用于承重应用的苹果衍生纤维素支架的机械性能。
引言
由损伤或疾病引起的大骨缺损通常需要生物材料移植物才能完全再生1.目前旨在改善骨组织再生的技术通常使用自体、同种异体、异种或合成移植物2。对于自体骨移植,被认为是修复大骨缺损的“金标准”移植实践,从患者身上提取骨骼。然而,这种移植手术有几个缺点,包括大小和形状限制、组织可用性和采样部位发病率3。此外,自体移植手术容易受到手术部位感染、随后的骨折、取样或重建部位血肿形成以及术后疼痛的影响4.骨组织工程 (BTE) 为传统骨移植方法提供了一种潜在的替代方案5.它结合了结构性生物材料和细胞来构建新的功能性骨组织。在设计用于 BTE 的生物材料时,将大孔结构、促进细胞附着的表面化学以及与天然骨非常相似的机械性能相结合至关重要6.过去的研究表明,BTE 中使用的生物材料的理想孔径和弹性模量分别约为 100-200 μm7 和 0.1-20 GPa,具体取决于接枝位点8。此外,支架的孔隙度和孔隙互连性是影响细胞迁移、营养扩散和血管生成的关键因素8。
BTE在开发和评估各种生物材料作为骨移植物的替代选择方面显示出有希望的结果。其中一些生物材料是骨诱导材料、混合材料和高级水凝胶8.骨诱导材料刺激新形成的骨骼结构的发育。混合材料由合成和/或天然聚合物组成8.先进的水凝胶模仿细胞外基质 (ECM),能够提供必要的生物活性因子来促进骨组织整合8.羟基磷灰石是一种传统材料,由于其成分和生物相容性,是 BTE 的常见选择9.生物活性玻璃是BTE的另一种生物材料,已被证明可以刺激特定的细胞反应以激活成骨所必需的基因10,11。可生物降解的聚合物,包括聚乙醇酸和聚乳酸,也已广泛用于BTE应用12。最后,壳聚糖、几丁质和细菌纤维素等天然或天然衍生的聚合物也显示出令人鼓舞的 BTE13 结果。然而,虽然合成聚合物和天然聚合物都显示出BTE的潜力,但开发具有所需宏观结构的功能支架通常需要广泛的方案。
相反,天然的宏观纤维素结构可以很容易地从不同的植物中衍生出来,我们的研究小组之前证明了来自植物的纤维素基支架对不同组织重建的适用性。事实上,经过简单的表面活性剂处理后,我们利用了植物材料的固有结构,突出了其作为多功能生物材料的潜力14。此外,这些基于纤维素的支架可用于体外哺乳动物细胞培养应用14,具有生物相容性,并支持自发皮下血管形成14,15,16,17。我们的研究小组和其他人都已经证明,这些支架可以根据预期的应用从特定植物中获得 14,15,16,17,18,19,20。例如,在植物茎和叶中观察到的维管结构与在动物组织中发现的结构表现出惊人的相似性19。此外,源自植物的纤维素支架可以很容易地成型并进行表面生化修饰,以实现所需的特性16。在最近的一项研究中,我们在脱细胞过程中掺入了盐缓冲液,从而增强了在体外和体内环境中观察到的细胞附着16。在同一项研究中,我们通过将水凝胶浇注到支架表面,证明了植物来源的纤维素支架在复合生物材料中的适用性。在最近的研究中,植物来源支架的功能化已被证明可以提高其有效性18.例如,Fontana等人(2017)进行的一项研究表明,人真皮成纤维细胞的粘附得到了RGD涂层脱细胞茎的支持,而未涂层的茎则没有表现出相同的能力18。此外,作者还证明,改良的模拟体液可用于人工矿化脱细胞的植物茎。在最近的研究中,我们探索了植物来源的纤维素支架中机械敏感成骨的概念,并评估了它们对 BTE17,20 的潜力。此外,Lee 等人(2019 年)利用植物来源的支架在体外环境中培养骨样组织21。通过对不同植物来源的综合评估,作者确定苹果衍生的支架是人类诱导多能干细胞(hiPSCs)培养和分化的最佳选择。此外,作者提出,苹果衍生支架的结构和机械属性在其是否适合预期用途方面起着关键作用。作为组织工程应用中最早实施的植物衍生支架,苹果衍生支架已被广泛证明具有与人体骨骼惊人相似的结构,特别是在其直径为 100 至 200 μm 的相互连接的孔隙方面14,21。
在本研究中,我们进一步研究了苹果衍生纤维素支架对BTE的潜力,并对其在 体外 和 体内的力学性能进行了分析。尽管已经对苹果衍生支架对 BTE17、20、21 的潜力进行了研究,但其机械性能尚未得到充分研究。结果显示,在分化培养基中培养 4 周的支架中接种的 MC3T3-E1 成骨前细胞具有野生扩散侵袭和成骨分化。这些支架的杨氏模量为192.0±16.6 kPa,显著高于空白支架(无接种细胞的支架)(31.6±4.8 kPa)和在非分化培养基中培养的细胞接种支架(24.1±8.8 kPa)。然而,应该注意的是,健康人体骨组织的杨氏模量通常在小梁骨的 0.1-2 GPa 范围内,皮质骨的 Young 模量通常在 15-20 GPa 的范围内8.然而,在啮齿动物颅骨缺损中植入 8 周后,细胞播种的支架似乎很好地融入了周围的骨骼,正如推出测试中的平均峰值力为 113.6 N ± 18.2 N 所证明的那样,这与先前报道的天然颅骨22 的骨折负荷相似。总体而言,从这项研究中获得的结果显示出巨大的前景,特别是对于非承重应用。然而,苹果衍生的纤维素支架目前不具备必要的机械性能,无法精确匹配植入部位的周围骨组织。因此,需要进一步开发以释放这些支架的全部潜力。
研究方案
实验方案由渥太华大学动物护理委员会审查和批准。
1. 支架准备
- 使用曼陀林切片机将麦金托什苹果(Canada Fancy)切成 8 毫米厚的薄片。将苹果片的 hypanthium 组织切成 5 毫米 x 5 毫米的正方形。
- 将方形样品置于 0.1% 十二烷基硫酸钠 (SDS) 中 2 天。
- 用去离子水洗涤脱细胞样品,并在室温 (RT) 下在 100 mM CaCl2 中孵育过夜以除去剩余的表面活性剂。
- 在70%乙醇中对样品(即支架)灭菌30分钟,用去离子水洗涤,并在细胞接种前将其置于24孔培养板中。
2. 细胞培养和支架接种
- 在细胞培养条件下(在95%空气和5%CO2的湿化气氛中为37°C),在直径为10cm的细胞培养处理的培养皿中维持MC3T3-E1亚克隆4细胞。
- 制备由 Eagle 最低必需培养基 - α 修饰 (α-MEM) 制成的细胞培养基,并补充有 10% 胎牛血清 (FBS) 和 1% 青霉素/链霉素。
- 一旦细胞达到80%汇合度,通过胰蛋白酶消化(0.05%胰蛋白酶-EDTA)将细胞从培养皿中分离出来。
- 将细胞悬液以约200× g 离心3分钟。吸出上清液,并以每mL2.5×107 个细胞的速度将细胞重悬于α-MEM中。
- 将40μL等分试样的细胞悬液移液到支架表面,让细胞在细胞培养条件下粘附1小时。随后,向培养板的每个培养孔中加入 2 mL 培养基。
- 每 2-3 天补充一次培养基,持续 14 天。
- 通过向先前描述的细胞培养基中加入 50 μg/mL 抗坏血酸和 4 mM 磷酸钠来制备分化培养基。
- 通过将支架在分化培养基中孵育 4 周来诱导 MC3T3-E1 细胞的分化。每 3-4 天补充一次培养基。同时,将支架在非分化培养基(即没有添加剂诱导分化的培养基)中孵育相同的持续时间,使用相同的培养基更换时间表作为阴性对照。
3. 使用共聚焦激光扫描显微镜测量孔径
- 用磷酸盐缓冲盐水 (PBS) 清洗脱细胞的苹果衍生支架。
- 将支架在 1 mL 10% (v/v) calcofluor 白色染色剂中在室温下在黑暗中孵育 25 分钟。
- 用PBS洗涤支架(n = 3),并使用DAPI通道,用高速共振共聚焦激光扫描显微镜(CLSM)以10倍放大倍率对每个支架随机选择的三个区域进行成像,如下所示:
- 激光发射滤光片配置:405 nm(激光);425-475 nm (发射)
- 手动调整激光功率和探测器,以确保最佳图像采集。以 5 μm 步长获取 20 张图像的 z 堆栈。
- 使用 ImageJ 软件,按如下方式处理和分析共聚焦图像:
- 使用 “Z投影至最大强度 ”功能创建图像,并应用 “查找边缘 ”功能突出显示孔隙的边缘。
- 使用 “手绘选择 ”工具手动描摹毛孔。
- 将每个孔拟合为椭圆,测量长轴的长度,编译所有测量值(本研究中总共 54 个 - 每个支架随机选择的 3 个区域中的 6 个),并计算平均长度。
4. 使用共聚焦激光扫描显微镜进行细胞分布分析
- 用PBS洗涤在非分化或分化培养基中培养的细胞接种支架三次。用4%多聚甲醛固定支架10分钟。
- 用去离子水彻底洗涤每个支架,用Triton-X 100溶液透化细胞5分钟,然后再次用PBS洗涤。
- 将支架在 1 mL 1% 高碘酸中孵育 40 分钟,并用去离子水冲洗 14,16。
- 将支架在含有 100 mM 焦亚硫酸钠和 0.15 M 盐酸的 1 mL 溶液中孵育,并补充有 100 μg/mL 碘化丙啶。将支架完全浸入溶液中。
- 用PBS洗涤支架,并通过将支架在5mg / mL DAPI溶液中在黑暗中孵育10分钟来染色细胞核。再次彻底清洗并在成像前将支架存放在 PBS 中。
- 使用 DAPI 和 TRITC 通道,在 10 倍放大倍率下使用高速共振 CLSM 对三种不同细胞种子支架的三个随机选择的表面进行成像,如下所示:
- 激光发射滤光片配置:
DAPI:激光:405 nm;发射波长:425-475 nm
TRITC:激光:561 nm;发射波长:570-620 nm - 手动调整激光功率和探测器,以确保最佳图像采集。以 5 μm 步长获取 20 张图像的 z 堆栈。
- 激光发射滤光片配置:
- 使用 ImageJ 软件处理共聚焦图像,并在 z 轴上创建最大投影,以便使用 Z 投影到最大强度 功能进行图像分析。
5. 碱性磷酸酶分析
- 用PBS洗涤在非分化或分化培养基中培养的细胞接种支架三次。用10%中性缓冲福尔马林固定支架30分钟。固定空白支架(没有接种细胞的支架)作为阴性对照。
- 通过将一片 BCIP/NBT 片剂溶解在 10 mL 去离子水中来制备 5-溴-4-氯-3'-吲哚磷酸盐和硝基蓝四唑 (BCIP/NBT) 染色溶液。
- 用0.05%吐温溶液洗涤固定支架,并在室温下用BCIP / NBT溶液染色20分钟。
- 用 1200 万像素数码相机对染色的支架进行成像。
6. 钙沉积分析
- 用PBS洗涤在非分化或分化培养基中培养的细胞接种支架三次。用10%中性缓冲福尔马林固定支架30分钟。固定空白支架(没有接种细胞的支架)作为阴性对照。
- 制备2%(w / v)茜素红S(ARS)染色溶液。
- 用去离子水洗涤固定支架,并在室温下用ARS溶液染色1小时。
- 用 1200 万像素数码相机对染色的支架进行成像。
7. 矿化分析
- 用PBS洗涤在非分化或分化培养基中培养的细胞接种支架三次。用4%多聚甲醛固定支架48小时。固定空白支架(没有接种细胞的支架)作为阴性对照。
- 如前所述,在含有乙醇浓度从50%增加到100%的溶液中对样品进行脱水23。
- 执行扫描电子显微镜 (SEM) 和能量色散光谱 (EDS) 以分析矿物聚集体,如下所示:
- 按照制造商的方案24,使用临界点干燥器干燥样品。
- 按照制造商的方案25,使用金溅射镀膜机在支架上涂上 5 nm 金涂层。
- 使用设置为3 kV,放大倍率为85倍的扫描电子显微镜对支架表面进行成像。
- 通过将扫描电子显微镜设置为 15 kV 来执行 EDS。在每个支架随机选择的三个区域上,获取用于矿物聚集体成分分析的 EDS 光谱。
8. 杨氏模量测量
- 从各自的孵育培养基中取出细胞接种的支架,并立即测试样品。
- 使用配备 1.5 N 称重传感器的定制单轴压缩装置,以 3 mm·min-1 的恒定速率将支架(每种条件下 n = 3)压缩至支架高度 10% 的最大压缩应变。
- 根据应力-应变曲线线性部分的斜率确定杨氏模量。在本研究中,模量在9%至10%应变之间确定。
9. 组织学细胞浸润和矿化分析: 体外 支架
- 用PBS洗涤在非分化或分化培养基中培养的细胞接种支架三次。
- 用4%多聚甲醛固定细胞接种的支架48小时,然后重悬于70%乙醇中储存。
- 组织学:
注:在本研究中,后续步骤中描述的整个组织学准备(包埋、切片和染色)由 Louise Pelletier 组织学核心设施(渥太华大学)进行。- 脱水并包埋在石蜡中后,将样品切成 5 μm 厚的连续切片,从支架内 1 mm 开始,然后将切片安装在显微镜载玻片上。
- 用苏木精和伊红 (H&E) 或 von Kossa (VK) 染色切片。
- 用载玻片扫描仪显微镜以 40 倍放大倍率对切片进行成像(在本研究中,非分化培养基中的 n = 1 个支架,分化培养基中的 n = 2 个支架)。
- 使用 ImageJ 软件,目视评估细胞浸润(H&E 染色)和矿化(VK 染色)。
10. 大鼠颅骨缺损模型
- 获得当地动物护理委员会审查和批准的实验方案。
- 按照上述第 1 节并使用 5 毫米活检冲头制备圆形(直径 5 毫米,厚度为 1 毫米)脱细胞支架。
- 按照既定方案26 进行双侧开颅手术,如下所示:
- 用异氟醚麻醉雄性Sprague-Dawley大鼠,首先以3%麻醉直到它们失去知觉,然后在整个过程中以2-3%麻醉。
- 使用手术刀刀片切割覆盖的皮肤,暴露骨膜和颅骨。切除骨膜。
- 在 0.9% NaCl 的持续冲洗下,使用配备有 5 毫米直径环钻的牙钻在矢状缝线两侧的双侧顶骨中形成双侧缺损。
- 用 0.9% NaCl 清洁周围的骨骼以去除任何骨碎片。
- 将圆形脱细胞支架放置在缺陷中。
- 用 4-0 缝合线封闭覆盖的皮肤。
- 让老鼠无限制地获取食物和水,并每天监测它们。
- 植入后 8 周后,通过吸入 CO2 和胸穿孔对大鼠实施安乐死作为次要安乐死措施。
- 要暴露颅骨并取回植入物,请使用手术刀刀片去除覆盖颅骨的皮肤。
- 使用牙钻在额骨和枕骨以及两个顶骨的侧面切开颅骨,以完全切除颅骨的顶部。
11. 推出测试
- 将单轴压缩设备(带有 445 N 称重传感器)连接到 USB 数据采集模块。
- 将数据采集模块连接到配备数据采集软件应用程序的计算机。
- 颅骨提取后,立即将每个样本(本研究中来自 4 只动物的 n = 7 个植入物)放在单轴压缩装置的样品架上,使骨骼的背侧朝上。
- 以 0.5 毫米/分钟的速度降低柱塞,直到稍微接触拔出的植入物。
- 通过使用数据采集软件以 0.5 mm/min 的恒定速度施加压缩,同时将柱塞降低到植入物直至完全推出,从而开始测试。
- 使用数据采集软件在力与位移曲线上记录峰值力。
12. 组织学细胞浸润和矿化分析: 体内 支架
- 将提取的颅骨和植入物固定在10%中性缓冲福尔马林中72小时,然后重悬于70%乙醇中储存。
- 组织学:
注:在本研究中,后续步骤中描述的所有组织学制备(包埋、切片和染色)均由 Accel Labs(加拿大魁北克省蒙特利尔)进行。- 将样品(嵌入甲基丙烯酸甲酯中)切成三个不同水平(顶部,底部和朝向中心)的6μm厚切片,并将它们安装在显微镜载玻片上。
- 用 H&E 或 Masson-Goldner 三色 (MGT) 对切片进行染色。
- 用载玻片扫描仪显微镜以 40 倍放大倍率对切片成像(本研究中 2 只动物的 4 个外植体)。
- 使用 ImageJ 软件,目视评估细胞浸润(H&E 染色)和胶原蛋白沉积(MGT 染色)。
结果
孔径测量、细胞分布和 体外 矿化(图1 和 图2)
用 SDS 和 CaCl2 处理支架后,完全去除苹果组织支架的天然细胞成分(图 1A)。支架表现出高度多孔的结构,使用共聚焦显微镜证实了这一点。图像的定量表明平均孔径为 154 μm ± 40 μm。孔径分布范围在73 μm至288 μm之间。然而,大多数孔隙在100μm至200μm之间(图1C)。
在分化培养基中培养 4 周后,细胞接种的支架表现出广泛的白色矿物质沉积物(图 1A)。含有细胞的支架显示出不透明的白色,表明矿化,这在空白支架(没有种子细胞的支架)中没有观察到。此外,使用共聚焦激光扫描显微镜的分析显示支架内的细胞分布均匀(图1B)。
用BCIP / NBT和ARS染色或未接种细胞的支架分别用BCIP / NBT和ARS染色以分析ALP活性和矿化(图1D)。BCIP/NBT 染色显示,与在非分化培养基中培养的空白支架或细胞接种支架相比,在分化培养基中培养的细胞接种支架内 ALP 活性显着增加(以强烈的紫色表示)。同样,在分化培养基中培养的细胞接种支架在用 ARS 染色时表现出更强烈的红色,表明与空白支架或在非分化培养基中培养的细胞接种支架相比具有更大的矿化程度。在空白支架中观察到背景染色,可能是由于脱细胞方案中存在 CaCl2 。
在支架上进行染色(H&E和VK)以分析细胞浸润和矿化,并使用SEM和EDS进一步评估矿化(图2)。H&E染色(图2A)显示,在非分化或分化培养基中培养的细胞接种支架中具有良好的细胞浸润。在外围和整个支架中可见多个细胞核。在淡粉色的支架中也观察到胶原蛋白的存在。此外,在分化培养基中培养 4 周后对支架进行的 VK 染色显示孔壁被染色,而在非分化培养基中培养的支架中仅沿孔壁的外边缘检测到钙沉积物,并且可能是由于脱细胞处理期间的钙吸收引起的。通过SEM分析观察到在分化培养基中培养4周的细胞接种支架表面的局部矿化(图2B)。更具体地说,在孔隙的外围观察到类似于球状聚集体的矿床。相比之下,在空白支架或在非分化培养基中培养 4 周的细胞接种支架上未观察到矿物聚集体。在选定感兴趣区域的EDS光谱中观察到对应于磷(P)和钙(Ca)的不同特征峰,特别是在分化培养基中培养4周的细胞接种支架上观察到的矿物沉积物(图2B)。
体外 生物力学分析(图3)
在非分化或分化培养基中培养 4 周后测量细胞接种支架的 Young 模量(每种实验条件的 n = 3)。将其与空白支架(没有种子细胞的支架)的杨氏模量进行比较(图3)。空白支架(31.6 kPa ± 4.8 kPa)与在非分化培养基中培养的细胞接种支架(24.1 kPa ± 8.8 kPa)之间的模量无显著差异; p = 0.88)。相比之下,空白支架的模量(31.6 kPa± 4.8 kPa)与在分化培养基中培养的细胞接种支架的模量(192.0 kPa±16.6 kPa; p < 0.001)。此外,在非分化和分化培养基中培养的细胞接种支架的杨氏模量之间存在显着差异(p < 0.001)。 补充图1 显示了杨氏模量计算的典型应力-应变曲线。
体内 生物力学性能和骨再生(图4 和 图5)
对总共 6 只 Sprague-Dawley 大鼠进行了手术开颅手术。使用环钻车针在颅骨的两个顶骨中产生直径为 5 毫米的双侧缺损,并将没有种子细胞的苹果衍生纤维素支架植入颅骨缺损中(图 4A)。植入 8 周后,对动物实施安乐死,并收集其头骨的上部并进行处理以进行机械测试或组织学分析。
根据视觉评估,支架似乎很好地融入了颅骨周围的组织。进行机械推出试验以定量评估支架 (n = 7) 在宿主颅骨中的整合。在动物安乐死后立即使用单轴压缩装置(图4B)进行测量。结果表明,峰值力为113.6 N±18.2 N(表1)。
进行组织学分析以评估植入支架内细胞浸润和细胞外基质的沉积(图5)。H&E 染色显示支架孔内的细胞浸润和血管形成的证据,如支架内血管的存在所示。此外,MGT染色表明支架内存在胶原蛋白。
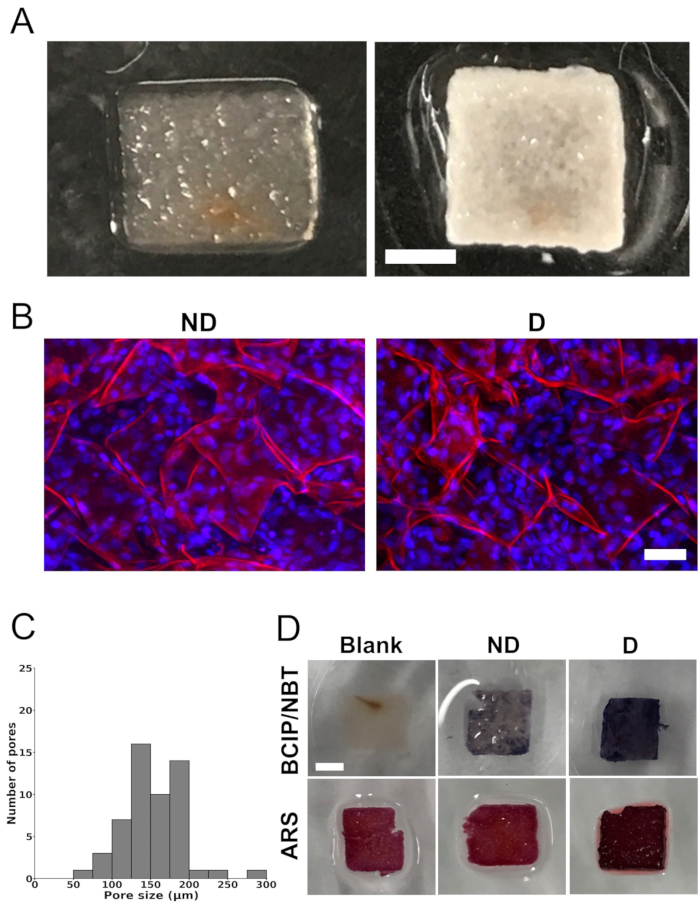
图 1:支架图像、孔径分布和 体外 矿化。 (A) 去除天然细胞和表面活性剂后苹果衍生纤维素支架(左)和在成骨分化培养基中培养 4 周后接种 MC3T3-E1 细胞的支架的代表性照片(右)。比例尺代表 2 mm。 (B) 代表性的共聚焦激光扫描显微镜图像,显示在非分化培养基 (“ND”) 或成骨分化培养基 (“D”) 中培养 4 周后,在苹果衍生的纤维素支架中接种的细胞。比例尺代表 50 μm。使用碘化丙啶对支架进行纤维素(红色)染色,使用DAPI对细胞核(蓝色)进行染色。(C) 脱细胞苹果衍生纤维素支架的孔径分布,在接种 MC3T3-E1 细胞之前,来自共聚焦图像 z 轴的最大投影。分析是在 3 个不同支架中的总共 54 个孔中进行的(每个支架在 3 个随机选择的感兴趣区域中有 6 个孔)。(D) 用 5-溴-4-氯-3'-吲哚磷酸盐和硝基蓝四唑 (BCIP/NBT) 染色以评估碱性磷酸酶 (ALP) 活性和用茜素红 S (ARS) 观察钙沉积的支架的代表性图像,表明矿化作用(比例尺 = 2 mm - 适用于所有)。标记为“空白”的支架(没有接种细胞的支架)显示没有 BCIP/NBT 染色,表明没有 ALP 活性。另一方面,与在非分化培养基(“ND”)中培养的细胞接种支架相比,在分化培养基(“D”)中培养的细胞接种支架显示出更高的ALP活性,以更强烈的蓝色表示。对于ARS染色,与在分化培养基(“D”)中培养的支架相比,空白支架和在非分化培养基(“ND”)中培养的支架都表现出较浅的红色阴影。在分化培养基(“D”)中培养的支架中钙沉积的存在由强烈的深红色说明。每次分析都在三个不同的支架上进行(n = 3)。该图经 Leblanc Latour (2023)27 许可改编。 请点击这里查看此图的较大版本.

图 2: 体外 支架的组织学、扫描电子显微镜 (SEM) 和能量色散光谱 (EDS) 分析。 (A) 支架顶部组织学横截面的代表性图像。将石蜡包埋的支架切成 5 μm 厚的切片,用苏木精和伊红 (H&E) 染色以可视化细胞浸润,或用 von Kossa (VK) 可视化支架内的矿化。用 MC3T3-E1 细胞浸润支架,如在外围和整个支架处可见的蓝色(细胞核)和粉红色(细胞质)染色所示。胶原蛋白(淡粉色)也可见(放大的“H&E-D”插图)。仅在非分化培养基(“ND”)中培养的支架的孔壁外围观察到矿化。在分化培养基(“D”)中培养的支架中的孔壁完全染成黑色。在非分化培养基(“ND”)中培养的一个支架和在分化培养基(“D”)中培养的两个支架上进行分析(较低放大倍率图片的比例尺= 1 mm,较高放大倍率图片的比例尺= 50 μm)。(B)通过SEM获得的代表性显微照片以及EDS光谱。支架经过镀金溅射涂层,并使用场发射扫描电子显微镜在3.0 kV电压下成像(比例尺= 100μm - 适用于所有)。在每个支架上采集EDS谱图。磷 (2.013 keV) 和钙 (3.69 keV) 峰在每个 EDS 光谱上表示。SEM 和 EDS 均在三种不同的支架上进行。空白:没有接种细胞的支架。该图经 Leblanc Latour (2023)27 许可改编。 请点击这里查看此图的较大版本.

图 3:在非分化培养基 (“ND”) 或分化培养基 (“D”) 中培养 4 周后体 外 支架的 Young 模量。 对于每个条件,数据以均值±均值的标准误差 (SEM) 表示。使用单因素方差分析 (ANOVA) 和 Tukey 事后检验确定统计学显着性(* 表示 p<0.05)。空白:没有接种细胞的支架。该图经 Leblanc Latour (2023)27 许可改编。 请点击这里查看此图的较大版本.

图4:植入前支架照片和植入8周后推出测试: (A)植入前支架的代表性照片;(B) 用于推出测试的单轴压缩装置,称重传感器用星号 (*) 表示,样品用箭头表示。该图经 Leblanc Latour (2023)27 许可改编。 请点击这里查看此图的较大版本.

图5: 体外 支架的组织学分析。 植入 8 周后未播种支架的组织学横截面的代表性图像。用苏木精和伊红 (H&E) 染色以观察细胞或用 Masson-Goldner 三色 (MGT) 观察胶原蛋白。箭头表示红细胞。胶原蛋白的存在是可见的(比例尺 = 1 mm 和 200 μm 分别用于左侧和右侧嵌件)。该图经 Leblanc Latour (2023)27 许可改编。 请点击这里查看此图的较大版本.
| 样品编号 | 峰值力 (N) |
| 1 | 92.8 |
| 2 | 162.7 |
| 3 | 140.3 |
| 4 | 135.7 |
| 5 | 37.7 |
| 6 | 157.8 |
| 7 | 67.9 |
| 意味 着 | 113.6 |
| 扫描电镜 | 18.2 |
表 1:推出测试测得的峰值力。
补充图1:杨氏模量计算的典型应力-应变曲线。请点击这里下载此文件。
讨论
几项体外和体内研究已经证明了植物来源纤维素的生物相容性及其在组织工程中的潜在用途 14,15,16,18,19,20,更具体地说是用于宿主成骨分化 20,21.本研究的目的是进一步研究苹果衍生的纤维素支架对BTE的潜力,并评估这些支架在体外和体内的机械性能。
对于体外研究,在从苹果组织中消除天然细胞后,将成骨细胞前细胞(MC3T3-E1)接种在支架中。MC3T3-E1 细胞通常用于研究细胞外基质 28,29,30 的生物矿化。然后将支架在成骨分化或非分化培养基中培养 4 周。研究结果表明,细胞在支架内增殖并发生分化,特别是在分化培养基中培养时,从而突出了来自苹果的纤维素支架支持骨组织发育的潜力。在支架孔中观察到大量细胞核,证实了早期研究 14,15,16,17,20,21 中报告的观察结果。此外,与我们之前的发现14和另一组21的发现类似,支架孔的平均直径为~154μm,大多数孔的直径在100μm至200μm之间(图1C)。这些尺寸与已知可促进骨骼生长的理想孔径范围 (100–200 μm) 一致7。
染色分析显示,在分化培养基中培养 4 周后,ALP 活性更高。与在非分化培养基中培养的空白支架和细胞接种支架相比,在分化培养基中培养的细胞接种支架表面观察到更多的钙沉积物。在苹果衍生支架中观察到差异化的 hiPSC 也观察到类似的结果21.虽然本研究对 ALP 的存在进行了定性评估,但可以进行额外的测定以进行定量分析。支架的组织学评估进一步证实,浸润的成骨细胞在分化后使支架矿化。值得注意的是,在非分化培养基中培养的构建体的外围也用VK染色。支架中残留的 CaCl2 可能导致在脱细胞后外围观察到的这种非特异性染色。对SEM图片进行了定性分析,以进一步评估矿化作用。在分化培养基中培养后,细胞接种的支架表现出ECM矿化的迹象。在支架表面可见矿物聚集体,特别是在孔隙的边缘。这些观察结果与先前使用ECM30 和植物来源支架21的研究一致。这些聚集体在没有接种细胞的支架表面不存在。对聚集体的EDS分析显示存在高水平的P和Ca,从而表明存在磷灰石。值得注意的是,虽然本研究中描述的方案允许可视化细胞浸润和矿化的存在,但它不允许评估它们随时间的进展。有必要在多个时间点进行组织学分析以充分评估这种进展。此外,还需要进一步分析以量化地表以及整个支架的细胞渗透和矿化。最后,虽然矿床的元素组成是通过EDS确定的,但可能需要其他表征技术,如X射线衍射(XRD)来提供有关观察到的矿床晶体结构的信息。
在分化培养基中培养后,支架的杨氏模量显着升高(约8倍)。相比之下,在非分化培养基中培养的支架的模量类似于空白支架(没有种子细胞的支架)的模量,类似于先前使用苹果衍生支架20 的研究报告的结果。尽管在分化培养基中培养的支架的杨氏模量较高,但仍远低于天然骨(小梁骨为0.1至2 GPa,皮质骨为15至20 GPa)8、松质同种异体移植物(3.78 GPa)31、聚醚醚酮(3.84 GPa)31、钛(50.20 GPa)31和钴铬合金(53.15 GPa)31 植入 物。因此,目前配方中的支架可能不适合承重应用。值得注意的是,杨氏模量提供了有关材料刚度的信息。然而,屈服强度也可以考虑提供对支架机械性能的更广泛理解。
然后将脱细胞的苹果支架植入大鼠(n = 6只动物)的5-mm双侧临界大小的颅骨缺损中。为评估宿主颅骨内支架的整合而进行的推出测试(对 7 个外植体)表明,平均峰值力为 113.6 N ± 18.2 N,这与先前报道的颅骨骨折负荷 (127.1 ± 9.6 N)22 相似,表明支架在周围骨组织中整合良好。然而,应该注意的是,推出测试仅提供有关支架与周围组织之间界面的信息。以前的研究将推出测试与压痕测试相结合,以提供对骨植入物界面和支架本身的机械性能的更广泛理解22。此外,双边缺陷更容易与柱塞32错位。在通用测试设备上正确放置颅骨外植体、单个缺陷模型或额外的夹紧系统可以潜在地避免错位32。
综上所述,本研究证实了苹果来源的纤维素支架可以促进成骨细胞前粘附和增殖。此外,在分化培养基中培养的细胞种子支架内发生矿化,导致支架杨氏模量增加。然而,模量仍然明显低于天然骨骼。有趣的是,置换植入的苹果衍生纤维素支架所需的力与以前用于 BTE22 的颅骨和其他类型的支架的骨折负荷相当。最后,与先前报告中说明的结果类似,细胞浸润了植入的支架并沉积了胶原蛋白。总体而言,这项研究证明了从植物中提取的纤维素支架在BTE应用中的潜力。这些发现与另一个研究小组先前进行的一项研究一致,进一步证实了植物来源的纤维素支架对BTE目的的适用性21。然而,与小梁骨或皮质骨相比,支架刚度的差异凸显了开发能够更接近天然骨骼机械性能的复合生物材料的重要性。因此,尽管人们越来越有兴趣将植物来源的支架用于BTE目的,但它们的使用可能仍然仅限于非承重应用。正如我们之前所展示的 16,通过化学改性或与其他生物/合成聚合物开发复合材料来重新设计植物衍生的纤维素支架对于承重应用可能至关重要。
披露声明
利益冲突声明:M.L.L、M.T. R.J.H.、C.M.C.、I.C. 和 AP 是渥太华大学和 Spiderwort Inc. 提交的关于将植物衍生纤维素用于 BTE 申请的专利申请的发明人。M.L.L.、R.J.H.、C.M.C. 和 AP 在 Spiderwort Inc. 拥有经济利益。
致谢
本项目由加拿大自然科学与工程研究理事会(NSERC)(发现资助)和李嘉诚基金会提供资助。MLL得到了安大略省卓越中心TalentEdge计划的支持,而RJH则得到了NSERC研究生奖学金和安大略省研究生奖学金(OGS)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | ThermoFisher | D1306 | DAPI |
| Alizarin red S | Sigma-Aldrich | A5533 | ARS |
| Ascorbic acid | Sigma-Aldrich | A4403 | Cell Culture |
| Calcium Chloride | ThermoFisher | AA12316 | CaCl2 |
| Calcofluor White | Sigma-Aldrich | 18909 | |
| Dental drill | Surgical tool | ||
| Ethanol | ThermoFisher | 615095000 | |
| Fetal bovine serum | Hyclone Laboratories | SH30396 | FBS |
| Formalin | Sigma-Aldrich | HT501128 | 10% Formalin |
| Goldner's trichrome stain | Sigma-Aldrich | 1.00485 | GTC |
| Hematoxylin and eosin stain | Fisher Scientific | NC1470670 | H&E |
| High-speed resonant confocal laser scanning microscope | Nikon | Nikon Ti-E A1-R | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| ImageJ software | National Institutes of Health | ||
| Irrigation saline | Baxter | JF7123 | 0.9% NaCl |
| MC3T3-E1 Subclone 4 cells | ATCC | CRL-2593 | Pre-osteoblast cells |
| McIntosh apples | Canada Fancy grade | ||
| Methyl methacrylate | Sigma-Aldrich | M55909 | Histological embedding |
| Minimum Essential Medium | ThermoFisher | M0894 | α-MEM |
| Paraformaldehyde | Fisher Scientific | O4042 | 4%; PFA |
| Penicillin/Streptomycin | Hyclone Laboratories | SV30010 | Cell Culture |
| Periodic acid | Sigma-Aldrich | 375810 | |
| Phosphate buffered saline | Hyclone Laboratories | 2810305 | PBS; without Ca2+ and Mg2+ |
| Propidium iodide | Invitrogen | p3566 | |
| Scanning electron microscope | JEOL | JSM-7500F FESEM | SEM and EDS |
| Slide scanner microscope | Zeiss | AXIOVERT 40 CFL | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166 | SDS |
| Sodium metabisulphite | Sigma-Aldrich | 31448 | |
| Sodium phosphate | ThermoFisher | BP329 | |
| Sprague-Dawley rats | Charles-River Laboratories | 400 | Male |
| Sutures | Ethicon | J494G | 4-0 |
| Trephine | ACE Surgical Supply Co | 583-0182 | 5-mm diameter |
| Triton-X 100 | ThermoFisher | 807423 | |
| Trypsin | Hyclone Laboratories | SH30236.02 | Cell Culture |
| Tween | Fisher Scientific | BP337 | |
| Universal compression Device | CellScale | UniVert | |
| Von Kossa stain | Sigma-Aldrich | 1.00362 | Histology |
参考文献
- Schmitz, J. P., Hollinger, J. O. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clinical Orthopaedics and Related Research. 205, 299-308 (1986).
- Yu, X., Tang, X., Gohil, S. V., Laurencin, C. T. Biomaterials for bone regenerative engineering. Advanced Healthcare Materials. 4 (9), 1268-1285 (2015).
- Parikh, S. N. Bone graft substitutes: Past, present, future. Journal of Postgraduate Medicine. 48 (2), 142-148 (2002).
- Silber, J. S., et al. Donor site morbidity after anterior iliac crest bone harvest for single-level anterior cervical discectomy and fusion. Spine (Phila Pa 1976). 28 (2), 134-139 (2003).
- Amini, A. R., Laurencin, C. T., Nukavarapu, S. P. Bone tissue engineering: recent advances and challenges. Critical Reviews in Biomedical Engineering. 40 (5), 363-408 (2012).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. Journal of Biomechanical Engineering. 122 (6), 570-575 (2000).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Bose, S., Roy, M., Bandyopadhyay, A. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnology. 30 (10), 546-554 (2012).
- Yoshikawa, H., Myoui, A. Bone tissue engineering with porous hydroxyapatite ceramics. Journal of Artificial Organs. 8 (3), 131-136 (2005).
- Fu, Q., Saiz, E., Rahaman, M. N., Tomsia, A. P. Bioactive glass scaffolds for bone tissue engineering: state of the art and future perspectives. Materials Science & Engineering. C, Materials for Biological Applications. 31 (7), 1245-1256 (2011).
- Xynos, I. D., Edgar, A. J., Buttery, L. D. K., Hench, L. L., Polak, J. M. Ionic products of bioactive glass dissolution increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochemical and Biophysical Research Communications. 276 (2), 461-465 (2000).
- Kroeze, R., Helder, M., Govaert, L., Smit, T. Biodegradable polymers in bone tissue engineering. Materials. 2 (3), 833-856 (2009).
- Venkatesan, J., Vinodhini, P. A., Sudha, P. N. Chitin and chitosan composites for bone tissue regeneration. Advances in Food and Nutrition Research. 73, 59-81 (2014).
- Modulevsky, D. J., Lefebvre, C., Haase, K., Al-Rekabi, Z., Pelling, A. E. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS One. 9 (5), e97835(2014).
- Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Biocompatibility of subcutaneously implanted plant-derived cellulose biomaterials. PLoS One. 11 (6), e0157894(2016).
- Hickey, R. J., Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Customizing the shape and microenvironment biochemistry of biocompatible macroscopic plant-derived cellulose scaffolds. ACS Biomaterials Science & Engineering. 4 (11), 3726-3736 (2018).
- Hickey, R. J., Leblanc Latour, M., Harden, J. L., Pelling, A. E. Designer scaffolds for interfacial bioengineering. Advanced Engineering Materials. 25, 2201415(2023).
- Fontana, G., et al. Biofunctionalized plants as diverse biomaterials for human cell culture. Advanced Healthcare Materials. 6 (8), 1601225(2017).
- Gershlak, J. R., et al. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials. 125, 13-22 (2017).
- Leblanc Latour, M., Pelling, A. E. Mechanosensitive osteogenesis on native cellulose scaffolds for bone tissue engineering. Journal of Biomechanics. 135, 111030(2022).
- Lee, J., Jung, H., Park, N., Park, S. H., Ju, J. H. Induced osteogenesis in plants decellularized scaffolds. Scientific Reports. 9 (1), 20194(2019).
- Zhao, J., et al. Enhanced healing of rat calvarial defects with sulfated chitosan-coated calcium-deficient hydroxyapatite/bone morphogenetic protein 2 scaffolds. Tissue Engineering. Part A. 18 (1-2), 185-197 (2012).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. In: Modern Electron Microscopy in Physical and Life Sciences. , 161-186 (2016).
- tousimis Critical Point Dryers - Samdri®-PVT-3D. , https://tousimis.com/critical_point_dryers/detail.html?Pid=8755B (2022).
- Leica EM ACE200 Vacuum Coater. , https://www.leica-microsystems.com/products/sample-preparation-for-electron-microscopy/p/leica-em-ace200/ (2023).
- Spicer, P. P. Evaluation of bone regeneration using the rat critical size calvarial defect. Nature Protocols. 7 (10), 1918-1929 (2012).
- Leblanc Latour, M. Cellulose biomaterials for bone tissue engineering [dissertation]. , Department of Physics, Faculty of Science, University of Ottawa, Ottawa, Canada. (2023).
- Kodama, H. -A., Amagai, Y., Sudo, H., Kasai, S., Yamamoto, S. Establishment of a clonal osteogenic cell line from newborn mouse calvaria. Japanese Journal of Oral Biology. 23 (4), 899-901 (1981).
- Wang, D., et al. Isolation and characterization of MC3T3-E1 preosteoblast subclones with distinct in vitro and in vivo differentiation/mineralization potential. Journal of Bone and Mineral Research. 14 (6), 893-903 (1999).
- Addison, W. N., et al. Extracellular matrix mineralization in murine MC3T3-E1 osteoblast cultures: An ultrastructural, compositional and comparative analysis with mouse bone. Bone. 71, 244-256 (2015).
- Heary, R. F., Parvathreddy, N., Sampath, S., Agarwal, N. Elastic modulus in the selection of interbody implants. Journal of Spine Surgery. 3 (2), 163-167 (2017).
- Lawson, Z. T., et al. Methodology for performing biomechanical push-out tests for evaluating the osseointegration of calvarial defect repair in small animal models. MethodsX. 8, 101541(2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。