Method Article
骨組織工学のための脱細胞化リンゴ由来の足場( In Vitro および In Vivo)
要約
本研究では、植物由来の生体材料の脱細胞化、物性評価、イメージング、 in vivo 移植の方法、および足場における細胞の播種と分化の方法について詳しく説明します。記載された方法は、骨組織工学的応用のための植物ベースの生体材料の評価を可能にする。
要約
植物由来のセルロース生体材料は、さまざまな組織工学用途に採用されています。 In vivo 研究では、天然由来のセルロースで作られた足場の驚くべき生体適合性が示されています。さらに、これらの足場は複数の組織に関連する構造的特徴を有しており、哺乳類細胞の侵入と増殖を促進します。脱細胞化リンゴのヒパンチウム組織を用いた最近の研究では、その細孔径が海綿骨の孔径と類似していること、および骨形成の分化を効果的にサポートする能力が実証されています。本研究では、骨組織工学(BTE)用途におけるリンゴ由来のセルロース足場の可能性をさらに検討し、in vitro および in vivo の機械的特性を評価しました。MC3T3-E1骨芽細胞をリンゴ由来のセルロース足場に播種し、骨形成能と機械的特性を評価しました。アルカリホスファターゼおよびアリザリンレッドS染色により、分化培地で培養した足場における骨形成分化が確認されました。組織学的検査では、足場全体に広範囲にわたる細胞浸潤と石灰化が示されました。走査型電子顕微鏡(SEM)により、足場の表面に鉱物凝集体が発見され、エネルギー分散型分光法(EDS)により、リン酸塩とカルシウム元素の存在が確認されました。しかし、細胞分化後のヤング率の有意な増加にもかかわらず、健康な骨組織よりも低いままでした。 In vivo 研究では、ラットの頭蓋骨に8週間移植した後、 脱細胞化リンゴ由来の足場内に細胞浸潤と細胞外マトリックスが沈着することが示されました。さらに、骨欠損部から足場を取り外すのに必要な力は、以前に報告された天然の頭蓋骨の骨折荷重と同様でした。全体として、この研究は、リンゴ由来のセルロースがBTEアプリケーションの有望な候補であることが確認されています。ただし、その機械的特性と健康な骨組織の機械的特性の相違により、低耐荷重シナリオへの適用が制限される可能性があります。耐荷重用途のリンゴ由来のセルロース足場の機械的特性を強化するために、追加の構造の再設計と最適化が必要になる場合があります。
概要
怪我や病気によって引き起こされる大きな骨欠損は、完全な再生のために生体材料移植片を必要とすることがよくあります1。骨組織の再生を改善するために設計された現在の技術では、自家移植片、同種移植片、異種移植片、または合成移植片が定期的に使用されています2。自家骨移植は、大きな骨欠損を修復するための「ゴールドスタンダード」移植方法と見なされており、患者から骨を抽出します。ただし、この移植手順には、サイズと形状の制限、組織の可用性、サンプリング部位の罹患率など、いくつかの欠点があります3。さらに、自家移植手術は、手術部位の感染、その後の骨折、サンプリング部位または再建部位での血腫形成、および術後の痛みの影響を受けやすい4。骨組織工学(BTE)は、従来の骨移植方法に代わる潜在的な方法を提供します5。構造的な生体材料と細胞を組み合わせて、新しい機能的な骨組織を構築します。BTE用の生体材料を設計する際には、マクロ多孔質構造、細胞接着を促進する表面化学、および天然の骨によく似た機械的特性を組み合わせることが重要です6。これまでの研究から、BTEに利用される生体材料の理想的な細孔径と弾性率は、グラフト部位にもよるが、それぞれ約100-200μm7、0.1-20GPa程度であることが示されている8。さらに、足場の多孔性と細孔の相互接続性は、細胞の移動、栄養素の拡散、および血管新生に影響を与える重要な要素です8。
BTEは、骨移植の代替オプションとして開発および評価されたさまざまな生体材料で有望な結果を示しています。これらの生体材料には、骨誘導材料、ハイブリッド材料、および高度なハイドロゲル8があります。骨誘導材料は、新しく形成された骨構造の発達を刺激します。ハイブリッド材料は、合成ポリマーおよび/または天然ポリマーで構成されています8。高度なハイドロゲルは細胞外マトリックス(ECM)を模倣し、骨組織の統合を促進するために必要な生理活性因子を提供することができます8。ハイドロキシアパタイトは伝統的な材料であり、その組成と生体適合性からBTEの一般的な選択肢です9。生体活性ガラスはBTEの別のタイプの生体材料であり、特定の細胞応答を刺激して骨形成に必要な遺伝子を活性化することが示されています10,11。ポリ(グリコール酸)やポリ(乳酸)などの生分解性ポリマーも、BTE用途で広く使用されています12。最後に、キトサン、キチン、バクテリアセルロースなどの天然または天然由来のポリマーも、BTE13の有望な結果を示しています。しかし、合成ポリマーと天然ポリマーの両方がBTEの可能性を示していますが、目的のマクロ構造を持つ機能的な足場の開発には、通常、広範なプロトコルが必要です。
逆に、天然の巨視的なセルロース構造は、多様な植物から容易に導出することができ、私たちの研究グループは、植物に由来するセルロースベースの足場が、異なる組織再建に適用できることを以前に実証しました。実際、簡単な界面活性剤処理に続いて、植物材料の固有の構造を利用し、用途の広い生体材料としての可能性を強調しました14。さらに、これらのセルロースベースの足場は、in vitro哺乳類細胞培養用途14に使用でき、生体適合性があり、自発的な皮下血管新生をサポートする14,15,16,17。私たちの研究グループと他の研究グループの両方が、これらの足場が意図された用途14、15、16、17、18、19、20に基づいて特定の植物から得られることを実証しました。例えば、植物の茎や葉に見られる維管束構造は、動物組織に見られる構造と著しい類似性を示す19。さらに、植物由来のセルロース足場は、所望の特性を達成するために、容易に成形され、表面の生化学的修飾を受けることができる16。最近の研究では、脱細胞化プロセス中に塩バッファーを組み込み、in vitroとin vivoの両方の設定で細胞接着の増強が観察されました16。同研究では、植物由来のセルロース足場を足場の表面にハイドロゲルを流延することで、複合生体材料への適用性を実証しました。最近の研究では、植物由来の足場の機能化がその有効性を高めることが示されています18。例えば、Fontana et al.(2017)が実施した研究では、ヒトの皮膚線維芽細胞の接着はRGDでコーティングされた脱細胞化ステムによって支えられているが、コーティングされていないステムは同じ能力を示さないことが明らかになった18。さらに、著者らは、改変された模擬体液を利用して、脱細胞化した植物の茎を人工的に石灰化できることも示しました。最近の研究では、植物由来のセルロース足場における機械感受性骨形成の概念を探り、BTE17,20の可能性を評価しました。さらに、Lee et al.(2019)は、植物由来の足場を利用して、in vitro設定で骨様組織を培養しました21。著者らは、さまざまな植物源を包括的に評価した結果、ヒト人工多能性幹細胞(iPS細胞)の培養と分化に最も適した足場がリンゴ由来の足場であることを突き止めた。さらに、著者らは、リンゴ由来の足場の構造的および機械的特性が、意図された目的への適合性において極めて重要な役割を果たすことを提案しました。組織工学用途に実装された最初の植物由来の足場であるリンゴ由来の足場は、特に直径100〜200μmの範囲の相互接続された細孔の点で、人間の骨の構造と驚くほど類似した構造を持っていることが広く示されています14,21。
本研究では、リンゴ由来のセルロース足場のBTEに対する可能性をさらに調査し、in vitroおよびin vivoの両方でその機械的特性の解析を行いました。BTE 17,20,21のリンゴ由来の足場の可能性に関する研究は行われてきましたが、その機械的特性は十分に調査されていませんでした。その結果、分化培地で4週間培養した足場に播種したMC3T3-E1骨芽細胞の野生の侵入と骨形成分化が示されました。これらの足場のヤング率は192.0 ± 16.6 kPaであり、ブランクスホールド(播種細胞のない足場)(31.6 ± 4.8 kPa)や非分化培地で培養した細胞播種足場(24.1 ± 8.8 kPa)よりも有意に高かった。しかしながら、健康なヒト骨組織のヤング率は、典型的には、海綿骨については0.1〜2GPa、皮質骨については約15〜20GPaの範囲に収まることに留意すべきである8。それにもかかわらず、げっ歯類の頭蓋骨欠損部に8週間の移植後、細胞播種された足場は周囲の骨によく統合されているように見え、押し出し試験で113.6 N±18.2 Nの平均ピーク力によって示され、これは以前に報告された天然の頭蓋骨の骨折荷重に類似しています22。全体として、この研究から得られた結果は、特に非耐荷重用途において大きな有望性を示しています。しかし、リンゴ由来のセルロース足場は、現在のところ、インプラント部位の周囲の骨組織と正確に一致させるために必要な機械的特性を有していません。そのため、これらの足場の可能性を最大限に引き出すには、さらなる開発が必要です。
プロトコル
実験プロトコルは、オタワ大学動物管理委員会によってレビューされ、承認されました。
1.足場の準備
- マンドリンスライサーを使用して、マッキントッシュのりんご(カナダファンシー)を厚さ8mmのスライスに切ります。リンゴのスライスのヒパンチウム組織を5mmx5mmの正方形に切ります。
- 正方形のサンプルを0.1%ドデシル硫酸ナトリウム(SDS)に2日間入れます。
- 脱細胞化サンプルを脱イオン水で洗浄し、100 mM CaCl2中で室温(RT)で一晩インキュベートして、残りの界面活性剤を除去します。
- サンプル(足場など)を70%エタノールで30分間滅菌し、脱イオン水で洗浄し、細胞播種前に24ウェル培養プレートに入れます。
2. 細胞培養と足場播種
- MC3T3-E1サブクローン4細胞を直径10cmの細胞培養処理ディッシュに入れ、細胞培養条件(37°C、空気95%、CO25%5%の加湿雰囲気)で維持します。
- 10%ウシ胎児血清(FBS)および1%ペニシリン/ストレプトマイシンを添加したEagleの最低限の必須培地であるアルファ修飾(α-MEM)で作られた細胞培養培地を調製します。
- 細胞が80%のコンフルエントに達したら、トリプシン処理(0.05%トリプシン-EDTA)によって培養皿から細胞を分離します。
- 細胞懸濁液を約200 x g で3分間遠心分離します。上清を吸引し、細胞をα-MEMで2.5 x 107 細胞/mLで再懸濁します。
- 40 μLの細胞懸濁液を足場の表面にピペットで移し、細胞培養条件で1時間接着させます。続いて、培養プレートの各培養ウェルに2mLの培地を添加する。
- 2〜3日ごとに培地を14日間補充します。
- 前述の細胞培養培地に50 μg/mLのアスコルビン酸と4 mMのリン酸ナトリウムを添加して分化培地を調製します。
- 分化培地中でスキャフォールドを4週間インキュベートすることにより、MC3T3-E1細胞の分化を誘導します。3〜4日ごとに培地を補充します。並行して、スキャフォールドを非分化培養培地(すなわち、分化を誘導するサプリメントを含まない培地)で同じ期間、同じ培地交換スケジュールでインキュベートし、ネガティブコントロールとして使用します。
3. 共焦点レーザー走査型顕微鏡を用いた細孔径測定
- 脱細胞化したリンゴ由来の足場をリン酸緩衝生理食塩水(PBS)で洗浄します。
- スキャフォールドを1 mLの10%(v/v)カルコフルオフローホワイト染色液中で、室温の暗所で25分間インキュベートします。
- スキャフォールド(n = 3)をPBSで洗浄し、DAPIチャネルを使用して、高速共鳴共焦点レーザー走査型顕微鏡(CLSM)で10倍の倍率でスキャフォールドごとにランダムに選択された3つの領域を画像化します。
- レーザー発光フィルター構成:405 nm(レーザー);425-475 nm (発光)
- レーザー出力と検出器を手動で調整して、最適な画像取得を確保します。5 μm のステップ サイズで 20 枚の画像の z スタックを取得します。
- ImageJ ソフトウェアを使用して、共焦点画像を次のように処理および解析します。
- Z-Project to Maximum Intensity関数を使用して画像を作成し、Find Edges関数を使用して細孔のエッジをハイライトします。
- フリーハンド選択ツールを使用して、毛穴を手動でトレースします。
- 各細孔を楕円としてフィットし、長軸の長さを測定し、すべての測定値をコンパイルし(本研究では合計54個-各足場のランダムに選択された3つの領域に6個)、平均長さを計算します。
4. 共焦点レーザー走査型顕微鏡を用いた細胞分布解析
- 非分化培地または分化培地で培養した細胞播種スキャフォールドをPBSで3回洗浄します。足場を4%パラホルムアルデヒドで10分間固定します。
- 各足場を脱イオン水で十分に洗浄し、Triton-X 100溶液で細胞を5分間透過処理し、PBSで再度洗浄します。
- 足場を1mLの1%過ヨウ素酸で40分間インキュベートし、脱イオン水ですすいでください14,16。
- 100 mM のメタ重亜硫酸ナトリウムと 0.15 M の塩酸を含む 1 mL の溶液に足場をインキュベートし、100 μg/mL のヨウ化プロピジウムを添加します。足場を溶液に完全に浸します。
- 足場をPBSで洗浄し、5 mg/mLのDAPI溶液中で暗所で10分間インキュベートして細胞核を染色します。イメージングの前に、再度徹底的に洗浄し、足場をPBSに保管してください。
- DAPIおよびTRITCチャンネルを使用して、10倍の倍率で高速共鳴CLSMを使用して、3つの異なる細胞播種スキャフォールドのランダムに選択された3つの表面を画像化します。
- レーザー発光フィルター構成:
DAPI:レーザー:405 nm;発光:425-475 nm
TRITC:レーザー:561 nm;発光:570-620 nm - レーザー出力と検出器を手動で調整して、最適な画像取得を確保します。5 μm のステップ サイズで 20 枚の画像の z スタックを取得します。
- レーザー発光フィルター構成:
- ImageJ ソフトウェアを使用して共焦点画像を処理し、 Z 投影から最大強度関数 を使用して画像解析用の z 軸に最大投影を作成します。
5. アルカリホスファターゼ分析
- 非分化培地または分化培地で培養した細胞播種スキャフォールドをPBSで3回洗浄します。足場を10%中性緩衝ホルマリンで30分間固定します。空白のスキャフォールド (シードされたセルのないスキャフォールド) を修正して、ネガティブ コントロールとして使用します。
- BCIP/NBT錠剤1錠を10 mLの脱イオン水に溶解して、5-ブロモ-4-クロロ-3'-インドリホスフェートおよびニトロブルーテトラゾリウム(BCIP/NBT)染色溶液を調製します。
- 固定スキャフォールドを0.05%トゥイーン溶液で洗浄し、BCIP/NBT溶液で室温で20分間染色します。 染色した足場を0.05%トゥイーン溶液で洗浄し、イメージング前にPBSで保存します。
- 汚れた足場を12メガピクセルのデジタルカメラで撮影します。
6. カルシウム沈着分析
- 非分化培地または分化培地で培養した細胞播種スキャフォールドをPBSで3回洗浄します。足場を10%中性緩衝ホルマリンで30分間固定します。空白のスキャフォールド (シードされたセルのないスキャフォールド) を修正して、ネガティブ コントロールとして使用します。
- 2%(w/v)アリザリンレッドS(ARS)染色溶液を調製します。
- 固定された足場を脱イオン水で洗浄し、室温でARS溶液で1時間染色します。
- 汚れた足場を12メガピクセルのデジタルカメラで撮影します。
7. 鉱化作用分析
- 非分化培地または分化培地で培養した細胞播種スキャフォールドをPBSで3回洗浄します。足場を4%パラホルムアルデヒドで48時間固定します。空白のスキャフォールド (シードされたセルのないスキャフォールド) を修正して、ネガティブ コントロールとして使用します。
- 前述のように、エタノールの濃度が50%から100%に増加した溶液でサンプルを脱水します23。
- 走査型電子顕微鏡(SEM)とエネルギー分散型分光法(EDS)を実行して、鉱物凝集体を次のように分析します。
- 臨界点乾燥機を使用して、メーカーのプロトコル24に従ってサンプルを乾燥させます。
- メーカーのプロトコル25に従って、金スパッタコーターを使用して足場に5nmの金コートを塗布します。
- 3 kV、倍率85倍に設定した走査型電子顕微鏡で足場の表面を画像化します。
- 走査型電子顕微鏡を15kVに設定してEDSを行います。スキャフォールドごとにランダムに選択された 3 つの領域で、鉱物凝集体組成分析用の EDS スペクトルを取得します。
8. ヤング率の測定
- 細胞播種したスキャフォールドをそれぞれのインキュベーション培地から取り出し、すぐにサンプルをテストします。
- 1.5Nのロードセルを搭載した特注の一軸圧縮装置を用いて、足場(条件ごとにn=3)を3mm・min-1 の一定速度で足場高さの10%の最大圧縮ひずみまで圧縮します。
- 応力-ひずみ曲線の線形部分の傾きからヤング率を決定します。本研究では、弾性率は9%から10%のひずみの間で決定されました。
9. 組織学による細胞浸潤・石灰化解析: In vitro scaffolds
- 非分化培地または分化培地で培養した細胞播種スキャフォールドをPBSで3回洗浄します。
- 細胞播種した足場を4%パラホルムアルデヒドで48時間固定した後、70%エタノールに再懸濁して保存します。
- 組織学:
注:本研究では、次のステップで説明する組織学的準備全体(包埋、切片化、および染色)は、ルイーズペルティエ組織学コア施設(オタワ大学)によって行われました。- 脱水してパラフィンに包埋した後、サンプルを足場の内側1 mmから厚さ5 μmの連続切片に切断し、切片を顕微鏡スライドに取り付けます。
- 切片をヘマトキシリンとエオシン(H&E)またはフォンコッサ(VK)染色で染色します。
- スライドスキャナー顕微鏡で40倍の倍率で切片を画像化します(本研究では、非分化培地ではn = 1つの足場、分化培地ではn = 2つの足場)。
- ImageJソフトウェアを使用して、細胞浸潤(H&E染色)と石灰化(VK染色)を視覚的に評価します。
10. ラット頭蓋骨欠損モデル
- 実験プロトコルは、地元の動物管理委員会によってレビューされ、承認されます。
- 上記のセクション 1 に従って、5 mm の生検パンチを使用して、円形 (直径 5 mm、厚さ 1 mm) の脱細胞化スキャフォールドを準備します。
- 次のように、確立されたプロトコル26に従って両側開頭術を実行します。
- オスのSprague-Dawleyラットにイソフルランを麻酔し、最初は意識を失うまで3%で、次に手順全体を通して2〜3%で麻酔します。.
- メスの刃で上にある皮膚を切って骨膜と頭蓋骨を露出させます。骨膜を取り除きます。
- 0.9%NaClの一定の洗浄下で直径5mmのトレフィンを備えた歯科用ドリルを使用して、矢状縫合糸の両側にある両方の頭頂骨に両側の欠損を作成します。
- 周囲の骨を0.9%NaClで洗浄し、骨片を取り除きます。
- 円形の脱細胞化足場を欠損部に配置します。
- 4-0の縫合糸で上にある皮膚を閉じます。
- ネズミに餌と水を無制限に与え、毎日監視します。
- 移植後8週間後、二次安楽死対策としてCO2 吸入および胸部穿孔によりラットを安楽死させる。
- 頭蓋骨を露出させてインプラントを回収するには、メスの刃を使用して頭蓋骨を覆っている皮膚を取り除きます。
- 歯科用ドリルを使用して、前頭骨と後頭骨、および両方の頭頂骨の側面で頭蓋骨を切断し、頭蓋骨の上部を完全に除去します。
11.押し出し試験
- 一軸圧縮装置(445 Nロードセル付き)をUSBデータ収集モジュールに接続します。
- データ収集モジュールを、データ収集ソフトウェアアプリケーションを搭載したコンピュータに接続します。
- 頭蓋摘出の直後に、各サンプル(本研究では4匹の動物からのn = 7インプラント)を、骨の背側が上を向くように一軸圧迫装置のサンプルホルダーに置きます。
- 抽出したインプラントにわずかに触れるまで、プランジャーを0.5 mm / minで下げます。
- データ収集ソフトウェアを使用して0.5 mm / minの一定速度で圧縮を適用しながら、完全に押し出されるまでプランジャーをインプラントに下げてテストを開始します。
- データ収集ソフトウェアを使用して、力対変位曲線のピーク力を記録します。
12. 組織学による細胞浸潤・石灰化解析: in vivo 足場
- 抽出した頭蓋骨とインプラントを10%中性緩衝ホルマリンで72時間固定した後、70%エタノールに再懸濁して保存します。
- 組織学:
注:本研究では、次のステップで説明するすべての組織学的調製(包埋、切片化、および染色)は、Accel Labs(カナダ、ケベック州モントリオール)によって実施されました。- サンプル(メタクリル酸メチルに包埋)を厚さ6 μmの3段階(上、下、中央)に切断し、顕微鏡スライドに取り付けます。
- 切片をH&EまたはMasson-Goldnerのトリクローム(MGT)で染色します。
- スライドスキャナー顕微鏡で40倍の倍率で切片を画像化します(本研究では2匹の動物から4つの外植片)。
- ImageJソフトウェアを使用して、細胞浸潤(H&E染色)とコラーゲン沈着(MGT染色)を視覚的に評価します。
結果
細孔径測定、細胞分布、 in vitro での石灰化(図1 および 図2)
リンゴ組織足場の天然細胞成分の完全な除去は、SDSおよびCaCl2 で足場を処理した後に達成されました(図1A)。足場は多孔質構造を示し、共焦点顕微鏡で確認しました。画像の定量化により、平均細孔径は154μm±40μmであることが実証されました。細孔径分布は73μmから288μmの範囲であった。しかし、大部分の細孔は100μmから200μmの範囲でした(図1C)。
分化培地で4週間培養した後、細胞播種した足場は広範囲に白いミネラル堆積物を示しました(図1A)。細胞を含む足場は不透明な白色を呈し、空白の足場(播種された細胞のない足場)では観察されなかった鉱化作用を示唆しています。さらに、共焦点レーザー走査型顕微鏡を用いた解析により、足場内の細胞分布が均一であることが明らかになりました(図1B)。
細胞を播種した、または播種していない足場をBCIP/NBTおよびARSで染色し、ALP活性および鉱化作用をそれぞれ解析しました(図1D)。BCIP/NBT染色では、分化培地で培養した細胞播種足場では、空白の足場や非分化培地で培養した細胞播種足場とは対照的に、ALP活性の大幅な増加(強い紫色で表される)が明らかになりました。同様に、分化培地で培養した細胞播種足場は、ARSで染色するとより濃い赤色を呈し、空白の足場や非分化培地で培養した細胞播種足場と比較して石灰化が大きいことが示されました。ブランクの足場にバックグラウンド染色が観察されましたが、これは脱細胞化プロトコルにCaCl2 が存在することが原因である可能性があります。
細胞の浸潤と石灰化を分析するために足場で染色(H&EおよびVK)を行い、SEMおよびEDSを使用してさらに石灰化を評価しました(図2)。H&E染色(図2A)では、非分化培地または分化培地で培養した細胞播種スキャフォールドにおいて、良好な細胞浸潤が示されました。複数の核が周辺部と足場全体に見えました。コラーゲンの存在は、淡いピンク色の足場にも観察されました。また、分化培地で4週間培養した後の足場にVK染色を行ったところ、非分化培地で培養した足場では、細孔壁が染色されているのに対し、カルシウム沈着物は細孔壁の外縁に沿ってのみ検出され、脱細胞化処理中のカルシウム吸収に起因している可能性があることが明らかになりました。分化培地で4週間培養した細胞播種足場の表面に局所的な石灰化がSEM分析によって観察されました(図2B)。具体的には、細孔の周囲に回転楕円体凝集体に似た鉱物堆積物が観察されました。対照的に、ブランクの足場または細胞播種の足場を非分化培地で4週間培養したところ、ミネラル凝集体は観察されませんでした。リン(P)とカルシウム(Ca)に対応する明確な特徴的なピークが、選択した関心領域のEDSスペクトル、特に分化培地で4週間培養した細胞播種足場で観察されたミネラル堆積物で観察されました(図2B)。
In vitro 生体力学分析(図3)
細胞播種した足場のヤング率は、非分化培地または分化培地(各実験条件でn = 3)で4週間培養した後に測定しました。これをブランクスキャフォールド(播種セルのないスキャフォールド)のヤング率と比較しました(図3)。ブランク足場(31.6 kPa ± 4.8 kPa)と非分化培地で培養した細胞播種足場(24.1 kPa ± 8.8 kPa; p = 0.88)です。対照的に、ブランクスキャフォールドの弾性率(31.6 kPa ± 4.8 kPa)と分化培地で培養した細胞播種スキャフォールドの弾性率(192.0 kPa ± 16.6 kPa; p < 0.001)。さらに、非分化培地で培養した細胞播種足場と分化培地で培養した細胞播種足場のヤング率の間に有意差(p < 0.001)が観察されました。 補足図 1 は、ヤング率計算の一般的な応力-ひずみ曲線を示しています。
生体内の 生体力学的性能と骨再生(図4 および 図5)
外科的開頭術は、合計6匹のSprague-Dawleyラットで実施されました。頭蓋骨の両頭頂骨にトレフィンバーを用いて直径5mmの両側欠損部を作製し、播種細胞を含まないリンゴ由来のセルロース足場を頭蓋骨欠損部に移植した(図4A)。8週間の移植後、動物は安楽死させられ、頭蓋骨の上部が採取され、機械的検査または組織学的分析のために処理されました。
目視による評価では、足場は頭蓋骨の周囲の組織にうまく統合されているように見えました。宿主の頭蓋骨における足場(n = 7)の統合を定量的に評価するために、機械的押し出し試験を実施しました。測定は、動物の安楽死の直後に一軸圧縮装置(図4B)を使用して行われました。その結果、ピーク力は113.6N±18.2Nであることが明らかになりました(表1)。
組織学的解析を実施して、移植された足場内の細胞浸潤と細胞外マトリックスの沈着を評価しました(図5)。H&E染色により、足場孔内の細胞浸潤と、足場内の血管の存在によって示されるように、血管新生の証拠が明らかになりました。さらに、MGT染色により、足場内にコラーゲンが存在することが実証されました。
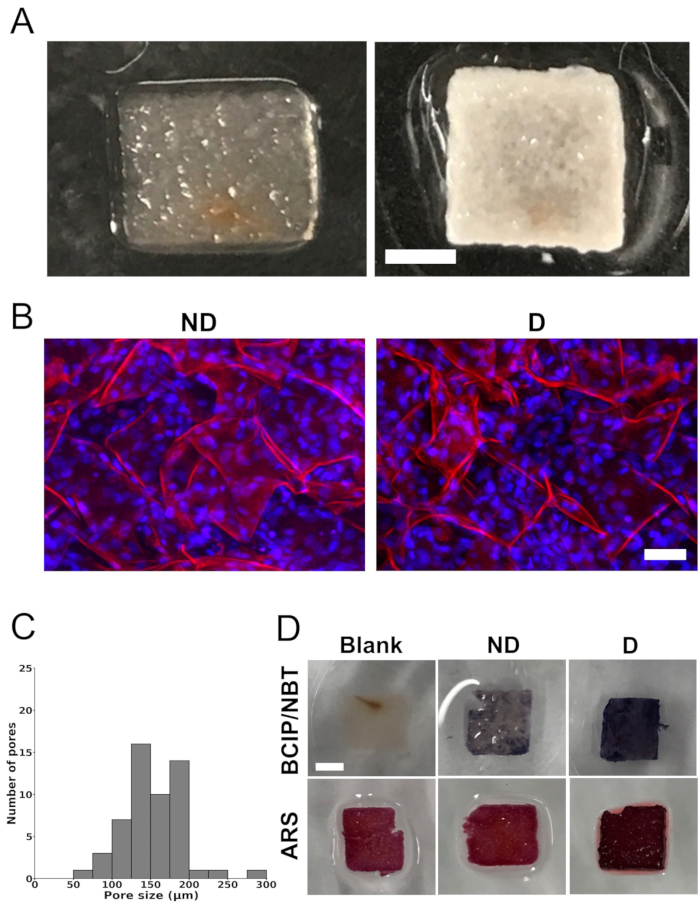
図1:足場画像、細孔径分布、 in vitro での鉱化作用。 (A)天然細胞と界面活性剤を除去した後のリンゴ由来セルロース足場(左)と、骨形成分化培地で4週間培養した後にMC3T3-E1細胞を播種した足場(右)。スケールバーは2mmを表します。 (B)非分化培地(「ND」)または骨形成分化培地(「D」)で4週間培養した後、リンゴ由来のセルロースス足場に播種された細胞を示す代表的な共焦点レーザー走査型顕微鏡画像。スケールバーは50μmを表します。足場の染色は、ヨウ化プロピジウムを用いたセルロース(赤)とDAPIを用いた細胞核(青)の染色を行った。(C)MC3T3-E1細胞を播種する前の脱細胞化リンゴ由来セルロース足場の孔径分布を、共焦点画像のz軸の最大投影から。分析は、3つの異なる足場の合計54の細孔(足場ごとにランダムに選択された3つの関心領域の6つの細孔)で実施されました。(D)アルカリホスファターゼ(ALP)活性を評価するために5-ブロモ-4-クロロ-3'-インドリホスフェートとニトロブルーテトラゾリウム(BCIP/NBT)で染色し、アリザリンレッドS(ARS)で染色してカルシウム沈着を可視化し、鉱化作用を示す足場の代表的な画像(スケールバー = 2 mm - すべてに適用)。「ブランク」とラベル付けされたスキャフォールド(播種された細胞のないスキャフォールド)は、BCIP/NBTによる染色を示さず、ALP活性がないことを示しています。一方、分化培地(D)で培養した細胞播種足場は、非分化培地(ND)で培養した細胞播種足場と比較して、より高いALP活性を示し、より濃い青色で示されました。ARS染色では、ブランク足場と非分化培地(「ND」)で培養した足場の両方が、分化培地(「D」)で培養された足場と比較して明るい赤色を示しました。分化培地(「D」)で培養した足場にカルシウムが沈着していることは、濃い赤色で示されました。各分析は、3つの異なる足場(n = 3)で実施しました。この図は、Leblanc Latour (2023)27 の許可を得て改作したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2: in vitro スキャフォールドの組織学、走査型電子顕微鏡(SEM)、エネルギー分散型分光法(EDS)分析。 (A)足場の上部組織学的断面の代表的な画像。パラフィン包埋足場を厚さ5 μmの切片にスライスし、ヘマトキシリンとエオシン(H&E)で染色して細胞浸潤を可視化するか、von Kossa(VK)で染色して足場内の石灰化を可視化しました。足場にはMC3T3-E1細胞が浸潤しており、足場の周辺部と全体に青色(核)とピンク色(細胞質)の染色が見られました。コラーゲン(淡いピンク色)も見えました(「H&E-D」の拡大挿入図)。鉱化作用は、非分化培地(「ND」)で培養された足場の細孔壁の周辺でのみ観察されました。分化培地(「D」)で培養した足場の細孔壁は、全体が黒色に染色されていました。分析は、非分化培地(「ND」)で培養した1つの足場と、分化培地(「D」)で培養した2つの足場で行いました(低倍率写真のスケールバー= 1 mm、高倍率写真のスケールバー= 50 μm)。(B)SEMで得られた代表的な顕微鏡写真とEDSスペクトル。足場は金でスパッタリングコーティングされ、電界放出型走査電子顕微鏡を使用して3.0 kVの電圧で画像化されました(スケールバー = 100 μm - すべてに適用されます)。EDSスペクトルは、各足場で取得されました。リン(2.013 keV)とカルシウム(3.69 keV)のピークは、各EDSスペクトルに示されています。SEMとEDSの両方を3つの異なる足場で実施しました。空白: シードされたセルのないスキャフォールディング。この図は、Leblanc Latour (2023)27 の許可を得て改作したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:非分化培地(「ND」)または分化培地(「D」)で4週間培養した後の in vitro スキャフォールドのヤング率。 データは、各条件±3つの反復サンプルの平均標準誤差(SEM)として表されます。統計的有意性(*は p<0.05を示す)は、一元配置分散分析(ANOVA)とテューキー事後検定を使用して決定されました。空白: シードされたセルのないスキャフォールディング。この図は、Leblanc Latour (2023)27 の許可を得て改作したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:移植前の足場写真と8週間の移植後の押し出し試験: (A)移植前の足場の代表的な写真。(B)押し出し試験に使用した一軸圧縮装置で、ロードセルはアスタリスク(*)で示され、サンプルは矢印で示されています。この図は、Leblanc Latour (2023)27 の許可を得て改作したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。

図5: in vitro スキャフォールドの組織学的分析。 移植後8週間後の播種されていない足場からの組織学的断面の代表的な画像。切片をヘマトキシリンとエオシン(H&E)で染色して細胞を可視化するか、Masson-Goldner's trichrome(MGT)で染色してコラーゲンを可視化しました。矢印は赤血球を示します。コラーゲンの存在が見られます(スケールバー = 左右のインセットでそれぞれ 1 mm と 200 μm)。この図は、Leblanc Latour (2023)27 の許可を得て改作したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。
| サンプル数 | ピーク力(N) |
| 1 | 92.8 |
| 2 | 162.7 |
| 3 | 140.3 |
| 4 | 135.7 |
| 5 | 37.7 |
| 6 | 157.8 |
| 7 | 67.9 |
| 意味する | 113.6 |
| SEM(溶断機) | 18.2 |
表1:押し出し試験で測定されたピーク力。
補足図1:ヤング率計算の典型的な応力-ひずみ曲線。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
いくつかのin vitroおよびin vivo研究は、植物由来のセルロースの生体適合性と、組織工学におけるその潜在的な使用を実証しています14,15,16,18,19,20、より具体的には骨形成分化をホストするために20,21.本研究の目的は、BTEに対するリンゴ由来のセルロース足場の可能性をさらに調査し、これらの足場の機械的特性をin vitroおよびin vivoの両方で評価することでした。
in vitro試験では、リンゴ組織から天然細胞を除去した後、骨芽細胞前細胞(MC3T3-E1)を足場に播種しました。MC3T3-E1細胞は、細胞外マトリックス28,29,30のバイオミネラリゼーションを調査するために一般的に使用されます。次に、足場を骨形成分化培地または非分化培地で4週間培養しました。この知見は、特に分化培地で培養した場合に、細胞が足場内で増殖し、分化を起こすことを示しており、リンゴ由来のセルロース足場が骨組織の発達をサポートする可能性を浮き彫りにしました。細胞核は足場孔に多数観察され、以前の研究で報告された観察を裏付けています14,15,16,17,20,21。さらに、以前の調査結果14および別のグループ21の調査結果と同様に、足場細孔の平均直径は~154μmであり、ほとんどの細孔の直径は100μmから200μmの間でした(図1C)。これらの寸法は、骨の成長を促進することが知られている理想的な細孔サイズ範囲(100〜200μm)と一致しています7。
染色分析では、分化培地での4週間の培養期間後にALP活性が高いことが示されました。分化培地で培養した細胞播種足場の表面には、ブランク足場と非分化培地で培養した細胞播種足場の両方と比較して、より多くのカルシウム沈着が観察されました。同様の結果は、リンゴ由来の足場における分化したiPS細胞でも観察されている21。ALPの存在は本研究で定性的に評価されましたが、定量分析のために追加のアッセイを実行することができました。さらに、足場の組織学的評価により、浸潤した骨芽細胞が分化後に足場を石灰化することが確認された。注目すべきは、非分化培地で培養したコンストラクトの周辺部もVKで染色されたことです。足場中のCaCl2 の残留は、脱細胞化後の周辺部で観察されるこの非特異的染色を引き起こした可能性があります。鉱化作用をさらに評価するために、SEM画像の定性分析を実施しました。分化培地で培養した後、細胞播種した足場はECM石灰化の兆候を示しました。鉱物凝集体は、足場の表面、特に細孔の縁に見られました。これらの観察結果は、ECM30 および植物由来の足場21を用いた以前の研究と一致している。これらの凝集体は、播種された細胞のない足場の表面には存在しなかった。凝集体のEDS分析により、高レベルのPとCaの存在が明らかになり、アパタイトの存在が示唆されました。注目すべきは、本研究で記述されたプロトコルは、細胞浸潤と石灰化の存在を視覚化することを可能にしますが、時間の経過に伴うそれらの進行の評価は許可しないということです。この進行を完全に評価するには、複数の時点での組織学的分析が必要です。さらに、表面および足場全体の細胞浸潤と石灰化を定量化するには、さらなる分析が必要になります。最後に、鉱床の元素組成はEDSによって決定されましたが、観察された鉱床の結晶構造に関する情報を提供するために、X線回折(XRD)などの他の特性評価技術が必要になる場合があります。
足場のヤング率は、分化培地での培養後に有意に高かった(約8倍)。対照的に、非分化培地で培養した足場の弾性率は、ブランク足場(播種細胞のない足場)の弾性率に似ており、リンゴ由来の足場を用いた以前の研究で報告された知見と同様であった20。分化培地で培養した足場のヤング率は高いにもかかわらず、天然骨(海綿骨で0.1〜2 GPa、皮質骨で15〜20 GPa)8、海綿同種移植片(3.78 GPa)31、ポリエーテルエーテルケトン(3.84 GPa)31、チタン(50.20 GPa)31、コバルトクロム合金(53.15 GPa)31 からなる同種形成移植片よりもはるかに低いままでしたインプラント。したがって、現在の配合の足場は、耐荷重用途に適していない可能性があります。注目すべきは、ヤング率が材料の剛性に関する情報を提供することです。ただし、降伏強度は、足場の機械的特性をより広く理解するために考慮することもできます。
次に、脱細胞化リンゴ足場をラット(n = 6匹)の5mm両側臨界サイズの頭蓋骨欠損に移植しました。宿主の頭蓋骨内の足場の統合を評価するために実施されたプッシュアウト試験(7つの外植片)では、平均ピーク力は113.6 N±18.2 Nであり、これは以前に報告された頭蓋骨の骨折荷重(127.1 ± 9.6 N)22に類似していることが示され、足場が周囲の骨組織にうまく統合されていることが示唆されました。ただし、押し出し試験は、足場と周囲の組織との間の界面に関する情報のみを提供することに注意する必要があります。以前の研究では、押し出し試験と圧痕試験を組み合わせて、骨とインプラントの界面と足場自体の機械的特性をより広く理解できるようにしました22。加えて、両側の欠陥は、プランジャー32とのミスアライメントをより生じやすくなる。頭蓋外植片、単一欠損モデル、または追加のクランプシステムを万能試験装置に適切に配置することで、ミスアライメントを回避できる可能性がある32。
要約すると、この研究は、リンゴ由来のセルロース足場が骨芽細胞前の接着と増殖を促進する可能性があることを確認しました。さらに、分化培地で培養した細胞播種足場内で石灰化が起こり、足場ヤング率の増加につながりました。しかし、弾性率は天然骨よりも有意に低いままであった。興味深いことに、埋め込まれたリンゴ由来のセルロース足場を変位させるのに必要な力は、以前にBTE22に使用されていた頭蓋骨やその他のタイプの足場の骨折荷重に匹敵しました。最後に、以前の報告で示した結果と同様に、細胞は埋め込まれた足場に浸潤し、コラーゲンを沈着させました。全体として、この研究は、BTE用途における植物由来のセルロース足場の可能性を示しています。これらの発見は、別の研究グループによって実施された以前の研究と一致しており、BTE目的に対する植物由来のセルロース足場の適合性をさらに実証しています21。それにもかかわらず、足場の剛性が海綿骨や皮質骨と異なることは、天然骨の機械的特性により近い複合生体材料を開発することの重要性を浮き彫りにしています。したがって、BTEの目的で植物由来の足場を利用することへの関心が高まっているにもかかわらず、それらの使用は非耐荷重用途に限定されたままである可能性があります。以前に実証したように16、化学修飾による植物由来のセルロース足場の再設計、または他の生物学的/合成ポリマーとの複合材料の開発は、耐荷重用途に不可欠である可能性があります。
開示事項
利益相反に関する声明:M.L.L.、M.T.、R.J.H.、C.M.C.、I.C.およびA.P.は、BTE用途における植物由来セルロースの使用に関して、オタワ大学とSpiderwort Inc.が出願した特許出願の発明者です。M.L.L.、R.J.H.、C.M.C.、およびA.P.は、Spiderwort Inc.の金銭的利害関係を有しています。
謝辞
このプロジェクトの資金は、カナダ自然科学工学研究評議会(NSERC)(ディスカバリー助成金)と李嘉誠基金会から提供されました。MLLはオンタリオ州センターオブエクセレンスTalentEdgeプログラムから支援を受け、RJHはNSERC大学院奨学金とオンタリオ大学院奨学金(OGS)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | ThermoFisher | D1306 | DAPI |
| Alizarin red S | Sigma-Aldrich | A5533 | ARS |
| Ascorbic acid | Sigma-Aldrich | A4403 | Cell Culture |
| Calcium Chloride | ThermoFisher | AA12316 | CaCl2 |
| Calcofluor White | Sigma-Aldrich | 18909 | |
| Dental drill | Surgical tool | ||
| Ethanol | ThermoFisher | 615095000 | |
| Fetal bovine serum | Hyclone Laboratories | SH30396 | FBS |
| Formalin | Sigma-Aldrich | HT501128 | 10% Formalin |
| Goldner's trichrome stain | Sigma-Aldrich | 1.00485 | GTC |
| Hematoxylin and eosin stain | Fisher Scientific | NC1470670 | H&E |
| High-speed resonant confocal laser scanning microscope | Nikon | Nikon Ti-E A1-R | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| ImageJ software | National Institutes of Health | ||
| Irrigation saline | Baxter | JF7123 | 0.9% NaCl |
| MC3T3-E1 Subclone 4 cells | ATCC | CRL-2593 | Pre-osteoblast cells |
| McIntosh apples | Canada Fancy grade | ||
| Methyl methacrylate | Sigma-Aldrich | M55909 | Histological embedding |
| Minimum Essential Medium | ThermoFisher | M0894 | α-MEM |
| Paraformaldehyde | Fisher Scientific | O4042 | 4%; PFA |
| Penicillin/Streptomycin | Hyclone Laboratories | SV30010 | Cell Culture |
| Periodic acid | Sigma-Aldrich | 375810 | |
| Phosphate buffered saline | Hyclone Laboratories | 2810305 | PBS; without Ca2+ and Mg2+ |
| Propidium iodide | Invitrogen | p3566 | |
| Scanning electron microscope | JEOL | JSM-7500F FESEM | SEM and EDS |
| Slide scanner microscope | Zeiss | AXIOVERT 40 CFL | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166 | SDS |
| Sodium metabisulphite | Sigma-Aldrich | 31448 | |
| Sodium phosphate | ThermoFisher | BP329 | |
| Sprague-Dawley rats | Charles-River Laboratories | 400 | Male |
| Sutures | Ethicon | J494G | 4-0 |
| Trephine | ACE Surgical Supply Co | 583-0182 | 5-mm diameter |
| Triton-X 100 | ThermoFisher | 807423 | |
| Trypsin | Hyclone Laboratories | SH30236.02 | Cell Culture |
| Tween | Fisher Scientific | BP337 | |
| Universal compression Device | CellScale | UniVert | |
| Von Kossa stain | Sigma-Aldrich | 1.00362 | Histology |
参考文献
- Schmitz, J. P., Hollinger, J. O. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clinical Orthopaedics and Related Research. 205, 299-308 (1986).
- Yu, X., Tang, X., Gohil, S. V., Laurencin, C. T. Biomaterials for bone regenerative engineering. Advanced Healthcare Materials. 4 (9), 1268-1285 (2015).
- Parikh, S. N. Bone graft substitutes: Past, present, future. Journal of Postgraduate Medicine. 48 (2), 142-148 (2002).
- Silber, J. S., et al. Donor site morbidity after anterior iliac crest bone harvest for single-level anterior cervical discectomy and fusion. Spine (Phila Pa 1976). 28 (2), 134-139 (2003).
- Amini, A. R., Laurencin, C. T., Nukavarapu, S. P. Bone tissue engineering: recent advances and challenges. Critical Reviews in Biomedical Engineering. 40 (5), 363-408 (2012).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. Journal of Biomechanical Engineering. 122 (6), 570-575 (2000).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Bose, S., Roy, M., Bandyopadhyay, A. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnology. 30 (10), 546-554 (2012).
- Yoshikawa, H., Myoui, A. Bone tissue engineering with porous hydroxyapatite ceramics. Journal of Artificial Organs. 8 (3), 131-136 (2005).
- Fu, Q., Saiz, E., Rahaman, M. N., Tomsia, A. P. Bioactive glass scaffolds for bone tissue engineering: state of the art and future perspectives. Materials Science & Engineering. C, Materials for Biological Applications. 31 (7), 1245-1256 (2011).
- Xynos, I. D., Edgar, A. J., Buttery, L. D. K., Hench, L. L., Polak, J. M. Ionic products of bioactive glass dissolution increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochemical and Biophysical Research Communications. 276 (2), 461-465 (2000).
- Kroeze, R., Helder, M., Govaert, L., Smit, T. Biodegradable polymers in bone tissue engineering. Materials. 2 (3), 833-856 (2009).
- Venkatesan, J., Vinodhini, P. A., Sudha, P. N. Chitin and chitosan composites for bone tissue regeneration. Advances in Food and Nutrition Research. 73, 59-81 (2014).
- Modulevsky, D. J., Lefebvre, C., Haase, K., Al-Rekabi, Z., Pelling, A. E. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS One. 9 (5), e97835(2014).
- Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Biocompatibility of subcutaneously implanted plant-derived cellulose biomaterials. PLoS One. 11 (6), e0157894(2016).
- Hickey, R. J., Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Customizing the shape and microenvironment biochemistry of biocompatible macroscopic plant-derived cellulose scaffolds. ACS Biomaterials Science & Engineering. 4 (11), 3726-3736 (2018).
- Hickey, R. J., Leblanc Latour, M., Harden, J. L., Pelling, A. E. Designer scaffolds for interfacial bioengineering. Advanced Engineering Materials. 25, 2201415(2023).
- Fontana, G., et al. Biofunctionalized plants as diverse biomaterials for human cell culture. Advanced Healthcare Materials. 6 (8), 1601225(2017).
- Gershlak, J. R., et al. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials. 125, 13-22 (2017).
- Leblanc Latour, M., Pelling, A. E. Mechanosensitive osteogenesis on native cellulose scaffolds for bone tissue engineering. Journal of Biomechanics. 135, 111030(2022).
- Lee, J., Jung, H., Park, N., Park, S. H., Ju, J. H. Induced osteogenesis in plants decellularized scaffolds. Scientific Reports. 9 (1), 20194(2019).
- Zhao, J., et al. Enhanced healing of rat calvarial defects with sulfated chitosan-coated calcium-deficient hydroxyapatite/bone morphogenetic protein 2 scaffolds. Tissue Engineering. Part A. 18 (1-2), 185-197 (2012).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. In: Modern Electron Microscopy in Physical and Life Sciences. , 161-186 (2016).
- tousimis Critical Point Dryers - Samdri®-PVT-3D. , https://tousimis.com/critical_point_dryers/detail.html?Pid=8755B (2022).
- Leica EM ACE200 Vacuum Coater. , https://www.leica-microsystems.com/products/sample-preparation-for-electron-microscopy/p/leica-em-ace200/ (2023).
- Spicer, P. P. Evaluation of bone regeneration using the rat critical size calvarial defect. Nature Protocols. 7 (10), 1918-1929 (2012).
- Leblanc Latour, M. Cellulose biomaterials for bone tissue engineering [dissertation]. , Department of Physics, Faculty of Science, University of Ottawa, Ottawa, Canada. (2023).
- Kodama, H. -A., Amagai, Y., Sudo, H., Kasai, S., Yamamoto, S. Establishment of a clonal osteogenic cell line from newborn mouse calvaria. Japanese Journal of Oral Biology. 23 (4), 899-901 (1981).
- Wang, D., et al. Isolation and characterization of MC3T3-E1 preosteoblast subclones with distinct in vitro and in vivo differentiation/mineralization potential. Journal of Bone and Mineral Research. 14 (6), 893-903 (1999).
- Addison, W. N., et al. Extracellular matrix mineralization in murine MC3T3-E1 osteoblast cultures: An ultrastructural, compositional and comparative analysis with mouse bone. Bone. 71, 244-256 (2015).
- Heary, R. F., Parvathreddy, N., Sampath, S., Agarwal, N. Elastic modulus in the selection of interbody implants. Journal of Spine Surgery. 3 (2), 163-167 (2017).
- Lawson, Z. T., et al. Methodology for performing biomechanical push-out tests for evaluating the osseointegration of calvarial defect repair in small animal models. MethodsX. 8, 101541(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved