Method Article
Scaffolds Decelularizados Derivados de Maçã para Engenharia de Tecido Ósseo In Vitro e In Vivo
Neste Artigo
Resumo
Neste estudo, detalhamos métodos de decelularização, caracterização física, imageamento e implantação in vivo de biomateriais de base vegetal, bem como métodos de semeadura e diferenciação celular nos scaffolds. Os métodos descritos permitem a avaliação de biomateriais de origem vegetal para aplicações em engenharia de tecido ósseo.
Resumo
Biomateriais de celulose derivados de plantas têm sido empregados em diversas aplicações de engenharia de tecidos. Estudos in vivo têm demonstrado a notável biocompatibilidade de arcabouços feitos de celulose derivada de fontes naturais. Além disso, esses arcabouços possuem características estruturais relevantes para múltiplos tecidos e promovem a invasão e proliferação de células de mamíferos. Pesquisas recentes utilizando tecido hipântio de maçã decelularizado demonstraram a semelhança de seu tamanho de poro com o do osso trabecular, bem como sua capacidade de apoiar efetivamente a diferenciação osteogênica. O presente estudo examinou ainda o potencial de scaffolds de celulose derivados de maçã para aplicações em engenharia de tecido ósseo (BTE) e avaliou suas propriedades mecânicas in vitro e in vivo . Pré-osteoblastos MC3T3-E1 foram semeados em scaffolds de celulose derivados de maçã que foram então avaliados quanto ao seu potencial osteogênico e propriedades mecânicas. A coloração de fosfatase alcalina e S vermelho de alizarina confirmou a diferenciação osteogênica em scaffolds cultivados em meio de diferenciação. O exame histológico demonstrou invasão celular generalizada e mineralização através dos scaffolds. A microscopia eletrônica de varredura (MEV) revelou agregados minerais na superfície dos scaffolds, e a espectroscopia de energia dispersiva (EDS) confirmou a presença de elementos fosfato e cálcio. No entanto, apesar de um aumento significativo no módulo de Young após a diferenciação celular, ele permaneceu menor do que o do tecido ósseo normal. Estudos in vivo mostraram infiltração celular e deposição de matriz extracelular dentro dos arcabouços derivados de maçãs decelularizadas após 8 semanas de implantação na calvária de ratos. Além disso, a força necessária para remover os scaffolds do defeito ósseo foi semelhante à carga de fratura relatada anteriormente do osso nativo da calota. No geral, este estudo confirma que a celulose derivada da maçã é uma candidata promissora para aplicações em BTE. Entretanto, a dissimilaridade entre suas propriedades mecânicas e as do tecido ósseo normal pode restringir sua aplicação a cenários de baixa carga de carga. Reengenharia estrutural adicional e otimização podem ser necessárias para melhorar as propriedades mecânicas de andaimes de celulose derivados de maçã para aplicações de suporte de carga.
Introdução
Grandes defeitos ósseos causados por uma lesão ou doença frequentemente requerem enxertos de biomateriais para regeneração completa1. As técnicas atuais destinadas a melhorar a regeneração do tecido ósseo utilizam regularmente enxertos autólogos, alogênicos, xenogênicos ou sintéticos2. Para o enxerto ósseo autólogo, considerado a prática de enxerto "padrão ouro" para reparar grandes defeitos ósseos, o osso é extraído do paciente. No entanto, esse procedimento de enxertia tem várias desvantagens, incluindo limitações de tamanho e forma, disponibilidade de tecido e morbidade do local de amostragem3. Além disso, os procedimentos de enxertia autóloga são suscetíveis a infecções do sítio cirúrgico, fraturas subsequentes, formação de hematoma no local da amostragem ou reconstruído e dor pós-operatória4. A engenharia do tecido ósseo (BTE) oferece uma alternativa potencial aos métodos convencionais de enxerto ósseo5. Ele combina biomateriais estruturais e células para construir novo tecido ósseo funcional. Ao projetar biomateriais para BTE, é fundamental combinar uma estrutura macroporosa, química de superfície que promova a fixação celular e propriedades mecânicas que se assemelham muito às do osso nativo6. Pesquisas anteriores indicaram que o tamanho ideal dos poros e o módulo de elasticidade para os biomateriais utilizados em BTE são de aproximadamente 100-200 μm7 e 0,1-20 GPa, respectivamente, dependendo do local de enxertia8. Além disso, a porosidade e a interconectividade dos poros dos scaffolds são fatores críticos que afetam a migração celular, a difusão de nutrientes e a angiogênese8.
O BTE tem mostrado resultados promissores com diversos biomateriais desenvolvidos e avaliados como opções alternativas aos enxertos ósseos. Alguns desses biomateriais são osteoindutores, híbridos e hidrogéis avançados8. Os materiais osteoindutores estimulam o desenvolvimento de estruturas ósseas neoformadas. Os materiais híbridos são compostos por polímeros sintéticos e/ou naturais8. Os hidrogéis avançados mimetizam a matriz extracelular (MEC) e são capazes de fornecer os fatores bioativos necessários para promover a integração do tecido ósseo8. A hidroxiapatita é um material tradicional e de escolha comum para BTE devido à sua composição e biocompatibilidade9. O vidro bioativo é outro tipo de biomaterial para BTE, que demonstrou estimular respostas celulares específicas para ativar genes necessários para a osteogênese10,11. Polímeros biodegradáveis, incluindo poli(ácido glicólico) e poli(ácido lático), também têm sido extensivamente utilizados em aplicações de BTE12. Finalmente, polímeros naturais ou de origem natural como quitosana, quitina e celulose bacteriana também demonstraram resultados encorajadores para o BTE13. No entanto, enquanto polímeros sintéticos e naturais mostram potencial para BTE, o desenvolvimento de um arcabouço funcional com a macroestrutura desejada normalmente requer protocolos extensos.
Por outro lado, estruturas macroscópicas nativas de celulose podem ser facilmente derivadas de diversas plantas e nosso grupo de pesquisa demonstrou anteriormente a aplicabilidade de scaffolds à base de celulose derivados de plantas para diferentes reconstruções teciduais. De fato, após um simples tratamento com surfactante, aproveitamos a estrutura inerente do material vegetal, destacando seu potencial como biomaterial versátil14. Além disso, esses scaffolds à base de celulose podem ser utilizados para aplicações em cultura de células de mamíferos in vitro 14, são biocompatíveis e suportam vascularização subcutânea espontânea 14,15,16,17. Tanto nosso grupo de pesquisa quanto outros demonstraram que esses scaffolds podem ser obtidos a partir de plantas específicas com base na aplicação pretendida 14,15,16,17,18,19,20. Por exemplo, a estrutura vascular observada em caules e folhas de plantas apresenta uma semelhança marcante com a estrutura encontrada em tecidos animais19. Além disso, suportes de celulose derivados de plantas podem ser facilmente moldados e submetidos a modificações bioquímicas superficiais para atingir as características desejadas16. Em um estudo recente, incorporamos um tampão salino durante o processo de decelularização, levando a uma maior adesão celular observada tanto in vitro quanto in vivo 16. No mesmo estudo, demonstramos a aplicabilidade de scaffolds de celulose de origem vegetal em biomateriais compósitos por meio da fundição de hidrogéis na superfície dos scaffolds. Em estudos recentes, a funcionalização de arcabouços derivados de plantas tem demonstrado aumentar sua eficácia18. Por exemplo, um estudo realizado por Fontana e colaboradores (2017) revelou que a adesão de fibroblastos dérmicos humanos era suportada por hastes decelularizadas revestidas com RGD, enquanto hastes não revestidas não exibiam a mesma capacidade18. Além disso, os autores também demonstraram que fluidos corporais simulados modificados podem ser utilizados para mineralizar artificialmente caules de plantas descelularizadas. Em estudos mais recentes, exploramos o conceito de osteogênese mecanossensível em scaffolds de celulose de origem vegetal e avaliamos seu potencial paraBTE17,20. (2019) utilizaram arcabouços derivados de plantas para cultivar tecidos semelhantes a ossos em um ambiente in vitro 21. Por meio de avaliações abrangentes de diferentes fontes vegetais, os autores identificaram os scaffolds derivados da maçã como os mais ideais para o cultivo e diferenciação de células-tronco pluripotentes induzidas por humanos (hiPSCs). Além disso, os autores propuseram que os atributos estruturais e mecânicos dos andaimes derivados de maçãs desempenham um papel fundamental na sua adequação à finalidade pretendida. Sendo os arcabouços iniciais derivados de plantas implementados em aplicações de engenharia de tecidos, os scaffolds derivados de maçãs têm demonstrado extensivamente possuir uma arquitetura surpreendentemente semelhante à do osso humano, notadamente em termos de seus poros interconectados variando de 100 a 200 μm de diâmetro14,21.
No presente estudo, investigamos o potencial de scaffolds de celulose derivados de maçã para BTE e realizamos uma análise de suas propriedades mecânicas tanto in vitro quanto in vivo. Embora existam estudos sobre o potencial de scaffolds derivados de maçãs para BTE 17,20,21, suas propriedades mecânicas têm sido pouco investigadas. Os resultados mostraram invasão selvagem e diferenciação osteogênica de pré-osteoblastos MC3T3-E1 semeados em scaffolds que foram cultivados em meio de diferenciação por 4 semanas. O módulo de Young desses scaffolds foi de 192,0 ± 16,6 kPa, significativamente maior do que os scaffolds blank (scaffolds sem células semeadas) (31,6 ± 4,8 kPa) e os scaffolds cell-seed cultivados em meio de não diferenciação (24,1 ± 8,8 kPa). No entanto, deve-se notar que o módulo de Young do tecido ósseo humano saudável tipicamente está dentro da faixa de 0,1-2 GPa para o osso trabecular e aproximadamente 15-20 GPa para o osso cortical8. No entanto, após um implante de 8 semanas em um defeito na calvária de roedores, os arcabouços com sementes de células pareciam estar bem integrados ao osso circundante, como demonstrado por um pico de força médio de 113,6 N ± 18,2 N em testes de push-out, que é semelhante à carga de fratura relatada anteriormente do osso nativo da calotacraniana22. Em geral, os resultados obtidos a partir deste estudo mostram uma promessa significativa, particularmente para aplicações sem suporte de carga. No entanto, os suportes de celulose derivados da maçã não possuem atualmente as propriedades mecânicas necessárias para combinar precisamente com o tecido ósseo circundante em um local de implante. Consequentemente, é necessário um maior desenvolvimento para desbloquear todo o potencial destes andaimes.
Protocolo
Os protocolos experimentais foram revisados e aprovados pelo Comitê de Cuidados com Animais da Universidade de Ottawa.
1. Preparação do andaime
- Use uma fatia de bandolim para cortar maçãs McIntosh (Canada Fancy) em fatias de 8 mm de espessura. Corte o tecido do hipântio das fatias de maçã em quadrados de 5 mm x 5 mm.
- Colocar as amostras quadradas em dodecil sulfato de sódio (SDS) a 0,1% durante 2 dias.
- Lavar as amostras decelularizadas com água deionizada e incubá-las durante a noite à temperatura ambiente (TR) em CaCl2 100 mM para remover o tensoativo restante.
- Esterilizar as amostras (isto é, arcabouços) em etanol 70% por 30 min, lavá-las com água deionizada e colocá-las em uma placa de cultura de 24 poços antes da semeadura celular.
2. Cultura celular e semeadura de andaimes
- Manter as células MC3T3-E1 Subclone 4 em placas tratadas com cultura celular de 10 cm de diâmetro em condições de cultura celular (37°C em atmosfera umidificada de 95% de ar e 5% de CO2).
- Preparar meio de cultura celular à base de meio essencial mínimo de Eagle - modificação alfa (α-MEM) suplementado com 10% de soro fetal bovino (SFB) e 1% de penicilina/estreptomicina.
- Separar as células das placas de cultura por tripsinização (0,05% tripsina-EDTA) quando atingirem 80% de confluência.
- Centrifugar a suspensão celular a c.a. 200 x g por 3 min. Aspirar o sobrenadante e ressuspender as células em α-MEM a 2,5 x 107 células por mL.
- Pipetar uma alíquota de 40 μL da suspensão celular na superfície dos scaffolds e deixar as células aderirem por 1 h em condições de cultura celular. Em seguida, adicionar 2 mL de meio de cultura a cada poço de cultura da placa de cultura.
- Reabastecer o meio de cultura a cada 2-3 dias por 14 dias.
- Preparar um meio de diferenciação adicionando 50 μg/mL de ácido ascórbico e 4 mM de fosfato de sódio ao meio de cultura celular descrito anteriormente.
- Induzir a diferenciação de células MC3T3-E1 incubando os scaffolds em meio de diferenciação por 4 semanas. Reabasteça o meio a cada 3-4 dias. Paralelamente, incubar scaffolds em meio de cultura sem diferenciação (ou seja, meio sem os suplementos para induzir diferenciação) pela mesma duração, com o mesmo esquema de troca de meio para servir como controle negativo.
3. Medidas do tamanho dos poros usando microscopia confocal de varredura a laser
- Lave os andaimes derivados de maçãs decelularizadas com solução salina tamponada com fosfato (PBS).
- Incubar os scaffolds em 1 mL de coloração branca de calcofluor a 10% (v/v) por 25 min no escuro em TR.
- Lavar os scaffolds (n = 3) com PBS e obter três áreas selecionadas aleatoriamente por andaime com um microscópio de varredura a laser confocal ressonante de alta velocidade (CLSM) em aumento de 10x, usando um canal DAPI, da seguinte forma:
- Configuração do filtro de emissão a laser: 405 nm (laser); 425-475 nm (emissão)
- Ajuste a potência do laser e o detector manualmente para garantir a aquisição ideal da imagem. Adquira uma pilha z de 20 imagens com um tamanho de passo de 5 μm.
- Usando o software ImageJ, processe e analise as imagens confocais da seguinte forma:
- Use a função Z-Project to Maximum Intensity para criar uma imagem e aplique a função Find Edges para realçar a borda dos poros.
- Trace os poros manualmente usando a ferramenta Seleção à mão livre .
- Ajustar cada poro como uma elipse, medir o comprimento do eixo maior, compilar todas as medidas (um total de 54 no presente estudo - 6 em 3 áreas selecionadas aleatoriamente para cada scaffold) e calcular o comprimento médio.
4. Análise da distribuição celular utilizando microscopia confocal de varredura a laser
- Lavar três vezes os scaffolds de sementes celulares cultivados em meio de não diferenciação ou diferenciação com PBS. Fixar os andaimes com paraformaldeído a 4% por 10 min.
- Lave bem cada andaime com água deionizada, permeabilize as células com uma solução de Triton-X 100 por 5 minutos e lave novamente com PBS.
- Incubar os scaffolds em 1 mL de ácido periódico a 1% por 40 min e enxaguar com água deionizada14,16.
- Incubar os scaffolds em 1 mL de solução contendo 100 mM de metabissulfito de sódio e ácido clorídrico 0,15 M, suplementada com 100 μg/mL de iodeto de propídio. Mergulhe completamente os andaimes na solução.
- Lavar os scaffolds com PBS e manchar os núcleos celulares incubando-os numa solução DAPI de 5 mg/ml durante 10 minutos no escuro. Lave bem novamente e armazene os andaimes em PBS antes da aquisição de imagens.
- Imagem de três superfícies selecionadas aleatoriamente de três diferentes scaffolds com sementes de células diferentes com um CLSM ressonante de alta velocidade em aumento de 10x, usando canais DAPI e TRITC, da seguinte forma:
- Configuração do filtro de emissão a laser:
DAPI: Laser: 405 nm; Emissão: 425-475 nm
TRITC: Laser: 561 nm; Emissão: 570-620 nm - Ajuste a potência do laser e o detector manualmente para garantir a aquisição ideal da imagem. Adquira uma pilha z de 20 imagens com um tamanho de passo de 5 μm.
- Configuração do filtro de emissão a laser:
- Use o software ImageJ para processar as imagens confocais e criar uma projeção máxima no eixo z para análise de imagens usando a função Z-Project to Maximum Intensity (Projeto Z para Intensidade Máxima ).
5. Análise de fosfatase alcalina
- Lavar três vezes os scaffolds de sementes celulares cultivados em meio de não diferenciação ou diferenciação com PBS. Fixar os andaimes com formalina tamponada neutra a 10% durante 30 minutos. Fixe andaimes em branco (andaimes sem células semeadas) para servir como controle negativo.
- Preparar uma solução corante de 5-bromo-4-cloro-3'-indolifosfato e nitro-azul tetrazólio (BCIP/NBT) dissolvendo um comprimido de BCIP/NBT em 10 ml de água deionizada.
- Lave os andaimes fixos com uma solução de Tween a 0,05% e core com a solução BCIP/NBT durante 20 minutos em RT. Lave os andaimes corados com uma solução de Tween a 0,05% e armazene-os em PBS antes da obtenção de imagens.
- Imagine os andaimes manchados com uma câmera digital de 12 megapixels.
6. Análise da deposição de cálcio
- Lavar três vezes os scaffolds de sementes celulares cultivados em meio de não diferenciação ou diferenciação com PBS. Fixar os andaimes com formalina tamponada neutra a 10% durante 30 minutos. Fixe andaimes em branco (andaimes sem células semeadas) para servir como controle negativo.
- Preparar uma solução corante a 2% (p/v) de alizarina vermelha S (ARS).
- Lave os andaimes fixos com água deionizada e manche-os com a solução ARS por 1 h no RT. Lave os andaimes corados com água deionizada e armazene-os em PBS antes da obtenção de imagens.
- Imagine os andaimes manchados com uma câmera digital de 12 megapixels.
7. Análise de mineralização
- Lavar três vezes os scaffolds de sementes celulares cultivados em meio de não diferenciação ou diferenciação com PBS. Fixar os andaimes com paraformaldeído a 4% por 48 h. Fixe andaimes em branco (andaimes sem células semeadas) para servir como controle negativo.
- Desidratar as amostras em soluções contendo concentrações de etanol aumentando de 50% a 100%, conforme descrito anteriormente23.
- Realizar microscopia eletrônica de varredura (MEV) e espectroscopia de energia dispersiva (EDS) para analisar agregados minerais da seguinte forma:
- Secar as amostras com secador de ponto crítico, seguindo o protocolo do fabricante24.
- Aplicar uma camada de ouro de 5 nm sobre os andaimes usando um revestidor de pulverização de ouro, seguindo o protocolo do fabricante25.
- Obtenha imagens da superfície dos scaffolds com um microscópio eletrônico de varredura regulado em 3 kV, com aumento de 85x.
- Realizar EDS ajustando o microscópio eletrônico de varredura em 15 kV. Em três áreas selecionadas aleatoriamente por scaffold, adquira espectros EDS para análise da composição de agregados minerais.
8. Medidas do módulo de elasticidade
- Retirar os suportes de sementes celulares do respectivo meio de incubação e testar imediatamente as amostras.
- Usando um aparelho de compressão uniaxial personalizado equipado com uma célula de carga de 1,5 N, comprima os andaimes (n = 3 por condição) a uma taxa constante de 3 mm·min-1 até uma deformação compressiva máxima de 10% da altura do andaime.
- Determinar o módulo de Young a partir da inclinação da porção linear das curvas tensão-deformação. No presente estudo, o módulo de elasticidade foi determinado entre 9% e 10% de deformação.
9. Infiltração celular e análise da mineralização por histologia: scaffolds in vitro
- Lavar três vezes os scaffolds com sementes de células cultivadas em meio de não diferenciação ou diferenciação com PBS.
- Fixar os arcabouços com paraformaldeído a 4% por 48 h antes da ressuspensão em etanol 70% para armazenamento.
- Histologia:
NOTA: No presente estudo, todo o preparo histológico (incorporação, secção e coloração) descrito nas próximas etapas foi realizado pelo Louise Pelletier Histology Core Facility (University of Ottawa).- Após a desidratação e inclusão em parafina, cortar as amostras em cortes seriados de 5 μm de espessura, iniciando 1 mm dentro dos scaffolds, e montar os cortes em lâminas de microscópio.
- Corar os cortes com hematoxilina e eosina (H&E) ou von Kossa (VK).
- Imagem dos cortes com microscópio scanner de lâminas em aumento de 40x (n = 1 scaffold em meio de diferenciação e n = 2 scaffolds em meio de diferenciação no presente estudo).
- Utilizando o software ImageJ, avalie visualmente a infiltração celular (coloração H&E) e a mineralização (coloração VK).
10. Modelo de defeito de calota craniana em rato
- Obtenha protocolos experimentais revisados e aprovados pelo comitê local de cuidados com animais.
- Preparar andaimes decelularizados circulares (5 mm de diâmetro e 1 mm de espessura) de acordo com a secção 1 descrita acima e utilizando um punch de biópsia de 5 mm.
- Realizar craniotomia bilateral seguindo protocoloestabelecido26, conforme segue:
- Anestesiar ratos machos Sprague-Dawley com isoflurano, primeiro a 3% até ficarem inconscientes, e depois a 2-3% durante todo o procedimento.
- Expor o periósteo e o crânio cortando a pele sobrejacente usando uma lâmina de bisturi. Remova o periósteo.
- Criar defeitos bilaterais em ambos os ossos parietais de cada lado da sutura sagital usando uma broca dental equipada com uma trefina de 5 mm de diâmetro sob irrigação constante de NaCl a 0,9%.
- Limpar o osso circundante com NaCl a 0,9% para remover quaisquer fragmentos ósseos.
- Coloque os andaimes circulares e decelularizados nos defeitos.
- Fechar a pele sobrejacente com pontos 4-0.
- Dê aos ratos acesso ilimitado a comida e água e monitore-os diariamente.
- Após 8 semanas pós-implantação, eutanásia dos ratos por inalação de CO2 e perfuração torácica como medida secundária de eutanásia.
- Para expor o crânio e recuperar os implantes, remova a pele que cobre o crânio usando uma lâmina de bisturi.
- Corte o crânio nos ossos frontal e occipital e no lado de ambos os ossos parietais usando uma broca dentária para remover a seção superior do crânio completamente.
11. Teste de push-out
- Conecte um dispositivo de compressão uniaxial (com uma célula de carga de 445 N) ao módulo de aquisição de dados USB.
- Conecte o módulo de aquisição de dados a um computador equipado com um aplicativo de software de aquisição de dados.
- Imediatamente após a extração craniana, colocar cada amostra (n = 7 implantes de 4 animais do presente estudo) no porta-amostras do dispositivo de compressão uniaxial de modo que a face dorsal do osso esteja voltada para cima.
- Abaixe o êmbolo a 0,5 mm/min até tocar levemente o implante extraído.
- Iniciar o teste abaixando o êmbolo através do implante até completar o push-out enquanto aplica compressão a uma velocidade constante de 0,5 mm/min usando o software de aquisição de dados.
- Registre o pico de força na curva força vs. deslocamento usando o software de aquisição de dados.
12. Infiltração celular e análise de mineralização por histologia: scaffolds in vivo
- Fixar a calvária extraída e os implantes em formalina tamponada a 10% neutra por 72 h antes da ressuspensão em etanol 70% para armazenamento.
- Histologia:
NOTA: No presente estudo, todo o preparo histológico (incorporação, secção e coloração) descrito nas próximas etapas foi realizado pelo Accel Labs (Montreal, QC, Canadá).- Corte as amostras (embutidas em metacrilato de metila) em seções de 6 μm de espessura em três níveis diferentes (superior, inferior e em direção ao centro) e monte-as em lâminas de microscópio.
- Manchar as seções com H&E ou tricrômico de Masson-Goldner (MGT).
- Imagem dos cortes com microscópio scanner de lâmina em aumento de 40x (4 explantes de 2 animais neste estudo).
- Usando o software ImageJ, avalie visualmente a infiltração celular (coloração H&E) e a deposição de colágeno (coloração MGT).
Resultados
Medida do tamanho dos poros, distribuição celular e mineralização in vitro (Figura 1 e Figura 2)
A remoção completa dos componentes celulares nativos dos scaffolds de tecido macieira foi obtida após o tratamento dos scaffolds com SDS e CaCl2 (Figura 1A). Os scaffolds exibiam uma estrutura altamente porosa, o que foi confirmado por microscopia confocal. A quantificação das imagens demonstrou um tamanho médio de poros de 154 μm ± 40 μm. A distribuição do tamanho dos poros variou entre 73 μm e 288 μm. Entretanto, a maioria dos poros variou entre 100 μm e 200 μm (Figura 1C).
Após um período de cultivo de 4 semanas em meio de diferenciação, os arcabouços de sementes celulares exibiram depósitos minerais brancos generalizados (Figura 1A). Os scaffolds contendo células apresentaram coloração branca opaca, sugerindo mineralização, o que não foi observado nos scaffolds em branco (scaffolds sem células semeadas). Além disso, a análise por microscopia confocal de varredura a laser revelou uma distribuição celular homogênea dentro dos scaffolds (Figura 1B).
Scaffolds semeados ou não com células foram corados com BCIP/NBT e ARS para análise da atividade e mineralização da ALP, respectivamente (Figura 1D). A coloração BCIP/NBT revelou um aumento substancial na atividade da ALP (representada por uma forte cor roxa) dentro dos scaffolds de sementes celulares cultivados em meio de diferenciação, em contraste com os scaffolds em branco ou os scaffolds de sementes de células cultivados em meio de não diferenciação. Da mesma forma, os scaffolds com sementes celulares cultivados em meio de diferenciação exibiram uma coloração vermelha mais intensa ao serem corados com ARS, indicando maior mineralização em comparação com os scaffolds em branco ou os scaffolds com sementes de células cultivados em meio sem diferenciação. Observou-se coloração de fundo nos scaffolds em branco, potencialmente devido à presença de CaCl2 no protocolo de decelularização.
Colorações (H&E e VK) foram realizadas nos scaffolds para analisar a infiltração e mineralização celular, e MEV e EDS foram usados para avaliar a mineralização (Figura 2). A coloração H&E (Figura 2A) mostrou boa infiltração celular nos scaffolds de sementes celulares cultivados em meio de não diferenciação ou diferenciação. Múltiplos núcleos eram visíveis na periferia e ao longo dos scaffolds. A presença de colágeno também foi observada nos scaffolds em rosa pálido. Além disso, a coloração VK realizada nos scaffolds após 4 semanas de cultura em meio de diferenciação revelou que as paredes dos poros foram coradas, enquanto depósitos de cálcio foram detectados apenas ao longo das bordas externas das paredes dos poros nos scaffolds cultivados em meio não diferenciacional e podem ter resultado da absorção de cálcio durante o tratamento de decelularização. Mineralização localizada na superfície dos arcabouços de sementes celulares cultivados em meio de diferenciação por 4 semanas foi observada por análise de MEV (Figura 2B). Mais especificamente, depósitos minerais semelhantes a agregados esferoides foram observados na periferia dos poros. Em contraste, não foram observados agregados minerais nos scaffolds em branco ou nos scaffolds com sementes de células cultivados por 4 semanas em meio sem diferenciação. Picos característicos distintos correspondentes a fósforo (P) e cálcio (Ca) foram observados nos espectros EDS das regiões de interesse selecionadas, especificamente nos depósitos minerais observados nos scaffolds de células-sementes cultivados por 4 semanas em meio de diferenciação (Figura 2B).
Análise biomecânica in vitro (Figura 3)
O módulo de elasticidade dos scaffolds célula-semente foi medido após 4 semanas de cultivo em meio de não diferenciação ou diferenciação (n = 3 para cada condição experimental). Foi comparado com o módulo de Young dos scaffolds em branco (scaffolds sem células semeadas) (Figura 3). Não foi observada diferença significativa no módulo entre os scaffolds em branco (31,6 kPa ± 4,8 kPa) e os scaffolds com sementes celulares cultivados em meio de não diferenciação (24,1 kPa ± 8,8 kPa; p = 0,88). Em contraste, observou-se diferença significativa entre o módulo dos scaffolds em branco (31,6 kPa ± 4,8 kPa) e o dos scaffolds com sementes celulares cultivados em meio de diferenciação (192,0 kPa ± 16,6 kPa; p < 0,001). Adicionalmente, uma diferença significativa (p < 0,001) foi observada entre os módulos de Young dos scaffolds de sementes celulares cultivados em meios de não diferenciação e diferenciação. A Figura 1 suplementar mostra uma curva tensão e deformação típica para o cálculo do módulo de elasticidade.
Desempenho biomecânico e regeneração óssea in vivo (Figura 4 e Figura 5)
Craniotomias cirúrgicas foram realizadas em um total de 6 ratos Sprague-Dawley. Defeitos bilaterais de 5 mm de diâmetro foram criados em ambos os ossos parietais do crânio usando uma broca de trefina, e scaffolds de celulose derivados de maçã sem células semeadas foram implantados nos defeitos da calota craniana (Figura 4A). Após 8 semanas de implantação, os animais foram eutanasiados e a parte superior do crânio foi coletada e processada para testes mecânicos ou histológicos.
Com base na avaliação visual, os scaffolds pareciam bem integrados nos tecidos circundantes ao crânio. Testes mecânicos de push-out foram realizados para avaliar quantitativamente a integração dos scaffolds (n = 7) na calvária hospedeira. As medidas foram realizadas com aparelho de compressão uniaxial (Figura 4B) imediatamente após a eutanásia dos animais. Os resultados revelaram que o pico de força foi de 113,6 N ± 18,2 N (Tabela 1).
A análise histológica foi realizada para avaliar a infiltração celular e a deposição de matriz extracelular no interior dos scaffolds implantados (Figura 5). A coloração de H&E revelou infiltração celular nos poros do arcabouço e evidência de vascularização, como demonstrado pela presença de vasos sanguíneos no interior dos scaffolds. Além disso, a coloração com MGT demonstrou a presença de colágeno no interior dos scaffolds.
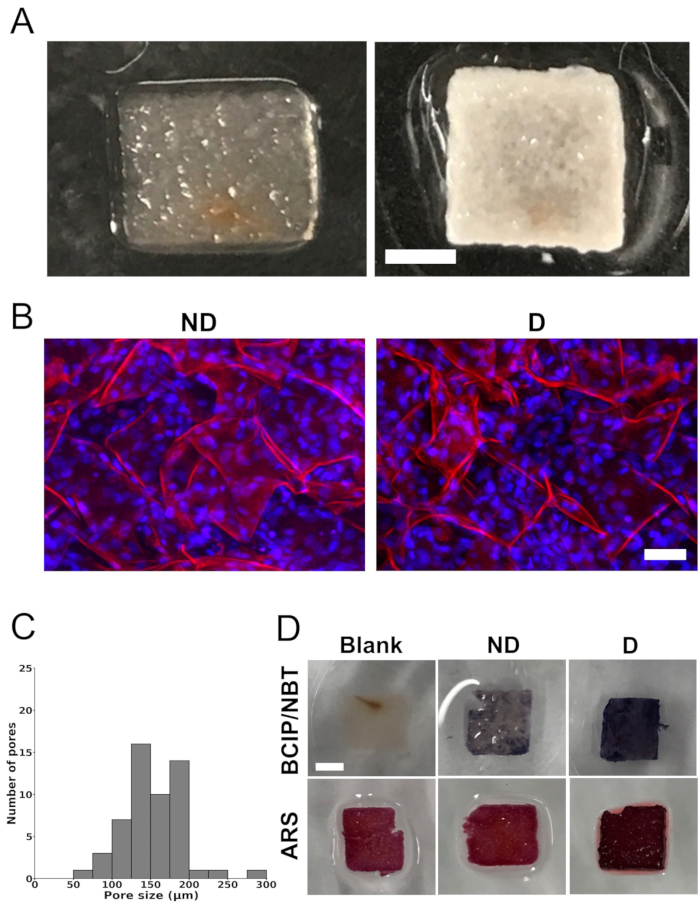
Figura 1: Imagens de andaimes, distribuição do tamanho dos poros e mineralização in vitro . (A) Fotografias representativas de um arcabouço de celulose derivado de maçã após a remoção das células nativas e do surfactante (esquerda) e de um arcabouço semeado com células MC3T3-E1 após 4 semanas de cultura em meio de diferenciação osteogênica (direita). A barra de escala representa 2 mm. (B) Imagens representativas de microscópio confocal de varredura a laser mostrando células semeadas em scaffolds de celulose derivados de maçã após 4 semanas de cultura em meio de não diferenciação ("ND") ou meio de diferenciação osteogênica ("D"). A barra de escala representa 50 μm. A coloração foi realizada nos scaffolds para celulose (vermelho) com iodeto de propídio e para núcleos celulares (azul) com DAPI. (C) Distribuição do tamanho dos poros de scaffolds de celulose derivados de maçã decelularizados, antes de serem semeados com células MC3T3-E1, a partir de projeções máximas no eixo z das imagens confocais. A análise foi realizada em um total de 54 poros em 3 scaffolds diferentes (6 poros em 3 regiões de interesse selecionadas aleatoriamente por scaffold). (D) Imagens representativas de arcabouços corados com 5-bromo-4-cloro-3'-indolifosfato e nitro-azul tetrazólio (BCIP/NBT) para avaliar a atividade da fosfatase alcalina (FA) e com vermelho de alizarina S (ARS) para visualizar a deposição de cálcio, indicando mineralização (barra de escala = 2 mm - aplica-se a todos). Os scaffolds marcados como "blank" (scaffolds sem células semeadas) não apresentaram coloração com BCIP/NBT, indicando ausência de atividade da ALP. Por outro lado, os scaffolds com sementes celulares cultivados em meio de diferenciação ("D") apresentaram maior atividade de ALP, indicada por uma coloração azul mais intensa, em comparação com os scaffolds com sementes de células cultivados em meio de não diferenciação ("ND"). Para a coloração ARS, tanto os scaffolds em branco quanto os scaffolds cultivados em meio de não-diferenciação ("ND") exibiram um tom de vermelho mais claro em comparação com os scaffolds cultivados em meio de diferenciação ("D"). A presença de deposição de cálcio nos scaffolds cultivados em meio de diferenciação ("D") foi ilustrada por uma intensa coloração vermelha profunda. Cada análise foi realizada em três scaffolds diferentes (n = 3). Essa figura foi adaptada com permissão de Leblanc Latour (2023)27. Clique aqui para ver uma versão maior desta figura.

Figura 2: Análise histológica, microscopia eletrônica de varredura (MEV) e espectroscopia de energia dispersiva (EDS) de arcabouços in vitro . (A) Imagens representativas dos cortes transversais histológicos superiores dos scaffolds. Os scaffolds embebidos em parafina foram fatiados em cortes de 5 μm de espessura que foram corados com hematoxilina e eosina (H&E) para visualizar a infiltração celular, ou com von Kossa (VK) para visualizar a mineralização dentro dos scaffolds. Os scaffolds foram infiltrados com células MC3T3-E1, como mostrado pelas colorações azul (núcleos) e rosa (citoplasma) visíveis na periferia e em todo o scaffolds. O colágeno (rosa pálido) também era visível (inset ampliado de "H&E - D"). A mineralização foi observada apenas na periferia das paredes dos poros nos scaffolds cultivados em meio de não-diferenciação ("ND"). As paredes dos poros dos scaffolds cultivados em meio de diferenciação ("D") foram inteiramente coradas de preto. A análise foi realizada em um scaffold cultivado em meio de não diferenciação ("ND") e em dois scaffolds cultivados em meio de diferenciação ("D") (Scale bar para as fotos de menor magnificação = 1 mm, scale bar para as fotos de maior magnificação = 50 μm). (B) Micrografias representativas obtidas por MEV, bem como espectros EDS. Os scaffolds foram submetidos a revestimento por pulverização com ouro e imageados em microscópio eletrônico de varredura por emissão de campo a uma tensão de 3,0 kV (barra de escala = 100 μm - aplica-se a todos). Espectros de EDS foram adquiridos em cada scaffold. Picos de fósforo (2,013 keV) e cálcio (3,69 keV) são indicados em cada espectro da EDS. Tanto a MEV quanto a SDE foram realizadas em três scaffolds diferentes. Em branco: andaimes sem células semeadas. Essa figura foi adaptada com permissão de Leblanc Latour (2023)27. Clique aqui para ver uma versão maior desta figura.

Figura 3: Módulos de Young de scaffolds in vitro após 4 semanas de cultura em meio de não diferenciação ("ND") ou meio de diferenciação ("D"). Os dados são apresentados como média ± erro padrão da média (EPM) de três amostras replicadas para cada condição. A significância estatística (* indica p<0,05) foi determinada por meio da análise de variância (ANOVA) one-way e do teste post-hoc de Tukey. Em branco: andaimes sem células semeadas. Essa figura foi adaptada com permissão de Leblanc Latour (2023)27. Clique aqui para ver uma versão maior desta figura.

Figura 4: Fotografia do andaime antes do implante e teste de push-out após 8 semanas do implante: (A) Fotografia representativa de um andaime antes do implante; (B) Dispositivo de compressão uniaxial utilizado para os ensaios de push-out, com a célula de carga indicada por um asterisco (*) e a amostra indicada por uma seta. Essa figura foi adaptada com permissão de Leblanc Latour (2023)27. Clique aqui para ver uma versão maior desta figura.

Figura 5: Análise histológica dos arcabouços in vitro . Imagens representativas de cortes histológicos de arcabouços não semeados após 8 semanas de implantação. Os cortes foram corados com hematoxilina e eosina (H&E) para visualização das células ou tricrômico de Masson-Goldner (MGT) para visualização do colágeno. A seta indica glóbulos vermelhos. A presença de colágeno é visível (barra de escala = 1 mm e 200 μm para as inserções esquerda e direita, respectivamente). Essa figura foi adaptada com permissão de Leblanc Latour (2023)27. Clique aqui para ver uma versão maior desta figura.
| Número da amostra | Pico de força (N) |
| 1 | 92.8 |
| 2 | 162.7 |
| 3 | 140.3 |
| 4 | 135.7 |
| 5 | 37.7 |
| 6 | 157.8 |
| 7 | 67.9 |
| Significar | 113.6 |
| MEV | 18.2 |
Tabela 1: Pico de força medido a partir de testes de push-out.
Figura suplementar 1: Curva tensão-deformação típica para cálculo do módulo de elasticidade. Clique aqui para baixar este arquivo.
Discussão
Vários estudos in vitro e in vivo têm demonstrado a biocompatibilidade da celulose vegetal e seu potencial uso na engenharia tecidual 14,15,16,18,19,20, mais especificamente para hospedar a diferenciação osteogênica 20,21. Os objetivos do presente estudo foram investigar o potencial de scaffolds de celulose derivados de maçã para BTE e avaliar as propriedades mecânicas desses scaffolds in vitro e in vivo.
Para os estudos in vitro, células pré-osteoblásticas (MC3T3-E1) foram semeadas nos scaffolds após a eliminação das células nativas do tecido macieiro. As células MC3T3-E1 são comumente utilizadas para investigar a biomineralização da matriz extracelular28,29,30. Os scaffolds foram então cultivados por 4 semanas em meio de diferenciação osteogênica ou não. Os achados indicaram que as células proliferaram e sofreram diferenciação dentro dos scaffolds, especialmente quando cultivadas em meio de diferenciação, evidenciando o potencial dos scaffolds de celulose derivados de maçãs para apoiar o desenvolvimento do tecido ósseo. Núcleos celulares foram observados em grande número nos poros do arcabouço, corroborando observações relatadas em estudos anteriores 14,15,16,17,20,21. Além disso, semelhante aos nossos achados anteriores14 e de outro grupo21, o diâmetro médio dos poros do andaime foi de ~154 μm, com a maioria dos poros com diâmetros entre 100 μm e 200 μm (Figura 1C). Essas dimensões estão de acordo com a faixa ideal de tamanho de poro (100-200 μm) conhecida por facilitar o crescimento ósseo7.
A análise de coloração mostrou maior atividade da ALP após um período de 4 semanas de cultura em meio de diferenciação. Mais depósitos de cálcio foram observados na superfície dos scaffolds células-sementes cultivados em meio de diferenciação em comparação com os scaffolds em branco e os scaffolds células-sementes cultivados em meio de não-diferenciação. Resultados semelhantes foram observados com hiPSCs diferenciadas em scaffolds derivados de maçãs21. Embora a presença de FA tenha sido avaliada qualitativamente no presente estudo, ensaios adicionais puderam ser realizados para uma análise quantitativa. A avaliação histológica dos scaffolds confirmou ainda que os osteoblastos infiltrados mineralizaram os scaffolds após a diferenciação. Notadamente, a periferia dos construtos cultivados em meio de não diferenciação também foi corada com VK. CaCl2 residual nos scaffolds pode ter causado essa coloração inespecífica observada na periferia pós-decelularização. Uma análise qualitativa das imagens de MEV foi realizada para avaliar a mineralização. Após cultivo em meio de diferenciação, scaffolds com sementes celulares exibiram sinais de mineralização da MEC. Agregados minerais foram visíveis na superfície do andaime, especificamente nas bordas dos poros. Essas observações são consistentes com estudos anteriores utilizando ECM30 e scaffolds derivados de plantas21. Esses agregados estavam ausentes na superfície dos arcabouços sem células semeadas. A análise EDS dos agregados revelou a presença de altos teores de P e Ca, sugerindo a presença de apatita. Vale ressaltar que, embora o protocolo descrito no presente estudo permita visualizar a infiltração celular e a presença de mineralização, não permite avaliar sua progressão ao longo do tempo. A análise histológica em múltiplos momentos seria necessária para avaliar completamente essa progressão. Além disso, análises adicionais seriam necessárias para quantificar a infiltração celular e a mineralização na superfície, bem como em todo o arcabouço. Finalmente, enquanto a composição elementar dos depósitos minerais foi determinada por EDS, outras técnicas de caracterização, como a difração de raios X (DRX), podem ser necessárias para fornecer informações sobre a estrutura cristalina dos depósitos observados.
O módulo de elasticidade dos scaffolds foi significativamente maior após o cultivo em meio de diferenciação (aproximadamente 8 vezes). Em contraste, o módulo dos scaffolds cultivados em meio de não diferenciação assemelhava-se ao dos scaffolds em branco (scaffolds sem células semeadas), semelhante aos achados relatados em estudo anterior com scaffolds derivados de maçãs20. Apesar do módulo de Young maior dos scaffolds cultivados em meio de diferenciação, ele permaneceu muito inferior ao do osso natural (0,1 a 2 GPa para o osso trabecular e 15 a 20 GPa para o osso cortical)8, aloenxerto esponjoso (3,78 GPa)31, enxertos aloplásticos feitos de poliéter-éter-cetona (3,84 GPa)31, titânio (50,20 GPa)31 e liga de cobalto-cromo (53,15 GPa)31 Implantes. Portanto, os andaimes em sua formulação atual podem não ser adequados para aplicações de suporte de carga. Vale ressaltar que o módulo de Young fornece informações sobre a rigidez de um material. No entanto, a resistência ao escoamento também pode ser considerada para fornecer uma compreensão mais ampla das propriedades mecânicas do andaime.
Scaffolds de maçã descelularizados foram então implantados em defeitos de calvária de tamanho crítico bilaterais de 5 mm em ratos (n = 6 animais). Testes de push-out (em 7 explantes), realizados para avaliar a integração dos scaffolds dentro da calvária do hospedeiro, indicaram que a força de pico média foi de 113,6 N ± 18,2 N, o que é semelhante à carga de fratura previamente relatada para o osso da calota craniana (127,1 ± 9,6 N)22, sugerindo que os scaffolds se integraram bem no tecido ósseo circundante. Deve-se, no entanto, notar que o teste de push-out apenas fornece informações sobre a interface entre o andaime e o tecido circundante. Estudos anteriores combinaram testes push-out com ensaios de indentação para fornecer uma compreensão mais ampla das propriedades mecânicas da interface osso-implante e do próprio arcabouço22. Além disso, defeitos bilaterais são mais propensos ao desalinhamento com o êmbolo32. O posicionamento adequado do explante craniano, modelo de defeito único ou sistema de pinçamento adicional no dispositivo universal de teste poderia potencialmente evitar o desalinhamento32.
Em resumo, este estudo confirmou que scaffolds de celulose derivados de maçã podem promover adesão e proliferação pré-osteoblastos. Além disso, a mineralização ocorreu dentro dos scaffolds de sementes celulares cultivados em meio de diferenciação, levando a um aumento no módulo de Young do arcabouço. No entanto, o módulo permaneceu significativamente menor que o do osso natural. Curiosamente, a força necessária para deslocar os scaffolds de celulose derivados de maçã implantados foi comparável à carga de fratura do osso da calota craniana e outros tipos de scaffolds usados anteriormente para BTE22. Finalmente, à semelhança dos resultados ilustrados em relatos anteriores, as células infiltraram os scaffolds implantados e depositaram colágeno. De modo geral, este estudo demonstra o potencial de scaffolds de celulose derivados de plantas para aplicações em BTE. Esses achados estão de acordo com estudo anterior realizado por outro grupo de pesquisa, comprovando ainda mais a adequação de arcabouços de celulose de origem vegetal para fins de BTE21. No entanto, a disparidade na rigidez dos scaffolds em comparação com o osso trabecular ou cortical destaca a importância do desenvolvimento de biomateriais compósitos que possam se aproximar mais das propriedades mecânicas do osso natural. Portanto, apesar do crescente interesse na utilização de arcabouços derivados de plantas para fins de BTE, seu uso pode permanecer limitado a aplicações sem suporte de carga. Como demonstramos anteriormente16, a reengenharia de scaffolds de celulose derivados de plantas por meio de modificação química ou desenvolvimento de compósitos com outros polímeros biológicos/sintéticos pode ser essencial para aplicações de suporte de carga.
Divulgações
Declaração de conflito de interesses: M.L.L, M.T. R.J.H., C.M.C., I.C. e A.P. são inventores de pedidos de patente depositados pela Universidade de Ottawa e pela Spiderwort Inc., relativos ao uso de celulose derivada de plantas para aplicações de BTE. M.L.L., R.J.H., C.M.C. e A.P. têm interesses financeiros na Spiderwort Inc.
Agradecimentos
O financiamento para este projeto foi fornecido pelo Conselho de Pesquisa em Ciências Naturais e Engenharia do Canadá (NSERC) (Discovery Grant) e pela Fundação Li Ka Shing. M.L.L. recebeu apoio do programa Ontario Centers of Excellence TalentEdge, e R.J.H. foi apoiado por uma bolsa de pós-graduação NSERC e uma Ontario Graduate Scholarship (OGS).
Materiais
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | ThermoFisher | D1306 | DAPI |
| Alizarin red S | Sigma-Aldrich | A5533 | ARS |
| Ascorbic acid | Sigma-Aldrich | A4403 | Cell Culture |
| Calcium Chloride | ThermoFisher | AA12316 | CaCl2 |
| Calcofluor White | Sigma-Aldrich | 18909 | |
| Dental drill | Surgical tool | ||
| Ethanol | ThermoFisher | 615095000 | |
| Fetal bovine serum | Hyclone Laboratories | SH30396 | FBS |
| Formalin | Sigma-Aldrich | HT501128 | 10% Formalin |
| Goldner's trichrome stain | Sigma-Aldrich | 1.00485 | GTC |
| Hematoxylin and eosin stain | Fisher Scientific | NC1470670 | H&E |
| High-speed resonant confocal laser scanning microscope | Nikon | Nikon Ti-E A1-R | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| ImageJ software | National Institutes of Health | ||
| Irrigation saline | Baxter | JF7123 | 0.9% NaCl |
| MC3T3-E1 Subclone 4 cells | ATCC | CRL-2593 | Pre-osteoblast cells |
| McIntosh apples | Canada Fancy grade | ||
| Methyl methacrylate | Sigma-Aldrich | M55909 | Histological embedding |
| Minimum Essential Medium | ThermoFisher | M0894 | α-MEM |
| Paraformaldehyde | Fisher Scientific | O4042 | 4%; PFA |
| Penicillin/Streptomycin | Hyclone Laboratories | SV30010 | Cell Culture |
| Periodic acid | Sigma-Aldrich | 375810 | |
| Phosphate buffered saline | Hyclone Laboratories | 2810305 | PBS; without Ca2+ and Mg2+ |
| Propidium iodide | Invitrogen | p3566 | |
| Scanning electron microscope | JEOL | JSM-7500F FESEM | SEM and EDS |
| Slide scanner microscope | Zeiss | AXIOVERT 40 CFL | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166 | SDS |
| Sodium metabisulphite | Sigma-Aldrich | 31448 | |
| Sodium phosphate | ThermoFisher | BP329 | |
| Sprague-Dawley rats | Charles-River Laboratories | 400 | Male |
| Sutures | Ethicon | J494G | 4-0 |
| Trephine | ACE Surgical Supply Co | 583-0182 | 5-mm diameter |
| Triton-X 100 | ThermoFisher | 807423 | |
| Trypsin | Hyclone Laboratories | SH30236.02 | Cell Culture |
| Tween | Fisher Scientific | BP337 | |
| Universal compression Device | CellScale | UniVert | |
| Von Kossa stain | Sigma-Aldrich | 1.00362 | Histology |
Referências
- Schmitz, J. P., Hollinger, J. O. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clinical Orthopaedics and Related Research. 205, 299-308 (1986).
- Yu, X., Tang, X., Gohil, S. V., Laurencin, C. T. Biomaterials for bone regenerative engineering. Advanced Healthcare Materials. 4 (9), 1268-1285 (2015).
- Parikh, S. N. Bone graft substitutes: Past, present, future. Journal of Postgraduate Medicine. 48 (2), 142-148 (2002).
- Silber, J. S., et al. Donor site morbidity after anterior iliac crest bone harvest for single-level anterior cervical discectomy and fusion. Spine (Phila Pa 1976). 28 (2), 134-139 (2003).
- Amini, A. R., Laurencin, C. T., Nukavarapu, S. P. Bone tissue engineering: recent advances and challenges. Critical Reviews in Biomedical Engineering. 40 (5), 363-408 (2012).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. Journal of Biomechanical Engineering. 122 (6), 570-575 (2000).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Bose, S., Roy, M., Bandyopadhyay, A. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnology. 30 (10), 546-554 (2012).
- Yoshikawa, H., Myoui, A. Bone tissue engineering with porous hydroxyapatite ceramics. Journal of Artificial Organs. 8 (3), 131-136 (2005).
- Fu, Q., Saiz, E., Rahaman, M. N., Tomsia, A. P. Bioactive glass scaffolds for bone tissue engineering: state of the art and future perspectives. Materials Science & Engineering. C, Materials for Biological Applications. 31 (7), 1245-1256 (2011).
- Xynos, I. D., Edgar, A. J., Buttery, L. D. K., Hench, L. L., Polak, J. M. Ionic products of bioactive glass dissolution increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochemical and Biophysical Research Communications. 276 (2), 461-465 (2000).
- Kroeze, R., Helder, M., Govaert, L., Smit, T. Biodegradable polymers in bone tissue engineering. Materials. 2 (3), 833-856 (2009).
- Venkatesan, J., Vinodhini, P. A., Sudha, P. N. Chitin and chitosan composites for bone tissue regeneration. Advances in Food and Nutrition Research. 73, 59-81 (2014).
- Modulevsky, D. J., Lefebvre, C., Haase, K., Al-Rekabi, Z., Pelling, A. E. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS One. 9 (5), e97835(2014).
- Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Biocompatibility of subcutaneously implanted plant-derived cellulose biomaterials. PLoS One. 11 (6), e0157894(2016).
- Hickey, R. J., Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Customizing the shape and microenvironment biochemistry of biocompatible macroscopic plant-derived cellulose scaffolds. ACS Biomaterials Science & Engineering. 4 (11), 3726-3736 (2018).
- Hickey, R. J., Leblanc Latour, M., Harden, J. L., Pelling, A. E. Designer scaffolds for interfacial bioengineering. Advanced Engineering Materials. 25, 2201415(2023).
- Fontana, G., et al. Biofunctionalized plants as diverse biomaterials for human cell culture. Advanced Healthcare Materials. 6 (8), 1601225(2017).
- Gershlak, J. R., et al. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials. 125, 13-22 (2017).
- Leblanc Latour, M., Pelling, A. E. Mechanosensitive osteogenesis on native cellulose scaffolds for bone tissue engineering. Journal of Biomechanics. 135, 111030(2022).
- Lee, J., Jung, H., Park, N., Park, S. H., Ju, J. H. Induced osteogenesis in plants decellularized scaffolds. Scientific Reports. 9 (1), 20194(2019).
- Zhao, J., et al. Enhanced healing of rat calvarial defects with sulfated chitosan-coated calcium-deficient hydroxyapatite/bone morphogenetic protein 2 scaffolds. Tissue Engineering. Part A. 18 (1-2), 185-197 (2012).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. In: Modern Electron Microscopy in Physical and Life Sciences. , 161-186 (2016).
- tousimis Critical Point Dryers - Samdri®-PVT-3D. , https://tousimis.com/critical_point_dryers/detail.html?Pid=8755B (2022).
- Leica EM ACE200 Vacuum Coater. , https://www.leica-microsystems.com/products/sample-preparation-for-electron-microscopy/p/leica-em-ace200/ (2023).
- Spicer, P. P. Evaluation of bone regeneration using the rat critical size calvarial defect. Nature Protocols. 7 (10), 1918-1929 (2012).
- Leblanc Latour, M. Cellulose biomaterials for bone tissue engineering [dissertation]. , Department of Physics, Faculty of Science, University of Ottawa, Ottawa, Canada. (2023).
- Kodama, H. -A., Amagai, Y., Sudo, H., Kasai, S., Yamamoto, S. Establishment of a clonal osteogenic cell line from newborn mouse calvaria. Japanese Journal of Oral Biology. 23 (4), 899-901 (1981).
- Wang, D., et al. Isolation and characterization of MC3T3-E1 preosteoblast subclones with distinct in vitro and in vivo differentiation/mineralization potential. Journal of Bone and Mineral Research. 14 (6), 893-903 (1999).
- Addison, W. N., et al. Extracellular matrix mineralization in murine MC3T3-E1 osteoblast cultures: An ultrastructural, compositional and comparative analysis with mouse bone. Bone. 71, 244-256 (2015).
- Heary, R. F., Parvathreddy, N., Sampath, S., Agarwal, N. Elastic modulus in the selection of interbody implants. Journal of Spine Surgery. 3 (2), 163-167 (2017).
- Lawson, Z. T., et al. Methodology for performing biomechanical push-out tests for evaluating the osseointegration of calvarial defect repair in small animal models. MethodsX. 8, 101541(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados