Method Article
פיגומים תפוחים שמקורם בתאים להנדסת רקמות עצם במבחנה וב-Vivo
In This Article
Summary
במחקר זה אנו מפרטים שיטות של דה-צלולריזציה, אפיון פיזיקלי, הדמיה והשתלת in vivo של ביו-חומרים צמחיים, כמו גם שיטות לזריעה והתמיינות של תאים בפיגומים. השיטות המתוארות מאפשרות הערכה של ביו-חומרים מבוססי צמחים עבור יישומי הנדסת רקמת עצם.
Abstract
ביו-חומרים של תאית שמקורם בצמחים שימשו ביישומים שונים של הנדסת רקמות. מחקרי In vivo הראו תאימות ביולוגית יוצאת דופן של פיגומים העשויים מתאית שמקורה במקורות טבעיים. בנוסף, פיגומים אלה הם בעלי מאפיינים מבניים הרלוונטיים לרקמות מרובות, והם מקדמים פלישה והתרבות של תאי יונקים. מחקר שנערך לאחרונה באמצעות רקמת hypanthium תפוח decellularized הוכיח את הדמיון של גודל הנקבוביות שלה לזה של עצם trabecular, כמו גם את היכולת שלה לתמוך ביעילות התמיינות אוסטאוגנית. המחקר הנוכחי המשיך ובחן את הפוטנציאל של פיגומי תאית שמקורם בתפוח עבור יישומי הנדסת רקמת עצם (BTE) והעריך את התכונות המכניות שלהם in vitro ו - in vivo . פראוסטאובלסטים MC3T3-E1 נזרעו בפיגומי תאית שמקורם בתפוח, ולאחר מכן הוערכו על הפוטנציאל האוסטאוגני והתכונות המכניות שלהם. פוספטאז אלקליין וצביעת S אדומה אליזרין אישרו התמיינות אוסטאוגנית בפיגומים שגודלו בתרבית בתווך התמיינות. בדיקה היסטולוגית הדגימה פלישה נרחבת של תאים ומינרליזציה על פני הפיגומים. מיקרוסקופ אלקטרונים סורק (SEM) חשף אגרגטים מינרליים על פני הפיגומים, וספקטרוסקופיה מפזרת אנרגיה (EDS) אישרה את נוכחותם של יסודות פוספט וסידן. עם זאת, למרות עלייה משמעותית במודולוס של יאנג בעקבות התמיינות תאים, הוא נשאר נמוך מזה של רקמת עצם בריאה. מחקרי In vivo הראו חדירה ושקיעה של מטריצה חוץ-תאית בתוך פיגומים תפוחים שעברו דה-צלולריזציה לאחר 8 שבועות של השתלה בקלבריה של חולדה. בנוסף, הכוח שנדרש כדי להסיר את הפיגומים מפגם העצם היה דומה לעומס השבר שדווח בעבר של עצם קלווריאלית טבעית. בסך הכל, מחקר זה מאשר כי תאית שמקורה בתפוחים היא מועמדת מבטיחה ליישומי BTE. עם זאת, ההבדל בין התכונות המכניות שלו לבין אלה של רקמת עצם בריאה עשוי להגביל את היישום שלו לתרחישים נושאי עומס נמוך. ייתכן שיהיה צורך בהנדסה מחדש מבנית נוספת ואופטימיזציה כדי לשפר את התכונות המכניות של פיגומי תאית שמקורם בתפוח עבור יישומים נושאי עומס.
Introduction
פגמים גדולים בעצמות הנגרמים על ידי פציעה או מחלה דורשים לעתים קרובות שתלים ביו-חומריים להתחדשות מלאה1. טכניקות עכשוויות שנועדו לשפר את התחדשות רקמת העצם משתמשות באופן קבוע בשתלים אוטולוגיים, אלוגניים, קסנוגניים או סינתטיים2. עבור השתלת עצם אוטולוגית, הנחשבת לשיטת ההשתלה "תקן הזהב" לתיקון פגמים גדולים בעצם, מופקת העצם מהמטופל. עם זאת, להליך השתלה זה מספר חסרונות, ביניהם מגבלות גודל וצורה, זמינות רקמות ותחלואה באתר הדגימה3. יתר על כן, הליכי השתלה אוטולוגיים רגישים לזיהומים באתר הניתוח, שברים עוקבים, היווצרות המטומה באתר הדגימה או המשוחזר, וכאב לאחר הניתוח4. הנדסת רקמת עצם (BTE) מציעה חלופה פוטנציאלית לשיטות השתלת עצם קונבנציונליות5. הוא משלב ביו-חומרים מבניים ותאים כדי לבנות רקמת עצם פונקציונלית חדשה. בעת תכנון ביו-חומרים עבור BTE, חיוני לשלב מבנה מקרו-נקבובי, כימיה של פני השטח המקדמת התקשרות של תאים, ותכונות מכניות הדומות מאוד לאלה של עצם טבעית6. מחקרים קודמים הצביעו על כך שגודל הנקבוביות האידיאלי והמודולוס האלסטי עבור ביו-חומרים המשמשים ב-BTE הם בערך 100-200 מיקרומטר7 ו-0.1-20 GPa, בהתאמה, בהתאם לאתר ההשתלה8. חוץ מזה, הנקבוביות והקישוריות הנקבובית של הפיגומים הם גורמים קריטיים המשפיעים על נדידת תאים, דיפוזיה של חומרי מזון ואנגיוגנזה8.
BTE הראה תוצאות מבטיחות עם ביו-חומרים שונים שפותחו והוערכו כאפשרויות חלופיות להשתלות עצם. חלק מהביו-חומרים הללו הם חומרים אוסטאואינדוקטיביים, חומרים היברידיים והידרוג'לים מתקדמים8. חומרים אוסטאואינדוקטיביים מעוררים את התפתחותם של מבני עצם שזה עתה נוצרו. חומרים היברידיים מורכבים מפולימרים סינתטיים ו/או טבעיים8. הידרוג'לים מתקדמים מחקים את המטריצה החוץ תאית (ECM) ומסוגלים לספק את הגורמים הביו-אקטיביים הדרושים לקידום אינטגרציה של רקמת עצם8. הידרוקסיאפטיט הוא חומר מסורתי ובחירה נפוצה עבור BTE בשל הרכבו ותאימות ביולוגית9. זכוכית ביו-אקטיבית היא סוג נוסף של חומר ביולוגי עבור BTE, אשר הוכח כמעורר תגובות תאים ספציפיות להפעלת גנים הדרושים לאוסטאוגנזה10,11. פולימרים מתכלים, כולל פולי (חומצה גליקולית) ופולי(חומצה לקטית), נמצאים גם הם בשימוש נרחב ביישומי BTE12. לבסוף, פולימרים טבעיים או טבעיים כמו צ'יטוזן, כיטין ותאית חיידקית הדגימו גם הם תוצאות מעודדות עבור BTE13. עם זאת, בעוד פולימרים סינתטיים וטבעיים כאחד מראים פוטנציאל עבור BTE, פיתוח פיגום פונקציונלי עם מבנה המאקרו הרצוי בדרך כלל דורש פרוטוקולים נרחבים.
לעומת זאת, מבני תאית מקרוסקופיים מקומיים יכולים להיגזר בקלות מצמחים מגוונים וקבוצת המחקר שלנו הדגימה בעבר את הישימות של פיגומים מבוססי תאית שמקורם בצמחים לשחזורי רקמות שונים. ואכן, לאחר טיפול פשוט של חומרים פעילי שטח, רתמנו את המבנה האינהרנטי של החומר הצמחי, תוך הדגשת הפוטנציאל שלו כחומר ביולוגי רב-תכליתי14. יתר על כן, פיגומים מבוססי תאית אלה יכולים לשמש ליישומי תרבית תאי יונקים במבחנה 14, הם תואמים ביולוגית, ותומכים בכלי דם תת-עוריים ספונטניים 14,15,16,17. הן קבוצת המחקר שלנו והן אחרות הוכיחו כי ניתן להשיג פיגומים אלה מצמחים ספציפיים בהתבסס על היישום המיועד 14,15,16,17,18,19,20. לדוגמה, מבנה כלי הדם שנצפה בגבעולים ובעלים של צמחים מציג דמיון בולט למבנה שנמצא ברקמות בעלי חיים19. בנוסף, פיגומי תאית שמקורם בצמחים יכולים להיות מעוצבים בקלות ונתונים לשינויים ביוכימיים על פני השטח כדי להשיג את המאפיינים הרצויים16. במחקר שנערך לאחרונה, שילבנו חיץ מלח במהלך תהליך הדה-צלולריזציה, מה שהוביל לחיבור תאים משופר שנצפה הן במבחנה והן ב-vivo 16. באותו מחקר הדגמנו את הישימות של פיגומי תאית ממקור צמחי בביו-חומרים מרוכבים על ידי יציקת הידרוג'לים על פני השטח של הפיגומים. במחקרים שנערכו לאחרונה, הפונקציונליות של פיגומים שמקורם בצמחים הוכחה כמשפרת את יעילותם18. לדוגמה, מחקר שנערך על ידי Fontana et al. (2017) גילה כי הידבקות של פיברובלסטים עוריים אנושיים נתמכה על ידי גבעולים decellularized מצופים RGD, בעוד גבעולים שאינם מצופים לא הציגו את אותה יכולת18. יתר על כן, המחברים גם הראו כי נוזל גוף מדומה שונה יכול לשמש מינרליזציה מלאכותית של גבעולי צמחים decellularized. במחקרים עדכניים יותר, בחנו את הרעיון של אוסטאוגנזה רגישה למכנוב בפיגומי תאית ממקור צמחי והערכנו את הפוטנציאל שלהם עבור BTE17,20. יתר על כן, Lee et al. (2019) השתמשו בפיגומים שמקורם בצמחים כדי לטפח רקמות דמויות עצם בסביבה חוץ גופית 21. באמצעות הערכות מקיפות של מקורות צמחיים שונים, המחברים זיהו פיגומים שמקורם בתפוחים כאופטימליים ביותר לתרבית ולהתמיינות של תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs). יתר על כן, המחברים הציעו כי התכונות המבניות והמכאניות של הפיגומים שמקורם בתפוח ממלאות תפקיד מרכזי בהתאמתם למטרה המיועדת. בהיותם הפיגומים הראשונים שמקורם בצמחים שיושמו ביישומי הנדסת רקמות, פיגומים שמקורם בתפוחים הוכחו בהרחבה כבעלי ארכיטקטורה דומה להפליא לזו של עצם אנושית, בעיקר במונחים של הנקבוביות המחוברות ביניהן בקוטרשל 100 עד 200 מיקרומטר בקוטר 14,21.
במחקר הנוכחי, חקרנו עוד יותר את הפוטנציאל של פיגומי תאית שמקורם בתפוח עבור BTE וערכנו ניתוח של התכונות המכניות שלהם הן במבחנה והן in vivo. למרות שהיו מחקרים על הפוטנציאל של פיגומים שמקורם בתפוח עבור BTE 17,20,21, התכונות המכניות שלהם לא נחקרו מספיק. התוצאות הראו פלישה של התפשטות בר והתמיינות אוסטאוגנית של פראוסטאובלסטים MC3T3-E1 שנזרעו בפיגומים שגודלו בתרבית בתווך התמיינות במשך 4 שבועות. המודולוס של פיגומים אלה היה 192.0 ±-16.6 kPa, שהיה גבוה משמעותית מאלה של הפיגומים הריקים (פיגומים ללא תאי זרע) (31.6 ±-4.8 kPa) והפיגומים מזרעי תאים שגודלו בתרבית בתווך אי-התמיינות (24.1 ±-8.8 kPa). עם זאת, יש לציין כי מודולוס יאנג של רקמת עצם אנושית בריאה בדרך כלל נופל בטווח של 0.1-2 GPa עבור עצם trabecular וכ 15-20 GPa עבור עצם קליפת המוח8. עם זאת, לאחר השתלה של 8 שבועות בפגם קלווריאלי של מכרסמים, נראה כי פיגומים מזרעי תאים השתלבו היטב בעצם שמסביב, כפי שהודגם על ידי כוח שיא ממוצע של 113.6 N ± 18.2 N בבדיקות דחיפה החוצה, הדומה לעומס השבר שדווח בעבר של עצם קלווריאלית מקומית22. בסך הכל, התוצאות שהתקבלו ממחקר זה מראות הבטחה משמעותית, במיוחד עבור יישומים שאינם נושאים עומס. עם זאת, לפיגומי תאית שמקורם בתפוח אין כיום את התכונות המכניות הדרושות כדי להתאים במדויק לרקמת העצם שמסביב באתר השתל. כתוצאה מכך, נדרש פיתוח נוסף כדי למצות את מלוא הפוטנציאל של פיגומים אלה.
Protocol
פרוטוקולי הניסוי נבדקו ואושרו על ידי הוועדה לטיפול בבעלי חיים באוניברסיטת אוטווה.
1. הכנת פיגומים
- השתמשו בפרוסת מנדולינה כדי לחתוך תפוחי מקינטוש (Canada Fancy) לפרוסות בעובי 8 מ"מ. חותכים את רקמת ההיפנתיום של פרוסות התפוחים לריבועים בגודל 5 מ"מ x 5 מ"מ.
- מניחים את הדגימות המרובעות ב-0.1% נתרן דודציל סולפט (SDS) למשך יומיים.
- שטפו את הדגימות שעברו דה-צלולר במים שעברו דה-יוניזציה ודגרו עליהן למשך הלילה בטמפרטורת החדר (RT) ב-100 mM CaCl2 כדי להסיר את שאריות פעילי השטח.
- מעקרים את הדגימות (כלומר פיגומים) באתנול 70% למשך 30 דקות, שוטפים אותן במים נטולי יונים, ומניחים אותן בצלחת תרבית של 24 בארות לפני זריעת התא.
2. תרבית תאים וזריעת פיגומים
- יש לשמור על תת-שיבוט MC3T3-E1 של 4 תאים בצלחות שטופלו בתרבית תאים בקוטר 10 ס"מ בתנאי תרבית תאים (37°C באטמוספירה לחה של 95% אוויר ו-5% CO2).
- הכינו מדיום תרבית תאים העשוי מהמדיום החיוני המינימלי של Eagle's - שינוי אלפא (α-MEM) בתוספת 10% נסיוב בקר עוברי (FBS) ו-1% פניצילין/סטרפטומיצין.
- נתקו את התאים מצלחות התרבית על ידי טריפסיניזציה (0.05% טריפסין-EDTA) ברגע שהם מגיעים למפגש של 80%.
- צנטריפוגה את מתלה התא ב c.a. 200 x g במשך 3 דקות. שאפו את הסופרנאטנט והשהו מחדש את התאים ב-α-MEM ב-2.5 x 107 תאים למ"ל.
- פיפטה 40 μL aliquot של תרחיף התא על פני הפיגומים, ולתת לתאים להיצמד במשך 1 שעה בתנאי תרבית תאים. לאחר מכן, הוסף 2 מ"ל של מדיום תרבות לכל באר תרבות של צלחת התרבות.
- לחדש את מדיום התרבות כל 2-3 ימים במשך 14 ימים.
- הכינו מדיום התמיינות על ידי הוספת 50 מיקרוגרם/מ"ל חומצה אסקורבית ו-4 מ"מ נתרן פוספט למדיום תרבית התאים שתואר קודם לכן.
- השראת התמיינות של תאי MC3T3-E1 על ידי דגירה על הפיגומים בתווך התמיינות למשך 4 שבועות. לחדש את המדיום כל 3-4 ימים. במקביל, יש לדגור על פיגומים בתווך תרבית אי-דיפרנציאציה (כלומר, מדיום ללא התוספים ליצירת בידול) למשך אותו משך זמן, כאשר אותו לוח שינויים בינוני ישמש כבקרה שלילית.
3. מדידות גודל נקבוביות באמצעות מיקרוסקופ סריקת לייזר קונפוקלי
- שטפו את הפיגומים שמקורם בתפוח עם מלח חוצץ פוספט (PBS).
- דגרו על הפיגומים ב-1 מ"ל של 10% (v/v) כתם לבן קלקופלור למשך 25 דקות בחושך ב-RT.
- שטפו את הפיגומים (n = 3) עם PBS ודמו שלושה אזורים שנבחרו באופן אקראי לכל פיגום עם מיקרוסקופ סריקת לייזר קונפוקלי (CLSM) בהגדלה של פי 10, באמצעות ערוץ DAPI, באופן הבא:
- תצורת מסנן פליטת לייזר: 405 ננומטר (לייזר); 425-475 ננומטר (פליטה)
- כוונן את עוצמת הלייזר ואת הגלאי באופן ידני כדי להבטיח קבלת תמונה מיטבית. קבל ערימת z של 20 תמונות עם גודל צעד של 5 מיקרומטר.
- באמצעות תוכנת ImageJ, לעבד ולנתח את התמונות confocal כדלקמן:
- השתמשו בפונקציה Z-Project to Maximum Intensity ליצירת תמונה, והחילו את הפונקציה Find Edges כדי להדגיש את קצות הנקבוביות.
- עקוב אחר הנקבוביות באופן ידני באמצעות הכלי בחירה חופשית .
- התאימו כל נקבובית כאליפסה, מדדו את אורך הציר הראשי, אספו את כל המדידות (סה"כ 54 במחקר הנוכחי - 6 מתוך 3 אזורים שנבחרו באופן אקראי לכל פיגום), וחשבו את האורך הממוצע.
4. ניתוח פיזור תאים באמצעות מיקרוסקופ סריקת לייזר קונפוקלי
- שטפו את הפיגומים מזרעי התאים שגודלו בתרבית במדיום אי-התמיינות או התמיינות שלוש פעמים עם PBS. תקן את הפיגומים עם 4% paraformaldehyde במשך 10 דקות.
- שטפו היטב כל פיגום במים שעברו דה-יוניזציה, חדרו את התאים בתמיסת Triton-X 100 למשך 5 דקות, ושטפו שוב עם PBS.
- יש לדגור על הפיגומים ב-1 מ"ל של 1% חומצה מחזורית למשך 40 דקות ולשטוף במים נטולי יונים,14,16.
- לדגור על הפיגומים ב 1 מ"ל של תמיסה המכילה 100 mM נתרן metabisulphite ו 0.15 M חומצה הידרוכלורית, בתוספת 100 מיקרוגרם / מ"ל יודיום יודיד. לטבול לחלוטין את הפיגומים בתמיסה.
- שטפו את הפיגומים עם PBS והכתימו את גרעיני התא על ידי דגירה על הפיגומים בתמיסת DAPI של 5 מ"ג/מ"ל למשך 10 דקות בחושך. יש לשטוף שוב ביסודיות ולאחסן את הפיגומים ב-PBS לפני ההדמיה.
- תמונה של שלושה משטחים שנבחרו באופן אקראי של שלושה פיגומים שונים מזרעי תאים עם CLSM תהודה במהירות גבוהה בהגדלה של פי 10, באמצעות ערוצי DAPI ו-TRITC, באופן הבא:
- תצורת מסנן פליטת לייזר:
DAPI: לייזר: 405 ננומטר; פליטה: 425-475 ננומטר
TRITC: לייזר: 561 ננומטר; פליטה: 570-620 ננומטר - כוונן את עוצמת הלייזר ואת הגלאי באופן ידני כדי להבטיח קבלת תמונה מיטבית. קבל ערימת z של 20 תמונות עם גודל צעד של 5 מיקרומטר.
- תצורת מסנן פליטת לייזר:
- השתמש בתוכנת ImageJ כדי לעבד את התמונות הקונפוקליות וליצור הקרנה מקסימלית בציר z לניתוח תמונות באמצעות הפונקציה Z-Project to Maximum Intensity .
5. ניתוח phosphatase אלקליין
- שטפו את הפיגומים מזרעי התאים שגודלו בתרבית במדיום אי-התמיינות או התמיינות שלוש פעמים עם PBS. תקנו את הפיגומים עם 10% פורמלין חוצץ נייטרלי למשך 30 דקות. תקן פיגומים ריקים (פיגומים ללא תאי זרע) כדי שישמשו כבקרה שלילית.
- הכינו תמיסת צביעה 5-bromo-4-chloro-3'-indolyphosphate ו-nitro-blue tetrazolium (BCIP/NBT) על ידי המסת טבלית BCIP/NBT אחת ב-10 מ"ל של מים שעברו דה-יוניזציה.
- שטפו את הפיגומים הקבועים בתמיסת רצף 0.05% והכתימו עם תמיסת BCIP/NBT למשך 20 דקות ב-RT. שטפו את הפיגומים המוכתמים בתמיסת רצף 0.05% ואחסנו אותם ב-PBS לפני ההדמיה.
- דמיינו את הפיגומים המוכתמים במצלמה דיגיטלית של 12 מגה-פיקסל.
6. ניתוח תצהיר סידן
- שטפו את הפיגומים מזרעי התאים שגודלו בתרבית במדיום אי-התמיינות או התמיינות שלוש פעמים עם PBS. תקנו את הפיגומים עם 10% פורמלין חוצץ נייטרלי למשך 30 דקות. תקן פיגומים ריקים (פיגומים ללא תאי זרע) כדי שישמשו כבקרה שלילית.
- הכינו תמיסת צביעה 2% (w/v) בצבע אדום אליזרין S (ARS).
- שטפו את הפיגומים הקבועים במים שעברו דה-יוניזציה והכתימו אותם בתמיסת ARS למשך שעה אחת ב-RT. שטפו את הפיגומים המוכתמים במים נטולי יונים, ואחסנו אותם ב-PBS לפני ההדמיה.
- דמיינו את הפיגומים המוכתמים במצלמה דיגיטלית של 12 מגה-פיקסל.
7. ניתוח מינרליזציה
- שטפו את הפיגומים מזרעי התאים שגודלו בתרבית במדיום אי-התמיינות או התמיינות שלוש פעמים עם PBS. תקן את הפיגומים עם 4% paraformaldehyde במשך 48 שעות. תקן פיגומים ריקים (פיגומים ללא תאי זרע) כדי שישמשו כבקרה שלילית.
- יש לייבש את הדגימות בתמיסות המכילות ריכוזי אתנול העולים מ-50% ל-100%, כפי שתואר לעיל23.
- בצע מיקרוסקופ אלקטרונים סורק (SEM) וספקטרוסקופיה מפזרת אנרגיה (EDS) כדי לנתח אגרגטים מינרליים כדלקמן:
- יבשו את הדגימות באמצעות מייבש נקודה קריטית, בהתאם לפרוטוקולהיצרן 24.
- יש למרוח ציפוי זהב 5 ננומטר על הפיגומים באמצעות ציפוי זהב, בהתאם לפרוטוקולהיצרן 25.
- דמיינו את פני השטח של הפיגומים במיקרוסקופ אלקטרונים סורק בהגדלה של 3 קילו-וולט, בהגדלה של פי 85.
- בצע EDS על ידי הגדרת מיקרוסקופ אלקטרונים סורק על 15 kV. בשלושה אזורים שנבחרו באופן אקראי לכל פיגום, רכשו ספקטרום EDS לניתוח הרכב אגרגטים מינרליים.
8. מדידות המודולוס של יאנג
- הסר את הפיגומים מזרע התא ממדיום הדגירה המתאים שלהם ובדוק מיד את הדגימות.
- באמצעות מנגנון דחיסה חד-צירי שנבנה בהתאמה אישית ומצויד בתא עומס של 1.5 N, דחסו את הפיגומים (n = 3 לכל תנאי) בקצב קבוע של 3 מ"מ·min-1 למאמץ דחיסה מרבי של 10% מגובה הפיגומים.
- לקבוע את המודולוס של יאנג מהשיפוע של החלק הליניארי של עקומות המתח. במחקר הנוכחי, המודולוס נקבע בין 9% ל -10% מתח.
9. חדירת תאים וניתוח מינרליזציה על ידי היסטולוגיה: פיגומים חוץ גופיים
- שטפו את הפיגומים מזרעי תאים שגודלו בתרבית במדיום אי-התמיינות או התמיינות שלוש פעמים עם PBS.
- תקן את הפיגומים זרע התא עם 4% paraformaldehyde במשך 48 שעות לפני ההשעיה ב 70% אתנול לאחסון.
- היסטולוגיה:
הערה: במחקר הנוכחי, כל ההכנה ההיסטולוגית (הטבעה, חתך וצביעה) המתוארת בשלבים הבאים בוצעה על ידי מתקן הליבה להיסטולוגיה ע"ש לואיז פלטייה (אוניברסיטת אוטווה).- לאחר התייבשות והטמעה בפרפין, חותכים את הדגימות למקטעים טוריים בעובי 5 מיקרומטר, החל מ-1 מ"מ בתוך הפיגומים, ומרכיבים את החלקים על שקופיות מיקרוסקופ.
- הכתימו את החלקים בכתמי המטוקסילין ואאוזין (H&E) או פון קוסה (VK).
- דמיינו את המקטעים במיקרוסקופ סורק שקופיות בהגדלה של 40x (n = פיגום אחד בתווך אי-התמיינות ו-n = 2 פיגומים במדיום התמיינות במחקר הנוכחי).
- באמצעות תוכנת ImageJ, בצע הערכה חזותית של חדירת תאים (צביעת H&E) ומינרליזציה (צביעת VK).
10. מודל פגם קלווריאלי של חולדה
- קבל פרוטוקולים ניסיוניים שנבדקו ואושרו על ידי הוועדה המקומית לטיפול בבעלי חיים.
- הכינו פיגומים עגולים (קוטר 5 מ"מ ועובי 1 מ"מ) דה-צלולריים בהתאם לסעיף 1 המתואר לעיל ובאמצעות ניקוב ביופסיה 5 מ"מ.
- ביצוע קרניוטומיה דו צדדית בעקבות פרוטוקול26 שנקבע, כדלקמן:
- הרדימו חולדות Sprague-Dawley זכרים עם איזופלורן, תחילה ב-3% עד שהן מאבדות את הכרתן, ולאחר מכן ב-2-3% לאורך כל ההליך.
- חשוף את periosteum ואת הגולגולת על ידי חיתוך העור מעל באמצעות להב אזמל. הסר את periosteum.
- יצירת פגמים דו צדדיים בשתי עצמות הקודקוד בכל צד של תפר הקשת באמצעות מקדחה דנטלית המצוידת בטרפין בקוטר 5 מ"מ תחת השקיה קבועה של 0.9% NaCl.
- נקו את העצם שמסביב עם 0.9% NaCl כדי להסיר שברי עצם.
- מניחים את הפיגומים העגולים, נטולי התא, בתוך הפגמים.
- סגור את העור שמעל עם 4-0 תפרים.
- תנו לחולדות גישה בלתי מוגבלת למזון ומים ועקבו אחריהן מדי יום.
- לאחר 8 שבועות לאחר ההשתלה, יש להרדים את החולדות על ידי שאיפתCO2 וניקוב בית החזה כאמצעי המתת חסד משני.
- כדי לחשוף את הגולגולת ולשלוף את השתלים, הסר את העור המכסה את הגולגולת באמצעות להב אזמל.
- חתכו את הגולגולת בעצמות הקדמיות והעורפיות ובצד שתי העצמות הקודקודיות באמצעות מקדחה דנטלית כדי להסיר את החלק העליון של הגולגולת לחלוטין.
11. מבחן דחיפה החוצה
- חבר התקן דחיסה חד-צירי (עם תא טעינה של 445 N) למודול רכישת הנתונים מסוג USB.
- חבר את מודול רכישת הנתונים למחשב המצויד ביישום תוכנה לרכישת נתונים.
- מיד לאחר מיצוי הגולגולת, הניחו כל דגימה (n = 7 שתלים מ-4 בעלי חיים במחקר הנוכחי) על מחזיק הדגימה של מכשיר הדחיסה החד-צירית, כך שהצד הגבי של העצם פונה כלפי מעלה.
- מנמיכים את הבוכנה ב-0.5 מ"מ/דקה עד למגע קל בשתל שחולץ.
- התחל את הבדיקה על ידי הורדת הבוכנה דרך השתל עד לדחיפה מלאה החוצה תוך הפעלת דחיסה במהירות קבועה של 0.5 מ"מ/דקה באמצעות תוכנת איסוף הנתונים.
- רשום את כוח השיא בעקומת הכוח לעומת התזוזה באמצעות תוכנת רכישת הנתונים.
12. חדירת תאים וניתוח מינרליזציה על ידי היסטולוגיה: פיגומים In vivo
- תקן את הקלבריה המופקת ואת השתלים בפורמלין חוצץ 10% ניטרלי למשך 72 שעות לפני השעיה באתנול 70% לאחסון.
- היסטולוגיה:
הערה: במחקר הנוכחי, כל ההכנה ההיסטולוגית (הטבעה, חתך וצביעה) המתוארת בשלבים הבאים בוצעה על ידי Accel Labs (מונטריאול, QC, קנדה).- חתכו את הדגימות (המוטבעות במתיל מתקרילט) למקטעים בעובי 6 מיקרומטר בשלוש רמות שונות (למעלה, למטה ולכיוון המרכז) והרכיבו אותן על שקופיות מיקרוסקופ.
- הכתימו את הקטעים ב-H&E או בטריכרום של מאסון-גולדנר (MGT).
- דמיינו את המקטעים במיקרוסקופ סורק שקופיות בהגדלה של פי 40 (במחקר הנוכחי 4 צמחים מ-2 בעלי חיים).
- באמצעות תוכנת ImageJ, יש להעריך ויזואלית חדירת תאים (צביעת H&E) ושקיעת קולגן (צביעת MGT).
תוצאות
מדידת גודל נקבוביות, פיזור תאים ומינרליזציה במבחנה (איור 1 ואיור 2)
הסרה מלאה של רכיבים תאיים מקוריים של פיגומי רקמת התפוחים הושגה לאחר טיפול בפיגומים עם SDS ו-CaCl2 (איור 1A). הפיגומים הציגו מבנה נקבובי מאוד, שאושר באמצעות מיקרוסקופ קונפוקלי. כימות התמונות הראה גודל נקבוביות ממוצע של 154 מיקרומטר ± 40 מיקרומטר. התפלגות גודל הנקבוביות נעה בין 73 מיקרומטר ל-288 מיקרומטר. אולם רוב הנקבוביות נעו בין 100 מיקרומטר ל-200 מיקרומטר (איור 1C).
לאחר תקופת תרבית של 4 שבועות בתווך התמיינות הפיגומים מזרעי התאים הראו מרבצי מינרלים לבנים נרחבים (איור 1A). הפיגומים שהכילו תאים הציגו צבע לבן אטום, דבר המרמז על מינרליזציה, שלא נצפתה בפיגומים הריקים (פיגומים ללא תאי זרע). יתר על כן, ניתוח באמצעות מיקרוסקופ סריקת לייזר קונפוקלי חשף התפלגות תאים הומוגנית בתוך הפיגומים (איור 1B).
פיגומים שנזרעו או לא היו עם תאים הוכתמו ב-BCIP/NBT וב-ARS כדי לנתח פעילות ALP ומינרליזציה, בהתאמה (איור 1D). צביעת BCIP/NBT חשפה עלייה משמעותית בפעילות ALP (המתוארת בצבע סגול חזק) בתוך פיגומים מזרעי תאים שגודלו בתרבית בתווך התמיינות בניגוד לפיגומים הריקים או לפיגומים מזרעי תאים שגודלו בתרבית בתווך שאינו התמיינות. כמו כן, פיגומים מזרעי תאים שגודלו בתרבית במדיום התמיינות הציגו צבע אדום עז יותר עם צביעה ב- ARS, מה שמצביע על מינרליזציה גדולה יותר בהשוואה לפיגומים הריקים או לפיגומים מזרעי תאים שגודלו במדיום שאינו התמיינות. צביעת רקע נצפתה בפיגומים הריקים, אולי בשל נוכחותו של CaCl2 בפרוטוקול דה-צלולריזציה.
צביעה (H&E ו-VK) בוצעה על הפיגומים כדי לנתח חדירת תאים ומינרליזציה, ו-SEM ו-EDS שימשו להערכה נוספת של מינרליזציה (איור 2). צביעת H&E (איור 2A) הראתה חדירת תאים טובה לפיגומים מזרעי תאים שגודלו בתרבית במדיום אי-התמיינות או התמיינות. גרעינים רבים נראו בפריפריה וברחבי הפיגומים. נוכחות קולגן נצפתה גם בפיגומים בוורוד בהיר. בנוסף, צביעת VK שבוצעה על הפיגומים לאחר 4 שבועות של תרבית במדיום התמיינות גילתה כי דפנות הנקבוביות היו מוכתמות ואילו משקעי סידן התגלו אך ורק לאורך הקצוות החיצוניים של דפנות הנקבוביות בפיגומים שגודלו בתווך ללא התמיינות וייתכן שנבעו מספיגת סידן במהלך טיפול הדה-צלולריזציה. מינרליזציה מקומית על פני השטח של פיגומים מזרעי תאים שגודלו בתרבית בתווך התמיינות במשך 4 שבועות נצפתה על-ידי ניתוח SEM (איור 2B). באופן ספציפי יותר, מרבצי מינרלים הדומים לצברים ספרואידים נצפו בשולי הנקבוביות. לעומת זאת, לא נצפו אגרגטים מינרליים על הפיגומים הריקים או על פיגומים מזרעי תאים שגודלו בתרבית במשך 4 שבועות בתווך ללא התמיינות. פסגות אופייניות מובהקות המתאימות לזרחן (P) ולסידן (Ca) נצפו בספקטרום EDS של אזורי העניין הנבחרים, במיוחד במרבצי המינרלים שנצפו על פיגומים מזרעי תאים שגודלו בתרבית במשך 4 שבועות בתווך התמיינות (איור 2B).
אנליזה ביומכנית במבחנה (איור 3)
המודולוס הצעיר של פיגומים מזרעי תאים נמדד לאחר 4 שבועות של תרבית בתווך אי-התמיינות או התמיינות (n = 3 עבור כל תנאי ניסוי). הוא הושווה למודולוס של יאנג של הפיגומים הריקים (פיגומים ללא תאי זרע) (איור 3). לא נצפה הבדל משמעותי במודולוס בין הפיגומים הריקים (31.6 kPa ±-4.8 kPa) לבין פיגומים מזרעי תאים שגודלו בתרבית בתווך אי-התמיינות (24.1 kPa ±-8.8 kPa; p = 0.88). לעומת זאת, נצפה הבדל משמעותי בין המודולוס של הפיגומים הריקים (31.6 kPa ± 4.8 kPa) לבין זה של פיגומים מזרעי תאים שגודלו במדיום התמיינות (192.0 kPa ± 16.6 kPa; עמ' < 0.001). בנוסף, נצפה הבדל משמעותי (p < 0.001) בין המודולים של יאנג של פיגומים מזרעי תאים שגודלו בתרבית באמצעי אי-התמיינות והתמיינות. איור משלים 1 מראה עקומת מתח-מאמץ טיפוסית לחישוב המודולוס של יאנג.
ביצועים ביומכניים In vivo והתחדשות עצם (איור 4 ואיור 5)
קרניוטומיות כירורגיות נערכו על סך של 6 חולדות Sprague-Dawley. פגמים דו-צדדיים בקוטר 5 מ"מ נוצרו בשתי העצמות הקודקודיות של הגולגולת באמצעות בור טרפין, ופיגומים של תאית שמקורם בתפוח ללא תאי זרע הושתלו בפגמים הקלוואריאליים (איור 4A). לאחר 8 שבועות של השתלה, בעלי החיים עברו המתת חסד, והחלק העליון של גולגולותיהם נאסף ועובד לבדיקה מכנית או לניתוח היסטולוגי.
בהתבסס על הערכה חזותית, הפיגומים נראו משולבים היטב ברקמות המקיפות את הגולגולת. בדיקות דחיפה מכניות בוצעו כדי להעריך כמותית את שילוב הפיגומים (n = 7) בקלבריה המארחת. המדידות נערכו באמצעות מכשיר דחיסה חד-צירי (איור 4B) מיד לאחר המתת החסד של בעלי החיים. התוצאות הראו כי כוח השיא היה 113.6 N ± 18.2 N (טבלה 1).
ניתוח היסטולוגי נערך כדי להעריך חדירה ושקיעה של מטריצה חוץ-תאית בתוך הפיגומים המושתלים (איור 5). צביעת H&E חשפה חדירה תאית בתוך נקבוביות הפיגום ועדות לכלי דם, כפי שניתן לראות בנוכחות כלי דם בתוך הפיגומים. בנוסף, צביעת MGT הדגימה נוכחות של קולגן בתוך הפיגומים.
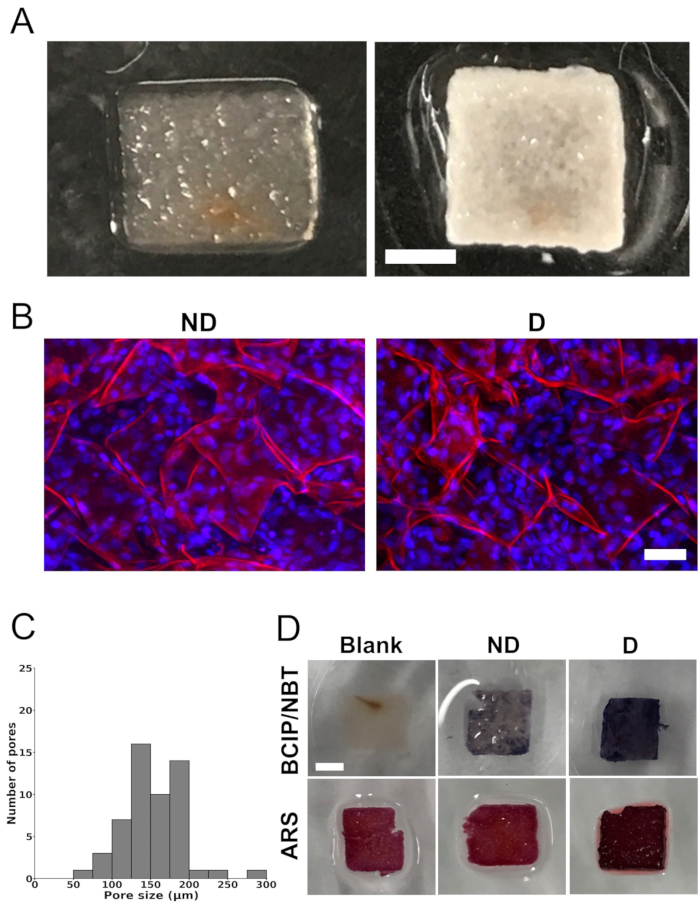
איור 1: תמונות פיגומים, התפלגות גודל נקבוביות ומינרליזציה במבחנה . (A) תצלומים מייצגים של פיגום תאית שמקורו בתפוח לאחר הסרת התאים המקומיים וחומר פעילי שטח (משמאל) ופיגום שנזרע עם תאי MC3T3-E1 לאחר 4 שבועות של תרבית במדיום התמיינות אוסטאוגני (מימין). סרגל קנה המידה מייצג 2 מ"מ. (B) תמונות מייצגות של מיקרוסקופ סריקת לייזר קונפוקלי המציגות תאי זרעים בפיגומי תאית שמקורם בתפוח לאחר 4 שבועות של תרבית בתווך ללא התמיינות ("ND") או בתווך התמיינות אוסטאוגני ("D"). סרגל קנה המידה מייצג 50 מיקרומטר. הצביעה בוצעה על הפיגומים עבור תאית (אדום) באמצעות פרופידיום יודיד ועבור גרעיני תאים (כחול) באמצעות DAPI. (C) התפלגות גודל הנקבוביות של פיגומי תאית שמקורם בתפוח שעבר דה-צלולריזציה, לפני שנזרעו עם תאי MC3T3-E1, מהקרנות מקסימליות בציר z של תמונות קונפוקליות. הניתוח בוצע על סך של 54 נקבוביות ב-3 פיגומים שונים (6 נקבוביות ב-3 אזורי עניין שנבחרו באופן אקראי לכל פיגום). (D) תמונות מייצגות של פיגומים מוכתמים ב-5-bromo-4-chloro-3'-indolyphosphate ו-nitro-blue tetrazolium (BCIP/NBT) כדי להעריך את פעילות phosphatase אלקליין (ALP) ועם S אדום אליזרין (ARS) כדי להמחיש שקיעת סידן, המציין מינרליזציה (סרגל קנה מידה = 2 מ"מ - חל על כולם). הפיגומים שסומנו כ"ריקים" (פיגומים ללא תאי זרע) לא הראו כתמים עם BCIP/NBT, מה שמעיד על היעדר פעילות ALP. מצד שני, פיגומים מזרעי תאים שגודלו בתרבית בתווך התמיינות ("D") הציגו פעילות ALP גבוהה יותר, המסומנת בצבע כחול עז יותר, בהשוואה לפיגומים מזרעי תאים שגודלו בתווך שאינו התמיינות ("ND"). עבור צביעת ARS, הן הפיגומים הריקים והן הפיגומים שגודלו בתרבית במדיום אי-התמיינות ("ND") הציגו גוון בהיר יותר של אדום בהשוואה לפיגומים שתורבתו בתווך בידול ("D"). נוכחותו של שקיעת סידן בפיגומים שגודלו במדיום התמיינות ("D") הודגמה על ידי צבע אדום עמוק עז. כל ניתוח בוצע על שלושה פיגומים שונים (n = 3). נתון זה הותאם באישור Leblanc Latour (2023)27. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: היסטולוגיה, מיקרוסקופ אלקטרונים סורק (SEM) וניתוח ספקטרוסקופיה מפזרת אנרגיה (EDS) של פיגומים במבחנה . (A) תמונות מייצגות של חתכים היסטולוגיים עליונים של הפיגומים. פיגומים משובצים בפרפין נחתכו למקטעים בעובי 5 מיקרומטר שהוכתמו בהמטוקסילין ואאוסין (H&E) כדי להמחיש חדירת תאים, או עם פון קוסה (VK) כדי להמחיש מינרליזציה בתוך הפיגומים. לפיגומים חדרו תאי MC3T3-E1, כפי שניתן לראות בכתמים כחולים (גרעינים) וורודים (ציטופלסמה) הנראים בפריפריה וברחבי הפיגומים. קולגן (ורוד בהיר) נראה גם כן (כניסה מוגדלת של "H&E - D"). מינרליזציה נצפתה רק בשולי קירות הנקבוביות בפיגומים שגודלו במדיום אי-התמיינות ("ND"). קירות הנקבוביות בפיגומים שתורבתו במדיום בידול ("D") היו מוכתמים כולם בשחור. הניתוח בוצע על פיגום אחד שתורבת בתווך אי-התמיינות ("ND") ועל שני פיגומים שתורבתו בתווך התמיינות ("D") (סרגל קנה מידה עבור תמונות ההגדלה התחתונות = 1 מ"מ, סרגל קנה מידה עבור תמונות ההגדלה הגבוהה יותר = 50 מיקרומטר). (B) מיקרוגרפים מייצגים המתקבלים על ידי SEM וכן על ידי ספקטרום EDS. הפיגומים עברו ציפוי בזהב וצולמו באמצעות מיקרוסקופ אלקטרונים סורק פליטת שדה במתח של 3.0 קילו וולט (סרגל קנה מידה = 100 מיקרומטר - חל על כולם). ספקטרום EDS נרכש על כל פיגום. זרחן (2.013 keV) וסידן (3.69 keV) מסומנים בכל ספקטרום EDS. הן SEM והן EDS בוצעו על שלושה פיגומים שונים. ריק: פיגומים ללא תאי זרע. נתון זה הותאם באישור Leblanc Latour (2023)27. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: מודולי יאנג של פיגומים במבחנה לאחר 4 שבועות של תרבית במדיום אי-התמיינות ("ND") או במדיום התמיינות ("D"). הנתונים מוצגים כממוצע ± שגיאת תקן של הממוצע (SEM) של שלוש דגימות משוכפלות עבור כל תנאי. מובהקות סטטיסטית (* מציין p<0.05) נקבעה באמצעות ניתוח חד-כיווני של שונות (ANOVA) ומבחן טוקי פוסט-הוק. ריק: פיגומים ללא תאי זרע. נתון זה הותאם באישור Leblanc Latour (2023)27. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: צילום פיגום לפני השתלה ובדיקת דחיפה החוצה לאחר 8 שבועות מההשתלה: (A) צילום מייצג של פיגום לפני ההשתלה; (B) התקן דחיסה חד-צירי המשמש לבדיקות הדחיפה החוצה, כאשר תא העומס מסומן בכוכבית (*) והדגימה מסומנת בחץ. נתון זה הותאם באישור Leblanc Latour (2023)27. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: ניתוח היסטולוגיה של פיגומים חוץ גופיים . תמונות מייצגות של חתכים היסטולוגיים מפיגומים שאינם זרעים לאחר 8 שבועות של השתלה. החלקים היו מוכתמים בהמטוקסילין ובאאוזין (H&E) כדי להמחיש תאים, או בטריכרום של מאסון-גולדנר (MGT) כדי להמחיש קולגן. החץ מציין תאי דם אדומים. נוכחות של קולגן גלוי (סרגל קנה מידה = 1 מ"מ ו 200 מיקרומטר עבור inets שמאל וימין, בהתאמה). נתון זה הותאם באישור Leblanc Latour (2023)27. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מספר מדגם | כוח שיא (N) |
| 1 | 92.8 |
| 2 | 162.7 |
| 3 | 140.3 |
| 4 | 135.7 |
| 5 | 37.7 |
| 6 | 157.8 |
| 7 | 67.9 |
| התכוון | 113.6 |
| SEM | 18.2 |
טבלה 1: נמדד כוח שיא ממבחני דחיפה החוצה.
איור משלים 1: עקומת מתח-מאמץ אופיינית לחישוב המודולוס של יאנג. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מספר מחקרי in vitro ו-in vivo הדגימו את התאימות הביולוגית של תאית ממקור צמחי ואת השימוש הפוטנציאלי שלה בהנדסת רקמות 14,15,16,18,19,20, באופן ספציפי יותר לאירוח התמיינות אוסטאוגנית 20,21. מטרות המחקר הנוכחי היו להמשיך לחקור את הפוטנציאל של פיגומי תאית שמקורם בתפוח עבור BTE ולהעריך את התכונות המכניות של פיגומים אלה הן במבחנה והן in vivo.
עבור מחקרים במבחנה, תאים preosteoblast (MC3T3-E1) נזרעו בפיגומים לאחר חיסול התאים המקומיים מרקמת התפוח. תאי MC3T3-E1 משמשים בדרך כלל לחקר הביומינרליזציה של מטריצה חוץ-תאית 28,29,30. לאחר מכן תורבתו פיגומים במשך 4 שבועות במדיום התמיינות אוסטאוגנית או אי-התמיינות. הממצאים הצביעו על כך שהתאים התרבו ועברו התמיינות בתוך הפיגומים, במיוחד כאשר התרבו בתווך התמיינות, ובכך הדגישו את הפוטנציאל של פיגומי תאית שמקורם בתפוחים לתמוך בהתפתחות רקמת עצם. גרעיני תאים נצפו במספרים גדולים בנקבוביות הפיגומים, מה שמאשש תצפיות שדווחו במחקרים קודמים 14,15,16,17,20,21. יתר על כן, בדומה לממצאים הקודמים שלנו14 ולממצאים של קבוצה אחרת21, הקוטר הממוצע של נקבוביות הפיגום היה ~154 מיקרומטר, כאשר רוב הנקבוביות היו בקטרים שבין 100 מיקרומטר ל-200 מיקרומטר (איור 1C). ממדים אלה תואמים את טווח גודל הנקבוביות האידיאלי (100-200 מיקרומטר) הידוע כמקל על צמיחת עצם7.
ניתוח הצביעה הראה פעילות ALP גבוהה יותר לאחר תקופת תרבית של 4 שבועות במדיום ההבחנה. מרבצי סידן נוספים נצפו על פני השטח של פיגומים מזרעי תאים שגודלו בתרבית במדיום התמיינות בהשוואה הן לפיגומים הריקים והן לפיגומים מזרעי התא שגודלו בתרבית בתווך שאינו התמיינות. תוצאות דומות נצפו עם hiPSCs מובחנים בפיגומים שמקורם בתפוח21. בעוד שנוכחות ALP הוערכה באופן איכותי במחקר הנוכחי, ניתן לבצע בדיקות נוספות לניתוח כמותי. ההערכה ההיסטולוגית של הפיגומים אישרה עוד כי האוסטאובלסטים שחדרו מינרלים לפיגומים לאחר ההתמיינות. יש לציין כי גם הפריפריה של המבנים המתורבתים במדיום אי-דיפרנציאציה הוכתמה ב-VK. ייתכן ששאריות CaCl2 בפיגומים גרמו לכתם לא ספציפי זה שנצפה בפריפריה לאחר דה-סלולריזציה. ניתוח איכותני של תמונות SEM בוצע כדי להעריך עוד יותר מינרליזציה. לאחר תרבית בתווך התמיינות הראו פיגומים מזרעי תאים סימנים של מינרליזציה של ECM. אגרגטים מינרליים נראו על פני הפיגומים, במיוחד בשולי הנקבוביות. תצפיות אלה עולות בקנה אחד עם מחקרים קודמים שהשתמשו ב-ECM30 ובפיגומים21 שמקורם בצמחים. אגרגטים אלה נעדרו על פני הפיגומים ללא תאי זרע. ניתוח EDS של המצרפים גילה נוכחות של רמות גבוהות של P ו- Ca, ובכך הציע נוכחות של אפטיט. יש לציין כי בעוד הפרוטוקול המתואר במחקר הנוכחי מאפשר הדמיה של חדירת תאים נוכחות של מינרליזציה, הוא אינו מאפשר הערכה של התקדמותם לאורך זמן. ניתוח היסטולוגי בנקודות זמן מרובות יהיה נחוץ כדי להעריך באופן מלא את ההתקדמות הזו. בנוסף, יידרש ניתוח נוסף כדי לכמת חדירה תאית ומינרליזציה על פני השטח, כמו גם לאורך הפיגומים כולו. לבסוף, בעוד שההרכב היסודי של מרבצי המינרלים נקבע על ידי EDS, טכניקות אפיון אחרות, כגון עקיפה של קרני רנטגן (XRD), עשויות להידרש כדי לספק מידע על המבנה הגבישי של המרבצים הנצפים.
המודולוס של הפיגומים הצעירים היה גבוה משמעותית אחרי תרבית במדיום בידול (בערך פי 8). לעומת זאת, המודולוס של הפיגומים שגודלו בתרבית בתווך אי-התמיינות דמה לזה של הפיגומים הריקים (פיגומים ללא תאי זרע), בדומה לממצאים שדווחו במחקר קודם עם פיגומים20 שמקורם בתפוח. למרות המודולוס הגבוה יותר של יאנג של פיגומים בתרבית בתווך התמיינות הוא נותר נמוך בהרבה מזה של עצם טבעית (0.1 עד 2 GPa עבור עצם טרבקולרית ו 15 עד 20 GPa עבור עצם קליפת המוח)8, allograft ביטול (3.78 GPa)31, שתלים אלופלסטיים עשויים poly-אתר-אתר-ketone (3.84 GPa)31, טיטניום (50.20 GPa)31, וסגסוגת קובלט-כרום (53.15 GPa)31 שתלים. לכן, ייתכן שהפיגומים בנוסחתם הנוכחית לא יתאימו ליישומים נושאי עומס. יש לציין כי המודולוס של יאנג מספק מידע על קשיחות של חומר. עם זאת, ניתן לשקול את חוזק היבול גם כדי לספק הבנה רחבה יותר של התכונות המכניות של הפיגומים.
פיגומי תפוחים שעברו דה-צלולריזציה הושתלו לאחר מכן בפגמים קלווריאליים דו-צדדיים בגודל קריטי של 5 מ"מ בחולדות (n = 6 בעלי חיים). בדיקות דחיפה החוצה (על 7 חצילים), שבוצעו כדי להעריך את שילוב הפיגומים בתוך הקלבריה המארחת, הצביעו על כך שכוח השיא הממוצע היה 113.6 N ± 18.2 N, בדומה לעומס השבר שדווח בעבר עבור עצם קלווריאלית (127.1 ± 9.6 N)22, דבר המצביע על כך שהפיגומים השתלבו היטב ברקמת העצם שמסביב. עם זאת, יש לציין כי בדיקת הדחיפה החוצה מספקת מידע רק על הממשק בין הפיגום לרקמה שמסביב. מחקרים קודמים שילבו בדיקות דחיפה החוצה עם בדיקות הזחה כדי לספק הבנה רחבה יותר של התכונות המכניות של ממשק שתל העצם והפיגום עצמו22. בנוסף, פגמים דו-צדדיים נוטים יותר לחוסר התאמה עם הבוכנה32. מיקום נכון של צמח הגולגולת, דגם פגם יחיד או מערכת הידוק נוספת במכשיר הבדיקה האוניברסלי עשוי למנוע חוסר התאמה32.
לסיכום, מחקר זה אישר כי פיגומי תאית שמקורם בתפוחים יכולים לקדם הידבקות ושגשוג של פראוסטאובלסטים. בנוסף, מינרליזציה התרחשה בתוך פיגומים מזרעי תאים שגודלו בתרבית בתווך התמיינות והובילה לעלייה במודולוס של הפיגום יאנג. עם זאת, המודולוס נותר נמוך משמעותית מזה של עצם טבעית. באופן מעניין, הכוח הדרוש כדי לעקור את פיגומי התאית המושתלים שמקורם בתפוח היה דומה לעומס השבר של עצם קלווריאלית וסוגים אחרים של פיגומים ששימשו בעבר עבור BTE22. לבסוף, בדומה לתוצאות שהודגמו בדוחות קודמים, תאים חדרו לפיגומים המושתלים והפקידו קולגן. בסך הכל, מחקר זה מדגים את הפוטנציאל של פיגומי תאית שמקורם בצמחים עבור יישומי BTE. ממצאים אלה עולים בקנה אחד עם מחקר קודם שנערך על ידי קבוצת מחקר אחרת, המבסס עוד יותר את התאמתם של פיגומי תאית ממקור צמחי למטרות BTE21. עם זאת, הפער בנוקשות הפיגומים בהשוואה לעצם טרבקולרית או קליפת המוח מדגיש את החשיבות של פיתוח ביו-חומרים מרוכבים שיכולים להתאים יותר לתכונות המכניות של עצם טבעית. לכן, למרות העניין הגובר בשימוש בפיגומים ממקור צמחי למטרות BTE, השימוש בהם עשוי להישאר מוגבל ליישומים שאינם נושאי עומס. כפי שהדגמנו בעבר16, הנדסה מחדש של פיגומי תאית ממקור צמחי באמצעות שינוי כימי או פיתוח חומרים מרוכבים עם פולימרים ביולוגיים/סינתטיים אחרים עשויה להיות חיונית ליישומים נושאי עומס.
Disclosures
הצהרת ניגוד עניינים: M.L.L, M.T. R.J.H., C.M.C., I.C. ו- A.P. הם ממציאים בבקשות פטנט שהוגשו על ידי אוניברסיטת אוטווה ו- Spiderwort Inc. בנוגע לשימוש בתאית ממקור צמחי עבור יישומי BTE. ל-M.L.L., R.J.H., C.M.C. ו-A.P. יש אינטרסים פיננסיים ב-Spiderwort Inc.
Acknowledgements
המימון לפרויקט זה ניתן על ידי מועצת המחקר למדעי הטבע וההנדסה של קנדה (NSERC) (מענק גילוי) ועל ידי קרן לי קה שינג. מ.ל.ל. קיבלה תמיכה מתוכנית TalentEdge של מרכזי המצוינות של אונטריו, ו- R.J.H. נתמכה על ידי מלגת NSERC לתואר שני ומלגת אונטריו לתארים מתקדמים (OGS).
Materials
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | ThermoFisher | D1306 | DAPI |
| Alizarin red S | Sigma-Aldrich | A5533 | ARS |
| Ascorbic acid | Sigma-Aldrich | A4403 | Cell Culture |
| Calcium Chloride | ThermoFisher | AA12316 | CaCl2 |
| Calcofluor White | Sigma-Aldrich | 18909 | |
| Dental drill | Surgical tool | ||
| Ethanol | ThermoFisher | 615095000 | |
| Fetal bovine serum | Hyclone Laboratories | SH30396 | FBS |
| Formalin | Sigma-Aldrich | HT501128 | 10% Formalin |
| Goldner's trichrome stain | Sigma-Aldrich | 1.00485 | GTC |
| Hematoxylin and eosin stain | Fisher Scientific | NC1470670 | H&E |
| High-speed resonant confocal laser scanning microscope | Nikon | Nikon Ti-E A1-R | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | |
| ImageJ software | National Institutes of Health | ||
| Irrigation saline | Baxter | JF7123 | 0.9% NaCl |
| MC3T3-E1 Subclone 4 cells | ATCC | CRL-2593 | Pre-osteoblast cells |
| McIntosh apples | Canada Fancy grade | ||
| Methyl methacrylate | Sigma-Aldrich | M55909 | Histological embedding |
| Minimum Essential Medium | ThermoFisher | M0894 | α-MEM |
| Paraformaldehyde | Fisher Scientific | O4042 | 4%; PFA |
| Penicillin/Streptomycin | Hyclone Laboratories | SV30010 | Cell Culture |
| Periodic acid | Sigma-Aldrich | 375810 | |
| Phosphate buffered saline | Hyclone Laboratories | 2810305 | PBS; without Ca2+ and Mg2+ |
| Propidium iodide | Invitrogen | p3566 | |
| Scanning electron microscope | JEOL | JSM-7500F FESEM | SEM and EDS |
| Slide scanner microscope | Zeiss | AXIOVERT 40 CFL | |
| Sodium dodecyl sulfate | Fisher Scientific | BP166 | SDS |
| Sodium metabisulphite | Sigma-Aldrich | 31448 | |
| Sodium phosphate | ThermoFisher | BP329 | |
| Sprague-Dawley rats | Charles-River Laboratories | 400 | Male |
| Sutures | Ethicon | J494G | 4-0 |
| Trephine | ACE Surgical Supply Co | 583-0182 | 5-mm diameter |
| Triton-X 100 | ThermoFisher | 807423 | |
| Trypsin | Hyclone Laboratories | SH30236.02 | Cell Culture |
| Tween | Fisher Scientific | BP337 | |
| Universal compression Device | CellScale | UniVert | |
| Von Kossa stain | Sigma-Aldrich | 1.00362 | Histology |
References
- Schmitz, J. P., Hollinger, J. O. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clinical Orthopaedics and Related Research. 205, 299-308 (1986).
- Yu, X., Tang, X., Gohil, S. V., Laurencin, C. T. Biomaterials for bone regenerative engineering. Advanced Healthcare Materials. 4 (9), 1268-1285 (2015).
- Parikh, S. N. Bone graft substitutes: Past, present, future. Journal of Postgraduate Medicine. 48 (2), 142-148 (2002).
- Silber, J. S., et al. Donor site morbidity after anterior iliac crest bone harvest for single-level anterior cervical discectomy and fusion. Spine (Phila Pa 1976). 28 (2), 134-139 (2003).
- Amini, A. R., Laurencin, C. T., Nukavarapu, S. P. Bone tissue engineering: recent advances and challenges. Critical Reviews in Biomedical Engineering. 40 (5), 363-408 (2012).
- Butler, D. L., Goldstein, S. A., Guilak, F. Functional tissue engineering: the role of biomechanics. Journal of Biomechanical Engineering. 122 (6), 570-575 (2000).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Bose, S., Roy, M., Bandyopadhyay, A. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnology. 30 (10), 546-554 (2012).
- Yoshikawa, H., Myoui, A. Bone tissue engineering with porous hydroxyapatite ceramics. Journal of Artificial Organs. 8 (3), 131-136 (2005).
- Fu, Q., Saiz, E., Rahaman, M. N., Tomsia, A. P. Bioactive glass scaffolds for bone tissue engineering: state of the art and future perspectives. Materials Science & Engineering. C, Materials for Biological Applications. 31 (7), 1245-1256 (2011).
- Xynos, I. D., Edgar, A. J., Buttery, L. D. K., Hench, L. L., Polak, J. M. Ionic products of bioactive glass dissolution increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochemical and Biophysical Research Communications. 276 (2), 461-465 (2000).
- Kroeze, R., Helder, M., Govaert, L., Smit, T. Biodegradable polymers in bone tissue engineering. Materials. 2 (3), 833-856 (2009).
- Venkatesan, J., Vinodhini, P. A., Sudha, P. N. Chitin and chitosan composites for bone tissue regeneration. Advances in Food and Nutrition Research. 73, 59-81 (2014).
- Modulevsky, D. J., Lefebvre, C., Haase, K., Al-Rekabi, Z., Pelling, A. E. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS One. 9 (5), e97835(2014).
- Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Biocompatibility of subcutaneously implanted plant-derived cellulose biomaterials. PLoS One. 11 (6), e0157894(2016).
- Hickey, R. J., Modulevsky, D. J., Cuerrier, C. M., Pelling, A. E. Customizing the shape and microenvironment biochemistry of biocompatible macroscopic plant-derived cellulose scaffolds. ACS Biomaterials Science & Engineering. 4 (11), 3726-3736 (2018).
- Hickey, R. J., Leblanc Latour, M., Harden, J. L., Pelling, A. E. Designer scaffolds for interfacial bioengineering. Advanced Engineering Materials. 25, 2201415(2023).
- Fontana, G., et al. Biofunctionalized plants as diverse biomaterials for human cell culture. Advanced Healthcare Materials. 6 (8), 1601225(2017).
- Gershlak, J. R., et al. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials. 125, 13-22 (2017).
- Leblanc Latour, M., Pelling, A. E. Mechanosensitive osteogenesis on native cellulose scaffolds for bone tissue engineering. Journal of Biomechanics. 135, 111030(2022).
- Lee, J., Jung, H., Park, N., Park, S. H., Ju, J. H. Induced osteogenesis in plants decellularized scaffolds. Scientific Reports. 9 (1), 20194(2019).
- Zhao, J., et al. Enhanced healing of rat calvarial defects with sulfated chitosan-coated calcium-deficient hydroxyapatite/bone morphogenetic protein 2 scaffolds. Tissue Engineering. Part A. 18 (1-2), 185-197 (2012).
- Murtey, M. D., Ramasamy, P. Sample Preparations for Scanning Electron Microscopy - Life Sciences. In: Modern Electron Microscopy in Physical and Life Sciences. , 161-186 (2016).
- tousimis Critical Point Dryers - Samdri®-PVT-3D. , https://tousimis.com/critical_point_dryers/detail.html?Pid=8755B (2022).
- Leica EM ACE200 Vacuum Coater. , https://www.leica-microsystems.com/products/sample-preparation-for-electron-microscopy/p/leica-em-ace200/ (2023).
- Spicer, P. P. Evaluation of bone regeneration using the rat critical size calvarial defect. Nature Protocols. 7 (10), 1918-1929 (2012).
- Leblanc Latour, M. Cellulose biomaterials for bone tissue engineering [dissertation]. , Department of Physics, Faculty of Science, University of Ottawa, Ottawa, Canada. (2023).
- Kodama, H. -A., Amagai, Y., Sudo, H., Kasai, S., Yamamoto, S. Establishment of a clonal osteogenic cell line from newborn mouse calvaria. Japanese Journal of Oral Biology. 23 (4), 899-901 (1981).
- Wang, D., et al. Isolation and characterization of MC3T3-E1 preosteoblast subclones with distinct in vitro and in vivo differentiation/mineralization potential. Journal of Bone and Mineral Research. 14 (6), 893-903 (1999).
- Addison, W. N., et al. Extracellular matrix mineralization in murine MC3T3-E1 osteoblast cultures: An ultrastructural, compositional and comparative analysis with mouse bone. Bone. 71, 244-256 (2015).
- Heary, R. F., Parvathreddy, N., Sampath, S., Agarwal, N. Elastic modulus in the selection of interbody implants. Journal of Spine Surgery. 3 (2), 163-167 (2017).
- Lawson, Z. T., et al. Methodology for performing biomechanical push-out tests for evaluating the osseointegration of calvarial defect repair in small animal models. MethodsX. 8, 101541(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved