Method Article
Таргетная микроинъекция и электропорация церебральных органоидов приматов для генетической модификации
В этой статье
Резюме
Электропорация церебральных органоидов приматов обеспечивает точный и эффективный подход к введению переходных генетических модификаций в различные типы предшественников и нейронов в модельной системе, близкой к (пато)физиологическому развитию неокортекса приматов. Это позволяет изучать процессы развития нервной системы и эволюционные процессы, а также может быть применено для моделирования заболеваний.
Аннотация
Кора головного мозга является самой внешней структурой мозга и отвечает за обработку сенсорного ввода и моторного выхода; Он рассматривается как место когнитивных способностей более высокого порядка у млекопитающих, в частности, приматов. Изучение функций генов в мозге приматов является сложной задачей по техническим и этическим причинам, но создание технологии органоидов мозга позволило изучить развитие мозга в традиционных моделях приматов (например, макаки-резуса и обыкновенной мартышки), а также у ранее экспериментально недоступных видов приматов (например, человекообразных обезьян) в этически оправданной и менее технически сложной системе. Кроме того, органоиды человеческого мозга позволяют проводить расширенные исследования нервно-психических и неврологических расстройств.
Поскольку органоиды мозга повторяют многие процессы развития мозга, они также представляют собой мощный инструмент для выявления различий и функционального сравнения генетических детерминант, лежащих в основе развития мозга различных видов в эволюционном контексте. Большим преимуществом использования органоидов является возможность введения генетических модификаций, что позволяет тестировать функции генов. Однако внедрение таких модификаций является трудоемким и дорогостоящим. В этой статье описывается быстрый и экономически эффективный подход к генетической модификации клеточных популяций в желудочкоподобных структурах церебральных органоидов приматов, подтипа органоидов мозга. Этот метод сочетает в себе модифицированный протокол для надежной генерации церебральных органоидов из индуцированных плюрипотентных стволовых клеток (ИПСК) человека, шимпанзе, макак-резуса и обыкновенной мартышки с микроинъекционным и электропорационным подходом. Это обеспечивает эффективный инструмент для изучения процессов развития нервной системы и эволюции, который также может быть применен для моделирования заболеваний.
Введение
Исследование (пато)физиологического развития и эволюции коры головного мозга является сложной задачей, которая затрудняется отсутствием подходящих модельных систем. Ранее такие исследования ограничивались двумерными моделями клеточных культур (таких как первичный нейронный предшественник или культуры нейрональных клеток) и эволюционно удаленными моделями животных (таких как грызуны)1,2. Хотя эти модели полезны для решения определенных вопросов, они ограничены в моделировании сложности, состава типа клеток, клеточной архитектуры и паттернов экспрессии генов развивающегося неокортекса человека в здоровом и болезненном состояниях. Эти ограничения приводят, например, к плохой переводимости мышиных моделей заболеваний человека на ситуацию человека, как описано для некоторых случаев микроцефалии (например, Zhang et al.3). В последнее время трансгенные нечеловекообразные приматы, которые являются эволюционно, функционально и морфологически более близкой моделью развития неокортекса человека, оказались в центре внимания 4,5,6,7,8, поскольку они преодолевают многие ограничения моделей, основанных на клеточных культурах и грызунах. Тем не менее, использование нечеловеческих приматов в исследованиях не только очень дорого и отнимает много времени, но и вызывает этические проблемы. Совсем недавно развитие технологии органоидов мозга 9,10 стало многообещающей альтернативой, которая решает многие ограничения предыдущих моделей 11,12,13,14,15,16.
Органоиды мозга представляют собой трехмерные (3D) многоклеточные структуры, которые имитируют основные особенности цитоархитектинации и клеточного состава одной или нескольких областей мозга для определенного временного окна развития 11,12,13,14,17. Эти 3D-структуры генерируются либо из индуцированных плюрипотентных стволовых клеток (ИПСК), либо, если они доступны для интересующих видов, из эмбриональных стволовых клеток (ЭСК). В целом, на основе используемой методологии можно выделить два типа органоидов мозга: неуправляемые и регионализованные (управляемые) органоиды мозга18. При создании последнего типа органоидов предусмотрены небольшие молекулы или факторы, которые направляют дифференцировку плюрипотентных стволовых клеток в органоиды определенной области мозга (например, органоиды переднего мозга)18. Напротив, в неуправляемых органоидах дифференциация не определяется добавлением малых молекул, а скорее опирается исключительно на спонтанную дифференцировку ИПСК/ЭСК. Полученные органоиды мозга состоят из типов клеток, представляющих различные области мозга (например, церебральные органоиды)18. Органоиды мозга сочетают в себе многие ключевые особенности развития мозга с относительно экономичной и эффективной по времени генерацией из любых видов, представляющих интерес, для которых доступны ИПСК или ЭСК11,12,13,14. Это делает органоиды мозга отличной моделью для многих видов нейробиологических исследований, начиная от вопросов эволюции и развития и заканчивая моделированием заболеваний и тестированием лекарств15,16. Однако решение таких вопросов с помощью органоидов мозга сильно зависит от наличия различных методов генетической модификации.
Одним из ключевых аспектов изучения неокортекса (пато)физиологического развития и его эволюции является функциональный анализ генов и вариантов генов. Обычно это достигается путем (эктопической) экспрессии и/или нокдауна (KD) или нокаута (KO) этих генов. Такие генетические модификации могут быть классифицированы как стабильные и преходящие генетические модификации, а также модификации, ограниченные или не ограниченные во времени и пространстве. Стабильная генетическая модификация определяется введением генетического изменения в геном хозяина, которое передается всем последующим поколениям клеток. В зависимости от момента генетической модификации он может влиять на все клетки органоида или может быть ограничен определенными клеточными популяциями. Чаще всего стабильная генетическая модификация достигается в органоидах мозга на уровне iPSC/ESC путем применения лентивирусов, транспозоноподобных систем и технологии CRISPR/Cas9 (рассмотрено, например, Fischer et al.17, Kyrousi et al.19 и Teriyapirom et al.20). Это имеет то преимущество, что все клетки органоида мозга несут генетическую модификацию и что она не ограничена ни во времени, ни в пространстве. Однако генерация и характеристика этих стабильных линий iPSC/ESC занимает очень много времени, часто занимая несколько месяцев, прежде чем можно будет проанализировать первые модифицированные органоиды мозга (рассмотренные, например, Fischer et al.17, Kyrousi et al.19 или Teriyapirom et al.20).
Напротив, преходящая генетическая модификация определяется доставкой генетического груза (например, плазмиды экспрессии генов), которая не интегрируется в геном хозяина. Хотя эта модификация в принципе может быть передана последующим поколениям клеток, доставленный генетический груз будет постепенно разбавляться с каждым делением клетки. Поэтому этот тип генетической модификации обычно ограничен во времени и пространстве. Преходящая генетическая модификация может осуществляться в органоидах мозга аденоассоциированными вирусами или электропорацией (рассмотрено, например, Fischer et al.17, Kyrousi et al.19 и Teriyapirom et al.20), причем последнее подробно описано в этой статье. В отличие от стабильной генетической модификации, этот подход очень быстрый и экономически эффективный. Действительно, электропорация может быть выполнена в течение нескольких минут, и, в зависимости от популяции клеток-мишеней, электропорированные органоиды готовы к анализу в течение нескольких дней (рассмотрено, например, Fischer et al.17 и Kyrousi et al.19). Однако грубые морфологические изменения органоида мозга, такие как различия в размерах, не могут быть обнаружены с помощью этого метода, поскольку этот тип генетической модификации ограничен во времени и пространстве. Это ограничение также может быть преимуществом, например, в случае изучения отдельных клеточных популяций внутри органоида или воздействия на органоиды мозга в определенные моменты времени развития (рассмотрено, например, Fischer et al.17 и Kyrousi et al.19).
Классический подход к изучению функции генов во время развития и эволюции мозга заключается в внутриутробной электропорации. Внутриутробная электропорация является хорошо известным и полезным методом доставки конструкций экспрессии генов в мозг грызунов 21,22,23 и хорька 24,25. Во-первых, раствор, содержащий интересующую конструкцию (конструкции) экспрессии, микроинъецируют через стенку матки в определенный желудочек эмбрионального мозга, в зависимости от области, на которую будет нацелена. На втором этапе электрические импульсы применяются для трансфицирования клеток, непосредственно выстилающих целевой желудочек. Этот подход не ограничивается только эктопической экспрессией или сверхэкспрессией генов, поскольку он также может быть применен в исследованиях KD или KO путем микроинъекции короткой шпильки (шРНК) или CRISPR/Cas9 (в виде экспрессионных плазмид или рибонуклеопротеинов [RNP]) соответственно26,27. Однако внутриутробная электропорация эмбрионов мышей, крыс и хорьков имеет те же ограничения, что и описанные выше для этих животных моделей.
В идеале хотелось бы проводить внутриутробную электропорацию непосредственно у приматов. Хотя это, в принципе, технически возможно, внутриутробно электропорация у приматов не проводится из-за этических соображений, высоких затрат на содержание животных и небольших размеров помета. Для некоторых приматов, таких как человекообразные обезьяны (включая людей), это вообще невозможно. Однако эти приматы обладают наибольшим потенциалом для изучения (пато)физиологического развития неокортекса человека и его эволюции. Одним из решений этой дилеммы является применение метода электропорации к органоидам мозга приматов28.
В данной работе представлен протокол электропорации подтипа органоидов мозга приматов, церебральных органоидов приматов. Этот подход позволяет быстро и экономически эффективно генетическую модификацию клеточных популяций в желудочкоподобных структурах органоидов. В частности, мы описываем унифицированный протокол генерации церебральных органоидов приматов из ИПСК человека (Homo sapiens), шимпанзе (Pan troglodytes), макак-резуса (Macaca mulatta) и обыкновенной мартышки (Callithrix jacchus). Кроме того, мы подробно описываем технику микроинъекций и электропорации и предоставляем критерии «идти» и «нет» для выполнения электропорации органоидов головного мозга приматов. Этот подход является эффективным инструментом для изучения (пато)физиологического развития неокортекса и его эволюции в модели, особенно близкой к человеческой ситуации.
протокол
1. Культура ИПСК приматов
ПРИМЕЧАНИЕ: Благодаря своей надежности представленный здесь метод может быть применен к любой линии iPSC приматов. В этой статье мы описываем продукцию церебральных органоидов из линий iPSC человека (iLonza2.2)29, шимпанзе (Sandra A)30, макаки-резуса (iRh33.1)29 и обыкновенной мартышки (cj_160419_5)31. Условия культивирования приведены в таблице 1. Подробную информацию обо всех материалах, реагентах и оборудовании, используемых в этом протоколе, см. в таблице материалов.
- Для культивирования соответствующих ИПСК следуйте первоначально описанным условиям культивирования. В целом, для успешной генерации и электропорации церебральных органоидов используйте линии iPSC, которые не культивировались более 90 пассажей. Кроме того, в начале генерации церебральных органоидов убедитесь, что ИПСК проявляют признаки плюрипотентности без признаков дифференцировки.
2. Генерация церебральных органоидов из ИПСК приматов
ПРИМЕЧАНИЕ: Протокол генерации церебральных органоидов основан на модифицированной версии 28,30,32,33 исходного протокола церебральных органоидов 10,34 с некоторыми видоспецифическими модификациями (подробно описанными ниже).
- Посев ИПСК для получения эмбриоидных тел (ЭБ)
- Как только ИПСК достигнут слияния 80-90%, промойте их фосфатно-буферным физиологическим раствором Дульбекко (DPBS) и добавьте 500 мкл рекомбинантного заменителя трипсина или 1 мл протеолитической и коллагенолитической смеси.
ПРИМЕЧАНИЕ: Как правило, ИПСК культивируют в чашке для культивирования клеток диаметром 60 мм для получения примерно 900 000 клеток, чего достаточно для получения 96 церебральных органоидов. Количество клеток можно регулировать в зависимости от количества необходимых органоидов. Имейте в виду, что не все генерируемые церебральные органоиды могут быть пригодны для электропорации. - Инкубируйте чашку при 37 ° C в течение 2 минут, чтобы отделить клетки.
ПРИМЕЧАНИЕ: Может потребоваться до 2 минут инкубации при 37 ° C в зависимости от используемой линии ИПСК или фермента. Рекомендуется исследовать чашку под микроскопом, чтобы убедиться, что клетки начали отделяться. - Добавьте 1,5 мл предварительно разогретой (37 °C) питательной среды iPSC, чтобы остановить реакцию, и пипетку вверх и вниз в 7x-10x (не более 10x) для диссоциации клеток из чашки для культивирования клеток и получения одноклеточной суспензии.
- Перенесите клеточную суспензию в коническую центрифужную пробирку объемом 15 мл и центрифугируйте клетки при 200 × г в течение 5 мин при комнатной температуре.
- Аспирируют надосадочную жидкость и ресуспендируют гранулу в 2 мл питательной среды iPSC с добавлением 50 мкМ Y27632 или 50 мкМ соединения, способствующего выживанию.
- Используйте 10 мкл клеточной суспензии для подсчета клеток с помощью камеры Нейбауэра.
- Отрегулируйте клеточную суспензию до концентрации 9000 клеток на 150 мкл (60 000 клеток / мл), используя питательную среду iPSC, дополненную 50 мкМ Y27632 или 50 мкМ соединением, способствующим выживанию.
- Для получения эмбриоидных тел (БЭ) засейте 150 мкл клеточной суспензии в каждую лунку пластины со сверхнизким прикреплением 96 лунок. Во время пипетки осторожно встряхните трубку , содержащую клеточную суспензию, чтобы предотвратить осаждение клеток.
- Культивируют ЭБ в гумифицированной атмосфере с содержанием 5%СО2 и 95% воздуха при 37 °C (0 дней после посева [dps]). Не нарушайте ЭБ в течение первых 24 ч после посева.
ПРИМЕЧАНИЕ: ЭБ, полученные из ИПСК мартышек, необходимо культивировать в гумифицированной атмосфере в условиях гипоксии (5% CO 2, 5% O 2 и 90 % N2) при 37 ° C. - Через ~48 ч (2 dps) смените среду на питательную среду iPSC без соединения Y27632/pro-survival. Удалите 100 мкл среды на лунку и добавьте 150 мкл предварительно подогретой (37 ° C) свежей среды без Y27632. Идите ряд за рядом.
- Выполняйте дальнейшую смену среды через день; удалите 150 мкл среды из каждой лунки и добавьте 150 мкл предварительно подогретой (37 °C) свежей среды без состава Y27632 / pro-survival на лунку.
ПРИМЕЧАНИЕ: Через 4-5 дней периферия ЭБ должна стать полупрозрачной.
- Как только ИПСК достигнут слияния 80-90%, промойте их фосфатно-буферным физиологическим раствором Дульбекко (DPBS) и добавьте 500 мкл рекомбинантного заменителя трипсина или 1 мл протеолитической и коллагенолитической смеси.
- Индукция нейроэктодермы
ПРИМЕЧАНИЕ: Как правило, качественные ЭБ должны иметь плавные контуры и полупрозрачные границы на этом этапе. Временные точки нейронной индукции немного различаются между видами приматов и линиями iPSC. В случае клеточных линий, используемых здесь (см. Раздел 1 и Таблицу материалов), нейронную индукцию для ЭБ мартышек обычно необходимо начинать с 4 д/с, для макак-резусов - 5 д/с, а для ЭБ человека и шимпанзе - с 4-5 д/с (рис. 1А), в зависимости от состояния ЭБ (см. выше).- Удалите 150 мкл среды из каждой лунки первого ряда 96-луночной пластины и добавьте 150 мкл предварительно разогретой (37 °C) среды для нейронной индукции (см. Таблицу 2) на лунку в том же ряду.
- Продолжайте менять среду, как описано выше, ряд за строкой для всей 96-луночной пластины. Выполняйте дальнейшую смену среды нейронной индукции (NIM) через день, удаляя 150 мкл NIM из каждой лунки и добавляя 150 мкл предварительно нагретого (37 °C) свежего NIM.
ПРИМЕЧАНИЕ: С этого момента ЭБ мартышек следует культивировать в тех же условиях, что и других ЭБ приматов (гумифицированная атмосфера 5% CO2 и 95% воздуха при 37 ° C).
- Встраивание в матрицу базальной мембраны
ПРИМЕЧАНИЕ: После того, как у БЭ развился ярко выраженный, полупрозрачный, радиально организованный нейроэпителий на поверхности, необходимо обеспечить структурную поддержку для развития желудочкоподобных структур. Это достигается путем встраивания ЭБ в матрицу базальной мембраны. Из-за различий в темпах развития ЭБ мартышек и макак-резусов готовы к встраиванию уже при 7 д/с, в то время как ЭБ человека и шимпанзе обычно встраиваются при 8-9 д/с. Для простоты матрица базальной мембраны в этом протоколе относится только к Matrigel. Тем не менее, Geltrex можно использовать в качестве замены.- При подготовке к встраиванию под ламинарным колпаком в течение 15 минут стерилизуют ножницы, щипцы, небольшую решетку для пробирок объемом 0,2 мл и от трех до шести квадратов парапленки, обработанной 70% (об./об.) этанолом. Дайте матрице базальной мембраны оттаять на льду в течение нескольких часов (~ 1,5 мл матрицы базальной мембраны обычно хватает на 96 ЭБ).
ПРИМЕЧАНИЕ: Всегда держите матрицу базальной мембраны на льду. - Создайте сетку углубления 4 x 4 на парапленке. Поместите сетку для парапленки на стойку для пробирок объемом 0,2 мл так, чтобы сторона, обернутая бумагой, была обращена вверх, и аккуратно прижмите палец в перчатке к каждому отверстию стойки.
- Извлеките бумагу и вырежьте из квадрата парапленки ножницами ямоточку, чтобы отрегулировать ее размер, чтобы она поместилась в чашку для культивирования клеток диаметром 60 мм. Поместите парапленку с ямочками обратно на стойку для пробирок объемом 0,2 мл, чтобы обеспечить основу для генерации капель матрицы базальной мембраны.
- Используя пипетку с отрезанным наконечником пипетки объемом 200 мкл, осторожно перенесите ЭБ один за другим из лунки чашки для культивирования в углубления парапленки.
- После перемещения 16 ЭБ в сетку возьмите новый наконечник пипетки объемом 200 мкл и удалите оставшуюся среду из ямочек.
- Пипеткой нанесите одну каплю (~ 15 мкл) матрицы базальной мембраны на каждую ямочку, содержащую один ЭБ.
- Возьмите наконечник пипетки объемом 10 мкл и быстро переместите ЭБ в центр каждой капли, не нарушая границ капель.
- Поместите парапленку с ямочками с каплями матрицы базальной мембраны в чашку для культивирования клеток диаметром 60 мм и инкубируйте в течение 15-30 минут при 37 ° C, чтобы матрица полимеризовалась.
- Чтобы отделить ЭБ, встроенные в матрицу, от парапленки, добавьте в чашку 5 мл дифференцировочной среды (СД) без витамина А (см. Таблицу 2) и переверните квадрат парапленки вверх дном с помощью щипцов так, чтобы сторона с ЭБ была обращена ко дну чашки.
- Осторожно встряхните блюдо, чтобы капли матрицы базальной мембраны, содержащие ЭБ, отделились от парапленки. Если некоторые из них все еще прикреплены, возьмите край квадрата парапленки с помощью щипцов и быстро сверните его к центру тарелки несколько раз.
- Культивируйте церебральные органоиды на орбитальном шейкере при 55 об/мин в гумифицированной атмосфере 5% CO2 и 95% воздуха при 37 ° C. Держите их в СД без витамина А со средними изменениями через день. Чтобы индуцировать выработку нейронов, переключитесь на СД с витамином А (ретиноевая кислота, РА) через 13 дней для церебральных органоидов мартышек и макак-резусов или 14-15 дней для церебральных органоидов человека и шимпанзе (рис. 1А). С этого момента меняйте среду каждые 3-4 дня.
ПРИМЕЧАНИЕ: Для поддержки выживания нейронов СД с витамином А можно дополнить 20 мкг/мл человеческого нейротрофина 3 (NT3), 20 мкг/мл нейротрофического фактора головного мозга (BDNF) и 1 мкл / мл матрикса базальной мембраны начиная с 40 дпс.
- При подготовке к встраиванию под ламинарным колпаком в течение 15 минут стерилизуют ножницы, щипцы, небольшую решетку для пробирок объемом 0,2 мл и от трех до шести квадратов парапленки, обработанной 70% (об./об.) этанолом. Дайте матрице базальной мембраны оттаять на льду в течение нескольких часов (~ 1,5 мл матрицы базальной мембраны обычно хватает на 96 ЭБ).
3. Электропорация церебральных органоидов приматов
ПРИМЕЧАНИЕ: С технической точки зрения электропорация церебральных органоидов может быть проведена, как только желудочкоподобные структуры станут достаточно выраженными, чтобы на них можно было нацелиться с помощью микроинъекций. Оптимальное временное окно электропорации зависит от биологического вопроса и от интересующей популяции клеток. Например, если апикальные предшественники (АП) являются основной мишенью, то церебральные органоиды на уровне около 30 дпс уже подходят. Если основными мишенями являются базальные предшественники (BP) или нейроны, следует использовать более старые церебральные органоиды с частотой более 50 dps (см., например, Fischer et al.28).
- Подготовка электропорационной установки
ПРИМЕЧАНИЕ: Эффективность электропорации сильно зависит от размера и концентрации электропорированной плазмиды (подробности см. в разделе обсуждения).- Приготовьте достаточное количество смеси электропорации для контроля и интересующего гена (GOI), например, 10 мкл смеси электропорации для каждого контроля и GOI для электропорации примерно 30 церебральных органоидов на условие.
ПРИМЕЧАНИЕ: Состав электропорационных смесей см. в таблице 3. - Предварительно разогреть (нестерильную) модифицированную среду Eagle от Dulbecco F-12 (DMEM/F12) и DM с витамином А до 37 °C. Подготовьте маленький шпатель и тонкие и обычные ножницы и сбрызните инструменты 70% (объем/объем) этанола.
ПРИМЕЧАНИЕ: Следующие этапы могут быть выполнены как в стерильных, так и в нестерильных условиях, так как СД содержит антибиотики (см. Таблицу 2). По нашему опыту, отсутствие стерильности никогда не вызывало никакого загрязнения. - Подготовьте чашки для клеточных культур диаметром 35 мм и подсоедините электродную камеру чашки Петри к электропоратору.
ПРИМЕЧАНИЕ: Электродные камеры чашки Петри имеются в продаже. Тем не менее, они могут быть легко изготовлены экономически эффективным способом (см. Дополнительный файл 1). - Используя наконечники микрозагрузчика, наполните иглы для микроинъекций 8 мкл каждой смеси для электропорации. Обрежьте кончики игл тонкими ножницами перед первым использованием, чтобы добиться стабильного потока. Однако удаляйте только небольшую часть наконечника, так как тупой и широкий кончик может сильно повредить органоиды.
ПРИМЕЧАНИЕ: Иглы для микроинъекций либо коммерчески доступны в виде предварительно вытянутых игл для микроинъекций, либо могут быть вытащены в лаборатории, если доступен иглосъемник. Следуйте инструкциям производителя игольчатого съемника, чтобы создать иглы для микроинъекций с длинным конусом и диаметром наконечника 10 мкм.
- Приготовьте достаточное количество смеси электропорации для контроля и интересующего гена (GOI), например, 10 мкл смеси электропорации для каждого контроля и GOI для электропорации примерно 30 церебральных органоидов на условие.
- Микроинъекции и электропорация
- Под микроскопом выбирают пять церебральных органоидов с гладкими границами и хорошо видимыми желудочкоподобными структурами. Переместите их в 35-миллиметровую чашку для культивирования клеток, содержащую предварительно разогретый (37 °C) DMEM/F12, используя отрезанный наконечник пипетки объемом 1,000 мкл.
ПРИМЕЧАНИЕ: Выбирайте церебральные органоиды с ярко выраженными и доступными желудочкоподобными структурами (см. рис. 1B). - Чтобы ввести структуру, похожую на желудочек, осторожно вставьте иглу через ее стенку и влейте ее электропорационной смесью до видимого заполнения. Не оказывайте чрезмерного давления на желудочкоподобные структуры, чтобы избежать их разрыва. Таким образом, приступайте к шести-восьми желудочкоподобным структурам каждого церебрального органоида.
ПРИМЕЧАНИЕ: Если игла засоряется во время процесса микроинъекции, наконечник необходимо слегка обрезать. - Перенесите один микроинжектированный церебральный органоид в электродную камеру чашки Петри с небольшим количеством DMEM/F12. Расположите органоид таким образом, чтобы поверхности микроинъекционных желудочковых структур были обращены к электроду, соединенному с положительным полюсом электропоратора.
ПРИМЕЧАНИЕ: Ориентация структур таким образом гарантирует, что клетки трансфицируются со стороны желудочковой структуры, которая не подвержена влиянию соседней структуры. - Электропорировать церебральные органоиды один за другим, используя следующие настройки: 5 импульсов по 80 В, длительность импульса 50 мс и интервал 1 с. Переместите электропорированные органоиды в новую 35-миллиметровую чашку для культивирования клеток, заполненную предварительно разогретым (37 °C) DMEM/F12.
ПРИМЕЧАНИЕ: Настройки электропорации могут зависеть от доступного электропоратора прямоугольной формы. Эти настройки оптимизированы для эталонной системы электропорации. Повышение напряжения может привести к смещению ячеек. - Таким же образом поступайте со следующими пятью церебральными органоидами, используя вторую электропорационную смесь (например, GOI).
ПРИМЕЧАНИЕ: Повторяйте шаги 3.2.1-3.2.5 до тех пор, пока не будет достигнуто желаемое количество электропорированных церебральных органоидов. - Если микроинъекция и электропорация проводились в нестерильных условиях, перенесите электропорированные органоиды в стерильную чашку для культивирования клеток диаметром 35 мм под колпаком с ламинарным потоком, перемещая как можно меньше DMEM/F12 в новую чашку для клеточных культур.
- Под микроскопом выбирают пять церебральных органоидов с гладкими границами и хорошо видимыми желудочкоподобными структурами. Переместите их в 35-миллиметровую чашку для культивирования клеток, содержащую предварительно разогретый (37 °C) DMEM/F12, используя отрезанный наконечник пипетки объемом 1,000 мкл.
- Дальнейшее культивирование и фиксация церебральных органоидов
- Культивируют электропорированные органоиды в СД с витамином А на орбитальном шейкере при 55 об/мин в гумифицированной атмосфере 5%СО2 и 95% воздуха при 37 °С.
- На следующий день после электропорации проверьте церебральные органоиды на успешную электропорацию под обычным инвертированным флуоресцентным микроскопом.
ПРИМЕЧАНИЕ: В зависимости от продолжительности дальнейшего культивирования после электропорации поражаются различные популяции клеток в церебральном органоиде (см. также раздел репрезентативных результатов). - Приступайте к последующему применению после культивирования электропорированных церебральных органоидов в течение времени, подходящего для интересующего биологического вопроса.
ПРИМЕЧАНИЕ: Электропорированные церебральные органоиды могут быть обработаны для различных последующих применений (например, фиксация для иммунофлуоресцентного окрашивания или мгновенное замораживание для выделения РНК и qRT-PCR). Здесь мы описываем фиксацию электропорированных церебральных органоидов. - Перенесите электропорированные органоиды в коническую центрифужную пробирку объемом 15 мл, используя отрезанный наконечник пипетки объемом 1000 мкл, и удалите лишнюю среду.
- Добавьте достаточное количество 4% параформальдегида (PFA) в DPBS (pH 7,5) и выдерживайте в течение 30 минут при комнатной температуре.
ВНИМАНИЕ: PFA классифицируется как канцероген для человека и может нанести непоправимый вред здоровью. Настоятельно рекомендуются дополнительные меры предосторожности, включая нитриловые перчатки и защитные очки. - Аспирируйте PFA, добавьте 5 мл DPBS, немного встряхните и аспирируйте DPBS. Повторите это 2 раза. Храните органоиды в DPBS при температуре 4 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь, так как фиксированные PFA церебральные органоиды могут храниться при 4 ° C в течение нескольких месяцев. Электропорированные органоиды, фиксированные PFA, могут быть проанализированы криосекцией и иммунофлуоресцентным окрашиванием10,28 или окрашиванием и очисткой всей монтировки35,36. Например, изображения см. в разделе репрезентативных результатов (см. Таблицу 4 для получения подробной информации об антителах).
Результаты
Описанный здесь протокол позволяет эффективно генерировать церебральные органоиды из линий iPSC человека, шимпанзе, макаки-резуса и обыкновенной мартышки с минимальными временными изменениями, необходимыми между видами (рис. 1A). Эти органоиды могут быть электропорированы в диапазоне от 20 до 50 дпс, в зависимости от доступности желудочковых структур и обилия интересующей клеточной популяции. Однако перед электропорацией важно определить, имеют ли церебральные органоиды достаточного качества для электропорации.
Церебральный органоид, идеально подходящий для электропорации, должен иметь ярко выраженные светлые желудочкоподобные структуры на периферии, отсутствие признаков дегенерации (например, отслоение клеток, увеличенное апоптотическое ядро) и в целом компактную здоровую морфологию (например, отсутствие чрезмерного выроста) (рис. 1B, «Go»). Предпочтительно выбирать церебральные органоиды с большими, хорошо организованными, желудочкоподобными структурами для нацеливания на большее количество клеток. Если периферическая зона органоида темная и не имеет выступающих структур, рекомендуется не использовать ее для электропорации, так как точные микроинъекции могут быть скомпрометированы отсутствием визуальных подсказок (рис. 1B, «Запрет»). Для достижения оптимальной морфологии церебральных органоидов важно обеспечить своевременность критических этапов, таких как индукция нейроэктодермы и встраивание матрицы. Проблемы, связанные с морфологией церебральных органоидов, обычно возникают из-за неудачного образования нейроэктодермы и/или нейроэпителиальных почек. Обычно это вызвано неоптимальным временем нейронной индукции и/или встраивания матрицы базальной мембраны и может быть решено путем регулировки времени этих шагов (дальнейшие советы по устранению неполадок при образовании церебральных органоидов можно найти в Lancaster and Knoblich34).
После электропорации первая оценка ее успеха и эффективности может быть проведена через 12 часов, когда экспрессия GFP трансфицированных клеток становится обнаруживаемой под обычным инвертированным флуоресцентным микроскопом. В идеале на этой стадии множественные желудочкоподобные структуры испускают ярко-зеленую флуоресценцию, локализованную на одной из их сторон (рис. 2А). Это говорит о высокой точности и эффективности процедуры. Успешно электропорированные церебральные органоиды четырех различных видов приматов (т.е. человека, шимпанзе, макаки-резуса и обыкновенной мартышки) демонстрируют сходные GFP-положительные паттерны в целевых желудочкоподобных структурах (рис. 2A). Кроме того, после фиксации и криосекции электропорированных органоидов головного мозга приматов успешно электропорированные желудочкоподобные структуры всех четырех видов демонстрируют колонки GFP-положительных клеток в радиально организованной и плотно упакованной желудочковой зоне (VZ) (рис. 2B). Количественное определение DAPI-положительных клеток, которые также были GFP-положительными в таких областях церебральных органоидов шимпанзе и мартышек через 2 дня после электропорации (17 желудочков из 12 органоидов количественно определены), показало, что в среднем примерно одна треть клеток (33%, SD ± 12%) были успешно электропорированы.
Субоптимальная электропорация отмечается либо небольшим количеством GFP-положительных клеток в желудочкообразной структуре (рис. 3A), либо несколькими GFP-положительными клетками, удаленными от любой желудочкоподобной структуры (рис. 3B). Низкое количество GFP-положительных клеток вызвано плохим поглощением плазмид. Это может быть связано либо с низкой концентрацией плазмиды, вызванной недостаточным количеством микроинъекционной электропорационной смеси, либо из-за недостаточно направленных электрических импульсов, что может быть вызвано неоптимальным расположением церебральных органоидов в электродной камере чашки Петри. Низкое количество GFP-положительных клеток, удаленных от любой желудочковой структуры, вызвано электропорацией постмитотических клеток в церебральном органоиде (например, нейронах) из-за неточной микроинъекции. Эти неоптимальные электропорации должны быть исключены из любых дальнейших анализов.
Надежная идентификация типов клеток, присутствующих в церебральных органоидах, основана, среди прочего, на положении клеток в желудочкоподобной структуре, что требует определения границы между VZ и зоной, обогащенной SVZ/нейронами. Эта граница может быть идентифицирована по радиальной организации и высоким характеристикам плотности клеточных ядер VZ (см. окрашивание DAPI на дополнительном рисунке S1). Подтверждение границы VZ/SVZ может быть выполнено путем иммунофлуоресцентного окрашивания на нейронные маркеры-предшественники, такие как PAX6 или SOX2, которые экспрессируются практически всеми клетками VZ (AP) и некоторыми клетками SVZ (BP). Наличие зоны, обогащенной нейронами, может быть подтверждено иммунофлуоресцентным окрашиванием нейрональных маркеров, таких как β-тубулин класса III (TUJ1) или NeuN (дополнительный рисунок S1).
Продолжительность культивирования церебральных органоидов после электропорации зависит от биологического вопроса и интересующих клеточных популяций. В недавнем исследовании было продемонстрировано, что различная продолжительность дальнейшей культуры после электропорации влияет на разные клеточные популяции в церебральных органоидах шимпанзе, начиная от AP и заканчивая нейронами верхнего слоя24. Здесь мы показываем аналогичные результаты для электропорированных органоидов мартышек. В частности, через 2 дня после электропорации GFP-положительные клетки почти исключительно локализуются в VZ, а также являются положительными на PAX6 — маркер нейронных клеток-предшественников, что указывает на то, что эти клетки являются AP или новорожденными BP (рис. 4A). Если период культивирования после электропорации удлиняется до 10 дней, то GFP-положительные клетки локализуются в базальных областях (т.е. в SVZ и зоне, обогащенной нейронами) (рис. 4B,C). Эти клетки могут (в дополнение к сигналу GFP) также быть положительными для PAX6 (рис. 4B), который указывает на BPs, или NeuN (рис. 4C), который указывает на нейроны. Аналогичные результаты могут быть получены для электропорированных церебральных органоидов человека и макаки-резуса. Таким образом, различные типы предшественников, а также нейроны могут быть успешно нацелены с помощью этого метода.
Почти все ранее показанные данные были получены в результате иммуноокрашивания гистологических срезов, полученных из электропорированных церебральных органоидов. Тем не менее, еще одним элегантным способом анализа этих органоидов является выполнение цельного иммуноокрашивания с последующей оптической очисткой35,36. Это позволило бы провести 3D-реконструкцию электропорированных церебральных органоидов, чтобы получить представление о 3D-распределении GFP-положительных клеток. На рисунке 5 и Видео 1 показан репрезентативный пример сигнала GFP в оптически очищенном электропорированном церебральном органоиде.
Таким образом, описанный здесь протокол электропорации обеспечивает точный и эффективный способ введения транзиторных генетических модификаций в различные типы предшественников и нейроны церебральных органоидов, полученных из разных линий iPSC приматов.
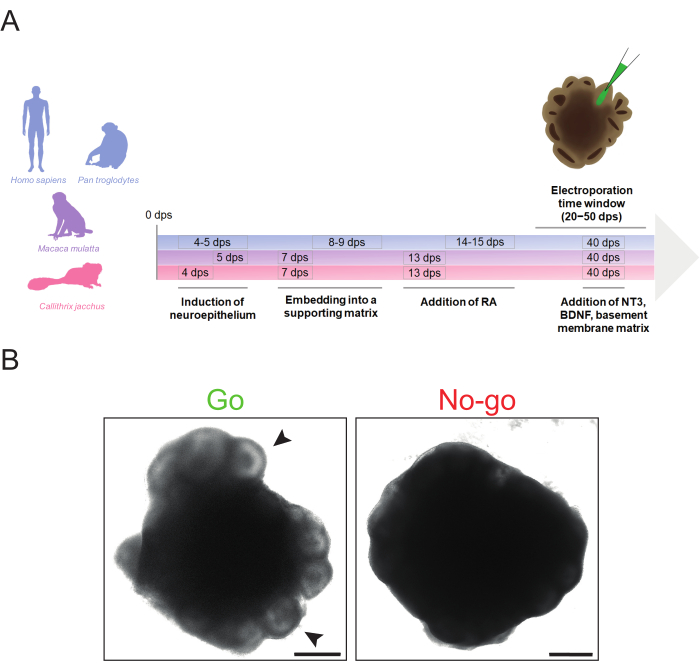
Рисунок 1: Схематический обзор генерации церебральных органоидов приматов и морфологических критериев «идти» и «не идти» для электропорации. (A) Хронология генерации церебральных органоидов и электропорации приматов, в которой подчеркиваются различные сроки выполнения этапов протокола для человека и шимпанзе (синий), макаки-резус (фиолетовый) и мартышки (пурпурный). Обратите внимание, что хронология временной шкалы не соответствует масштабу. (B) Изображения светлого поля подходящего (левое изображение, Go) и неподходящего (правое изображение, No-go) мозгового органоида человека с частотой 32 dps. Наконечники стрелок указывают на примеры подходящих желудочкообразных структур для микроинъекций. Изображения были получены с помощью инвертированного флуоресцентного микроскопа Zeiss Axio Observer.Z1 с 2,5-кратным объективом. Масштабные линейки = 500 мкм. Сокращения: BDNF = нейротрофический фактор головного мозга; dps = дни после посева; NT3 = нейротрофин 3; РА = ретиноевая кислота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
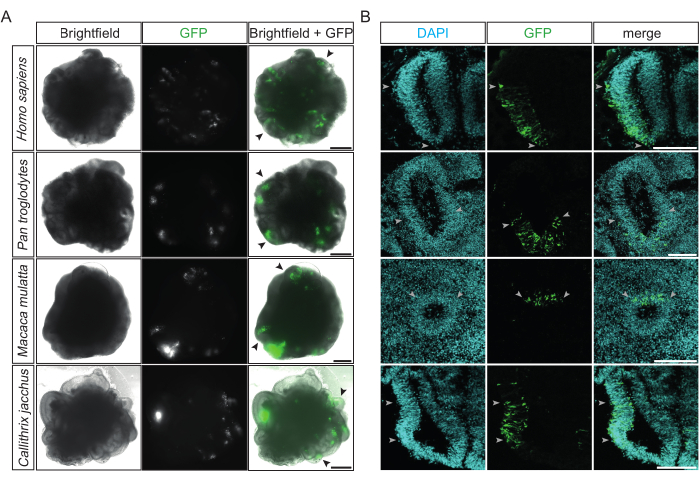
Рисунок 2: Примеры успешно электропорированных церебральных органоидов приматов . (A) Изображения Brightfield (левый столбец), флуоресценция (средний столбец) и слияние (правый столбец) 22 dps человек, 32 dps шимпанзе, 32 dps макак-резусов и 31 dps мартышек церебральных органоидов (сверху вниз) через 15-48 ч после электропорации плазмидой, экспрессирующей GFP. Черные наконечники стрелок указывают на примеры отдельных электропорированных желудочкоподобных структур. Изображения были получены с помощью инвертированного флуоресцентного микроскопа Zeiss Axio Observer.Z1 с 2,5-кратным объективом. Масштабные линейки = 500 мкм. (B) Иммунофлуоресценция для GFP (зеленый) в сочетании с окрашиванием DAPI (голубой) 32 dps человека, 34 dps шимпанзе, 32 dps макак-резусов и 32 dps мартышек церебральных органоидов (сверху вниз) через 2-4 дня после электропорации плазмидой, экспрессирующей GFP. Светло-серые наконечники стрелок обозначают границы электропорированных областей в желудочкоподобных структурах. Изображения были получены с помощью конфокального микроскопа Zeiss LSM 800 с 10-кратным объективом. Масштабные линейки = 150 мкм. Сокращения: DAPI = 4',6-диамидино-2-фенилиндол; dps = дни после посева; GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Примеры неудачно электропорированных церебральных органоидов приматов. (A, B) Иммунофлуоресценция для GFP (зеленый) в сочетании с окрашиванием DAPI (голубой) церебрального органоида (A) 34 dps макаки-резуса через 4 дня после электропорации плазмидой, экспрессирующей GFP, и (B) церебрального органоида макаки-резуса 32 dps через 2 дня после электропорации плазмидой, экспрессирующей GFP. Светло-серые наконечники стрелок обозначают электропорированные клетки. Светло-серый пунктирный контур указывает на границу между VZ и SVZ/обогащённой нейронами зоной желудочкообразной структуры, примыкающей к электропорированным клеткам. Изображения были получены с помощью конфокального микроскопа Zeiss LSM 800 с 10-кратным объективом. Масштабные линейки = 150 мкм. Сокращения: DAPI = 4',6-диамидино-2-фенилиндол; dps = дни после посева; GFP = зеленый флуоресцентный белок; СВЗ = субвентрикулярная зона; VZ = желудочковая зона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Визуализация различных клеточных популяций, присутствующих в церебральных органоидах приматов после электропорации. (А-С) Двойная иммунофлуоресценция для GFP (зеленый) и PAX6 (A, B; пурпурный) или NeuN (C; пурпурный), во всех случаях в сочетании с окрашиванием DAPI (голубой), мозгового органоида мартышки (A) 32 dps через 2 дня после электропорации плазмидой, экспрессирующей GFP, и (B, C) церебрального органоида мартышки 40 dps через 10 дней после электропорации плазмидой, экспрессирующей GFP. Светло-серые стрелки обозначают (A, B) GFP+ и PAX6+ или (C) NeuN+ двойные положительные клетки. Светло-серые пунктирные линии обозначают границу между ВЗ и зоной, обогащенной СВЗ/нейронами. Изображения были получены с помощью конфокального микроскопа Zeiss LSM 800 с 20-кратным объективом. Масштабные линейки = 100 мкм. Сокращения: DAPI = 4',6-диамидино-2-фенилиндол; dps = дни после посева; GFP = зеленый флуоресцентный белок; NeuN = белок ядер нейронов; PAX6 = парный белок коробки 6; СВЗ = субвентрикулярная зона; VZ = желудочковая зона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
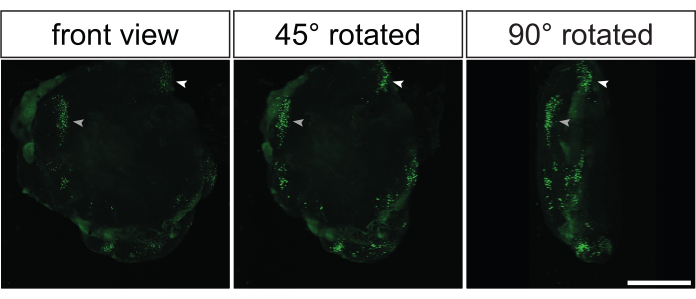
Рисунок 5: Трехмерная реконструкция электропорированных изображений с помощью 3D-конфокальной визуализации электропорированных органоидов головного мозга приматов после оптической очистки. Фронтальный (левое изображение), повернутый на 45° (среднее изображение) и повернутый на 90° (правое изображение) вид 3D-реконструированного электропорированного церебрального органоида человека со скоростью 32 dps через 2 дня после электропорации плазмидой, экспрессирующей GFP. Перед визуализацией органоид был оптически очищен на основе метода 2Eci35. 3D-реконструкция целого электропорированного органоида была получена из 269 оптических срезов (толщиной 1 мкМ каждый), которые находятся на расстоянии 3,73 мкм друг от друга, с использованием конфокального микроскопа Zeiss LSM 800 с 10-кратным объективом. Изображения были обработаны для 3D-реконструкции с использованием Фиджи. Обратите внимание, что изображения были сделаны с того же 3D-реконструированного органоида, показанного на видео 1. Масштабная линейка = 500 мкм. Аббревиатура: GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: 3D-реконструированный электропорированный органоид головного мозга человека после оптической очистки. Видео 3D-реконструированного электропорированного церебрального органоида человека с частотой 32 dps через 2 дня после электропорации плазмидой, экспрессирующей GFP. Перед визуализацией органоид был оптически очищен на основе метода 2Eci35. 3D-реконструкция целого электропорированного органоида была получена из 269 оптических срезов (толщиной 1 мкМ каждый), которые находятся на расстоянии 3,73 мкм друг от друга, с использованием конфокального микроскопа Zeiss LSM 800 с 10-кратным объективом. Изображения были обработаны для 3D-реконструкции с использованием Фиджи. Обратите внимание, что видео было снято с того же 3D-реконструированного органоида, показанного на рисунке 5. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
| Линия iPSC | Вид | Публикация | Состав питательной среды | Условия выращивания | ||||
| iLonza2.2 | Человек разумный | Stauske et al., 2020 | 1 мкМ IWR1 и 0,5 мкМ CHIR в StemMACS iPS-Brew XF | гумифицированная атмосфера 5%СО2 и 95% воздуха, 37 °C | ||||
| СандраА | Пан троглодиты | Mora-Bermúdez et al., 2016 | mTeSR1 | гумифицированная атмосфера 5%СО2 и 95% воздуха, 37 °C | ||||
| iRh33.1 | Макака мулатта | Stauske et al., 2020 | 1 мкМ IWR1 и 0,5 мкМ CHIR в StemMACS iPS-Brew XF | гумифицированная атмосфера 5%СО2 и 95% воздуха, 37 °C | ||||
| cj_160419_5 | Callithrix jacchus | Петков и др., 2020 | 3 мкМ IWR1, 0,3 мкМ CGP77675, 0,3 мкМ AZD77675, 0,5 мкМ CHIR99021, 10 мкМ форсколин, 1 нг/мл активин А, 1 мкМ OAC1 в StemMACS iPS-Brew XF | гумифицированная атмосфера 5% CO 2, 5% O 2 и 90% N 2, 37 ° C | ||||
Таблица 1: Условия культивирования ИПСК приматов, используемых в данной публикации. Аббревиатура: ИПСК = индуцированные плюрипотентные стволовые клетки.
| Терпимая | Состав | ||
| Среда нейронной индукции | 1x добавка N-2, 1x добавка-заменитель глютамина, 1x раствор заменимых аминокислот MEM, 1 мкг / мл гепарина в модифицированной среде Eagle F12 Дульбекко (DMEM / F12) | ||
| Дифференциирующая среда (СД) без витамина А | 0,5x добавка B-27 (минус витамин A), 0,5x добавка N-2, 0,5x раствор заменимых аминокислот MEM, 1x добавка-заменитель глютамина, 100 ЕД / мл пенициллина-стрептомицина, 0,00035% 2-меркаптоэтанола, 2,875 нг / мл инсулина в 1: 1 DMEM / F12 и нейробазальной среде | ||
| Дифференциирующая среда (СД) с витамином А | 0,5x добавка B-27, 0,5x добавка N-2, 0,5x раствор заменимых аминокислот MEM, 1x добавка заменителя глютамина, 100 ЕД / мл пенициллина-стрептомицина, 0,00035% 2-меркаптоэтанола, 2,875 нг / мл инсулина в 1: 1 DMEM / F12 и нейробазальной среде | ||
Таблица 2: Состав сред, используемых для генерации и культивирования органоидов головного мозга приматов.
| Компонент | Контрольная электропорационная смесь | Электропорационная смесь ГОИ |
| Плазмида экспрессии GFP | 500 нг/мкл | 500 нг/мкл |
| Пустой вектор | 500 нг/мкл | - |
| Экспрессия плазмиды ГОИ | - | 500 нг/мкл |
| Быстрый зеленый | 0.10% | 0.10% |
| в DPBS |
Таблица 3: Состав электропорационной смеси (подход с отдельными плазмидами) для контроля и интересующего гена. Аббревиатура: ГОИ = интересующий ген.
| Антитело | Компания | Каталожный номер | РРИД | Разбавление |
| Курица против GFP | Aves labs | ГФП-1020 | РРИД:AB_10000240 | 1:300 |
| Кролик против PAX6 | Novus Biologicals | НБП1-89100 | РРИД:AB_11013575 | 1:300 |
| Кролик анти NeuN | Абкам | АБ104225 | РРИД:AB_10711153 | 1:300 |
| Козий анти-куриный Alexa Fluor 488 | Термо Фишер | А-11039 | РРИД:AB_142924 | 1:500 |
| Ослик против кролика Alexa Fluor 555 | Термо Фишер | А-31572 | РРИД:AB_162543 | 1:500 |
Таблица 4: Антитела, используемые для иммунофлуоресцентного окрашивания.
Дополнительный рисунок S1: Определение границы VZ/SVZ в церебральных органоидах электропорированных приматов. Двойная иммунофлуоресценция для PAX6 (пурпурный) и TUJ1 (желтый) в сочетании с окрашиванием DAPI (голубой) церебрального органоида мартышки 32 dps через 2 дня после электропорации плазмидой, экспрессирующей GFP. Иммунофлюоресценция при ГФП не показана. Светло-серые пунктирные линии обозначают границу между ВЗ и зоной, обогащенной СВЗ/нейронами. Изображения были получены с помощью конфокального микроскопа Zeiss LSM 800 с 20-кратным объективом. Масштабная линейка = 100 мкм. Сокращения: DAPI = 4',6-диамидино-2-фенилиндол; dps = дни после посева; PAX6 = парный белок коробки 6; СВЗ = субвентрикулярная зона; TUJ1 = β-тубулин III класса; VZ = желудочковая зона. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Инструкция по сборке электропорационной камеры чашки Петри. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Описанные здесь процедуры представляют собой унифицированный протокол генерации церебральных органоидов от разных видов приматов с целевым электропорационным подходом. Это позволяет эктопическую экспрессию ГОИ в модельной системе, которая имитирует (в том числе человека) (пато)физиологическое развитие неокортекса. Этот унифицированный протокол для генерации церебральных органоидов приматов использует одни и те же материалы (например, среды) и этапы протокола для всех четырех представленных видов приматов. Различия в развитии между этими видами устраняются путем изменения времени критических этапов протокола (т.е. нейронной индукции и встраивания в матрицу базальной мембраны; см. выше). Это может примерно отражать различия во времени развития нервной системы in vivo между этими видами и представляет собой интересную тему для дальнейших исследований.
Этот подход основан на экспериментах по электропорации, описанных в предыдущей статье о церебральных органоидах10. Однако эти эксперименты, как отмечают Ланкастер и его коллеги, были ограничены обширными степенями апоптоза, которые происходили из-за высокой концентрации GFP и приводили к исключению электропорированных клеток, демонстрирующих сильный сигнал GFP10. В наших экспериментах мы обнаружили, что конечная общая концентрация плазмиды (например, концентрация плазмиды, кодирующая EGFP, плюс концентрация плазмиды, кодирующая GOI) 1,000 нг / мкл была оптимальной. Концентрации ниже 1000 нг/мкл приводят к снижению эффективности электропорации, в то время как высокие концентрации выше 1000 нг/мкл могут быть токсичными для электропорированных клеток и приводить к гибели клеток10. Возможны исследования, объединяющие более двух различных экспрессионных плазмид28. Однако окончательная общая концентрация плазмиды должна поддерживаться на уровне 1000 нг / мкл.
В типичном подходе к электропорации плазмида, кодирующая флуоресцентный маркер, необходима для идентификации успешно электропорированных клеток. Существует две возможности включения флуоресцентного маркера в экспериментальную установку: (i) путем совместного введения двух отдельных плазмид (т.е. плазмиды, кодирующей маркер, плюс контрольная плазмида [например, пустой вектор] или плазмида, кодирующая интересующий ген [GOI]) ( подход с отдельными плазмидами); (ii) путем инъекции одной плазмиды, которая кодирует как маркер, так и GOI, с использованием внутреннего сайта входа рибосомы (IRES) или саморасщепляющегося пептида 2A (например, P2A) ( подход с одной плазмидой). В этом случае в качестве контроля используется плазмида, кодирующая исключительно маркер флуоресценции. В то время как одиночный плазмидный подход приводит к полной коэкспрессии маркера флуоресценции и GOI, такие плазмиды имеют большой размер, что приводит к низкой эффективности электропорации. Если требуется высокая эффективность электропорации, рекомендуется использовать подход отдельных плазмид, так как разделенная экспрессия не оказывает существенного влияния на уровень коэкспрессии маркера флуоресценции и ГОИ при сохранении высокой эффективности электропорации28. В представленном здесь протоколе мы описываем электропорацию с использованием подхода отдельных плазмид. Если применяется подход с одной плазмидой, шаги в протоколе должны быть соответствующим образом скорректированы.
По сравнению с недавно опубликованным протоколом37 наш подход имеет три основных преимущества. Во-первых, мы специально нацелены на желудочкоподобные структуры церебрального органоида. Мы достигаем этого (i) путем микроинъекции отдельных желудочкоподобных структур церебрального органоида вместо инъекции в центр органоида 37 и (ii) путем организации ориентации церебрального органоида в электродной камере чашки Петри для оптимизации направления электрического поля (см. выше) вместо использования кюветы37 для электропорации. Во-вторых, этот протокол не предполагает использования дорогостоящего раствора нуклеофектора, поскольку в этом подходе используется электропоратор прямоугольной формы в сочетании с электродной камерой чашки Петри. В-третьих, этот унифицированный протокол генерации церебральных органоидов приматов позволяет изучать не только человеческие, но и нечеловеческие органоиды приматов, что позволяет проводить эволюционные, сравнительные и болезнетворные исследования.
Две особенности, касающиеся церебральных органоидов, имеют решающее значение для успешной электропорации: качество церебральных органоидов, а также размер и качество желудочкоподобных структур (см. репрезентативные результаты и рис. 1B). Что касается первой функции, мы представляем критерии «идти» и «нет» (см. выше и рис. 1B) для продолжения электропорации. Основным критерием является наличие хорошо видимых, полупрозрачных и радиально организованных желудочкоподобных структур. Размер желудочкоподобных структур является вторым важным признаком для успешной микроинъекции и электропорации. Слишком маленькие желудочкоподобные структуры трудно вводить и, как правило, не дают достаточно большого количества электропорированных клеток для последующих анализов. Это основная причина, по которой мы использовали модифицированный церебральный органоидный протокол, поскольку этот протокол в наших руках и для этих линий iPSC производит, по сравнению с другими протоколами, хорошо организованные желудочкоподобные структуры, которые достаточно велики для электропорации. В принципе, подход к электропорации, представленный здесь, может быть применен к любому другому протоколу нейронных органоидов, если последний дает достаточно большие и организованные желудочкоподобные структуры (см. репрезентативные результаты и рис. 1B). Более того, этот протокол может быть применен и к другим приматам в будущем, таким как макака-крабоед (Macaca fascicularis), классическая модель приматов, используемая в промышленных исследованиях. Это потребовало бы либо идентификации правильных критических временных точек (см. выше) модифицированного протокола церебральных органоидов, описанного здесь, либо создания протокола нейронных органоидов, который приводит к появлению подходящих структур больших желудочков (см. выше).
После успешной электропорации церебральные органоиды могут быть дополнительно культивированы в течение различных периодов времени, чтобы позволить исследуемой генетической модификации влиять на различные клеточные популяции в развивающемся церебральном органоиде. Они варьируются от различных популяций нейронных предшественников до различных типов нейронов, присутствующих в церебральном органоиде (см. репрезентативные результаты и Fischer et al.28). Затем эти клеточные популяции могут быть проанализированы либо криосекцией и иммунофлуоресцентным окрашиванием (см. рис. 4), либо иммунофлуоресцентным окрашиванием и оптической очисткой (см. рис. 5 и видео 1) электропорированных церебральных органоидов головного мозга, фиксированных PFA.
До сих пор электропорация органоидов мозга в основном использовалась для эктопической экспрессии генов для выполнения исследований функции генов 10,28,38,39, визуализации в реальном времени 10,39,40, визуализации морфологииклеток 40 и отслеживания деления клеток 10. Однако в первой статье о церебральных органоидах шРНК была введена в органоиды путем электропорации, чтобы подавить экспрессию генов посредством РНК-интерференции. Это показало, что электропорация может быть использована не только для эктопической экспрессии генов, но и для KD или даже KO генов. Недавно было показано, что CRISPR/Cas9-опосредованные КО могут быть достигнуты путем внутриутробной электропорации эмбрионовмышей 27 и электропорации тканей плода человека ex vivo41. Такие КО на основе CRISPR/Cas9 могут быть легко применены к электропорации церебральных органоидов, поскольку основной механизм электропорации одинаков, и это еще больше расширит полезность этого подхода.
Одним из потенциальных дальнейших применений электропорации в церебральных органоидах является спасение специфических фенотипов КО в тех случаях, когда невозможно получить специфический КО ГОИ из-за очень похожих последовательностей между ГОИ и его предковыми версиями. Это особенно относится к недавно эволюционировавшим генам, специфичным для человека. В таких случаях невозможно (даже с использованием технологии CRISPR/Cas9) получить специфический KO (как это было в случае с ARHGAP11A и ARHGAP11B28). Решение этой дилеммы состоит в том, чтобы создать двойной КО ГОИ и его предкового гена и спасти только ГОИ, только предковый ген или оба гена вместе с помощью электропорации. Эти электропорированные органоиды можно рассматривать как селективный предковый ген KO, селективный GOI KO или контроль, соответственно. Это позволило бы рассмотреть индивидуальный вклад этих генов в фенотип (см., например, Fischer et al.28). Другое потенциальное применение связано с анализом церебральных органоидов, полученных из ИПСК, полученных от пациентов. В таких случаях неясно, обусловлен ли наблюдаемый фенотип мутацией в гене-кандидате или какой-либо другой мутацией, присутствующей у пациента. Здесь электропорация гена-кандидата и (потенциальное) спасение фенотипа позволили бы подтвердить роль этого гена в заболевании (см., например, Lancaster et al.10).
Взятые вместе, представленный здесь протокол предлагает быстрый и экономичный подход к генетической модификации клеточных популяций в желудочковых структурах церебральных органоидов приматов. Это обеспечивает эффективный инструмент для изучения процессов развития нервной системы и эволюции, который также может быть применен для моделирования заболеваний.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы приносим извинения всем исследователям, чьи работы не могли быть процитированы из-за нехватки места. Мы благодарим Ульриха Блейера (Ulrich Bleyer) из технической службы DPZ и Хартмута Вольфа (Hartmut Wolf) из цеха MPI-CBG за строительство электродных камер чашки Петри; Стоян Петков (Stoyan Petkov) и Рюдигер Бер (Rüdiger Behr) за обеспечение ИПСК человека (iLonza2.2), макак-резуса (iRh33.1) и мартышек (cj_160419_5); Сабрина Хайде для криосекции и иммунофлуоресцентного окрашивания; а также Неринге Лютикайте и Сезару Матео Бастидасу Бетанкуру за критическое прочтение рукописи. Работа в лаборатории W.B.H. была поддержана грантом ERA-NET NEURON (MicroKin). Работа в лаборатории М.Х. была поддержана стартовым грантом ERC (101039421).
Материалы
| Name | Company | Catalog Number | Comments |
| 20 µL Microloader | Eppendorf | 5242956003 | |
| 2-Mercaptoethanol | Merck | 8.05740.0005 | |
| 35 mm cell culture dishes | Sarstedt | 83.3900 | |
| 60 mm cell culture dishes | CytoOne | CC7682-3359 | |
| Activin A | Sigma-Aldrich | SRP3003 | |
| AOC1 | Selleckchem | S7217 | |
| Axio Observer.Z1 Inverted Fluorescence Microscope | Zeiss | replacable by comparable fluorescent microscopes | |
| AZD0530 | Selleckchem | S1006 | |
| B-27 Supplement with Vitamin A (retinoic acid, RA) (50x) | Gibco | 17504-044 | |
| B-27 Supplement without Vitamin A (50x) | Gibco | 12587-010 | |
| BTX ECM 830 Square Wave Electroporation System | BTX | 45-2052 | |
| CGP77675 | Sigma-Aldrich | SML0314 | |
| Chimpanzee induced pluripotent stem cell line Sandra A | doi: 10.7554/elife.18683 | ||
| Common marmoset induced pluripotent stem cell line cj_160419_5 | doi: 10.3390/cells9112422 | ||
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Gibco | 11320-033 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Gibco | 14190-094 | pH 7.0−7.3; warm to room temperature before use |
| Fast Green | Sigma-Aldrich | F7252-5G | |
| Forskolin | Selleckchem | 2449 | |
| GlutaMAX Supplement (100x) | Gibco | 35050-061 | glutamine substitute supplement |
| Heparin (1 mg/mL stock) | Sigma-Aldrich | H3149 | |
| Human induced pluripotent stem cell line iLonza2.2 | doi: 10.3390/cells9061349 | ||
| Human Neurotrophin-3 (NT-3) | PeproTech | 450-03 | |
| Insulin | Sigma-Aldrich | 19278 | |
| IWR1 | Sigma-Aldrich | I0161 | |
| Leica MS5 stereomicroscope (MDG 17 transmitted-light base) | Leica | 10473849 | replacable by comparable stereomicroscopes |
| Matrigel | Corning | 354277/354234 | basement membrane matrix; alternatively, Geltrex (ThermoFisher Scientific, A1413302) can be used |
| MEM Non-Essential Amino Acids Solution (100x) | Sigma-Aldrich | M7145 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Paraformaldehyde | Merck | 818715 | handle with causion due to cancerogenecity |
| Penicillin/Streptomycin (10,000 U/mL) | PanBiotech | P06-07100 | |
| Petri dish electrode chamber | self-produced (see Supplemental File 1) | also commertially available | |
| Pre-Pulled Glass Pipettes | WPI | TIP10LT | borosilicate glass pipettes with long taper, 10 µm tip diameter |
| Pro-Survival Compound | MerckMillipore | 529659 | |
| Recombinant Human/Murine/RatBrain-Derived Neurotrophic Factor (BDNF) | PeproTech | AF-450-02 | |
| Rhesus macaque induced pluripotent stem cell line iRh33.1 | doi: 10.3390/cells9061349 | ||
| StemMACS iPS-Brew XF | Miltenyi Biotech | 130-104-368 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | proteolytic and collagenolytic enzyme mixture |
| TrypLE | Gibco | 12604-013 | recombinant trypsin substitute; warm to room temperature before use |
| Ultra-Low Attachment 96-well plates | Costar | 7007 | |
| Y27632 | Stemcell Technologies | 72305 |
Ссылки
- Marchetto, M. C. N., Winner, B., Gage, F. H. Pluripotent stem cells in neurodegenerative and neurodevelopmental diseases. Human Molecular Genetics. 19 (R1), R71-R76 (2010).
- Zhao, X., Bhattacharyya, A. Human models are needed for studying human neurodevelopmental disorders. The American Journal of Human Genetics. 103 (6), 829-857 (2018).
- Zhang, W., et al. Modeling microcephaly with cerebral organoids reveals a WDR62–CEP170–KIF2A pathway promoting cilium disassembly in neural progenitors. Nature Communications. 10 (1), 2612(2019).
- Sasaki, E., et al. Generation of transgenic non-human primates with germline transmission. Nature. 459 (7246), 523-527 (2009).
- Niu, Y., et al. Transgenic rhesus monkeys produced by gene transfer into early-cleavage–stage embryos using a simian immunodeficiency virus-based vector. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17663-17667 (2010).
- Niu, Y., et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell. 156 (4), 836-843 (2014).
- Shi, L., et al. Transgenic rhesus monkeys carrying the human MCPH1 gene copies show human-like neoteny of brain development. National Science Review. 6 (3), 480-493 (2019).
- Heide, M., et al. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science. 369 (6503), 546-550 (2020).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell–derived neocortex. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20284-20289 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Kelava, I., Lancaster, M. A. Stem cell models of human brain development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Lullo, E. D., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Arlotta, P. Organoids required! A new path to understanding human brain development and disease. Nature Methods. 15 (1), 27-29 (2018).
- Heide, M., Huttner, W. B., Mora-Bermúdez, F. Brain organoids as models to study human neocortex development and evolution. Current Opinion in Cell Biology. 55, 8-16 (2018).
- Qian, X., Song, H., Ming, G. Brain organoids: Advances, applications and challenges. Development. 146 (8), dev166074(2019).
- Sun, N., Meng, X., Liu, Y., Song, D., Jiang, C., Cai, J. Applications of brain organoids in neurodevelopment and neurological diseases. Journal of Biomedical Science. 28 (1), 30(2021).
- Fischer, J., Heide, M., Huttner, W. B. Genetic modification of brain organoids. Frontiers in Cellular Neuroscience. 13, 558(2019).
- Pașca, S. P., et al. A nomenclature consensus for nervous system organoids and assembloids. Nature. 609 (7929), 907-910 (2022).
- Kyrousi, C., Cappello, S. Using brain organoids to study human neurodevelopment, evolution and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 9 (1), e347(2020).
- Teriyapirom, I., Batista-Rocha, A. S., Koo, B. -K. Genetic engineering in organoids. Journal of Molecular Medicine. 99 (4), 555-568 (2021).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Kawasaki, H., Toda, T., Tanno, K. In vivo genetic manipulation of cortical progenitors in gyrencephalic carnivores using in utero electroporation. Biology Open. 2 (1), 95-100 (2012).
- Kawasaki, H., Iwai, L., Tanno, K. Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Molecular Brain. 5 (1), 24(2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nature Neuroscience. 6 (12), 1277-1283 (2003).
- Kalebic, N., et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO reports. 17 (3), 338-348 (2016).
- Fischer, J., et al. Human-specific ARHGAP11B ensures human-like basal progenitor levels in hominid cerebral organoids. EMBO Reports. 23 (11), e54728(2022).
- Stauske, M., et al. Non-human primate iPSC generation, cultivation, and cardiac differentiation under chemically defined conditions. Cells. 9 (6), 1349(2020).
- Mora-Bermúdez, F., et al. Differences and similarities between human and chimpanzee neural progenitors during cerebral cortex development. eLife. 5, e18683(2016).
- Petkov, S., Dressel, R., Rodriguez-Polo, I., Behr, R. Controlling the switch from neurogenesis to pluripotency during marmoset monkey somatic cell reprogramming with self-replicating mRNAs and small molecules. Cells. 9 (11), 2422(2020).
- Camp, J. G., et al. Human cerebral organoids recapitulate gene expression programs of fetal neocortex development. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15672-15677 (2015).
- Kanton, S., et al. Organoid single-cell genomic atlas uncovers human-specific features of brain development. Nature. 574 (7778), 418-422 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Cakir, B., et al. Engineering of human brain organoids with a functional vascular-like system. Nature Methods. 16 (11), 1169-1175 (2019).
- Masselink, W., et al. Broad applicability of a streamlined ethyl cinnamate-based clearing procedure. Development. 146 (3), dev166884(2019).
- Denoth-Lippuner, A., Royall, L. N., Gonzalez-Bohorquez, D., Machado, D., Jessberger, S. Injection and electroporation of plasmid DNA into human cortical organoids. STAR Protocols. 3 (1), 101129(2022).
- Denoth-Lippuner, A., et al. Visualization of individual cell division history in complex tissues using iCOUNT. Cell Stem Cell. 28 (11), 2020.e12-2034.e12 (2021).
- Kelava, I., Chiaradia, I., Pellegrini, L., Kalinka, A. T., Lancaster, M. A. Androgens increase excitatory neurogenic potential in human brain organoids. Nature. 602 (7895), 112-116 (2022).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Kalebic, N., et al. Neocortical expansion due to increased proliferation of basal progenitors is linked to changes in their morphology. Cell Stem Cell. 24 (4), 535.e9-550.e9 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены