Method Article
유전자 변형을 위한 영장류 대뇌 오가노이드의 표적 미세주입 및 전기천공
요약
영장류 대뇌 오가노이드의 전기천공법은 영장류(병리)생리학적 신피질 발달에 가까운 모델 시스템에서 다양한 전구체 유형과 뉴런에 일시적인 유전자 변형을 도입하는 정확하고 효율적인 접근 방식을 제공합니다. 이를 통해 신경 발달 및 진화 과정을 연구 할 수 있으며 질병 모델링에도 적용 할 수 있습니다.
초록
대뇌 피질은 가장 바깥쪽 뇌 구조이며 감각 입력 및 운동 출력 처리를 담당합니다. 그것은 포유류, 특히 영장류에서 고차원인지 능력의 자리로 간주됩니다. 영장류의 뇌에서 유전자 기능을 연구하는 것은 기술적, 윤리적 이유로 인해 어려운 일이지만, 뇌 오가노이드 기술의 확립은 전통적인 영장류 모델(예: 붉은털 원숭이 및 일반 마모셋)뿐만 아니라 이전에는 실험적으로 접근할 수 없었던 영장류 종(예: 유인원)에서 윤리적으로 정당하고 기술적으로 덜 까다로운 시스템. 또한, 인간의 뇌 오가노이드는 신경 발달 및 신경 장애에 대한 고급 조사를 가능하게 합니다.
뇌 오가노이드는 뇌 발달의 많은 과정을 요약하기 때문에 진화적 맥락에서 다양한 종의 뇌 발달의 기초가 되는 유전적 결정 요인의 차이점을 식별하고 기능적으로 비교할 수 있는 강력한 도구이기도 합니다. 오가노이드 사용의 가장 큰 장점은 유전자 기능을 테스트할 수 있는 유전자 변형을 도입할 수 있다는 것입니다. 그러나 이러한 수정의 도입은 힘들고 비용이 많이 듭니다. 이 논문은 뇌 오가노이드의 하위 유형인 영장류 대뇌 오가노이드의 심실과 같은 구조 내에서 세포 집단을 유전적으로 변형하는 빠르고 비용 효율적인 접근 방식을 설명합니다. 이 방법은 인간, 침팬지, 붉은털원숭이 및 일반 마모셋 유래 유도만능줄기세포(iPSC)에서 대뇌 오가노이드의 안정적인 생성을 위한 수정된 프로토콜을 미세주입 및 전기천공 접근법과 결합합니다. 이것은 질병 모델링에도 적용할 수 있는 신경 발달 및 진화 과정 연구를 위한 효과적인 도구를 제공합니다.
서문
대뇌 피질의 (병리) 생리적 발달과 진화를 조사하는 것은 적절한 모델 시스템의 부족으로 인해 방해받는 엄청난 작업입니다. 이전에는 이러한 연구가 2차원 세포 배양 모델(예: 1차 신경 전구체 또는 신경 세포 배양)과 진화적으로 멀리 떨어진 동물 모델(예: 설치류)에 국한되었습니다1,2. 이러한 모델은 특정 질문을 해결하는 데 유용하지만 건강 및 질병 상태에서 발달 중인 인간 신피질의 복잡성, 세포 유형 구성, 세포 구조 및 유전자 발현 패턴을 모델링하는 데는 제한적입니다. 이러한 제한은 예를 들어 소두증의 특정 사례에 대해 설명된 바와 같이 인간 질병의 마우스 모델을 인간 상황에 대한 열악한 번역 가능성으로 이끕니다(예: Zhang et al.3). 최근에, 인간 신피질 발달의 진화학적, 기능적, 형태학적으로 더 가까운 모델인 형질전환 비인간 영장류가 세포 배양 및 설치류 기반 모델의 많은 한계를 극복함에따라 4,5,6,7,8에 초점이 맞춰졌습니다. 그러나 연구에 인간이 아닌 영장류를 사용하는 것은 비용과 시간이 많이 소요될 뿐만 아니라 윤리적 문제를 제기합니다. 보다 최근에, 뇌 오가노이드 기술(9,10)의 개발은 이전 모델(11,12,13,14,15,16)의 많은 한계를 해결하는 유망한 대안으로 부상했다.
뇌 오가노이드는 정의된 발달 시간 창 11,12,13,14,17 동안 하나 또는 여러 뇌 영역의 세포 구조 및 세포 유형 구성의 주요 특징을 모방하는 3차원(3D) 다세포 구조입니다. 이러한 3D 구조는 유도만능줄기세포(iPSC) 또는 관심 종에 사용할 수 있는 경우 배아 줄기 세포(ESC)에서 생성됩니다. 일반적으로, 두 종류의 뇌 오가노이드가 사용된 방법론에 기초하여 구별될 수 있다: 비유도 및 국소화된(guided) 뇌 오가노이드18. 후자의 유형의 오가노이드를 생성할 때, 만능 줄기 세포를 특정 뇌 영역의 오가노이드(예: 전뇌 오가노이드)로 분화시키는 것을 안내하는 소분자 또는 인자가 제공됩니다18. 대조적으로, 유도되지 않은 오가노이드에서 분화는 작은 분자의 추가에 의해 유도되는 것이 아니라 iPSC/ESC의 자발적인 분화에만 전적으로 의존합니다. 생성된 뇌 오가노이드는 서로 다른 뇌 영역(예: 대뇌 오가노이드)을 나타내는 세포 유형으로 구성됩니다18. 뇌 오가노이드는 뇌 발달의 많은 주요 특징과 iPSC 또는 ESC를 사용할 수 있는 모든 관심 종에서 상대적으로 비용 및 시간 효율적인 생성을 결합합니다11,12,13,14. 따라서 뇌 오가노이드는 진화 및 발달 문제에서 질병 모델링 및 약물 테스트에 이르기까지 다양한 종류의 신경생물학적 연구를 위한 훌륭한 모델이 됩니다15,16. 그러나 뇌 오가노이드를 사용하여 이러한 문제를 해결하는 것은 유전자 변형을 위한 다양한 방법의 가용성에 크게 의존합니다.
신피질(병리)생리학적 발달과 그 진화를 연구하는 한 가지 핵심 측면은 유전자와 유전자 변이체의 기능적 분석입니다. 이것은 일반적으로 (이소성) 발현 및/또는 해당 유전자의 녹다운(KD) 또는 녹아웃(KO)에 의해 달성됩니다. 이러한 유전자 변형은 안정적이고 일시적인 유전자 변형뿐만 아니라 시간적 및 공간적으로 제한되거나 제한되지 않는 변형으로 분류될 수 있습니다. 안정적인 유전자 변형은 모든 후속 세포 세대에 전달되는 숙주 게놈에 유전적 변형을 도입하는 것으로 정의됩니다. 유전자 변형의 시점에 따라 오가노이드의 모든 세포에 영향을 미치거나 특정 세포 집단으로 제한될 수 있습니다. 가장 빈번하게, 렌티바이러스, 트랜스포존 유사 시스템 및 CRISPR/Cas9 기술을 적용하여 iPSC/ESC 수준에서 뇌 오가노이드에서 안정적인 유전자 변형이 달성됩니다(예: Fischer et al.17, Kyrousi et al.19 및 Teriyapirom et al.20). 이것은 뇌 오가노이드의 모든 세포가 유전자 변형을 가지고 있으며 시간적으로나 공간적으로 제한되지 않는다는 장점이 있습니다. 그러나 이러한 안정적인 iPSC/ESC 라인의 생성 및 특성화는 매우 시간이 많이 소요되며, 첫 번째 변형된 뇌 오가노이드를 분석할 수 있을 때까지 종종 몇 개월이 걸립니다(예: Fischer et al.17, Kyrousi et al.19 또는 Teriyapirom et al.20에 의해 검토됨).
대조적으로, 일시적인 유전자 변형은 숙주 게놈 내로 통합되지 않는 유전자 화물(예를 들어, 유전자 발현 플라스미드)의 전달에 의해 정의된다. 이 변형은 원칙적으로 후속 세포 세대로 전달될 수 있지만, 전달된 유전 화물은 각 세포 분열에 따라 점진적으로 희석됩니다. 따라서 이러한 유형의 유전자 변형은 일반적으로 시간적, 공간적으로 제한됩니다. 일시적인 유전자 변형은 아데노 관련 바이러스 또는 전기천공에 의해 뇌 오가노이드에서 수행될 수 있으며(예: Fischer et al.17, Kyrousi et al.19 및 Teriyapirom et al.20에 의해 검토됨), 후자는 이 기사에서 자세히 설명합니다. 안정적인 유전자 변형과 달리 이 접근 방식은 매우 빠르고 비용 효율적입니다. 실제로, 전기천공은 몇 분 이내에 수행될 수 있으며, 표적 세포 집단에 따라 전기천공된 오가노이드는 수일 이내에 분석 준비가 완료됩니다(예: Fischer et al.17 및 Kyrousi et al.19에 의해 검토됨). 그러나 크기의 차이와 같은 뇌 오가노이드의 전체적인 형태학적 변화는 이러한 유형의 유전자 변형이 시간적, 공간적으로 제한되기 때문에 이 방법을 사용하여 감지할 수 없습니다. 이러한 제한은 예를 들어 오가노이드 내의 개별 세포 집단을 연구하거나 특정 발달 시점에서 뇌 오가노이드에 미치는 영향을 연구하는 경우에도 이점이 될 수 있습니다(예: Fischer et al.17 및 Kyrousi et al.19에 의해 검토됨).
뇌 발달과 진화 과정에서 유전자 기능을 연구하는 고전적인 접근 방식은 자궁 전기 천공법입니다. 자궁 내 전기천공은 설치류 21,22,23 및 흰 족제비24,25 뇌에 유전자 발현 구조를 전달하는 데 잘 알려져 있고 유용한 기술입니다. 먼저, 관심있는 발현 구조체를 함유하는 용액을 자궁벽을 통해 표적화 할 영역에 따라 배아 뇌의 특정 심실에 미세 주입합니다. 두 번째 단계에서는 전기 펄스를 적용하여 표적 심실을 직접 감싸는 세포를 transfection합니다. 이 접근법은 이소성 발현 또는 유전자의 과발현에만 국한되지 않고 짧은 헤어핀(shRNA) 또는 CRISPR/Cas9(발현 플라스미드 또는 리보핵단백질[RNP]의 형태)를 각각 미세 주입하여 KD 또는 KO 연구에도 적용할 수 있습니다26,27. 그러나 마우스, 쥐 및 흰 족제비 배아의 자궁 내 전기천공법은 이러한 동물 모델에 대해 위에서 설명한 것과 동일한 한계를 가지고 있습니다.
이상적으로는 영장류 에서 직접 자궁 전기 천공을 수행하고 싶습니다. 이것은 원칙적으로 기술적으로 가능하지만 자궁 내 전기 천공은 윤리적 문제, 높은 동물 유지 비용 및 작은 깔짚 크기로 인해 영장류에서 수행되지 않습니다. 유인원(인간 포함)과 같은 특정 영장류의 경우 이것은 전혀 불가능합니다. 그러나 이 영장류는 인간의 (병리)생리학적 신피질 발달과 그 진화를 연구할 수 있는 가장 큰 잠재력을 가지고 있습니다. 이 딜레마에 대한 한 가지 해결책은 영장류 뇌 오가노이드에 전기천공 기술을 적용하는 것이다28.
이 논문은 영장류 뇌 오가노이드의 아형인 영장류 대뇌 오가노이드의 전기천공을 위한 프로토콜을 제시합니다. 이 접근법은 오가노이드의 심실과 같은 구조 내에서 세포 집단의 빠르고 비용 효율적인 유전자 변형을 가능하게 합니다. 구체적으로, 우리는 인간(호모 사피엔스), 침팬지(Pan troglodytes), 붉은털 원숭이(Macaca mulatta) 및 일반 마모셋(Callithrix jacchus) iPSC에서 영장류 대뇌 오가노이드를 생성하기 위한 통합 프로토콜을 설명합니다. 또한, 우리는 미세주입 및 전기천공 기술을 자세히 설명하고 영장류 대뇌 오가노이드 전기천공을 수행하기 위한 "이동" 및 "금지" 기준을 제공합니다. 이 접근법은 특히 인간 상황에 가까운 모델에서 (병리) 생리적 신피질 발달과 그 진화를 연구하는 데 효과적인 도구입니다.
프로토콜
1. 영장류 iPSC의 배양
참고: 견고성으로 인해 여기에 제시된 방법은 모든 영장류 iPSC 라인에 적용할 수 있습니다. 이 글에서는 인간(iLonza2.2)29, 침팬지(Sandra A)30, 붉은털원숭이(iRh33.1)29 및 일반적인 마모셋(cj_160419_5)31 iPSC 계통의 대뇌 오가노이드 생산에 대해 설명합니다. 배양 조건은 표 1에 요약되어 있다. 이 프로토콜에 사용된 모든 재료, 시약 및 장비와 관련된 자세한 내용은 재료 표를 참조하십시오.
- 각 iPSC를 배양하려면 원래 설명된 배양 조건을 따르십시오. 일반적으로 대뇌 오가노이드의 성공적인 생성 및 전기천공을 위해서는 90계대 이상 배양되지 않은 iPSC 라인을 사용합니다. 또한 대뇌 오가노이드 생성 시작 시 iPSC가 분화의 징후 없이 만능의 특징을 나타내는지 확인합니다.
2. 영장류 iPSC에서 대뇌 오가노이드 생성
참고: 대뇌 오가노이드 생성을 위한 프로토콜은 원래 대뇌 오가노이드 프로토콜 10,34의 수정된 버전 28,30,32,33을 기반으로 하며 일부 종별 수정(아래 자세히 설명)이 있습니다.
- 배아체(EB)를 생성하기 위한 iPSC 시드
- iPSC가 80%-90% 밀도에 도달하면 Dulbecco의 인산염 완충 식염수(DPBS)로 세척하고 500μL의 재조합 트립신 대체물 또는 1mL의 단백질 분해 및 콜라겐 분해 혼합물을 추가합니다.
참고: 일반적으로 iPSC는 60mm 세포 배양 접시에서 배양하여 약 900,000개의 세포를 얻으며, 이는 96개의 대뇌 오가노이드를 생성하기에 충분합니다. 세포 번호는 필요한 오가노이드의 수에 따라 조정할 수 있습니다. 생성된 모든 대뇌 오가노이드가 전기천공에 적합한 것은 아닙니다. - 접시를 37°C에서 2분 동안 배양하여 세포를 분리합니다.
참고: 사용된 iPSC 라인 또는 효소에 따라 2°C에서 최대 37분의 추가 배양이 필요할 수 있습니다. 세포가 분리되기 시작했는지 확인하기 위해 현미경으로 접시를 검사하는 것이 좋습니다. - 예열된(37°C) iPSC 배양액 1.5mL를 첨가하여 반응을 중지하고, 7x-10x(10x 이하)의 상하로 피펫팅하여 세포 배양 접시로부터 세포를 해리시키고 단일세포 현탁액을 얻었다.
- 세포 현탁액을 15 mL 원추형 원심분리 튜브로 옮기고, 실온에서 5분 동안 200 × g 에서 세포를 원심분리한다.
- 상청액을 흡인하고 50μM Y27632 또는 50μM 생존 촉진 화합물이 보충된 iPSC 배양 배지 2mL에 펠릿을 재현탁합니다.
- 10 μL의 세포 현탁액을 사용하여 Neubauer 챔버를 사용하여 세포를 계수합니다.
- 50μM Y27632 또는 50μM 생존 촉진 화합물이 보충된 iPSC 배양 배지를 사용하여 세포 현탁액을 150μL(60,000세포/mL)당 9,000개 세포 농도로 조정합니다.
- 배아체(EB)를 생성하기 위해, 150 μL의 세포 현탁액을 초저 부착 96-웰 플레이트의 각 웰에 시딩한다. 피펫팅하는 동안 세포 현탁액이 들어 있는 튜브를 부드럽게 흔들 어 세포가 침전되는 것을 방지합니다.
- EB를 37°C에서 5%CO2 및 95% 공기의 가습된 분위기에서 배양합니다(파종 후 0일[dps]). 시드 후 처음 24시간 이내에 EB를 방해하지 마십시오.
참고: 마모셋 iPSC에서 생성된 EB는 37°C의 저산소 조건(5% CO 2, 5% O 2 및 90% N 2) 하에서 가습된 분위기에서 배양해야 합니다. - ~48시간(2dps) 후 배지를 Y27632/pro-survival 화합물이 없는 iPSC 배양 배지로 변경합니다. 웰 당 100 μL의 배지를 제거하고, Y27632 없이 150 μL의 예열된(37 °C) 신선한 배지를 추가한다. 행별로 이동하십시오.
- 격일로 추가 매체 변경을 수행하십시오. 각 웰에서 150 μL의 배지를 제거하고, 웰당 Y27632/프로 서바이벌 화합물이 없는 150 μL의 예열된(37 °C) 신선한 배지를 추가한다.
참고: 4-5dps 후에 EB의 주변이 반투명해져야 합니다.
- iPSC가 80%-90% 밀도에 도달하면 Dulbecco의 인산염 완충 식염수(DPBS)로 세척하고 500μL의 재조합 트립신 대체물 또는 1mL의 단백질 분해 및 콜라겐 분해 혼합물을 추가합니다.
- 신경 외배엽의 유도
참고: 일반적으로 양질의 EB는 이 단계에서 부드러운 윤곽과 반투명 테두리를 가져야 합니다. 신경 유도의 시점은 영장류 종과 iPSC 계통 간에 약간 다릅니다. 여기에 사용된 세포주의 경우(섹션 1 및 재료 표 참조), 마모셋 EB에 대한 신경 유도는 일반적으로 EB의 상태에 따라 4dps, 붉은털 원숭이의 경우 5dps, 인간 및 침팬지 EB의 경우 4-5dps(그림 1A)에서 시작해야 합니다(그림 1A).- 96-웰 플레이트의 첫 번째 행의 각 웰로부터 150 μL의 배지를 제거하고, 동일한 행에 웰 당 150 μL의 예열된(37°C) 신경 유도 배지 ( 표 2 참조)를 추가한다.
- 전체 96-웰 플레이트에 대해 행별로 전술한 바와 같이 배지를 계속 변경한다. 각 웰에서 150 μL의 NIM을 제거하고 150 μL의 예열된(37 °C) 신선한 NIM을 추가하여 격일로 추가 신경 유도 배지(NIM) 변경을 수행합니다.
참고: 이 시점부터 마모셋 EB는 다른 영장류 EB와 동일한 조건(37°C에서 5%CO2 및 95% 공기의 가습 분위기)에서 배양해야 합니다.
- 기저막 매트릭스에 매립
참고: EB가 표면에 뚜렷하고 반투명하며 방사상으로 조직된 신경상피를 발달시키면 심실과 같은 구조의 발달을 위해 구조적 지원이 제공되어야 합니다. 이것은 EB를 기저막 매트릭스에 내장함으로써 달성됩니다. 발달 속도의 차이로 인해 마모셋과 붉은털원숭이 EB는 이미 7dps로 임베딩할 준비가 되어 있는 반면 인간과 침팬지 EB는 일반적으로 8-9dps로 임베딩할 준비가 되어 있습니다. 단순화를 위해, 기저막 매트릭스는 이 프로토콜에서 Matrigel만을 지칭한다. 그러나 Geltrex는 대체품으로 사용할 수 있습니다.- 임베딩을 준비하기 위해 UV 살균 가위, 집게, 0.2mL 튜브용 소형 랙, 층류 후드 아래에서 70%(vol/vol) 에탄올로 처리된 3-6개의 정사각형 파라필름을 15분 동안 처리합니다. 기저막 매트릭스를 얼음에서 몇 시간 동안 해동시키십시오(~1.5mL의 기저막 매트릭스는 일반적으로 96EB에 충분합니다).
알림: 기저막 매트릭스는 항상 얼음 위에 두십시오. - 파라 필름에 4 x 4 딤플 그리드를 만듭니다. 종이로 덮인 면이 위를 향하도록 0.2mL 튜브 랙에 파라필름 그리드를 놓고 장갑을 낀 손가락으로 랙의 각 구멍을 부드럽게 누릅니다.
- 종이를 제거하고 가위를 사용하여 파라필름 사각형에서 딤플 그리드를 잘라 60mm 세포 배양 접시에 맞도록 크기를 조정합니다. 딤플 파라필름을 0.2mL 튜브 랙에 다시 놓아 기저막 매트릭스 액적 생성을 위한 기초를 제공합니다.
- 절단된 200μL 피펫 팁이 있는 피펫을 사용하여 EB를 배양 접시의 웰에서 파라필름 딤플까지 차례로 조심스럽게 옮깁니다.
- 16개의 EB를 그리드로 이동한 후 새 200μL 피펫 팁을 가져와서 딤플에서 나머지 배지를 제거합니다.
- 하나의 EB가 들어 있는 각 딤플에 기저막 매트릭스 한 방울(~15μL)을 피펫팅합니다.
- 10μL 피펫 팁을 사용하여 액적 경계를 방해하지 않고 EB를 각 액적의 중앙으로 빠르게 이동합니다.
- 기저막 매트릭스 방울이 있는 딤플 파라필름을 60 mm 세포 배양 접시에 넣고, 매트릭스가 중합될 수 있도록 37°C에서 15-30분 동안 인큐베이션한다.
- 파라필름에서 매트릭스 내장 EB를 분리하려면 비타민 A가 없는 분화 배지(DM ) 5mL( 표 2 참조)를 접시에 넣고 집게를 사용하여 파라필름을 거꾸로 뒤집어 EB가 있는 면이 접시 바닥을 향하도록 합니다.
- 접시를 조심스럽게 흔들어 EB가 들어 있는 기저막 매트릭스 방울이 파라필름에서 분리되도록 합니다. 그들 중 일부가 여전히 붙어 있다면, 집게를 사용하여 파라 필름 사각형의 가장자리를 잡고 접시 중앙을 향해 여러 번 빠르게 굴립니다.
- 대뇌 오가노이드를 37°C에서 5%CO2 및 95% 공기의 가습 분위기에서 55 rpm으로 오비탈 쉐이커에서 배양한다. 격일로 중간 정도의 변화로 비타민 A없이 DM에 보관하십시오. 뉴런 생성을 유도하려면 마모셋 및 붉은털원숭이 대뇌 오가노이드의 경우 13dps 또는 인간 및 침팬지 대뇌 오가노이드의 경우 14-15dps 후에 비타민 A(레티노산, RA)가 포함된 DM으로 전환합니다(그림 1A). 이 시점부터 3-4 일마다 매체를 교체하십시오.
참고: 신경 생존을 지원하기 위해 비타민 A가 함유된 DM에 20μg/mL의 인간 뉴로트로핀 3(NT3), 20μg/mL의 뇌 유래 신경영양 인자(BDNF) 및 40dps부터 1μL/mL의 기저막 기질을 보충할 수 있습니다.
- 임베딩을 준비하기 위해 UV 살균 가위, 집게, 0.2mL 튜브용 소형 랙, 층류 후드 아래에서 70%(vol/vol) 에탄올로 처리된 3-6개의 정사각형 파라필름을 15분 동안 처리합니다. 기저막 매트릭스를 얼음에서 몇 시간 동안 해동시키십시오(~1.5mL의 기저막 매트릭스는 일반적으로 96EB에 충분합니다).
3. 영장류 대뇌 오가노이드의 전기천공법
참고: 기술적인 관점에서 대뇌 오가노이드의 전기천공은 심실과 같은 구조가 미세주입의 표적이 될 만큼 충분히 뚜렷해지자마자 수행될 수 있습니다. 최적의 전기천공 시간 창은 생물학적 질문과 관심 있는 세포 집단에 따라 다릅니다. 예를 들어, 정점 전구체(AP)가 주요 표적인 경우 약 30dps의 대뇌 오가노이드가 이미 적합합니다. 기저 전구체(BP) 또는 뉴런이 주요 표적인 경우 50dps 이상의 오래된 대뇌 오가노이드를 사용해야 합니다(예: Fischer et al.28 참조).
- 전기천공 설정 준비
참고: 전기천공 효율은 전기천공된 플라스미드의 크기와 농도에 크게 영향을 받습니다(자세한 내용은 논의 섹션 참조).- 대조군 및 관심 유전자(GOI)를 위한 충분한 양의 전기천공 혼합물, 예를 들어 각 대조군 및 GOI에 대해 10μL의 전기천공 혼합물을 준비하여 조건당 약 30개의 대뇌 오가노이드를 전기천공합니다.
참고: 전기천공 혼합물의 조성은 표 3을 참조하십시오. - 비타민 A와 함께 예열(비멸균) Dulbecco's modified Eagle 배지/영양 혼합물 F-12(DMEM/F12) 및 DM을 37°C로 예열합니다. 작은 주걱과 가는 가위와 일반 가위를 준비하고 기구에 70%(vol/vol) 에탄올을 뿌립니다.
알림: DM에는 항생제가 포함되어 있으므로 다음 단계는 멸균 또는 비멸균 조건에서 수행할 수 있습니다( 표 2 참조). 우리의 경험에 비추어 볼 때, 무균 상태의 부재는 오염을 일으킨 적이 없습니다. - 35mm 세포 배양 접시를 준비하고 페트리 접시 전극 챔버를 전기 구멍 장치에 연결합니다.
참고: 페트리 접시 전극 챔버는 상업적으로 이용 가능합니다. 그러나 비용 효율적인 방법으로 쉽게 생산할 수 있습니다( 보충 파일 1 참조). - 마이크로로더 팁을 사용하여 미세주입 바늘에 각 전기천공 혼합물 8μL를 채웁니다. 안정적인 흐름을 얻기 위해 처음 사용하기 전에 가는 가위를 사용하여 바늘 끝을 자릅니다. 그러나 팁이 뭉툭하고 넓으면 오가노이드가 심하게 손상될 수 있으므로 팁의 작은 부분만 제거하십시오.
알림: 미세 주입 바늘은 미리 당겨진 미세 주사 바늘로 시판되거나 바늘 풀러를 사용할 수 있는 경우 실험실에서 뽑을 수 있습니다. 바늘 풀러 제조업체의 지침에 따라 긴 테이퍼와 10μm 팁 직경의 미세 주입 바늘을 생성하십시오.
- 대조군 및 관심 유전자(GOI)를 위한 충분한 양의 전기천공 혼합물, 예를 들어 각 대조군 및 GOI에 대해 10μL의 전기천공 혼합물을 준비하여 조건당 약 30개의 대뇌 오가노이드를 전기천공합니다.
- 미세주입 및 전기천공
- 현미경으로 테두리가 매끄럽고 심실과 같은 구조가 선명하게 보이는 5개의 대뇌 오가노이드를 선택합니다. 절단된 1,000μL 피펫 팁을 사용하여 예열된(37°C) DMEM/F12가 들어 있는 35mm 세포 배양 접시로 옮깁니다.
참고: 뚜렷하고 접근 가능한 심실과 같은 구조를 가진 대뇌 오가노이드를 선택하십시오( 그림 1B 참조). - 심실과 같은 구조를 주입하려면 바늘을 벽을 통해 조심스럽게 삽입하고 눈에 띄게 채워질 때까지 전기 천공 혼합물을 주입하십시오. 심실과 같은 구조가 파열되는 것을 방지하기 위해 과도한 압력을 가하지 마십시오. 이러한 방식으로 각 대뇌 오가노이드의 6-8개의 심실 유사 구조를 진행합니다.
알림: 미세주입 과정에서 바늘이 막히면 팁을 약간 다듬어야 합니다. - 미세주입된 대뇌 오가노이드 1개를 소량의 DMEM/F12와 함께 페트리 접시 전극실 로 옮깁니다. 미세 주입된 심실과 같은 구조의 표면이 전기천공기의 양극에 연결된 전극을 향하도록 오가노이드를 배열합니다.
참고: 이러한 방식으로 구조의 방향을 지정하면 세포가 인접한 구조의 영향을 받지 않는 심실과 같은 구조의 측면에서 형질감염됩니다. - 다음 설정을 사용하여 대뇌 오가노이드를 하나씩 전기천공합니다: 80V의 5펄스, 50ms의 펄스 지속 시간, 1초의 간격. 전기천공된 오가노이드를 예열된(37°C) DMEM/F12로 채워진 새로운 35mm 세포 배양 접시로 옮깁니다.
알림: electroporation 설정은 사용 가능한 구형파 electroporator에 따라 달라질 수 있습니다. 이러한 설정은 참조된 전기천공 시스템에 최적화되어 있습니다. 전압을 높이면 셀이 변위 될 수 있습니다. - 두 번째 전기천공 믹스(예: GOI)를 사용하여 다음 5개의 대뇌 오가노이드와 동일한 방식으로 진행합니다.
참고: 원하는 수의 전기천공된 대뇌 오가노이드에 도달할 때까지 3.2.1-3.2.5단계를 반복합니다. - 비멸균 조건에서 미세주입 및 전기천공을 수행한 경우, 전기천공된 오가노이드를 층류 후드 아래의 멸균 된 35mm 세포 배양 접시에 옮기면서 DMEM/F12를 새 세포 배양 접시로 최대한 적게 이동합니다.
- 현미경으로 테두리가 매끄럽고 심실과 같은 구조가 선명하게 보이는 5개의 대뇌 오가노이드를 선택합니다. 절단된 1,000μL 피펫 팁을 사용하여 예열된(37°C) DMEM/F12가 들어 있는 35mm 세포 배양 접시로 옮깁니다.
- 대뇌 오가노이드의 추가 배양 및 고정
- 37°C에서 5%CO2 및 95% 공기의 가습된 분위기에서 55rpm의 오비탈 쉐이커 상에서 비타민 A와 함께 DM의 전기천공된 오가노이드를 배양한다.
- 전기천공 후 다음 날, 기존의 도립 형광 현미경으로 성공적인 전기천공을 위해 대뇌 오가노이드를 확인합니다.
참고: 전기천공 후 추가 배양 길이에 따라 대뇌 오가노이드 내의 다른 세포 집단이 영향을 받습니다(대표 결과 섹션 참조). - 관심 있는 생물학적 문제에 적합한 시간 동안 전기천공된 대뇌 오가노이드를 배양한 후 다운스트림 적용을 진행합니다.
참고: 전기천공된 대뇌 오가노이드는 다양한 다운스트림 응용 분야(예: 면역형광 염색을 위한 고정 또는 RNA 분리 및 qRT-PCR을 위한 급속 냉동)를 위해 처리할 수 있습니다. 여기에서는 전기천공된 대뇌 오가노이드의 고정에 대해 설명합니다. - 절단된 1,000μl 피펫 팁을 사용하여 전기천공된 오가노이드를 15mL 원뿔형 원심분리기 튜브로 옮기고 초과 배지를 제거합니다.
- DPBS(pH 7.5)에 충분한 양의 4% 파라포름알데히드(PFA)를 첨가하고 실온에서 30분 동안 배양합니다.
주의: PFA는 인체 발암 물질로 분류되며 돌이킬 수 없는 건강 손상을 일으킬 수 있습니다. 니트릴 장갑과 고글을 포함한 추가 예방 조치를 강력히 권장합니다. - PFA를 흡인하고 DPBS 5mL를 넣고 약간 흔들어 DPBS를 흡인합니다. 이 2 번 반복하십시오. 추가 사용이 있을 때까지 4°C에서 오가노이드를 DPBS에 보관한다.
참고: PFA 고정 대뇌 오가노이드는 4°C에서 몇 달 동안 보관할 수 있으므로 여기에서 프로토콜을 일시 중지할 수 있습니다. PFA 고정 전기천공된 오가노이드는 냉동 절개 및 면역형광 염색 10,28 또는 전체 마운트 염색 및 투명 염색35,36으로 분석할 수 있습니다. 예시 이미지는 대표 결과 섹션을 참조하십시오(항체 세부 정보는 표 4 참조).
결과
여기에 설명된 프로토콜은 종 간에 필요한 타이밍 변경을 최소화하면서 인간, 침팬지, 붉은털 원숭이 및 일반적인 마모셋 iPSC 계통에서 대뇌 오가노이드를 효율적으로 생성할 수 있도록 합니다(그림 1A). 이러한 오가노이드는 심실과 같은 구조의 접근성과 관심 있는 세포 집단의 풍부도에 따라 20dps에서 50dps 범위에서 전기천공될 수 있습니다. 그러나 전기천공에 앞서 대뇌 오가노이드가 전기천공을 하기에 충분한 품질인지 여부를 결정하는 것이 중요합니다.
전기천공에 이상적인 대뇌 오가노이드는 말초에 뚜렷한 밝은 심실과 같은 구조를 나타내야 하며, 퇴행의 징후가 없어야 하며(예: 세포 분리, 세포사멸 코어 확대) 일반적으로 조밀한 건강한 형태(예: 과도한 성장 없음)를 나타내야 합니다(그림 1B, "Go"). 더 많은 수의 세포를 표적으로 삼기 위해 크고 잘 조직된 심실과 같은 구조를 가진 대뇌 오가노이드를 선택하는 것이 바람직합니다. 오가노이드의 주변 영역이 어둡고 돌출된 구조가 보이지 않는 경우, 시각적 단서가 부족하여 정확한 미세주입이 손상될 수 있으므로 전기천공에 사용하지 않는 것이 좋습니다(그림 1B, "No-go"). 최적의 대뇌 오가노이드 형태를 달성하려면 신경외배엽 유도 및 매트릭스 임베딩과 같은 중요한 단계가 시기 적절한지 확인하는 것이 중요합니다. 대뇌 오가노이드 형태와 관련된 문제는 일반적으로 실패한 신경외배엽 및/또는 신경상피 새싹 형성에서 비롯됩니다. 이것은 일반적으로 신경 유도 및/또는 기저막 매트릭스 임베딩의 최적이 아닌 타이밍으로 인해 발생하며 이러한 단계의 타이밍을 조정하여 해결할 수 있습니다(대뇌 오가노이드 형성에 대한 추가 문제 해결 팁은 Lancaster 및 Knoblich34에서 찾을 수 있음).
전기천공 후, transfection된 세포의 GFP 발현이 기존의 도립 형광 현미경으로 검출될 수 있게 되는 12시간 후에 성공 및 효율성에 대한 첫 번째 평가를 수행할 수 있습니다. 이상적으로는 이 단계에서 여러 심실과 같은 구조가 측면 중 하나에 국한된 밝은 녹색 형광을 방출합니다(그림 2A). 이것은 절차의 높은 정밀도와 효율성을 나타냅니다. 4가지 다른 영장류 종(즉, 인간, 침팬지, 붉은털원숭이 및 일반 마모셋)의 성공적으로 전기천공된 대뇌 오가노이드는 표적 심실 유사 구조 내에서 유사한 GFP 양성 패턴을 보여줍니다(그림 2A). 또한, 전기천공된 영장류 대뇌 오가노이드의 고정 및 냉동 절개 후, 4종 모두의 성공적으로 전기천공된 심실 유사 구조는 방사상으로 조직되고 조밀하게 채워진 심실 영역(VZ) 내에서 GFP 양성 세포의 컬럼을 나타냅니다(그림 2B). 전기천공 2일 후 침팬지와 마모셋 대뇌 오가노이드의 이러한 영역에서 GFP 양성인 DAPI 양성 세포의 정량화(12개의 오가노이드에서 17개의 심실을 정량화)한 결과, 평균적으로 세포의 약 1/3(33%, SD ± 12%)이 성공적으로 전기천공된 것으로 나타났습니다.
최적이 아닌 전기천공은 심실과 같은 구조 내에 있는 소수의 GFP 양성 세포(그림 3A) 또는 심실과 같은 구조에서 멀리 떨어진 소수의 GFP 양성 세포(그림 3B)로 표시됩니다. GFP 양성 세포의 수가 적은 것은 플라스미드 흡수 불량으로 인해 발생합니다. 이는 미세 주입된 전기천공 혼합물의 양이 충분하지 않아 발생하는 낮은 플라스미드 농도 또는 잘 지시되지 않은 전기 펄스 때문일 수 있으며, 이는 페트리 접시 전극 챔버에서 대뇌 오가노이드의 최적이 아닌 위치로 인해 발생할 수 있습니다. 심실과 같은 구조에서 멀리 떨어진 적은 수의 GFP 양성 세포는 부정확한 미세주입으로 인해 대뇌 오가노이드(예: 뉴런) 내의 유사분열 후 세포의 전기천공으로 인해 발생합니다. 이러한 최적이 아닌 전기천공은 추가 분석에서 제외해야 합니다.
대뇌 오가노이드에 존재하는 세포 유형의 신뢰할 수 있는 식별은 무엇보다도 VZ와 SVZ/뉴런 농축 영역 사이의 경계 정의가 필요한 심실과 같은 구조 내의 세포 위치를 기반으로 합니다. 이 경계는 VZ의 방사형 조직 및 높은 세포 핵 밀도 특성에 의해 식별될 수 있습니다( 보충 그림 S1의 DAPI 염색 참조). VZ/SVZ 경계의 확인은 거의 모든 VZ 세포(AP) 및 일부 SVZ 세포(BP)에 의해 발현되는 PAX6 또는 SOX2와 같은 신경 전구 마커에 대한 면역형광 염색에 의해 수행될 수 있습니다. 뉴런 농축 영역의 존재는 클래스 III β-튜불린(TUJ1) 또는 NeuN(보충 그림 S1)과 같은 뉴런 마커에 대한 면역형광 염색으로 검증할 수 있습니다.
전기천공 후 대뇌 오가노이드 배양 기간은 생물학적 질문과 관심 세포 집단에 따라 다릅니다. 최근 연구에서, 전기천공 후 다양한 길이의 추가 배양이 침팬지 대뇌 오가노이드의 다양한 세포 집단에 영향을 미친다는 것이 입증되었다24. 여기서는 전기천공된 마모셋 오가노이드에 대해 유사한 결과를 보여줍니다. 특히, 전기천공 2일 후, GFP 양성 세포는 거의 독점적으로 VZ에 국한되어 있으며 신경 전구 세포의 마커인 PAX6에도 양성이어서 이러한 세포가 AP 또는 신생아 BP임을 나타냅니다(그림 4A). 전기천공 후 배양 기간이 10일로 연장되면 GFP 양성 세포는 기저 영역(즉, SVZ 및 뉴런 농축 영역)에 국한됩니다(그림 4B, C). 이러한 세포는 (GFP 신호 외에) BP를 나타내는 PAX6(그림 4B) 또는 뉴런을 나타내는 NeuN(그림 4C)에 대해 양성일 수도 있습니다. 인간 및 붉은털 원숭이 전기천공된 대뇌 오가노이드에 대해서도 유사한 결과를 얻을 수 있습니다. 요약하면, 뉴런뿐만 아니라 다양한 전구체 유형이 이 기술에 의해 성공적으로 표적화될 수 있습니다.
이전에 표시된 거의 모든 데이터는 전기천공된 대뇌 오가노이드에서 생성된 조직학적 절편의 면역염색에서 파생되었습니다. 그러나 이러한 오가노이드를 분석하는 또 다른 우아한 방법은 전체 마운트 면역염색을 수행한 후 광학 투명화를 수행하는 것입니다35,36. 이를 통해 전기천공된 대뇌 오가노이드의 3D 재구성을 통해 GFP 양성 세포의 3D 분포에 대한 인상을 얻을 수 있습니다. 그림 5와 비디오 1은 광학 투명 전기천공된 대뇌 오가노이드에서 GFP 신호의 대표적인 예를 보여줍니다.
요약하면, 여기에 설명된 전기천공 프로토콜은 서로 다른 영장류 iPSC 계통에서 파생된 대뇌 오가노이드의 다양한 전구체 유형과 뉴런에 일시적인 유전자 변형을 도입하는 정확하고 효율적인 방법을 제공합니다.
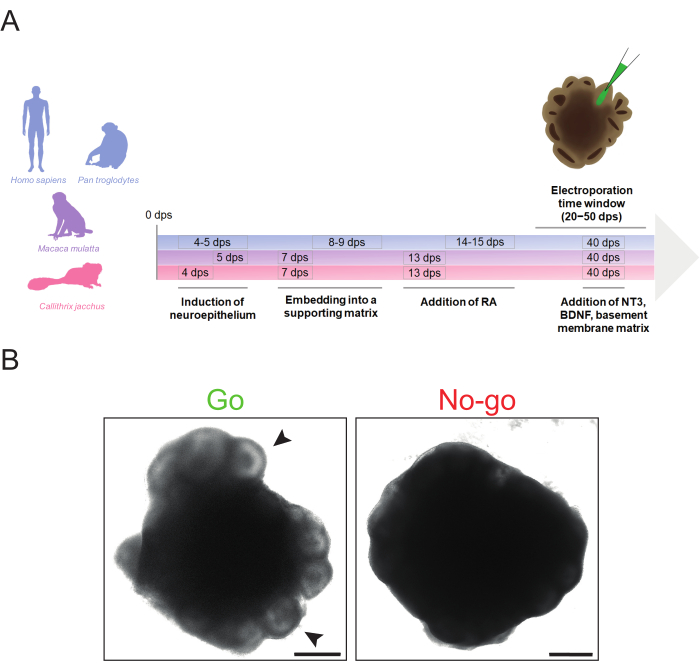
그림 1: 영장류 대뇌 오가노이드 생성의 개략도 및 전기천공을 위한 형태학적 "이동" 및 "금지" 기준. (A) 인간과 침팬지(파란색), 붉은털원숭이(보라색) 및 마모셋(자홍색)에 대한 프로토콜 단계의 다양한 타이밍을 강조하는 영장류 대뇌 오가노이드 생성 및 전기천공의 타임라인. 타임라인의 연대기는 축척되지 않습니다. (B) 적합한(왼쪽 이미지, Go) 및 부적합한(오른쪽 이미지, No-go) 32dps 인간 대뇌 오가노이드의 명시야 이미지. 화살촉은 미세 주입에 적합한 심실과 같은 구조의 예를 나타냅니다. 이미지는 2.5x 대물렌즈가 장착된 Zeiss Axio Observer.Z1 도립 형광 현미경을 사용하여 획득했습니다. 스케일 바 = 500 μm. 약어: BDNF = 뇌 유래 신경영양 인자; dps = 시드 후 일수; NT3 = 뉴로트로핀 3; RA = 레티노산. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
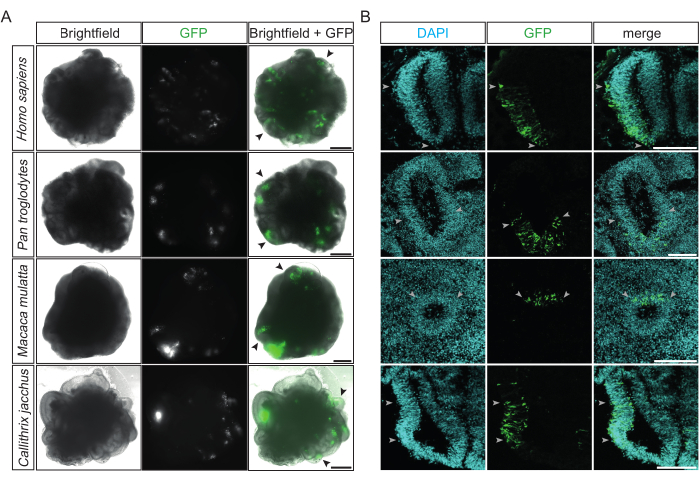
그림 2: 성공적으로 전기천공된 영장류 대뇌 오가노이드의 예. (A) GFP 발현 플라스미드로 전기천공한 후 15-48시간 후 인간 22마리, 침팬지 32마리 침팬지 침팬지 32마리, 붉은털원숭이 32마리, 마모셋 대뇌 오가노이드 31마리의 명시야(왼쪽 열), 형광(가운데 열) 및 병합(오른쪽 열) 이미지. 검은색 화살촉은 개별 전기 천공된 심실과 같은 구조의 예를 나타냅니다. 이미지는 2.5x 대물렌즈가 장착된 Zeiss Axio Observer.Z1 도립 형광 현미경을 사용하여 획득했습니다. 스케일 바 = 500 μm. (B) GFP 발현 플라스미드로 전기천공한 후 2-4일 후 인간 32dps, 침팬지 34dps, 붉은털원숭이 32dps 붉은털원숭이 및 32dps 마모셋 대뇌 오가노이드(위에서 아래로)의 DAPI 염색(청록색)과 결합된 GFP(녹색)에 대한 면역형광. 밝은 회색 화살촉은 심실과 같은 구조 내에서 전기 천공 영역의 경계를 나타냅니다. 이미지는 10x 대물렌즈가 장착된 Zeiss LSM 800 컨포칼 현미경을 사용하여 획득했습니다. 스케일 바 = 150 μm. 약어: DAPI = 4',6-디아미디노-2-페닐인돌; dps = 시드 후 일수; GFP = 녹색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 전기천공에 실패한 영장류 대뇌 오가노이드의 예. (A,B) (A) GFP 발현 플라스미드로 전기천공한 지 4일 후 34dps 붉은털원숭이 대뇌 오가노이드 및 (B) GFP 발현 플라스미드로 전기천공한 후 2일 후 32dps 붉은털원숭이 대뇌 오가노이드. 밝은 회색 화살촉은 전기천공된 세포를 나타냅니다. 밝은 회색 점선 윤곽선은 전기천공된 세포에 인접한 심실과 같은 구조의 VZ와 SVZ/뉴런이 풍부한 영역 사이의 경계를 나타냅니다. 이미지는 10x 대물렌즈가 장착된 Zeiss LSM 800 컨포칼 현미경을 사용하여 획득했습니다. 스케일 바 = 150 μm. 약어: DAPI = 4',6-디아미디노-2-페닐인돌; dps = 시드 후 일수; GFP = 녹색 형광 단백질; SVZ = 심실하 영역; VZ = 심실 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 전기천공 후 영장류 대뇌 오가노이드에 존재하는 다양한 세포 집단의 시각화. (ᄀ씨) 모든 경우에 DAPI 염색(청록색)과 결합된 GFP(녹색) 및 PAX6(A,B; 마젠타) 또는 NeuN(C; 자홍색)에 대한 이중 면역형광, (A) GFP 발현 플라스미드로 전기천공한 후 2일 후 32dps 마모셋 대뇌 오가노이드 및 (B,C) GFP 발현 플라스미드로 전기천공한 후 10일 후 40dps 마모셋 대뇌 오가노이드. 밝은 회색 화살촉은 (A,B) GFP+ 및 PAX6+ 또는 (C) NeuN+ 이중 양성 세포를 나타냅니다. 밝은 회색 점선은 VZ와 SVZ/뉴런 농축 영역 사이의 경계를 나타냅니다. 이미지는 20x 대물렌즈의 Zeiss LSM 800 컨포칼 현미경을 사용하여 획득했습니다. 스케일 바 = 100 μm. 약어: DAPI = 4',6-디아미디노-2-페닐인돌; dps = 시드 후 일수; GFP = 녹색 형광 단백질; NeuN = 뉴런 핵 단백질; PAX6 = 짝을 이루는 상자 6 단백질; SVZ = 심실하 영역; VZ = 심실 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
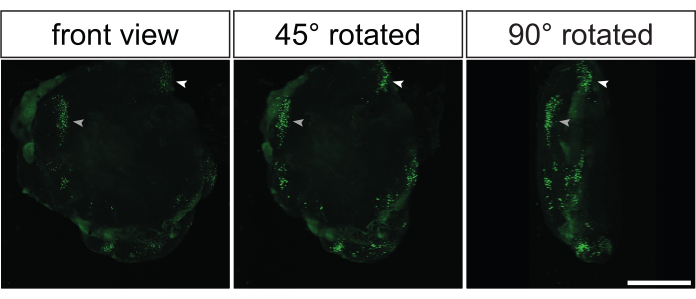
그림 5: 광학 투명화 후 전기천공된 영장류 대뇌 오가노이드의 3D 컨포칼 이미징에 의한 전기천공 이미지의 3차원 재구성. GFP 발현 플라스미드로 전기천공한 지 2일 후 3D 재구성된 전기천공된 32dps 인간 대뇌 오가노이드의 정면(왼쪽 이미지), 45° 회전(중간 이미지) 및 90° 회전(오른쪽 이미지) 보기. 이미징에 앞서, 오가노이드는 2Eci 방법35에 기초하여 광학적으로 투명화되었다. 10x 대물렌즈를 가진 Zeiss LSM 800 컨포칼 현미경을 사용하여 서로 3.73μm 떨어져 있는 269개의 광학 섹션(각각 1μM 두께)에서 전체 전기천공된 오가노이드의 3D 재구성을 생성했습니다. 이미지는 피지를 사용하여 3D 재구성을 위해 처리되었습니다. 이미지는 비디오 1에 표시된 것과 동일한 3D 재구성 오가노이드에서 가져온 것입니다. 스케일 바 = 500 μm. 약어: GFP = 녹색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1: 광학 투명화 후 3D 재구성 전기천공된 인간 대뇌 오가노이드. GFP 발현 플라스미드로 전기천공한 지 2일 후 32dps 인간 대뇌 오가노이드를 3D로 재구성한 비디오. 이미징에 앞서, 오가노이드는 2Eci 방법35에 기초하여 광학적으로 투명화되었다. 10x 대물렌즈를 가진 Zeiss LSM 800 컨포칼 현미경을 사용하여 서로 3.73μm 떨어져 있는 269개의 광학 섹션(각각 1μM 두께)에서 전체 전기천공된 오가노이드의 3D 재구성을 생성했습니다. 이미지는 피지를 사용하여 3D 재구성을 위해 처리되었습니다. 비디오는 그림 5에 표시된 것과 동일한 3D 재구성 오가노이드에서 촬영되었습니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
| iPSC 라인 | 종 | 출판 | 배양 배지 조성 | 문화 조건 | ||||
| 아이론자2.2 | 인류 | Stauske 외, 2020 | StemMACS iPS-Brew XF의 1μM IWR1 및 0.5μM CHIR | 5%CO2 및 95% 공기, 37°C의 가습 분위기 | ||||
| 산드라 | 팬 트로글로다이트 | Mora-Bermúdez 외, 2016 | 엠테SR1 | 5%CO2 및 95% 공기, 37°C의 가습 분위기 | ||||
| iRh33.1 (영어) | 마카카 물라타 | Stauske 외, 2020 | StemMACS iPS-Brew XF의 1μM IWR1 및 0.5μM CHIR | 5%CO2 및 95% 공기, 37°C의 가습 분위기 | ||||
| cj_160419_5 | 칼리스릭스 자쿠스 | Petkov 외, 2020 | 3μM IWR1, 0.3μM CGP77675, 0.3μM AZD77675, 0.5μM CHIR99021, 10μM 포스콜린, 1ng/mL 액티빈 A, 1μM OAC1(StemMACS iPS-Brew XF) | 5% CO2, 5% O2, 및 90% N2, 37°C의 가습 분위기 | ||||
표 1: 본 간행물에 사용된 영장류 iPSC의 배양 조건. 약어: iPSCs = 유도만능줄기세포.
| 보통 | 구성 | ||
| 신경 유도 매체 | 1x N-2 보충제, 1x 글루타민 대체 보충제, 1x MEM 비필수 아미노산 용액, Dulbecco's Modified Eagle Medium F12(DMEM/F12)의 1μg/mL 헤파린 | ||
| 비타민 A가 없는 분화 배지(DM) | 0.5x B-27 보충제(비타민 A 제외), 0.5x N-2 보충제, 0.5x MEM 비필수 아미노산 용액, 글루타민 대체 보충제 1x, 페니실린-스트렙토마이신 100U/mL, 1:1 DMEM/F12 및 Neurobasal 배지에 0.00035% 2-메르캅토에탄올, 2.875ng/mL 인슐린 | ||
| 비타민 A와 분화 배지(DM) | 0.5x B-27 보충제, 0.5x N-2 보충제, 0.5x MEM 비필수 아미노산 용액, 글루타민 대체 보충제 1개, 페니실린-스트렙토마이신 100U/mL, 1:1 DMEM/F12 및 신경기저 배지에 0.00035% 2-메르캅토에탄올, 2.875ng/mL 인슐린 | ||
표 2: 영장류 대뇌 오가노이드 생성 및 배양에 사용되는 배지의 조성.
| 구성 요소 | 제어 electroporation 혼합 | GOI 전기 천공 믹스 |
| GFP 발현 플라스미드 | 500ng/μL | 500ng/μL |
| 빈 벡터 | 500ng/μL | - |
| GOI 발현 플라스미드 | - | 500ng/μL |
| 패스트 그린 | 0.10% | 0.10% |
| DPBS에서 |
표 3: 대조군 및 관심 유전자에 대한 전기천공 혼합물(분리 플라스미드 접근법)의 조성. 약어: GOI = 관심 유전자.
| 항체 | 회사 | 카탈로그 번호 | 증권 시세 표시기 | 희석 |
| 치킨 안티 GFP | Aves 연구소 | GFP-1020 시리즈 | 리리드:AB_10000240 | 1:300 |
| 토끼 안티 PAX6 | 노부스 바이오로직스(Novus Biologicals) | NBP1-89100 | 리리드:AB_11013575 | 1:300 |
| 토끼 안티 NeuN | 아브캠 | AB104225 | 리리드:AB_10711153 | 1:300 |
| 염소 안티 치킨 Alexa Fluor 488 | 써모 피셔(Thermo Fisher) | A-11039 (영문) | 리리드:AB_142924 | 1:500 |
| 당나귀 안티 토끼 Alexa Fluor 555 | 써모 피셔(Thermo Fisher) | A-31572 (영문) | 리리드:AB_162543 | 1:500 |
표 4: 면역형광 염색에 사용된 항체.
보충 그림 S1: 전기천공된 영장류 대뇌 오가노이드의 VZ/SVZ 경계 결정. GFP 발현 플라스미드로 전기천공한 지 2일 후 32dps 마모셋 대뇌 오가노이드의 DAPI 염색(청록색)과 결합된 PAX6(자홍색) 및 TUJ1(노란색)에 대한 이중 면역형광. GFP에 대한 면역형광은 나타내지 않았다. 밝은 회색 점선은 VZ와 SVZ/뉴런 농축 영역 사이의 경계를 나타냅니다. 이미지는 20x 대물렌즈의 Zeiss LSM 800 컨포칼 현미경을 사용하여 획득했습니다. 스케일 바 = 100 μm. 약어: DAPI = 4',6-디아미디노-2-페닐인돌; dps = 시드 후 일수; PAX6 = 짝을 이루는 상자 6 단백질; SVZ = 심실하 영역; TUJ1 = 클래스 III β-튜불린; VZ = 심실 영역. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 페트리 접시 전기천공 챔버 조립 지침. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에 설명된 절차는 표적 전기천공 접근법을 사용하여 다양한 영장류 종에서 대뇌 오가노이드를 생성하기 위한 통합 프로토콜을 나타냅니다. 이것은 영장류(인간 포함)(병리)생리학적 신피질 발달을 모방하는 모델 시스템에서 GOI의 이소성 발현을 허용합니다. 영장류 대뇌 오가노이드 생성을 위한 이 통합 프로토콜은 제시된 4가지 영장류 종 모두에 대해 동일한 재료(예: 배지) 및 프로토콜 단계를 사용합니다. 이러한 종 간의 발달 차이는 중요한 프로토콜 단계(즉, 신경 유도 및 기저막 매트릭스에 임베딩, 위 참조)의 타이밍을 변경하여 해결됩니다. 이것은 이들 종 간의 생체 내 신경 발달 타이밍 차이를 대략적으로 반영할 수 있으며 추가 연구를 위한 흥미로운 주제를 구성합니다.
이 접근법은 대뇌 오가노이드에 대한 이전 논문에서 설명한 전기천공 실험을 기반으로 한다10. 그러나, 랭커스터와 동료들에 의해 지적된 바와 같이, 이러한 실험은 높은 GFP 농도로 인해 발생하고 강한 GFP 신호를 나타내는 전기천공된 세포의 배제로 이어진 광범위한 정도의 세포자멸사에 의해 제한되었다10. 우리의 실험에서, 우리는 1,000 ng/μL의 최종 총 플라스미드 농도(예: EGFP-인코딩 플라스미드 농도와 GOI-인코딩 플라스미드 농도)가 최적임을 발견했습니다. 1,000 ng/μL 미만의 농도는 전기천공 효율을 감소시키고, 1,000 ng/μL를 초과하는 농도는 전기천공된 세포에 독성을 유발하여 세포 사멸을 유발할 수 있다10. 2개 이상의 상이한 발현 플라스미드를 결합하는 연구가 가능하다28. 그러나 최종 총 플라스미드 농도는 1,000ng/μL로 유지해야 합니다.
일반적인 전기천공 접근법에서, 형광 마커를 코딩하는 플라스미드는 성공적으로 전기천공된 세포를 식별하기 위해 필요합니다. 실험 셋업에 형광 마커를 포함시키는 두 가지 가능성이 있다: (i) 2개의 별개의 플라스미드 (즉, 마커를 암호화하는 플라스미드 및 대조군 플라스미드 [예를 들어, 빈 벡터] 또는 관심 유전자를 코딩하는 플라스미드 [GOI])를 공동-주입함으로써 ( 별개의 플라스미드 접근법); (ii) 내부 리보솜 진입 부위 (IRES) 또는 2A 자가 절단 펩티드 (예를 들어, P2A)를 사용하여 마커 및 GOI 둘 다를 암호화하는 하나의 플라스미드를 주입함으로써 ( 단일 플라스미드 접근법). 이때, 형광 마커만을 암호화하는 플라스미드가 대조군으로 사용된다. 단일 플라스미드 접근법은 형광 마커 및 GOI의 완전한 동시-발현을 초래하는 반면, 이러한 플라스미드는 크기가 커서, 낮은 전기천공 효율을 초래한다. 높은 전기천공 효율이 필요한 경우, 분리된 발현이 높은 전기천공 효율을 유지하면서 형광 마커와 GOI의 동시 발현 수준에 유의한 영향을 미치지 않기 때문에 분리된 플라스미드 접근법을 사용하는 것이 좋다 28. 여기에 제시된 프로토콜에서 우리는 별도의 플라스미드 접근법을 사용하여 전기천공을 설명합니다. 단일 플라스미드 접근법이 적용되는 경우 프로토콜의 단계를 적절하게 조정해야 합니다.
최근에 발표된 프로토콜37과 비교하여, 우리의 접근 방식은 세 가지 주요 이점을 가지고 있습니다. 첫째, 우리는 특히 대뇌 오가노이드의 심실과 같은 구조를 표적으로 삼습니다. 우리는 (i) 오가노이드(37)의 중앙에 주입하는 대신 대뇌 오가노이드의 개별 심실과 같은 구조를 미세주입하고, (ii) 전기천공 큐벳(37)을 사용하는 대신 전기장의 방향을 최적화하기 위해 페트리 디쉬 전극실에 대뇌 오가노이드의 방향을 배열함으로써 이를 달성합니다(위 참조). 둘째, 이 프로토콜은 페트리 접시 전극 챔버와 함께 구형파 전기포레이터를 사용하기 때문에 값비싼 핵펙터 용액의 사용을 포함하지 않습니다. 셋째, 영장류 대뇌 오가노이드 생성을 위한 이 통합 프로토콜은 인간뿐만 아니라 비인간 영장류 오가노이드의 연구를 가능하게 하여 진화, 비교 및 질병 연구를 가능하게 합니다.
대뇌 오가노이드와 관련된 두 가지 특징, 즉 대뇌 오가노이드의 품질과 심실 유사 구조의 크기 및 품질은 성공적인 전기천공에 매우 중요합니다(대표 결과 및 그림 1B 참조). 첫 번째 기능과 관련하여 전기 천공을 진행하기 위한 이동 및 이동 금지 기준(위 및 그림 1B 참조)을 제시합니다. 주요 기준은 명확하게 보이고, 반투명하고, 방사형으로 조직 된 심실과 같은 구조의 존재입니다. 심실과 같은 구조의 크기는 성공적인 미세 주입 및 전기 천공을 위한 두 번째 중요한 특징입니다. 너무 작은 심실과 같은 구조는 주입하기 어렵고 일반적으로 후속 분석을 위해 충분히 많은 수의 전기천공된 세포를 생성하지 않습니다. 이것이 우리가 수정된 대뇌 오가노이드 프로토콜을 사용한 주된 이유입니다., 이 프로토콜로, 우리 손에서, 그리고 이러한 iPSC 라인에 대해-다른 프로토콜과 비교하여 전기천공될 만큼 충분히 큰 잘 조직된 심실과 같은 구조를 생성합니다. 원칙적으로, 여기에 제시된 전기천공 접근법은 후자가 충분히 크고 조직화된 심실과 같은 구조를 생성하는 한 다른 신경 오가노이드 프로토콜에 적용할 수 있습니다(대표 결과 및 그림 1B 참조). 또한, 이 프로토콜은 산업 연구에 사용되는 고전적인 영장류 모델인 게를 먹는 원숭이(Macaca fascicularis)와 같은 미래의 다른 영장류에도 적용될 수 있습니다. 이를 위해서는 여기에 설명된 수정된 대뇌 오가노이드 프로토콜의 정확한 임계 시점(위 참조)을 식별하거나 적절한 대심실 유사 구조를 생성하는 신경 오가노이드 프로토콜(위 참조)을 설정해야 합니다.
성공적인 전기천공 후, 대뇌 오가노이드는 검사 중인 유전자 변형이 발달 중인 대뇌 오가노이드 내의 다양한 세포 집단에 영향을 미칠 수 있도록 다양한 기간 동안 추가 배양될 수 있습니다. 이들은 다양한 신경 전구체 집단에서 대뇌 오가노이드에 존재하는 다양한 유형의 뉴런에 이르기까지 다양합니다(대표 결과 및 Fischer et al.28 참조). 그런 다음 이러한 세포 집단은 냉동 절편 및 면역형광 염색(그림 4 참조) 또는 PFA 고정 전기천공 대뇌 오가노이드의 전체 장착 면역형광 염색 및 광학 투명화( 그림 5 및 비디오 1 참조)로 분석할 수 있습니다.
지금까지 뇌 오가노이드의 전기천공법은 유전자 기능 연구 10,28,38,39, 라이브 이미징10,39,40, 세포 형태 시각화 40, 세포 분열 추적 10을 수행하기 위해 유전자의 이소성 발현에 주로 사용되어 왔다. 그러나 첫 번째 대뇌 오가노이드 논문에서는 RNA 간섭에 의한 유전자 발현을 침묵시키기 위해 전기천공에 의해 shRNA를 오가노이드에 도입했습니다. 이는 유전자의 이소성 발현뿐만 아니라 유전자의 KD 또는 KO에도 사용될 수 있는 전기천공의 가능성을 보여주었다. 최근에, CRISPR/Cas9 매개 KO는 마우스 배아의 자궁 내 전기천공(27)과 생체 외 태아 인간 조직의 전기천공(41)에 의해 달성될 수 있음이 밝혀졌다. 이러한 CRISPR/Cas9 기반 KO는 전기천공의 주요 메커니즘이 동일하기 때문에 대뇌 오가노이드의 전기천공에 쉽게 적용할 수 있으며, 이는 이 접근법의 유용성을 더욱 확장할 것입니다.
대뇌 오가노이드에서 전기천공법의 잠재적인 추가 적용 중 하나는 GOI와 그 조상 버전 사이의 매우 유사한 서열로 인해 GOI의 특정 KO를 얻을 수 없는 경우 특정 KO 표현형을 구출하는 것입니다. 이것은 특히 최근에 진화 된 인간 특이 적 유전자의 경우입니다. 이러한 경우 (CRISPR/Cas9 기술을 사용하더라도) 특정 KO를 얻을 수 없습니다(ARHGAP11A 및 ARHGAP11B28의 경우와 같이). 이 딜레마에 대한 해결책은 GOI와 그 조상 유전자의 이중 KO를 생성하고 GOI 단독, 조상 유전자 단독 또는 전기 천공을 통해 두 유전자를 함께 구출하는 것입니다. 이러한 전기천공된 오가노이드는 각각 선택적 조상 유전자 KO, 선택적 GOI KO 또는 대조군으로 간주될 수 있습니다. 이것은 표현형에 대한 이러한 유전자의 개별적인 기여를 다룰 수 있게 해줄 것이다(예를 들어, Fischer et al.28 참조). 또 다른 잠재적인 응용 분야는 환자 유래 iPSC에서 생성된 대뇌 오가노이드 분석과 관련이 있습니다. 이러한 경우 관찰된 표현형이 후보 유전자의 돌연변이 때문인지 아니면 환자에게 존재하는 다른 돌연변이 때문인지는 명확하지 않습니다. 여기서, 후보 유전자의 전기천공 및 표현형의 (잠재적) 구조는 질병에서 이 유전자의 역할이 검증될 수 있도록 할 것이다(예를 들어, Lancaster et al.10 참조).
종합하면, 여기에 제시된 프로토콜은 영장류 대뇌 오가노이드의 심실과 같은 구조 내에서 세포 집단을 유전적으로 변형하는 빠르고 비용 효율적인 접근 방식을 제공합니다. 이것은 질병 모델링에도 적용할 수 있는 신경 발달 및 진화 과정 연구를 위한 효과적인 도구를 제공합니다.
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
지면의 제약으로 인해 논문을 인용하지 못한 모든 연구자들에게 사과드립니다. 페트리 접시 전극 챔버 건설에 대해 DPZ의 기술 서비스 담당자인 Ulrich Bleyer와 MPI-CBG 워크숍의 Hartmut Wolf에게 감사드립니다. 인간(iLonza2.2), 붉은털 원숭이(iRh33.1) 및 마모셋(cj_160419_5) iPSC를 제공한 Stoyan Petkov 및 Rüdiger Behr; 동결절개 및 면역형광 염색을 위한 Sabrina Heide; 그리고 원고를 비판적으로 읽은 Neringa Liutikaite와 César Mateo Bastidas Betancourt. W.B.H. 실험실에서의 작업은 ERA-NET NEURON (MicroKin) 보조금으로 지원되었습니다. M.H.의 실험실에서의 작업은 ERC 시작 보조금 (101039421)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 20 µL Microloader | Eppendorf | 5242956003 | |
| 2-Mercaptoethanol | Merck | 8.05740.0005 | |
| 35 mm cell culture dishes | Sarstedt | 83.3900 | |
| 60 mm cell culture dishes | CytoOne | CC7682-3359 | |
| Activin A | Sigma-Aldrich | SRP3003 | |
| AOC1 | Selleckchem | S7217 | |
| Axio Observer.Z1 Inverted Fluorescence Microscope | Zeiss | replacable by comparable fluorescent microscopes | |
| AZD0530 | Selleckchem | S1006 | |
| B-27 Supplement with Vitamin A (retinoic acid, RA) (50x) | Gibco | 17504-044 | |
| B-27 Supplement without Vitamin A (50x) | Gibco | 12587-010 | |
| BTX ECM 830 Square Wave Electroporation System | BTX | 45-2052 | |
| CGP77675 | Sigma-Aldrich | SML0314 | |
| Chimpanzee induced pluripotent stem cell line Sandra A | doi: 10.7554/elife.18683 | ||
| Common marmoset induced pluripotent stem cell line cj_160419_5 | doi: 10.3390/cells9112422 | ||
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Gibco | 11320-033 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Gibco | 14190-094 | pH 7.0−7.3; warm to room temperature before use |
| Fast Green | Sigma-Aldrich | F7252-5G | |
| Forskolin | Selleckchem | 2449 | |
| GlutaMAX Supplement (100x) | Gibco | 35050-061 | glutamine substitute supplement |
| Heparin (1 mg/mL stock) | Sigma-Aldrich | H3149 | |
| Human induced pluripotent stem cell line iLonza2.2 | doi: 10.3390/cells9061349 | ||
| Human Neurotrophin-3 (NT-3) | PeproTech | 450-03 | |
| Insulin | Sigma-Aldrich | 19278 | |
| IWR1 | Sigma-Aldrich | I0161 | |
| Leica MS5 stereomicroscope (MDG 17 transmitted-light base) | Leica | 10473849 | replacable by comparable stereomicroscopes |
| Matrigel | Corning | 354277/354234 | basement membrane matrix; alternatively, Geltrex (ThermoFisher Scientific, A1413302) can be used |
| MEM Non-Essential Amino Acids Solution (100x) | Sigma-Aldrich | M7145 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Paraformaldehyde | Merck | 818715 | handle with causion due to cancerogenecity |
| Penicillin/Streptomycin (10,000 U/mL) | PanBiotech | P06-07100 | |
| Petri dish electrode chamber | self-produced (see Supplemental File 1) | also commertially available | |
| Pre-Pulled Glass Pipettes | WPI | TIP10LT | borosilicate glass pipettes with long taper, 10 µm tip diameter |
| Pro-Survival Compound | MerckMillipore | 529659 | |
| Recombinant Human/Murine/RatBrain-Derived Neurotrophic Factor (BDNF) | PeproTech | AF-450-02 | |
| Rhesus macaque induced pluripotent stem cell line iRh33.1 | doi: 10.3390/cells9061349 | ||
| StemMACS iPS-Brew XF | Miltenyi Biotech | 130-104-368 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | proteolytic and collagenolytic enzyme mixture |
| TrypLE | Gibco | 12604-013 | recombinant trypsin substitute; warm to room temperature before use |
| Ultra-Low Attachment 96-well plates | Costar | 7007 | |
| Y27632 | Stemcell Technologies | 72305 |
참고문헌
- Marchetto, M. C. N., Winner, B., Gage, F. H. Pluripotent stem cells in neurodegenerative and neurodevelopmental diseases. Human Molecular Genetics. 19 (R1), R71-R76 (2010).
- Zhao, X., Bhattacharyya, A. Human models are needed for studying human neurodevelopmental disorders. The American Journal of Human Genetics. 103 (6), 829-857 (2018).
- Zhang, W., et al. Modeling microcephaly with cerebral organoids reveals a WDR62–CEP170–KIF2A pathway promoting cilium disassembly in neural progenitors. Nature Communications. 10 (1), 2612 (2019).
- Sasaki, E., et al. Generation of transgenic non-human primates with germline transmission. Nature. 459 (7246), 523-527 (2009).
- Niu, Y., et al. Transgenic rhesus monkeys produced by gene transfer into early-cleavage–stage embryos using a simian immunodeficiency virus-based vector. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17663-17667 (2010).
- Niu, Y., et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell. 156 (4), 836-843 (2014).
- Shi, L., et al. Transgenic rhesus monkeys carrying the human MCPH1 gene copies show human-like neoteny of brain development. National Science Review. 6 (3), 480-493 (2019).
- Heide, M., et al. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science. 369 (6503), 546-550 (2020).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell–derived neocortex. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20284-20289 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Kelava, I., Lancaster, M. A. Stem cell models of human brain development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Lullo, E. D., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Arlotta, P. Organoids required! A new path to understanding human brain development and disease. Nature Methods. 15 (1), 27-29 (2018).
- Heide, M., Huttner, W. B., Mora-Bermúdez, F. Brain organoids as models to study human neocortex development and evolution. Current Opinion in Cell Biology. 55, 8-16 (2018).
- Qian, X., Song, H., Ming, G. Brain organoids: Advances, applications and challenges. Development. 146 (8), dev166074 (2019).
- Sun, N., Meng, X., Liu, Y., Song, D., Jiang, C., Cai, J. Applications of brain organoids in neurodevelopment and neurological diseases. Journal of Biomedical Science. 28 (1), 30 (2021).
- Fischer, J., Heide, M., Huttner, W. B. Genetic modification of brain organoids. Frontiers in Cellular Neuroscience. 13, 558 (2019).
- Pașca, S. P., et al. A nomenclature consensus for nervous system organoids and assembloids. Nature. 609 (7929), 907-910 (2022).
- Kyrousi, C., Cappello, S. Using brain organoids to study human neurodevelopment, evolution and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 9 (1), e347 (2020).
- Teriyapirom, I., Batista-Rocha, A. S., Koo, B. -. K. Genetic engineering in organoids. Journal of Molecular Medicine. 99 (4), 555-568 (2021).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Kawasaki, H., Toda, T., Tanno, K. In vivo genetic manipulation of cortical progenitors in gyrencephalic carnivores using in utero electroporation. Biology Open. 2 (1), 95-100 (2012).
- Kawasaki, H., Iwai, L., Tanno, K. Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Molecular Brain. 5 (1), 24 (2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nature Neuroscience. 6 (12), 1277-1283 (2003).
- Kalebic, N., et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO reports. 17 (3), 338-348 (2016).
- Fischer, J., et al. Human-specific ARHGAP11B ensures human-like basal progenitor levels in hominid cerebral organoids. EMBO Reports. 23 (11), e54728 (2022).
- Stauske, M., et al. Non-human primate iPSC generation, cultivation, and cardiac differentiation under chemically defined conditions. Cells. 9 (6), 1349 (2020).
- Mora-Bermúdez, F., et al. Differences and similarities between human and chimpanzee neural progenitors during cerebral cortex development. eLife. 5, e18683 (2016).
- Petkov, S., Dressel, R., Rodriguez-Polo, I., Behr, R. Controlling the switch from neurogenesis to pluripotency during marmoset monkey somatic cell reprogramming with self-replicating mRNAs and small molecules. Cells. 9 (11), 2422 (2020).
- Camp, J. G., et al. Human cerebral organoids recapitulate gene expression programs of fetal neocortex development. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15672-15677 (2015).
- Kanton, S., et al. Organoid single-cell genomic atlas uncovers human-specific features of brain development. Nature. 574 (7778), 418-422 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Cakir, B., et al. Engineering of human brain organoids with a functional vascular-like system. Nature Methods. 16 (11), 1169-1175 (2019).
- Masselink, W., et al. Broad applicability of a streamlined ethyl cinnamate-based clearing procedure. Development. 146 (3), dev166884 (2019).
- Denoth-Lippuner, A., Royall, L. N., Gonzalez-Bohorquez, D., Machado, D., Jessberger, S. Injection and electroporation of plasmid DNA into human cortical organoids. STAR Protocols. 3 (1), 101129 (2022).
- Denoth-Lippuner, A., et al. Visualization of individual cell division history in complex tissues using iCOUNT. Cell Stem Cell. 28 (11), 2020.e12-2034.e12 (2021).
- Kelava, I., Chiaradia, I., Pellegrini, L., Kalinka, A. T., Lancaster, M. A. Androgens increase excitatory neurogenic potential in human brain organoids. Nature. 602 (7895), 112-116 (2022).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Kalebic, N., et al. Neocortical expansion due to increased proliferation of basal progenitors is linked to changes in their morphology. Cell Stem Cell. 24 (4), 535.e9-550.e9 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유