Method Article
灵长类动物脑类器官的靶向显微注射和电穿孔用于基因修饰
摘要
灵长类大脑类器官的电穿孔提供了一种精确有效的方法,将瞬时遗传修饰引入接近灵长类(病理)生理新皮层发育的模型系统中的不同祖细胞类型和神经元中。这允许研究神经发育和进化过程,也可以应用于疾病建模。
摘要
大脑皮层是大脑最外层的结构,负责处理感觉输入和运动输出;它被视为哺乳动物,特别是灵长类动物的高阶认知能力的所在地。由于技术和伦理原因,研究灵长类动物大脑中的基因功能具有挑战性,但大脑类器官技术的建立使得能够在传统的灵长类动物模型(例如恒河猴和普通狨猴)以及以前实验无法进入的灵长类动物物种(例如,类人猿)中研究大脑发育,在一个道德上合理且技术要求较低的系统中。此外,人脑类器官允许对神经发育和神经系统疾病进行高级研究。
由于大脑类器官概括了大脑发育的许多过程,它们也代表了一种强大的工具,可以识别进化背景下各种物种大脑发育背后的遗传决定因素的差异,并在功能上进行比较。使用类器官的一大优点是可以引入基因修饰,从而可以测试基因功能。然而,引入这种修改既费力又昂贵。本文描述了一种快速且具有成本效益的方法,用于对灵长类动物大脑类器官(大脑类器官的一种亚型)的心室样结构内的细胞群进行基因修饰。该方法将改进的方案与显微注射和电穿孔方法相结合,用于从人、黑猩猩、恒河猴和普通狨猴衍生的诱导多能干细胞 (iPSC) 中可靠生成脑类器官。这为研究神经发育和进化过程提供了有效的工具,也可以应用于疾病建模。
引言
研究大脑皮层的(病理)生理发育和进化是一项艰巨的任务,由于缺乏合适的模型系统而受到阻碍。以前,此类研究仅限于二维细胞培养模型(例如原代神经祖细胞或神经元细胞培养物)和进化上遥远的动物模型(例如啮齿动物)1,2。虽然这些模型对于解决某些问题很有用,但它们在模拟健康和患病状态下发育中的人类新皮层的复杂性、细胞类型组成、细胞结构和基因表达模式方面受到限制。例如,这些限制导致人类疾病的小鼠模型对人类情况的可转化性差,如某些小头畸形病例所描述的那样(例如,Zhang等人3)。最近,转基因非人灵长类动物,在进化,功能和形态上更接近人类新皮层发育的模型,已经成为焦点4,5,6,7,8,因为它们克服了基于细胞培养和啮齿动物模型的许多限制。然而,在研究中使用非人类灵长类动物不仅非常昂贵和耗时,而且还引起了伦理问题。最近,脑类器官技术9,10的发展已成为一种有前途的替代方案,解决了以前模型11,12,13,14,15,16的许多局限性。
脑类器官是三维(3D)的多细胞结构,在定义的发育时间窗口11,12,13,14,17内模拟一个或多个脑区域的细胞结构和细胞类型组成的主要特征。这些3D结构由诱导多能干细胞(iPSC)产生,或者,如果可用于感兴趣的物种,则由胚胎干细胞(ESC)产生。一般来说,可以根据所使用的方法区分两种类型的脑类器官:无引导和区域化(引导)脑类器官18。在生成后一种类型的类器官时,提供了小分子或因子,引导多能干细胞分化为特定大脑区域的类器官(例如,前脑类器官)18。相比之下,在无引导类器官中,分化不是由添加小分子引导的,而是完全依赖于iPSC/ESC的自发分化。由此产生的脑类器官由代表不同大脑区域的细胞类型(例如,大脑类器官)组成18。脑类器官结合了大脑发育的许多关键特征,以及从任何感兴趣的物种(iPSCs或ESCs可用)相对经济和时间高效的生成11,12,13,14。这使得脑类器官成为多种神经生物学研究的绝佳模型,从进化和发育问题到疾病建模和药物测试15,16。然而,使用大脑类器官解决这些问题在很大程度上取决于不同基因修饰方法的可用性。
研究新皮层(病理)生理发育及其进化的一个关键方面是基因和基因变异的功能分析。这通常是通过这些基因的(异位)表达和/或敲低(KD)或敲除(KO)来实现的。这种遗传修饰可分为稳定和短暂的遗传修饰,以及受时间和空间限制或不受限的修饰。稳定的基因修饰是通过将遗传改变引入宿主基因组来定义的,该改变会传递给所有后续细胞世代。根据基因改造的时间点,它可以影响类器官的所有细胞,也可以仅限于某些细胞群。最常见的是,通过应用慢病毒、转座子样系统和CRISPR/Cas9技术,在iPSC/ESC水平的脑类器官中实现稳定的基因修饰(例如,Fischer等人17,Kyrousi等人19和Teriyapirom等人20)。这样做的好处是,大脑类器官的所有细胞都携带基因修饰,并且不受时间或空间限制。然而,这些稳定的iPSC/ESC系的生成和表征非常耗时,通常需要几个月的时间才能分析第一个修饰的脑类器官(例如,Fischer等人17,Kyrousi等人19或Teriyapirom等人20)。
相反,瞬时遗传修饰的定义是传递不整合到宿主基因组中的遗传货物(例如,基因表达质粒)。虽然这种修饰原则上可以传递给后续细胞代,但传递的遗传货物将随着每次细胞分裂而逐渐稀释。因此,这种类型的基因改造通常在时间和空间上受到限制。瞬时遗传修饰可以通过腺相关病毒或通过电穿孔在脑类器官中进行(例如,Fischer等人17,Kyrousi等人19和Teriyapirom等人20审查),本文将详细描述后者。与稳定的基因改造相比,这种方法非常快速且具有成本效益。事实上,电穿孔可以在几分钟内完成,并且根据靶细胞群的不同,电穿孔类器官可以在几天内准备好进行分析(例如,由Fischer等人17 和Kyrousi等人19审查)。然而,使用这种方法无法检测到大脑类器官的粗大形态变化,例如大小差异,因为这种类型的遗传修饰在时间和空间上受到限制。这种限制也可能是一个优势,例如,在研究类器官内的单个细胞群或在特定发育时间点对大脑类器官的影响的情况下(由例如Fischer等人17 和Kyrousi等人19审查)。
研究大脑发育和进化过程中基因功能的经典方法是子宫电穿孔。在子宫内电穿孔是一种众所周知的有用技术,用于将基因表达构建体递送到啮齿动物21,22,23和雪貂24,25的大脑中。首先,根据要靶向的区域,通过子宫壁将含有目标表达构建体的溶液显微注射到胚胎大脑的某个脑室中。在第二步中,施加电脉冲以转染直接衬在靶心室内的细胞。这种方法不仅限于异位表达或基因的过表达,因为它还可以通过显微注射短发夹(shRNA)或CRISPR / Cas9(以表达质粒或核糖核蛋白[RNPs]的形式)分别应用于KD或KO研究26,27。然而,小鼠、大鼠和雪貂胚胎的子宫内电穿孔具有与上述这些动物模型相同的局限性。
理想情况下,人们希望直接在灵长类动物的 子宫内 进行电穿孔。虽然这在原则上在技术上是可行的,但由于伦理问题、高动物维护成本和小窝产仔数,灵长类动物不会在 子宫内 进行电穿孔。对于某些灵长类动物,例如类人猿(包括人类),这根本不可能。然而,这些灵长类动物在研究人类(病理)生理新皮层发育及其进化方面具有最大的潜力。解决这一困境的一种方法是将电穿孔技术应用于灵长类动物脑类器官28。
本文提出了灵长类脑类器官亚型灵长类脑类器官电穿孔的方案。这种方法允许对类器官的心室样结构内的细胞群进行快速且具有成本效益的遗传修饰。具体来说,我们描述了从人类(智人),黑猩猩(Pan穴居人),恒河猴(Macaca mulatta)和普通狨猴(Callithrix jacchus)iPSCs中产生灵长类动物大脑类器官的统一协议。此外,我们详细描述了显微注射和电穿孔技术,并提供了进行灵长类大脑类器官电穿孔的"通过"和"不通过"标准。这种方法是研究(病理)生理新皮层发育及其在特别接近人类情况的模型中的进化的有效工具。
研究方案
1. 灵长类iPSCs的培养
注意:由于其稳健性,此处介绍的方法可以应用于任何灵长类iPSC系。在本文中,我们描述了人类(iLonza2.2)29,黑猩猩(Sandra A)30,恒河猴(iRh33.1)29和普通狨猴(cj_160419_5)31 iPSC系的大脑类器官生产。培养条件总结于表1中。有关本协议中使用的所有材料、试剂和设备的详细信息,请参阅材料表。
- 为了培养相应的iPSC,请遵循最初描述的培养条件。一般来说,为了成功生成和电穿孔脑类器官,请使用未培养超过90代的iPSC系。此外,在大脑类器官生成开始时,确保iPSCs表现出多能性特征,没有分化迹象。
2. 灵长类 iPSC 生成脑类器官
注意:脑类器官生成的方案基于原始脑类器官方案10,34的修改版本28,30,32,33,并进行了一些物种特异性修改(详见下文)。
- 接种iPSCs以产生拟胚体(EB)
- 一旦iPSC达到80%-90%汇合度,用Dulbecco的磷酸盐缓冲盐水(DPBS)洗涤它们,并加入500 μL重组胰蛋白酶替代品或1 mL蛋白水解和胶原溶解混合物。
注意:通常,iPSCs在60 mm细胞培养皿中培养以获得约900,000个细胞,这足以产生96个脑类器官。细胞数量可以根据所需的类器官数量进行调整。请注意,并非所有生成的脑类器官都适合电穿孔。 - 将培养皿在37°C孵育2分钟以分离细胞。
注意:可能需要在37°C下再孵育2分钟,具体取决于所使用的iPSC系或酶。建议在显微镜下检查培养皿,以确保细胞已开始分离。 - 加入 1.5 mL 预热 (37 °C) iPSC 培养基以停止反应,并上下移液 7x-10x(不超过 10x)以使细胞从细胞培养皿中解离并获得 单细胞悬液。
- 将细胞悬液转移到 15 mL 锥形离心管中,并在室温下以 200 × g 离心细胞 5 分钟。
- 吸出上清液,并将沉淀重悬于补充有 50 μM Y27632 或 50 μM 促生存化合物的 2 mL iPSC 培养基中。
- 使用 10 μL 细胞悬液使用纽鲍尔室对细胞进行计数。
- 使用补充有 50 μM Y27632 或 50 μM 促生存化合物的 iPSC 培养基,将细胞悬液调节至每 150 μL 9,000 个细胞(60,000 个细胞/mL)的浓度。
- 为了产生拟胚体 (EB),将 150 μL 细胞悬液接种到超低附着 96 孔板的每个孔中。移液时, 轻轻摇动 含有细胞悬液的管,以防止细胞沉淀。
- 在37°C(播种后0天[dps])的5%CO2和95%空气的腐殖气氛中培养EB。在播种后的前24小时内不要打扰EB。
注意:由狨猴iPSC产生的EB需要在37°C的缺氧条件下(5%CO 2,5%O 2和90%N 2)在腐殖气氛中培养。 - ~48小时(2dps)后,将培养基更换为 不含Y27632/促存活化合物的iPSC培养基。每孔取出 100 μL 培养基,并加入 150 μL 不含 Y27632 的预热 (37 °C) 新鲜培养基。逐行进行。
- 每隔一天进行进一步的介质更换;从每个孔中取出 150 μL 培养基,并在每孔中加入 150 μL 不含 Y27632/促生存化合物的预热 (37 °C) 新鲜培养基。
注意: 在 4-5 dps 后,EB 的外围应变为半透明。
- 一旦iPSC达到80%-90%汇合度,用Dulbecco的磷酸盐缓冲盐水(DPBS)洗涤它们,并加入500 μL重组胰蛋白酶替代品或1 mL蛋白水解和胶原溶解混合物。
- 神经外胚层的诱导
注意:一般来说,高质量的EB在此阶段应具有平滑的轮廓和半透明的边框。灵长类动物和iPSC系之间的神经诱导时间点略有不同。对于此处使用的细胞系(参见第1节和材料表),狨猴EB的神经诱导通常需要从4 dps开始,恒河猴的神经诱导为5 dps,人类和黑猩猩EB的神经诱导为4-5 dps(图1A),具体取决于EB的状态(见上文)。- 从96孔板第一排的每个孔中取出150μL培养基,并在同一行中每孔加入150μL预热(37°C) 神经诱导培养基 (见 表2)。
- 继续按照上述一行逐行更换整个96孔板的培养基。通过从每个孔中取出 150 μL NIM 并加入 150 μL 预热 (37 °C) 新鲜 NIM,每隔一天进行进一步的神经诱导培养基 (NIM) 更换。
注意:从这一点开始,狨猴EB应在与其他灵长类EB相同的条件下培养(37°C时5%CO2 和95%空气的腐殖化气氛)。
- 嵌入基底膜基质中
注意:一旦EB在表面上形成明显的,半透明的,放射状组织的神经上皮,就需要为心室样结构的发展提供结构支持。这是通过将EB嵌入基底膜基质来实现的。由于发育速度的差异,狨猴和恒河猴EB已经准备好嵌入7 dps,而人类和黑猩猩EB通常以8-9 dps嵌入。为简单起见,基底膜基质在本协议中仅指基质胶。但是,Geltrex可以用作替代品。- 在准备包埋时,对剪刀、镊子、用于 0.2 mL 管的小架子和三到六平方的封口膜在层流罩下用 70%(体积/体积)乙醇处理 15 分钟。让基底膜基质在冰上解冻数小时(~1.5 mL 基底膜基质通常足以容纳 96 EB)。
注意: 始终 将基底膜基质放在冰上。 - 在封口膜上创建一个 4 x 4 的酒窝网格。将封口膜网格放在 0.2 mL 管架上,使纸封面朝上,然后用戴手套的手指轻轻按压管架的每个孔。
- 取出纸张,用剪刀将酒窝网格从封口膜方块中剪出,以调整其大小以适合60毫米细胞培养皿。将凹陷的封口膜放回 0.2 mL 管架上,为基底膜基质液滴的产生提供基础。
- 使用带有切割的 200 μL 移液器吸头的移液器,小心地将 EB 一个接一个地从培养皿孔转移到封口膜酒窝中。
- 将 16 个 EB 移动到网格后,取一个新的 200 μL 移液器吸头,并从酒窝中取出剩余的培养基。
- 将一滴(~15μL)基底膜基质移液到每个含有一个EB的酒窝上。
- 取 10 μL 移液器吸头, 快速 将 EB 移动到每个液滴的中心,而不会干扰液滴边界。
- 将带有基底膜基质滴的凹陷封口膜放入60mm细胞培养皿中,并在37°C下孵育15-30分钟以使基质聚合。
- 要将基质嵌入的EB从封口膜中分离,向培养皿中加入5 mL不含 维生素A的分化培养基(DM)( 见 表2),并使用镊子将封口膜方块倒置,使EB的一侧朝向培养皿底部。
- 小心摇动培养皿,使含有EB的基底膜基质液滴从封口膜上分离。如果其中一些仍然附着,请使用镊子将封口膜方块的边缘,并将其快速卷向盘子的中心多次。
- 在37°C的5%CO2和95%空气的腐殖气氛中以55rpm在轨道振荡器上培养脑类器官。 将它们保存在不含维生素A的DM中,每隔一天更换一次培养基。为了诱导神经元的产生,在狨猴和恒河猴大脑类器官为 13 dps 或人类和黑猩猩大脑类器官为 14-15 dps 后切换到含有维生素 A(视黄酸,RA)的 DM(图 1A)。从这一点开始,每3-4天更换一次培养基。
注意:为了支持神经元存活,含有维生素A的DM可以从40 dps开始补充20μg/ mL人神经营养因子3(NT3),20μg/ mL脑源性神经营养因子(BDNF)和1μL/mL基底膜基质。
- 在准备包埋时,对剪刀、镊子、用于 0.2 mL 管的小架子和三到六平方的封口膜在层流罩下用 70%(体积/体积)乙醇处理 15 分钟。让基底膜基质在冰上解冻数小时(~1.5 mL 基底膜基质通常足以容纳 96 EB)。
3. 灵长类动物脑类器官的电穿孔
注意:从技术角度来看,一旦心室样结构足够明显,可以通过显微注射靶向脑类器官,就可以进行脑类器官的电穿孔。最佳电穿孔时间窗口取决于生物学问题和感兴趣的细胞群。例如,如果顶端祖细胞(AP)是主要靶标,那么大约30 dps的大脑类器官已经是合适的了。如果基底祖细胞(BPs)或神经元是主要靶标,则应使用超过50 dps的较老的大脑类器官(例如,参见Fischer等人28)。
- 电穿孔装置的准备
注意:电穿孔效率受电穿孔质粒的大小和浓度的强烈影响(有关详细信息,请参阅讨论部分)。- 为对照和目的基因(GOI)准备足够量的电穿孔混合物,例如,每个对照和GOI准备足够量的电穿孔混合物,以在每个条件下电穿孔约30个脑类器官。
注意:有关电穿孔混合物的组成,请参见 表3。 - 预热(非无菌)Dulbecco的改良Eagle培养基/营养混合物F-12(DMEM / F12)和DM与维生素A至37°C。 准备一把小刮刀和细剪刀和普通剪刀,并用70%(体积/体积)乙醇喷洒仪器。
注意:以下步骤可以在无菌或非无菌条件下进行,因为DM含有抗生素(见 表2)。根据我们的经验,没有无菌从未造成任何污染。 - 准备35 mm细胞培养皿,并将培养皿电极室连接到电穿孔器。
注意:培养皿电极室是市售的。但是,它们可以以具有成本效益的方式轻松生产(请参阅 补充文件 1)。 - 使用微量加载器吸头,用 8 μL 每种电穿孔混合物填充显微注射针头。第一次使用前用细剪刀剪针尖,以达到稳定的流动。但是, 仅去除尖端的一小部分,因为钝而宽的尖端会严重损坏类器官。
注意:显微注射针可以作为预拉式显微注射针在市场上购买,也可以作为拉针器在实验室中拉动。按照拔针器制造商的说明生成具有长锥度和 10 μm 尖端直径的显微注射针。
- 为对照和目的基因(GOI)准备足够量的电穿孔混合物,例如,每个对照和GOI准备足够量的电穿孔混合物,以在每个条件下电穿孔约30个脑类器官。
- 显微注射和电穿孔
- 在显微镜下,选择五个具有光滑边界和 清晰可见的心室样结构的大脑类器官。使用切开的 1,000 μL 移液器吸头将它们移动到含有预热 (37 °C) DMEM/F12 的 35 mm 细胞培养皿中。
注意:选择具有明显且可触及的心室样结构的脑类器官(见 图1B)。 - 要注射心室样结构,请小心地将针头插入其壁,并注入电穿孔混合物,直到 明显填充。不要对心室样结构施加过大的压力,以免它们破裂。以这种方式进行每个大脑类器官的六到八个心室样结构。
注意:如果在显微注射过程中针头堵塞,则需要稍微修剪尖端。 - 用少量DMEM / F12将一个显微注射的脑类器官转移到 培养皿电极室 中。以显微注射的心室样结构的表面朝向连接到电穿孔器正极的电极的方式排列类器官。
注意:以这种方式定向结构可确保细胞转染在不受相邻结构影响的心室样结构的一侧。 - 使用以下设置逐个电穿孔脑类器官:5 个 80 V 脉冲、50 ms 脉冲持续时间和 1 s 间隔。将电穿孔类器官移至装有预热(37°C)DMEM / F12的新35 mm细胞培养皿中。
注意:电穿孔设置可能取决于可用的方波电穿孔器。这些设置针对参考的电穿孔系统进行了优化。增加电压会导致电池位移。 - 使用第二种电穿孔混合物(例如GOI)以相同的方式处理接下来的五个大脑类器官。
注意:重复步骤3.2.1-3.2.5,直到达到所需数量的电穿孔脑类器官。 - 如果在非无菌条件下进行显微注射和电穿孔,则将电穿孔类器官转移到层流罩下的 无菌 35 mm细胞培养皿中,同时尽可能少地将DMEM / F12移动到新的细胞培养皿中。
- 在显微镜下,选择五个具有光滑边界和 清晰可见的心室样结构的大脑类器官。使用切开的 1,000 μL 移液器吸头将它们移动到含有预热 (37 °C) DMEM/F12 的 35 mm 细胞培养皿中。
- 脑类器官的进一步培养和固定
- 在37°C的5%CO2 和95%空气的腐殖气氛中以55rpm的轨道振荡器在DM中用维生素A培养电穿孔类器官。
- 电穿孔后的第二天,在常规倒置荧光显微镜下检查脑类器官是否成功电穿孔。
注意:根据电穿孔后进一步培养的长度,大脑类器官内的不同细胞群会受到影响(另见代表性结果部分)。 - 在培养电穿孔的脑类器官一段时间后,继续进行下游应用,适合感兴趣的生物学问题。
注意:电穿孔的脑类器官可以处理用于不同的下游应用(例如,用于免疫荧光染色的固定或用于RNA分离和qRT-PCR的快速冷冻)。在这里,我们描述了电穿孔脑类器官的固定。 - 使用切开的1,000μl移液器吸头将电穿孔类器官转移到15mL锥形离心管中,并除去多余的培养基。
- 在DPBS(pH 7.5)中加入足量的4%多聚甲醛(PFA),并在室温下孵育30分钟。
注意:PFA被归类为人类致癌物,可能会造成无法弥补的健康损害。强烈建议采取额外的预防措施,包括丁腈手套和护目镜。 - 吸出PFA,加入5mL DPBS,摇晃一点,然后吸出DPBS。重复此操作 2 次。将类器官储存在DPBS中的4°C直至进一步使用。
注意:该方案可以在此处暂停,因为PFA固定的脑类器官可以在4°C下储存数月。PFA固定的电穿孔类器官可以通过冷冻切片和免疫荧光染色10,28或通过整体安装染色和清除35,36进行分析。有关示例图像,请参阅代表性结果部分(抗体详细信息见表4)。
结果
此处描述的方案允许从人类、黑猩猩、恒河猴和普通狨猴 iPSC 系中有效生成大脑类器官,而物种之间所需的时间变化最小(图 1A)。这些类器官可以在20 dps至50 dps的范围内电穿孔,具体取决于心室样结构的可及性和目标细胞群的丰度。然而,在电穿孔之前,重要的是要确定脑类器官的质量是否足以进行电穿孔。
非常适合电穿孔的脑类器官应在外围表现出明显的明亮心室样结构,没有变性迹象(例如,分离细胞,凋亡核心增大),并且通常具有紧凑的健康形态(例如,没有过度生长)(图1B,"Go")。最好选择具有大而组织良好、心室样结构的脑类器官,以靶向更多数量的细胞。如果类器官的外围区域是黑暗的并且没有显示任何突出的结构,建议不要将其用于电穿孔,因为精确的显微注射可能会因缺乏视觉线索而受到影响(图1B,"不行")。为了实现最佳的大脑类器官形态,必须确保神经外胚层诱导和基质嵌入等关键步骤适时进行。有关脑类器官形态的问题通常源于神经外胚层和/或神经上皮芽形成失败。这通常是由神经诱导和/或基底膜基质嵌入的次优时机引起的,可以通过调整这些步骤的时间来解决(脑类器官形成的进一步故障排除技巧可以在Lancaster和Knoblich34中找到)。
电穿孔后,可以在12小时后对其成功和效率进行首次评估,此时转染细胞的GFP表达在常规倒置荧光显微镜下可检测到。理想情况下,在这个阶段,多个心室样结构发出位于其一侧的亮绿色荧光(图2A)。这表明该程序的高精度和高效率。四种不同灵长类动物(即人类、黑猩猩、恒河猴和普通狨猴)的成功电穿孔脑类器官在靶向心室样结构中显示出相似的 GFP 阳性模式(图 2A)。此外,在电穿孔灵长类动物脑类器官的固定和冷冻切片后,所有四种物种的成功电穿孔心室样结构在径向组织和密集堆积的心室区(VZ)内表现出GFP阳性细胞柱(图2B)。电穿孔后2天,在黑猩猩和狨猴大脑类器官的这些区域中,DAPI阳性细胞也呈GFP阳性(来自12个类器官的17个脑室定量)的定量表明,平均而言,大约三分之一的细胞(33%,SD±12%)成功电穿孔。
次优电穿孔的特征是心室样结构内的少量GFP阳性细胞(图3A)或远离任何心室样结构的少数GFP阳性细胞(图3B)。GFP阳性细胞数量少是由质粒摄取不良引起的。这可能是由于微量注射电穿孔混合物量不足引起的质粒浓度低,或者由于电脉冲方向不佳,这可能是由于大脑类器官在培养皿电极室中的定位欠佳引起的。远离任何心室样结构的GFP阳性细胞数量较少是由不精确的显微注射导致大脑类器官内有丝分裂后细胞(例如神经元)的电穿孔引起的。这些次优电穿孔需要从任何进一步的分析中排除。
大脑类器官中存在的细胞类型的可靠鉴定基于心室样结构中的细胞位置,这需要在VZ和SVZ/神经元富集区之间定义边界。该边界可以通过VZ的径向组织和高细胞核密度特征来识别(参见 补充图S1中的DAPI染色)。VZ/SVZ 边界的确认可以通过对神经祖细胞标记物(如 PAX6 或 SOX2)进行免疫荧光染色来完成,这些标记物几乎由所有 VZ 细胞 (AP) 和一些 SVZ 细胞 (BP) 表达。神经元富集区的存在可以通过免疫荧光染色来验证神经元标志物,例如III类β-微管蛋白(TUJ1)或NeuN(补充图S1)。
电穿孔后脑类器官培养的持续时间取决于生物学问题和感兴趣的细胞群。在最近的一项研究中,研究表明,电穿孔后不同长度的进一步培养会影响黑猩猩大脑类器官中的不同细胞群,范围从AP到上层神经元24。在这里,我们显示了电穿孔狨类器官的类似结果。具体来说,电穿孔后2天,GFP阳性细胞几乎完全定位在VZ中,并且对PAX6(神经祖细胞的标志物)也呈阳性,表明这些细胞是AP或新生儿BP(图4A)。如果电穿孔后的培养期延长至10天,则GFP阳性细胞定位在基底区域(即SVZ和神经元富集区)(图4B,C)。这些细胞(除了GFP信号外)也可以对PAX6(图4B)呈阳性,这表明BPs或NeuN(图4C),这是指示神经元的。对于人和恒河猴电穿孔脑类器官,可以获得类似的结果。总之,不同的祖细胞类型以及神经元可以通过这种技术成功靶向。
几乎所有先前显示的数据都来自电穿孔脑类器官产生的组织学切片的免疫染色。然而,分析这些类器官的另一种优雅方法是进行全安装免疫染色,然后进行光学清除35,36。这将允许电穿孔脑类器官的3D重建,以获得GFP阳性细胞3D分布的印象。 图5 和 视频1 显示了光学清除的电穿孔脑类器官中GFP信号的代表性示例。
总之,这里描述的电穿孔方案提供了一种精确有效的方法,将瞬时遗传修饰引入来自不同灵长类动物iPSC系的大脑类器官的不同祖细胞类型和神经元中。
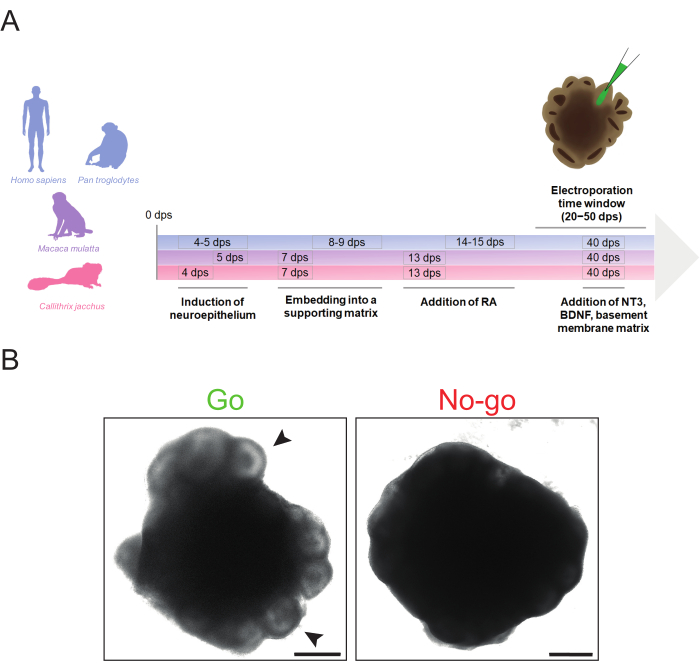
图1:灵长类动物大脑类器官生成的示意图以及电穿孔的形态学"通过"和"不通过"标准 。 (A)灵长类大脑类器官生成和电穿孔的时间表,突出了人类和黑猩猩(蓝色)、恒河猴(紫色)和狨猴(洋红色)的方案步骤的不同时间。请注意,时间线的时间顺序不是按比例排列的。(B)合适的(左图,Go)和不合适的(右图,不去)32 dps人脑类器官的明场图像。箭头表示适合显微注射的心室样结构的示例。这些图像是使用蔡司Axio Observer.Z1倒置荧光显微镜和2.5倍物镜采集的。比例尺 = 500 μm。缩写:BDNF = 脑源性神经营养因子;DPS = 播种后的天数;NT3 = 神经营养因子 3;RA = 视黄酸。 请点击此处查看此图的大图。
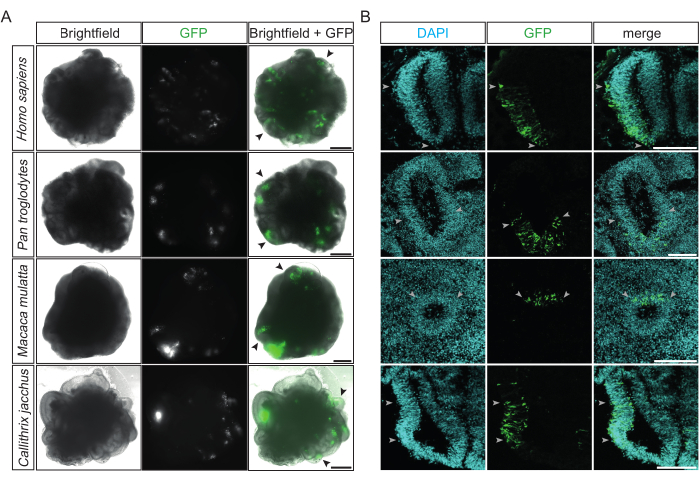
图2:成功电穿孔灵长类动物大脑类器官的示例 。 (A)用表达GFP的质粒电穿孔15-48小时后22 dps人类,32 dps黑猩猩,32 dps恒河猴和31 dps狨猴脑类器官(从上到下)的明场(左列),荧光(中列)和合并(右列)图像。黑色箭头表示单个电穿孔心室样结构的例子。这些图像是使用蔡司Axio Observer.Z1倒置荧光显微镜和2.5倍物镜采集的。比例尺 = 500 μm。 (B)GFP(绿色)的免疫荧光结合32 dps人,34 dps黑猩猩,32 dps恒河猴和32 dps狨猴脑类器官(从上到下)的免疫荧光在电穿孔后2-4天与表达GFP的质粒。浅灰色箭头表示心室样结构内电穿孔区域的边界。这些图像是使用蔡司LSM 800共聚焦显微镜和10倍物镜采集的。比例尺 = 150 μm。缩写:DAPI = 4',6-二脒基-2-苯基吲哚;DPS = 播种后的天数;GFP = 绿色荧光蛋白。 请点击此处查看此图的大图。

图3:未成功电穿孔灵长类动物脑类器官的示例。 (A,B)GFP(绿色)的免疫荧光与DAPI染色(青色)结合(A)34 dps恒河猴脑类器官电穿孔后4天与(B)用表达GFP的质粒电穿孔后2天32 dps恒河猴脑类器官。浅灰色箭头表示电穿孔细胞。浅灰色虚线轮廓表示与电穿孔细胞相邻的心室样结构的 VZ 和 SVZ/神经元富集区之间的边界。这些图像是使用蔡司LSM 800共聚焦显微镜和10倍物镜采集的。比例尺 = 150 μm。缩写:DAPI = 4',6-二脒基-2-苯基吲哚;DPS = 播种后的天数;GFP = 绿色荧光蛋白;SVZ = 脑室下区;VZ = 心室区。请点击此处查看此图的大图。

图4:电穿孔后灵长类动物大脑类器官中存在的各种细胞群的可视化。 (A-C)GFP(绿色)和PAX6(A,B;洋红色)或NeuN(C;洋红色)的双重免疫荧光,在所有情况下与DAPI染色(青色)相结合,在用表达GFP的质粒电穿孔2天后(A)32 dps狨猴脑类器官,以及(B,C)在用表达GFP的质粒电穿孔10天后40 dps狨猴脑类器官。浅灰色箭头表示(A,B)GFP+和PAX6+或(C)NeuN +双阳性细胞。浅灰色虚线表示VZ和SVZ/神经元富集区之间的边界。这些图像是使用蔡司LSM 800共聚焦显微镜和20倍物镜采集的。比例尺 = 100 μm。缩写:DAPI = 4',6-二脒基-2-苯基吲哚;DPS = 播种后的天数;GFP = 绿色荧光蛋白;NeuN = 神经元核蛋白;PAX6 = 配对框 6 蛋白;SVZ = 脑室下区;VZ = 心室区。请点击此处查看此图的大图。
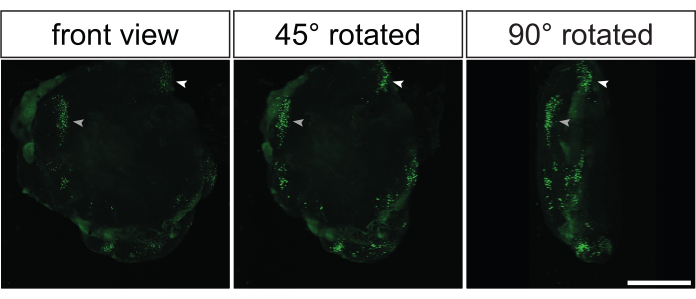
图 5:光学清除后通过电穿孔灵长类动物大脑类器官的 3D 共聚焦成像对电穿孔图像进行三维重建。 用表达GFP的质粒电穿孔2天后,3D重建的32 dps人脑类器官的正面(左图),45°旋转(中图)和90°旋转(右图)视图。在成像之前,根据2Eci方法35对类器官进行光学清除。使用蔡司LSM 800共聚焦显微镜和10倍物镜,从269个彼此相距3.73μm的光学切片(每个厚度1μM)生成整个电穿孔类器官的3D重建。使用斐济对图像进行处理以进行3D重建。请注意,这些图像取自 视频1所示的相同3D重建类器官。比例尺 = 500 μm。缩写:GFP = 绿色荧光蛋白。 请点击此处查看此图的大图。
视频1:光学清除后的3D重建电穿孔人脑类器官。 用表达GFP的质粒电穿孔2天后3D重建的32 dps人脑类器官的视频。在成像之前,根据2Eci方法35对类器官进行光学清除。使用蔡司LSM 800共聚焦显微镜和10倍物镜,从269个彼此相距3.73μm的光学切片(每个厚度1μM)生成整个电穿孔类器官的3D重建。使用斐济对图像进行处理以进行3D重建。请注意,该视频取自 图5所示的相同3D重建类器官。 请点击此处下载此视频。
| iPSC 生产线 | 物种 | 出版 | 培养基组成 | 培养条件 | ||||
| iLonza2.2 | 智人 | 斯陶斯克等人,2020 | 1 μM IWR1 和 0.5 μM CHIR 采用 StemMACS iPS-Brew XF | 5% CO2 和 95% 空气的腐化气氛,37 °C | ||||
| 桑德拉· | 泛穴居人 | 莫拉-贝穆德斯等人,2016 | mTeSR1 | 5% CO2 和 95% 空气的腐化气氛,37 °C | ||||
| iRh33.1 | 猕猴穆拉塔 | 斯陶斯克等人,2020 | 1 μM IWR1 和 0.5 μM CHIR 采用 StemMACS iPS-Brew XF | 5% CO2 和 95% 空气的腐化气氛,37 °C | ||||
| cj_160419_5 | Callithrix jacchus | 佩特科夫等人,2020 | 3 μM IWR1, 0.3 μM CGP77675, 0.3 μM AZD77675, 0.5 μM CHIR99021, 10 μM 佛司可林, 1 ng/mL Activin A, 1 μM OAC1 in StemMACS iPS-Brew XF | 5%CO2、5%O 2和90%N2的腐殖气氛,37°C | ||||
表1:本出版物中使用的灵长类iPSC的培养条件。 缩写:iPSCs=诱导多能干细胞。
| 中等 | 组成 | ||
| 神经诱导培养基 | 1x N-2 补充剂、1x 谷氨酰胺替代品补充剂、1x MEM 非必需氨基酸溶液、1 μg/mL 肝素在 Dulbecco 的改良 Eagle 培养基 F12 (DMEM/F12) 中 | ||
| 不含维生素A的分化培养基(DM) | 0.5x B-27 补充剂(减去维生素 A)、0.5x N-2 补充剂、0.5x MEM 非必需氨基酸溶液、1x 谷氨酰胺替代品补充剂、100 U/mL 青霉素-链霉素、0.00035% 2-巯基乙醇、2.875 ng/mL 胰岛素,1:1 DMEM/F12 和神经基础培养基 | ||
| 含维生素A的分化培养基(DM) | 0.5x B-27 补充剂、0.5x N-2 补充剂、0.5x MEM 非必需氨基酸溶液、1x 谷氨酰胺替代品补充剂、100 U/mL 青霉素-链霉素、0.00035% 2-巯基乙醇、2.875 ng/mL 胰岛素,1:1 DMEM/F12 和神经基础培养基中的胰岛素 | ||
表2:用于灵长类动物大脑类器官生成和培养的培养基组成。
| 元件 | 控制电穿孔混合物 | GOI电穿孔混合物 |
| GFP表达质粒 | 500 纳克/微升 | 500 纳克/微升 |
| 空向量 | 500 纳克/微升 | - |
| GOI表达质粒 | - | 500 纳克/微升 |
| 快速绿色 | 0.10% | 0.10% |
| 在 DPBS 中 |
表3:对照和目标基因的电穿孔混合物(单独的质粒方法)的组成。 缩写:GOI = 目的基因。
| 抗体 | 公司 | 货号 | 里德 | 稀释 |
| 鸡肉抗GFP | 阿维斯实验室 | GFP-1020 | RRID:AB_10000240 | 1:300 |
| 兔子反PAX6 | 诺瓦斯生物制剂 | NBP1-89100 | RRID:AB_11013575 | 1:300 |
| 兔子反诺伊恩 | 阿卡姆 | 编号: AB104225 | RRID:AB_10711153 | 1:300 |
| 山羊防鸡亚历克萨福陆 488 | 赛默飞世尔 | A-11039 | RRID:AB_142924 | 1:500 |
| 驴防兔亚历克萨福陆555 | 赛默飞世尔 | A-31572 | RRID:AB_162543 | 1:500 |
表4:用于免疫荧光染色的抗体。
补充图S1:电穿孔灵长类动物脑类器官中的VZ/SVZ边界测定。 用表达GFP的质粒电穿孔2天后,PAX6(品红色)和TUJ1(黄色)的双重免疫荧光与32 dps狨猴脑类器官的DAPI染色(青色)相结合。GFP的免疫荧光未显示。浅灰色虚线表示VZ和SVZ/神经元富集区之间的边界。这些图像是使用蔡司LSM 800共聚焦显微镜和20倍物镜采集的。比例尺 = 100 μm。缩写:DAPI = 4',6-二脒基-2-苯基吲哚;DPS = 播种后的天数;PAX6 = 配对框 6 蛋白;SVZ = 脑室下区;TUJ1 = III类β-微管蛋白;VZ = 心室区。 请点击此处下载此文件。
补充文件1:培养皿电穿孔室组装说明。请点击此处下载此文件。
讨论
这里描述的程序代表了一个统一的方案,用于使用靶向电穿孔方法从不同的灵长类动物物种中生成大脑类器官。这允许GOI在模拟灵长类动物(包括人类)(病理)生理新皮层发育的模型系统中的异位表达。这种用于生成灵长类动物大脑类器官的统一方案对所有四种灵长类动物使用相同的材料(例如培养基)和方案步骤。这些物种之间的发育差异通过改变关键方案步骤的时间来解决(即,神经诱导和嵌入基底膜基质;见上文)。这可能大致反映了这些物种之间的 体内 神经发育时间差异,并构成了进一步研究的有趣主题。
该方法基于先前关于脑类器官10的论文中描述的电穿孔实验。然而,正如Lancaster及其同事所指出的,这些实验受到广泛凋亡的限制,这是由于高GFP浓度而发生的,并导致排除表现出强GFP信号的电穿孔细胞10。在我们的实验中,我们发现最终的总质粒浓度(例如,编码EGFP的质粒浓度加上GOI编码的质粒浓度)为 1,000 ng/μL是最佳的。浓度低于 1,000 ng/μL 会导致电穿孔效率降低,而高于 1,000 ng/μL 的高浓度可能对电穿孔细胞有毒并导致细胞死亡10。结合两种以上不同表达质粒的研究是可能的28。但是,最终的总质粒浓度应保持在1,000 ng/μL。
在典型的电穿孔方法中,需要编码荧光标记物的质粒来鉴定成功的电穿孔细胞。在实验设置中包括荧光标记物有两种可能性:(i)通过共同进样两个单独的质粒(即,编码标记物的质粒加上对照质粒[例如,空载体]或编码目的基因[GOI]的质粒)( 单独的质粒方法);(ii)通过使用内部核糖体进入位点(IRES)或2A自裂肽(例如P2A)(单质粒方法)注射一个编码标记物和GOI的 质粒。在这种情况下,仅编码荧光标记物的质粒用作对照。虽然单质粒方法导致荧光标记物和GOI的完全共表达,但这种质粒体积大,导致电穿孔效率低。如果需要高电穿孔效率, 建议使用单独的质粒方法,因为分离的表达不会显着影响荧光标记物和GOI的共表达水平,同时保持高电穿孔效率28。在这里介绍的方案中,我们描述了使用单独的质粒方法的电穿孔。如果应用单质粒方法,则必须相应地调整方案中的步骤。
与最近发布的协议37相比,我们的方法具有三个主要优点。首先,我们专门针对大脑类器官的心室样结构。我们(i)通过显微注射大脑类器官的单个心室样结构而不是注射到类器官的中心37 和(ii)通过在培养皿电极室中安排大脑类器官的方向来优化电场的方向(见上文),而不是使用电穿孔比色皿37.其次,该协议不涉及使用昂贵的核子溶液,因为这种方法使用方波电穿孔器与培养皿电极室结合使用。第三,这种用于产生灵长类大脑类器官的统一方案不仅可以研究人类,还可以研究非人类灵长类器官,从而可以进行进化,比较和疾病研究。
关于大脑类器官的两个特征对于成功的电穿孔至关重要 - 大脑类器官的质量以及心室样结构的大小和质量(参见代表性结果和 图1B)。关于第一个特征,我们提出了进行电穿孔的通过和不通过标准(见上文和 图1B)。主要标准是是否存在清晰可见、半透明和放射状组织的心室样结构。心室样结构的大小是成功的显微注射和电穿孔的第二个关键特征。太小的心室样结构难以注射,并且通常不会产生足够多的电穿孔细胞用于后续分析。这就是为什么我们使用改良的脑类器官方案的主要原因,因为与其他方案相比,该协议在我们手中和这些iPSC系中产生了组织良好的心室样结构,这些结构足够大,可以电穿孔。原则上,这里介绍的电穿孔方法可以应用于任何其他神经类器官方案,只要后者产生足够大且有组织的心室样结构(参见代表性结果和 图1B)。此外,该协议还可以应用于未来的其他灵长类动物,例如食蟹猕猴(Macaca fascicularis),这是工业研究中使用的经典灵长类动物模型。这需要识别此处描述的改良脑类器官方案的正确关键时间点(见上文),或者建立产生合适的大心室样结构的神经类器官方案(见上文)。
成功电穿孔后,脑类器官可以进一步培养不同的时间段,以使所检查的基因修饰影响发育中的大脑类器官内的各种细胞群。这些范围从各种神经祖细胞群到大脑类器官中存在的不同类型的神经元(参见代表性结果和Fischer等人28)。然后可以通过冷冻切片和免疫荧光染色(见图 4)或通过PFA固定电穿孔脑类器官的全安装免疫荧光染色和光学清除(见 图5 和 视频1)来分析这些细胞群。
到目前为止,脑类器官的电穿孔主要用于基因的异位表达,进行基因功能研究10,28,38,39,39,40,细胞形态可视化40和细胞分裂示踪10.然而,在第一篇脑类器官论文中,shRNA通过电穿孔引入类器官中,以沉默RNA干扰的基因表达。这表明电穿孔不仅可用于基因的异位表达,还可用于基因的KD甚至KO的潜力。最近,研究表明,CRISPR/Cas9介导的KO可以通过小鼠胚胎27的子宫内电穿孔和胎人组织离体电穿孔41来实现。这种基于CRISPR/Cas9的KO可以很容易地应用于脑类器官的电穿孔,因为电穿孔的主要机制是相同的,这将进一步扩大这种方法的实用性。
电穿孔在脑类器官中的一个潜在进一步应用是在由于GOI与其祖先版本之间的高度相似序列而无法获得GOI的特定KO的情况下拯救特定的KO表型。对于最近进化的人类特异性基因来说尤其如此。在这种情况下,即使使用CRISPR / Cas9技术也不可能获得特定的KO(如 ARHGAP11A 和 ARHGAP11B28的情况)。解决这一困境的办法是产生GOI及其祖先基因的双KO,并通过电穿孔单独拯救GOI,单独拯救祖先基因或两个基因。然后,这些电穿孔类器官可以分别被视为选择性祖先基因KO,选择性GOI KO或对照。这将允许解决这些基因对表型的个体贡献(参见,例如,Fischer等人28)。另一个潜在的应用与分析由患者来源的iPSC产生的脑类器官有关。在这种情况下,尚不清楚观察到的表型是由于候选基因的突变还是由于患者存在的任何其他突变。在这里,候选基因的电穿孔和表型的(潜在)拯救将允许验证该基因在疾病中的作用(参见,例如,Lancaster等人10)。
综上所述,这里介绍的方案提供了一种快速且具有成本效益的方法,可以在灵长类动物大脑类器官的心室样结构内对细胞群进行基因修饰。这为研究神经发育和进化过程提供了有效的工具,也可以应用于疾病建模。
披露声明
提交人声明他们没有利益冲突。
致谢
我们向所有由于篇幅限制而无法引用其工作的研究人员表示歉意。我们感谢DPZ技术服务的Ulrich Bleyer和MPI-CBG研讨会的Hartmut Wolf,以建造培养皿电极室;斯托扬·佩特科夫和吕迪格·贝尔提供人类(iLonza2.2)、恒河猴(iRh33.1)和狨猴(cj_160419_5)iPSC;萨布丽娜·海德用于冷冻切片和免疫荧光染色;以及Neringa Liutikaite和César Mateo Bastidas Betancourt批判性地阅读了手稿。W.B.H.实验室的工作得到了ERA网络神经元(MicroKin)资助的支持。M.H.实验室的工作得到了ERC启动补助金(101039421)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 20 µL Microloader | Eppendorf | 5242956003 | |
| 2-Mercaptoethanol | Merck | 8.05740.0005 | |
| 35 mm cell culture dishes | Sarstedt | 83.3900 | |
| 60 mm cell culture dishes | CytoOne | CC7682-3359 | |
| Activin A | Sigma-Aldrich | SRP3003 | |
| AOC1 | Selleckchem | S7217 | |
| Axio Observer.Z1 Inverted Fluorescence Microscope | Zeiss | replacable by comparable fluorescent microscopes | |
| AZD0530 | Selleckchem | S1006 | |
| B-27 Supplement with Vitamin A (retinoic acid, RA) (50x) | Gibco | 17504-044 | |
| B-27 Supplement without Vitamin A (50x) | Gibco | 12587-010 | |
| BTX ECM 830 Square Wave Electroporation System | BTX | 45-2052 | |
| CGP77675 | Sigma-Aldrich | SML0314 | |
| Chimpanzee induced pluripotent stem cell line Sandra A | doi: 10.7554/elife.18683 | ||
| Common marmoset induced pluripotent stem cell line cj_160419_5 | doi: 10.3390/cells9112422 | ||
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Gibco | 11320-033 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Gibco | 14190-094 | pH 7.0−7.3; warm to room temperature before use |
| Fast Green | Sigma-Aldrich | F7252-5G | |
| Forskolin | Selleckchem | 2449 | |
| GlutaMAX Supplement (100x) | Gibco | 35050-061 | glutamine substitute supplement |
| Heparin (1 mg/mL stock) | Sigma-Aldrich | H3149 | |
| Human induced pluripotent stem cell line iLonza2.2 | doi: 10.3390/cells9061349 | ||
| Human Neurotrophin-3 (NT-3) | PeproTech | 450-03 | |
| Insulin | Sigma-Aldrich | 19278 | |
| IWR1 | Sigma-Aldrich | I0161 | |
| Leica MS5 stereomicroscope (MDG 17 transmitted-light base) | Leica | 10473849 | replacable by comparable stereomicroscopes |
| Matrigel | Corning | 354277/354234 | basement membrane matrix; alternatively, Geltrex (ThermoFisher Scientific, A1413302) can be used |
| MEM Non-Essential Amino Acids Solution (100x) | Sigma-Aldrich | M7145 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Paraformaldehyde | Merck | 818715 | handle with causion due to cancerogenecity |
| Penicillin/Streptomycin (10,000 U/mL) | PanBiotech | P06-07100 | |
| Petri dish electrode chamber | self-produced (see Supplemental File 1) | also commertially available | |
| Pre-Pulled Glass Pipettes | WPI | TIP10LT | borosilicate glass pipettes with long taper, 10 µm tip diameter |
| Pro-Survival Compound | MerckMillipore | 529659 | |
| Recombinant Human/Murine/RatBrain-Derived Neurotrophic Factor (BDNF) | PeproTech | AF-450-02 | |
| Rhesus macaque induced pluripotent stem cell line iRh33.1 | doi: 10.3390/cells9061349 | ||
| StemMACS iPS-Brew XF | Miltenyi Biotech | 130-104-368 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | proteolytic and collagenolytic enzyme mixture |
| TrypLE | Gibco | 12604-013 | recombinant trypsin substitute; warm to room temperature before use |
| Ultra-Low Attachment 96-well plates | Costar | 7007 | |
| Y27632 | Stemcell Technologies | 72305 |
参考文献
- Marchetto, M. C. N., Winner, B., Gage, F. H. Pluripotent stem cells in neurodegenerative and neurodevelopmental diseases. Human Molecular Genetics. 19 (R1), R71-R76 (2010).
- Zhao, X., Bhattacharyya, A. Human models are needed for studying human neurodevelopmental disorders. The American Journal of Human Genetics. 103 (6), 829-857 (2018).
- Zhang, W., et al. Modeling microcephaly with cerebral organoids reveals a WDR62–CEP170–KIF2A pathway promoting cilium disassembly in neural progenitors. Nature Communications. 10 (1), 2612(2019).
- Sasaki, E., et al. Generation of transgenic non-human primates with germline transmission. Nature. 459 (7246), 523-527 (2009).
- Niu, Y., et al. Transgenic rhesus monkeys produced by gene transfer into early-cleavage–stage embryos using a simian immunodeficiency virus-based vector. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17663-17667 (2010).
- Niu, Y., et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell. 156 (4), 836-843 (2014).
- Shi, L., et al. Transgenic rhesus monkeys carrying the human MCPH1 gene copies show human-like neoteny of brain development. National Science Review. 6 (3), 480-493 (2019).
- Heide, M., et al. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science. 369 (6503), 546-550 (2020).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell–derived neocortex. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20284-20289 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Kelava, I., Lancaster, M. A. Stem cell models of human brain development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Lullo, E. D., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Arlotta, P. Organoids required! A new path to understanding human brain development and disease. Nature Methods. 15 (1), 27-29 (2018).
- Heide, M., Huttner, W. B., Mora-Bermúdez, F. Brain organoids as models to study human neocortex development and evolution. Current Opinion in Cell Biology. 55, 8-16 (2018).
- Qian, X., Song, H., Ming, G. Brain organoids: Advances, applications and challenges. Development. 146 (8), dev166074(2019).
- Sun, N., Meng, X., Liu, Y., Song, D., Jiang, C., Cai, J. Applications of brain organoids in neurodevelopment and neurological diseases. Journal of Biomedical Science. 28 (1), 30(2021).
- Fischer, J., Heide, M., Huttner, W. B. Genetic modification of brain organoids. Frontiers in Cellular Neuroscience. 13, 558(2019).
- Pașca, S. P., et al. A nomenclature consensus for nervous system organoids and assembloids. Nature. 609 (7929), 907-910 (2022).
- Kyrousi, C., Cappello, S. Using brain organoids to study human neurodevelopment, evolution and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 9 (1), e347(2020).
- Teriyapirom, I., Batista-Rocha, A. S., Koo, B. -K. Genetic engineering in organoids. Journal of Molecular Medicine. 99 (4), 555-568 (2021).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Kawasaki, H., Toda, T., Tanno, K. In vivo genetic manipulation of cortical progenitors in gyrencephalic carnivores using in utero electroporation. Biology Open. 2 (1), 95-100 (2012).
- Kawasaki, H., Iwai, L., Tanno, K. Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Molecular Brain. 5 (1), 24(2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nature Neuroscience. 6 (12), 1277-1283 (2003).
- Kalebic, N., et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO reports. 17 (3), 338-348 (2016).
- Fischer, J., et al. Human-specific ARHGAP11B ensures human-like basal progenitor levels in hominid cerebral organoids. EMBO Reports. 23 (11), e54728(2022).
- Stauske, M., et al. Non-human primate iPSC generation, cultivation, and cardiac differentiation under chemically defined conditions. Cells. 9 (6), 1349(2020).
- Mora-Bermúdez, F., et al. Differences and similarities between human and chimpanzee neural progenitors during cerebral cortex development. eLife. 5, e18683(2016).
- Petkov, S., Dressel, R., Rodriguez-Polo, I., Behr, R. Controlling the switch from neurogenesis to pluripotency during marmoset monkey somatic cell reprogramming with self-replicating mRNAs and small molecules. Cells. 9 (11), 2422(2020).
- Camp, J. G., et al. Human cerebral organoids recapitulate gene expression programs of fetal neocortex development. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15672-15677 (2015).
- Kanton, S., et al. Organoid single-cell genomic atlas uncovers human-specific features of brain development. Nature. 574 (7778), 418-422 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Cakir, B., et al. Engineering of human brain organoids with a functional vascular-like system. Nature Methods. 16 (11), 1169-1175 (2019).
- Masselink, W., et al. Broad applicability of a streamlined ethyl cinnamate-based clearing procedure. Development. 146 (3), dev166884(2019).
- Denoth-Lippuner, A., Royall, L. N., Gonzalez-Bohorquez, D., Machado, D., Jessberger, S. Injection and electroporation of plasmid DNA into human cortical organoids. STAR Protocols. 3 (1), 101129(2022).
- Denoth-Lippuner, A., et al. Visualization of individual cell division history in complex tissues using iCOUNT. Cell Stem Cell. 28 (11), 2020.e12-2034.e12 (2021).
- Kelava, I., Chiaradia, I., Pellegrini, L., Kalinka, A. T., Lancaster, M. A. Androgens increase excitatory neurogenic potential in human brain organoids. Nature. 602 (7895), 112-116 (2022).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Kalebic, N., et al. Neocortical expansion due to increased proliferation of basal progenitors is linked to changes in their morphology. Cell Stem Cell. 24 (4), 535.e9-550.e9 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。