Method Article
Microinyección dirigida y electroporación de organoides cerebrales de primates para la modificación genética
En este artículo
Resumen
La electroporación de organoides cerebrales de primates proporciona un enfoque preciso y eficiente para introducir modificaciones genéticas transitorias en diferentes tipos de progenitores y neuronas en un sistema modelo cercano al desarrollo (pato)fisiológico del neocórtex de primates. Esto permite el estudio de los procesos evolutivos y del desarrollo neurológico y también se puede aplicar para el modelado de enfermedades.
Resumen
La corteza cerebral es la estructura cerebral más externa y es responsable del procesamiento de la entrada sensorial y la salida motora; Es visto como el asiento de las capacidades cognitivas de orden superior en los mamíferos, en particular, los primates. El estudio de las funciones genéticas en los cerebros de los primates es un desafío debido a razones técnicas y éticas, pero el establecimiento de la tecnología de organoides cerebrales ha permitido el estudio del desarrollo del cerebro en modelos tradicionales de primates (por ejemplo, macaco rhesus y tití común), así como en especies de primates previamente inaccesibles experimentalmente (por ejemplo, grandes simios), en un sistema éticamente justificable y menos exigente técnicamente. Además, los organoides cerebrales humanos permiten la investigación avanzada de trastornos neurológicos y del neurodesarrollo.
A medida que los organoides cerebrales recapitulan muchos procesos del desarrollo cerebral, también representan una herramienta poderosa para identificar diferencias y comparar funcionalmente los determinantes genéticos subyacentes al desarrollo cerebral de varias especies en un contexto evolutivo. Una gran ventaja del uso de organoides es la posibilidad de introducir modificaciones genéticas, lo que permite probar las funciones de los genes. Sin embargo, la introducción de tales modificaciones es laboriosa y costosa. Este documento describe un enfoque rápido y rentable para modificar genéticamente las poblaciones celulares dentro de las estructuras ventriculares de los organoides cerebrales de primates, un subtipo de organoides cerebrales. Este método combina un protocolo modificado para la generación confiable de organoides cerebrales a partir de células madre pluripotentes inducidas (iPSC) derivadas de titíes humanos, chimpancés, macacos rhesus y comunes con un enfoque de microinyección y electroporación. Esto proporciona una herramienta eficaz para el estudio de los procesos de desarrollo neurológico y evolutivo que también se puede aplicar para el modelado de enfermedades.
Introducción
Investigar el desarrollo (pato)fisiológico y la evolución de la corteza cerebral es una tarea formidable que se ve obstaculizada por la falta de sistemas modelo adecuados. Anteriormente, tales estudios se limitaban a modelos de cultivo celular bidimensionales (como progenitores neurales primarios o cultivos de células neuronales) y modelos animales evolutivamente distantes (como roedores)1,2. Si bien estos modelos son útiles para abordar ciertas preguntas, están limitados para modelar la complejidad, la composición del tipo de célula, la arquitectura celular y los patrones de expresión génica del neocórtex humano en desarrollo en estados sanos y enfermos. Estas limitaciones conducen, por ejemplo, a la escasa traducibilidad de los modelos de ratón de enfermedades humanas a la situación humana, como se describe para ciertos casos de microcefalia (por ejemplo, Zhang et al.3). Recientemente, los primates transgénicos no humanos, que son un modelo evolutivo, funcional y morfológicamente más cercano del desarrollo del neocórtex humano, se han enfocado 4,5,6,7,8 a medida que superan muchas limitaciones de los modelos basados en cultivos celulares y roedores. Sin embargo, el uso de primates no humanos en la investigación no solo es muy costoso y requiere mucho tiempo, sino que también plantea preocupaciones éticas. Más recientemente, el desarrollo de la tecnología de organoides cerebrales 9,10 ha surgido como una alternativa prometedora que resuelve muchas de las limitaciones de los modelos anteriores 11,12,13,14,15,16.
Los organoides cerebrales son estructuras tridimensionales (3D), multicelulares que emulan las características principales de la citoarquitectura y la composición de tipo celular de una o múltiples regiones cerebrales para una ventana de tiempo de desarrollo definida 11,12,13,14,17. Estas estructuras 3D se generan a partir de células madre pluripotentes inducidas (iPSC) o, si están disponibles para las especies de interés, a partir de células madre embrionarias (ESC). En general, se pueden distinguir dos tipos de organoides cerebrales con base en la metodología utilizada: organoides cerebrales no guiados y regionalizados (guiados)18. Al generar este último tipo de organoides, se proporcionan pequeñas moléculas o factores que guían la diferenciación de las células madre pluripotentes a organoides de una región particular del cerebro (por ejemplo, organoides del cerebro anterior)18. Por el contrario, en los organoides no guiados, la diferenciación no está guiada por la adición de moléculas pequeñas, sino que se basa exclusivamente en la diferenciación espontánea de las iPSCs/ESCs. Los organoides cerebrales resultantes consisten en tipos de células que representan diferentes regiones cerebrales (por ejemplo, organoides cerebrales)18. Los organoides cerebrales combinan muchas características clave del desarrollo cerebral con una generación relativamente rentable y eficiente en el tiempo a partir de cualquier especie de interés para la cual se dispone de iPSC o ESCs11,12,13,14. Esto hace que los organoides cerebrales sean un excelente modelo para muchos tipos de estudios neurobiológicos, que van desde preguntas evolutivas y de desarrollo hasta modelos de enfermedades y pruebas de drogas15,16. Sin embargo, abordar estas preguntas utilizando organoides cerebrales depende en gran medida de la disponibilidad de diferentes métodos para la modificación genética.
Un aspecto clave del estudio del desarrollo (pato)fisiológico del neocórtex y su evolución es el análisis funcional de genes y variantes genéticas. Esto generalmente se logra por expresión (ectópica) y / o por knock-down (KD) o knock-out (KO) de esos genes. Tales modificaciones genéticas pueden clasificarse en modificaciones genéticas estables y transitorias, así como en modificaciones restringidas temporal y espacialmente o no restringidas. La modificación genética estable se define por la introducción de una alteración genética en el genoma del huésped que se transmite a todas las generaciones celulares posteriores. Dependiendo del punto de tiempo de la modificación genética, puede afectar a todas las células de un organoide o puede restringirse a ciertas poblaciones celulares. Con mayor frecuencia, la modificación genética estable se logra en organoides cerebrales a nivel de iPSC / ESC mediante la aplicación de lentivirus, sistemas similares a transposones y la tecnología CRISPR / Cas9 (revisada por, por ejemplo, Fischer et al.17, Kyrousi et al.19 y Teriyapirom et al.20). Esto tiene la ventaja de que todas las células del organoide cerebral llevan la modificación genética y que no está restringida temporal o espacialmente. Sin embargo, la generación y caracterización de estas líneas estables iPSC/ESC lleva mucho tiempo, a menudo toma varios meses hasta que se pueden analizar los primeros organoides cerebrales modificados (revisado por, por ejemplo, Fischer et al.17, Kyrousi et al.19, o Teriyapirom et al.20).
En contraste, la modificación genética transitoria se define por la entrega de carga genética (por ejemplo, un plásmido de expresión génica) que no se integra en el genoma del huésped. Si bien esta modificación puede, en principio, transmitirse a las generaciones celulares posteriores, la carga genética entregada se diluirá progresivamente con cada división celular. Por lo tanto, este tipo de modificación genética suele estar restringida temporal y espacialmente. La modificación genética transitoria puede llevarse a cabo en organoides cerebrales por virus adenoasociados o por electroporación (revisada por, por ejemplo, por Fischer et al.17, Kyrousi et al.19 y Teriyapirom et al.20), siendo este último descrito en detalle en este artículo. En contraste con la modificación genética estable, este enfoque es muy rápido y rentable. De hecho, la electroporación se puede realizar en cuestión de minutos y, dependiendo de la(s) población(es) de células diana, los organoides electroporados están listos para su análisis en cuestión de días (revisados por, por ejemplo, Fischer et al.17 y Kyrousi et al.19). Sin embargo, los cambios morfológicos macroscópicos del organoide cerebral, como las diferencias de tamaño, no se pueden detectar utilizando este método, ya que este tipo de modificación genética está restringida temporal y espacialmente. Esta restricción también puede ser una ventaja, por ejemplo, en el caso de estudiar poblaciones celulares individuales dentro del organoide o los efectos sobre los organoides cerebrales en puntos de tiempo de desarrollo específicos (revisado por, por ejemplo, Fischer et al.17 y Kyrousi et al.19).
Un enfoque clásico para estudiar la función de los genes durante el desarrollo y la evolución del cerebro es la electroporación in utero. La electroporación in utero es una técnica bien conocida y útil para la entrega de construcciones de expresión génica en cerebros de roedores 21,22,23 y hurones24,25. Primero, una solución que contiene la(s) construcción(es) de expresión de interés se microinyecta a través de la pared uterina en un determinado ventrículo del cerebro embrionario, dependiendo de la región a la que se dirija. En el segundo paso, se aplican pulsos eléctricos para transfectar las células que recubren directamente el ventrículo objetivo. Este enfoque no sólo se limita a la expresión ectópica o la sobreexpresión de genes, sino que también puede aplicarse en estudios de KD o KO mediante microinyección de horquilla corta (shRNA) o CRISPR/Cas9 (en forma de plásmidos de expresión o ribonucleoproteínas [RNPs]), respectivamente26,27. Sin embargo, la electroporación in utero de embriones de ratón, rata y hurón tiene las mismas limitaciones que se describieron anteriormente para estos modelos animales.
Idealmente, a uno le gustaría realizar electroporación in utero directamente en primates. Si bien esto es, en principio, técnicamente posible, la electroporación in utero no se lleva a cabo en primates debido a preocupaciones éticas, altos costos de mantenimiento de los animales y pequeños tamaños de camada. Para ciertos primates, como los grandes simios (incluidos los humanos), esto no es posible en absoluto. Sin embargo, estos primates tienen el mayor potencial para el estudio del desarrollo (pato)fisiológico del neocórtex humano y su evolución. Una solución a este dilema es aplicar la técnica de electroporación a organoides cerebrales de primates28.
Este artículo presenta un protocolo para la electroporación de un subtipo de organoides cerebrales de primates, los organoides cerebrales de primates. Este enfoque permite la modificación genética rápida y rentable de las poblaciones celulares dentro de las estructuras similares a ventrículos de los organoides. Específicamente, describimos un protocolo unificado para la generación de organoides cerebrales de primates a partir de iPSC humanas (Homo sapiens), chimpancés (Pan troglodytes), macacos rhesus (Macaca mulatta) y tití común (Callithrix jacchus). Además, describimos la técnica de microinyección y electroporación en detalle y proporcionamos criterios de "ir" y "no ir" para realizar la electroporación de organoides cerebrales de primates. Este enfoque es una herramienta eficaz para estudiar el desarrollo (pato)fisiológico del neocórtex y su evolución en un modelo especialmente cercano a la situación humana.
Protocolo
1. Cultivo de iPSCs de primates
NOTA: Debido a su robustez, el método presentado aquí se puede aplicar a cualquier línea iPSC de primates. En este artículo, describimos la producción de organoides cerebrales a partir de líneas humanas (iLonza2.2)29, chimpancés (Sandra A)30, macacos rhesus (iRh33.1)29 y tití común (cj_160419_5)31 iPSC. Las condiciones de cultivo se resumen en la Tabla 1. Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, reactivos y equipos utilizados en este protocolo.
- Para cultivar las iPSC respectivas, siga las condiciones de cultivo descritas originalmente. En general, para la generación exitosa y electroporación de organoides cerebrales, utilice líneas iPSC que no hayan sido cultivadas por más de 90 pasajes. Además, al comienzo de la generación de organoides cerebrales, asegúrese de que las iPSC exhiban características de pluripotencia sin signos de diferenciación.
2. Generación de organoides cerebrales a partir de iPSCs de primates
NOTA: El protocolo para la generación de organoides cerebrales se basa en una versión modificada 28,30,32,33 del protocolo original del organoide cerebral 10,34 con algunas modificaciones específicas de la especie (detalladas a continuación).
- Siembra de iPSCs para generar cuerpos embrioides (EBs)
- Una vez que las iPSCs hayan alcanzado el 80%-90% de confluencia, lávelas con solución salina tamponada con fosfato (DPBS) de Dulbecco y agregue 500 μL de sustituto de tripsina recombinante o 1 ml de mezcla proteolítica y colagenolítica.
NOTA: Típicamente, las iPSCs se cultivan en una placa de cultivo celular de 60 mm para obtener aproximadamente 900.000 células, lo que es suficiente para generar 96 organoides cerebrales. El número de células se puede ajustar dependiendo del número de organoides necesarios. Tenga en cuenta que no todos los organoides cerebrales generados pueden ser adecuados para la electroporación. - Incubar el plato a 37 °C durante 2 min para desprender las células.
NOTA: Puede ser necesario hasta 2 minutos adicionales de incubación a 37 °C dependiendo de la línea iPSC o enzima utilizada. Se recomienda examinar el plato bajo un microscopio para asegurarse de que las células han comenzado a desprenderse. - Añadir 1,5 ml de medio de cultivo iPSC precalentado (37 °C) para detener la reacción, y pipetear hacia arriba y hacia abajo 7x-10x (no más de 10x) para disociar las células de la placa de cultivo celular y obtener una suspensión unicelular.
- Transfiera la suspensión celular a un tubo de centrífuga cónica de 15 ml y centrifugar las células a 200 × g durante 5 minutos a temperatura ambiente.
- Aspirar el sobrenadante y resuspender el pellet en 2 ml de medio de cultivo iPSC suplementado con 50 μM Y27632 o 50 μM pro-survival compound.
- Utilice 10 μL de la suspensión celular para contar las células utilizando una cámara Neubauer.
- Ajustar la suspensión celular a una concentración de 9.000 células por 150 μL (60.000 células/ml) utilizando medio de cultivo iPSC suplementado con 50 μM Y27632 o 50 μM compuesto pro-supervivencia.
- Para generar cuerpos embrioides (EB), siembre 150 μL de la suspensión celular en cada pocillo de una placa de 96 pocillos de unión ultrabaja. Durante el pipeteo, agite suavemente el tubo que contiene la suspensión celular para evitar que las células sedimenten.
- Cultivar los EBs en una atmósfera humificada de 5% deCO2 y 95% de aire a 37 °C (0 días después de la siembra [dps]). No perturbe los EB dentro de las primeras 24 h después de la siembra.
NOTA: Las EB generadas a partir de iPSCs de tití deben cultivarse en una atmósfera humificada en condiciones hipóxicas (5% CO2, 5% O2 y 90%N2) a 37 °C. - Después de ~48 h (2 dps), cambie el medio a medio de cultivo iPSC sin Y27632/compuesto pro-supervivencia. Eliminar 100 μL de medio por pocillo y añadir 150 μL de medio fresco precalentado (37 °C) sin Y27632. Ir fila por fila.
- Realizar más cambios medios cada dos días; eliminar 150 μL de medio de cada pocillo y añadir 150 μL de medio fresco precalentado (37 °C) sin Y27632/compuesto prosupervivencia por pocillo.
NOTA: Después de 4-5 dps, la periferia de los EB debe volverse translúcida.
- Una vez que las iPSCs hayan alcanzado el 80%-90% de confluencia, lávelas con solución salina tamponada con fosfato (DPBS) de Dulbecco y agregue 500 μL de sustituto de tripsina recombinante o 1 ml de mezcla proteolítica y colagenolítica.
- Inducción del neuroectodermo
NOTA: En general, los EB de buena calidad deben tener contornos suaves y bordes translúcidos en esta etapa. Los puntos de tiempo de la inducción neural difieren ligeramente entre las especies de primates y las líneas iPSC. En el caso de las líneas celulares utilizadas aquí (ver sección 1 y Tabla de materiales), la inducción neural para EB de tití generalmente debe iniciarse a 4 dps, para macaco rhesus a 5 dps, y para EBs humanas y de chimpancés a 4-5 dps (Figura 1A), dependiendo del estado de los EBs (ver arriba).- Retire 150 μL de medio de cada pocillo de la primera fila de la placa de 96 pocillos y agregue 150 μL de medio de inducción neural precalentado (37 °C) (ver Tabla 2) por pocillo en la misma fila.
- Continúe cambiando el medio como se describió anteriormente fila por fila para toda la placa de 96 pocillos. Realice más cambios en el medio de inducción neural (NIM) cada dos días eliminando 150 μL de NIM de cada pocillo y agregando 150 μL de NIM fresco precalentado (37 °C).
NOTA: A partir de este momento, los EB de tití deben cultivarse en las mismas condiciones que los otros EB de primates (atmósfera humificada de 5% deCO2 y 95% de aire a 37 °C).
- Incrustación en matriz de membrana basal
NOTA: Una vez que los EB han desarrollado un neuroepitelio pronunciado, translúcido y organizado radialmente en la superficie, se debe proporcionar soporte estructural para el desarrollo de estructuras similares a ventrículos. Esto se logra incrustando los EB en una matriz de membrana basal. Debido a las diferencias en las tasas de desarrollo, los EB de tití y macaco rhesus están listos para incrustarse ya a 7 dps, mientras que los EB humanos y chimpancés generalmente están incrustados a 8-9 dps. Para simplificar, la matriz de membrana basal se refiere solo a Matrigel en este protocolo. Sin embargo, Geltrex se puede utilizar como un reemplazo.- En preparación para la incrustación, esterilice con UV tijeras, pinzas, un pequeño bastidor para tubos de 0,2 ml y de tres a seis cuadrados de parafilm tratados con etanol al 70% (vol/vol) debajo de la campana de flujo laminar durante 15 min. Deje que la matriz de la membrana basal se descongele en hielo durante varias horas (~ 1.5 ml de matriz de membrana basal suele ser suficiente para 96 EB).
NOTA: Siempre mantenga la matriz de la membrana basal en hielo. - Cree una cuadrícula de hoyuelos de 4 x 4 en el parafilm. Coloque la rejilla de parafilm en el bastidor de tubos de 0,2 ml de modo que el lado envuelto en papel quede hacia arriba y presione suavemente un dedo enguantado contra cada orificio del bastidor.
- Retire el papel y corte la rejilla de hoyuelos del cuadrado de parafilm con tijeras para ajustar su tamaño para que quepa en una placa de cultivo celular de 60 mm. Coloque el parafilm con hoyuelos de nuevo en el bastidor de tubos de 0,2 ml para proporcionar una base para la generación de gotitas de la matriz de membrana basal.
- Usando una pipeta con una punta de pipeta cortada de 200 μL, transfiera cuidadosamente los EB uno tras otro desde el pozo de la placa de cultivo a los hoyuelos de parafilm.
- Después de mover 16 EB a la red, tome una nueva punta de pipeta de 200 μL y retire el medio restante de los hoyuelos.
- Pipetear una gota (~15 μL) de matriz de membrana basal sobre cada hoyuelo que contenga un EB.
- Tome una punta de pipeta de 10 μL y mueva rápidamente los EB al centro de cada gota sin alterar los bordes de las gotas.
- Coloque la parapelícula con hoyuelos con las gotas de la matriz de membrana basal en una placa de cultivo celular de 60 mm e incube durante 15-30 min a 37 °C para permitir que la matriz polimerice.
- Para separar los EB incrustados en la matriz del parafilm, agregue 5 ml de medio de diferenciación (MS) sin vitamina A ( ver Tabla 2) al plato, y voltee el cuadrado de parafilm boca abajo usando fórceps para que el lado con los EB quede hacia el fondo del plato.
- Agite cuidadosamente el plato para que las gotas de la matriz de la membrana basal que contienen los EB se desprendan de la parapelícula. Si algunos de ellos todavía están unidos, tome un borde del cuadrado de parafilm con pinzas y enróllelo rápidamente hacia el centro del plato varias veces.
- Cultivar los organoides cerebrales en un agitador orbital a 55 rpm en una atmósfera humificada de 5% deCO2 y 95% de aire a 37 °C. Manténgalos en DM sin vitamina A con cambios medios cada dos días. Para inducir la producción de neuronas, cambie a DM con vitamina A (ácido retinoico, AR) después de 13 dps para organoides cerebrales de tití y macaco rhesus o 14-15 dps para organoides cerebrales humanos y chimpancés (Figura 1A). A partir de este momento, cambie el medio cada 3-4 días.
NOTA: Para apoyar la supervivencia neuronal, la DM con vitamina A se puede complementar con 20 μg/ml de neurotrofina humana 3 (NT3), 20 μg/ml de factor neurotrófico derivado del cerebro (BDNF) y 1 μL/ml de matriz de membrana basal a partir de 40 dps.
- En preparación para la incrustación, esterilice con UV tijeras, pinzas, un pequeño bastidor para tubos de 0,2 ml y de tres a seis cuadrados de parafilm tratados con etanol al 70% (vol/vol) debajo de la campana de flujo laminar durante 15 min. Deje que la matriz de la membrana basal se descongele en hielo durante varias horas (~ 1.5 ml de matriz de membrana basal suele ser suficiente para 96 EB).
3. Electroporación de organoides cerebrales de primates
NOTA: Desde un punto de vista técnico, la electroporación de organoides cerebrales se puede realizar tan pronto como las estructuras en forma de ventrículo son lo suficientemente pronunciadas como para ser atacadas por microinyección. La ventana de tiempo de electroporación óptima depende de la cuestión biológica y de la(s) población(es) celular(es) de interés. Por ejemplo, si los progenitores apicales (AP) son el objetivo principal, entonces los organoides cerebrales a alrededor de 30 dps ya son adecuados. Si los progenitores basales (PA) o las neuronas son los objetivos principales, se deben utilizar organoides cerebrales más antiguos de más de 50 dps (véase, por ejemplo, Fischer et al.28).
- Preparación de la configuración de electroporación
NOTA: La eficiencia de electroporación se ve fuertemente afectada por el tamaño y la concentración de los plásmidos electroporados (consulte la sección de discusión para obtener más detalles).- Preparar una cantidad suficiente de mezcla de electroporación para el control y el gen de interés (GOI), por ejemplo, 10 μL de mezcla de electroporación para cada control y GOI para electroporate aproximadamente 30 organoides cerebrales por condición.
NOTA: Para la composición de las mezclas de electroporación, ver Tabla 3. - Precaliente (no estéril) la mezcla modificada de Dulbecco Eagle medio/nutriente F-12 (DMEM/F12) y DM con vitamina A a 37 °C. Prepare una espátula pequeña y unas tijeras finas y normales, y rocíe los instrumentos con etanol al 70% (vol/vol).
NOTA: Los siguientes pasos se pueden realizar en condiciones estériles o no estériles, ya que la DM contiene antibióticos (ver Tabla 2). En nuestra experiencia, la ausencia de esterilidad nunca ha causado ninguna contaminación. - Prepare placas de cultivo celular de 35 mm y conecte la cámara de electrodos de la placa de Petri al electroporator.
NOTA: Las cámaras de electrodos de placa de Petri están disponibles comercialmente. Sin embargo, se pueden producir fácilmente de una manera rentable (consulte el Archivo complementario 1). - Usando puntas de microcargador, llene las agujas de microinyección con 8 μL de cada mezcla de electroporación. Cortar las puntas de las agujas con tijeras finas antes del primer uso para lograr un flujo estable. Sin embargo, retire solo una pequeña parte de la punta, ya que una punta roma y ancha puede dañar gravemente los organoides.
NOTA: Las agujas de microinyección están disponibles comercialmente como agujas de microinyección pre-tiradas o se pueden extraer en el laboratorio si hay un extractor de agujas disponible. Siga las instrucciones del fabricante del extractor de agujas para generar agujas de microinyección con un cono largo y un diámetro de punta de 10 μm.
- Preparar una cantidad suficiente de mezcla de electroporación para el control y el gen de interés (GOI), por ejemplo, 10 μL de mezcla de electroporación para cada control y GOI para electroporate aproximadamente 30 organoides cerebrales por condición.
- Microinyección y electroporación
- Bajo un microscopio, elija cinco organoides cerebrales con bordes lisos y estructuras similares a ventrículos claramente visibles. Trasladarlos a una placa de cultivo celular de 35 mm que contenga DMEM/F12 precalentado (37 °C) utilizando una punta de pipeta cortada de 1.000 μL.
NOTA: Elija organoides cerebrales con estructuras similares a ventrículos pronunciadas y accesibles (ver Figura 1B). - Para inyectar una estructura similar a un ventrículo, inserte cuidadosamente la aguja a través de su pared e infundirla con la mezcla de electroporación hasta que esté visiblemente llena. No aplique una presión excesiva sobre las estructuras similares a los ventrículos para evitar que se rompan. Proceda con seis a ocho estructuras similares a ventrículos de cada organoide cerebral de esta manera.
NOTA: Si la aguja se obstruye durante el proceso de microinyección, la punta debe recortarse ligeramente. - Transfiera un organoide cerebral microinyectado a la cámara de electrodos de la placa de Petri con una pequeña cantidad de DMEM/F12. Coloque el organoide de manera que las superficies de las estructuras similares a ventrículos microinyectadas miren hacia el electrodo conectado al polo positivo del electroporador.
NOTA: La orientación de las estructuras de esta manera asegura que las células se transfecten en el lado de la estructura similar a un ventrículo que no se ve afectada por una estructura adyacente. - Electroporar los organoides cerebrales uno por uno utilizando los siguientes ajustes: 5 pulsos de 80 V, una duración del pulso de 50 ms y un intervalo de 1 s. Mover los organoides electroporados a una nueva placa de cultivo celular de 35 mm llena de DMEM/F12 precalentado (37 °C).
NOTA: Los ajustes de electroporación pueden depender del electroporador de onda cuadrada disponible. Estos ajustes están optimizados para el sistema de electroporación al que se hace referencia. El aumento del voltaje puede conducir al desplazamiento de las células. - Proceda de la misma manera con los siguientes cinco organoides cerebrales utilizando la segunda mezcla de electroporación (por ejemplo, GOI).
NOTA: Repita los pasos 3.2.1-3.2.5 hasta alcanzar el número deseado de organoides cerebrales electroporados. - Si la microinyección y la electroporación se realizaron en condiciones no estériles, transferir los organoides electroporados a una placa de cultivo celular estéril de 35 mm bajo una campana de flujo laminar mientras se mueve la menor cantidad posible de DMEM/F12 a la nueva placa de cultivo celular.
- Bajo un microscopio, elija cinco organoides cerebrales con bordes lisos y estructuras similares a ventrículos claramente visibles. Trasladarlos a una placa de cultivo celular de 35 mm que contenga DMEM/F12 precalentado (37 °C) utilizando una punta de pipeta cortada de 1.000 μL.
- Cultivo adicional y fijación de organoides cerebrales
- Cultivar los organoides electroporados en DM con vitamina A en un agitador orbital a 55 rpm en una atmósfera humificada de 5% deCO2 y 95% de aire a 37 °C.
- Al día siguiente después de la electroporación, verifique los organoides cerebrales para una electroporación exitosa bajo un microscopio de fluorescencia invertida convencional.
NOTA: Dependiendo de la duración del cultivo adicional después de la electroporación, diferentes poblaciones celulares dentro del organoide cerebral se ven afectadas (ver también la sección de resultados representativos). - Proceder con las aplicaciones posteriores después de cultivar los organoides cerebrales electroporados durante un período de tiempo adecuado para la cuestión biológica de interés.
NOTA: Los organoides cerebrales electroporados pueden procesarse para diferentes aplicaciones posteriores (por ejemplo, fijación para tinción de inmunofluorescencia o congelación instantánea para aislamiento de ARN y qRT-PCR). Aquí, describimos la fijación de organoides cerebrales electroporados. - Transfiera los organoides electroporados a un tubo de centrífuga cónica de 15 ml utilizando una punta de pipeta cortada de 1.000 μl y elimine el exceso de medio.
- Añadir una cantidad suficiente de paraformaldehído (PFA) al 4% en DPBS (pH 7,5) e incubar durante 30 min a temperatura ambiente.
PRECAUCIÓN: El PFA está clasificado como carcinógeno humano y puede causar daños irreparables a la salud. Se recomiendan encarecidamente medidas de precaución adicionales, incluidos guantes y gafas de nitrilo. - Aspire el PFA, agregue 5 ml de DPBS, agite un poco y aspire el DPBS. Repita esto 2x. Conservar los organoides en DPBS a 4 °C hasta su uso posterior.
NOTA: El protocolo se puede pausar aquí, ya que los organoides cerebrales fijados con PFA se pueden almacenar a 4 °C durante varios meses. Los organoides electroporados fijados por PFA pueden analizarse mediante criosección y tinción por inmunofluorescencia 10,28 o por tinción y limpieza de montaje completo 35,36. Para ver imágenes de ejemplo, consulte la sección de resultados representativos (consulte la Tabla 4 para obtener detalles sobre anticuerpos).
Resultados
El protocolo descrito aquí permite la generación eficiente de organoides cerebrales a partir de líneas iPSC humanas, de chimpancés, de macaco rhesus y tití común con alteraciones mínimas de tiempo requeridas entre especies (Figura 1A). Estos organoides pueden electroporarse en el rango de 20 dps a 50 dps, dependiendo de la accesibilidad de las estructuras similares a ventrículos y la abundancia de la(s) población(es) celular(es) de interés. Sin embargo, antes de la electroporación, es importante determinar si los organoides cerebrales son de calidad suficiente para ser electroporosos.
Un organoide cerebral ideal para la electroporación debe exhibir estructuras pronunciadas similares a ventrículos brillantes en la periferia, sin signos de degeneración (por ejemplo, desprendimiento de células, núcleo apoptótico agrandado) y una morfología saludable generalmente compacta (por ejemplo, sin crecimiento excesivo) (Figura 1B, "Go"). Es preferible elegir organoides cerebrales con estructuras grandes, bien organizadas, similares a ventrículos para dirigirse a un mayor número de células. Si la zona periférica de un organoide es oscura y no muestra ninguna estructura sobresaliente, se recomienda no usarla para electroporación, ya que las microinyecciones precisas podrían verse comprometidas por la falta de señales visuales (Figura 1B, "No-go"). Para lograr una morfología organoide cerebral óptima, es esencial asegurarse de que los pasos críticos como la inducción del neuroectodermo y la incrustación de la matriz sean oportunos. Los problemas relacionados con la morfología del organoide cerebral generalmente se originan por el neuroectodermo fallido y / o la formación de brotes neuroepiteliales. Esto normalmente es causado por un momento subóptimo de la inducción neural y / o la incrustación de la matriz de la membrana basal y se puede resolver ajustando el tiempo de estos pasos (se pueden encontrar más consejos de solución de problemas para la formación de organoides cerebrales en Lancaster y Knoblich34).
Después de la electroporación, se puede realizar una primera evaluación de su éxito y su eficiencia después de 12 h, cuando la expresión de GFP de las células transfectadas se vuelve detectable bajo un microscopio de fluorescencia invertido convencional. Idealmente, en esta etapa, múltiples estructuras similares a ventrículos emiten fluorescencia verde brillante localizada en uno de sus lados (Figura 2A). Esto indica la alta precisión y eficiencia del procedimiento. Los organoides cerebrales electroporados con éxito de las cuatro especies diferentes de primates (es decir, humanos, chimpancés, macacos rhesus y titíes comunes) muestran patrones similares positivos de GFP dentro de las estructuras similares a ventrículos objetivo (Figura 2A). Además, después de la fijación y criosección de organoides cerebrales de primates electroporados, las estructuras similares a ventrículos electroporados con éxito de las cuatro especies exhiben columnas de células GFP positivas dentro de la zona ventricular (VZ) organizada radialmente y densamente empaquetada (VZ) (Figura 2B). La cuantificación de las células positivas para DAPI que también fueron positivas para GFP en tales regiones de los organoides cerebrales de chimpancé y tití 2 días después de la electroporación (17 ventrículos de 12 organoides cuantificados) mostró que, en promedio, aproximadamente un tercio de las células (33%, SD ± 12%) se electroporaron con éxito.
Las electroporaciones subóptimas están marcadas por un pequeño número de células positivas para GFP dentro de la estructura similar a un ventrículo (Figura 3A) o por unas pocas células positivas para GFP distantes de cualquier estructura similar a un ventrículo (Figura 3B). Un bajo número de células GFP positivas es causado por una absorción deficiente de plásmidos. Esto puede deberse a una baja concentración de plásmidos causada por una cantidad insuficiente de mezcla de electroporación microinyectada o debido a pulsos eléctricos que no están bien dirigidos, lo que puede ser causado por un posicionamiento subóptimo de los organoides cerebrales en la cámara de electrodos de la placa de Petri. Un bajo número de células GFP positivas distantes de cualquier estructura similar a un ventrículo es causado por la electroporación de células postmitóticas dentro del organoide cerebral (por ejemplo, neuronas) debido a una microinyección imprecisa. Estas electroporaciones subóptimas deben excluirse de cualquier análisis adicional.
La identificación fiable de los tipos de células presentes en los organoides cerebrales se basa, entre otras cosas, en la posición celular dentro de una estructura similar a un ventrículo, lo que requiere una definición de frontera entre la VZ y la zona enriquecida con SVZ/neurona. Este borde puede identificarse por la organización radial y las características de alta densidad de núcleos celulares de la VZ (ver tinción DAPI en la Figura Suplementaria S1). La confirmación del borde VZ/SVZ se puede realizar mediante tinción de inmunofluorescencia para marcadores progenitores neurales como PAX6 o SOX2, que son expresados por prácticamente todas las células VZ (AP) y algunas células SVZ (BP). La presencia de una zona enriquecida con neuronas puede validarse mediante tinción de inmunofluorescencia para marcadores neuronales como la clase III β-tubulina (TUJ1) o NeuN (Figura suplementaria S1).
La duración del cultivo de organoides cerebrales después de la electroporación depende de la cuestión biológica y de las poblaciones celulares de interés. En un estudio reciente, se demostró que diferentes longitudes de cultivo adicional después de la electroporación afectan a diferentes poblaciones celulares en organoides cerebrales de chimpancés, que van desde AP hasta neuronas de capa superior24. Aquí, mostramos resultados similares para los organoides de tití electroporados. Específicamente, 2 días después de la electroporación, las células GFP positivas se localizan casi exclusivamente en la VZ y también son positivas para PAX6, un marcador para las células progenitoras neurales, lo que indica que estas células son AP o PA recién nacidas (Figura 4A). Si el período de cultivo después de la electroporación se extiende a 10 días, entonces las células GFP positivas se localizan en las regiones basales (es decir, la SVZ y la zona enriquecida con neuronas) (Figura 4B, C). Estas células también pueden (además de la señal GFP) ser positivas para PAX6 (Figura 4B), que es indicativa de BP, o NeuN (Figura 4C), que es indicativo de neuronas. Se pueden obtener resultados similares para los organoides cerebrales electroporados humanos y macacos rhesus. En resumen, diferentes tipos de progenitores, así como neuronas, pueden ser atacados con éxito por esta técnica.
Casi todos los datos mostrados anteriormente se derivaron de la inmunotinción de secciones histológicas generadas a partir de organoides cerebrales electroporados. Sin embargo, otra forma elegante de analizar estos organoides es realizar inmunotinción de montaje completo seguida de limpieza óptica35,36. Esto permitiría la reconstrucción 3D de los organoides cerebrales electroporados para obtener una impresión de la distribución 3D de las células GFP positivas. La Figura 5 y el Vídeo 1 muestran un ejemplo representativo de la señal GFP en un organoide cerebral electroporado con depuración óptica.
En resumen, el protocolo de electroporación descrito aquí proporciona una forma precisa y eficiente de introducir modificaciones genéticas transitorias en diferentes tipos de progenitores y neuronas de organoides cerebrales derivados de diferentes líneas iPSC de primates.
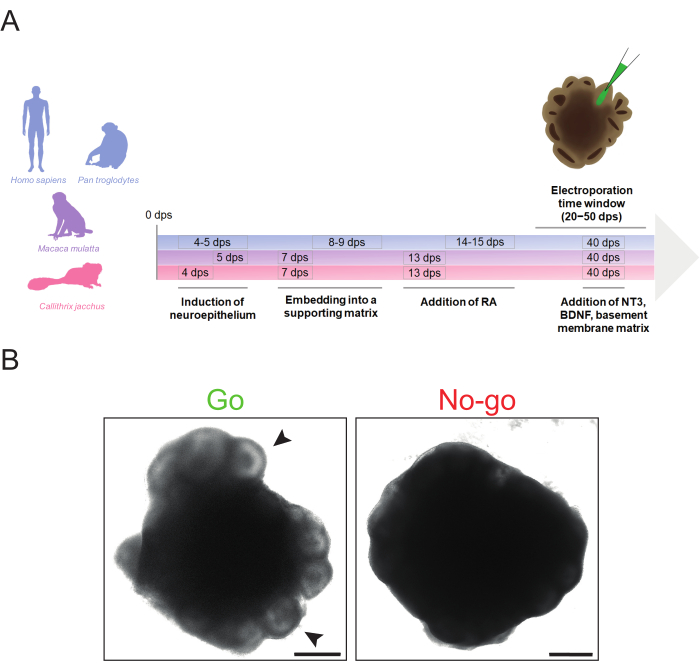
Figura 1: Resumen esquemático de la generación de organoides cerebrales de primates y criterios morfológicos de "ir" y "no ir" para la electroporación. (A) Cronología de la generación y electroporación de organoides cerebrales de primates destacando los diferentes tiempos de los pasos del protocolo para humanos y chimpancés (azul), macaco rhesus (violeta) y tití (magenta). Tenga en cuenta que la cronología de la línea de tiempo no está a escala. (B) Imágenes de campo claro de un organoide cerebral humano adecuado (imagen izquierda, Go) e inadecuado (imagen derecha, No-go) 32 dps. Las puntas de flecha indican ejemplos de estructuras similares a ventrículos adecuadas para la microinyección. Las imágenes fueron adquiridas utilizando un microscopio de fluorescencia invertida Zeiss Axio Observer.Z1 con un objetivo de 2,5x. Barras de escala = 500 μm. Abreviaturas: BDNF = factor neurotrófico derivado del cerebro; DPS = días después de la siembra; NT3 = neurotrofina 3; AR = ácido retinoico. Haga clic aquí para ver una versión más grande de esta figura.
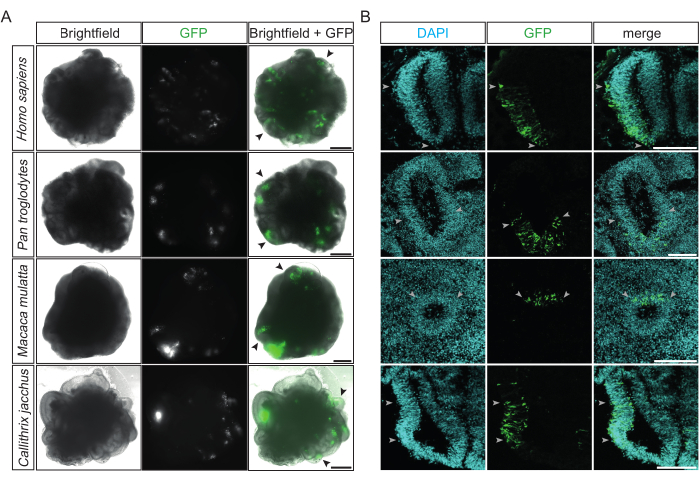
Figura 2: Ejemplos de organoides cerebrales de primates electroporados con éxito . (A) Imágenes de campo claro (columna izquierda), fluorescencia (columna central) y fusión (columna derecha) de 22 dps humanos, 32 dps de chimpancés, 32 dps de macaco rhesus y 31 dps de tití (de arriba a abajo) 15-48 h después de la electroporación con el plásmido que expresa GFP. Las puntas de flecha negras indican ejemplos de estructuras individuales similares a ventrículos electroporados. Las imágenes fueron adquiridas utilizando un microscopio de fluorescencia invertida Zeiss Axio Observer.Z1 con un objetivo de 2,5x. Barras de escala = 500 μm. (B) Inmunofluorescencia para GFP (verde) combinada con tinción DAPI (cian) de 32 dps humanos, 34 dps de chimpancés, 32 dps de macaco rhesus y 32 dps de tití (de arriba a abajo) 2-4 días después de la electroporación con el plásmido que expresa GFP. Las puntas de flecha de color gris claro indican los bordes de las regiones electroporadas dentro de las estructuras similares a ventrículos. Las imágenes fueron adquiridas utilizando un microscopio confocal Zeiss LSM 800 con un objetivo de 10x. Barras de escala = 150 μm. Abreviaturas: DAPI = 4',6-diamidino-2-fenilindol; DPS = días después de la siembra; GFP = proteína verde fluorescente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ejemplos de organoides cerebrales de primates electroporados sin éxito. (A,B) Inmunofluorescencia para GFP (verde) combinada con tinción DAPI (cian) de un (A) 34 dps de organoide cerebral macaco rhesus 4 días después de la electroporación con el plásmido que expresa GFP y de (B) un organoide cerebral de macaco rhesus de 32 dps 2 días después de la electroporación con el plásmido que expresa GFP. Las puntas de flecha de color gris claro indican células electroporadas. El contorno discontinuo gris claro indica el borde entre la zona enriquecida con VZ y SVZ/neuronas de una estructura similar a un ventrículo adyacente a las células electroporadas. Las imágenes fueron adquiridas utilizando un microscopio confocal Zeiss LSM 800 con un objetivo de 10x. Barras de escala = 150 μm. Abreviaturas: DAPI = 4',6-diamidino-2-fenilindol; DPS = días después de la siembra; GFP = proteína verde fluorescente; SVZ = zona subventricular; VZ = zona ventricular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Visualización de las diversas poblaciones celulares presentes en organoides cerebrales de primates después de la electroporación. (A-C) Doble inmunofluorescencia para GFP (verde) y PAX6 (A,B; magenta) o NeuN (C; magenta), en todos los casos combinada con tinción DAPI (cian), de un (A) 32 dps de tití organoide cerebral 2 días después de la electroporación con el plásmido que expresa GFP, y (B,C) de un organoide cerebral tití 40 dps 10 días después de la electroporación con el plásmido que expresa GFP. Las puntas de flecha de color gris claro indican (A,B) GFP+ y PAX6+ o (C) NeuN+ células doblemente positivas. Las líneas discontinuas de color gris claro indican el borde entre la zona VZ y SVZ/zona enriquecida con neuronas. Las imágenes fueron adquiridas utilizando un microscopio confocal Zeiss LSM 800 con un objetivo de 20x. Barras de escala = 100 μm. Abreviaturas: DAPI = 4',6-diamidino-2-fenilindol; DPS = días después de la siembra; GFP = proteína verde fluorescente; NeuN = proteína de los núcleos neuronales; PAX6 = proteína de caja 6 pareada; SVZ = zona subventricular; VZ = zona ventricular. Haga clic aquí para ver una versión más grande de esta figura.
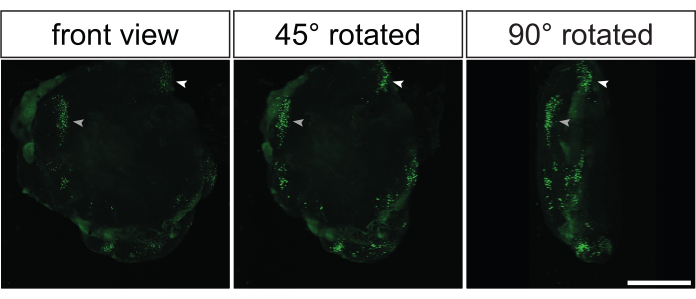
Figura 5: Reconstrucción tridimensional de imágenes electroporadas mediante imágenes confocales 3D de organoides cerebrales de primates electroporados después de la limpieza óptica. Vistas frontales (imagen izquierda), 45° rotadas (imagen central) y 90° rotadas (imagen derecha) de un organoide cerebral humano electroporado 3D reconstruido 32 dps 2 días después de la electroporación con el plásmido que expresa GFP. Antes de la obtención de imágenes, el organoide se eliminó ópticamente con base en el método 2Eci35. Se generó una reconstrucción 3D de un organoide electroporado completo a partir de 269 secciones ópticas (1 μM de espesor cada una) que están separadas entre sí a 3,73 μm utilizando un microscopio confocal Zeiss LSM 800 con un objetivo de 10x. Las imágenes fueron procesadas para la reconstrucción 3D utilizando Fiji. Tenga en cuenta que las imágenes fueron tomadas del mismo organoide reconstruido en 3D que se muestra en el Video 1. Barra de escala = 500 μm. Abreviatura: GFP = proteína verde fluorescente. Haga clic aquí para ver una versión más grande de esta figura.
Video 1: Un organoide cerebral humano electroporado reconstruido en 3D después de la limpieza óptica. Video de un organoide cerebral humano de 32 dps electroporado reconstruido en 3D 2 días después de la electroporación con el plásmido que expresa GFP. Antes de la obtención de imágenes, el organoide se eliminó ópticamente con base en el método 2Eci35. Se generó una reconstrucción 3D de un organoide electroporado completo a partir de 269 secciones ópticas (1 μM de espesor cada una) que están separadas entre sí a 3,73 μm utilizando un microscopio confocal Zeiss LSM 800 con un objetivo de 10x. Las imágenes fueron procesadas para la reconstrucción 3D utilizando Fiji. Tenga en cuenta que el video fue tomado del mismo organoide reconstruido en 3D que se muestra en la Figura 5. Haga clic aquí para descargar este video.
| Línea iPSC | Especie | Publicación | Composición del medio de cultivo | Condiciones de cultivo | ||||
| iLonza2.2 | Género humano | Stauske et al., 2020 | 1 μM IWR1 y 0,5 μM CHIR en StemMACS iPS-Brew XF | atmósfera humificada de 5%CO2 y 95% aire, 37 °C | ||||
| Sandra | Pan trogloditas | Mora-Bermúdez et al., 2016 | mTeSR1 | atmósfera humificada de 5%CO2 y 95% aire, 37 °C | ||||
| iRh33.1 | Macaca mulata | Stauske et al., 2020 | 1 μM IWR1 y 0,5 μM CHIR en StemMACS iPS-Brew XF | atmósfera humificada de 5%CO2 y 95% aire, 37 °C | ||||
| cj_160419_5 | Callithrix jacchus | Petkov et al., 2020 | 3 μM IWR1, 0,3 μM CGP77675, 0,3 μM AZD77675, 0,5 μM CHIR99021, 10 μM Forskolin, 1 ng/mL Activin A, 1 μM OAC1 en StemMACS iPS-Brew XF | atmósfera humificada de 5% CO2, 5% O2 y 90% N2, 37 °C | ||||
Tabla 1: Condiciones de cultivo de las iPSCs de primates utilizadas en esta publicación. Abreviatura: iPSCs = células madre pluripotentes inducidas.
| Medio | Composición | ||
| Medio de inducción neural | 1x suplemento de N-2, 1x suplemento sustituto de glutamina, 1x solución de aminoácidos no esenciales MEM, 1 μg / ml de heparina en el medio Eagle F12 modificado de Dulbecco (DMEM / F12) | ||
| Medio de diferenciación (MS) sin vitamina A | 0.5x Suplemento B-27 (menos vitamina A), 0.5x Suplemento N-2, 0.5x Solución de aminoácidos no esenciales MEM, 1x Suplemento sustituto de glutamina, 100 U/mL Penicilina-Estreptomicina, 0.00035% 2-Mercaptoetanol, 2.875 ng/mL Insulina en 1:1 DMEM/F12 y Medio Neurobasal | ||
| Medio de diferenciación (DM) con vitamina A | 0.5x Suplemento B-27, 0.5x Suplemento N-2, 0.5x Solución de aminoácidos no esenciales MEM, 1x Suplemento sustituto de glutamina, 100 U/ml Penicilina-Estreptomicina, 0.00035% 2-Mercaptoetanol, 2.875 ng/mL Insulina en 1:1 DMEM/F12 y Medio Neurobasal | ||
Tabla 2: Composición de los medios utilizados para la generación y cultivo de organoides cerebrales de primates.
| Componente | Mezcla de electroporación de control | Mezcla de electroporación GOI |
| Plásmido de expresión de GFP | 500 ng/μL | 500 ng/μL |
| Vector vacío | 500 ng/μL | - |
| Plásmido de expresión GOI | - | 500 ng/μL |
| Verde rápido | 0.10% | 0.10% |
| en DPBS |
Tabla 3: Composición de la mezcla de electroporación (enfoque de plásmidos separados) para el control y el gen de interés. Abreviatura: GOI = gen de interés.
| Anticuerpo | Compañía | Número de catálogo | RRID | Dilución |
| Pollo anti GFP | Laboratorios Aves | GFP-1020 | RRID:AB_10000240 | 1:300 |
| Conejo anti PAX6 | Novus Productos Biológicos | NBP1-89100 | RRID:AB_11013575 | 1:300 |
| Conejo anti NeuN | Abcam | AB104225 | RRID:AB_10711153 | 1:300 |
| Cabra anti pollo Alexa Fluor 488 | Thermo Fisher | A-11039 | RRID:AB_142924 | 1:500 |
| Burro anti conejo Alexa Fluor 555 | Thermo Fisher | A-31572 | RRID:AB_162543 | 1:500 |
Tabla 4: Anticuerpos utilizados para la tinción de inmunofluorescencia.
Figura suplementaria S1: Determinación del borde VZ/SVZ en organoides cerebrales de primates electroporados. Doble inmunofluorescencia para PAX6 (magenta) y TUJ1 (amarillo) combinada con tinción DAPI (cian) de un organoide cerebral tití 32 dps 2 días después de la electroporación con el plásmido que expresa GFP. No se muestra la inmunofluorescencia para GFP. Las líneas discontinuas de color gris claro indican el borde entre la zona VZ y SVZ/zona enriquecida con neuronas. Las imágenes fueron adquiridas utilizando un microscopio confocal Zeiss LSM 800 con un objetivo de 20x. Barra de escala = 100 μm. Abreviaturas: DAPI = 4',6-diamidino-2-fenilindol; DPS = días después de la siembra; PAX6 = proteína de caja 6 pareada; SVZ = zona subventricular; TUJ1 = clase III β-tubulina; VZ = zona ventricular. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Instrucciones de montaje de la cámara de electroporación de la placa de Petri. Haga clic aquí para descargar este archivo.
Discusión
Los procedimientos descritos aquí representan un protocolo unificado para la generación de organoides cerebrales de diferentes especies de primates con un enfoque de electroporación dirigido. Esto permite la expresión ectópica de un GOI en un sistema modelo que emula el desarrollo (pato)fisiológico del neocórtex de los primates (incluido el humano). Este protocolo unificado para la generación de organoides cerebrales de primates utiliza los mismos materiales (por ejemplo, medios) y pasos de protocolo para las cuatro especies de primates presentadas. Las diferencias de desarrollo entre estas especies se abordan cambiando el tiempo de los pasos críticos del protocolo (es decir, la inducción neural y la incrustación en la matriz de la membrana basal; ver arriba). Esto podría reflejar aproximadamente las diferencias de tiempo en el desarrollo neurológico in vivo entre estas especies y constituye un tema interesante para estudios posteriores.
Este enfoque se basa en los experimentos de electroporación descritos en un artículo anterior sobre organoides cerebrales10. Sin embargo, estos experimentos, como señalaron Lancaster y sus colegas, estaban limitados por amplios grados de apoptosis, que ocurrieron debido a una alta concentración de GFP y llevaron a la exclusión de las células electroporadas que exhibían una fuerte señal de GFP10. En nuestros experimentos, encontramos que una concentración final total de plásmidos (por ejemplo, concentración de plásmidos codificadores de EGFP más concentración de plásmidos codificantes de GOI) de 1,000 ng / μL fue óptima. Las concentraciones inferiores a 1.000 ng/μL conducen a una reducción de la eficiencia de electroporación, mientras que las altas concentraciones superiores a 1.000 ng/μL podrían ser tóxicas para las células electroporadas y conducir a la muerte celular10. Los estudios que combinan más de dos plásmidos de expresión diferentes son posibles28. Sin embargo, la concentración final total de plásmidos debe mantenerse en 1.000 ng/μL.
En un enfoque típico de electroporación, se necesita un plásmido que codifique un marcador de fluorescencia para identificar las células electroporadas con éxito. Hay dos posibilidades para incluir el marcador de fluorescencia en la configuración experimental: (i) mediante la coinyección de dos plásmidos separados (es decir, un plásmido que codifica para el marcador más un plásmido de control [por ejemplo, vector vacío] o un plásmido que codifica el gen de interés [GOI]) (el enfoque de plásmidos separados); (ii) inyectando un plásmido que codifique tanto para el marcador como para el GOI utilizando un sitio de entrada de ribosoma interno (IRES) o un péptido autoescindido 2A (por ejemplo, P2A) (el enfoque de plásmido único). En este caso, un plásmido que codifica únicamente el marcador de fluorescencia se utiliza como control. Mientras que el enfoque de plásmido único da como resultado la coexpresión completa del marcador de fluorescencia y GOI, tales plásmidos son de gran tamaño, lo que resulta en una baja eficiencia de electroporación. Si se necesita una alta eficiencia de electroporación, se recomienda utilizar el enfoque de plásmidos separados, ya que la expresión separada no afecta significativamente el nivel de coexpresión del marcador de fluorescencia y del GOI, manteniendo una alta eficiencia de electroporación28. En el protocolo presentado aquí, describimos la electroporación utilizando el enfoque de plásmidos separados. Si se aplica el enfoque de plásmido único, los pasos del protocolo deben ajustarse en consecuencia.
En comparación con un protocolo37 publicado recientemente, nuestro enfoque tiene tres ventajas principales. Primero, nos dirigimos específicamente a las estructuras similares a ventrículos del organoide cerebral. Logramos esto (i) microinyectando las estructuras individuales similares a ventrículos del organoide cerebral en lugar de inyectar en el centro del organoide 37 y (ii) organizando la orientación del organoide cerebral en la cámara de electrodos de la placa de Petri para optimizar la dirección del campo eléctrico (ver arriba) en lugar de usar una cubeta de electroporación37. En segundo lugar, este protocolo no implica el uso de una solución de nucleofector costosa, ya que este enfoque utiliza un electroporador de onda cuadrada en combinación con una cámara de electrodos de placa de Petri. En tercer lugar, este protocolo unificado para la generación de organoides cerebrales de primates permite el estudio no solo de organoides de primates humanos sino también no humanos, lo que permite estudios evolutivos, comparativos y de enfermedades.
Dos características relacionadas con los organoides cerebrales son críticas para una electroporación exitosa: la calidad de los organoides cerebrales y el tamaño y la calidad de las estructuras similares a ventrículos (ver los resultados representativos y la Figura 1B). Con respecto a la primera característica, presentamos los criterios de ir y no ir (ver arriba y la Figura 1B) para proceder con la electroporación. El criterio principal es la presencia de estructuras similares a ventrículos claramente visibles, translúcidas y organizadas radialmente. El tamaño de las estructuras similares a ventrículos es la segunda característica crucial para una microinyección y electroporación exitosas. Las estructuras similares a ventrículos que son demasiado pequeñas son difíciles de inyectar y normalmente no producen un número suficientemente alto de células electroporadas para análisis posteriores. Esta es la razón principal por la que utilizamos un protocolo organoide cerebral modificado, ya que este protocolo, en nuestras manos y para estas líneas iPSC, produce, en comparación con otros protocolos, estructuras similares a ventrículos bien organizadas que son lo suficientemente grandes como para ser electroporadas. En principio, el enfoque de electroporación presentado aquí se puede aplicar a cualquier otro protocolo de organoide neural, siempre y cuando este último produzca estructuras similares a ventrículos suficientemente grandes y organizadas (ver los resultados representativos y la Figura 1B). Además, este protocolo también podría aplicarse a otros primates en el futuro, como el macaco cangrejero (Macaca fascicularis), el modelo clásico de primates utilizado en la investigación industrial. Esto requeriría la identificación de los puntos de tiempo críticos correctos (ver arriba) del protocolo de organoide cerebral modificado descrito aquí o el establecimiento de un protocolo de organoide neural que dé lugar a estructuras similares a ventrículos grandes adecuadas (ver arriba).
Después de una electroporación exitosa, los organoides cerebrales pueden cultivarse durante diferentes períodos de tiempo para permitir que la modificación genética bajo examen afecte a las diversas poblaciones celulares dentro del organoide cerebral en desarrollo. Estos van desde las diversas poblaciones progenitoras neurales hasta los diversos tipos de neuronas presentes en el organoide cerebral (ver los resultados representativos y Fischer et al.28). Estas poblaciones celulares pueden analizarse mediante criosección y tinción por inmunofluorescencia (ver Figura 4) o por tinción de inmunofluorescencia de montaje completo y aclaramiento óptico (ver Figura 5 y Video 1) de los organoides cerebrales electroporados fijados por PFA.
Hasta ahora, la electroporación de organoides cerebrales se ha utilizado principalmente para la expresión ectópica de genes para realizar estudios de función génica 10,28,38,39, imágenes en vivo 10,39,40, visualización de morfología celular 40 y rastreo de división celular 10. Sin embargo, en el primer artículo de organoide cerebral, el shRNA se introdujo en los organoides por electroporación para silenciar la expresión génica por interferencia de ARN. Esto mostró el potencial de la electroporación para ser utilizado no sólo para la expresión ectópica de genes, sino también para el KD o incluso KO de los genes. Recientemente, se demostró que los KOs mediados por CRISPR/Cas9 pueden lograrse mediante la electroporación in utero de embriones de ratón27 y la electroporación de tejido humano fetal ex vivo41. Tales KO basados en CRISPR / Cas9 podrían aplicarse fácilmente a la electroporación de organoides cerebrales, ya que el mecanismo principal de electroporación es el mismo, y esto ampliaría aún más la utilidad de este enfoque.
Una posible aplicación adicional de la electroporación en organoides cerebrales es el rescate de fenotipos específicos de KO en casos en los que no es posible obtener un KO específico del GOI debido a secuencias muy similares entre el GOI y sus versiones ancestrales. Este es particularmente el caso de los genes específicos humanos recientemente evolucionados. En tales casos, no es posible (incluso con el uso de la tecnología CRISPR/Cas9) obtener un KO específico (como fue el caso de ARHGAP11A y ARHGAP11B28). Una solución a este dilema es generar un doble KO del GOI y su gen ancestral y rescatar el GOI solo, el gen ancestral solo, o ambos genes juntos por electroporación. Estos organoides electroporados podrían considerarse como un gen ancestral selectivo KO, un GOI KO selectivo o un control, respectivamente. Esto permitiría abordar las contribuciones individuales de estos genes al fenotipo (véase, por ejemplo, Fischer et al.28). Otra aplicación potencial está relacionada con el análisis de organoides cerebrales generados a partir de iPSCs derivadas de pacientes. En tales casos, no está claro si el fenotipo observado se debe a una mutación en el gen candidato o a cualquier otra mutación presente en el paciente. Aquí, la electroporación del gen candidato y el rescate (potencial) del fenotipo permitirían validar el papel de este gen en la enfermedad (ver, por ejemplo, Lancaster et al.10).
En conjunto, el protocolo presentado aquí ofrece un enfoque rápido y rentable para modificar genéticamente las poblaciones celulares dentro de las estructuras similares a ventrículos de los organoides cerebrales de primates. Esto proporciona una herramienta eficaz para el estudio de los procesos de desarrollo neurológico y evolutivo que también se puede aplicar para el modelado de enfermedades.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Pedimos disculpas a todos los investigadores cuyo trabajo no pudo ser citado debido a limitaciones de espacio. Agradecemos a Ulrich Bleyer de los servicios técnicos de DPZ y a Hartmut Wolf del taller de MPI-CBG por la construcción de las cámaras de electrodos de la placa de Petri; Stoyan Petkov y Rüdiger Behr por proporcionar iPSC humanas (iLonza2.2), macacos rhesus (iRh33.1) y titíes (cj_160419_5); Sabrina Heide para la criosección y tinción por inmunofluorescencia; y Neringa Liutikaite y César Mateo Bastidas Betancourt por la lectura crítica del manuscrito. El trabajo en el laboratorio de W.B.H. fue apoyado por una subvención de ERA-NET NEURON (MicroKin). El trabajo en el laboratorio de M.H. fue apoyado por una subvención inicial del ERC (101039421).
Materiales
| Name | Company | Catalog Number | Comments |
| 20 µL Microloader | Eppendorf | 5242956003 | |
| 2-Mercaptoethanol | Merck | 8.05740.0005 | |
| 35 mm cell culture dishes | Sarstedt | 83.3900 | |
| 60 mm cell culture dishes | CytoOne | CC7682-3359 | |
| Activin A | Sigma-Aldrich | SRP3003 | |
| AOC1 | Selleckchem | S7217 | |
| Axio Observer.Z1 Inverted Fluorescence Microscope | Zeiss | replacable by comparable fluorescent microscopes | |
| AZD0530 | Selleckchem | S1006 | |
| B-27 Supplement with Vitamin A (retinoic acid, RA) (50x) | Gibco | 17504-044 | |
| B-27 Supplement without Vitamin A (50x) | Gibco | 12587-010 | |
| BTX ECM 830 Square Wave Electroporation System | BTX | 45-2052 | |
| CGP77675 | Sigma-Aldrich | SML0314 | |
| Chimpanzee induced pluripotent stem cell line Sandra A | doi: 10.7554/elife.18683 | ||
| Common marmoset induced pluripotent stem cell line cj_160419_5 | doi: 10.3390/cells9112422 | ||
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Gibco | 11320-033 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Gibco | 14190-094 | pH 7.0−7.3; warm to room temperature before use |
| Fast Green | Sigma-Aldrich | F7252-5G | |
| Forskolin | Selleckchem | 2449 | |
| GlutaMAX Supplement (100x) | Gibco | 35050-061 | glutamine substitute supplement |
| Heparin (1 mg/mL stock) | Sigma-Aldrich | H3149 | |
| Human induced pluripotent stem cell line iLonza2.2 | doi: 10.3390/cells9061349 | ||
| Human Neurotrophin-3 (NT-3) | PeproTech | 450-03 | |
| Insulin | Sigma-Aldrich | 19278 | |
| IWR1 | Sigma-Aldrich | I0161 | |
| Leica MS5 stereomicroscope (MDG 17 transmitted-light base) | Leica | 10473849 | replacable by comparable stereomicroscopes |
| Matrigel | Corning | 354277/354234 | basement membrane matrix; alternatively, Geltrex (ThermoFisher Scientific, A1413302) can be used |
| MEM Non-Essential Amino Acids Solution (100x) | Sigma-Aldrich | M7145 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Paraformaldehyde | Merck | 818715 | handle with causion due to cancerogenecity |
| Penicillin/Streptomycin (10,000 U/mL) | PanBiotech | P06-07100 | |
| Petri dish electrode chamber | self-produced (see Supplemental File 1) | also commertially available | |
| Pre-Pulled Glass Pipettes | WPI | TIP10LT | borosilicate glass pipettes with long taper, 10 µm tip diameter |
| Pro-Survival Compound | MerckMillipore | 529659 | |
| Recombinant Human/Murine/RatBrain-Derived Neurotrophic Factor (BDNF) | PeproTech | AF-450-02 | |
| Rhesus macaque induced pluripotent stem cell line iRh33.1 | doi: 10.3390/cells9061349 | ||
| StemMACS iPS-Brew XF | Miltenyi Biotech | 130-104-368 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | proteolytic and collagenolytic enzyme mixture |
| TrypLE | Gibco | 12604-013 | recombinant trypsin substitute; warm to room temperature before use |
| Ultra-Low Attachment 96-well plates | Costar | 7007 | |
| Y27632 | Stemcell Technologies | 72305 |
Referencias
- Marchetto, M. C. N., Winner, B., Gage, F. H. Pluripotent stem cells in neurodegenerative and neurodevelopmental diseases. Human Molecular Genetics. 19 (R1), R71-R76 (2010).
- Zhao, X., Bhattacharyya, A. Human models are needed for studying human neurodevelopmental disorders. The American Journal of Human Genetics. 103 (6), 829-857 (2018).
- Zhang, W., et al. Modeling microcephaly with cerebral organoids reveals a WDR62–CEP170–KIF2A pathway promoting cilium disassembly in neural progenitors. Nature Communications. 10 (1), 2612(2019).
- Sasaki, E., et al. Generation of transgenic non-human primates with germline transmission. Nature. 459 (7246), 523-527 (2009).
- Niu, Y., et al. Transgenic rhesus monkeys produced by gene transfer into early-cleavage–stage embryos using a simian immunodeficiency virus-based vector. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17663-17667 (2010).
- Niu, Y., et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell. 156 (4), 836-843 (2014).
- Shi, L., et al. Transgenic rhesus monkeys carrying the human MCPH1 gene copies show human-like neoteny of brain development. National Science Review. 6 (3), 480-493 (2019).
- Heide, M., et al. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science. 369 (6503), 546-550 (2020).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell–derived neocortex. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20284-20289 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Kelava, I., Lancaster, M. A. Stem cell models of human brain development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Lullo, E. D., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Arlotta, P. Organoids required! A new path to understanding human brain development and disease. Nature Methods. 15 (1), 27-29 (2018).
- Heide, M., Huttner, W. B., Mora-Bermúdez, F. Brain organoids as models to study human neocortex development and evolution. Current Opinion in Cell Biology. 55, 8-16 (2018).
- Qian, X., Song, H., Ming, G. Brain organoids: Advances, applications and challenges. Development. 146 (8), dev166074(2019).
- Sun, N., Meng, X., Liu, Y., Song, D., Jiang, C., Cai, J. Applications of brain organoids in neurodevelopment and neurological diseases. Journal of Biomedical Science. 28 (1), 30(2021).
- Fischer, J., Heide, M., Huttner, W. B. Genetic modification of brain organoids. Frontiers in Cellular Neuroscience. 13, 558(2019).
- Pașca, S. P., et al. A nomenclature consensus for nervous system organoids and assembloids. Nature. 609 (7929), 907-910 (2022).
- Kyrousi, C., Cappello, S. Using brain organoids to study human neurodevelopment, evolution and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 9 (1), e347(2020).
- Teriyapirom, I., Batista-Rocha, A. S., Koo, B. -K. Genetic engineering in organoids. Journal of Molecular Medicine. 99 (4), 555-568 (2021).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Kawasaki, H., Toda, T., Tanno, K. In vivo genetic manipulation of cortical progenitors in gyrencephalic carnivores using in utero electroporation. Biology Open. 2 (1), 95-100 (2012).
- Kawasaki, H., Iwai, L., Tanno, K. Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Molecular Brain. 5 (1), 24(2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nature Neuroscience. 6 (12), 1277-1283 (2003).
- Kalebic, N., et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO reports. 17 (3), 338-348 (2016).
- Fischer, J., et al. Human-specific ARHGAP11B ensures human-like basal progenitor levels in hominid cerebral organoids. EMBO Reports. 23 (11), e54728(2022).
- Stauske, M., et al. Non-human primate iPSC generation, cultivation, and cardiac differentiation under chemically defined conditions. Cells. 9 (6), 1349(2020).
- Mora-Bermúdez, F., et al. Differences and similarities between human and chimpanzee neural progenitors during cerebral cortex development. eLife. 5, e18683(2016).
- Petkov, S., Dressel, R., Rodriguez-Polo, I., Behr, R. Controlling the switch from neurogenesis to pluripotency during marmoset monkey somatic cell reprogramming with self-replicating mRNAs and small molecules. Cells. 9 (11), 2422(2020).
- Camp, J. G., et al. Human cerebral organoids recapitulate gene expression programs of fetal neocortex development. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15672-15677 (2015).
- Kanton, S., et al. Organoid single-cell genomic atlas uncovers human-specific features of brain development. Nature. 574 (7778), 418-422 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Cakir, B., et al. Engineering of human brain organoids with a functional vascular-like system. Nature Methods. 16 (11), 1169-1175 (2019).
- Masselink, W., et al. Broad applicability of a streamlined ethyl cinnamate-based clearing procedure. Development. 146 (3), dev166884(2019).
- Denoth-Lippuner, A., Royall, L. N., Gonzalez-Bohorquez, D., Machado, D., Jessberger, S. Injection and electroporation of plasmid DNA into human cortical organoids. STAR Protocols. 3 (1), 101129(2022).
- Denoth-Lippuner, A., et al. Visualization of individual cell division history in complex tissues using iCOUNT. Cell Stem Cell. 28 (11), 2020.e12-2034.e12 (2021).
- Kelava, I., Chiaradia, I., Pellegrini, L., Kalinka, A. T., Lancaster, M. A. Androgens increase excitatory neurogenic potential in human brain organoids. Nature. 602 (7895), 112-116 (2022).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Kalebic, N., et al. Neocortical expansion due to increased proliferation of basal progenitors is linked to changes in their morphology. Cell Stem Cell. 24 (4), 535.e9-550.e9 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados