Method Article
霊長類脳オルガノイドの遺伝子改変のための標的マイクロインジェクションとエレクトロポレーション
要約
霊長類の大脳オルガノイドのエレクトロポレーションは、霊長類(病原)生理学的新皮質の発生に近いモデルシステムにおいて、異なる前駆細胞タイプおよびニューロンに一過性の遺伝子改変を導入するための正確かつ効率的なアプローチを提供します。これにより、神経発達および進化過程の研究が可能になり、疾患モデリングにも適用できます。
要約
大脳皮質は最も外側の脳構造であり、感覚入力と運動出力の処理に関与しています。それは哺乳類、特に霊長類の高次認知能力の座と見なされています。霊長類の脳における遺伝子機能の研究は、技術的および倫理的な理由から困難ですが、脳オルガノイド技術の確立により、従来の霊長類モデル(アカゲザルやコモンマーモセットなど)や、以前は実験的にアクセスできなかった霊長類種(大型類人猿など)での脳発生の研究が可能になりました。さらに、ヒトの脳オルガノイドは、神経発達および神経障害の高度な研究を可能にします。
脳オルガノイドは、脳の発達の多くの過程を再現しているため、進化の文脈でさまざまな種の脳の発達の根底にある遺伝的決定要因の違いを特定し、機能的に比較するための強力なツールでもあります。オルガノイドを使用する大きな利点は、遺伝子機能の試験を可能にする遺伝子改変を導入する可能性である。しかしながら、そのような修正の導入は面倒で費用がかかる。この論文では、脳オルガノイドのサブタイプである霊長類大脳オルガノイドの心室様構造内の細胞集団を遺伝子組み換えするための迅速で費用効果の高いアプローチについて説明します。この方法は、ヒト、チンパンジー、アカゲザル、および一般的なマーモセット由来の人工多能性幹細胞(iPSC)から脳オルガノイドを確実に生成するための修正プロトコルと、マイクロインジェクションおよびエレクトロポレーションアプローチを組み合わせたものです。これは、疾患モデリングにも適用できる神経発達および進化過程の研究のための効果的なツールを提供します。
概要
大脳皮質の(病的)生理学的発達と進化を調査することは、適切なモデルシステムの欠如によって妨げられている手ごわい仕事です。以前は、このような研究は、二次元細胞培養モデル(初代神経前駆細胞や神経細胞培養など)と進化的に遠い動物モデル(げっ歯類など)に限定されていました1,2。これらのモデルは特定の問題に対処するのに役立ちますが、健康な状態と病気の状態で発達中のヒト新皮質の複雑さ、細胞タイプの組成、細胞構造、および遺伝子発現パターンのモデリングには制限があります。これらの制限は、例えば、小頭症の特定の症例について記載されているように、ヒト疾患のマウスモデルのヒト状況への翻訳可能性の低さにつながる(例えば、Zhangら3)。最近、ヒト新皮質発生の進化的、機能的、形態学的に近いモデルであるトランスジェニック非ヒト霊長類が、細胞培養およびげっ歯類ベースのモデルの多くの制限を克服するにつれて、焦点が当てられています4,5,6,7,8。しかし、研究におけるヒト以外の霊長類の使用は、非常に費用と時間がかかるだけでなく、倫理的な懸念も引き起こします。最近では、脳オルガノイド技術9,10の開発が、以前のモデル11,12,13,14,15,16の制限の多くを解決する有望な代替手段として浮上している。
脳オルガノイドは、3次元(3D)の多細胞構造であり、定義された発生時間ウィンドウ11、12、13、14、17に対する1つまたは複数の脳領域の細胞構造および細胞型組成の主な特徴をエミュレートする。これらの3D構造は、人工多能性幹細胞(iPSC)から、または目的の種で利用可能な場合は胚性幹細胞(ESC)から生成されます。一般に、2種類の脳オルガノイドは、使用される方法論に基づいて区別することができる:ガイドなしおよび局所化(ガイド付き)脳オルガノイド18。後者のタイプのオルガノイドを生成する際には、多能性幹細胞を特定の脳領域のオルガノイド(例えば、前脳オルガノイド)に分化させる小分子または因子が提供される18。対照的に、非誘導オルガノイドでは、分化は低分子の添加によって導かれるのではなく、iPSC/ESCの自然分化にのみ依存します。結果として得られる脳オルガノイドは、異なる脳領域を表す細胞型(例えば、大脳オルガノイド)からなる18。脳オルガノイドは、脳発生の多くの重要な特徴と、iPS細胞またはESCが利用可能なあらゆる対象種からの比較的コスト効率と時間効率の高い生成を兼ね備えています11、12、13、14。これにより、脳オルガノイドは、進化的および発達的問題から疾患モデリングや薬物検査に至るまで、多くの種類の神経生物学的研究の優れたモデルになります15,16。しかし、脳オルガノイドを使用してこのような問題に取り組むことは、遺伝子組み換えのためのさまざまな方法の利用可能性に強く依存します。
新皮質(病)生理学的発達とその進化を研究する上で重要な側面の1つは、遺伝子と遺伝子変異の機能解析です。これは通常、(異所性)発現および/またはそれらの遺伝子のノックダウン(KD)またはノックアウト(KO)によって達成される。このような遺伝子改変は、安定な遺伝子改変と一過性の遺伝子改変、ならびに時間的および空間的に制限されている改変または制限されていない改変に分類することができる。安定した遺伝子組み換えは、その後のすべての細胞世代に受け継がれる宿主ゲノムへの遺伝子改変の導入によって定義されます。遺伝子組み換えの時点に応じて、オルガノイドのすべての細胞に影響を与えるか、特定の細胞集団に制限される可能性があります。ほとんどの場合、レンチウイルス、トランスポゾン様システム、およびCRISPR/Cas9技術を適用することにより、iPSC/ESCレベルで脳オルガノイドで安定した遺伝子改変が達成されます(例えば、Fischer et al.17、Kyrousi et al.19、およびTeriyapirom et al.20によってレビューされています)。これは、脳オルガノイドのすべての細胞が遺伝子組み換えを持ち、時間的または空間的に制限されないという利点があります。しかし、これらの安定なiPSC/ESC株の生成と特性評価は非常に時間がかかり、最初の改変された脳オルガノイドが分析されるまでに数か月かかることがよくあります(例えば、Fischer et al.17、Kyrousi et al.19、またはTeriyapirom et al.20によってレビューされています)。
対照的に、一過性の遺伝子改変は、宿主ゲノムに組み込まれない遺伝的貨物(例えば、遺伝子発現プラスミド)の送達によって定義される。この修飾は、原則として、次の細胞世代に受け継がれる可能性がありますが、送達された遺伝子貨物は、細胞分裂ごとに徐々に希釈されます。したがって、このタイプの遺伝子組み換えは通常、時間的および空間的に制限されています。一過性の遺伝子改変は、アデノ随伴ウイルスまたはエレクトロポレーション(例えば、Fischer et al.17、Kyrousi et al.19、およびTeriyapirom et al.20によってレビューされている)によって脳オルガノイドで実行することができ、後者はこの記事で詳細に説明されています。安定した遺伝子組み換えとは対照的に、このアプローチは非常に高速で費用効果が高いです。実際、エレクトロポレーションは数分以内に実行でき、標的細胞集団によっては、エレクトロポレーションされたオルガノイドは数日以内に分析の準備が整います(Fischer et al.17およびKyrousi et al.19などによってレビューされています)。しかし、大きさの違いなどの脳オルガノイドの全体的な形態学的変化は、この種の遺伝子組み換えが時間的および空間的に制限されているため、この方法では検出できません。この制限は、例えば、オルガノイド内の個々の細胞集団または特定の発生時点における脳オルガノイドへの影響を研究する場合にも利点となり得る(例えば、Fischer et al.17およびKyrousi et al.19によってレビューされた)。
脳の発生と進化の間の遺伝子機能を研究するための古典的なアプローチは、子宮エレクトロポレーションです。子宮内エレクトロポレーションは、げっ歯類21、22、23およびフェレット24、25脳への遺伝子発現構築物の送達のための周知かつ有用な技術である。まず、目的の発現コンストラクトを含む溶液を、標的とする領域に応じて、子宮壁を介して胚性脳の特定の心室にマイクロインジェクションします。第2ステップでは、電気パルスを適用して、標的心室を直接裏打ちする細胞をトランスフェクトします。このアプローチは、異所性発現または遺伝子の過剰発現に限定されるものではなく、それぞれショートヘアピン(shRNA)またはCRISPR/Cas9(発現プラスミドまたはリボ核タンパク質[RNP]の形態)をマイクロインジェクションすることにより、KDまたはKO研究にも適用できます26,27。しかしながら、マウス、ラット、およびフェレット胚の子宮内エレクトロポレーションには、これらの動物モデルについて上述したのと同じ制限がある。
理想的には、霊長類で直接 子宮内 エレクトロポレーションを行いたいと考えています。これは原則として技術的に可能ですが、 子宮内 エレクトロポレーションは、倫理的懸念、高い動物維持費、および小さな産仔サイズのために霊長類では行われません。類人猿(人間を含む)などの特定の霊長類では、これはまったく不可能です。しかし、これらの霊長類は、ヒト(病的)生理学的新皮質の発達とその進化の研究に最も大きな可能性を秘めています。このジレンマに対する1つの解決策は、霊長類の脳オルガノイドにエレクトロポレーション技術を適用することである28。
この論文は、霊長類の脳オルガノイドのサブタイプである霊長類の大脳オルガノイドのエレクトロポレーションのためのプロトコルを提示します。このアプローチにより、オルガノイドの心室様構造内の細胞集団の迅速かつ費用効果の高い遺伝子改変が可能になります。具体的には、ヒト(ホモサピエンス)、チンパンジー(パントログロダイト)、アカゲザル(マカカムラッタ)、およびコモンマーモセット(Callithrix jacchus)iPS細胞から霊長類の大脳オルガノイドを生成するための統一プロトコルについて説明します。さらに、マイクロインジェクションとエレクトロポレーションの手法について詳しく説明し、霊長類の脳オルガノイドエレクトロポレーションを行うための「go」と「no-go」の基準を提供します。このアプローチは、特に人間の状況に近いモデルで(病的)生理学的新皮質の発達とその進化を研究するための効果的なツールです。
プロトコル
1. 霊長類iPS細胞の培養
注:その堅牢性により、ここで紹介する方法は、あらゆる霊長類iPS細胞株に適用できます。本稿では、ヒト(iLonza2.2)29、チンパンジー(Sandra A)30、アカゲザル(iRh33.1)29、およびコモンマーモセット(cj_160419_5)31 iPS細胞株からの脳オルガノイド産生について述べる。培養条件を 表1にまとめた。このプロトコルで使用されるすべての材料、試薬、および機器に関連する詳細については、 材料表 を参照してください。
- 各iPS細胞の培養については、当初記載した培養条件に従う。一般に、脳オルガノイドの作製とエレクトロポレーションを成功させるには、90継代以上培養されていないiPS細胞株を使用します。さらに、脳オルガノイド生成の開始時に、iPS細胞が分化の兆候のない多能性の特徴を示すことを確認します。
2. 霊長類iPS細胞からの大脳オルガノイドの作製
注:脳オルガノイド生成のプロトコルは、元の脳オルガノイドプロトコル10,34の修正バージョン28,30,32,33に基づいており、いくつかの種固有の変更が加えられています(以下に詳述)。
- iPS細胞を播種して胚様体(EB)を作製
- iPS細胞が80%〜90%のコンフルエントに達したら、ダルベッコリン酸緩衝生理食塩水(DPBS)で洗浄し、500 μLの組換えトリプシン代替物または1 mLのタンパク質分解およびコラーゲン分解混合物を追加します。
注:通常、iPS細胞は60 mmの細胞培養皿で培養され、約900,000個の細胞が得られ、これは96個の脳オルガノイドを生成するのに十分です。細胞数は、必要なオルガノイドの数に応じて調整できます。生成された脳オルガノイドのすべてがエレクトロポレーションに適しているわけではないことに注意してください。 - 皿を37°Cで2分間インキュベートして細胞を剥離します。
注:使用するiPSC株または酵素によっては、37°Cで最大2分間のインキュベーションが必要になる場合があります。細胞が剥離し始めたことを確認するために、顕微鏡下で皿を調べることをお勧めします。 - 予め温めた(37°C)iPS細胞培養液1.5 mLを加えて反応を停止し、ピペットで7x-10x(10x以下)上下にピペットで細胞培養皿から細胞を解離させ、 単一細胞懸濁液を得た。
- 細胞懸濁液を15 mLコニカル遠沈管に移し、細胞を200 × g で室温で5分間遠心分離します。
- 上清を吸引し、50 μM Y27632または50 μM生存促進化合物を添加した2 mLのiPSC培地にペレットを再懸濁します。
- 10 μLの細胞懸濁液を使用して、ノイバウアーチャンバーを使用して細胞をカウントします。
- 50 μM Y27632または50 μM生存促進化合物を添加したiPS細胞培養液を使用して、細胞懸濁液を150 μLあたり9,000細胞(60,000細胞/mL)の濃度に調整します。
- 胚様体(EB)を生成するには、150 μLの細胞懸濁液を超低接着96ウェルプレートの各ウェルに播種します。ピペッティング中は、細胞懸濁液が入っている チューブを静かに振って 、細胞が沈降するのを防ぎます。
- EBsを5%CO2 および95%空気の加湿雰囲気中で37°Cで培養する(播種後0日[dps])。播種後最初の24時間以内にEBを邪魔しないでください。
注:マーモセットiPS細胞から生成されたEBは、37°Cの低酸素条件(5%CO2、5%O2、および90%N2)の腐植雰囲気で培養する必要があります。 - ~48時間(2 dps)後、 培地をY27632/プロ生存化合物を含まないiPS細胞培地に変更します。ウェルあたり100 μLの培地を取り出し、Y27632を含まない150 μLの予熱(37°C)の新しい培地を追加します。行ごとに移動します。
- 一日おきにさらに媒体の変更を実行します。各ウェルから150 μLの培地を取り出し、ウェルあたりY27632/pro-survival化合物を含まない150 μLの予熱(37°C)新鮮培地を追加します。
注: 4〜5 dpsの後、EBの周囲は半透明になります。
- iPS細胞が80%〜90%のコンフルエントに達したら、ダルベッコリン酸緩衝生理食塩水(DPBS)で洗浄し、500 μLの組換えトリプシン代替物または1 mLのタンパク質分解およびコラーゲン分解混合物を追加します。
- 神経外胚葉の誘導
注:一般に、高品質のEBは、この段階で滑らかな輪郭と半透明の境界線を持つ必要があります。神経誘導の時点は、霊長類の種とiPS細胞株でわずかに異なります。ここで用いた細胞株(セクション1および材料表を参照)の場合、EBの状態に応じて、マーモセットEBの神経誘導は通常4 dps、アカゲザルの神経誘導は5 dps、ヒトおよびチンパンジーEBの神経誘導は4〜5 dpsで開始する必要があります(図1A)。- 96ウェルプレートの最初の列の各ウェルから150 μLの培地を取り出し、同じ列のウェルあたり150 μLの予熱(37°C) 神経誘導培地 ( 表2を参照)を追加します。
- 96ウェルプレート全体について上記の培地を1行ずつ交換し続ける。各ウェルから150 μLのNIMを除去し、150 μLの予熱した(37°C)新鮮なNIMを添加することにより、さらに神経誘導培地(NIM)を1日おきに交換します。
注:この時点から、マーモセットEBは他の霊長類EBと同じ条件(37°Cで5%CO2 および95%空気の加湿雰囲気)で培養する必要があります。
- 基底膜マトリックスへの埋め込み
注:EBが表面に顕著な半透明の放射状に組織化された神経上皮を発達させたら、心室様構造の発達のために構造的サポートを提供する必要があります。これは、EBを基底膜マトリックスに埋め込むことによって達成される。発育率の違いにより、 マーモセットとアカゲザル のEBはすでに 7 dpsで埋め込む準備ができていますが、 人間とチンパンジーのEB は通常 8〜9 dpsで埋め込まれています。簡単にするために、基底膜マトリックスは、このプロトコルではマトリゲルのみを指す。ただし、ゲルトレックスは代替品として使用できます。- 埋め込みの準備として、はさみ、鉗子、0.2 mLチューブ用の小さなラック、および層流フードの下で70%(vol/vol)エタノールで処理された3〜6個の正方形のパラフィルムを15分間UV滅菌します。基底膜マトリックスを氷上で数時間解凍します(通常、96EBには~1.5 mLの基底膜マトリックスで十分です)。
注意: 基底膜マトリックス は常に 氷の上に置いてください。 - パラフィルムに4 x 4のディンプルグリッドを作成します。パラフィルムグリッドを0.2 mLチューブラックに置き、紙で覆われた面が上を向くようにし、手袋をはめた指をラックの各穴にそっと押し付けます。
- 紙をはがし、はさみを使用してパラフィルムの正方形からディンプルグリッドを切り取り、60 mmの細胞培養皿に収まるようにサイズを調整します。ディンプルパラフィルムを0.2 mLチューブラックに戻し、基底膜マトリックス液滴生成の基礎を提供します。
- 200 μLのピペットチップをカットしたピペットを使用して、培養皿のウェルからパラフィルムディンプルにEBを次々に慎重に移します。
- 16 EBをグリッドに移動した後、新しい200 μLのピペットチップを取り、残りの培地をディンプルから取り出します。
- 1滴(~15 μL)の基底膜マトリックスを、1つのEBを含む各ディンプルにピペットで移します。
- 10 μLのピペットチップを取り、液滴の境界を乱すことなく、EBを各液滴の中心に すばやく 移動します。
- 基底膜マトリックス滴を含むディンプルパラフィルムを60 mmの細胞培養皿に入れ、マトリックスを重合させるために37°Cで15〜30分間インキュベートします。
- マトリックス包埋EBをパラフィルムから剥離するには、 ビタミンAを含まない分化培地(DM )5 mL( 表2を参照)をディッシュに加え、鉗子を使用してパラフィルムの正方形を逆さまにして、EBのある側がディッシュの底を向くようにします。
- 皿を注意深く振って、EBを含む基底膜マトリックス液滴をパラフィルムから切り離します。それらのいくつかがまだ取り付けられている場合は、鉗子を使用してパラフィルムの正方形の端を取り、皿の中央に向かって何度もすばやく巻き上げます。
- 脳オルガノイドをオービタルシェーカー上で55rpmで、5%CO2および95%空気の加湿雰囲気中、37°Cで培養する。 一日おきに中程度の変化でビタミンAなしでDMに保管してください。ニューロンの産生を誘導するには、マーモセットとアカゲザルの脳オルガノイドの場合は13 dps、ヒトとチンパンジーの脳オルガノイドの場合は14〜15 dpsの後に、ビタミンA(レチノイン酸、RA)を含むDMに切り替えます(図1A)。この時点から、3〜4日ごとに培地を交換してください。
注:ニューロンの生存をサポートするために、ビタミンAを含むDMには、20 μg/mLのヒトニューロトロフィン3(NT3)、20 μg/mLの脳由来神経栄養因子(BDNF)、および1 μL/mLの基底膜マトリックスを40 dpsから補給することができます。
- 埋め込みの準備として、はさみ、鉗子、0.2 mLチューブ用の小さなラック、および層流フードの下で70%(vol/vol)エタノールで処理された3〜6個の正方形のパラフィルムを15分間UV滅菌します。基底膜マトリックスを氷上で数時間解凍します(通常、96EBには~1.5 mLの基底膜マトリックスで十分です)。
3. 霊長類大脳オルガノイドのエレクトロポレーション
注:技術的な観点から、脳室オルガノイドのエレクトロポレーションは、心室様構造がマイクロインジェクションの標的となるのに十分顕著になるとすぐに実施することができる。最適なエレクトロポレーションの時間枠は、生物学的な問題と目的の細胞集団によって異なります。例えば、頂端前駆細胞(AP)が主な標的である場合、約30dpsの大脳オルガノイドがすでに適しています。基底前駆細胞(BP)またはニューロンが主な標的である場合、50dpsを超える古い大脳オルガノイドを使用する必要があります(たとえば、Fischerら28を参照)。
- エレクトロポレーションセットアップの準備
注:エレクトロポレーション効率は、エレクトロポレーションプラスミドのサイズと濃度に強く影響されます(詳細については、ディスカッションセクションを参照してください)。- コントロールと目的遺伝子(GOI)に十分な量のエレクトロポレーションミックスを準備し、例えば、各コントロールとGOIに10μLのエレクトロポレーションミックスを準備して、条件ごとに約30個の脳オルガノイドをエレクトロポレーションします。
注:エレクトロポレーションミックスの組成については、 表3を参照してください。 - ダルベッコの改変イーグル培地/栄養混合物F-12(DMEM / F12)とビタミンAを含むDMを37°Cに予熱(非滅菌)します。 小さなへらと細かい通常のはさみを準備し、器具に70%(vol / vol)エタノールをスプレーします。
注意: DMには抗生物質が含まれているため、次の手順は無菌または非無菌条件下で実行できます( 表2を参照)。私たちの経験では、無菌性の欠如が汚染を引き起こしたことはありません。 - 35 mm細胞培養皿を準備し、シャーレ電極チャンバーをエレクトロポレーターに接続します。
注:ペトリ皿電極チャンバーは市販されています。ただし、コスト効率の高い方法で簡単に作成できます( 補足ファイル1を参照)。 - マイクロローダーチップを使用して、マイクロインジェクションニードルに各エレクトロポレーションミックス8 μLを充填します。安定した流れを達成するために、最初の使用の前に細かいハサミを使用して針の先端を切ってください。ただし、先端が鈍くて幅が広いとオルガノイドに深刻な損傷を与える可能性があるため、 先端のごく一部だけを取り除いてください。
注:マイクロインジェクションニードルは、事前にプルされたマイクロインジェクションニードルとして市販されているか、ニードルプラーが利用可能な場合はラボでプルすることができます。ニードルプラーの製造元の指示に従って、長いテーパーと10μmの先端直径を持つマイクロインジェクションニードルを生成します。
- コントロールと目的遺伝子(GOI)に十分な量のエレクトロポレーションミックスを準備し、例えば、各コントロールとGOIに10μLのエレクトロポレーションミックスを準備して、条件ごとに約30個の脳オルガノイドをエレクトロポレーションします。
- マイクロインジェクションとエレクトロポレーション
- 顕微鏡下で、滑らかな境界と はっきりと見える心室様構造を持つ5つの脳オルガノイドを選択します。カットした1,000 μLピペットチップを使用して、予熱(37°C)DMEM/F12を含む35 mm細胞培養皿に移します。
注:顕著でアクセス可能な心室様構造を有する脳オルガノイドを選択してください( 図1Bを参照)。 - 心室のような構造を注入するには、針を壁に注意深く挿入し、 目に見えるように満たされるまでエレクトロポレーションミックスを注入します。心室のような構造が破裂するのを防ぐために、心室のような構造に過度の圧力をかけないでください。このようにして、各大脳オルガノイドの6〜8個の心室様構造を進めます。
注意: マイクロインジェクションプロセス中に針が詰まった場合は、先端を少しトリミングする必要があります。 - 微量注入された脳オルガノイド1個を少量のDMEM/F12とともに ペトリ皿電極チャンバー に移します。マイクロ注入された心室様構造体の表面がエレクトロポレーターの正極に接続された電極に向くようにオルガノイドを配置します。
注:このように構造の向きを変えることで、隣接する構造の影響を受けない心室様構造の側面に細胞がトランスフェクトされることが保証されます。 - 次の設定を使用して、脳オルガノイドを1つずつエレクトロポレーションします:80 Vの5パルス、50 msのパルス幅、および1秒の間隔。エレクトロポレーションしたオルガノイドを、予熱(37°C)DMEM/F12で満たされた新しい35 mm細胞培養皿に移します。
注:エレクトロポレーションの設定は、使用可能な方形波エレクトロポレーターによって異なる場合があります。これらの設定は、参照されるエレクトロポレーションシステム用に最適化されています。電圧を上げると、セルが変位する可能性があります。 - 2番目のエレクトロポレーションミックス(例えば、GOI)を用いて次の5つの大脳オルガノイドについても同様に進める。
注意: 必要な数のエレクトロポレーション脳オルガノイドに達するまで、手順3.2.1〜3.2.5を繰り返します。 - マイクロインジェクションとエレクトロポレーションを非滅菌条件下で行った場合は、層流フードの下でエレクトロポレーションオルガノイドを 滅菌済みの 35 mm細胞培養皿に移し、DMEM/F12を新しい細胞培養皿にできるだけ移動させません。
- 顕微鏡下で、滑らかな境界と はっきりと見える心室様構造を持つ5つの脳オルガノイドを選択します。カットした1,000 μLピペットチップを使用して、予熱(37°C)DMEM/F12を含む35 mm細胞培養皿に移します。
- 脳オルガノイドのさらなる培養と固定
- ビタミンAを含むDM中のエレクトロポレーションオルガノイドを、37°Cで5%CO2 および95%空気の加湿雰囲気中、55rpmのオービタルシェーカーで培養します。
- エレクトロポレーションの翌日に、従来の倒立蛍光顕微鏡で脳オルガノイドのエレクトロポレーションが成功するかどうかを確認します。
注:エレクトロポレーション後のさらなる培養の長さに応じて、脳オルガノイド内の異なる細胞集団が影響を受けます(代表的な結果のセクションも参照)。 - エレクトロポレーションされた脳オルガノイドを、目的の生物学的問題に適した時間培養した後、下流のアプリケーションに進みます。
注:エレクトロポレーションされた脳オルガノイドは、さまざまなダウンストリームアプリケーション(免疫蛍光染色のための固定や、RNA単離およびqRT-PCRのための急速凍結など)で処理できます。ここでは、エレクトロポレーションされた脳オルガノイドの固定について述べる。 - カットした1,000 μlのピペットチップを使用して、エレクトロポレーションしたオルガノイドを15 mLのコニカル遠心チューブに移し、余分な培地を除去します。
- 十分な量の4%パラホルムアルデヒド(PFA)をDPBS(pH 7.5)に加え、室温で30分間インキュベートします。
注意:PFAはヒト発がん性物質として分類され、回復不能な健康被害を引き起こす可能性があります。ニトリル手袋やゴーグルなどの追加の予防措置を強くお勧めします。 - PFAを吸引し、5mLのDPBSを添加し、少し振ってDPBSを吸引します。これを2回繰り返します。オルガノイドは、さらに使用するまで4°CのDPBSで保存してください。
注:PFA固定脳オルガノイドは4°Cで数ヶ月間保存できるため、プロトコルはここで一時停止できます。PFA固定エレクトロポレーションオルガノイドは、凍結切片および免疫蛍光染色10,28またはホールマウント染色および透明化35,36によって分析できます。画像例については、代表的な結果のセクションを参照されたい(抗体の詳細については表4を参照されたい)。
結果
ここで説明するプロトコルにより、ヒト、チンパンジー、アカゲザル、および一般的なマーモセットiPS細胞株から、種間で必要なタイミングの変更を最小限に抑えながら、脳オルガノイドを効率的に生成できます(図1A)。これらのオルガノイドは、心室様構造のアクセス可能性および目的の細胞集団の存在量に応じて、20 dpsから50 dpsの範囲でエレクトロポレーションすることができます。ただし、エレクトロポレーションの前に、脳オルガノイドがエレクトロポレーションに十分な品質であるかどうかを判断することが重要です。
エレクトロポレーションに理想的な大脳オルガノイドは、末梢に顕著な明るい心室様構造を示し、変性の兆候(例えば、細胞の剥離、アポトーシスコアの拡大)、および一般的にコンパクトな健康な形態(例えば、過度の伸長なし)を示す必要があります(図1B、「Go」)。より多くの細胞を標的とするために、大きく、よく組織化された、心室様構造を有する大脳オルガノイドを選択することが好ましい。オルガノイドの周辺領域が暗く、突出した構造を示さない場合、視覚的な手がかりの欠如によって正確なマイクロインジェクションが損なわれる可能性があるため、エレクトロポレーションには使用しないことをお勧めします(図1B、「No-go」)。最適な大脳オルガノイド形態を達成するためには、神経外胚葉誘導やマトリックス埋め込みなどの重要なステップが適切なタイミングであることを確認することが不可欠です。大脳オルガノイド形態に関する問題は、典型的には、神経外胚葉および/または神経上皮芽形成の失敗に起因する。これは通常、神経誘導および/または基底膜マトリックス埋め込みのタイミングが最適ではないことによって引き起こされ、これらのステップのタイミングを調整することで解決できます(脳オルガノイド形成に関するさらなるトラブルシューティングのヒントは、LancasterとKnoblich34にあります)。
エレクトロポレーション後、その成功とその効率の最初の評価は、トランスフェクトされた細胞のGFP発現が従来の倒立蛍光顕微鏡で検出可能になった12時間後に行うことができます。理想的には、この段階で、複数の心室様構造がそれらの側面の1つに局在する明るい緑色の蛍光を放出します(図2A)。これは、手順の高精度と効率を示しています。4つの異なる霊長類種(すなわち、ヒト、チンパンジー、アカゲザル、およびコモンマーモセット)のエレクトロポレーションに成功した大脳オルガノイドは、標的の心室様構造内で同様のGFP陽性パターンを示します(図2A)。さらに、霊長類の大脳オルガノイドの固定と凍結切片の後、4種すべてのエレクトロポレーション心室様構造は、放射状に組織化され密集した心室ゾーン(VZ)内にGFP陽性細胞のカラムを示すことに成功しました(図2B)。エレクトロポレーションの2日後にチンパンジーとマーモセットの脳オルガノイドのそのような領域でもGFP陽性であったDAPI陽性細胞(定量された12個のオルガノイドから17個の心室)の定量は、平均して、細胞の約3分の1(33%、SD±12%)がエレクトロポレーションに成功したことを示しました。
最適ではないエレクトロポレーションは、心室様構造内の少数のGFP陽性細胞(図3A)または心室様構造から離れた少数のGFP陽性細胞(図3B)のいずれかによってマークされます。GFP陽性細胞の数が少ないのは、プラスミドの取り込みが悪いことが原因です。これは、マイクロインジェクションされたエレクトロポレーションミックスの不十分な量によって引き起こされるプラスミド濃度が低いため、またはペトリ皿電極チャンバー内の脳オルガノイドの最適でない位置決めによって引き起こされる可能性のある、適切に向けられていない電気パルスが原因である可能性があります。心室様構造から離れたGFP陽性細胞の数が少ないのは、不正確なマイクロインジェクションによる大脳オルガノイド内の有糸分裂後細胞(ニューロンなど)のエレクトロポレーションによって引き起こされます。これらの最適でないエレクトロポレーションは、今後の分析から除外する必要があります。
大脳オルガノイドに存在する細胞型の確実な同定は、とりわけ、心室様構造内の細胞位置に基づいており、VZとSVZ/ニューロンリッチゾーンの間の境界定義が必要です。この境界は、VZの放射状組織および高い細胞核密度特性によって識別することができる( 補足図S1のDAPI染色を参照)。VZ/SVZ境界の確認は、事実上すべてのVZ細胞(AP)および一部のSVZ細胞(BP)によって発現されるPAX6またはSOX2などの神経前駆細胞マーカーの免疫蛍光染色によって行うことができます。ニューロン濃縮ゾーンの存在は、クラスIII βチューブリン(TUJ1)やNeuNなどのニューロンマーカーの免疫蛍光染色によって検証できます(補足図S1)。
エレクトロポレーション後の脳オルガノイド培養の期間は、生物学的な問題と目的の細胞集団によって異なります。最近の研究では、エレクトロポレーション後の異なる長さのさらなる培養が、APから上層ニューロンに至るまで、チンパンジーの脳オルガノイドの異なる細胞集団に影響を与えることが実証されました24。ここでは、エレクトロポレーションマーモセットオルガノイドについて同様の結果を示します。具体的には、エレクトロポレーションの2日後、GFP陽性細胞はほぼ独占的にVZに局在し、神経前駆細胞のマーカーであるPAX6も陽性であり、これらの細胞がAPまたは新生児BPであることを示しています(図4A)。エレクトロポレーション後の培養期間を10日間に延長すると、GFP陽性細胞は基底領域(すなわち、SVZおよびニューロン富化ゾーン)に局在する(図4B、C)。これらの細胞は、(GFPシグナルに加えて)BPを示すPAX6(図4B)またはニューロンを示すNeuN(図4C)に対しても陽性である可能性があります。同様の結果は、ヒトおよびアカゲザルのエレクトロポレーション脳オルガノイドについても得ることができる。要約すると、ニューロンと同様に、異なる前駆細胞タイプを、この技術によって首尾よく標的とすることができる。
以前に示されたデータのほとんどすべては、エレクトロポレーションされた脳オルガノイドから生成された組織学的切片の免疫染色から得られたものでした。しかし、これらのオルガノイドを分析する別のエレガントな方法は、ホールマウント免疫染色とそれに続く光学的透明化を行うことです35,36。これにより、エレクトロポレーションされた大脳オルガノイドの3D再構成が可能になり、GFP陽性細胞の3D分布の印象を得ることができます。図5およびビデオ1は、光透明のエレクトロポレーション脳オルガノイドにおけるGFPシグナルの代表例を示す。
要約すると、ここで説明するエレクトロポレーションプロトコルは、異なる霊長類iPS細胞株に由来する脳オルガノイドの異なる前駆細胞タイプおよびニューロンに一過性の遺伝子改変を導入するための正確かつ効率的な方法を提供する。
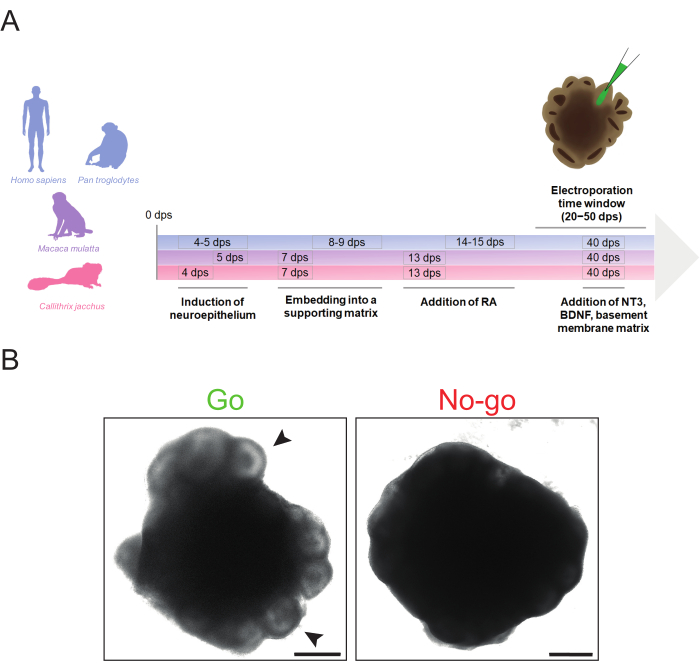
図1:霊長類の脳オルガノイド生成の概略図と、エレクトロポレーションの形態学的「go」および「no-go」基準。 (A)霊長類の脳オルガノイド生成とエレクトロポレーションのタイムラインは、ヒトとチンパンジー(青)、アカゲザル(紫)、マーモセット(マゼンタ)のプロトコルステップのさまざまなタイミングを強調しています。タイムラインの年表はスケーリングされていないことに注意してください。(B)適切な(左の画像、Go)および不適切な(右の画像、No-go)32dpsヒト脳オルガノイドの明視野画像。矢印は、マイクロインジェクションに適した心室様構造の例を示す。画像は、2.5倍の対物レンズを備えたZeiss Axio Observer.Z1倒立蛍光顕微鏡を使用して取得されました。スケールバー = 500 μm。略語:BDNF =脳由来神経栄養因子;dps =シード後の日数。NT3 =ニューロトロフィン3;RA =レチノイン酸。この図の拡大版を表示するには、ここをクリックしてください。
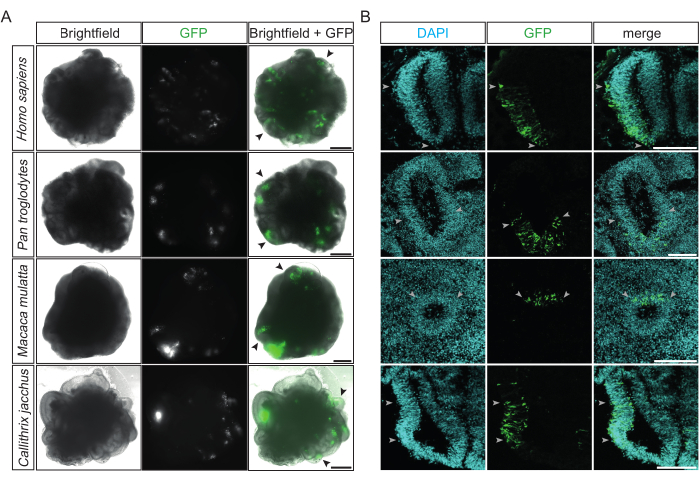
図2:霊長類脳オルガノイドのエレクトロポレーションに成功した例。 (A)GFP発現プラスミドによるエレクトロポレーションの15〜48時間後に、22 dpsのヒト、32 dpsのチンパンジー、32 dpsのアカゲザル、および31 dpsのマーモセット脳オルガノイド(上から下)の明視野(左列)、蛍光(中央列)、およびマージ(右列)。黒い矢印は、個々のエレクトロポレーションされた心室様構造の例を示す。画像は、2.5倍の対物レンズを備えたZeiss Axio Observer.Z1倒立蛍光顕微鏡を使用して取得されました。スケールバー = 500 μm。 (B)GFP発現プラスミドによるエレクトロポレーションの2〜4日後に、32 dpsのヒト、34 dpsのチンパンジー、32 dpsのアカゲザル、および32 dpsのマーモセット脳オルガノイド(上から下)のDAPI染色(シアン)と組み合わせたGFP(緑)の免疫蛍光。薄い灰色の矢印は、心室様構造内のエレクトロポレーション領域の境界を示す。画像は、10倍の対物レンズを備えたZeiss LSM 800共焦点顕微鏡を使用して取得されました。スケールバー= 150 μm。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;dps =シード後の日数。GFP = 緑色蛍光タンパク質。 この図の拡大版を表示するには、ここをクリックしてください。

図3:霊長類脳オルガノイドのエレクトロポレーションに失敗した例。 (A,B)GFP発現プラスミドによるエレクトロポレーションの4日後の(A)34 dpsアカゲザル脳オルガノイドおよび(B)GFP発現プラスミドによるエレクトロポレーションの2日後の32 dpsアカゲザル脳オルガノイドのDAPI染色(シアン)と組み合わせたGFP(緑色)に対する免疫蛍光。薄い灰色の矢印は、エレクトロポレーションされた細胞を示す。薄い灰色の破線のアウトラインは、エレクトロポレーションされた細胞に隣接する心室様構造のVZとSVZ/ニューロンが濃縮されたゾーンとの間の境界を示す。画像は、10倍の対物レンズを備えたZeiss LSM 800共焦点顕微鏡を使用して取得されました。スケールバー= 150 μm。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;dps =シード後の日数。GFP = 緑色蛍光タンパク質;SVZ = 心室下帯;VZ =心室帯。この図の拡大版を表示するには、ここをクリックしてください。

図4:エレクトロポレーション後の霊長類大脳オルガノイドに存在するさまざまな細胞集団の可視化。 (A-C)GFP(緑)とPAX6(A、B;マゼンタ)またはNeuN(C;マゼンタ)のいずれかに対する二重免疫蛍光法(DAPI染色(シアン)と組み合わせたすべての場合において、GFP発現プラスミドによるエレクトロポレーションの2日後に(A)32 dpsマーモセット脳オルガノイド、およびGFP発現プラスミドによるエレクトロポレーションの10日後に40 dpsマーモセット脳オルガノイドの(B、C)の二重免疫蛍光。薄い灰色の矢印は、(A、B)GFP+およびPAX6+または(C)NeuN+ダブルポジティブ細胞を示す。薄い灰色の破線は、VZとSVZ/ニューロンが豊富なゾーンの境界を示します。画像は、20倍の対物レンズを備えたZeiss LSM 800共焦点顕微鏡を使用して取得されました。スケールバー= 100 μm。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;dps =シード後の日数。GFP = 緑色蛍光タンパク質;NeuN =ニューロン核タンパク質;PAX6 =ペアボックス6タンパク質;SVZ = 心室下帯;VZ =心室帯。この図の拡大版を表示するには、ここをクリックしてください。
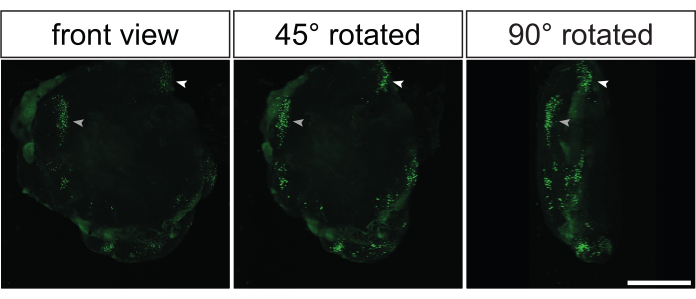
図5:光学クリア後の霊長類脳オルガノイドのエレクトロポレーション3D共焦点イメージングによるエレクトロポレーション画像の3次元再構成。 GFP発現プラスミドによるエレクトロポレーションの2日後に3D再構成された32 dpsヒト脳オルガノイドの正面(左の画像)、45°回転(中央の画像)、および90°回転(右の画像)。イメージングに先立ち、オルガノイドを2Eci法35に基づいて光学的に透明化した。10倍の対物レンズを備えたZeiss LSM 800共焦点顕微鏡を使用して、互いに3.73 μm離れた269の光学セクション(それぞれ1 μMの厚さ)からエレクトロポレーションオルガノイド全体の3D再構成を生成しました。画像は、フィジーを使用して3D再構成のために処理されました。画像は、 ビデオ1に示したのと同じ3D再構成オルガノイドから撮影されたことに注意してください。スケールバー = 500 μm。略称:GFP =緑色蛍光タンパク質。 この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1:光学クリア後の3D再構成エレクトロポレーションヒト脳オルガノイド。 GFP発現プラスミドによるエレクトロポレーションの2日後に3D再構成された32 dpsヒト脳オルガノイドのビデオ。イメージングに先立ち、オルガノイドを2Eci法35に基づいて光学的に透明化した。10倍の対物レンズを備えたZeiss LSM 800共焦点顕微鏡を使用して、互いに3.73 μm離れた269の光学セクション(それぞれ1 μMの厚さ)からエレクトロポレーションオルガノイド全体の3D再構成を生成しました。画像は、フィジーを使用して3D再構成のために処理されました。なお、ビデオは 図5に示すのと同じ3D再構成オルガノイドから撮影されたものである。 このビデオをダウンロードするには、ここをクリックしてください。
| iPS細胞ライン | 種 | 出版 | 培地組成物 | 培養条件 | ||||
| iロンザ2.2 | ホモサピエンス | スタウスケら, 2020 | 1 μM IWR1 および 0.5 μM CHIR in StemMACS iPS-Brew XF | 5%CO2 および95%空気の加湿雰囲気、37°C | ||||
| サンドラA | パントログロダイト | モラ・ベルムデスら、2016年 | mTeSR1 | 5%CO2 および95%空気の加湿雰囲気、37°C | ||||
| iRh33.1 | マカカムラッタ | スタウスケら, 2020 | 1 μM IWR1 および 0.5 μM CHIR in StemMACS iPS-Brew XF | 5%CO2 および95%空気の加湿雰囲気、37°C | ||||
| cj_160419_5 | カリスリクス・ジャッカス | ペトコフら、2020年 | 3 μM IWR1, 0.3 μM CGP77675, 0.3 μM AZD77675, 0.5 μM CHIR99021, 10 μM フォルスコリン, 1 ng/mL アクチビン A, 1 μM OAC1 in StemMACS iPS-Brew XF | 5%CO2、5%O2、および90%N2の加湿雰囲気、37°C | ||||
表1:本公報で用いた霊長類iPS細胞の培養条件。 略称:iPS細胞=人工多能性幹細胞。
| 中程度 | 組成 | ||
| 神経誘導培地 | 1x N-2サプリメント、1xグルタミン代替サプリメント、1x MEM非必須アミノ酸溶液、1 μg/mLヘパリン、ダルベッコ改変イーグル培地F12(DMEM / F12) | ||
| ビタミンAを含まない分化培地(DM) | 0.5x B-27サプリメント(ビタミンAを除く)、0.5x N-2サプリメント、0.5x MEM非必須アミノ酸溶液、1x グルタミン代替サプリメント、100 U / mLペニシリン-ストレプトマイシン、0.00035%2-メルカプトエタノール、1:1 DMEM / F12および神経基礎培地中の2.875 ng / mLインスリン | ||
| ビタミンAを含む分化培地(DM) | 0.5x B-27サプリメント、0.5x N-2サプリメント、0.5x MEM非必須アミノ酸溶液、1xグルタミン代替サプリメント、100 U / mLペニシリン-ストレプトマイシン、0.00035%2-メルカプトエタノール、1:1 DMEM / F12および神経基礎培地中の2.875 ng / mLインスリン | ||
表2:霊長類脳オルガノイドの生成および培養に用いた培地の組成。
| コンポーネント | コントロールエレクトロポレーションミックス | GOIエレクトロポレーションミックス |
| GFP発現プラスミド | 500 ng/μL | 500 ng/μL |
| 空のベクトル | 500 ng/μL | - |
| GOI発現プラスミド | - | 500 ng/μL |
| ファストグリーン | 0.10% | 0.10% |
| DPBSで |
表3:コントロールおよび目的の遺伝子に対するエレクトロポレーションミックス(別々のプラスミドアプローチ)の組成。 略称:GOI =目的の遺伝子。
| 抗体 | 会社 | カタログ番号 | リッド | 希釈 |
| チキンアンチGFP | アベスラボ | GFP-1020 | RRID:AB_10000240 | 1:300 |
| ウサギのアンチPAX6 | ノバスバイオロジカルズ | NBP1-89100 | RRID:AB_11013575 | 1:300 |
| ウサギの反NeuN | アブカム | AB104225 | RRID:AB_10711153 | 1:300 |
| ヤギアンチチキンアレクサフルア488 | サーモフィッシャー | A-11039 | RRID:AB_142924 | 1:500 |
| ロバの反ウサギアレクサフルア555 | サーモフィッシャー | A-31572 | RRID:AB_162543 | 1:500 |
表4:免疫蛍光染色に用いた抗体。
補足図S1:霊長類脳オルガノイドのエレクトロポレーションにおけるVZ/SVZ境界決定。 GFP発現プラスミドによるエレクトロポレーションの2日後に、PAX6(マゼンタ)およびTUJ1(黄色)の二重免疫蛍光法と32 dpsマーモセット脳オルガノイドのDAPI染色(シアン)を組み合わせた。GFPに対する免疫蛍光は示されていない。薄い灰色の破線は、VZとSVZ/ニューロンが豊富なゾーンの境界を示します。画像は、20倍の対物レンズを備えたZeiss LSM 800共焦点顕微鏡を使用して取得されました。スケールバー = 100 μm。略語:DAPI = 4',6-ジアミジノ-2-フェニルインドール;dps =シード後の日数。PAX6 =ペアボックス6タンパク質;SVZ = 心室下帯;TUJ1 = クラスIII β-チューブリン;VZ =心室帯。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:ペトリ皿エレクトロポレーションチャンバーの組み立て手順。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明する手順は、ターゲットを絞ったエレクトロポレーションアプローチを用いて、異なる霊長類種から脳オルガノイドを生成するための統一されたプロトコルを表しています。これにより、霊長類(ヒトを含む)(病的)生理学的新皮質発達をエミュレートするモデルシステムにおけるGOIの異所性発現が可能になります。霊長類大脳オルガノイドの生成のためのこの統一されたプロトコルは、提示された4つの霊長類種すべてについて同じ材料(例えば、媒体)およびプロトコルステップを使用する。これらの種間の発生上の違いは、重要なプロトコルステップ(すなわち、神経誘導および基底膜マトリックスへの埋め込み;上記参照)のタイミングを変更することによって対処される。これは、これらの種間の in vivo 神経発達のタイミングの違いを大まかに反映している可能性があり、さらなる研究のための興味深いトピックを構成します。
このアプローチは、脳オルガノイド10に関する以前の論文に記載されたエレクトロポレーション実験に基づいている。しかし、Lancasterらが指摘したように、これらの実験は、GFP濃度が高いために発生した広範囲のアポトーシスによって制限され、強いGFPシグナルを示すエレクトロポレーション細胞を除外しました10。実験の結果、最終的な総プラスミド濃度(EGFPコードプラスミド濃度とGOIコードプラスミド濃度など)が 1,000 ng/μLであることが最適であることがわかりました。1,000 ng/μL未満の濃度はエレクトロポレーション効率の低下につながり、1,000 ng/μLを超える高濃度はエレクトロポレーションされた細胞に有毒であり、細胞死につながる可能性があります10。2種類以上の異なる発現プラスミドを組み合わせた研究が可能である28。ただし、最終的な総プラスミド濃度は1,000 ng/μLに保つ必要があります。
典型的なエレクトロポレーションアプローチでは、蛍光マーカーをコードするプラスミドが、正常にエレクトロポレーションされた細胞を同定するために必要とされる。蛍光マーカーを実験セットアップに含めるには2つの可能性があります:(i)2つの別々のプラスミド(すなわち、マーカーをコードするプラスミドと対照プラスミド[例えば、空のベクター]または目的の遺伝子をコードするプラスミド[GOI])を同時注入することによって(別々のプラスミドアプローチ);(ii)内部リボソーム侵入部位(IRES)または2A自己切断ペプチド(例えば、P2A)を用いて、マーカーおよびGOIの両方をコードする1つのプラスミドを注入することによる(単一プラスミドアプローチ)。この場合、蛍光マーカーのみをコードするプラスミドが対照として用いられる。単一プラスミドアプローチでは蛍光マーカーとGOIが完全に共発現しますが、そのようなプラスミドはサイズが大きいため、エレクトロポレーション効率が低くなります。高いエレクトロポレーション効率が必要な場合は、分離された発現は高いエレクトロポレーション効率を維持しながら蛍光マーカーとGOIの共発現レベルに大きな影響を与えないため、分離プラスミドアプローチを使用することをお勧めします28。ここで提示するプロトコルでは、個別のプラスミドアプローチを使用したエレクトロポレーションについて説明します。シングルプラスミドアプローチを適用する場合は、プロトコルのステップを適宜調整する必要があります。
最近公開されたプロトコル37と比較して、私たちのアプローチには3つの主な利点があります。まず、大脳オルガノイドの心室様構造を特異的に標的とする。これは、(i)オルガノイド37の中心に注入する代わりに、大脳オルガノイドの個々の心室様構造をマイクロインジェクションすることによって、および(ii)エレクトロポレーションキュベット37を使用する代わりに、ペトリ皿電極チャンバー内の大脳オルガノイドの向きを配置して電場の方向を最適化することによって達成される(上記参照).第2に、このプロトコルは、このアプローチがペトリ皿電極チャンバーと組み合わせて矩形波エレクトロポレーターを使用するので、高価なヌクレオフェクター溶液の使用を含まない。第三に、霊長類大脳オルガノイド生成のためのこの統一されたプロトコルは、ヒトだけでなく非ヒト霊長類オルガノイドの研究を可能にし、進化的、比較的、および疾患研究を可能にします。
エレクトロポレーションを成功させるには、大脳オルガノイドの質と心室様構造の大きさと質という2つの特徴がエレクトロポレーションを成功させるために重要です(代表的な結果と 図1Bを参照)。最初の機能に関しては、エレクトロポレーションを進めるためのゴーとノーゴーの基準(上記と 図1Bを参照)を提示します。主な基準は、はっきりと見える、半透明の、放射状に組織化された心室様構造の存在です。心室様構造のサイズは、マイクロインジェクションとエレクトロポレーションを成功させるための2番目の重要な特徴です。小さすぎる心室様構造は注入が困難であり、通常、その後の分析に十分な数のエレクトロポレーション細胞を生成しません。これが、このプロトコルとして、私たちの手とこれらのiPS細胞株のために、他のプロトコルと比較して、エレクトロポレーションするのに十分な大きさのよく組織化された心室様構造を生成するように、修正された脳オルガノイドプロトコルを使用した主な理由です。原則として、ここで提示されたエレクトロポレーションアプローチは、後者が十分に大きく組織化された心室様構造をもたらす限り、他の任意の神経オルガノイドプロトコルに適用することができる(代表的な結果および 図1Bを参照)。さらに、このプロトコルは、産業研究で使用される古典的な霊長類モデルであるカニを食べるマカク(Macaca fascicularis)など、将来的には他の霊長類にも適用される可能性があります。これには、ここに記載されている修正された脳オルガノイドプロトコルの正しい臨界時点(上記を参照)の同定、または適切な大きな心室様構造を生じさせる神経オルガノイドプロトコルの確立(上記参照)のいずれかが必要です。
エレクトロポレーションが成功した後、脳オルガノイドをさらに異なる期間培養して、検査中の遺伝子改変が発生中の脳オルガノイド内のさまざまな細胞集団に影響を与えることを可能にします。これらは、さまざまな神経前駆集団から、大脳オルガノイドに存在する多様なタイプのニューロンにまで及びます(代表的な結果とFischerら28を参照)。次に、これらの細胞集団を、PFA固定エレクトロポレーション脳オルガノイドの凍結切片および免疫蛍光染色(図 4を参照)、またはホールマウント免疫蛍光染色および光学透明化( 図5 および ビデオ1を参照)のいずれかによって分析できます。
これまで、脳オルガノイドのエレクトロポレーションは、主に遺伝子の異所性発現に用いられ、遺伝子機能研究10、28、38、39、39、ライブイメージング10、39、40、細胞形態の可視化40、および細胞分裂追跡10を行ってきた.しかし、最初の大脳オルガノイド論文では、エレクトロポレーションによってオルガノイドにshRNAを導入し、RNA干渉による遺伝子発現をサイレンシングしました。これは、エレクトロポレーションが遺伝子の異所性発現だけでなく、遺伝子のKDやKOにも使用できる可能性を示しました。最近、CRISPR/Cas9を介したKOは、マウス胚の子宮内エレクトロポレーション27および胎児ヒト組織のexvivo41のエレクトロポレーションによって達成できることが示された。このようなCRISPR/Cas9ベースのKOは、エレクトロポレーションの主要なメカニズムが同じであるため、脳オルガノイドのエレクトロポレーションに容易に適用でき、このアプローチの有用性をさらに拡大します。
脳オルガノイドにおけるエレクトロポレーションのさらなる応用の可能性の1つは、GOIとその祖先バージョンとの間の配列が非常に類似しているためにGOIの特異的KOを得ることができない場合の特定のKO表現型の救済である。これは特に、最近進化したヒト特異的遺伝子の場合に当てはまります。そのような場合、(CRISPR/Cas9技術を使用しても)特定のKOを得ることは不可能です(ARHGAP11AおよびARHGAP11B28の場合のように)。このジレンマの解決策は、GOIとその祖先遺伝子の二重KOを生成し、エレクトロポレーションによってGOIのみ、祖先遺伝子のみ、または両方の遺伝子を一緒に救出することです。これらのエレクトロポレーションオルガノイドは、それぞれ選択的祖先遺伝子KO、選択的GOI KO、または対照と見なすことができます。これにより、表現型に対するこれらの遺伝子の個々の寄与に対処することができます(例えば、Fischerら28を参照)。別の潜在的なアプリケーションは、患者由来のiPS細胞から生成された脳オルガノイドの分析に関連しています。そのような場合、観察された表現型が候補遺伝子の突然変異によるものなのか、それとも患者に存在する他の突然変異によるものなのかは明らかではない。ここで、候補遺伝子のエレクトロポレーションおよび表現型の(潜在的な)レスキューは、疾患におけるこの遺伝子の役割を検証することを可能にするであろう(例えば、Lancaster et al.10を参照されたい)。
まとめると、ここで紹介するプロトコルは、霊長類の大脳オルガノイドの心室様構造内の細胞集団を遺伝子組み換えするための迅速で費用効果の高いアプローチを提供します。これは、疾患モデリングにも適用できる神経発達および進化過程の研究のための効果的なツールを提供します。
開示事項
著者は、利益相反がないことを宣言します。
謝辞
スペースの都合上、研究内容を引用できなかった研究者の皆様にお詫び申し上げます。ペトリ皿電極チャンバーの建設について、DPZの技術サービスのウルリッヒ・ブレイヤーとMPI-CBGのワークショップのハルトムート・ヴォルフに感謝します。ストヤン・ペトコフとリューディガー・ベーアは、ヒト(iLonza2.2)、アカゲザル(iRh33.1)、マーモセット(cj_160419_5)のiPS細胞を提供しました。サブリナ・ハイデ 凍結切開および免疫蛍光染色用;ネリンガ・リウティカイテとセザール・マテオ・バスティダス・ベタンクールは、原稿を批判的に読んでくれました。W.B.H.の研究室での作業は、ERA-NET NEURON(MICROKin)の助成金によってサポートされました。M.H.の研究室での作業は、ERC開始助成金(101039421)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 20 µL Microloader | Eppendorf | 5242956003 | |
| 2-Mercaptoethanol | Merck | 8.05740.0005 | |
| 35 mm cell culture dishes | Sarstedt | 83.3900 | |
| 60 mm cell culture dishes | CytoOne | CC7682-3359 | |
| Activin A | Sigma-Aldrich | SRP3003 | |
| AOC1 | Selleckchem | S7217 | |
| Axio Observer.Z1 Inverted Fluorescence Microscope | Zeiss | replacable by comparable fluorescent microscopes | |
| AZD0530 | Selleckchem | S1006 | |
| B-27 Supplement with Vitamin A (retinoic acid, RA) (50x) | Gibco | 17504-044 | |
| B-27 Supplement without Vitamin A (50x) | Gibco | 12587-010 | |
| BTX ECM 830 Square Wave Electroporation System | BTX | 45-2052 | |
| CGP77675 | Sigma-Aldrich | SML0314 | |
| Chimpanzee induced pluripotent stem cell line Sandra A | doi: 10.7554/elife.18683 | ||
| Common marmoset induced pluripotent stem cell line cj_160419_5 | doi: 10.3390/cells9112422 | ||
| Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12 (DMEM/F12) | Gibco | 11320-033 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Gibco | 14190-094 | pH 7.0−7.3; warm to room temperature before use |
| Fast Green | Sigma-Aldrich | F7252-5G | |
| Forskolin | Selleckchem | 2449 | |
| GlutaMAX Supplement (100x) | Gibco | 35050-061 | glutamine substitute supplement |
| Heparin (1 mg/mL stock) | Sigma-Aldrich | H3149 | |
| Human induced pluripotent stem cell line iLonza2.2 | doi: 10.3390/cells9061349 | ||
| Human Neurotrophin-3 (NT-3) | PeproTech | 450-03 | |
| Insulin | Sigma-Aldrich | 19278 | |
| IWR1 | Sigma-Aldrich | I0161 | |
| Leica MS5 stereomicroscope (MDG 17 transmitted-light base) | Leica | 10473849 | replacable by comparable stereomicroscopes |
| Matrigel | Corning | 354277/354234 | basement membrane matrix; alternatively, Geltrex (ThermoFisher Scientific, A1413302) can be used |
| MEM Non-Essential Amino Acids Solution (100x) | Sigma-Aldrich | M7145 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Parafilm | Sigma-Aldrich | P7793 | |
| Paraformaldehyde | Merck | 818715 | handle with causion due to cancerogenecity |
| Penicillin/Streptomycin (10,000 U/mL) | PanBiotech | P06-07100 | |
| Petri dish electrode chamber | self-produced (see Supplemental File 1) | also commertially available | |
| Pre-Pulled Glass Pipettes | WPI | TIP10LT | borosilicate glass pipettes with long taper, 10 µm tip diameter |
| Pro-Survival Compound | MerckMillipore | 529659 | |
| Recombinant Human/Murine/RatBrain-Derived Neurotrophic Factor (BDNF) | PeproTech | AF-450-02 | |
| Rhesus macaque induced pluripotent stem cell line iRh33.1 | doi: 10.3390/cells9061349 | ||
| StemMACS iPS-Brew XF | Miltenyi Biotech | 130-104-368 | |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | proteolytic and collagenolytic enzyme mixture |
| TrypLE | Gibco | 12604-013 | recombinant trypsin substitute; warm to room temperature before use |
| Ultra-Low Attachment 96-well plates | Costar | 7007 | |
| Y27632 | Stemcell Technologies | 72305 |
参考文献
- Marchetto, M. C. N., Winner, B., Gage, F. H. Pluripotent stem cells in neurodegenerative and neurodevelopmental diseases. Human Molecular Genetics. 19 (R1), R71-R76 (2010).
- Zhao, X., Bhattacharyya, A. Human models are needed for studying human neurodevelopmental disorders. The American Journal of Human Genetics. 103 (6), 829-857 (2018).
- Zhang, W., et al. Modeling microcephaly with cerebral organoids reveals a WDR62–CEP170–KIF2A pathway promoting cilium disassembly in neural progenitors. Nature Communications. 10 (1), 2612 (2019).
- Sasaki, E., et al. Generation of transgenic non-human primates with germline transmission. Nature. 459 (7246), 523-527 (2009).
- Niu, Y., et al. Transgenic rhesus monkeys produced by gene transfer into early-cleavage–stage embryos using a simian immunodeficiency virus-based vector. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17663-17667 (2010).
- Niu, Y., et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell. 156 (4), 836-843 (2014).
- Shi, L., et al. Transgenic rhesus monkeys carrying the human MCPH1 gene copies show human-like neoteny of brain development. National Science Review. 6 (3), 480-493 (2019).
- Heide, M., et al. Human-specific ARHGAP11B increases size and folding of primate neocortex in the fetal marmoset. Science. 369 (6503), 546-550 (2020).
- Kadoshima, T., et al. Self-organization of axial polarity, inside-out layer pattern, and species-specific progenitor dynamics in human ES cell–derived neocortex. Proceedings of the National Academy of Sciences of the United States of America. 110 (50), 20284-20289 (2013).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Kelava, I., Lancaster, M. A. Stem cell models of human brain development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Lullo, E. D., Kriegstein, A. R. The use of brain organoids to investigate neural development and disease. Nature Reviews Neuroscience. 18 (10), 573-584 (2017).
- Arlotta, P. Organoids required! A new path to understanding human brain development and disease. Nature Methods. 15 (1), 27-29 (2018).
- Heide, M., Huttner, W. B., Mora-Bermúdez, F. Brain organoids as models to study human neocortex development and evolution. Current Opinion in Cell Biology. 55, 8-16 (2018).
- Qian, X., Song, H., Ming, G. Brain organoids: Advances, applications and challenges. Development. 146 (8), dev166074 (2019).
- Sun, N., Meng, X., Liu, Y., Song, D., Jiang, C., Cai, J. Applications of brain organoids in neurodevelopment and neurological diseases. Journal of Biomedical Science. 28 (1), 30 (2021).
- Fischer, J., Heide, M., Huttner, W. B. Genetic modification of brain organoids. Frontiers in Cellular Neuroscience. 13, 558 (2019).
- Pașca, S. P., et al. A nomenclature consensus for nervous system organoids and assembloids. Nature. 609 (7929), 907-910 (2022).
- Kyrousi, C., Cappello, S. Using brain organoids to study human neurodevelopment, evolution and disease. Wiley Interdisciplinary Reviews: Developmental Biology. 9 (1), e347 (2020).
- Teriyapirom, I., Batista-Rocha, A. S., Koo, B. -. K. Genetic engineering in organoids. Journal of Molecular Medicine. 99 (4), 555-568 (2021).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Kawasaki, H., Toda, T., Tanno, K. In vivo genetic manipulation of cortical progenitors in gyrencephalic carnivores using in utero electroporation. Biology Open. 2 (1), 95-100 (2012).
- Kawasaki, H., Iwai, L., Tanno, K. Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Molecular Brain. 5 (1), 24 (2012).
- Bai, J., et al. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nature Neuroscience. 6 (12), 1277-1283 (2003).
- Kalebic, N., et al. CRISPR/Cas9-induced disruption of gene expression in mouse embryonic brain and single neural stem cells in vivo. EMBO reports. 17 (3), 338-348 (2016).
- Fischer, J., et al. Human-specific ARHGAP11B ensures human-like basal progenitor levels in hominid cerebral organoids. EMBO Reports. 23 (11), e54728 (2022).
- Stauske, M., et al. Non-human primate iPSC generation, cultivation, and cardiac differentiation under chemically defined conditions. Cells. 9 (6), 1349 (2020).
- Mora-Bermúdez, F., et al. Differences and similarities between human and chimpanzee neural progenitors during cerebral cortex development. eLife. 5, e18683 (2016).
- Petkov, S., Dressel, R., Rodriguez-Polo, I., Behr, R. Controlling the switch from neurogenesis to pluripotency during marmoset monkey somatic cell reprogramming with self-replicating mRNAs and small molecules. Cells. 9 (11), 2422 (2020).
- Camp, J. G., et al. Human cerebral organoids recapitulate gene expression programs of fetal neocortex development. Proceedings of the National Academy of Sciences of the United States of America. 112 (51), 15672-15677 (2015).
- Kanton, S., et al. Organoid single-cell genomic atlas uncovers human-specific features of brain development. Nature. 574 (7778), 418-422 (2019).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Cakir, B., et al. Engineering of human brain organoids with a functional vascular-like system. Nature Methods. 16 (11), 1169-1175 (2019).
- Masselink, W., et al. Broad applicability of a streamlined ethyl cinnamate-based clearing procedure. Development. 146 (3), dev166884 (2019).
- Denoth-Lippuner, A., Royall, L. N., Gonzalez-Bohorquez, D., Machado, D., Jessberger, S. Injection and electroporation of plasmid DNA into human cortical organoids. STAR Protocols. 3 (1), 101129 (2022).
- Denoth-Lippuner, A., et al. Visualization of individual cell division history in complex tissues using iCOUNT. Cell Stem Cell. 28 (11), 2020.e12-2034.e12 (2021).
- Kelava, I., Chiaradia, I., Pellegrini, L., Kalinka, A. T., Lancaster, M. A. Androgens increase excitatory neurogenic potential in human brain organoids. Nature. 602 (7895), 112-116 (2022).
- Lancaster, M. A., et al. Guided self-organization and cortical plate formation in human brain organoids. Nature Biotechnology. 35 (7), 659-666 (2017).
- Kalebic, N., et al. Neocortical expansion due to increased proliferation of basal progenitors is linked to changes in their morphology. Cell Stem Cell. 24 (4), 535.e9-550.e9 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved