Method Article
Высокопроизводительный чувствительный чип, модифицированный графеном, для обнаружения SARS-CoV-2
В этой статье
Резюме
Настоящий протокол описывает изготовление недорогих прототипов биосенсоров на основе полезных наносистем для точного обнаружения вирусных белков (на уровне Fg). Такая крошечная сенсорная платформа позволяет создавать приложения на местах оказания медицинской помощи, которые могут быть интегрированы с Интернетом медицинских вещей (IoMT) для решения задач телемедицины.
Аннотация
Эта модель сенсорного прототипа включает в себя разработку многоразового двухкомпонентного двузначного емкостного чипа (DIDC), покрытого оксидом графена (GrO), для специфического и быстрого обнаружения вируса коронавируса 2 тяжелого острого респираторного синдрома (SARS-CoV-2). Изготовленный DIDC состоит из содержащей Ti/Pt стеклянной подложки, покрытой оксидом графена (GrO), который далее химически модифицирован с помощью EDC-NHS для иммобилизации антител (Abs), враждебных SARS-CoV-2, на основе спайкового белка (S1) вируса. Результаты глубоких исследований показали, что GrO обеспечивает идеальную поверхность для иммобилизации Ab и увеличивает емкость, обеспечивая более высокую чувствительность и низкие пределы срабатывания. Эти перестраиваемые элементы помогли достичь широкого диапазона чувствительности (от 1,0 мг/мл до 1,0 фг/мл), минимального предела чувствительности 1 фг/мл, высокой чувствительности и хорошей линейности 18,56 нФ/г, а также короткого времени реакции 3 с. Кроме того, с точки зрения разработки финансово жизнеспособных структур тестирования в местах оказания медицинской помощи (POC), возможность повторного использования биочипа GrO-DIDC в этом исследовании хороша. Важно отметить, что биочип специфичен к антигенам, переносимым через кровь, и стабилен до 10 дней при 5 °C. Благодаря своей компактности, этот уменьшенный биосенсор обладает потенциалом для POC-диагностики инфекции COVID-19. Эта система может выявлять и другие тяжелые вирусные заболевания, хотя в настоящее время разрабатывается этап утверждения с использованием других примеров вирусов.
Введение
В конце 2019 года в городе Ухань, Китай, возникла вирусная пандемия, вызванная новым бета-коронавирусом1 (т.е. 2019-nCoV), который позже был назван коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2)2 (далее преимущественно именуемым вирусом), включающая в себя легочный кластер и тяжелый острый респираторный дистресс3. В связи с быстрой передачей вируса от человека к человеку по всему миру, высоким уровнем инфицирования, высоким уровнем смертности и серьезными опасными для жизни побочными эффектами4 во время пандемии вирусологические исследования5 быстро развивались для определения геномной организации и структуры вируса 5,6. Симптомы COVID-19 7,8 включают высокую температуру, сухой кашель и генерализованную боль9. Важно отметить, что различные серотипы вируса приводят к различной степени тяжести заболевания10. Более того, бессимптомные носители потенциально могут распространять вирус. Обычно под микроскопом частицы вируса COVID-19 демонстрируют булавовидные выступы, образованные шиповидными белками11. Поэтому для контроля за распространением этого нового патогена выявление случаев заболевания должно быть своевременным и эффективным. Таким образом, сверхчувствительное, быстрое и избирательное выявление вируса на ранних стадиях вирусной инфекции приобрело решающее значение 2,11. Необходимо социальное/физическое дистанцирование, чтобы избежать передачи вируса12. Учреждения здравоохранения уделяют особое внимание разработке интеллектуальных диагностических средств и наносистем13. Действительно, как предлагают органы здравоохранения, целевое и массовое тестирование14,15 является обязательным и до сих пор востребованным.
В принципе, современные методы биологической диагностики, такие как полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР), являются наилучшими средствами массовой идентификации SARS-CoV-2, как в случае с коронавирусом, связанным с ближневосточным респираторным синдромом (MERS-CoV)16 и SARS-CoV-117. В этом контексте текущая стандартная идентификация заражения SARS-CoV-2 зависит от улучшения специфических для инфекции характеристик18,19. Кроме того, следует учитывать вариации инфекции SARS-CoV-2 в зависимости от региона, возраста, расы и пола. С конечной целью спасения жизней крайне важно создать инструменты быстрой диагностики для использования в местах оказания медицинской помощи (POC)20,21.
В этом контексте обычные стратегии, такие как флуоресцентная гибридизация in situ (FISH), исследование белкового иммуносорбента (ИФА), методы на основе микросфер, электрохимические тесты, а также МРТ, ПЭТ и NIRFOI22, имеют низкую чувствительность к низким уровням вируса, низкую селективность и низкую способность к повторному использованию; Кроме того, такие процедуры имеют недостатки, в том числе дорогостоящие диагностические системы с биосенсорным управлением, реагенты, не подлежащие повторному использованию, и потребность в высококвалифицированной рабочей силе. Таким образом, эти проницательные методы нельзя рассматривать как быстрые, разумные, исключительно специфичные или чувствительные методы POC24,25. Следует отметить, что существуют различные виды биосенсоров на основе ДНК и иммунизаторов, в которых используются составные, емкостные и электрические методы 18,26,27,28. Например, электрические биосенсоры ДНК, которые обладают высокой отзывчивостью, могут быть легко уменьшены и могут быть перестраиваемы29,30, были созданы для обнаружения вирусов Эбола31, Зика, MERS-CoV и SARS-CoV32,33,34. Аналогичным образом, был эффективно создан полевой полупроводниковый (FET) биосенсор для обнаружения шиповидного белка вируса с использованием определенных антител (моноклональных), иммобилизованных на устройствах, покрытых графеновой глазурью35,36. Тем не менее, эта новая стратегия менее чувствительна, чем ОТ-ПЦР. Кроме того, совсем недавно была разработана покрытая аэрозольными струями наночастицами оксида графена (GrO) 3D-терминальная структура детектирования вируса, которая имеет низкий предел идентификации (2,8 × 10−15 М); В любом случае, предложенная сложная структура биосенсора35 была протестирована с точки зрения использования POC и сравнена с другими существующими биосенсорными стратегиями, которые используются для обнаружения вируса 35,37,38.
В этом исследовании мы разработали и изготовили уменьшенный и многоразовый биосенсор DIDC на основе GrO для идентификации шиповидного белка вируса без ограничений, описанных выше для других биосенсоров. Этот биосенсор позволяет проводить детектирование на уровне фемтограммы (fg) в течение 3 с18,27 времени отклика. Для проведения этого исследования были выбраны нанохлопья GrO из-за лучшей чувствительности и селективности, что означает, что могут быть обнаружены низкие концентрации белка антигена вируса из мазков из ротоглотки или носоглотки. GrO является подходящим, синтетически надежным, стабильным и проводящим материалом, который может быть с выгодой использован для биосенсорных приложений 2,39,40,41. Кроме того, был использован подход к гибридизации моноклональных антител IgG без меток, при этом основное внимание уделялось белку S1 вирусного шипа. Изготовленный биосенсор SARS-CoV-2-GrO-DIDC можно использовать повторно после расширенной обработки и очистки раствором пираньи. Этот сверхбыстрый, чувствительный, селективный, не требующий меток и многоразовый биосенсор может быть использован для биосенсоризации клинических образцов и персонализированных приложений в здравоохранении 26,42,43,44.
протокол
1. Очистка чувствительного чипа DIDC
- В начале эксперимента очистите поверхность чипа26 DIDC раствором пираньи (H2SO4:H2O2в соотношении 3:1) и поместите ее на горячую плиту при температуре 80 °C на 15 минут. Затем промойте поверхность датчика дистиллированной водой по капле с помощью пипетки, чтобы полностью удалить чистящие реагенты. Чтобы обеспечить полное удаление реагента, промойте поверхность четырьмя-пятью каплями этилового спирта.
ПРИМЕЧАНИЕ: Микросхема DIDC была изготовлена в соответствии с ранее опубликованным отчетом26. - Затем высушите поверхность сенсора при комнатной температуре для полного удаления реагентов и получения гидрофильной поверхности сенсора. Этот чип может быть использован для дальнейшего изготовления слоя оксида графена на чипе (шаг 2).
- Накройте чистые электродные прокладки чипа датчика полиимидной лентой.
2. Изготовление тонкого слоя оксида графена на сенсорной микросхеме DIDC
- Поместите чип в центр машины для нанесения покрытий в горизонтальном положении и добавьте 4 мкл водного раствора коммерчески доступного однослойного оксида графена (GO) (см. Таблицу материалов) на поверхность чипа. Затем закройте камеру отжима покрытия и работайте в течение 2 минут со скоростью 1 300 об/мин.
- Для отжига изготовленной стружки GO держите стружку на горячей плите горизонтально в течение 40 минут при температуре 80 °C.
3. Сшивание и функционализация сенсорного чипа GO-глазурованного DIDC
- Выполните сшивание N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида (EDC) и NHydroxysuccinimide (NHS) с помощью тонкопленочного чипа GO.
- Добавьте 4 мкл (0,4 М и 0,1 М, соответственно) EDC-NHS (см. Таблицу материалов) в тонкопленочный чип GO для получения ковалентного сопряжения аминных и карбоновых групп путем образования амидных связей26.
4. Получение антител и иммобилизация на чипе для чувствительности к белку
- Для связывания функционализированного чипа GO-DIDC с антителом растворяют коммерчески доступные анти-SARS-CoV-2 Abs (воспроизводимые кроличьим белком mAb anti-S1, см. Таблицу материалов) с помощью разбавляющего буфера (0,01 M PBS, содержащего 0,1% BSA [бычьего сывороточного альбумина] и 0,86% NaCl).
- К 1 мкг очищенного антитела добавьте 1 мл разведенного PBS. Затем капните 4 мкл раствора антитела на сшитый активированный чип GO-DIDC. Оставьте чип в закрытой камере на 2 часа, чтобы привязать Abs к функционализированной поверхности чипа при комнатной температуре.
ПРИМЕЧАНИЕ: Область Fab Abs обычно состоит из большого количества реакционноспособных аминных и карбоксильных групп из-за своей полярной природы26; таким образом, последующая специфическая иммобилизация приводит к устойчивой ковалентной «хвостовой» Ab-специфической ориентации.
- К 1 мкг очищенного антитела добавьте 1 мл разведенного PBS. Затем капните 4 мкл раствора антитела на сшитый активированный чип GO-DIDC. Оставьте чип в закрытой камере на 2 часа, чтобы привязать Abs к функционализированной поверхности чипа при комнатной температуре.
- После того, как иммобилизация антител на поверхности сенсора завершена, капните 4 мкл бычьего сывороточного альбумина (БСА) на чип, чтобы блокировать неспецифические участки иммуноемкостного чувствительного чипа. Поместите чип горизонтально в закрытую камеру на 20 минут при комнатной температуре.
- Промойте иммуноемкостный сенсорный чип деионизионной водой, а затем продолжайте сушить при комнатной температуре.
ПРИМЕЧАНИЕ: После сушки емкостный иммуносенсор на основе DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs) готов к выполнению серийного обнаружения спайкового антигена вируса. - Для дальнейшего зондирования спайкового белка вируса готовят различные концентрации от 1,0 мг до 1,0 fg для получения широкого предела обнаружения.
Результаты
В данной работе представлен протокол для зондирования белка S1 вируса SARS-CoV-2 с помощью двойного интердигитального емкостного сенсорного чипа (DIDC), покрытого оксидом графена. На рисунке 1 показано схематическое изображение (изготовление с компоновкой схемы) чрезвычайно чувствительной и пригодной для вторичной переработки микросхемы, модифицированной оксидом графена, с двойным межпальцевым емкостным считыванием (DIDC). Подробный процесс пошагового изготовления показан на рисунке 2. На рисунке 3 представлена характеристика функциональности поверхности с помощью атомно-силовой микроскопии (АСМ). Типичный вид сверху изготовленной микросхемы, спектроскопическая характеристика ИК-Фурье спектроскопии и угол контакта с поверхностью показаны на рисунке 4. На рисунке 5 показаны биомолекулы антигена S1, возмущающие электрическое поле между металлическими электродами и проектируемым прототипом, чувствительность чипа DIDC, селективность чипа DIDC, график зависимости концентрации от емкости для линейности (18,56 нФ/г) и время отклика при множественных концентрациях. На рисунке 6 показана оценка постоянства и воспроизводимости по отношению ко времени (в часах) и дням. На рисунке 7 показаны результаты испытаний на повторное использование чипа DIDC после регенерации. На рисунке 8 представлены графики Найквиста пригодных для вторичной переработки микросхем DIDC с точки зрения соотношения емкости и антиген-чувствительности к вирусному шипу (S1). Поэтапный процесс изготовления был проанализирован с помощью характеризации АСМ и СЭМ, а химическая связь и функционализация были проанализированы с помощью ИК-Фурье.
Схема нашего проектируемого биосенсора изображена на рисунке 1. Созданный биосенсор белка SARS-CoV-2 S1, представленный на рисунках 1А и В , обладал двукратными характеристиками двузначного емкостного чипа (DIDC) на основе GrO с указанными компонентами; идентичный формат схемы изготовленной микросхемы двухкратного межцифрового конденсатора (DIDC) показан на рисунке 1C. CL представляет конденсаторы для основных анодов, а CS представляет конденсаторы для небольших фокальных выводов, соединенных последовательно; Ширина и длина чипа составляют 4,1 мм и 5 мм соответственно. Чип детектирования DIDC на основе GrO с иммобилизованным анти-SARS-CoV-2 Abs, ограничивающим белок антигена вируса S1 (в качестве назначенного аналита) показан на рисунке 1D. Морфологическое исследование анти-SARS-CoV-2 Abs, имплантированных в GrO в масштабе 1 мкм с помощью электронной микроскопии (СЭМ), представлено на рисунке 1E; на врезке из АСМ видно, что чешуйки оксида графена распределялись аналогично, с уровнем 25 нм. На рисунке 1F показано изображение обнаженного чипа, полученное в сканирующем электронном микроскопе, а оценка двух металлических пальцев (т.е. 20 мкм) представлена на рисунке 1G.
Важно отметить, что производство биосенсоров для обнаружения белка вируса S1 на основе DIDC зависит от некоторых ключевых элементов, таких как диэлектрическая проницаемость, проводимость и распределение заряда18,45. Детектирующий белок размещается на биосенсоре DIDC, а ключевой элемент с иммунизатором и антигеном модифицируется в части детектирующих границ по сравнению с емкостным реактивным сопротивлением DIDC. Схематическое изображение процесса направленных геологоразведочных работ показано на рисунке 2A-E. Оценка DIDC проводилась с использованием измерителя LCR (портативный, серия 0,2 ГОм, 200 пФ, 1 кГц, 2 кГн, U1730C) с ПК для анализа данных, показанных на рисунке 2A. На биосенсор DIDC подавалось напряжение 0 В постоянного тока с частотой 1 кГц. Сначала пространство датчика было настроено на очистку раствором пираньи в пропорции 3:1 (H2SO4:H2O2) при 80 °C, а затем пространство было очищено деионизированной водой для удаления гидрофильных реагентов, как подробно описано в предыдущих исследованиях46,47. После взаимодействия привода поверхность изготавливали из GrO (4 мкл) при 1300 об/мин с помощью прядильной установки (рис. 2B). Затем оксид графена на чипе DIDC упрочняли путем помещения чипа на горячую пластину на 1 ч при температуре 80 °C. После процесса темперированияпроводили химический анализ EDC-NHS (4 μL; 0,4M и 0,1 M) с использованием модернизированного цикла для создания ковалентного образования аминных и карбоксильных групп путем развития амидной связи35, как показано на рисунке 2C. Затем использовали восстановительный буфер с 0,1 М реагентным буфером и обеззараженным нейтрализатором 1 мкг/мл. Для образования вируса Abs (реплицируемого mAb кроликов, враждебных белку S1), каплю объемом 4 мкл добавляли к оксиду графена, введенному NHS (рис. 2D). Следует отметить, что Fab-область антител обычно содержит много рецептивных аминных и карбоновых групп из-за своей полярной природы; таким образом, прогрессирующая явная иммобилизация приводит к образованию устойчивой ковалентной «хвостовой» Ab-специфической ориентации26, как показано на рисунке 2E. Важно отметить, что обработку бычьим сывороточным альбумином (БСА) использовали с встряхиванием в течение 20 минут при комнатной температуре для блокирования неспецифических участков чувствительного чипа. После сушки был подготовлен емкостный иммуносенсор49,50 на основе DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDC) для последовательного детектирования спайкового антигена вируса.
Для оценки морфологии поверхности чипа DIDC, голого чипа или с учетом оксида графена проводили активацию EDC-NHS, враждебного вирусу S1 Abs и антигену вируса спайка, с помощью АСМ и СЭМ. Процесс функционализации поверхности представлен на рисунке 3A-D. Последовательные поверхности показали различную морфологию и уровни на микроуровне. На чипе DIDC была отмечена стандартизированная морфология оксида графена размером 25 нм (рис. 3A), в то время как на GrO-функционализированном чипе DIDC наблюдалась иммобилизация антител против SARS-CoV-2 на чипе EDC-NHS-GrO-Pt/Ti DIDC, а затем наблюдалось дальнейшее расширение уровня до 400 нм (рис. 3B). Сшивающий агент EDC-NHS был диспергирован на уровне 40 нм (рис. 3C), что подтверждает, что антитела против SARS-CoV-2 были иммобилизованы в функционализированный чип DIDC. Кроме того, после экспансии спайкового антигена вируса наблюдался резкий пик на длине волны 600 нм за счет спайкового белка (S1), как показано на рисунке 3D, что указывает на ориентацию антител-антиген «в хвосте».
Типичные снимки СЭМ с видом сверху показаны на рисунке 4A-D. На рисунке 4A с длиной волны 500 мкм представлена успешная пластина SiO-2, покрытая фоторезистом, и микросхема DIDC с концевым контактом Ti/Pt; Кроме того, вставка в 20 мкм — это расстояние между двумя металлическими пальцами. Изготовленная поверхность чипа DIDC имеет однородную и гладкую морфологию поверхности; часть чипа, функционализированная оксидом графена, часть, которая введена в действие EDC-NHS, часть, которая иммунизирована для того, чтобы быть враждебной к вирусу, и чипы, шипованные белком вируса, отображаются на панелях (A), (B), (C) и (D) соответственно. Очищенные капли оксида графена наделяют чип гидроксильной группой (-OH) и карбоксильной группой (-COOH), что улучшает обнаружение с точки зрения чувствительности и селективности. На рисунке 4A показано распространение гомогенных чешуек GrO при длине волны 1 мкм. На рисунке 4B показана связка EDC-NHS с пустой, круглой, полой конструкцией, враждебной к вирусу, при концентрации 3 мкм. На иллюстрации 4C показано антитело с шипами, имплантированное в функционализированный детектирующий чип оксида графена EDC-NHS с массой 1 мкм. Рисунок 4D демонстрирует вирусно-спайковую антигеноподобную структуру пула, усиленную спайковым антителом при длине 10 мкм. Развитие ожидаемых связей в процессе поэтапного изготовления биосенсора GrO-DIDC было продемонстрировано с помощью ИК-Фурье спектроскопии, как показано на рисунке 4E(i-iv). Результаты ИК-Фурьеспектрометрии 26 были следующими: (i) пик связи C-H размером 2 976 см-1, вызванный антителами на поверхности чипа; (ii) функционализация EDC-NHS с пиком N-O на уровне 1 567 см-1, указывающим на присутствие нитрогруппы; (iii) пик на уровне 1038 см-1, свидетельствующий о наличии связей C-O (ароматный эфир) и ароматических колец в остаточном оксиде графена, иммобилизованном на чипе DIDC; и (iv) подвергшийся воздействию чип DIDC, показывающий первичный алкоголь (т.е. C-O связи) со слабой интенсивностью при 1060 см-1.
Предлагаемый перерабатываемый бионический чип DIDC был разработан и изготовлен для нацеливания на вирусный спайковый белок S1 путем иммобилизации явных моноклональных антител на поверхности, связывающей оксид графена-EDC-NHS. Поскольку чип включает в себя биоинженерную поверхность и схему для образования анти-SARS-CoV-2 AB, способность сшивающих агентов увеличивать скорость движения заряда, на что указывает электрическая емкость, может быть использована для подтверждения эффекта чипа (рис. 5A). Удивительно, но иммуносенсор показал минимальный уровень детализации 1,0 фг/мл, что ниже, чем у существующих биосенсорных систем для обнаружения вируса. Важно отметить, что предложенный электроемкостный иммуносенсор дополнительно обладает лучшим контрастом, а другие биосенсоры электрохимической склонности показали такой долгий путь для определения местоположения белка вируса с точки зрения отзывчивости, времени реакции, селективности и возможности повторного использования.
Для проверки чувствительности созданной иммуностадии SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC мы взяли 13 прогрессивных количеств белка вируса S1-His (от 1,0 × 10−3 г до 1,0 × 10−15 г), и использовали метод проецирования капель для добавления белка в чипы DIDC и количественной оценки емкости с учетом различных фиксаций антигена; впоследствии спектры были сопоставлены с контрольными спектрами (рис. 5В). Кроме того, мы также оценили селективность к антигенам вируса (рисунок 5C), чтобы изучить потенциальные эффекты интерферирующих веществ в естественных примерах; Например, ПСА и белки амилоидаβ 1-42 могут быть загрязнителями. Концентрация интерферирующего белка составляла 1,0 мкг/мл как для ПСА, так и для амилоида β1-42. Тест на селективность работал при наличии и отсутствии интерферирующих белков. Тестирование проводилось с использованием 10 различных датчиков; В частности, сенсоры с первого по пятый были протестированы при наличии интерферирующего белка, а остальные сенсоры (с шестого по десятый) были протестированы без интерферирующего белка. Различий между этими условиями замечено не было. С первого по пятый датчик емкость менялась от 286,9 нФ до 275,5 нФ, а с шестого по десятый датчик емкость колебалась в пределах 271,9-273,0 нФ. Каждый из образцов был подготовлен в люльке PBS 0,1 М (pH 7,4). Тесты проводились с использованием белка S1 вируса с концентрацией около 1,0 мкг/мл в условиях как с присутствием нецелевых белковых биомолекул, так и без него. После одного этапа инкубации этот емкостный иммуносенсорный чип дал количественные результаты в отношении образцов раствора объемом 5 мкл за короткий промежуток времени; Емкость изменялась через 3 С по отношению к антигенам вируса, при этом значимая перекрестная реактивность с неспецифическими аналитами отсутствовала. Оценка чувствительности белка антигена вируса показала прямолинейную зависимость между емкостью и фиксацией (т.е. y = mx + c). Здесь y — это элемент x, m — наклон, точка линии к оси x, а c — блок на y-хабе. В фактической оценке каждая оценка многократно отыграла базу, и была использована типичная стоимость; чувствительность была охарактеризована как 18,56 нФ/г (рисунок 5D). Для проверки состояния реакции созданной иммуностадии SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC были выбраны три специфические концентрации антигена, в том числе 1,0 × 10−15 г/мл, 1 × 10−9 г/мл и 1 × 10−3 г/мл. Оценка емкости становится замкнутой не менее чем за 3 с на уровне каждого фокуса в отдельности, как показано на рисунке 5Е.
Затем была проверена долговечность биокомпозита (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC); Для этого чипы помещали во влажную камеру при температуре 5 °C на 10 дней. Важно отметить, что не было замечено никаких существенных изменений в презентации изготовленного чипа DIDC с постепенным увеличением времени хранения (рисунок 6A). Кроме того, была дополнительно оценена воспроизводимость сенсора на основе DIDC, как показано на рисунке 6B. Значения емкости SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC оценивали в течение 10 ч. Важно отметить, что значения емкости были стабильными, не более ±5% отклонения значений между точками опоры. Кроме того, следуя приведенным выше результатам по долговечности, мы также оценили воспроизводимость в течение 10 дней. Следует отметить, что эти оценки емкости также различались менее чем на ±5% между точками поддержки. Следует отметить, что на второй день мы заметили небольшой контраст (от 8,8 нФ до 7,2 нФ), скорее всего, из-за перемещения чипа с комнатной температуры на низкую; Действительно, со второго дня значения емкости оставались стабильными. Важно отметить, что с первого дня до десятого дня значения емкости сместились с 8,8 нФ до 7,2 нФ, при этом не наблюдалось существенных изменений воспроизводимости/повторяемости на основе стандартного отклонения (SD), относительного стандартного отклонения (RSD) и среднего значения (x̄), как показано в таблице 1.
Наконец, была оценена возможность повторного использования вирусного чипа DIDC. Для элюирования антител с поверхности сенсора использовали 0,1 М элюирующий буфер глицин-HCl при pH 2,7; Следует отметить, что для оценки нарушения по иммуноаффинности был выбран рН от 7 до 7,4, который физиологически невозможен в организме. Важно отметить, что буфер элюирования был нанесен один раз на поверхность сенсора, и после нанесения значение емкости достигло уровня, аналогичного тому, который был обнаружен при функционализированном GrO (1,2 нФ). Через некоторое время в датчик DIDC при 80 °C был добавлен раствор пираньи, после чего было показано, что емкость находится на уровне, почти эквивалентном емкости обнаженного чипа DIDC (0,26 нФ); действительно, чип DIDC восстановил 96% своих непокрытых качеств. Примечательно, что результаты сравнивались после первого и второго выздоровлений, и не было выявлено существенных изменений, как показано на рисунках 7A, B и 8A-C.

Рисунок 1: Схематическое изображение сверхчувствительного и многократно используемого модифицированного оксидом графена двойного межпальцевого емкостного (DIDC) чувствительного чипа. (A) Структура белка вируса S1. (B) Схема изготовленной двукратной цифровой емкостной детектирующей микросхемы (DIDC). (C) Двукратный межпальцевый конденсатор (DIDC) со схемой (эквивалент). CL = конденсатор для основных выводов, соединенных последовательно; CS = конденсатор для малых фокальных электродов, соединенных последовательно; ширина чипа составляет 4,1 мм, а длина — 5 мм. (D) Чип детектирования GrO-глазированного двойного цифрового емкостного (DIDC) с иммобилизованным анти-SARS-CoV-2 Abs, специфичным для антигена вируса S1 (сфокусирован на аналите). (E) Морфологическое представление антивируса Abs, встроенного в оксид графена в масштабе 1 мкм; На рисунке на врезке показана АСМ чешуек оксида графена, которые равномерно диспергируются на уровне 25 нм. (F) Сэм-изображение экспонированной микросхемы. (G) Определяется расстояние между двумя пальцами (металлическими). Масштабная линейка = 20 мкм. Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Поэтапный процесс изготовления DIDC и оценка изменений поверхности и функциональных возможностей с помощью АСМ и сканирующей электронной микроскопии (СЭМ). (A) Изготовленный сенсорный чип DIDC с покрытой фоторезистом пластиной SiO2и экспонированным электродом Ti/Pt. (B) Изготовление GrO на микросхеме методом нанесения на микросхему методом отжима при 1300 об/мин. (C) Химическое взаимодействие EDC-NHS для микросхемы детектирования интердигитированного емкости (DIDC) с двукратным покрытием GrO. (D) Связывание антител отвечает на белок вируса S1 с выравниванием Ab «хвостом» за счет EDC-NHS (EDC-NHS-GrO-Ti/Pt-SiO2-DIDC). (E) Связывание белка S1 вируса с SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs.Этот рисунок был изменен по данным Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Определение характеристик АСМ. Осветление поверхности чипа DIDC отдельно и с учетом (A) оксида графена, (B) антитела против вирусного шиповидного белка, (C) EDC-NHS и (D) спайкового антигена вируса, что осуществляется с помощью атомно-силовой микроскопии (AFM). Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
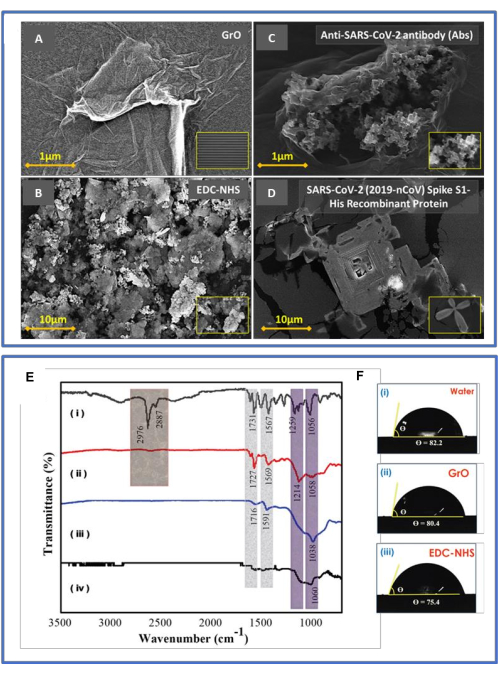
Рисунок 4: Определение характеристик СЭМ и ИК-Фурье. (А-Г) Здесь показаны типичные снимки SEM с видом сверху. Примеры, охваченные DIDC, представляют собой дополнительную стандартизированную поверхностную этиологию; (A) часть чипа, функционализированная оксидом графена, (B) часть, которая введена в действие EDC-NHS, (C) часть, функционализированная как враждебная по отношению к вирусу, и (D) чипы, шипованные вирусным белком. (B) Оценка ИК-Фурье спектрометрии и точки контакта. (E) ИК-Фурье спектроскопия: (i) враждебные антителам вируса, (ii) соединение EDC-NHS, (iii) чип DIDC, покрытый оксидом графена, и (iv) голый чип DIDC. (F) Измерение угла контакта с водой: (i) голый чип DIDC (82,0° ± 3,0°), (ii) GrO (80,4° ± 3,0°) и (iii) EDC-NHS (75,4° ± 3,0°). Кроме того, смачиваемость различных стружек оценивалась с точки зрения угла контакта капли воды объемом 5 мкл. Жидкость (вода) имела более высокую точку контакта (около 82,0° ± 3,0°) по отношению к сорванной стружке на рисунке F(i). Следует отметить, что этот показатель уменьшается с помощью GrO (80,4° ± 3,0°), как на рисунке F(ii), и EDC-NHS (75,4° ± 3,0°), как на рисунке F(iii). Эти точки контакта с поверхностью демонстрируют, что чипы, обработанные оксидом графена и EDC-NHS, были более гидрофильными, чем открытые двойные межпальцевые емкостные электроды. Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
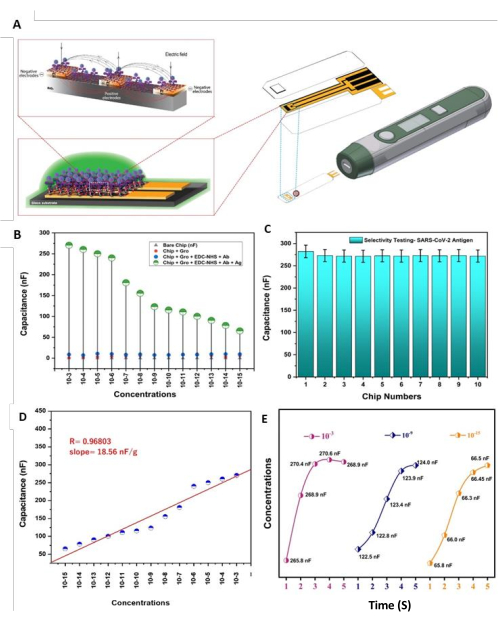
Рисунок 5: Чувствительность и функциональные характеристики. (A) Катоды DIDC на основе Ti/Pt, связанные антителами и антигеном биомолекул вируса, разрушают электрическое поле поперек/между металлом (пальцами), и влияние на емкость изготовленного чипа DIDC оценивается с помощью устройства для оценки емкости. (В)Чувствительность организованного чипа для детектирования SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs на иммуно-стадии охватывала широкий диапазон (т.е. от 1,0 мг/мл до 1,0 фг/мл); емкость в верхней части открытого чипа, Chip-GrO, Chip-Gro-EDC-NHS-SARS-CoV-2-Ab и EDC_NHS+ SARS-CoV-2-Ab+ SARS-CoV-2-Ag. (C) Селективность организованного иммуностадийного биосенсора SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs с присутствием интерферирующего белка и без него. (D) линейность составляла 18,56 нФ/г для широкого диапазона концентраций, и существовала сильная прямая линия рецидива; наклон и коэффициент рецидива (R) определяли путем подгонки информации. (E) Время отклика (3 с) концентраций 1,0 × 10−15 г/мл, 1 × 10−9 г/мл и 1 × 10−3 г/мл в зависимости от значений емкости после применения образцов белка. Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
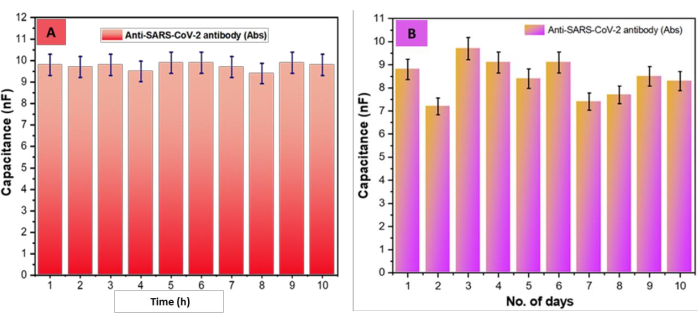
Рисунок 6: Оценка стабильности и воспроизводимости биосенсора. (A) Диаграмма зависимости емкости SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDCs от 1 до 10 часов с отклонением на ±5% между значениями точки поддержки. (B) Результаты стабильности, в которых оценивалась воспроизводимость организованных SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDC во времени, показали отклонение на ±5% в течение 10 дней между значениями точки поддержки. Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Возможность повторного использования чипа DIDC на основе атомно-силовой микроскопии и изображений сканирующей электронной микроскопии. (A) 3D АСМ-изображение чипа DIDC после одного испытания; Утолщение скола отчетливо заметно до 250 нм. (B) Изображение СЭМ с высоким разрешением (HR) после одной попытки обнаружения вирусного спайкового антигена в масштабе 1 мм; В центре представлены изображения катодов Pt/Ti на расстоянии 50 мкм, изображение HR пальца металлического электрода на расстоянии 10 мкм и расстояние между двумя пальцами (т. е. 20 мкм). На изображениях АСМ и СЭМ не было замечено никаких дефектов или разрывов, и тот же чип был использован для еще одного испытания анализа. Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Емкость по сравнению с чувствительностью антигена SARS-CoV-2 spike (S1) при различных концентрациях, а также регенерация и возможность повторного использования чипа DIDC: (A) Графики Найквиста бионического электрода DIDC, покрытого оксидом графена, измеренные с помощью импедансного анализатора; емкостный метод без и с спайковыми антигенами S1 в концентрациях от 1,0 мг/мл до 1,0 фг/мл в растворе PBS. (ii,iii) Графики Найквиста, соответствующие графикам в A. (B) После одного успешного восстановления сенсора при низком pH (2,7) с использованием элюирующего буфера (0,1 M) глицин-HCl и очистки пираний. Восстановление достигалось за 20 минут или меньше. Для всех фокусов вход в (B,C) составлял 96% от входа в (A). (C) после двух последовательных регенераций датчика. Для каждой из оценок заряд движется для бионических анодов DIDC, покрытых оксидом графена; в качестве контроля использовали буферную схему PBS 0,1 М (pH 7,4). Было получено три последовательных показания для различных концентраций антигена вирусного шипа (S1). Для сбора этих данных использовалась частота 1 кГц. Эта цифра была изменена по сравнению с Sharma et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Время (в часах) | Чип + Гро + EDC- NHS + Ab | Ошибка | Нет. дней | Чип + Гро + EDC- NHS + Ab | Ошибка |
| 1 | 9.8 | 0.49 | 1 | 8.8 | 0.44 |
| 2 | 9.7 | 0.485 | 2 | 7.2 | 0.36 |
| 3 | 9.8 | 0.49 | 3 | 9.7 | 0.485 |
| 4 | 9.5 | 0.475 | 4 | 9.1 | 0.455 |
| 5 | 9.9 | 0.495 | 5 | 8.4 | 0.42 |
| 6 | 9.9 | 0.495 | 6 | 9.1 | 0.455 |
| 7 | 9.7 | 0.485 | 7 | 7.4 | 0.37 |
| 8 | 9.4 | 0.47 | 8 | 7.7 | 0.385 |
| 9 | 9.9 | 0.495 | 9 | 8.5 | 0.425 |
| 10 | 9.8 | 0.49 | 10 | 8.3 | 0.415 |
| Среднее (x̄) | 9.74 | 8.42 | |||
| УР (±) | 0.171269768 | 0.801110479 | |||
| РСД (%) | 1.758416506 | 9.514376238 |
Таблица 1: Оценка воспроизводимости/повторяемости со средними значениями (x̄), стандартного отклонения (SD) и относительного стандартного отклонения (RSD).
Обсуждение
Для создания производительного биосенсора на основе чипа DIDC чрезвычайно важны распределение заряда, проводимость и диэлектрическая проницаемость DIDC. Важно отметить, что улучшения в этих границах детектирования связаны с емкостным реактивным сопротивлением DIDC 18,26,27. В этом исследовании был изготовлен емкостный иммуносенсор, который является враждебным к вирусу Abs и функционализирован путем связывания EDC-NHS на субстрате SiO2на основе оксида графена и DIDC. Кроме того, был добавлен кросслинкинг EDC-NHS путем использования ковалентного связывания с субстратом GrO для функционализации против вируса Abs.
С помощью тщательно спланированной процедуры, которая обеспечила готовность поверхности датчика, иммобилизацию Abs против SARS-CoV-2 и связывание с белком вируса S1, было найдено равновесие между конкурирующими элементами простоты иммобилизации, эксплицитности и общей емкости. Совершенствование GrO-регулируемого биочипа DIDC было проверено с помощью электрического и оптического исследования поверхности. Большая площадь поверхности материалов на основе графена обуславливает адсорбцию различных аналитов. Кроме того, этот сверхчувствительный и сверхбыстрый биочип GrO-DIDC представляет собой простую и подходящую систему для тестирования POC. Таким образом, детальный биосенсор является передовой технологией. Во-первых, датчик может создавать изменение емкости, превышающее 70 нФ, поскольку открытый чип DIDC с покрытием GrO имеет низкую сходимость 1,0 фг/мл. Степень изменения емкости увеличивается с приращением при концентрации белка-мишени вирусного антигена в диапазоне от 1,0 мг/мл до 1,0 фг/мл. Пределы идентификации данного биосенсора являются одними из самых низких на сегодняшний день для нефарадического биосенсора (емкостного). Во-вторых, явность сенсора была показана по вариации метода дифференциации емкости между целевыми и нецелевыми биомаркерами (белком). Для белков, не являющихся мишенями, изменение емкости принципиально отличалось от изменения емкости целевого белка антигена S1 для объективного вируса, и существенного изменения емкости при приращениях фиксации белка без мишени не наблюдалось. В-третьих, датчик обеспечивает широкий диапазон обнаружения от 1,0 мг/мл до 1,0 фг/мл с большой линейностью емкости (т.е. 18,56 нФ/г). С одной стороны, быстрая идентификация антигена вируса S1 позволяет быстро выявлять ключевые личные контакты, расширяет возможности лечения и поддерживает назначенное лечение; Кроме того, такая идентификация помогает сдерживать распространение болезни, что необходимо для своевременной борьбы с пандемией. Наиболее важной частью этой сложной и ограниченной технологии является оптимизация производственного процесса и функциональности чипов. Необходимо управлять каждым этапом производственного процесса. Результаты изготовления могут отличаться и быть ограниченными в зависимости от того, как с ним обращаются.
Заключение и точка зрения
В данной статье представлен разработанный и изготовленный сверхбыстрый и пригодный для вторичной переработки двукратный интердигитированный емкостный чип (DIDC), измененный оксидом графена, для идентификации белков вируса S1 конкретно на уровне fg. Исследования в этой работе показали, что использование GrO-функционализированного емкостного чипа DIDC еще больше развивает пределы чувствительности, тем самым повышая отзывчивость и селективность биосенсорного устройства. Ограниченная форма линии и изменение электрических свойств (импедансной связи) приводили к изменению емкости для массива диапазонов идентификации (от 1,0 × 10−3 г до 1,0 × 10−15 г). Функционирование емкостного сенсора DIDC было всесторонне протестировано в глубоко ослабленных конструкциях, содержащих биомолекулы BSA и спайковые белки. Эти исследования показали, что предложенный емкостный сенсор DIDC может быть использован для обнаружения белков вируса S1 на низких уровнях за короткое время (~5-6 с). Таким образом, предлагаемая безболезненная, бесконтактная и быстрая процедура в данной работе позволяет выявлять белок вируса S1 на начальных фазах заболевания с высокой чувствительностью.
В дальнейшем планируется идентифицировать вирусные шиповидные белки в POC, чтобы расширить возможности лечения, ориентированного на пациента, и модернизировать все части устройства (т.е. чип обнаружения, развивая полную координацию емкостного датчика DIDC на основе модели с реальными примерами пациентов [одновременно]). В конечном счете, COVID-19 можно будет обнаружить с помощью технологий на основе сотовых телефонов. Тем не менее, обсуждаемый и представленный биосенсор еще не был опробован с использованием подлинных образцов из-за отсутствия биологического образца и этического одобрения. Предпринимаются серьезные усилия по налаживанию сотрудничества между южнокорейскими вирусологическими и инфекционными лабораториями и клиниками неотложной помощи за рубежом для получения биожидкостей от пациентов, инфицированных COVID-19. Результаты будущих исследований диагностики COVID-19 POC с использованием нашего высококачественного емкостного датчика будут опубликованы в других источниках.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была в некоторой степени поддержана Программой фундаментальных научных исследований через Национальный исследовательский фонд Кореи (NRF), спонсируемой Министерством образования в рамках гранта 2018R1D1A1A09083353 и гранта 2018R1A6A1A03025242, в некоторой степени Ассоциацией GCS Group Ltd., а также Высшей школой Министерства окружающей среды Кореи (MOE) в 2022 году она вложила огромные усилия в проект комплексного предотвращения и контроля загрязнения и исследовательский грант Университета Квангун.
Э.М. выражает благодарность за поддержку со стороны Национального института биомедицинской визуализации и биоинженерии (5T32EB009035).
Материалы
| Name | Company | Catalog Number | Comments |
| Amyloid β1-42 Protein | Merck (Sigma-Aldrich) | 107761-42-2 | |
| anti-SARS-CoV-2 Spike (S1) monoclonal IgG antibody | SinoBiological | 40150-R007 | |
| EDC [N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride] | Thermo Fisher Scientific | A35391 | |
| Ethyl alcohol (C2H5OH) | Sigma-Aldrich | ||
| Hydrogen peroxide (H2O2) | |||
| Kapton tape | polyimide tape | ||
| NHS (NHydroxysuccinimide, 98+%; C4H5NO3) | Thermo Fisher Scientific | A39269 | |
| PBS | |||
| Prostate-specific antigen | Sigma-Aldrich | P3338-25UG | |
| SARS-CoV-2 Spike S1-His recombinant protein | SinoBiological | 40591-V08H | |
| Single layer Graphene Oxide | Graphene Supermarket | ||
| Spin Coater | High Precision Spin Coater (Spin Coating System) | ACE-200 | |
| Sulfuric acid (H2SO4) |
Ссылки
- Boldog, P. Risk assessment of novel coronavirus COVID-19 outbreaks outside China. Journal of Clinical Medicine. 9 (2), 571-583 (2020).
- Seo, G., et al. Rapid detection of COVID-19 causative virus (SARS-CoV-2) in human nasopharyngeal swab specimens using field-effect transistor-based biosensor. ACS Nano. 14 (4), 5135-5142 (2020).
- Panda, P. K. Structure-based drug designing and immunoinformatics approach for SARS-CoV-2. Science Advances. 6, 5135-5142 (2020).
- Li, R., et al. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV-2). Science Advances. 368, 489-493 (2020).
- Lu, R., et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 395 (10224), 565-574 (2020).
- Hui, D. S. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. Journal of Infectious Diseases. 91, 264-266 (2020).
- Chen, I. Y., et al. Upregulation of the chemokine (C-C motif) ligand 2 via a severe acute respiratory syndrome coronavirus spike-ACE2 signaling pathway. Journal of Virology. 84 (15), 7703-7712 (2010).
- Fung, T. S., Huang, M., Liu, D. X. Coronavirus-induced ER stress response and its involvement in regulation of coronavirus-host interactions. Virus Research. 194, 110-123 (2014).
- Park, S. E. Epidemiology, virology, and clinical features of severe acute respiratory syndrome -coronavirus-2 (SARS-CoV-2: Coronavirus Disease-19). Korean Journal of Pediatrics. 63 (4), 119-124 (2020).
- Fajnzylber, J., et al. SARS-CoV-2 viral load is associated with increased disease severity and mortality. Nature Communications. 11 (1), 5493 (2020).
- Rao, K., et al. Review on newly identified coronavirus and its genomic organization. SSR Institute of International Journal of Life Sciences. 6 (2), 2509 (2020).
- Mujawar, M. A., et al. Nano-enabled biosensing systems for intelligent healthcare: Towards COVID-19 management. Materials Today Chemistry. 17, 100306 (2020).
- Manickam, P., et al. Artificial intelligence (AI) and internet of medical things (IoMT) assisted biomedical systems for intelligent healthcare. Biosensors. 12 (8), 562-591 (2022).
- Kaushik, A. K., et al. Electrochemical SARS-CoV-2 sensing at point-of-care and artificial intelligence for intelligent COVID-19 management. ACS Applied Bio Materials. 3 (11), 7306-7325 (2020).
- Lee, D., Lee, J. Testing on the move: South Korea's rapid response to the COVID-19 pandemic. Transportation Research Interdisciplinary Perspectives. 5, 100111 (2020).
- Emery, S. L., et al. Real-time reverse transcription-polymerase chain reaction assay for SARS-associated coronavirus. Emerging Infectious Diseases. 10 (2), 311-316 (2004).
- Lu, X., et al. Real-time reverse transcription-PCR assay panel for Middle East respiratory syndrome coronavirus. Journal of Clinical Microbiology. 52 (1), 67-75 (2014).
- Mishra, S., et al. Tailored biofunctionalized biosensor for the label-free sensing of prostate-specific antigen. ACS Applied Bio Materials. 3 (11), 7821-7830 (2020).
- Wang, Y. L., et al. Detection of severe acute respiratory syndrome (SARS) coronavirus nucleocapsid protein using AlGaN/GaN high electron mobility transistors. ECS Transactions. 50 (6), 239-243 (2013).
- Ravi, N., Cortade, D. L., Ng, E., Wang, S. X. Diagnostics for SARS-CoV-2 detection: A comprehensive review of the FDA-EUA COVID-19 testing landscape. Biosensors and Bioelectronics. 165, 112454 (2020).
- Sethuraman, N., Jeremiah, S. S., Ryo, A. Interpreting diagnostic tests for SARS-CoV-2. JAMA. 323, 2249-2251 (2020).
- Timmer, W. C., Villalobos, J. M. . Chemistry Education. 70 (4), 273-280 (1993).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (5), 368-373 (2006).
- Drummond, T. G., Hill, M. G., Barton, J. K. Electrochemical DNA sensors. Nature Biotechnology. 21, 1192-1199 (2003).
- Singhal, C., Khanuja, M., Chaudhary, N., Pundir, C. S., Narang, J. Detection of chikungunya virus DNA using two-dimensional MoS2 nanosheets based disposable biosensor. Scientific Reports. 8, 7734 (2018).
- Sharma, P. K., et al. Ultrasensitive and reusable graphene oxide-modified double-interdigitated capacitive (DIDC) sensing chip for detecting SARS-CoV-2. ACS Sensors. 6 (9), 3468-3476 (2021).
- Sharma, P. K., et al. Ultrasensitive probeless capacitive biosensor for amyloid beta (Ab) detection in human plasma using interdigitated electrodes. Biosensors and Bioelectronics. 212, 114365 (2022).
- Wang, L., et al. A sensitive DNA capacitive biosensor using interdigitated electrodes. Biosensors and Bioelectronics. 87, 646-653 (2017).
- Brasil, P., et al. Zika virus infection in pregnant women in Rio de Janeiro. The New England Journal of Medicine. 375 (24), 2321-2334 (2016).
- Kong, J., et al. Molecular wires as chemical sensors. Science. 287 (5453), 622-625 (2000).
- Wang, J. Carbon-nanotube based electrochemical biosensors: A review. Electroanalysis. 17 (1), 7-14 (2005).
- Layqah, L. A., Eissa, S. An electrochemical immunosensor for the coronavirus associated with the Middle East respiratory syndrome using an array of gold nanoparticle-modified carbon electrodes. Microchimica Acta. 186 (4), 224-234 (2019).
- Vermisoglou, E., et al. Human virus detection with graphene-based materials. Biosensors and Bioelectronics. 166, 112436 (2020).
- Mostafavi, E., Dubey, A. K., Teodori, L., Ramakrishna, S., Kaushik, A. SARS-CoV-2 Oomicron variant: A next phase of the COVID-19 pandemic and a call to arms for system sciences and precision medicine. MedComm. 3 (1), 119 (2022).
- Ali, M. A., et al. Sensing of COVID-19 antibodies in seconds via aerosol jet printed three dimensional electrodes. Advanced Materials. 33 (7), 2006647 (2020).
- Ganbold, E., Sharma, P. K., Kim, E. -. S., Lee, D. -. N., Kim, N. -. Y. Capacitive humidity sensor with a rapid response time on a GO-doped P(VDF-TrFE)/LiCl composite for noncontact sensing applications. Chemosensors. 11 (2), 122 (2023).
- Shivani, T., et al. Antibacterial and antiviral high-performance nanosystems to mitigate new SARS-CoV-2 variants of concern. Current Opinion in Biomedical Engineering. 21, 100363 (2022).
- Kujawska, M., Mostafavi, E., Kaushik, A. SARS-CoV-2 getting into the brain; Neurological phenotype of COVID-19, and management by nano-biotechnology. Neural Regeneration Research. 18 (3), 519-520 (2022).
- Kang, P., Wang, M. C., Nam, S. Bioelectronics with two-dimensional materials. Microelectronic Engineering. 161, 18-35 (2016).
- Syama, S., Mohanan, P. V. Comprehensive application of graphene: Emphasis on biomedical concerns. Nano-Micro Letters. 11, 6 (2019).
- Chaudhary, V., Kaushik, A., Furukawa, H., Khosla, A. Review-Towards 5th generation AI and IoT driven sustainable intelligent sensors based on 2D MXenes and borophene. ECS Sensors Plus. 1, 013601 (2022).
- Sharma, P. K., et al. Perspectives on 2D-borophene flatland for smart bio-sensing. Materials Letters. 308, 131089 (2022).
- Sharma, P. K., Khondakar, K. R., Kaushik, A. K., et al. Nanotechnology and its application: A review. Nanotechnology in Cancer Management. Precise Diagnostics Toward Personalized Health Care. 1 (1), 1-33 (2021).
- Rawat, P., et al. Emergence of high-performing and ultra-fast 2D-graphene nano-biosensing system. Materials Letters. 308, 131241 (2022).
- Ganbold, E., et al. Highly sensitive interdigitated capacitive humidity sensors based on sponge-like nanoporous PVDF/LiCl composite for real-time monitoring. ACS Applied Materials & Interfaces. 15 (3), 4559-4568 (2023).
- Feng, J., Guo, Z. Wettability of graphene: From influencing factors and reversible conversions to potential applications. Nanoscale Horizons. 4, 339-364 (2019).
- Flynn, S. P., et al. qua-Art: A demonstration of hydrophilic and hydrophobic surfaces fabricated by plasma enhanced chemical vapor deposition. Chemical Education. 94 (2), 221-225 (2017).
- Bhardwaj, S. K., Yadav, P., Ghosh, S., Basu, T., Mahapatro, A. K. Biosensing test-bed using electrochemically deposited reduced graphene oxide. ACS Applied Materials & Interfaces. 8 (37), 24350-24360 (2016).
- Reddicherla, U., Seyed, M. G., Sonwal, S., Gokana, M. R., Yun, S. H. Portable electrochemical sensing methodologies for on-site detection of pesticide residues in fruits and vegetables. Coordination Chemistry Reviews. 453, 214305 (2022).
- Reddicherla, U., et al. Colorimetric based on-site sensing strategies for the rapid detection of pesticides in agricultural foods: New horizons, perspectives, and challenges. Coordination Chemistry Reviews. 446, 214061 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены