Method Article
Chip de detección modificado con grafeno de alto rendimiento para la detección del SARS-CoV-2
En este artículo
Resumen
El presente protocolo describe la fabricación de prototipos de biodetección de bajo coste basados en nanosistemas útiles para la detección precisa de proteínas virales (a nivel de Fg). Una plataforma de sensores tan pequeña permite aplicaciones en el punto de atención que se pueden integrar con el Internet de las cosas médicas (IoMT) para cumplir con los objetivos de la telemedicina.
Resumen
Este modelo prototipo de detección implica el desarrollo de un chip de detección reutilizable y bipartidista con doble esmalte de óxido de grafeno (GrO) capacitivo (DIDC) para detectar el virus del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) de manera específica y rápida. El DIDC fabricado comprende un sustrato de vidrio que contiene Ti/Pt esmaltado con óxido de grafeno (GrO), que se modifica químicamente con EDC-NHS para inmovilizar anticuerpos (Abs) hostiles al SARS-CoV-2 basados en la proteína de pico (S1) del virus. Los resultados de investigaciones perspicaces mostraron que GrO proporcionó una superficie de ingeniería ideal para la inmovilización de Ab y mejoró la capacitancia para permitir una mayor sensibilidad y bajos límites de detección. Estos elementos sintonizables ayudaron a lograr un amplio rango de detección (1,0 mg/mL a 1,0 fg/mL), un límite mínimo de detección de 1 fg/mL, alta capacidad de respuesta y buena linealidad de 18,56 nF/g, y un tiempo de reacción rápido de 3 s. Además, en términos de desarrollo de marcos de pruebas en el punto de atención (POC) financieramente viables, la reutilización del biochip GrO-DIDC en este estudio es buena. Significativamente, el biochip es específico contra antígenos transmitidos por la sangre y es estable hasta 10 días a 5 °C. Debido a su compacidad, este biosensor a escala reducida tiene el potencial de realizar diagnósticos POC de infección por COVID-19. Este sistema también puede detectar otras enfermedades virales graves, aunque se está desarrollando un paso de aprobación que utiliza otros ejemplos de virus.
Introducción
A finales de 2019, se produjo en la ciudad de Wuhan (China) una pandemia viral causada por un nuevo coronavirusbeta 1 (es decir, 2019-nCoV), que posteriormente se denominó coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2)2 (en lo sucesivo denominado predominantemente el virus), que implicó un grupo neumónico y dificultad respiratoria aguda grave3. Debido a su rápida transmisión mundial de persona a persona, su alta tasa de infección, su alta tasa de mortalidad y sus graves efectos adversos potencialmente mortales4, durante la pandemia, la investigación en virología5 evolucionó rápidamente para identificar la organización y estructura genómica del virus 5,6. Los síntomas de la COVID-19 7,8 incluyen fiebre alta, tos seca y dolor generalizado9. Es importante destacar que los diferentes serotipos del virus conducen a diferentes gravedades de la enfermedad10. Además, los portadores asintomáticos pueden propagar el virus. Por lo general, bajo el microscopio, las partículas del virus COVID-19 muestran proyecciones en forma de garrote formadas por proteínas de pico11. Por lo tanto, para controlar la propagación de este nuevo patógeno, la detección de casos debe ser oportuna y eficiente. Así, la detección ultrasensible, rápida y selectiva del virus en las primeras etapas de la infección viral se ha vuelto crucial 2,11. El distanciamiento social/físico es necesario para evitarla transmisión del virus. Los organismos de salud están haciendo hincapié en el desarrollo de herramientas de diagnóstico inteligentes y nanosistemas13. De hecho, como sugieren las agencias de salud, las pruebas dirigidas y masivas14,15 son necesarias y siguen siendo demandadas.
En principio, los métodos de diagnóstico biológico en curso, como la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR), son los mejores medios para la identificación masiva del SARS-CoV-2, al igual que con el coronavirus relacionado con el síndrome respiratorio de Oriente Medio (MERS-CoV)16 y el SARS-CoV-117. En este contexto, la identificación estándar actual de la contaminación por SARS-CoV-2 depende de la mejora de las características específicas de la infección18,19. Además, se debe tener en cuenta la variación de la infección por SARS-CoV-2 según la zona, la edad, la raza y el sexo. Con el objetivo final de salvar vidas, es crucial crear herramientas de diagnóstico rápido para su uso en el punto de atención (POC)20,21.
En este contexto, las estrategias regulares como la hibridación fluorescente in situ (FISH), el examen de inmunoabsorción de proteínas (ELISA), los métodos basados en microesferas, las pruebas electroquímicas y la resonancia magnética, la PET y la NIRFOI22 tienen baja sensibilidad a los niveles bajos del virus, baja selectividad y baja capacidad de reutilización; Además, estos procedimientos tienen desventajas, como los costosos sistemas de diagnóstico por biodetección, los reactivos no reutilizables y la necesidad de una mano de obra altamente cualificada23. Por lo tanto, estas técnicas perspicaces no pueden ser vistas como métodos POC rápidos, razonables, excepcionalmente específicos o sensibles24,25. Cabe destacar que existen diferentes tipos de biosensores basados en ADN e inmunizantes que utilizan técnicas compuestas, capacitivas y eléctricas 18,26,27,28. A modo de ejemplo, se han producido biosensores eléctricos de ADN, que tienen una alta capacidad de respuesta, se pueden reducir fácilmente y son sintonizables29,30, para la detección de Ébola31, Zika, MERS-CoV y SARS-CoV 32,33,34. Del mismo modo, se ha creado eficazmente un biosensor semiconductor de impacto de campo (FET) para detectar la proteína de pico del virus utilizando ciertos anticuerpos (monoclonales) inmovilizados en dispositivos vidriados con grafeno35,36. No obstante, esta nueva estrategia es menos sensible que la RT-PCR. Además, más recientemente, se ha desarrollado un marco de detección 3D basado en terminales cubierto de óxido de grafeno (GrO) en aerosol y con nanopartículas disminuidas en aerosol para el virus, que tiene un límite bajo de identificación (2,8 × 10-15 M); en cualquier caso, la estructura compleja de biosensores propuesta35 ha sido probada con respecto al uso de POC y comparada con otras estrategias de biosensores existentes que se utilizan para la detección del virus 35,37,38.
En este estudio, diseñamos y fabricamos un biosensor DIDC a escala reducida y reutilizable basado en GrO para identificar la proteína de pico del virus sin las limitaciones descritas anteriormente para otros biosensores. Este biosensor permite la detección a nivel de femtogramo (fg) dentro de los 3 s18,27 de tiempo de respuesta. Para llevar a cabo esta investigación, se eligieron nanocopos de GrO por su mejor capacidad de respuesta y selectividad, lo que significa que se pueden detectar bajas concentraciones de la proteína del antígeno del virus en hisopos orofaríngeos o nasofaríngeos. El GrO es un material apropiado, sintéticamente confiable, consistente y conductor que puede utilizarse de manera beneficiosa para aplicaciones de biodetección 2,39,40,41. Además, se utilizó un enfoque de hibridación sin marcadores de anticuerpos monoclonales IgG, centrándose en la proteína S1 de la espícula del virus. El biosensor fabricado para el SARS-CoV-2-GrO-DIDC es reutilizable después de un tratamiento avanzado y una limpieza con solución de piraña. Este biosensor ultrarrápido, sensible, selectivo, sin etiquetas y reutilizable se puede utilizar para la biodetección de muestras clínicas y aplicaciones de atención médica personalizada 26,42,43,44.
Protocolo
1. Limpieza del chip de detección DIDC
- Al comienzo del experimento, limpie la superficie del chip DIDC26 con solución de piraña (H2SO4:H2O2en una proporción de 3:1) y colóquela en la placa calefactora a 80 °C durante 15 min. A continuación, enjuague la superficie del sensor con agua destilada gota a gota utilizando una pipeta para eliminar completamente los reactivos de limpieza. Para asegurar la eliminación completa del reactivo, enjuague la superficie con cuatro o cinco gotas de alcohol etílico.
NOTA: El chip DIDC se fabricó a partir de un informe publicado anteriormente26. - A continuación, seque la superficie del sensor a temperatura ambiente para eliminar por completo los reactivos y obtener una superficie de sensor hidrófila. Este chip se puede utilizar para la fabricación posterior de la capa de óxido de grafeno en el chip (paso 2).
- Cubra las almohadillas de electrodos del chip del sensor limpias con cinta de poliimida.
2. Fabricación de la fina capa de óxido de grafeno en el chip de detección DIDC
- Coloque la viruta en el centro de la máquina de recubrimiento por rotación en posición horizontal y agregue 4 μL de una solución acuosa de óxido de grafeno (GO) de una sola capa disponible comercialmente (consulte la Tabla de materiales) sobre la superficie de la viruta. A continuación, cierre la cámara de recubrimiento por centrifugado y hágala funcionar durante 2 minutos a 1.300 rpm.
- Para el recocido del chip GO fabricado, mantenga el chip en la placa calefactora horizontalmente durante 40 minutos a 80 °C.
3. Reticulación y funcionalización del chip de detección DIDC glaseado GO
- Realice la reticulación del clorhidrato de N-(3-dimetilaminopropil)-N'-etilcarbodiimida (EDC) y NHydroxysuccinimida (NHS) con el chip GO de película delgada.
- Agregue 4 μL (0,4 M y 0,1 M, respectivamente) de EDC-NHS (ver Tabla de Materiales) al chip GO de película delgada para generar la conjugación covalente de grupos amina y carboxílico a través de la formación de enlaces amida26.
4. Preparación e inmovilización de anticuerpos en el chip para la detección de proteínas
- Para unir el chip GO-DIDC funcionalizado con el anticuerpo, disuelva los Abs anti-SARS-CoV-2 disponibles comercialmente (reproducidos por la proteína mAb anti-S1 de conejo, consulte la Tabla de materiales) utilizando el tampón de dilución (0,01 M PBS que contiene 0,1% de BSA [albúmina sérica bovina] y 0,86% de NaCl).
- A 1 μg de anticuerpo purificado, añadir 1 mL de PBS diluido. A continuación, coloque 4 μL de la solución de anticuerpos en el chip GO-DIDC activado reticulado. Deje el chip en la cámara cerrada durante 2 h para unir el Abs a la superficie funcionalizada del chip a temperatura ambiente.
NOTA: La región Fab de los Abs suele estar formada por abundantes aminas reactivas y grupos carboxílicos debido a su naturaleza polar26; por lo tanto, la inmovilización específica posterior conduce a una orientación covalente robusta "en cola" Ab-específica.
- A 1 μg de anticuerpo purificado, añadir 1 mL de PBS diluido. A continuación, coloque 4 μL de la solución de anticuerpos en el chip GO-DIDC activado reticulado. Deje el chip en la cámara cerrada durante 2 h para unir el Abs a la superficie funcionalizada del chip a temperatura ambiente.
- Una vez realizada la inmovilización de anticuerpos en la superficie del sensor, se colocan 4 μL de albúmina sérica bovina (BSA) en el chip para bloquear los sitios no específicos del chip de detección inmunocapacitivo. Coloque el chip horizontalmente en la cámara cerrada durante 20 minutos a temperatura ambiente.
- Lave el chip sensor inmunocapacitivo con agua desionizada y luego continúe secando a temperatura ambiente.
NOTA: Después del secado, el inmunosensor capacitivo basado en DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs) está listo para realizar la detección en serie del antígeno de la espícula del virus. - Para una mayor detección de la proteína de pico del virus, prepare diferentes concentraciones de 1,0 mg a 1,0 fg para obtener un límite de detección amplio.
Resultados
Aquí, se presenta un protocolo para detectar la proteína S1 del virus SARS-CoV-2 utilizando un chip de detección capacitivo doble interdigitado (DIDC) glaseado con óxido de grafeno. La Figura 1 muestra una representación esquemática (fabricación con el diseño del circuito) del chip de detección capacitivo de doble interdigitación (DIDC) modificado con óxido de grafeno extremadamente sensible y reciclable. El proceso de fabricación paso a paso detallado se muestra en la Figura 2. La Figura 3 representa la caracterización de la funcionalidad de la superficie mediante microscopía de fuerza atómica (AFM). En la Figura 4 se muestra una vista superior típica del chip fabricado, la caracterización espectroscópica FTIR y el ángulo de contacto de la superficie. La Figura 5 denota las biomoléculas del antígeno S1 que perturban el campo eléctrico entre los electrodos metálicos y el prototipo proyectado, la sensibilidad del chip DIDC, la selectividad del chip DIDC, el gráfico de concentración frente a capacitancia para la linealidad (18,56 nF/g) y los tiempos de respuesta de múltiples concentraciones. En la figura 6 se muestra la evaluación de la constancia y reproducibilidad con respecto al tiempo (en horas) y días. La Figura 7 muestra los resultados de las pruebas de reutilización del chip DIDC después de la regeneración. La Figura 8 presenta los gráficos de Nyquist de los chips DIDC reciclables en términos de la capacitancia frente al rendimiento de detección de antígenos de la espícula del virus (S1). El proceso de fabricación escalonado se analizó mediante caracterización AFM y SEM, y la unión química y la funcionalización se analizaron mediante FTIR.
El esquema de nuestro biosensor proyectado se muestra en la Figura 1. El biosensor de proteína SARS-CoV-2 S1 creado representado en las Figuras 1A y B exhibió las características dobles del chip capacitivo interdigitado doble (DIDC) basado en GrO con los componentes mencionados anteriormente; el formato de circuito idéntico del chip de condensador interdigitado doble (DIDC) fabricado se muestra en la Figura 1C. CL representa los condensadores para los ánodos principales, y CS representa los condensadores para terminales focales pequeños conectados en serie; El ancho y la longitud del chip son de 4,1 mm y 5 mm, respectivamente. En la Figura 1D se muestra el chip de detección DIDC basado en GrO con Abs anti-SARS-CoV-2 inmovilizado que se restringe a la proteína del antígeno S1 del virus (como analito designado). En la Figura 1E se muestra el examen morfológico de los Abs anti-SARS-CoV-2 implantados en el GrO a escala de 1 μm mediante microscopía electrónica (SEM); la imagen insertada del AFM muestra que las escamas de óxido de grafeno se distribuyeron de manera similar, con un nivel de 25 nm. La Figura 1F muestra la imagen del microscopio electrónico de barrido de un chip descubierto, y la estimación de dos dedos metálicos (es decir, 20 μm) se presenta en la Figura 1G.
Es importante destacar que la fabricación de biosensores para la detección de la proteína del virus S1 basada en DIDC depende de ciertos elementos clave, como la constante dieléctrica, la conductividad y la distribución de la carga18,45. La proteína de detección se coloca en el biosensor DIDC, y el elemento clave con el inmunizante y el antígeno se modifica en cuanto a los límites de detección en comparación con la reactancia capacitiva DIDC. En la Figura 2A-E se muestra una representación esquemática del proceso de trabajo de exploración dirigida. El DIDC se evaluó utilizando un medidor LCR (portátil, 0,2 GΩ, 200 pF, 1 kHz, 2 kH, serie U1730C) con una PC para el análisis de datos en la Figura 2A. Se aplicó un voltaje de 0 V CC con una frecuencia de 1 kHz a través del biosensor DIDC. En primer lugar, se configuró el espacio del sensor con una solución de piraña con una proporción de 3:1 (H2SO4:H2O2) a 80 °C y, posteriormente, se limpió el espacio con agua desionizada para eliminar los reactivos hidrofílicos, como se detalla en investigaciones previas46,47. Después de la interacción de actuación, la superficie se fabricó con GrO (4 μL) a 1.300 rpm por medio de un spin-coater (Figura 2B). A continuación, se reforzó el óxido de grafeno del chip DIDC colocando el chip en una placa calefactora durante 1 h a 80 °C. Después del proceso de templado, se realizó la química EDC-NHS (4 μL; 0.4M y 0.1 M,)48, utilizando un ciclo mejorado para crear la formación covalente de grupos amina y carboxílico a través del desarrollo del enlace amida35, como se aborda en la Figura 2C. A continuación, se utilizó un tampón de reconstitución con un tampón reactivo de 0,1 M y un neutralizador descontaminado de 1 μg/mL. Para la formación del virus Abs (replicado por mAbs de conejo hostiles a la proteína S1), se añadió una gota de 4 μL al óxido de grafeno promulgado por el NHS (Figura 2D). Cabe destacar que el área Fab de los anticuerpos generalmente comprende muchos grupos amina receptivos y carboxílicos debido a su naturaleza polar; de esta manera, la inmovilización explícita progresiva da como resultado una orientación covalente robusta "en la cola"Ab-específica 26, como se caracteriza en la Figura 2E. Significativamente, se utilizó el tratamiento con albúmina sérica bovina (BSA) con agitación durante 20 min a temperatura ambiente para bloquear los sitios no específicos del chip de detección. Tras el secado, se preparó el inmunosensor capacitivo49,50 basado en DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDCs) para detectar secuencialmente el antígeno de la espícula del virus.
Para evaluar la morfología de la superficie del chip DIDC, chip desnudo, o con respecto al óxido de grafeno, la activación de EDC-NHS, hostil al virus S1 Abs y al antígeno de la espícula del virus, se realizó utilizando AFM y SEM. El proceso de funcionalización de la superficie se presenta en la Figura 3A-D. Las superficies sucesivas mostraron diversas morfologías y niveles a microescala. Se observó una morfología estandarizada de óxido de grafeno de 25 nm en el chip DIDC (Figura 3A), mientras que en el chip DIDC funcionalizado con GrO, se observó la inmovilización de los anticuerpos anti-SARS-CoV-2 en el chip EDC-NHS-GrO-Pt/Ti DIDC, y posteriormente se observó una mayor expansión de nivel hasta 400 nm (Figura 3B). El reticulante EDC-NHS se dispersó a un nivel de 40 nm (Figura 3C), lo que confirma que los anticuerpos contra el SARS-CoV-2 se inmovilizaron en el chip DIDC funcionalizado. Además, después de la expansión del antígeno de la espícula del virus, se observó un pico brusco a 600 nm debido a la proteína de la espícula (S1), como se muestra en la Figura 3D, lo que indica una orientación anticuerpo-antígeno "de cola".
Las imágenes SEM típicas de la vista superior se muestran en la Figura 4A-D. La Figura 4A a 500 μm presenta una exitosa oblea de SiO2cubierta con fotorresistencia y un chip DIDC expuesto al terminal de Ti/Pt; Además, el recuadro a 20 μm es la distancia entre dos dedos metálicos. La superficie del chip DIDC fabricada presenta una morfología de superficie homogénea y lisa; la parte del chip que está funcionalizada con óxido de grafeno, la parte que está promulgada por EDC-NHS, la parte que está inmunizada para ser hostil al virus y los chips con proteínas del virus se muestran en los paneles (A), (B), (C) y (D), respectivamente. Las gotas de óxido de grafeno peladas proporcionan al chip un grupo hidroxilo (-OH) y un grupo carboxílico (-COOH), lo que mejora la detección en términos de sensibilidad y selectividad. La figura 4A muestra la diseminación de las escamas homogéneas de GrO a 1 μm. La figura 4B muestra el acoplamiento EDC-NHS, con una construcción vacía, redonda y hueca que es hostil al virus a 3 μm. La figura 4C muestra un anticuerpo con picos implantado en el chip de detección funcionalizado de óxido de grafeno-EDC-NHS a 1 μm. Figura 4D muestra la estructura de grupo similar al antígeno con picos del virus reforzada con el anticuerpo con picos a 10 μm. El desarrollo de los enlaces esperados durante la fabricación escalonada del biosensor GrO-DIDC se demostró mediante espectroscopía FTIR, como se muestra en la Figura 4E (i-iv). Los resultados de FTIR26 fueron los siguientes: (i) un pico de enlace C-H de 2.976 cm-1 causado por los anticuerpos en la superficie del chip; (ii) funcionalización EDC-NHS, con un pico de N-O a 1.567 cm-1 que indica la presencia del grupo nitro; (iii) un pico a 1.038 cm-1 que sugiere la presencia de enlaces C-O (éster fragante) y anillos aromáticos en el fraguado de óxido de grafeno inmovilizado en el chip DIDC; y (iv) el chip DIDC expuesto que muestra alcohol primario (es decir, enlaces C-O) con una intensidad débil a 1.060 cm-1.
El chip biónico DIDC reciclable propuesto fue diseñado y fabricado para dirigirse a la proteína S1 de la espícula del virus mediante la inmovilización de los anticuerpos monoclonales explícitos en una superficie de unión de óxido de grafeno-EDC-NHS. Como el chip incluye una superficie y un diseño de bioingeniería para la formación de Abs anti-SARS-CoV-2, la capacidad de los reticulantes para mejorar la tasa de movimiento de carga, según lo indicado por la capacitancia eléctrica, se puede utilizar para confirmar el efecto del chip (Figura 5A). Sorprendentemente, el inmunosensor mostró un LOD mínimo de 1,0 fg/mL, que es más bajo que los sistemas de biodetección actuales para detectar el virus. Críticamente, el inmunosensor capacitivo eléctrico propuesto también tiene un mejor contraste, y otros biosensores de proclividad electroquímica mostraron un largo camino para la ubicación de la proteína del virus, con respecto a la capacidad de respuesta, el tiempo de reacción, la selectividad y la reutilización.
Para probar la sensibilidad del estadio inmunológico creado por el SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs, tomamos 13 cantidades progresivas de la proteína S1-His del virus (de 1,0 × 10-3 g a 1,0 × 10-15 g), y se utilizó la técnica de proyección de gotas para añadir la proteína a los chips DIDC y cuantificar la capacitancia con respecto a las diversas fijaciones de antígenos; posteriormente, se contrastaron los espectros con espectros de control (Figura 5B). Además, estimamos la selectividad a los antígenos del virus (Figura 5C) para examinar los efectos potenciales de las sustancias interferentes en ejemplos naturales; por ejemplo, el PSA y las proteínasβ amiloide 1-42 pueden ser contaminantes. La concentración de la proteína interferente fue de 1,0 μg/mL tanto para el PSA como para el amiloide β1-42. La prueba de selectividad funcionó en presencia y ausencia de proteínas interferentes. Las pruebas se llevaron a cabo con 10 sensores distintos; En concreto, se probaron del primero al quinto sensor cuando la proteína interferente estaba presente, y el resto de los sensores (del sexto al décimo) se probaron sin la proteína interferente. No se observaron diferencias entre estas condiciones. Del primer al quinto sensor, la capacitancia cambió de 286,9 nf a 275,5 nf, y del sexto al décimo sensor, la capacitancia osciló entre 271,9 y 273,0 nF. Cada una de las muestras se preparó en la disposición de cuna de PBS de 0,1 M (pH 7,4). Las pruebas se realizaron utilizando aproximadamente 1,0 μg/mL de proteína del virus S1 para las condiciones con y sin presencia de las biomoléculas de proteína no objetivo. Después de un solo paso de incubación, este chip capacitivo de inmunodetección dio resultados cuantitativos con respecto a las muestras de solución de 5 μL en un corto período de tiempo; La capacitancia cambió en 3 s con respecto a los antígenos del virus, sin reactividad cruzada significativa con los analitos inespecíficos. La estimación de la sensibilidad de la proteína antígeno del virus mostró una relación en línea recta entre la capacitancia frente a la fijación (es decir, y = mx + c). Aquí, y es un elemento de x, m es la inclinación, el punto de la línea al pivote x, y c es un bloque en el eje y. En la estimación fáctica, cada estimación ha tenido una base varias veces, y se utilizó un valor típico; la capacidad de respuesta se caracterizó como 18,56 nF/g (Figura 5D). Para comprobar la condición de reacción del estadio inmunológico creado por el SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDIC, se eligieron tres concentraciones específicas de antígenos, que incluyen 1,0 × 10-15 g/mL, 1 × 10-9 g/mL y 1 × 10-3 g/mL. La estimación de la capacitancia se cierra en no menos de 3 s al nivel de cada foco por separado, como se muestra en la Figura 5E.
A continuación, se comprobó la durabilidad del biocompuesto (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs); Para ello, las virutas se colocaron en una cámara húmeda a 5 °C durante 10 días. Críticamente, no se observaron cambios significativos en la presentación del chip DIDC fabricado con aumentos incrementales en el tiempo de almacenamiento Figura 6A. Además, se evaluó adicionalmente la reproducibilidad del sensor basado en DIDC, como se muestra en la Figura 6B. Se evaluaron los valores de capacitancia de los SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC durante 10 h. Significativamente, los valores de capacitancia se mantuvieron estables, sin más del ±5% de desviación en los valores entre los puntos de apoyo. Además, siguiendo los resultados de durabilidad anteriores, también evaluamos la reproducibilidad durante 10 días. Cabe destacar que estas estimaciones de capacitancia también variaron en menos del ±5% entre los puntos de soporte. Cabe destacar que, en el segundo día, notamos un poco de contraste (de 8,8 nF a 7,2 nF), probablemente debido a que el chip pasó de temperatura ambiente a una temperatura baja; De hecho, desde el segundo día en adelante, los valores de capacitancia se mantuvieron estables. Críticamente, desde el primer día hasta el décimo día, los valores de capacitancia cambiaron de 8.8 nF a 7.2 nF, sin que se observaran cambios significativos en la reproducibilidad/repetibilidad basada en la desviación estándar (SD), la desviación estándar relativa (RSD) y la media (x̄), como se muestra en la Tabla 1.
Finalmente, se evaluó la reutilización del chip DIDC del virus. Para eluir los anticuerpos de la superficie del sensor, se utilizó un tampón de elución de 0,1 M de glicina-HCl a 2,7 pH; Cabe destacar que se seleccionó un pH entre 7 y 7,4, que no es fisiológicamente posible en el organismo, para evaluar la alteración por inmunoafinidad. Significativamente, el tampón de elución se aplicó una vez sobre la superficie del sensor y, después de la aplicación, el valor de capacitancia alcanzó un nivel similar al encontrado con el GrO funcionalizado (1,2 nF). Poco tiempo después, se añadió solución de piraña al sensor DIDC a 80 °C y, posteriormente, se demostró que la capacitancia estaba a un nivel casi equivalente al del chip DIDC expuesto (0,26 nF); de hecho, el chip DIDC recuperó el 96% de sus cualidades descubiertas. En particular, se compararon los resultados después de la primera y segunda recuperación, y no se identificaron cambios significativos, como se muestra en la Figura 7A, B y Figura 8A-C.

Figura 1: Representación esquemática del chip de detección capacitivo doble interdigitado (DIDC) modificado con óxido de grafeno ultrasensible y reutilizable. (A) La estructura de la proteína S1 del virus. (B) Un esquema del chip de detección capacitivo (DIDC) de doble dígito fabricado. (C) El condensador interdigitado doble (DIDC) con el circuito (equivalente). CL = el condensador para los terminales principales conectados en serie; CS = el condensador para los electrodos focales menores conectados en serie; el ancho del chip es de 4,1 mm y la longitud es de 5 mm. (D) El chip de detección capacitivo (DIDC) doble digitalizado glaseado con GrO con Abs anti-SARS-CoV-2 inmovilizado específico para el antígeno del virus S1 (enfocado en el analito). (E) Presentación morfológica del antivirus Abs incrustado en el óxido de grafeno a escala de 1 μm; la imagen del recuadro muestra el AFM de las escamas de óxido de grafeno, que se dispersan homogéneamente a un nivel de 25 nm. (F) Una imagen SEM del chip expuesto. (G) Se define la distancia entre dos dedos (metal). Barra de escala = 20 μm. Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Proceso escalonado de fabricación de DIDC y evaluación de los cambios y funcionalidades de la superficie mediante AFM y microscopía electrónica de barrido (SEM). (A) El chip de detección DIDC fabricado con la oblea de SiO2cubierta con fotorresistencia y el electrodo de Ti/Pt expuesto. (B) La fabricación del GrO en el chip mediante recubrimiento por rotación a 1.300 rpm. (C) La interacción química EDC-NHS para el chip de detección capacitivo interdigitado (DIDC) con doble recubrimiento de GrO. (D) La unión de anticuerpos responde a la proteína S1 del virus con una alineación Ab "a la cola" debido al EDC-NHS (EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs). (E) La unión de la proteína S1 del virus en los SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs.Esta cifra ha sido modificada de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Caracterización de AFM. Clarificación de la superficie del chip DIDC por separado y con respecto a (A) óxido de grafeno, (B) el anticuerpo contra la proteína con picos del virus, (C) EDC-NHS y (D) el antígeno con picos del virus, tal como se logra mediante microscopía de fuerza atómica (AFM). Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.
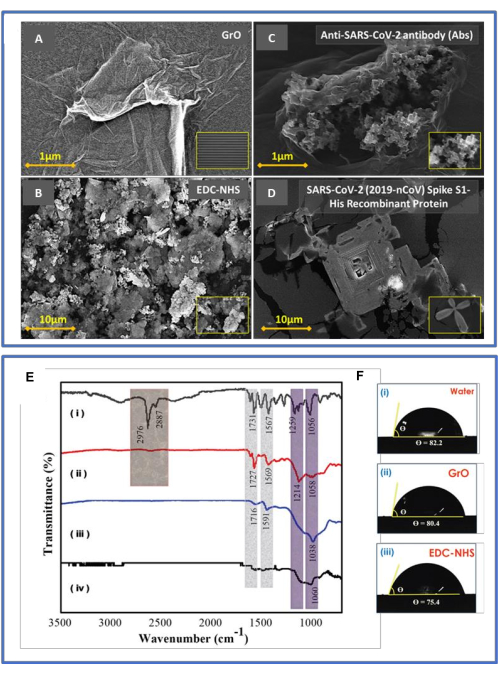
Figura 4: Caracterización SEM y FTIR. (A-D) Esto muestra las típicas imágenes SEM de vista superior. Los ejemplos cubiertos por DIDC presentan una etiología superficial complementaria y estandarizada adicional; (A) la parte del chip funcionalizada con óxido de grafeno, (B) la parte que está promulgada por EDC-NHS, (C) la parte funcionalizada para ser hostil al virus y (D) se muestran los chips con proteínas del virus. (B) Estimaciones FTIR y puntos de contacto. (E) Espectroscopía FTIR: (i) hostil a los anticuerpos del virus, (ii) acoplamiento EDC-NHS, (iii) el chip DIDC recubierto con óxido de grafeno, y (iv) el chip DIDC desnudo. (F) Medición del ángulo de contacto con el agua: (i) el chip DIDC desnudo (82,0 ° ± 3,0 °), (ii) GrO (80,4 ° ± 3,0 °) y (iii) EDC-NHS (75,4 ° ± 3,0 °). Además, se estimó la humectabilidad de los distintos chips en términos del ángulo de contacto de una gota de agua de 5 μL. El líquido (agua) mostró un punto de contacto más alto (alrededor de 82.0° ± 3.0°) con respecto a las virutas peladas en la Figura F (i). Cabe destacar que este punto disminuyó con el GrO (80,4° ± 3,0°), como en la figura F(ii), y el EDC-NHS (75,4° ± 3,0°), como en la figura F(iii). Estos puntos de contacto superficial demuestran que el óxido de grafeno y los chips tratados con EDC-NHS eran más hidrófilos que los electrodos capacitivos dobles interdigitados expuestos. Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.
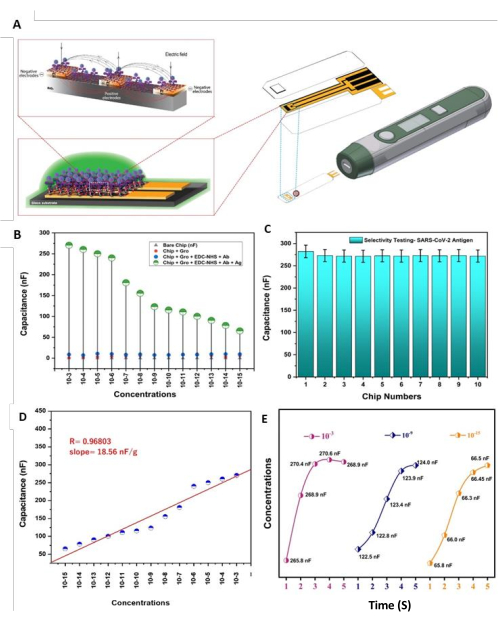
Figura 5: Sensibilidad y caracterización funcional. (A) Los cátodos DIDC basados en Ti/Pt unidos por los anticuerpos y el antígeno de las biomoléculas del virus interrumpen el campo eléctrico a través/entre el metal (dedos), y el impacto en la capacitancia del chip DIDC fabricado se evalúa utilizando el dispositivo de estimación de capacitancia. (B)La sensibilidad del chip de detección de la etapa inmunológica del SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDC cubrió un amplio rango (es decir, de 1,0 mg/mL a 1,0 fg/mL); capacitancia en la parte superior del chip descubierto, el Chip-GrO, el Chip-Gro-EDC-NHS-SARS-CoV-2-Ab y el EDC_NHS+ SARS-CoV-2-Ab+ SARS-CoV-2-Ag. (C) La selectividad del biosensor de estadio inmunológico SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC con y sin presencia de una proteína interferente. (D) La linealidad fue de 18,56 nF/g para una amplia variedad de concentraciones, y hubo una fuerte línea de recaída directa; el coeficiente de inclinación y recaída (R) se determinó mediante el ajuste de la información. (E) El tiempo de respuesta (3 s) de las concentraciones de 1,0 × 10-15 g/mL, 1 × 10-9 g/mL y 1 × 10-3 g/mL frente a los valores de capacitancia después de aplicar las muestras de proteína. Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.
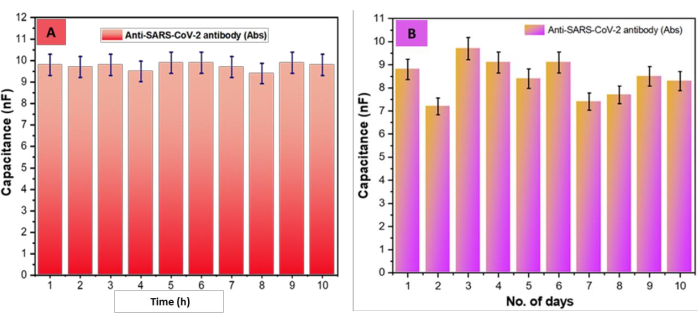
Figura 6: Evaluación de la estabilidad y reproducibilidad del biosensor. (A) El diagrama de capacitancia frente al tiempo del SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDCs de 1 a 10 h, con una desviación del ±5% entre los valores del punto de apoyo. (B) Los resultados de estabilidad, que evaluaron la reproducibilidad de los SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDC a lo largo del tiempo, mostraron una desviación del ±5% durante 10 días entre los valores de los puntos de soporte. Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Reutilización del chip DIDC basada en imágenes de microscopía de fuerza atómica y microscopía electrónica de barrido. (A) Una imagen 3D AFM del chip DIDC después de una prueba; El engrosamiento del chip es claramente evidente hasta 250 Nm. (B) Una imagen SEM de alta resolución (HR) después de un ensayo de detección del antígeno de la espícula del virus a escala de 1 mm; en el centro, se presentan las imágenes de los cátodos Pt/Ti a 50 μm, la imagen HR del dedo del electrodo metálico a 10 μm y la distancia entre los dos dedos (es decir, 20 μm). Tanto en las imágenes AFM como en las SEM, no se observaron imperfecciones ni roturas, y se utilizó el mismo chip para una prueba de análisis más. Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Capacitancia v/s detección del antígeno de la espícula (S1) del SARS-CoV-2 a diferentes concentraciones y la regeneración y reutilización del chip DIDC: (A) Gráficos de Nyquist del electrodo biónico DIDC recubierto de óxido de grafeno medido por un analizador de impedancia; método de capacitancia sin y con los antígenos de la espícula S1 a concentraciones de 1,0 mg/mL a 1,0 fg/mL en solución de PBS. (ii,iii) Parcelas de Nyquist correspondientes a las de A. (B) Después de una recuperación exitosa del sensor a un pH bajo (2,7) utilizando un tampón de elución (0,1 M) de glicina-HCl y limpieza de pirañas. La recuperación se logró en 20 minutos o menos. Para todos los enfoques, el signo en (B,C) fue el 96% del de (A). (C) después de dos regeneraciones secuenciales del sensor. Para cada una de las estimaciones, la carga se mueve para los ánodos biónicos DIDC recubiertos de óxido de grafeno; se utilizó como control la disposición de tampón PBS de 0,1 M (pH 7,4). Se adquirieron tres lecturas sucesivas para diferentes concentraciones del antígeno de la espícula del virus (S1). Se aplicó una frecuencia de 1 kHz para recoger estos datos. Esta figura ha sido modificada a partir de Sharma et al.26. Haga clic aquí para ver una versión más grande de esta figura.
| Tiempo (en horas) | Chip + Gro + EDC- NHS + Ab | Error | No. de Días | Chip + Gro + EDC- NHS + Ab | Error |
| 1 | 9.8 | 0.49 | 1 | 8.8 | 0.44 |
| 2 | 9.7 | 0.485 | 2 | 7.2 | 0.36 |
| 3 | 9.8 | 0.49 | 3 | 9.7 | 0.485 |
| 4 | 9.5 | 0.475 | 4 | 9.1 | 0.455 |
| 5 | 9.9 | 0.495 | 5 | 8.4 | 0.42 |
| 6 | 9.9 | 0.495 | 6 | 9.1 | 0.455 |
| 7 | 9.7 | 0.485 | 7 | 7.4 | 0.37 |
| 8 | 9.4 | 0.47 | 8 | 7.7 | 0.385 |
| 9 | 9.9 | 0.495 | 9 | 8.5 | 0.425 |
| 10 | 9.8 | 0.49 | 10 | 8.3 | 0.415 |
| Media (x̄) | 9.74 | 8.42 | |||
| SD (±) | 0.171269768 | 0.801110479 | |||
| RSD (%) | 1.758416506 | 9.514376238 |
Tabla 1: Evaluación de la reproducibilidad/repetibilidad con los valores de media (x̄), desviación estándar (DE) y desviación estándar relativa (RSD).
Discusión
Para crear un biosensor productivo basado en un chip DIDC, la distribución de carga, la conductividad y la constante dieléctrica del DIDC son extremadamente importantes. Significativamente, las mejoras en estos límites de detección se relacionan con la reactancia capacitiva del DIDC 18,26,27. En este estudio, se fabricó un inmunosensor de capacitancia que es hostil al virus Abs y se funcionalizó mediante el acoplamiento EDC-NHS en el sustrato27 de SiO2basado en óxido de grafeno-DIDC. Además, se añadió la reticulación EDC-NHS mediante el empleo de una unión covalente sobre el sustrato GrO para funcionalizarse contra el virus Abs.
Con el procedimiento minuciosamente planificado que garantizó la preparación de la superficie del sensor, la inmovilización de Abs anti-SARS-CoV-2 y la unión con la proteína S1 del virus, se encontró un equilibrio entre los elementos contendientes de la simplicidad de la inmovilización, la explicitud y la capacitancia general. El avance del biochip DIDC regulado por GrO se verificó mediante un examen eléctrico y óptico de la superficie. La gran superficie de los materiales a base de grafeno provoca la adsorción de varios analitos. Además, este biochip GrO-DIDC supersensible y ultrarrápido representa un sistema sencillo y adecuado para las pruebas POC. De esta manera, el biosensor detallado es una tecnología de vanguardia. En primer lugar, el sensor podría crear un cambio de capacitancia superior a 70 nF porque el chip DIDC expuesto con recubrimiento de GrO tiene una convergencia baja de 1,0 fg/mL. El alcance del cambio de capacitancia aumenta en incrementos con la concentración de proteína del antígeno del virus objetivo dentro del rango de 1,0 mg/mL a 1,0 fg/mL. Los límites de identificación de este biosensor se encuentran entre los más bajos hasta la fecha para un biosensor no faradaico (capacitivo). En segundo lugar, la explicitud del sensor se demostró por la variación en el método del diferencial de capacitancia entre los biomarcadores objetivo y no objetivo (proteína). En el caso de las proteínas no objetivo, el cambio en la capacitancia no fue fundamentalmente el mismo que para la proteína diana del antígeno objetivo del virus S1, y no hubo un cambio considerable en la capacitancia con los incrementos de fijación de proteínas no objetivo. En tercer lugar, el sensor logró un amplio rango de detección de 1,0 mg/mL a 1,0 fg/mL con una gran linealidad de capacitancia (es decir, 18,56 nF/g). Por un lado, la identificación rápida del antígeno del virus S1 permite detectar rápidamente los contactos personales clave, amplía las opciones de tratamiento y apoya el tratamiento designado; Además, esta identificación ayuda a frenar la propagación de la enfermedad, lo cual es necesario para combatir la pandemia de manera oportuna. La parte más crucial de esta tecnología complicada y limitada es la optimización del proceso de fabricación y la funcionalidad del chip. Cada paso del proceso de fabricación debe ser gestionado. Los resultados de la fabricación pueden diferir y ser limitados dependiendo de cómo se maneje.
Conclusión y punto de vista
Este artículo presenta un chip de detección capacitivo interdigitado (DIDC) doblemente alterado con óxido de grafeno ultrarrápido y reciclable diseñado y fabricado para identificar las proteínas del virus S1 específicamente a nivel de fg. Las exploraciones de este trabajo revelaron que el uso de un chip capacitivo DIDC funcionalizado con GrO desarrolla aún más los límites de detección, mejorando así la capacidad de respuesta y la selectividad del dispositivo de biodetección. La forma restringida de la línea y los cambios en las propiedades eléctricas (acoplamiento de impedancia) causaron cambios en la capacitancia para una matriz de rangos de identificación (1,0 × 10−3 gm a 1,0 × 10−15 gm). El funcionamiento del sensor capacitivo DIDC se probó exhaustivamente en arreglos profundamente debilitados que contenían biomoléculas BSA y proteínas de pico. Estos estudios demostraron que el sensor capacitivo DIDC propuesto podría usarse para detectar proteínas del virus S1 a niveles bajos en poco tiempo (~5-6 s). Por lo tanto, el procedimiento indoloro, sin contacto y rápido propuesto en este trabajo puede detectar la proteína S1 del virus en las fases iniciales de la enfermedad con alta sensibilidad.
Más adelante, el plan es identificar las proteínas de la espícula del virus en POC para potenciar el tratamiento impulsado por el paciente y actualizar todas las partes del dispositivo (es decir, el chip de detección, desarrollando la coordinación completa del sensor capacitivo DIDC basado en modelos con ejemplos de pacientes reales [simultáneamente]). Eventualmente, el COVID-19 podría detectarse utilizando tecnología basada en teléfonos celulares. Sin embargo, el biosensor discutido e introducido aún no se ha probado utilizando muestras genuinas debido a la ausencia de disponibilidad de muestras biológicas y aprobación ética. Se están haciendo serios esfuerzos para establecer la cooperación entre los laboratorios de virología e infección de Corea del Sur y las clínicas de emergencia en el extranjero para obtener biolíquidos de pacientes infectados con COVID-19. Las consecuencias de futuras investigaciones sobre el diagnóstico de POC de COVID-19 utilizando nuestro sensor capacitivo de alta calidad se publicarán en otro lugar.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue respaldado hasta cierto punto por el Programa de Investigación en Ciencias Básicas a través de la Fundación Nacional de Investigación de Corea (NRF) patrocinado por el Ministerio de Educación en virtud de la Subvención 2018R1D1A1A09083353 y la Subvención 2018R1A6A1A03025242, en parte por la GCS Group Association Ltd., y por la Escuela de Posgrado del Ministerio de Medio Ambiente de Corea (MOE) que invirtió una gran energía en el Proyecto Integrado de Prevención y Control de la Contaminación y una Beca de Investigación de la Universidad de Kwangwoon en 2022.
E.M. desea agradecer el apoyo del Instituto Nacional de Imágenes Biomédicas y Bioingeniería (5T32EB009035).
Materiales
| Name | Company | Catalog Number | Comments |
| Amyloid β1-42 Protein | Merck (Sigma-Aldrich) | 107761-42-2 | |
| anti-SARS-CoV-2 Spike (S1) monoclonal IgG antibody | SinoBiological | 40150-R007 | |
| EDC [N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride] | Thermo Fisher Scientific | A35391 | |
| Ethyl alcohol (C2H5OH) | Sigma-Aldrich | ||
| Hydrogen peroxide (H2O2) | |||
| Kapton tape | polyimide tape | ||
| NHS (NHydroxysuccinimide, 98+%; C4H5NO3) | Thermo Fisher Scientific | A39269 | |
| PBS | |||
| Prostate-specific antigen | Sigma-Aldrich | P3338-25UG | |
| SARS-CoV-2 Spike S1-His recombinant protein | SinoBiological | 40591-V08H | |
| Single layer Graphene Oxide | Graphene Supermarket | ||
| Spin Coater | High Precision Spin Coater (Spin Coating System) | ACE-200 | |
| Sulfuric acid (H2SO4) |
Referencias
- Boldog, P. Risk assessment of novel coronavirus COVID-19 outbreaks outside China. Journal of Clinical Medicine. 9 (2), 571-583 (2020).
- Seo, G., et al. Rapid detection of COVID-19 causative virus (SARS-CoV-2) in human nasopharyngeal swab specimens using field-effect transistor-based biosensor. ACS Nano. 14 (4), 5135-5142 (2020).
- Panda, P. K. Structure-based drug designing and immunoinformatics approach for SARS-CoV-2. Science Advances. 6, 5135-5142 (2020).
- Li, R., et al. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV-2). Science Advances. 368, 489-493 (2020).
- Lu, R., et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 395 (10224), 565-574 (2020).
- Hui, D. S. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. Journal of Infectious Diseases. 91, 264-266 (2020).
- Chen, I. Y., et al. Upregulation of the chemokine (C-C motif) ligand 2 via a severe acute respiratory syndrome coronavirus spike-ACE2 signaling pathway. Journal of Virology. 84 (15), 7703-7712 (2010).
- Fung, T. S., Huang, M., Liu, D. X. Coronavirus-induced ER stress response and its involvement in regulation of coronavirus-host interactions. Virus Research. 194, 110-123 (2014).
- Park, S. E. Epidemiology, virology, and clinical features of severe acute respiratory syndrome -coronavirus-2 (SARS-CoV-2: Coronavirus Disease-19). Korean Journal of Pediatrics. 63 (4), 119-124 (2020).
- Fajnzylber, J., et al. SARS-CoV-2 viral load is associated with increased disease severity and mortality. Nature Communications. 11 (1), 5493(2020).
- Rao, K., et al. Review on newly identified coronavirus and its genomic organization. SSR Institute of International Journal of Life Sciences. 6 (2), 2509(2020).
- Mujawar, M. A., et al. Nano-enabled biosensing systems for intelligent healthcare: Towards COVID-19 management. Materials Today Chemistry. 17, 100306(2020).
- Manickam, P., et al. Artificial intelligence (AI) and internet of medical things (IoMT) assisted biomedical systems for intelligent healthcare. Biosensors. 12 (8), 562-591 (2022).
- Kaushik, A. K., et al. Electrochemical SARS-CoV-2 sensing at point-of-care and artificial intelligence for intelligent COVID-19 management. ACS Applied Bio Materials. 3 (11), 7306-7325 (2020).
- Lee, D., Lee, J. Testing on the move: South Korea's rapid response to the COVID-19 pandemic. Transportation Research Interdisciplinary Perspectives. 5, 100111(2020).
- Emery, S. L., et al. Real-time reverse transcription-polymerase chain reaction assay for SARS-associated coronavirus. Emerging Infectious Diseases. 10 (2), 311-316 (2004).
- Lu, X., et al. Real-time reverse transcription-PCR assay panel for Middle East respiratory syndrome coronavirus. Journal of Clinical Microbiology. 52 (1), 67-75 (2014).
- Mishra, S., et al. Tailored biofunctionalized biosensor for the label-free sensing of prostate-specific antigen. ACS Applied Bio Materials. 3 (11), 7821-7830 (2020).
- Wang, Y. L., et al. Detection of severe acute respiratory syndrome (SARS) coronavirus nucleocapsid protein using AlGaN/GaN high electron mobility transistors. ECS Transactions. 50 (6), 239-243 (2013).
- Ravi, N., Cortade, D. L., Ng, E., Wang, S. X. Diagnostics for SARS-CoV-2 detection: A comprehensive review of the FDA-EUA COVID-19 testing landscape. Biosensors and Bioelectronics. 165, 112454(2020).
- Sethuraman, N., Jeremiah, S. S., Ryo, A. Interpreting diagnostic tests for SARS-CoV-2. JAMA. 323, 2249-2251 (2020).
- Timmer, W. C., Villalobos, J. M. Chemistry Education. 70 (4), 273-280 (1993).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (5), 368-373 (2006).
- Drummond, T. G., Hill, M. G., Barton, J. K. Electrochemical DNA sensors. Nature Biotechnology. 21, 1192-1199 (2003).
- Singhal, C., Khanuja, M., Chaudhary, N., Pundir, C. S., Narang, J. Detection of chikungunya virus DNA using two-dimensional MoS2 nanosheets based disposable biosensor. Scientific Reports. 8, 7734(2018).
- Sharma, P. K., et al. Ultrasensitive and reusable graphene oxide-modified double-interdigitated capacitive (DIDC) sensing chip for detecting SARS-CoV-2. ACS Sensors. 6 (9), 3468-3476 (2021).
- Sharma, P. K., et al. Ultrasensitive probeless capacitive biosensor for amyloid beta (Ab) detection in human plasma using interdigitated electrodes. Biosensors and Bioelectronics. 212, 114365(2022).
- Wang, L., et al. A sensitive DNA capacitive biosensor using interdigitated electrodes. Biosensors and Bioelectronics. 87, 646-653 (2017).
- Brasil, P., et al. Zika virus infection in pregnant women in Rio de Janeiro. The New England Journal of Medicine. 375 (24), 2321-2334 (2016).
- Kong, J., et al. Molecular wires as chemical sensors. Science. 287 (5453), 622-625 (2000).
- Wang, J. Carbon-nanotube based electrochemical biosensors: A review. Electroanalysis. 17 (1), 7-14 (2005).
- Layqah, L. A., Eissa, S. An electrochemical immunosensor for the coronavirus associated with the Middle East respiratory syndrome using an array of gold nanoparticle-modified carbon electrodes. Microchimica Acta. 186 (4), 224-234 (2019).
- Vermisoglou, E., et al. Human virus detection with graphene-based materials. Biosensors and Bioelectronics. 166, 112436(2020).
- Mostafavi, E., Dubey, A. K., Teodori, L., Ramakrishna, S., Kaushik, A. SARS-CoV-2 Oomicron variant: A next phase of the COVID-19 pandemic and a call to arms for system sciences and precision medicine. MedComm. 3 (1), 119(2022).
- Ali, M. A., et al. Sensing of COVID-19 antibodies in seconds via aerosol jet printed three dimensional electrodes. Advanced Materials. 33 (7), 2006647(2020).
- Ganbold, E., Sharma, P. K., Kim, E. -S., Lee, D. -N., Kim, N. -Y. Capacitive humidity sensor with a rapid response time on a GO-doped P(VDF-TrFE)/LiCl composite for noncontact sensing applications. Chemosensors. 11 (2), 122(2023).
- Shivani, T., et al. Antibacterial and antiviral high-performance nanosystems to mitigate new SARS-CoV-2 variants of concern. Current Opinion in Biomedical Engineering. 21, 100363(2022).
- Kujawska, M., Mostafavi, E., Kaushik, A. SARS-CoV-2 getting into the brain; Neurological phenotype of COVID-19, and management by nano-biotechnology. Neural Regeneration Research. 18 (3), 519-520 (2022).
- Kang, P., Wang, M. C., Nam, S. Bioelectronics with two-dimensional materials. Microelectronic Engineering. 161, 18-35 (2016).
- Syama, S., Mohanan, P. V. Comprehensive application of graphene: Emphasis on biomedical concerns. Nano-Micro Letters. 11, 6(2019).
- Chaudhary, V., Kaushik, A., Furukawa, H., Khosla, A. Review-Towards 5th generation AI and IoT driven sustainable intelligent sensors based on 2D MXenes and borophene. ECS Sensors Plus. 1, 013601(2022).
- Sharma, P. K., et al. Perspectives on 2D-borophene flatland for smart bio-sensing. Materials Letters. 308, https://www-sciencedirect-com.remotexs.ntu.edu.sg/science/article/pii/B978012818154600010X 131089(2022).
- Sharma, P. K., et al. Nanotechnology and its application: A review. Nanotechnology in Cancer Management. Precise Diagnostics Toward Personalized Health Care. Khondakar, K. R., Kaushik, A. K. 1 (1), Elsevier Science. 1-33 (2021).
- Rawat, P., et al. Emergence of high-performing and ultra-fast 2D-graphene nano-biosensing system. Materials Letters. 308, 131241(2022).
- Ganbold, E., et al. Highly sensitive interdigitated capacitive humidity sensors based on sponge-like nanoporous PVDF/LiCl composite for real-time monitoring. ACS Applied Materials & Interfaces. 15 (3), 4559-4568 (2023).
- Feng, J., Guo, Z. Wettability of graphene: From influencing factors and reversible conversions to potential applications. Nanoscale Horizons. 4, 339-364 (2019).
- Flynn, S. P., et al. qua-Art: A demonstration of hydrophilic and hydrophobic surfaces fabricated by plasma enhanced chemical vapor deposition. Chemical Education. 94 (2), 221-225 (2017).
- Bhardwaj, S. K., Yadav, P., Ghosh, S., Basu, T., Mahapatro, A. K. Biosensing test-bed using electrochemically deposited reduced graphene oxide. ACS Applied Materials & Interfaces. 8 (37), 24350-24360 (2016).
- Reddicherla, U., Seyed, M. G., Sonwal, S., Gokana, M. R., Yun, S. H. Portable electrochemical sensing methodologies for on-site detection of pesticide residues in fruits and vegetables. Coordination Chemistry Reviews. 453, 214305(2022).
- Reddicherla, U., et al. Colorimetric based on-site sensing strategies for the rapid detection of pesticides in agricultural foods: New horizons, perspectives, and challenges. Coordination Chemistry Reviews. 446, 214061(2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados