Method Article
شريحة استشعار معدلة بالجرافين عالية الأداء للكشف عن SARS-CoV-2
In This Article
Summary
يصف البروتوكول الحالي تصنيع نماذج أولية منخفضة التكلفة للاستشعار الحيوي تعتمد على أنظمة نانوية مفيدة للكشف الدقيق عن البروتينات الفيروسية (على مستوى Fg). تسمح منصة الاستشعار الصغيرة هذه بتطبيقات نقاط الرعاية التي يمكن دمجها مع إنترنت الأشياء الطبية (IoMT) لتحقيق أهداف التطبيب عن بعد.
Abstract
يتضمن نموذج الاستشعار هذا تطوير شريحة كشف سعوية مزدوجة بين الأرقام (DIDC) قابلة لإعادة الاستخدام ومزجج بأكسيد الجرافين (GrO) للكشف عن فيروس كورونا 2 (SARS-CoV-2) على وجه التحديد وبسرعة. يتكون DIDC المصنع من ركيزة زجاجية تحتوي على Ti / Pt مزججة بأكسيد الجرافين (GrO) ، والتي يتم تعديلها كيميائيا باستخدام EDC-NHS لشل حركة الأجسام المضادة (Abs) المعادية ل SARS-CoV-2 بناء على بروتين سبايك (S1) للفيروس. أظهرت نتائج التحقيقات الثاقبة أن GrO أعطى سطحا هندسيا مثاليا لتثبيت Ab وعزز السعة للسماح بحساسية أعلى وحدود استشعار منخفضة. ساعدت هذه العناصر القابلة للضبط على تحقيق نطاق استشعار واسع (1.0 ملغم/مل إلى 1.0 fg/mL)، وحد أدنى للاستشعار يبلغ 1 fg/mL، واستجابة عالية وخطية جيدة تبلغ 18.56 nF/g، ووقت تفاعل سريع يبلغ 3 ثوان. إلى جانب ذلك ، من حيث تطوير أطر اختبار نقاط الرعاية (POC) القابلة للتطبيق المالي ، فإن قابلية إعادة استخدام الرقاقة الحيوية GrO-DIDC في هذه الدراسة جيدة. بشكل ملحوظ ، فإن الرقاقة الحيوية خاصة بالمستضدات المنقولة بالدم ومستقرة لمدة تصل إلى 10 أيام عند 5 درجات مئوية. نظرا لصغر حجمه ، فإن هذا المستشعر الحيوي المصغر لديه القدرة على تشخيص POC لعدوى COVID-19. يمكن لهذا النظام أيضا اكتشاف الأمراض الفيروسية الشديدة الأخرى ، على الرغم من أن خطوة الموافقة باستخدام أمثلة الفيروسات الأخرى قيد التطوير.
Introduction
ظهر جائحة فيروسي ناجم عن فيروس كورونا بيتاالجديد 1 (أي 2019-nCoV) ، والذي أطلق عليه لاحقا اسم فيروس كورونا 2 (SARS-CoV-2) 2 (يشار إليه فيما يلي باسم الفيروس) ، والذي ينطوي على عنقود رئوي وضيق تنفسي حاد شديد ، في مدينة ووهان ، الصين ، في نهاية عام 20193. نظرا لانتقاله السريع من إنسان إلى إنسان في جميع أنحاء العالم ، وارتفاع معدل الإصابة ، وارتفاع معدل الوفيات ، والآثار الضارة الخطيرة التي تهدد الحياة4 ، خلال الوباء ، تطورت أبحاث علمالفيروسات 5 بسرعة لتحديد التنظيم الجيني للفيروس وهيكله5،6. تشمل أعراض COVID-19 7,8 ارتفاع في درجة الحرارة والسعال الجاف والألم العام9. الأهم من ذلك ، أن الأنماط المصلية المختلفة للفيروس تؤدي إلى اختلاف شدة المرض10. علاوة على ذلك ، يمكن للناقلات التي لا تظهر عليها أعراض أن تنشر الفيروس. عادة ، تحت المجهر ، تظهر جزيئات فيروس COVID-19 إسقاطات تشبه النادي تتكون من بروتينات سبايك11. لذلك ، للسيطرة على انتشار هذا العامل الممرض الجديد ، يجب أن يكون الكشف عن الحالات في الوقت المناسب وفعالا. وبالتالي ، أصبح الكشف شديد الحساسية والسرعة والانتقائي للفيروس في المراحل المبكرة من العدوى الفيروسية أمرا بالغ الأهمية2،11. هناك حاجة إلى التباعد الاجتماعي / الجسدي لتجنب انتقالالفيروس 12. وتؤكد الوكالات الصحية على تطوير أدوات التشخيص الذكية وأنظمة النانو13. في الواقع ، كما اقترحت الوكالات الصحية ، هناك حاجة إلى اختبار مستهدفوجماعي 14،15 ولا يزال مطلوبا.
من حيث المبدأ ، تعد طرق التشخيص البيولوجي المستمرة مثل تفاعل البوليميراز المتسلسل للنسخ العكسي (RT-PCR) أفضل وسيلة للتعرف الجماعي على SARS-CoV-2 ، كما هو الحال مع فيروس كورونا المرتبط بمتلازمة الشرق الأوسط التنفسية (MERS-CoV) 16 و SARS-CoV-117. في هذا السياق ، يعتمد التحديد المعياري الحالي للتلوث ب SARS-CoV-2 على تعزيز الخصائص الخاصة بالعدوى18،19. بالإضافة إلى ذلك ، يجب مراعاة التباين في عدوى SARS-CoV-2 وفقا للمنطقة والعمر والعرق والجنس. مع الهدف النهائي المتمثل في إنقاذ الأرواح ، من الأهمية بمكان بناء أدوات تشخيص سريعة لاستخدام نقاط الرعاية (POC) 20،21.
في هذا السياق ، فإن الاستراتيجيات المنتظمة مثل التهجين الموضعي الفلوري (FISH) ، وفحص الممتز المناعي للبروتين (ELISA) ، والطرق القائمة على الكرة المجهرية ، والاختبارات الكهروكيميائية ، والتصوير بالرنين المغناطيسي ، و PET ، و NIRFOI22 لها حساسية منخفضة لمستويات الفيروس المنخفضة ، وانتقائية منخفضة ، وقدرة منخفضة على إعادة الاستخدام. بالإضافة إلى ذلك ، فإن هذه الإجراءات لها عيوب ، بما في ذلك أنظمة تشخيص الاستشعار الحيوي المكلفة ، والكواشف غير القابلة لإعادة الاستخدام ، ومتطلبات القوى العاملة ذات المهارات العالية23. لذلك ، لا يمكن اعتبار هذه التقنيات الثاقبة على أنها طرق POC سريعة أو معقولة أو محددة بشكل استثنائي أو حساسة24،25. وتجدر الإشارة إلى أن هناك أنواعا مختلفة من أجهزة الاستشعار الحيوية القائمة على الحمض النووي والتحصين والتي تستخدم التقنيات المركبة والسعوية والكهربائية18،26،27،28. على سبيل المثال ، يمكن تقليص أجهزة الاستشعار الحيوية للحمض النووي الكهربائي ، التي تتمتع باستجابة عالية ، ببساطة ، وهي قابلة للضبط29،30 ، وقد تم إنتاجها للكشف عن الإيبولا31 ، وزيكا ، وفيروس كورونا المسبب لمتلازمة الشرق الأوسط التنفسية ، وفيروس كوروناالسارس 32،33،34. وبالمثل ، تم إنشاء مستشعر حيوي لأشباه الموصلات ذات التأثير الميداني (FET) للكشف عن بروتين سبايك للفيروس باستخدام بعض الأجسام المضادة (أحادية النسيرة) المثبتة على الأجهزة المزججة بالجرافينبشكل فعال 35،36. ومع ذلك ، فإن هذه الاستراتيجية الجديدة أقل حساسية من RT-PCR. وعلاوة على ذلك، تم في الآونة الأخيرة، وضع إطار للكشف ثلاثي الأبعاد عن الفيروس مغطى بأكسيد الجرافين النفاث النفاث على الهباء الجوي، والذي له حد منخفض لتحديد الهوية (2.8 × 10-15 م). على أي حال ، تم اختبار هيكل المستشعر الحيوي المعقدالمقترح 35 فيما يتعلق باستخدام POC ومقارنته باستراتيجيات الاستشعار الحيوي الأخرى الموجودة المستخدمة للكشف عن الفيروس35،37،38.
في هذه الدراسة ، قمنا بتصميم وتصنيع مستشعر حيوي DIDC مصغر وقابل لإعادة الاستخدام قائم على GrO لتحديد بروتين سبايك الفيروس دون القيود الموضحة أعلاه لأجهزة الاستشعار الحيوية الأخرى. يسمح هذا المستشعر الحيوي بالكشف على مستوى الفيمتوجرام (fg) في غضون 3 ثوان18,27 من وقت الاستجابة. لإنجاز هذا البحث ، تم اختيار رقائق GrO النانوية لتحسين الاستجابة والانتقائية ، مما يعني أنه يمكن اكتشاف تركيزات منخفضة من بروتين مستضد الفيروس من مسحات الفم والبلعوم أو البلعوم الأنفي. GrO هي مادة مناسبة ويمكن الاعتماد عليها صناعيا ومتسقة وموصلة يمكن استخدامها بشكل مفيد لتطبيقات الاستشعار الحيوي2،39،40،41. بالإضافة إلى ذلك ، تم استخدام نهج تهجين أحادي النسيلة الخالي من الملصقات المضادة IgG ، مع التركيز على بروتين S1 للفيروس. يمكن إعادة استخدام المستشعر الحيوي SARS-CoV-2-GrO-DIDC المصنع بعد المعالجة المتقدمة والتنظيف بمحلول سمكة الضاري المفترسة. يمكن استخدام هذا المستشعر الحيوي فائق السرعة والحساس والانتقائي وخالي من الملصقات وقابل لإعادة الاستخدام للاستشعار الحيوي للعينات السريرية وتطبيقات الرعاية الصحية الشخصية26،42،43،44.
Protocol
1. تنظيف شريحة الاستشعار DIDC
- في بداية التجربة ، قم بتنظيف سطح رقاقة DIDC26 بمحلول سمكة الضاري المفترسة (H2SO4: H2O2بنسبة 3: 1) ، وضعه على اللوح الساخن عند 80 درجة مئوية لمدة 15 دقيقة. بعد ذلك ، اشطف سطح المستشعر بالماء المقطر قطرة قطرة باستخدام ماصة لإزالة كواشف التنظيف تماما. لضمان الإزالة الكاملة للكاشف ، اشطف السطح بأربع إلى خمس قطرات من الكحول الإيثيلي.
ملاحظة: تم تصنيع شريحة DIDC بعد تقرير منشور سابقا26. - بعد ذلك ، جفف سطح المستشعر في درجة حرارة الغرفة للإزالة الكاملة للكواشف للحصول على سطح مستشعر محب للماء. يمكن استخدام هذه الشريحة لمزيد من التصنيع لطبقة أكسيد الجرافين على الرقاقة (الخطوة 2).
- قم بتغطية وسادات القطب الكهربائي لشريحة المستشعر النظيفة بشريط بوليميد.
2. تصنيع الطبقة الرقيقة من أكسيد الجرافين على رقاقة الاستشعار DIDC
- ضع الرقاقة في وسط آلة طلاء الدوران في الوضع الأفقي ، وأضف 4 ميكرولتر من محلول مائي من أكسيد الجرافين أحادي الطبقة المتاح تجاريا (GO) (انظر جدول المواد) على سطح الرقاقة. ثم أغلق غرفة الطلاء الدوار ، وقم بتشغيله لمدة دقيقتين عند 1,300 دورة في الدقيقة.
- لتلدين شريحة GO المصنعة ، احتفظ بالشريحة على اللوح الساخن أفقيا لمدة 40 دقيقة عند 80 درجة مئوية.
3. الربط المتقاطع وتشغيل رقاقة الاستشعار DIDC المزججة GO
- قم بإجراء الربط المتقاطع بين N- (3-dimethylaminopropyl) -N′-ethylcarbodiimide hydrochloride (EDC) و NHydroxysuccinimide (NHS) باستخدام شريحة GO ذات الأغشية الرقيقة.
- أضف 4 ميكرولتر (0.4 م و 0.1 م ، على التوالي) من EDC-NHS (انظر جدول المواد) إلى شريحة GO ذات الأغشية الرقيقة لتوليد الاقتران التساهمي لمجموعات الأمين والكربوكسيل عبر تكوين رابطة أميد26.
4. تحضير الأجسام المضادة والتثبيت على الرقاقة لاستشعار البروتين
- لربط شريحة GO-DIDC الوظيفية بالجسم المضاد ، قم بإذابة ABS المضادة ل SARS-CoV-2 المتوفرة تجاريا (المستنسخة بواسطة بروتين الأرانب mAb المضاد ل S1 ، انظر جدول المواد) باستخدام المخزن المؤقت للتخفيف (0.01 M PBS يحتوي على 0.1٪ BSA [زلاليم مصل البقري] و 0.86٪ كلوريد الصوديوم).
- إلى 1 ميكروغرام من الأجسام المضادة المنقاة ، أضف 1 مل من PBS المخفف. بعد ذلك ، قم بإسقاط 4 ميكرولتر من محلول الجسم المضاد على شريحة GO-DIDC المنشطة المتشابكة. اترك الشريحة في الغرفة المغلقة لمدة 2 ساعة لربط عضلات البطن على سطح الرقاقة الوظيفي في درجة حرارة الغرفة.
ملاحظة: تتكون منطقة فاب من عضلات البطن عادة من مجموعات أمين تفاعلية وفيرة ومجموعات كربوكسيل بسبب طبيعتها القطبية26. لذلك ، يؤدي الشلل المحدد اللاحق إلى اتجاه تساهمي قوي "ذيل" خاص ب Ab.
- إلى 1 ميكروغرام من الأجسام المضادة المنقاة ، أضف 1 مل من PBS المخفف. بعد ذلك ، قم بإسقاط 4 ميكرولتر من محلول الجسم المضاد على شريحة GO-DIDC المنشطة المتشابكة. اترك الشريحة في الغرفة المغلقة لمدة 2 ساعة لربط عضلات البطن على سطح الرقاقة الوظيفي في درجة حرارة الغرفة.
- بمجرد الانتهاء من تثبيت الجسم المضاد على سطح المستشعر ، قم بإلقاء 4 ميكرولتر من ألبومين مصل الأبقار (BSA) على الشريحة لمنع المواقع غير المحددة لشريحة الاستشعار المناعي السعوي. ضع الشريحة أفقيا في الغرفة المغلقة لمدة 20 دقيقة في درجة حرارة الغرفة.
- اغسل شريحة الاستشعار بالسعة المناعية بماء DI ، ثم استمر في التجفيف في درجة حرارة الغرفة.
ملاحظة: بعد التجفيف ، يكون المستشعر المناعي السعوي القائم على DIDC جاهزا لإجراء الكشف التسلسلي عن مستضد سبايك للفيروس. - لمزيد من الاستشعار لبروتين سبايك الفيروس ، قم بإعداد تركيزات مختلفة من 1.0 مجم إلى 1.0 fg للحصول على حد واسع للكشف.
النتائج
هنا ، يتم تقديم بروتوكول لاستشعار بروتين S1 لفيروس SARS-CoV-2 باستخدام شريحة استشعار سعوية مزدوجة بين الأرقام (DIDC) مزججة بأكسيد الجرافين. يوضح الشكل 1 تمثيلا تخطيطيا (تصنيع مع تخطيط الدائرة) لشريحة الاستشعار السعوية المزدوجة متعددة الأصابع (DIDC) المعدلة بأكسيد الجرافين شديدة الحساسية والقابلة لإعادة التدوير. يتم عرض عملية التصنيع التدريجية التفصيلية في الشكل 2. يمثل الشكل 3 توصيف وظائف السطح عبر الفحص المجهري للقوة الذرية (AFM). يظهر الشكل 4 منظر علوي نموذجي للرقاقة المصنعة ، وتوصيف طيفي FTIR ، وزاوية ملامسة السطح في الشكل 4. يشير الشكل 5 إلى الجزيئات الحيوية لمستضد S1 التي تزعج المجال الكهربائي بين الأقطاب الكهربائية والنموذج الأولي المتوقع ، وحساسية شريحة DIDC ، وانتقائية شريحة DIDC ، والرسم البياني للتركيز مقابل السعة للخطية (18.56 nF / g) ، وأوقات الاستجابة للتركيزات المتعددة. يوضح الشكل 6 تقييم الثبات وقابلية التكرار فيما يتعلق بالوقت (بالساعات) والأيام. يوضح الشكل 7 نتائج اختبار قابلية إعادة الاستخدام لشريحة DIDC بعد التجديد. يعرض الشكل 8 مخططات Nyquist لرقائق DIDC القابلة لإعادة التدوير من حيث السعة مقابل أداء استشعار مستضد ارتفاع الفيروس (S1). تم تحليل عملية التصنيع التدريجي بواسطة توصيف AFM و SEM ، وتم تحليل الترابط الكيميائي والوظيفية بواسطة FTIR.
تم تصوير الرسم التخطيطي للمستشعر الحيوي المتوقع في الشكل 1. أظهر المستشعر الحيوي لبروتين SARS-CoV-2 S1 الممثل في الشكلين 1A و B خصائص رقاقة سعوية مزدوجة الأرقام (DIDC) قائمة على GrO مع المكونات المذكورة أعلاه. يتم عرض تنسيق الدائرة المتطابق لشريحة المكثف المزدوج المكون من الأرقام (DIDC) المصنعة في الشكل 1C. يمثل CL المكثفات للأنودات الرئيسية ، ويمثل CS المكثفات للأطراف البؤرية الصغيرة المرتبطة في سلسلة ؛ عرض وطول الرقاقة 4.1 مم و 5 مم على التوالي. تظهر رقاقة الكشف DIDC المستندة إلى GrO مع ABS المضادة ل SARS-CoV-2 التي تقيد بروتين مستضد الفيروس S1 (كمادة تحليلية معينة) في الشكل 1 د. يظهر الفحص المورفولوجي لمضاد SARS-CoV-2 Abs المزروع في GrO بمقياس 1 ميكرومتر من خلال المجهر الإلكتروني (SEM) في الشكل 1 ه. تظهر الصورة الداخلية من AFM أن رقائق أكسيد الجرافين تم توزيعها بشكل مماثل ، بمستوى 25 نانومتر. يوضح الشكل 1F صورة المجهر الإلكتروني الماسح لشريحة مكشوفة ، ويتم عرض تقدير إصبعين معدنيين (أي 20 ميكرومتر) في الشكل 1G.
الأهم من ذلك ، أن تصنيع المستشعر الحيوي للكشف المستند إلى DIDC لبروتين الفيروس S1 يعتمد على عناصر رئيسية معينة ، مثل ثابت العزل الكهربائي ، والتوصيلية الكهربية ، وتوزيع الشحنة18،45. يتم وضع بروتين الكشف على المستشعر الحيوي DIDC ، ويتم تعديل العنصر الأساسي مع المحصن والمستضد فيما يتعلق بالكشف عن الحدود مقارنة بالمفاعلة السعوية DIDC. يظهر تصوير تخطيطي لعملية عمل الاستكشاف الموجه في الشكل 2A-E. تم تقييم DIDC باستخدام مقياس LCR (محمول باليد ، 0.2 GΩ ، 200 pF ، 1 كيلو هرتز ، 2 كيلو ساعة ، سلسلة U1730C) مع جهاز كمبيوتر لتحليل البيانات في الشكل 2 أ. تم تطبيق جهد 0 فولت تيار مستمر بتردد 1 كيلو هرتز عبر المستشعر الحيوي DIDC. أولا ، تم إعداد مساحة المستشعر مع التنظيف بمحلول سمكة الضاري المفترسة بنسبة 3: 1 (H2SO4: H2O2) عند 80 درجة مئوية ، وبعد ذلك ، تم تنظيف المساحة بماء DI للتخلص من الكواشف المحبة للماء ، كما هو مفصل في البحث السابق46،47. بعد تفاعل التشغيل ، تم تصنيع السطح باستخدام GrO (4 ميكرولتر) عند 1,300 دورة في الدقيقة عن طريق طلاء دوار (الشكل 2 ب). بعد ذلك ، تم تقوية أكسيد الجرافين على شريحة DIDC عن طريق وضع الرقاقة على لوح ساخن لمدة ساعة واحدة عند 80 درجة مئوية. بعد عملية التقسية ، تم إجراء كيمياء EDC-NHS (4 ميكرولتر ؛ 0.4 م و 0.1 م)48 ، باستخدام دورة مطورة لإنشاء التكوين التساهمي لمجموعات الأمين والكربوكسيل من خلال تطوير رابطة الأميد35، كما هو موضح في الشكل 2 ج. بعد ذلك ، تم استخدام مخزن مؤقت لإعادة التكوين مع مخزن مؤقت متفاعل 0.1 M ومعادل مطهر 1 ميكروغرام / مل. لتكوين الفيروس Abs (الذي تم تكراره بواسطة أرنب mAbs معاد لبروتين S1) ، تمت إضافة قطرة من 4 ميكرولتر إلى أكسيد الجرافين الذي سنته NHS (الشكل 2 د). وتجدر الإشارة إلى أن منطقة فاب من الأجسام المضادة تتكون عموما من العديد من مجموعات الأمين والكربوكسيل المستقبلة بسبب طبيعتها القطبية. وبهذه الطريقة ، ينتج عن الشلل الصريح التدريجي اتجاه26 الخاص ب "الذيل" التساهمي القوي ، كما هو موضح في الشكل 2E. بشكل ملحوظ ، تم استخدام العلاج بألبومين مصل الأبقار (BSA) مع الرج لمدة 20 دقيقة في درجة حرارة الغرفة لمنع المواقع غير المحددة لشريحة الاستشعار. بعد التجفيف ، تم إعداد المستشعر المناعي السعوي49،50 المستند إلى DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-Glass-DIDCs) للكشف بالتتابع عن مستضد سبايك الفيروس.
لتقييم التشكل السطحي لشريحة DIDC ، أو رقاقة عارية ، أو فيما يتعلق بأكسيد الجرافين ، تم إجراء تنشيط EDC-NHS ، المعادي للفيروس S1 Abs ومستضد سبايك الفيروس ، باستخدام AFM و SEM. يتم عرض عملية وظائف السطح في الشكل 3A-D. أظهرت الأسطح المتتالية شكلات ومستويات مختلفة على النطاق الصغير. شوهد مورفولوجيا أكسيد الجرافين الموحدة 25 نانومتر على شريحة DIDC (الشكل 3 أ) ، بينما على شريحة DIDC الوظيفية GrO ، لوحظ تثبيت الأجسام المضادة ل SARS-CoV-2 على رقاقة EDC-NHS-GrO-Pt / Ti DIDC ، وشوهد توسع مستوى إضافي يصل إلى 400 نانومتر لاحقا (الشكل 3 ب). تم تشتيت الرابط المتقاطع EDC-NHS عند مستوى 40 نانومتر (الشكل 3C) ، مما يؤكد أن الأجسام المضادة ضد SARS-CoV-2 قد تم تجميدها في شريحة DIDC الوظيفية. إلى جانب ذلك ، بعد توسع مستضد سبايك الفيروس ، لوحظت ذروة حادة عند 600 نانومتر بسبب بروتين السنبلة (S1) ، كما هو موضح في الشكل 3D ، مما يشير إلى اتجاه مستضد الجسم المضاد "الذيل".
يتم عرض صور التسويق عبر محرك البحث النموذجية للعرض العلوي في الشكل 4A-D. يقدم الشكل 4A عند 500 ميكرومتر رقاقة SiO2المغطاة بمقاومة الضوء الناجحة وشريحة DIDC المكشوفة للطرف Ti / Pt ؛ بالإضافة إلى ذلك ، فإن الإدخال عند 20 ميكرومتر هو المسافة بين إصبعين معدنيين. يصور سطح رقاقة DIDC المصنع مورفولوجيا سطحية متجانسة وأملسة. يتم عرض جزء الرقاقة الذي يتم تشغيله بأكسيد الجرافين ، والجزء الذي تم سنه EDC-NHS ، والجزء الذي تم تحصينه ليكون معاديا للفيروس ، والرقائق المملوءة ببروتين الفيروس في اللوحات (A) و (B) و (C) و (D) ، على التوالي. تزود قطرات أكسيد الجرافين المقشرة الرقاقة بمجموعة هيدروكسيل (-OH) ومجموعة كربوكسيل (-COOH) ، مما يعزز الكشف من حيث الحساسية والانتقائية. يوضح الشكل 4 أ انتشار رقائق GrO المتجانسة عند 1 ميكرومتر. يوضح الشكل 4 ب اقتران EDC-NHS ، مع بنية فارغة ومستديرة ومجوفة معادية للفيروس عند 3 ميكرومتر. يوضح الشكل 4 ج جسما مضادا مسننة مزروعا في رقاقة الكشف الوظيفية لأكسيد الجرافين-EDC-NHS عند 1 ميكرومتر. الشكل 4 د يظهر هيكل تجمع يشبه المستضد المسننة بالفيروس معزز بالجسم المضاد المسنن عند 10 ميكرومتر. تم توضيح تطوير الروابط المتوقعة أثناء التصنيع التدريجي للمستشعر الحيوي GrO-DIDC من خلال التحليل الطيفي FTIR ، كما هو موضح في الشكل 4E (i-iv). كانت نتائج FTIR26 على النحو التالي: (أنا) ذروة رابطة C-H 2,976 cm−1 ناتجة عن الأجسام المضادة على سطح الرقاقة. '2' تشغيل EDC-NHS، مع ذروة N-O عند 1,567 cm−1 مما يدل على وجود مجموعة النيترو؛ (3) ذروة عند 1,038 سم −1 مما يشير إلى وجود روابط C-O (إستر عطري) وحلقات عطرية في أكسيد الجرافين الثابت على شريحة DIDC ؛ و (رابعا) رقاقة DIDC المكشوفة التي تظهر الكحول الأولي (أي روابط O) بكثافة ضعيفة عند 1،060 سم −1.
تم تصميم وتصنيع رقاقة DIDC الإلكترونية القابلة لإعادة التدوير المقترحة لاستهداف بروتين S1 للفيروس من خلال تثبيت الأجسام المضادة أحادية النسيلة الصريحة على سطح ربط أكسيد الجرافين - EDC-NHS. نظرا لأن الشريحة تشتمل على سطح وتخطيط معسكر بيولوجيا لتشكيل ABS المضاد ل SARS-CoV-2 ، يمكن استخدام قدرة الروابط المتقاطعة على تعزيز معدل حركة الشحنة ، كما هو موضح في السعة الكهربائية ، لتأكيد تأثير الرقاقة (الشكل 5 أ). والمثير للدهشة أن المستشعر المناعي أظهر حدا أدنى من LOD يبلغ 1.0 fg / mL ، وهو أقل من أنظمة الاستشعار الحيوي الحالية للكشف عن الفيروس. بشكل حاسم ، يتمتع المستشعر المناعي بالسعة الكهربائية المقترح بالإضافة إلى تباين أفضل ، وصورت المستشعرات الحيوية الكهروكيميائية الأخرى مثل هذا الطريق الطويل لموقع بروتين الفيروس ، فيما يتعلق بالاستجابة ووقت رد الفعل والانتقائية وإعادة الاستخدام.
لاختبار حساسية المرحلة المناعية SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-SiO2-DIDCs التي تم إنشاؤها ، أخذنا 13 كمية تدريجية من بروتين الفيروس S1-His (من 1.0 × 10-3 جم إلى 1.0 × 10-15 جم) ، وتم استخدام تقنية إسقاط القطرات لإضافة البروتين إلى رقائق DIDC وتحديد السعة فيما يتعلق بتثبيتات المستضد المختلفة ؛ بعد ذلك ، تم مقارنة الأطياف بأطياف التحكم (الشكل 5 ب). علاوة على ذلك ، قمنا أيضا بتقدير الانتقائية لمستضدات الفيروس (الشكل 5 ج) من أجل فحص الآثار المحتملة للمواد المتداخلة في الأمثلة الطبيعية. على سبيل المثال ، قد يكون مستضد البروستاتا النوعي والأميلويد β1-42 بروتينات ملوثات. كان تركيز البروتين المسبب للتداخل 1.0 ميكروغرام / مل لكل من مستضد البروستاتا النوعي والأميلويد β1-42. عمل اختبار الانتقائية في وجود وعدم وجود بروتينات متداخلة. تم إجراء الاختبار باستخدام 10 أجهزة استشعار متميزة. على وجه التحديد ، تم اختبار المستشعرات من الأول إلى الخامس عند وجود البروتين المسبب للتداخل ، وتم اختبار بقية المستشعرات (من السادس إلى العاشر) بدون البروتين المتداخل. لم تكن هناك اختلافات ملحوظة بين هذه الحالات. من المستشعر الأول إلى المستشعر الخامس ، تغيرت السعة من 286.9 nf إلى 275.5 nf ، ومن المستشعر السادس إلى المستشعر العاشر ، تراوحت السعة بين 271.9-273.0 nF. تم تحضير كل عينة في ترتيب مهد 0.1 M PBS (الرقم الهيدروجيني 7.4). أجريت الاختبارات باستخدام ما يقرب من 1.0 ميكروغرام / مل بروتين الفيروس S1 للظروف مع وبدون وجود الجزيئات الحيوية للبروتين غير المستهدف. بعد خطوة حضانة واحدة ، أعطت شريحة الاستشعار المناعي السعوية هذه نتائج كمية فيما يتعلق بعينات محلول 5 ميكرولتر في فترة زمنية قصيرة ؛ تغيرت السعة في 3 ثوان فيما يتعلق بمستضدات الفيروس ، مع عدم وجود تفاعل متبادل كبير مع التحليلات غير المحددة. أظهر تقدير حساسية بروتين مستضد الفيروس علاقة مستقيمة بين السعة مقابل التثبيت (أي y = mx + c). هنا ، y هو عنصر x ، m هو الميل ، نقطة الخط المؤدي إلى x-pivot ، و c عبارة عن كتلة على y-hub. في التقدير الواقعي ، لعب كل تقدير قاعدة عدة مرات ، وتم استخدام قيمة نموذجية. تم وصف الاستجابة بأنها 18.56 nF / g (الشكل 5D). للتحقق من حالة تفاعل المرحلة المناعية ل SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-SiO 2-DIDCs ، تم اختيار ثلاثة تركيزات مستضد محددة ، بما في ذلك 1.0 × 10-15 جم / مل ، و 1 × 10-9 جم / مل ، و 1 × 10-3 جم / مل. يصبح تقدير السعة مغلقا في ما لا يقل عن 3 ثوان على مستوى كل تركيز على حدة ، كما هو موضح في الشكل 5E.
بعد ذلك ، تم فحص متانة المركب الحيوي (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-SiO 2-DIDCs) ؛ لهذا ، تم وضع الرقائق في غرفة رطبة عند 5 درجات مئوية لمدة 10 أيام. بشكل حاسم ، لم يلاحظ أي تغييرات كبيرة في عرض شريحة DIDC المصنعة مع زيادات تدريجية في وقت التخزين الشكل 6 أ. علاوة على ذلك ، تم تقييم قابلية استنساخ جهاز الاستشعار القائم على DIDC ، كما هو موضح في الشكل 6 ب. تم تقييم قيم السعة ل SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-SiO2-DIDCs لمدة 10 ساعات. بشكل ملحوظ ، كانت قيم السعة ثابتة ، دون أي انحراف يزيد عن ±5٪ في القيم بين نقاط الدعم. علاوة على ذلك ، بعد نتائج المتانة أعلاه ، قمنا أيضا بتقييم قابلية التكرار على مدار 10 أيام. وتجدر الإشارة إلى أن تقديرات السعة هذه تختلف أيضا بأقل من ±5٪ بين نقاط الدعم. وتجدر الإشارة إلى أنه في اليوم الثاني ، لاحظنا تباينا بسيطا (من 8.8 فهرنهايت إلى 7.2 فهرنهايت) ، على الأرجح بسبب نقل الشريحة من درجة حرارة الغرفة إلى درجة حرارة منخفضة. في الواقع ، من اليوم الثاني فصاعدا ، ظلت قيم السعة ثابتة. بشكل حاسم ، من اليوم الأول إلى اليوم العاشر ، تحولت قيم السعة من 8.8 nF إلى 7.2 nF ، مع عدم ملاحظة أي تغييرات كبيرة في القابلية للتكرار / التكرار بناء على الانحراف المعياري (SD) ، والانحراف المعياري النسبي (RSD) ، والمتوسط (x̄) ، كما هو موضح في الجدول 1.
أخيرا ، تم تقييم قابلية إعادة استخدام شريحة DIDC للفيروس. لتصفية الأجسام المضادة من سطح المستشعر ، تم استخدام محلول شطف 0.1 متر من الجلايسين حمض الهيدروكلوريك عند 2.7 درجة الحموضة. وتجدر الإشارة إلى أن الرقم الهيدروجيني بين 7 و 7.4 ، وهو أمر غير ممكن من الناحية الفسيولوجية في الجسم ، تم اختياره لتقييم الاضطراب عن طريق التقارب المناعي. بشكل ملحوظ ، تم تطبيق المخزن المؤقت للشطف مرة واحدة على سطح المستشعر ، وبعد التطبيق ، وصلت قيمة السعة إلى مستوى مماثل لتلك الموجودة مع GrO الوظيفي (1.2 nF). بعد وقت قصير ، تمت إضافة محلول سمكة الضاري المفترسة إلى مستشعر DIDC عند 80 درجة مئوية ، وبعد ذلك ، تبين أن السعة عند مستوى يعادل تقريبا مستوى شريحة DIDC المكشوفة (0.26 nF) ؛ في الواقع ، استعادت شريحة DIDC 96٪ من صفاتها المكشوفة. والجدير بالذكر أنه تمت مقارنة النتائج بعد التعافي الأول والثاني ، ولم يتم تحديد أي تغييرات كبيرة ، كما هو موضح في الشكل 7 أ ، ب والشكل 8 أ - ج.

الشكل 1: التمثيل التخطيطي لشريحة الاستشعار السعوية المزدوجة متعددة الأرقام (DIDC) فائقة الحساسية والقابلة لإعادة الاستخدام. (أ) بنية بروتين الفيروس S1. (ب) مخطط لشريحة الكشف السعوية الرقمية المزدوجة المصنعة (DIDC). (ج) المكثف ثنائي الأصابع (DIDC) مع الدائرة (مكافئ). CL = مكثف المطاريف الرئيسية المتصلة في سلسلة ؛ CS = مكثف الأقطاب البؤرية الثانوية المتصلة في سلسلة ؛ عرض الرقاقة 4.1 مم ، والطول 5 مم. (د) رقاقة الكشف بالسعة الرقمية ذات الشقين المزجج GrO (DIDC) مع تثبيت المضاد ل SARS-CoV-2 ABS الخاص بمستضد الفيروس S1 (يركز على المادة التحليلية). (ه) العرض المورفولوجي لنظام ABS المضاد للفيروسات المضمن في أكسيد الجرافين بمقياس 1 ميكرومتر؛ تظهر الصورة الداخلية AFM لرقائق أكسيد الجرافين ، والتي تنتشر بشكل متجانس عند مستوى 25 نانومتر. (و) صورة التسويق عبر محرك البحث للشريحة المكشوفة. (ز) يتم تحديد المسافة بين إصبعين (معدن). شريط المقياس = 20 ميكرومتر. تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: العملية التدريجية لتصنيع DIDC وتقييم التغيرات والوظائف السطحية عبر AFM والفحص المجهري الإلكتروني الماسح (SEM). (أ) شريحة الاستشعار DIDC المصنعة مع رقاقة SiO2المغطاة بمقاومة الضوء وقطب Ti / Pt المكشوف. (ب) تصنيع GrO على الرقاقة عن طريق الطلاء الدوار عند 1,300 دورة في الدقيقة. (ج) تفاعل الكيمياء EDC-NHS لشريحة الكشف السعوية متعددة الأرقام المطلية ب GrO (DIDC). (د) يستجيب ارتباط الجسم المضاد لبروتين الفيروس S1 بمحاذاة Ab "الذيل" بسبب EDC-NHS (EDC-NHS-GRO-Ti / Pt-SiO 2-DIDCs). (ه) ارتباط بروتين الفيروس S1 على SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-SiO2-DIDCs.تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: توصيف AFM. توضيح سطح رقاقة DIDC بشكل منفصل وفيما يتعلق ب (أ) أكسيد الجرافين ، (ب) الجسم المضاد ضد البروتين المسننة للفيروس ، (ج) EDC-NHS ، و (د) المستضد المسنن للفيروس ، كما تم إنجازه من خلال الفحص المجهري للقوة الذرية (AFM). تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
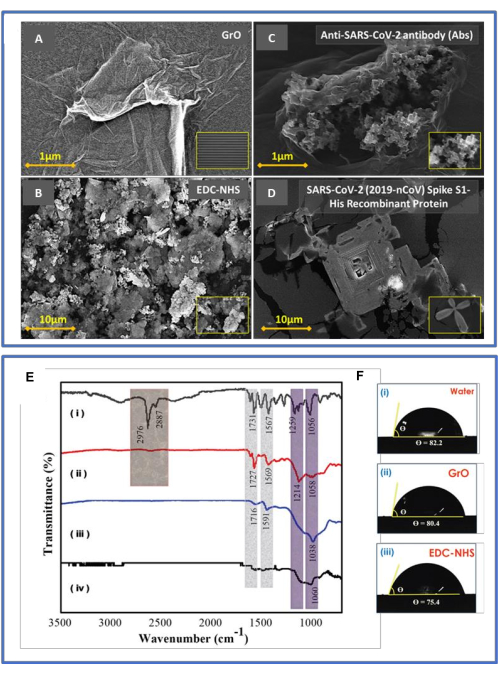
الشكل 4: توصيف SEM و FTIR. (أ-د) يعرض هذا صور التسويق عبر محرك البحث النموذجية للعرض العلوي. تقدم الأمثلة التي يغطيها مركز دبي للتطوير الدولي مسببات سطحية موحدة تكميلية وإضافية. (أ) جزء من الرقاقة يعمل بأكسيد الجرافين ، (ب) الجزء الذي تم سنه EDC-NHS ، (ج) الجزء الذي تم تشغيله ليكون معاديا للفيروس ، و (د) يتم عرض رقائق البروتين بالفيروس. (ب) تقديرات FTIR ونقاط الاتصال. (ه) التحليل الطيفي FTIR: (أنا) معاد للأجسام المضادة للفيروس ، (ثانيا) اقتران EDC-NHS ، (3) شريحة DIDC المغلفة بأكسيد الجرافين ، و (4) شريحة DIDC العارية. (و) قياس زاوية ملامسة الماء: (1) شريحة DIDC العارية (82.0 درجة ± 3.0 درجة) ، (2) GrO (80.4 درجة ± 3.0 درجة) ، و (ثالثا) EDC-NHS (75.4 درجة ± 3.0 درجة). علاوة على ذلك ، تم تقدير قابلية البلل للرقائق المختلفة من حيث زاوية التلامس لقطرة ماء 5 ميكرولتر. أظهر السائل (الماء) نقطة اتصال أعلى (حوالي 82.0 درجة ± 3.0 درجة) فيما يتعلق بالرقائق المجردة في الشكل F (i). وتجدر الإشارة إلى أن هذه النقطة تضاءلت مع GrO (80.4 درجة ± 3.0 درجة) ، كما في الشكل F (ii) ، و EDC-NHS (75.4 درجة ± 3.0 درجة) ، كما في الشكل F (iii). توضح نقاط التلامس السطحية هذه أن أكسيد الجرافين والرقائق المعالجة ب EDC-NHS كانت أكثر محبة للماء من الأقطاب الكهربائية السعوية المزدوجة المكشوفة. تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
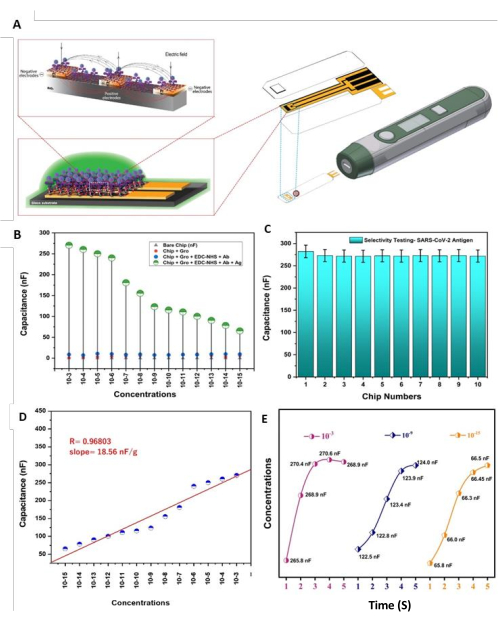
الشكل 5: الحساسية والتوصيف الوظيفي. (أ) تؤدي كاثودات DIDC القائمة على Ti / Pt المرتبطة بالأجسام المضادة ومستضد الجزيئات الحيوية للفيروس إلى تعطيل المجال الكهربائي عبر / بين المعدن (الأصابع) ، ويتم تقييم التأثير على سعة شريحة DIDC المصنعة باستخدام أداة تقدير السعة. (ب)غطت حساسية رقاقة الكشف عن المرحلة المناعية SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs المرتبة نطاقا واسعا (أي 1.0 ملغم/مل إلى 1.0 fg/mL)؛ السعة الموجودة في الجزء العلوي من الشريحة المكشوفة ، و Chip-Gro ، و Chip-Gro-EDC-NHS-SARS-CoV-2-Ab ، و EDC_NHS+ SARS-CoV-2-Ab + SARS-CoV-2-Ag. (ج) انتقائية المستشعر الحيوي في المرحلة المناعية SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs مع وجود بروتين مسبب للتداخل وبدونه. (د) كانت الخطية 18.56 nF/g لمجموعة متنوعة من التركيزات، وكان هناك خط انتكاسة مباشر قوي؛ تم تحديد معامل الميل والانتكاس (R) من خلال تركيب المعلومات. (ه) زمن الاستجابة (3 ثوان) من 1.0 × 10-15 جم / مل ، 1 × 10-9 جم / مل ، و 1 × 10-3 جم / مل مقابل قيم السعة بعد تطبيق عينات البروتين. تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
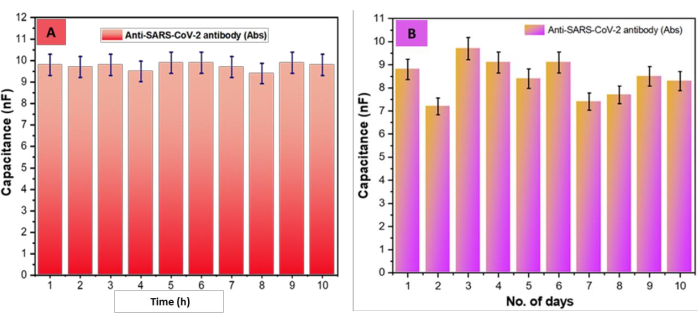
الشكل 6: تقييم استقرار المستشعر الحيوي وقابليته للاستنساخ. (أ) السعة SARS-CoV-2-Ab-EDC-NHS-GrO-Ti / Pt-Glass-DIDCs مقابل مخطط الوقت من 1-10 ساعات ، مع انحراف بنسبة ±5٪ بين قيم نقطة الدعم. (ب) أظهرت نتائج الاستقرار، التي قيمت قابلية استنساخ SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDCs المرتبة عبر الزمن، انحرافا بنسبة ٪±5 على مدى 10 أيام بين قيم نقاط الدعم. تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: قابلية إعادة استخدام شريحة DIDC بناء على الفحص المجهري للقوة الذرية ومسح صور المجهر الإلكتروني. (أ) صورة 3D AFM لشريحة DIDC بعد تجربة واحدة ؛ سماكة الرقاقة واضحة بوضوح حتى 250 نانومتر. (ب) صورة عالية الاستبانة (HR) SEM بعد تجربة واحدة للكشف عن مستضد الفيروس المفاجئ بمقياس 1 مم ؛ في الوسط ، يتم عرض صور لكاثودات Pt / Ti عند 50 ميكرومتر ، وصورة HR لإصبع القطب المعدني عند 10 ميكرومتر ، والمسافة بين الإصبعين (أي 20 ميكرومتر). في كل من صور AFM و SEM ، لم يتم ملاحظة أي عيوب أو فواصل ، وتم استخدام نفس الشريحة لتجربة تحليل أخرى. تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: استشعار مستضد السعة مقابل SARS-CoV-2 (S1) بتركيزات مختلفة وتجديد وإعادة استخدام شريحة DIDC: (أ) مخططات Nyquist للقطب الكهربائي الإلكتروني DIDC المطلي بأكسيد الجرافين المقاسة بواسطة محلل المقاومة. طريقة السعة بدون وباستخدام مستضدات S1 السنبلية بتركيزات 1.0 مجم / مل إلى 1.0 fg / مل في محلول PBS. (ثانيا وثالثا) مؤامرات Nyquist المقابلة لتلك الموجودة في A. (ب) بعد استرداد مستشعر ناجح عند درجة حموضة منخفضة (2.7) باستخدام مخزن مؤقت للشطف (0.1 متر) من تنظيف الجلايسين حمض الهيدروكلوريك وسمكة الضاري المفترسة. تم تحقيق التعافي في 20 دقيقة أو أقل. بالنسبة لجميع نقاط التركيز ، كانت علامة الدخول (B ، C) 96٪ من ذلك في (A). (ج) بعد تجديدين متسلسلين لأجهزة الاستشعار. لكل تقدير من التقديرات ، تتحرك الشحنة لأنودات DIDC الإلكترونية المطلية بأكسيد الجرافين. تم استخدام ترتيب المخزن المؤقت 0.1 M PBS (درجة الحموضة 7.4) كعنصر تحكم. تم الحصول على ثلاث قراءات متتالية لتركيزات مختلفة من مستضد الفيروس المرتفع (S1). تم تطبيق تردد kHz 1 لجمع هذه البيانات. تم تعديل هذا الرقم من Sharma et al.26. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الوقت (بالساعات) | رقاقة + جرو + EDC- NHS + Ab | خطأ | لا. عدد الأيام | رقاقة + جرو + EDC- NHS + Ab | خطأ |
| 1 | 9.8 | 0.49 | 1 | 8.8 | 0.44 |
| 2 | 9.7 | 0.485 | 2 | 7.2 | 0.36 |
| 3 | 9.8 | 0.49 | 3 | 9.7 | 0.485 |
| 4 | 9.5 | 0.475 | 4 | 9.1 | 0.455 |
| 5 | 9.9 | 0.495 | 5 | 8.4 | 0.42 |
| 6 | 9.9 | 0.495 | 6 | 9.1 | 0.455 |
| 7 | 9.7 | 0.485 | 7 | 7.4 | 0.37 |
| 8 | 9.4 | 0.47 | 8 | 7.7 | 0.385 |
| 9 | 9.9 | 0.495 | 9 | 8.5 | 0.425 |
| 10 | 9.8 | 0.49 | 10 | 8.3 | 0.415 |
| المتوسط (x̄) | 9.74 | 8.42 | |||
| SD (±) | 0.171269768 | 0.801110479 | |||
| تقرير اللاجئ (٪) | 1.758416506 | 9.514376238 |
الجدول 1: تقييم القابلية للتكرار / التكرار بقيم المتوسط (x̄) والانحراف المعياري (SD) والانحراف المعياري النسبي (RSD).
Discussion
لتشكيل مستشعر حيوي منتج قائم على رقاقة DIDC ، يعد توزيع الشحنة والموصلية وثابت العزل الكهربائي ل DIDC أمرا في غاية الأهمية. بشكل ملحوظ ، تتعلق التحسينات في حدود الكشف هذه بالمفاعلة السعوية ل DIDC18 ، 26 ، 27. في هذه الدراسة ، تم تصنيع جهاز استشعار مناعي بالسعة معاد للفيروس Abs ويعمل عن طريق اقتران EDC-NHS على ركيزة SiO2المستندة إلى أكسيد الجرافينDIDC 27. بالإضافة إلى ذلك ، تمت إضافة الربط المتقاطع EDC-NHS من خلال استخدام الربط التساهمي على ركيزة GrO ليعمل ضد الفيروس ABS.
من خلال الإجراء المخطط له بشق الأنفس والذي يضمن جاهزية سطح المستشعر ، وتثبيت عضلات البطن المضادة ل SARS-CoV-2 ، والارتباط ببروتين الفيروس S1 ، تم العثور على توازن بين العناصر المتنافسة لبساطة الشلل ، والوضوح ، والسعة العامة. تم فحص تقدم رقاقة DIDC الحيوية الخاضعة للتنظيم GrO باستخدام فحص السطح الكهربائي والبصري. تتسبب مساحة السطح الكبيرة للمواد القائمة على الجرافين في امتصاص التحليلات المختلفة. بالإضافة إلى ذلك ، تمثل هذه الرقاقة الحيوية GrO-DIDC فائقة الحساسية والسرعة نظاما بسيطا ومناسبا لاختبار POC. بهذه الطريقة ، يعد المستشعر الحيوي التفصيلي تقنية متطورة. أولا ، يمكن أن يخلق المستشعر تغييرا في السعة يزيد عن 70 nF لأن شريحة DIDC المطلية ب GrO المكشوفة لها تقارب منخفض يبلغ 1.0 fg / mL. يزداد مدى تغير السعة بزيادات مع تركيز بروتين مستضد الفيروس المستهدف في حدود 1.0 ملغم/مل إلى 1.0 fg/mL. تعد حدود تحديد هذا المستشعر الحيوي من بين أدنى الحدود حتى الآن لمستشعر حيوي غير فاراديك (سعوي). ثانيا ، تم إظهار وضوح المستشعر من خلال التباين في طريقة فرق السعة بين المؤشرات الحيوية المستهدفة وغير المستهدفة (البروتين). بالنسبة للبروتينات غير المستهدفة ، لم يكن التغيير في السعة هو نفسه بشكل أساسي بالنسبة للبروتين المستهدف لمستضد الفيروس S1 الموضوعي ، ولم يكن هناك تغيير كبير في السعة مع زيادات تثبيت البروتين غير المستهدف. ثالثا ، أنجز المستشعر نطاقا واسعا للكشف من 1.0 مجم / مل إلى 1.0 fg / مل مع سعة خطية كبيرة (أي 18.56 nF / g). فمن ناحية، يسمح التحديد السريع لمستضد الفيروس S1 بالكشف عن جهات الاتصال الشخصية الرئيسية بسرعة، ويوسع خيارات العلاج، ويدعم العلاج المحدد؛ علاوة على ذلك ، يساعد هذا التحديد على الحد من انتشار المرض ، وهو أمر ضروري لمكافحة الوباء في الوقت المناسب. الجزء الأكثر أهمية في هذه التكنولوجيا المعقدة والمقيدة هو تحسين عملية التصنيع ووظائف الرقاقة. يجب إدارة كل خطوة من خطوات عملية التصنيع. يمكن أن تختلف نتائج التصنيع وتكون محدودة اعتمادا على كيفية التعامل معها.
الاستنتاج ووجهة النظر
تقدم هذه الورقة شريحة كشف سعوية ثنائية الأبعاد متداخلة الأرقام (DIDC) مصممة ومصنعة ومصنعة فائقة السرعة وقابلة لإعادة التدوير بأكسيد الجرافين لتحديد بروتينات الفيروس S1 على وجه التحديد على مستوى fg. كشفت الاستكشافات في هذا العمل أن استخدام شريحة سعوية DIDC تعمل ب GrO يعمل على تطوير حدود الاستشعار ، وبالتالي تعزيز استجابة وانتقائية جهاز الاستشعار الحيوي. تسبب شكل الخط المقيد والتغيرات في الخصائص الكهربائية (اقتران المقاومة) في تغيرات في السعة لمجموعة من نطاقات التعريف (1.0 × 10-3 جم إلى 1.0 × 10-15 جم). تم اختبار عمل جهاز الاستشعار السعوي DIDC بشكل شامل في ترتيبات ضعيفة للغاية تحتوي على جزيئات حيوية BSA وبروتينات سبايك. أظهرت هذه الدراسات أنه يمكن استخدام المستشعر السعوي DIDC المقترح للكشف عن بروتينات الفيروس S1 بمستويات منخفضة في وقت قصير (~ 5-6 ثوان). لذلك ، يمكن للإجراء غير المؤلم وغير الملامس والسريع المقترح في هذا العمل اكتشاف بروتين الفيروس S1 في المراحل الأولى من المرض بحساسية عالية.
في وقت لاحق ، تتمثل الخطة في تحديد بروتينات سبايك الفيروس في POC لتمكين العلاج الذي يحركه المريض وترقية جميع أجزاء الجهاز (أي شريحة الكشف ، وتطوير التنسيق الكامل لمستشعر DIDC السعوي المستند إلى النموذج مع أمثلة حقيقية للمريض [في وقت واحد]). في النهاية ، يمكن اكتشاف COVID-19 من خلال استخدام التكنولوجيا القائمة على الهاتف الخلوي. ومع ذلك ، لم تتم تجربة المستشعر الحيوي الذي تمت مناقشته وإدخاله باستخدام عينات أصلية بسبب عدم توفر العينة البيولوجية والموافقة الأخلاقية. وتبذل مساعي جادة لإقامة تعاون بين مختبرات علم الفيروسات ومختبرات العدوى في كوريا الجنوبية وعيادات الطوارئ في الخارج للحصول على السوائل الحيوية من المرضى المصابين بكوفيد-19. سيتم نشر عواقب التحقيقات المستقبلية في تشخيصات COVID-19 POC باستخدام المستشعر السعوي عالي الجودة الخاص بنا في مكان آخر.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل إلى حد ما من قبل برنامج أبحاث العلوم الأساسية من خلال المؤسسة الوطنية للبحوث في كوريا (NRF) برعاية وزارة التعليم بموجب منحة 2018R1D1A1A09083353 ومنحة 2018R1A6A1A03025242 ، إلى حد ما من قبل جمعية مجموعة GCS المحدودة ، ومن قبل كلية الدراسات العليا بوزارة البيئة الكورية (MOE) استثمرت طاقة ضخمة في المشروع المتكامل لمنع التلوث ومكافحته ومنحة بحثية من جامعة Kwangwoon في عام 2022.
تود E.M. أن تعرب عن تقديرها للدعم المقدم من المعهد الوطني للتصوير الطبي الحيوي والهندسة الحيوية (5T32EB009035).
Materials
| Name | Company | Catalog Number | Comments |
| Amyloid β1-42 Protein | Merck (Sigma-Aldrich) | 107761-42-2 | |
| anti-SARS-CoV-2 Spike (S1) monoclonal IgG antibody | SinoBiological | 40150-R007 | |
| EDC [N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride] | Thermo Fisher Scientific | A35391 | |
| Ethyl alcohol (C2H5OH) | Sigma-Aldrich | ||
| Hydrogen peroxide (H2O2) | |||
| Kapton tape | polyimide tape | ||
| NHS (NHydroxysuccinimide, 98+%; C4H5NO3) | Thermo Fisher Scientific | A39269 | |
| PBS | |||
| Prostate-specific antigen | Sigma-Aldrich | P3338-25UG | |
| SARS-CoV-2 Spike S1-His recombinant protein | SinoBiological | 40591-V08H | |
| Single layer Graphene Oxide | Graphene Supermarket | ||
| Spin Coater | High Precision Spin Coater (Spin Coating System) | ACE-200 | |
| Sulfuric acid (H2SO4) |
References
- Boldog, P. Risk assessment of novel coronavirus COVID-19 outbreaks outside China. Journal of Clinical Medicine. 9 (2), 571-583 (2020).
- Seo, G., et al. Rapid detection of COVID-19 causative virus (SARS-CoV-2) in human nasopharyngeal swab specimens using field-effect transistor-based biosensor. ACS Nano. 14 (4), 5135-5142 (2020).
- Panda, P. K. Structure-based drug designing and immunoinformatics approach for SARS-CoV-2. Science Advances. 6, 5135-5142 (2020).
- Li, R., et al. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV-2). Science Advances. 368, 489-493 (2020).
- Lu, R., et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 395 (10224), 565-574 (2020).
- Hui, D. S. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. Journal of Infectious Diseases. 91, 264-266 (2020).
- Chen, I. Y., et al. Upregulation of the chemokine (C-C motif) ligand 2 via a severe acute respiratory syndrome coronavirus spike-ACE2 signaling pathway. Journal of Virology. 84 (15), 7703-7712 (2010).
- Fung, T. S., Huang, M., Liu, D. X. Coronavirus-induced ER stress response and its involvement in regulation of coronavirus-host interactions. Virus Research. 194, 110-123 (2014).
- Park, S. E. Epidemiology, virology, and clinical features of severe acute respiratory syndrome -coronavirus-2 (SARS-CoV-2: Coronavirus Disease-19). Korean Journal of Pediatrics. 63 (4), 119-124 (2020).
- Fajnzylber, J., et al. SARS-CoV-2 viral load is associated with increased disease severity and mortality. Nature Communications. 11 (1), 5493 (2020).
- Rao, K., et al. Review on newly identified coronavirus and its genomic organization. SSR Institute of International Journal of Life Sciences. 6 (2), 2509 (2020).
- Mujawar, M. A., et al. Nano-enabled biosensing systems for intelligent healthcare: Towards COVID-19 management. Materials Today Chemistry. 17, 100306 (2020).
- Manickam, P., et al. Artificial intelligence (AI) and internet of medical things (IoMT) assisted biomedical systems for intelligent healthcare. Biosensors. 12 (8), 562-591 (2022).
- Kaushik, A. K., et al. Electrochemical SARS-CoV-2 sensing at point-of-care and artificial intelligence for intelligent COVID-19 management. ACS Applied Bio Materials. 3 (11), 7306-7325 (2020).
- Lee, D., Lee, J. Testing on the move: South Korea's rapid response to the COVID-19 pandemic. Transportation Research Interdisciplinary Perspectives. 5, 100111 (2020).
- Emery, S. L., et al. Real-time reverse transcription-polymerase chain reaction assay for SARS-associated coronavirus. Emerging Infectious Diseases. 10 (2), 311-316 (2004).
- Lu, X., et al. Real-time reverse transcription-PCR assay panel for Middle East respiratory syndrome coronavirus. Journal of Clinical Microbiology. 52 (1), 67-75 (2014).
- Mishra, S., et al. Tailored biofunctionalized biosensor for the label-free sensing of prostate-specific antigen. ACS Applied Bio Materials. 3 (11), 7821-7830 (2020).
- Wang, Y. L., et al. Detection of severe acute respiratory syndrome (SARS) coronavirus nucleocapsid protein using AlGaN/GaN high electron mobility transistors. ECS Transactions. 50 (6), 239-243 (2013).
- Ravi, N., Cortade, D. L., Ng, E., Wang, S. X. Diagnostics for SARS-CoV-2 detection: A comprehensive review of the FDA-EUA COVID-19 testing landscape. Biosensors and Bioelectronics. 165, 112454 (2020).
- Sethuraman, N., Jeremiah, S. S., Ryo, A. Interpreting diagnostic tests for SARS-CoV-2. JAMA. 323, 2249-2251 (2020).
- Timmer, W. C., Villalobos, J. M. . Chemistry Education. 70 (4), 273-280 (1993).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (5), 368-373 (2006).
- Drummond, T. G., Hill, M. G., Barton, J. K. Electrochemical DNA sensors. Nature Biotechnology. 21, 1192-1199 (2003).
- Singhal, C., Khanuja, M., Chaudhary, N., Pundir, C. S., Narang, J. Detection of chikungunya virus DNA using two-dimensional MoS2 nanosheets based disposable biosensor. Scientific Reports. 8, 7734 (2018).
- Sharma, P. K., et al. Ultrasensitive and reusable graphene oxide-modified double-interdigitated capacitive (DIDC) sensing chip for detecting SARS-CoV-2. ACS Sensors. 6 (9), 3468-3476 (2021).
- Sharma, P. K., et al. Ultrasensitive probeless capacitive biosensor for amyloid beta (Ab) detection in human plasma using interdigitated electrodes. Biosensors and Bioelectronics. 212, 114365 (2022).
- Wang, L., et al. A sensitive DNA capacitive biosensor using interdigitated electrodes. Biosensors and Bioelectronics. 87, 646-653 (2017).
- Brasil, P., et al. Zika virus infection in pregnant women in Rio de Janeiro. The New England Journal of Medicine. 375 (24), 2321-2334 (2016).
- Kong, J., et al. Molecular wires as chemical sensors. Science. 287 (5453), 622-625 (2000).
- Wang, J. Carbon-nanotube based electrochemical biosensors: A review. Electroanalysis. 17 (1), 7-14 (2005).
- Layqah, L. A., Eissa, S. An electrochemical immunosensor for the coronavirus associated with the Middle East respiratory syndrome using an array of gold nanoparticle-modified carbon electrodes. Microchimica Acta. 186 (4), 224-234 (2019).
- Vermisoglou, E., et al. Human virus detection with graphene-based materials. Biosensors and Bioelectronics. 166, 112436 (2020).
- Mostafavi, E., Dubey, A. K., Teodori, L., Ramakrishna, S., Kaushik, A. SARS-CoV-2 Oomicron variant: A next phase of the COVID-19 pandemic and a call to arms for system sciences and precision medicine. MedComm. 3 (1), 119 (2022).
- Ali, M. A., et al. Sensing of COVID-19 antibodies in seconds via aerosol jet printed three dimensional electrodes. Advanced Materials. 33 (7), 2006647 (2020).
- Ganbold, E., Sharma, P. K., Kim, E. -. S., Lee, D. -. N., Kim, N. -. Y. Capacitive humidity sensor with a rapid response time on a GO-doped P(VDF-TrFE)/LiCl composite for noncontact sensing applications. Chemosensors. 11 (2), 122 (2023).
- Shivani, T., et al. Antibacterial and antiviral high-performance nanosystems to mitigate new SARS-CoV-2 variants of concern. Current Opinion in Biomedical Engineering. 21, 100363 (2022).
- Kujawska, M., Mostafavi, E., Kaushik, A. SARS-CoV-2 getting into the brain; Neurological phenotype of COVID-19, and management by nano-biotechnology. Neural Regeneration Research. 18 (3), 519-520 (2022).
- Kang, P., Wang, M. C., Nam, S. Bioelectronics with two-dimensional materials. Microelectronic Engineering. 161, 18-35 (2016).
- Syama, S., Mohanan, P. V. Comprehensive application of graphene: Emphasis on biomedical concerns. Nano-Micro Letters. 11, 6 (2019).
- Chaudhary, V., Kaushik, A., Furukawa, H., Khosla, A. Review-Towards 5th generation AI and IoT driven sustainable intelligent sensors based on 2D MXenes and borophene. ECS Sensors Plus. 1, 013601 (2022).
- Sharma, P. K., et al. Perspectives on 2D-borophene flatland for smart bio-sensing. Materials Letters. 308, 131089 (2022).
- Sharma, P. K., Khondakar, K. R., Kaushik, A. K., et al. Nanotechnology and its application: A review. Nanotechnology in Cancer Management. Precise Diagnostics Toward Personalized Health Care. 1 (1), 1-33 (2021).
- Rawat, P., et al. Emergence of high-performing and ultra-fast 2D-graphene nano-biosensing system. Materials Letters. 308, 131241 (2022).
- Ganbold, E., et al. Highly sensitive interdigitated capacitive humidity sensors based on sponge-like nanoporous PVDF/LiCl composite for real-time monitoring. ACS Applied Materials & Interfaces. 15 (3), 4559-4568 (2023).
- Feng, J., Guo, Z. Wettability of graphene: From influencing factors and reversible conversions to potential applications. Nanoscale Horizons. 4, 339-364 (2019).
- Flynn, S. P., et al. qua-Art: A demonstration of hydrophilic and hydrophobic surfaces fabricated by plasma enhanced chemical vapor deposition. Chemical Education. 94 (2), 221-225 (2017).
- Bhardwaj, S. K., Yadav, P., Ghosh, S., Basu, T., Mahapatro, A. K. Biosensing test-bed using electrochemically deposited reduced graphene oxide. ACS Applied Materials & Interfaces. 8 (37), 24350-24360 (2016).
- Reddicherla, U., Seyed, M. G., Sonwal, S., Gokana, M. R., Yun, S. H. Portable electrochemical sensing methodologies for on-site detection of pesticide residues in fruits and vegetables. Coordination Chemistry Reviews. 453, 214305 (2022).
- Reddicherla, U., et al. Colorimetric based on-site sensing strategies for the rapid detection of pesticides in agricultural foods: New horizons, perspectives, and challenges. Coordination Chemistry Reviews. 446, 214061 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved