Method Article
Puce de détection haute performance modifiée au graphène pour la détection du SARS-CoV-2
Dans cet article
Résumé
Le présent protocole décrit la fabrication de prototypes de biodétection à faible coût basés sur des nanosystèmes utiles pour détecter avec précision les protéines virales (au niveau Fg). Une plate-forme de capteur aussi minuscule permet des applications au point d’intervention qui peuvent être intégrées à l’Internet des objets médicaux (IoMT) pour répondre aux objectifs de télémédecine.
Résumé
Ce modèle prototype de détection implique le développement d’une puce de détection capacitive double interdigitée (DIDC) réutilisable et à double vitrage d’oxyde de graphène (GrO) pour détecter spécifiquement et rapidement le virus du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2). Le DIDC fabriqué comprend un substrat de verre contenant du Ti/Pt vitré avec de l’oxyde de graphène (GrO), qui est ensuite modifié chimiquement avec l’EDC-NHS pour immobiliser les anticorps (Abs) hostiles au SRAS-CoV-2 basés sur la protéine de pointe (S1) du virus. Les résultats d’investigations perspicaces ont montré que GrO offrait une surface d’ingénierie idéale pour l’immobilisation des anticorps et améliorait la capacité pour permettre une sensibilité plus élevée et des limites de détection basses. Ces éléments réglables ont permis d’obtenir une large plage de détection (1,0 mg/mL à 1,0 fg/mL), une limite de détection minimale de 1 fg/mL, une réactivité élevée et une bonne linéarité de 18,56 nF/g, et un temps de réaction rapide de 3 s. De plus, en ce qui concerne le développement de cadres de test au point de service (POC) financièrement viables, la réutilisabilité de la biopuce GrO-DIDC dans cette étude est bonne. De manière significative, la biopuce est spécifique contre les antigènes transmissibles par le sang et est stable jusqu’à 10 jours à 5 °C. En raison de sa compacité, ce biocapteur à échelle réduite a le potentiel de diagnostiquer l’infection par le COVID-19 au point de service. Ce système peut également détecter d’autres maladies virales graves, bien qu’une étape d’approbation utilisant d’autres exemples de virus soit en cours de développement.
Introduction
Une pandémie virale causée par un nouveau coronavirusbêta 1 (c’est-à-dire 2019-nCoV), qui a ensuite été nommé coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2)2 (ci-après principalement appelé le virus), impliquant un cluster pulmonaire et une détresse respiratoire aiguë sévère, est apparue dans la ville de Wuhan, en Chine, à la fin de 20193. En raison de sa transmission interhumaine rapide à l’échelle mondiale, de son taux d’infection élevé, de son taux de mortalité élevé et de ses effets indésirables graves mettant la vie en danger4, pendant la pandémie, la recherche en virologie5 a évolué rapidement pour identifier l’organisation et la structure génomiques du virus 5,6. Les symptômes de la COVID-19 7,8 comprennent une forte fièvre, une toux sèche et une douleur généralisée9. Il est important de noter que les différents sérotypes du virus entraînent des sévérités différentes de la maladie10. De plus, les porteurs asymptomatiques peuvent potentiellement propager le virus. Habituellement, au microscope, les particules du virus COVID-19 montrent des projections en forme de massue formées par les protéines de pointe11. Par conséquent, pour contrôler la propagation de ce nouvel agent pathogène, la détection des cas doit être rapide et efficace. Ainsi, la détection ultra-sensible, rapide et sélective du virus aux premiers stades de l’infection virale est devenue cruciale 2,11. La distanciation sociale/physique est nécessaire pour éviter la transmission12 du virus. Les organismes de santé mettent l’accent sur le développement d’outils de diagnostic intelligents et de nanosystèmes13. En effet, comme le suggèrent les agences de santé, des tests ciblés et de masse14,15 sont nécessaires et sont toujours demandés.
En principe, les méthodes de diagnostic biologique continu telles que la réaction en chaîne par polymérase à transcription inverse (RT-PCR) sont les meilleurs moyens d’identification de masse du SRAS-CoV-2, comme pour le coronavirus lié au syndrome respiratoire du Moyen-Orient (MERS-CoV)16 et le SRAS-CoV-117. Dans ce contexte, l’identification standard actuelle de la contamination par le SARS-CoV-2 dépend de l’amélioration des caractéristiques spécifiques à l’infection18,19. De plus, la variation de l’infection par le SRAS-CoV-2 en fonction de la région, de l’âge, de la race et du sexe doit être prise en compte. Dans le but ultime de sauver des vies, il est crucial de créer des outils de diagnostic rapides pour une utilisation sur le lieu d’intervention20,21.
Dans ce contexte, les stratégies habituelles telles que l’hybridation in situ en fluorescence (FISH), l’examen immuno-absorbant des protéines (ELISA), les méthodes basées sur les microsphères, les tests électrochimiques et l’IRM, la TEP et le NIRFOI22 ont une faible sensibilité aux faibles niveaux de virus, une faible sélectivité et une faible capacité de réutilisation ; De plus, ces procédures présentent des inconvénients, notamment des systèmes de diagnostic de biodétection coûteux, des réactifs non réutilisables et la nécessité d’une main-d’œuvre hautement qualifiée23. Par conséquent, ces techniques perspicaces ne peuvent pas être considérées comme des méthodes de POC rapides, raisonnables, exceptionnellement spécifiques ou sensibles24,25. Il convient de noter qu’il existe différents types de biocapteurs basés sur l’ADN et les immunisateurs qui utilisent des techniques composées, capacitives et électriques 18,26,27,28. À titre d’exemple, des biocapteurs d’ADN électriques, qui ont une grande réactivité, peuvent être réduits simplement et sont réglables29,30, ont été produits pour la détection d’Ebola31, de Zika, de MERS-CoV et de SARS-CoV 32,33,34. De même, un biocapteur à semi-conducteur à impact de champ (FET) permettant de détecter la protéine de pointe du virus à l’aide de certains anticorps (monoclonaux) immobilisés sur des dispositifs vitrés au graphène a été efficacement créé35,36. Néanmoins, cette nouvelle stratégie est moins sensible que la RT-PCR. De plus, plus récemment, un cadre de détection 3D du virus recouvert d’oxyde de graphène diminué par des nanoparticules (GrO) a été mis au point, qui a une limite d’identification basse (2,8 × 10-15 M) ; Quoi qu’il en soit, la structure complexe de biocapteursproposée 35 a été testée en ce qui concerne l’utilisation du POC et comparée à d’autres stratégies de biocapteurs existantes utilisées pour la détection du virus 35,37,38.
Dans cette étude, nous avons conçu et fabriqué un biocapteur DIDC à base de GrO réduit et réutilisable pour identifier la protéine de pointe du virus sans les limitations décrites ci-dessus pour d’autres biocapteurs. Ce biocapteur permet une détection au niveau du femtogramme (fg) dans les 3 s18,27 du temps de réponse. Pour mener à bien cette recherche, les nanoflocons GrO ont été choisis pour leur meilleure réactivité et leur sélectivité, ce qui signifie que de faibles concentrations de la protéine de l’antigène du virus provenant d’écouvillons oropharyngés ou nasopharyngés peuvent être détectées. GrO est un matériau approprié, synthétiquement fiable, cohérent et conducteur qui peut être utilisé de manière bénéfique pour les applications de biodétection 2,39,40,41. De plus, une approche d’hybridation sans marquage d’anticorps IgG monoclonaux a été utilisée, en se concentrant sur la protéine S1 de pointe du virus. Le biocapteur SARS-CoV-2-GrO-DIDC fabriqué est réutilisable après un traitement et un nettoyage avancés avec une solution de piranha. Ce biocapteur ultrarapide, sensible, sélectif, sans marquage et réutilisable peut être utilisé pour la biodétection d’échantillons cliniques et les applications de soins de santé personnalisées 26,42,43,44.
Protocole
1. Nettoyage de la puce de détection DIDC
- Au début de l’expérience, nettoyez la surface de la puce DIDC26 avec une solution de piranha (H2SO4 :H2O2dans un rapport de 3:1), et placez-la sur la plaque chauffante à 80 °C pendant 15 min. Ensuite, rincez la surface du capteur avec de l’eau distillée goutte à goutte à l’aide d’une pipette pour éliminer complètement les réactifs de nettoyage. Pour assurer l’élimination complète du réactif, rincez la surface avec quatre à cinq gouttes d’alcool éthylique.
REMARQUE : La puce DIDC a été fabriquée à la suite d’un rapport26 précédemment publié. - Ensuite, séchez la surface de la sonde à température ambiante pour l’élimination complète des réactifs afin d’obtenir une surface de sonde hydrophile. Cette puce peut être utilisée pour la fabrication ultérieure de la couche d’oxyde de graphène sur la puce (étape 2).
- Couvrez les électrodes de la puce du capteur avec du ruban adhésif.
2. Fabrication de la fine couche d’oxyde de graphène sur la puce de détection DIDC
- Placez la puce au centre de la machine de revêtement par centrifugation en position horizontale et ajoutez 4 μL d’une solution aqueuse d’oxyde de graphène monocouche (GO) disponible dans le commerce (voir le tableau des matériaux) sur la surface de la puce. Ensuite, fermez la chambre d’étanchéification et faites-la fonctionner pendant 2 min à 1 300 tr/min.
- Pour le recuit de la puce GO fabriquée, maintenez la puce sur la plaque chauffante horizontalement pendant 40 min à 80 °C.
3. Réticulation et fonctionnalisation de la puce de détection DIDC GO-glazed
- Effectuez la réticulation du chlorhydrate de N-(3-diméthylaminopropyl)-N'-éthylcarbodiimide (EDC) et du NHydroxysuccinimide (NHS) avec la puce GO à couche mince.
- Ajouter 4 μL (0,4 M et 0,1 M, respectivement) d’EDC-NHS (voir le tableau des matériaux) à la puce GO à couche mince pour générer la conjugaison covalente des groupes amine et carboxyle via la formation de liaisons amide26.
4. Préparation et immobilisation d’anticorps sur la puce pour la détection des protéines
- Pour lier la puce GO-DIDC fonctionnalisée à l’anticorps, dissoudre les anticorps anti-SARS-CoV-2 disponibles dans le commerce (reproduits par la protéine anti-S1 mAb de lapin, voir le tableau des matériaux) à l’aide du tampon de dilution (0,01 M PBS contenant 0,1 % de BSA [albumine sérique bovine] et 0,86 % de NaCl).
- À 1 μg d’anticorps purifiés, ajoutez 1 mL de PBS dilué. Ensuite, versez 4 μL de la solution d’anticorps sur la puce GO-DIDC activée réticulée. Laissez la puce dans la chambre fermée pendant 2 h pour lier l’Abs sur la surface de la puce fonctionnalisée à température ambiante.
REMARQUE : La région Fab de l’Abs se compose généralement d’une abondance d’amines réactives et de groupes carboxyliques en raison de sa nature polaire26 ; par conséquent, l’immobilisation spécifique ultérieure conduit à une orientation covalente robuste et spécifique de l’Ab.
- À 1 μg d’anticorps purifiés, ajoutez 1 mL de PBS dilué. Ensuite, versez 4 μL de la solution d’anticorps sur la puce GO-DIDC activée réticulée. Laissez la puce dans la chambre fermée pendant 2 h pour lier l’Abs sur la surface de la puce fonctionnalisée à température ambiante.
- Une fois l’immobilisation des anticorps à la surface du capteur terminée, versez 4 μL d’albumine sérique bovine (BSA) sur la puce pour bloquer les sites non spécifiques de la puce de détection immuno-capacitive. Placez la puce horizontalement dans la chambre fermée pendant 20 min à température ambiante.
- Lavez la puce de détection immuno-capacitive avec de l’eau DI, puis poursuivez le séchage à température ambiante.
REMARQUE : Après séchage, l’immunocapteur capacitif basé sur le DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs) est prêt à effectuer la détection en série de l’antigène de pointe du virus. - Pour une détection plus poussée de la protéine de spicule du virus, préparer différentes concentrations de 1,0 mg à 1,0 fg pour obtenir une large limite de détection.
Résultats
Ici, un protocole est présenté pour détecter la protéine S1 du virus SARS-CoV-2 à l’aide d’une puce de détection capacitive double interdigitée (DIDC) à vitrage d’oxyde de graphène. La figure 1 montre une représentation schématique (fabrication avec la disposition du circuit) de la puce de détection capacitive à double interdigitation modifiée par l’oxyde de graphène (DIDC), extrêmement sensible et recyclable. Le processus de fabrication détaillé par étapes est illustré à la figure 2. La figure 3 représente la caractérisation de la fonctionnalité de surface par microscopie à force atomique (AFM). La figure 4 montre une vue de dessus typique de la puce fabriquée, la caractérisation spectroscopique FTIR et l’angle de contact de surface. La figure 5 montre les biomolécules de l’antigène S1 perturbant le champ électrique entre les électrodes métalliques et le prototype projeté, la sensibilité de la puce DIDC, la sélectivité de la puce DIDC, le graphique de la concentration en fonction de la capacité pour la linéarité (18,56 nF/g) et les temps de réponse des concentrations multiples. La figure 6 montre l’évaluation de la constance et de la reproductibilité en fonction du temps (en heures) et des jours. La figure 7 montre les résultats des tests de réutilisation de la puce DIDC après la régénération. La figure 8 présente les graphiques de Nyquist des puces DIDC recyclables en termes de capacité en fonction de la performance de détection de l’antigène de pointe du virus (S1). Le processus de fabrication par étapes a été analysé par caractérisation AFM et MEB, et la liaison chimique et la fonctionnalisation ont été analysées par FTIR.
Le schéma de notre biocapteur projeté est illustré à la figure 1. Le biocapteur de protéine SARS-CoV-2 S1 créé représenté dans les figures 1A et B présentait les deux caractéristiques de la puce capacitive double interdigitée (DIDC) basée sur GrO avec les composants mentionnés ci-dessus ; le format de circuit identique de la puce DIDC (Twofold Interdigitated Capacitor) fabriquée est illustré à la Figure 1C. CL représente les condensateurs des anodes principales, et CS représente les condensateurs des petites bornes focales reliées en série ; La largeur et la longueur de la puce sont respectivement de 4,1 mm et 5 mm. La figure 1D montre la puce de détection DIDC basée sur GrO avec des anticorps anti-SARS-CoV-2 immobilisés se limitant à la protéine antigène S1 du virus (en tant qu’analyte désigné). L’examen morphologique des Abs anti-SARS-CoV-2 implantés dans le GrO à une échelle de 1 μm par microscopie électronique (MEB) est illustré à la figure 1E ; l’image en médaillon de l’AFM montre que les flocons d’oxyde de graphène étaient répartis de manière similaire, avec un niveau de 25 nm. La figure 1F montre l’image au microscope électronique à balayage d’une puce non recouverte, et l’estimation de deux doigts métalliques (c.-à-d. 20 μm) est présentée à la figure 1G.
Il est important de noter que la fabrication du biocapteur pour la détection de la protéine virale S1 basée sur le DIDC dépend de certains éléments clés, tels que la constante diélectrique, la conductivité et la distribution de charge18,45. La protéine de détection est positionnée sur le biocapteur DIDC, et l’élément clé avec l’immunisateur et l’antigène est modifié en ce qui concerne les limites de détection par rapport à la réactance capacitive DIDC. Une représentation schématique du processus de travail d’exploration dirigée est présentée à la figure 2A-E. Le DIDC a été évalué à l’aide d’un compteur LCR (portable, 0,2 GΩ, 200 pF, 1 kHz, 2 kH, série U1730C) avec un PC pour l’analyse des données (figure 2A). Une tension de 0 V CC avec une fréquence de 1 kHz a été appliquée à travers le biocapteur DIDC. Tout d’abord, l’espace du capteur a été configuré avec un nettoyage avec une solution de piranha avec une proportion de 3:1 (H2SO4 :H2O2) à 80 °C, puis l’espace a été nettoyé avec de l’eau DI pour éliminer les réactifs hydrophiles, comme détaillé dans des recherches précédentes46,47. Après l’interaction d’actionnement, la surface a été fabriquée avec du GrO (4 μL) à 1 300 tr/min au moyen d’une machine à revêtir par centrifugation (figure 2B). Ensuite, l’oxyde de graphène sur la puce DIDC a été renforcé en plaçant la puce sur une plaque chauffante pendant 1 h à 80 °C. Après le processus de revenu, la chimie EDC-NHS (4 μL ; 0,4 M et 0,1 M) a été réalisée48, en utilisant un cycle amélioré pour créer la formation covalente de groupes amines et carboxyliques par le développement de la liaison amide35, comme indiqué à la figure 2C. Ensuite, un tampon de reconstitution a été utilisé avec un tampon réactif de 0,1 M et un neutralisant décontaminé de 1 μg/mL. Pour la formation du virus Abs (répliqué par des anticorps monoclonaux de lapin hostiles à la protéine S1), une gouttelette de 4 μL a été ajoutée sur l’oxyde de graphène promulgué par le NHS (Figure 2D). Il convient de noter que la zone Fab des anticorps comprend généralement de nombreux groupes amines et carboxyles réceptifs en raison de sa nature polaire ; de cette manière, l’immobilisation explicite progressive aboutit à une orientation covalente robuste de l’Abspécifique 26, comme le montre la figure 2E. De manière significative, le traitement à l’albumine sérique bovine (BSA) a été utilisé en agitant pendant 20 minutes à température ambiante pour bloquer les sites non spécifiques de la puce de détection. Après séchage, l’immunocapteur capacitif49,50 basé sur DIDC (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDCs) a été préparé pour détecter séquentiellement l’antigène de pointe du virus.
Pour évaluer la morphologie de surface de la puce DIDC, puce nue, ou vis-à-vis de l’oxyde de graphène, l’activation EDC-NHS, hostile au virus S1 Abs et à l’antigène de pointe du virus, a été réalisée à l’aide de l’AFM et du MEB. Le processus de fonctionnalisation de surface est présenté dans la figure 3A-D. Les surfaces successives ont montré des morphologies et des niveaux variés à l’échelle microscopique. Une morphologie standardisée de l’oxyde de graphène de 25 nm a été observée sur la puce DIDC (Figure 3A), tandis que sur la puce DIDC fonctionnalisée par GrO, l’immobilisation des anticorps anti-SARS-CoV-2 sur la puce DIDC EDC-NHS-GrO-Pt/Ti a été observée, et une expansion de niveau supplémentaire jusqu’à 400 nm a été observée par la suite (Figure 3B). Le réticulant EDC-NHS a été dispersé à un niveau de 40 nm (Figure 3C), affirmant que les anticorps contre le SARS-CoV-2 ont été immobilisés dans la puce DIDC fonctionnalisée. De plus, après l’expansion de l’antigène de pointe du virus, un pic brutal à 600 nm a été observé en raison de la protéine de pointe (S1), comme le montre la figure 3D, indiquant l’orientation anticorps-antigène « tail-on ».
Des images MEB typiques vues de dessus sont illustrées à la figure 4A-D. La figure 4A à 500 μm présente une plaquette SiO2recouverte de photorésine réussie et une puce DIDC exposée à une borne Ti/Pt ; De plus, l’encart à 20 μm est la distance entre deux doigts métalliques. La surface de la puce DIDC fabriquée présente une morphologie de surface homogène et lisse ; la partie de la puce qui est fonctionnalisée par l’oxyde de graphène, la partie qui est promulguée par EDC-NHS, la partie qui est immunisée pour être hostile au virus et les puces dopées par les protéines virales sont affichées dans les panneaux (A), (B), (C) et (D), respectivement. Les gouttes d’oxyde de graphène pelées fournissent à la puce un groupe hydroxyle (-OH) et un groupe carboxylique (-COOH), ce qui améliore la détection en termes de sensibilité et de sélectivité. La figure 4A montre la dissémination des flocons homogènes de GrO à 1 μm. La figure 4B montre le couplage EDC-NHS, avec une construction vide, ronde et creuse hostile au virus à 3 μm. La figure 4C montre un anticorps enrichi implanté dans la puce de détection fonctionnalisée à l’oxyde de graphène-EDC-NHS à 1 μm. Figure 4D montre la structure du pool de type antigène à épi viral renforcé par l’anticorps enrichi à 10 μm. Le développement des liaisons attendues lors de la fabrication par étapes du biocapteur GrO-DIDC a été démontré par spectroscopie FTIR, comme le montre la figure 4E(i-iv). Les résultats de la FTIR26 étaient les suivants : (i) un pic de liaison C-H de 2 976 cm−1 causé par les anticorps à la surface de la puce ; (ii) la fonctionnalisation EDC-NHS, avec un pic N-O à 1 567 cm−1 indiquant la présence du groupe nitro ; (iii) un pic à 1 038 cm−1 suggérant la présence de liaisons C-O (ester parfumé) et de cycles aromatiques dans le réglage de l’oxyde de graphène immobilisé sur la puce DIDC ; et (iv) l’éclat DIDC exposé montrant de l’alcool primaire (c’est-à-dire des liaisons C-O) d’une faible intensité à 1 060 cm−1.
La puce bionique DIDC recyclable proposée a été conçue et fabriquée pour cibler la protéine de pointe S1 du virus en immobilisant les anticorps monoclonaux explicites sur une surface de liaison oxyde de graphène-EDC-NHS. Comme la puce comprend une surface et une disposition bio-conçues pour la formation d’Abs anti-SARS-CoV-2, la capacité des réticulants à améliorer le taux de mouvement de charge, comme indiqué par la capacité électrique, peut être utilisée pour confirmer l’effet de la puce (Figure 5A). Étonnamment, l’immunocapteur a montré une LD minimale de 1,0 fg/mL, ce qui est inférieur aux systèmes de biodétection actuels pour détecter le virus. De manière critique, l’immunocapteur capacitif électrique proposé a en outre un meilleur contraste, et d’autres biocapteurs de propension électrochimique ont représenté un long chemin pour la localisation de la protéine virale, en ce qui concerne la réactivité, le temps de réaction, la sélectivité et la réutilisabilité.
Pour tester la sensibilité de l’immuno-stade SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs créé, nous avons prélevé 13 quantités progressives de la protéine S1-His du virus (de 1,0 × 10−3 g à 1,0 × 10−15 g), et la technique de projection de gouttes a été utilisée pour ajouter la protéine aux puces DIDC et quantifier la capacité par rapport aux différentes fixations de l’antigène ; par la suite, les spectres ont été contrastés avec les spectres de contrôle (Figure 5B). De plus, nous avons également estimé la sélectivité des antigènes du virus (Figure 5C) afin d’examiner les effets potentiels des substances interférentes dans des exemples naturels ; par exemple, l’APS et les protéines amyloïdes β1 à 42 peuvent être des contaminants. La concentration de la protéine interférente était de 1,0 μg/mL pour l’APS et l’amyloïde β1-42. Le test de sélectivité a fonctionné en présence et en absence de protéines interférentes. Les tests ont été effectués avec 10 capteurs distincts ; Plus précisément, les capteurs du premier au cinquième ont été testés en présence de la protéine interférente, et le reste des capteurs (du sixième au dixième) a été testé sans la protéine interférente. Aucune différence n’a été constatée entre ces affections. Du premier au cinquième capteur, la capacité est passée de 286,9 nf à 275,5 nf, et du sixième au dixième capteur, la capacité a varié entre 271,9 et 273,0 nF. Chacun des échantillons a été préparé dans le dispositif de berceau PBS de 0,1 M (pH 7,4). Les tests ont été effectués en utilisant environ 1,0 μg/mL de protéine S1 du virus pour les conditions avec et sans la présence de biomolécules protéiques non cibles. Après une seule étape d’incubation, cette puce d’immunodétection capacitive a donné des résultats quantitatifs en ce qui concerne les échantillons de solution de 5 μL dans un court laps de temps ; La capacité a changé en 3 s par rapport aux antigènes du virus, sans réactivité croisée significative avec les analytes non spécifiques. L’estimation de la sensibilité de la protéine de l’antigène viral a montré une relation linéaire entre la capacité et la fixation (c’est-à-dire y = mx + c). Ici, y est un élément de x, m est l’inclinaison, le point de la droite vers le pivot x, et c est un bloc sur le moyeu en y. Dans l’estimation factuelle, chaque estimation a joué une base plusieurs fois, et une valeur typique a été utilisée ; la réactivité a été caractérisée à 18,56 nF/g (figure 5D). Pour vérifier l’état réactionnel de l’immuno-stade SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs créé, trois concentrations d’antigènes spécifiques ont été choisies, soit 1,0 × 10-15 g/mL, 1 × 10-9 g/mL et 1 × 10-3 g/mL. L’estimation de la capacité devient fermée en pas moins de 3 s au niveau de chaque foyer séparément, comme le montre la figure 5E.
Ensuite, la durabilité du bio-composite (SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs) a été vérifiée ; pour cela, les copeaux ont été placés dans une chambre humide à 5 °C pendant 10 jours. De manière critique, aucun changement significatif n’a été observé dans la présentation de la puce DIDC fabriquée avec des augmentations progressives du temps de stockage Figure 6A. De plus, la reproductibilité du capteur basé sur DIDC a également été évaluée, comme le montre la figure 6B. Les valeurs de capacité des DIDC SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDC ont été évaluées pendant 10 h. De manière significative, les valeurs de capacité étaient stables, sans écart de plus de ±5 % dans les valeurs entre les points d’appui. De plus, suite aux résultats de durabilité ci-dessus, nous avons également évalué la reproductibilité sur 10 jours. Il convient de noter que ces estimations de capacité variaient également de moins de ±5 % entre les points d’appui. Il est à noter que le deuxième jour, nous avons remarqué un petit contraste (de 8,8 nF à 7,2 nF), probablement dû au déplacement de la puce de la température ambiante à une température basse ; En effet, à partir du deuxième jour, les valeurs de capacité sont restées stables. De manière critique, du premier au dixième jour, les valeurs de capacité sont passées de 8,8 nF à 7,2 nF, sans qu’aucun changement significatif n’ait été observé dans la reproductibilité/répétabilité basée sur l’écart-type (écart-type), l’écart-type relatif (RSD) et la moyenne (x̄), comme le montre le tableau 1.
Enfin, la réutilisabilité de la puce DIDC du virus a été évaluée. Pour éluer les anticorps de la surface du capteur, un tampon d’élution de 0,1 M de glycine-HCl à un pH de 2,7 a été utilisé ; Il convient de noter qu’un pH compris entre 7 et 7,4, qui n’est pas physiologiquement possible dans l’organisme, a été sélectionné pour évaluer la perturbation par immunoaffinité. De manière significative, le tampon d’élution a été appliqué une fois sur la surface du capteur, et après l’application, la valeur de capacité a atteint un niveau similaire à celui trouvé avec le GrO fonctionnalisé (1,2 nF). Peu de temps après, une solution de piranha a été ajoutée au capteur DIDC à 80 °C, et par la suite, il a été démontré que la capacité était à un niveau presque équivalent à celui de la puce DIDC exposée (0,26 nF) ; en effet, la puce DIDC a récupéré 96 % de ses qualités découvertes. Notamment, les résultats ont été comparés après les premier et deuxième rétablissements, et aucun changement significatif n’a été identifié, comme le montrent les figures 7A, B et 8A-C.

Figure 1 : Représentation schématique de la puce de détection DIDC (Modified Double Interdigitated Capacitive) ultra-sensible et réutilisable à l’oxyde de graphène. (A) La structure de la protéine S1 du virus. (B) Un aperçu de la puce de détection capacitive à deux chiffres (DIDC) fabriquée. (C) Le condensateur à deux interfaces (DIDC) avec le circuit (équivalent). CL = le condensateur pour les principales bornes connectées en série ; CS = le condensateur pour les électrodes focales mineures connectées en série ; la largeur de la puce est de 4,1 mm et sa longueur est de 5 mm. (D) La puce de détection capacitive à deux chiffres (DIDC) à double digitation GrO avec des Abs anti-SARS-CoV-2 immobilisés spécifiques de l’antigène du virus S1 (centrés sur l’analyte). (E) Présentation morphologique de l’anticorps anti-virus intégré dans l’oxyde de graphène à l’échelle de 1 μm ; l’image en médaillon montre l’AFM des flocons d’oxyde de graphène, qui sont dispersés de manière homogène au niveau de 25 nm. (F) Une image MEB de la puce exposée. (G) La distance entre deux doigts (métal) est définie. Barre d’échelle = 20 μm. Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Processus par étapes de fabrication du DIDC et évaluation des changements de surface et des fonctionnalités via AFM et microscopie électronique à balayage (MEB). (A) La puce de détection DIDC fabriquée avec la plaquette SiO2recouverte de résine photosensible et l’électrode Ti/Pt exposée. (B) La fabrication du GrO sur la puce par centrifugation à 1 300 tr/min. (C) L’interaction chimique EDC-NHS pour la double puce de détection capacitive interdigitée (DIDC) revêtue de GrO. (D) La liaison de l’anticorps répond à la protéine S1 du virus avec un alignement Ab « queue sur » dû à l’EDC-NHS (EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs). (E) La liaison de la protéine S1 du virus sur les DIDC du SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO2-DIDCs.Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Caractérisation de l’AFM. Clarification de surface de la puce DIDC séparément et en ce qui concerne (A) l’oxyde de graphène, (B) l’anticorps contre la protéine dopée du virus, (C) l’EDC-NHS et (D) l’antigène dopé du virus, tel qu’accompli par microscopie à force atomique (AFM). Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.
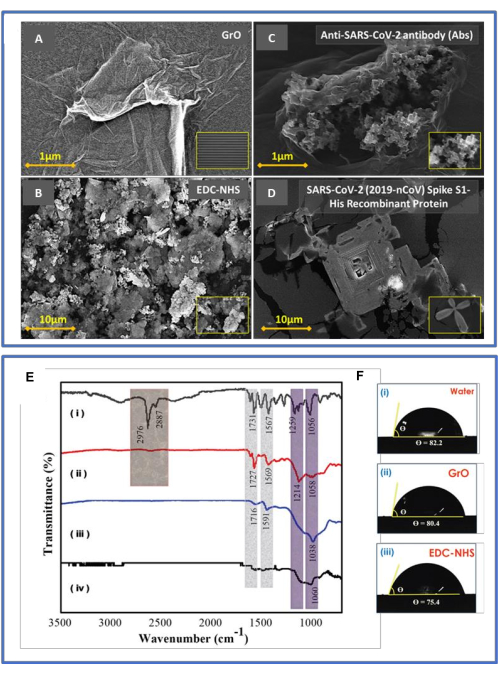
Figure 4 : Caractérisation MEB et IRTF. (A-D) Cela montre les images SEM typiques vues de dessus. Les exemples recouverts de DIDC présentent une étiologie de surface standardisée complémentaire et supplémentaire ; (A) la partie de la puce fonctionnalisée avec de l’oxyde de graphène, (B) la partie qui est promulguée par EDC-NHS, (C) la partie fonctionnalisée pour être hostile au virus, et (D) les puces dopées de protéines virales sont affichées. (B) Estimations de la FTIR et des points de contact. (E) spectroscopie FTIR : (i) hostile aux anticorps du virus, (ii) couplage EDC-NHS, (iii) la puce DIDC recouverte d’oxyde de graphène, et (iv) la puce DIDC nue. (F) Mesure de l’angle de contact avec l’eau : (i) la puce DIDC nue (82,0° ± 3,0°), (ii) GrO (80,4° ± 3,0°) et (iii) EDC-NHS (75,4° ± 3,0°). De plus, la mouillabilité des différents copeaux a été estimée en fonction de l’angle de contact d’une gouttelette d’eau de 5 μL. Le liquide (eau) présentait un point de contact plus élevé (environ 82,0° ± 3,0°) par rapport aux copeaux dénudés de la figure F(i). Il convient de noter que ce point a diminué avec le GrO (80,4° ± 3,0°), comme dans la figure F(ii), et l’EDC-NHS (75,4° ± 3,0°), comme dans la figure F(iii). Ces points de contact de surface démontrent que l’oxyde de graphène et les puces traitées EDC-NHS étaient plus hydrophiles que les électrodes capacitives à double interdigitation exposées. Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.
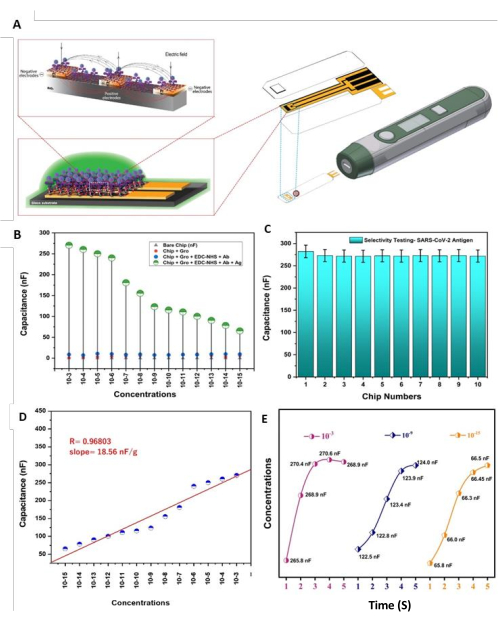
Figure 5 : Sensibilité et caractérisation fonctionnelle. (A) Les cathodes DIDC à base de Ti/Pt liées par les anticorps et l’antigène des biomolécules virales perturbent le champ électrique à travers / entre le métal (doigts), et l’impact sur la capacité de la puce DIDC fabriquée est évalué à l’aide du gadget d’estimation de capacité. (B)La sensibilité de la puce de détection d’immuno-étage SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs couvrait une large gamme (c.-à-d. 1,0 mg/mL à 1,0 fg/mL) ; sur le dessus de la puce non couverte, le Chip-GrO, le Chip-Gro-EDC-NHS-SARS-CoV-2-Ab et le EDC_NHS+ SARS-CoV-2-Ab+ SARS-CoV-2-Ag. (C) La sélectivité du biocapteur d’immuno-étage arrangé SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-SiO 2-DIDCs avec et sans la présence d’une protéine interférente. (D) La linéarité était de 18,56 nF/g pour une grande variété de concentrations, et il y avait une forte ligne de rechute directe ; l’inclinaison et le coefficient de rechute (R) ont été déterminés en ajustant l’information. (E) Le temps de réponse (3 s) des concentrations de 1,0 × 10-15 g/mL, de 1 × 10-9 g/mL et de 1 × 10-3 g/mL par rapport aux valeurs de capacité après application des échantillons de protéines. Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.
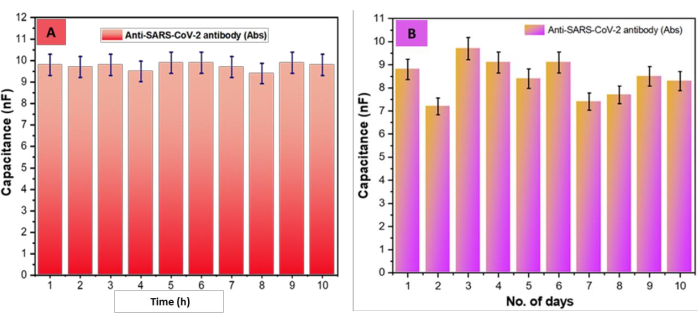
Figure 6 : Évaluation de la stabilité et de la reproductibilité du biocapteur. (A) Le diagramme de capacité en fonction du temps SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDC de 1 à 10 h, avec un écart de ±5 % entre les valeurs du point de support. (B) Les résultats de stabilité, qui ont évalué la reproductibilité des SARS-CoV-2-Ab-EDC-NHS-GrO-Ti/Pt-Glass-DIDC arrangés dans le temps, ont montré un écart de ±5 % sur 10 jours entre les valeurs des points d’appui. Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Réutilisabilité de la puce DIDC sur la base d’images de microscopie à force atomique et de microscopie électronique à balayage. (A) Une image AFM 3D de la puce DIDC après un essai ; L’épaississement de la puce est clairement visible jusqu’à 250 nm. (B) Une image MEB à haute résolution (HR) après un essai de détection de l’antigène de pointe du virus à l’échelle de 1 mm ; au centre, des images des cathodes Pt/Ti à 50 μm, de l’image HR du doigt de l’électrode métallique à 10 μm et de la distance entre les deux doigts (c’est-à-dire 20 μm) sont présentées. Sur les images AFM et MEB, aucune imperfection ou rupture n’a été remarquée, et la même puce a été utilisée pour un autre essai d’analyse. Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Détection de l’antigène de pointe (S1) de la capacité par rapport à la capacité du SRAS-CoV-2 à différentes concentrations et régénération et réutilisation de la puce DIDC : (A) Tracés de Nyquist de l’électrode bionique DIDC recouverte d’oxyde de graphène mesurée par un analyseur d’impédance ; méthode de capacitance sans et avec les antigènes S1 de pointe à des concentrations de 1,0 mg/mL à 1,0 fg/mL dans une solution de PBS. (ii, iii) Tracés de Nyquist correspondant à ceux de A. (B) Après une récupération réussie de la sonde à un faible pH (2,7) à l’aide d’un tampon d’élution (0,1 M) de glycine-HCl et nettoyage par piranha. La récupération a été réalisée en 20 minutes ou moins. Pour tous les focus, le nombre de connexions (B, C) était de 96 % de celui de (A). (C) après deux régénérations séquentielles du capteur. Pour chacune des estimations, la charge se déplace pour les anodes bioniques DIDC recouvertes d’oxyde de graphène ; le dispositif tampon PBS de 0,1 M (pH 7,4) a été utilisé comme témoin. Trois lectures successives ont été obtenues pour différentes concentrations de l’antigène de pointe du virus (S1). Une fréquence de 1 kHz a été appliquée pour collecter ces données. Cette figure a été modifiée de Sharma et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Temps (en heures) | Puce + Gro + EDC- NHS + Ab | Erreur | Non. de jours | Puce + Gro + EDC- NHS + Ab | Erreur |
| 1 | 9.8 | 0.49 | 1 | 8.8 | 0.44 |
| 2 | 9.7 | 0.485 | 2 | 7.2 | 0.36 |
| 3 | 9.8 | 0.49 | 3 | 9.7 | 0.485 |
| 4 | 9.5 | 0.475 | 4 | 9.1 | 0.455 |
| 5 | 9.9 | 0.495 | 5 | 8.4 | 0.42 |
| 6 | 9.9 | 0.495 | 6 | 9.1 | 0.455 |
| 7 | 9.7 | 0.485 | 7 | 7.4 | 0.37 |
| 8 | 9.4 | 0.47 | 8 | 7.7 | 0.385 |
| 9 | 9.9 | 0.495 | 9 | 8.5 | 0.425 |
| 10 | 9.8 | 0.49 | 10 | 8.3 | 0.415 |
| Moyenne (x̄) | 9.74 | 8.42 | |||
| SD (±) | 0.171269768 | 0.801110479 | |||
| DSR ( %) | 1.758416506 | 9.514376238 |
Tableau 1 : Évaluation de la reproductibilité/répétabilité avec les valeurs moyennes (x̄), écart-type (ET) et écart-type relatif (RSD).
Discussion
Pour fabriquer un biocapteur productif basé sur une puce DIDC, la distribution de charge, la conductivité et la constante diélectrique du DIDC sont extrêmement importantes. De manière significative, les améliorations apportées à ces limites de détection sont liées à la réactance capacitive du DIDC 18,26,27. Dans cette étude, on a fabriqué un immunocapteur capacitif hostile au virus Abs et fonctionnalisé par couplage EDC-NHS sur le substrat SiO2à base d’oxyde de graphène-DIDC27. De plus, la réticulation EDC-NHS a été ajoutée en utilisant une liaison covalente sur le substrat GrO pour fonctionnaliser contre le virus Abs.
Grâce à la procédure minutieusement planifiée qui a permis d’assurer la préparation de la surface du capteur, l’immobilisation de l’Abs anti-SARS-CoV-2 et la liaison avec la protéine S1 du virus, un équilibre a été trouvé entre les éléments opposés de la simplicité de l’immobilisation, de l’explicitation et de la capacité générale. L’avancement de la biopuce DIDC régulée par GrO a été vérifié à l’aide d’un examen de surface électrique et optique. La grande surface des matériaux à base de graphène provoque l’adsorption de divers analytes. De plus, cette biopuce GrO-DIDC ultra-sensible et ultra-rapide représente un système simple et adapté aux tests POC. De cette façon, le biocapteur détaillé est une technologie de pointe. Tout d’abord, le capteur pourrait créer une variation de capacité supérieure à 70 nF, car la puce DIDC exposée recouverte de GrO a une faible convergence de 1,0 fg/mL. L’ampleur de la variation de capacité augmente par paliers avec la concentration en protéines de l’antigène viral cible dans la plage de 1,0 mg/mL à 1,0 fg/mL. Les limites d’identification de ce biocapteur sont parmi les plus basses à ce jour pour un biocapteur non faradaïque (capacitif). Deuxièmement, l’explicitation du capteur a été démontrée par la variation de la méthode de différentiel de capacité entre les biomarqueurs ciblés et non cibles (protéines). Pour les protéines non cibles, la variation de la capacité n’était fondamentalement pas la même que pour la protéine cible de l’antigène S1 du virus objectif, et il n’y a pas eu de changement considérable de la capacité avec les augmentations de fixation des protéines non cibles. Troisièmement, le capteur a atteint une large plage de détection de 1,0 mg/mL à 1,0 fg/mL avec une grande linéarité de capacité (c’est-à-dire 18,56 nF/g). D’une part, l’identification rapide de l’antigène du virus S1 permet de détecter rapidement les contacts personnels clés, élargit les options de traitement et soutient le traitement désigné ; De plus, cette identification permet de freiner la propagation de la maladie, ce qui est nécessaire pour lutter contre la pandémie en temps opportun. La partie la plus cruciale de cette technologie compliquée et contrainte est l’optimisation du processus de fabrication et de la fonctionnalité des puces. Chaque étape du processus de fabrication doit être gérée. Les résultats de fabrication peuvent différer et être limités en fonction de la façon dont il est manipulé.
Conclusion et point de vue
Cet article présente une puce de détection capacitive à deux interdigités (DIDC) ultra-rapide et recyclable altérée par l’oxyde de graphène pour identifier les protéines S1 du virus spécifiquement au niveau fg. Les explorations de ce travail ont révélé que l’utilisation d’une puce capacitive DIDC fonctionnalisée par GrO développe davantage les limites de détection, améliorant ainsi la réactivité et la sélectivité du dispositif de biodétection. La forme restreinte de la ligne et les modifications des propriétés électriques (couplage d’impédance) ont provoqué des modifications de capacité pour un ensemble de plages d’identification (1,0 × 10−3 g à 1,0 × 10−15 g). Le fonctionnement du capteur capacitif DIDC a été testé de manière exhaustive dans des arrangements profondément affaiblis contenant des biomolécules BSA et des protéines de pointe. Ces études ont démontré que le capteur capacitif DIDC proposé pouvait être utilisé pour détecter les protéines virales S1 à de faibles niveaux en peu de temps (~5-6 s). Par conséquent, la procédure indolore, sans contact et rapide proposée dans ce travail peut détecter la protéine S1 du virus dans les phases initiales de la maladie avec une sensibilité élevée.
Plus tard, le plan est d’identifier les protéines de pointe du virus au POC afin de permettre un traitement axé sur le patient et de mettre à niveau toutes les parties du dispositif (c’est-à-dire la puce de détection, en développant une coordination complète du capteur capacitif DIDC basé sur un modèle avec des exemples de patients réels [simultanément]). Finalement, le COVID-19 pourrait être détecté en utilisant la technologie des téléphones portables. Néanmoins, le biocapteur discuté et introduit n’a pas encore été essayé en utilisant des échantillons authentiques en raison de l’absence de disponibilité d’échantillons biologiques et d’approbation éthique. Des efforts sérieux sont déployés pour établir une coopération entre les laboratoires sud-coréens de virologie et d’infection et les cliniques d’urgence à l’étranger afin d’obtenir des bioliquides à partir de patients infectés par le COVID-19. Les conséquences des futures investigations sur le diagnostic du COVID-19 au point de service à l’aide de notre capteur capacitif de haute qualité seront publiées ailleurs.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu dans une certaine mesure par le programme de recherche en sciences fondamentales par l’intermédiaire de la Fondation nationale de la recherche de Corée (NRF) parrainé par le ministère de l’Éducation dans le cadre de la subvention 2018R1D1A1A09083353 et de la subvention 2018R1A6A1A03025242, un peu par la GCS Group Association Ltd., et par la Graduate School du ministère coréen de l’Environnement (MOE) a investi énormément d’énergie dans le projet intégré de prévention et de contrôle de la pollution et une subvention de recherche de l’Université de Kwangwoon en 2022.
E.M. tient à souligner le soutien de l’Institut national d’imagerie biomédicale et de bio-ingénierie (5T32EB009035).
matériels
| Name | Company | Catalog Number | Comments |
| Amyloid β1-42 Protein | Merck (Sigma-Aldrich) | 107761-42-2 | |
| anti-SARS-CoV-2 Spike (S1) monoclonal IgG antibody | SinoBiological | 40150-R007 | |
| EDC [N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride] | Thermo Fisher Scientific | A35391 | |
| Ethyl alcohol (C2H5OH) | Sigma-Aldrich | ||
| Hydrogen peroxide (H2O2) | |||
| Kapton tape | polyimide tape | ||
| NHS (NHydroxysuccinimide, 98+%; C4H5NO3) | Thermo Fisher Scientific | A39269 | |
| PBS | |||
| Prostate-specific antigen | Sigma-Aldrich | P3338-25UG | |
| SARS-CoV-2 Spike S1-His recombinant protein | SinoBiological | 40591-V08H | |
| Single layer Graphene Oxide | Graphene Supermarket | ||
| Spin Coater | High Precision Spin Coater (Spin Coating System) | ACE-200 | |
| Sulfuric acid (H2SO4) |
Références
- Boldog, P. Risk assessment of novel coronavirus COVID-19 outbreaks outside China. Journal of Clinical Medicine. 9 (2), 571-583 (2020).
- Seo, G., et al. Rapid detection of COVID-19 causative virus (SARS-CoV-2) in human nasopharyngeal swab specimens using field-effect transistor-based biosensor. ACS Nano. 14 (4), 5135-5142 (2020).
- Panda, P. K. Structure-based drug designing and immunoinformatics approach for SARS-CoV-2. Science Advances. 6, 5135-5142 (2020).
- Li, R., et al. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV-2). Science Advances. 368, 489-493 (2020).
- Lu, R., et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 395 (10224), 565-574 (2020).
- Hui, D. S. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. Journal of Infectious Diseases. 91, 264-266 (2020).
- Chen, I. Y., et al. Upregulation of the chemokine (C-C motif) ligand 2 via a severe acute respiratory syndrome coronavirus spike-ACE2 signaling pathway. Journal of Virology. 84 (15), 7703-7712 (2010).
- Fung, T. S., Huang, M., Liu, D. X. Coronavirus-induced ER stress response and its involvement in regulation of coronavirus-host interactions. Virus Research. 194, 110-123 (2014).
- Park, S. E. Epidemiology, virology, and clinical features of severe acute respiratory syndrome -coronavirus-2 (SARS-CoV-2: Coronavirus Disease-19). Korean Journal of Pediatrics. 63 (4), 119-124 (2020).
- Fajnzylber, J., et al. SARS-CoV-2 viral load is associated with increased disease severity and mortality. Nature Communications. 11 (1), 5493 (2020).
- Rao, K., et al. Review on newly identified coronavirus and its genomic organization. SSR Institute of International Journal of Life Sciences. 6 (2), 2509 (2020).
- Mujawar, M. A., et al. Nano-enabled biosensing systems for intelligent healthcare: Towards COVID-19 management. Materials Today Chemistry. 17, 100306 (2020).
- Manickam, P., et al. Artificial intelligence (AI) and internet of medical things (IoMT) assisted biomedical systems for intelligent healthcare. Biosensors. 12 (8), 562-591 (2022).
- Kaushik, A. K., et al. Electrochemical SARS-CoV-2 sensing at point-of-care and artificial intelligence for intelligent COVID-19 management. ACS Applied Bio Materials. 3 (11), 7306-7325 (2020).
- Lee, D., Lee, J. Testing on the move: South Korea's rapid response to the COVID-19 pandemic. Transportation Research Interdisciplinary Perspectives. 5, 100111 (2020).
- Emery, S. L., et al. Real-time reverse transcription-polymerase chain reaction assay for SARS-associated coronavirus. Emerging Infectious Diseases. 10 (2), 311-316 (2004).
- Lu, X., et al. Real-time reverse transcription-PCR assay panel for Middle East respiratory syndrome coronavirus. Journal of Clinical Microbiology. 52 (1), 67-75 (2014).
- Mishra, S., et al. Tailored biofunctionalized biosensor for the label-free sensing of prostate-specific antigen. ACS Applied Bio Materials. 3 (11), 7821-7830 (2020).
- Wang, Y. L., et al. Detection of severe acute respiratory syndrome (SARS) coronavirus nucleocapsid protein using AlGaN/GaN high electron mobility transistors. ECS Transactions. 50 (6), 239-243 (2013).
- Ravi, N., Cortade, D. L., Ng, E., Wang, S. X. Diagnostics for SARS-CoV-2 detection: A comprehensive review of the FDA-EUA COVID-19 testing landscape. Biosensors and Bioelectronics. 165, 112454 (2020).
- Sethuraman, N., Jeremiah, S. S., Ryo, A. Interpreting diagnostic tests for SARS-CoV-2. JAMA. 323, 2249-2251 (2020).
- Timmer, W. C., Villalobos, J. M. . Chemistry Education. 70 (4), 273-280 (1993).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (5), 368-373 (2006).
- Drummond, T. G., Hill, M. G., Barton, J. K. Electrochemical DNA sensors. Nature Biotechnology. 21, 1192-1199 (2003).
- Singhal, C., Khanuja, M., Chaudhary, N., Pundir, C. S., Narang, J. Detection of chikungunya virus DNA using two-dimensional MoS2 nanosheets based disposable biosensor. Scientific Reports. 8, 7734 (2018).
- Sharma, P. K., et al. Ultrasensitive and reusable graphene oxide-modified double-interdigitated capacitive (DIDC) sensing chip for detecting SARS-CoV-2. ACS Sensors. 6 (9), 3468-3476 (2021).
- Sharma, P. K., et al. Ultrasensitive probeless capacitive biosensor for amyloid beta (Ab) detection in human plasma using interdigitated electrodes. Biosensors and Bioelectronics. 212, 114365 (2022).
- Wang, L., et al. A sensitive DNA capacitive biosensor using interdigitated electrodes. Biosensors and Bioelectronics. 87, 646-653 (2017).
- Brasil, P., et al. Zika virus infection in pregnant women in Rio de Janeiro. The New England Journal of Medicine. 375 (24), 2321-2334 (2016).
- Kong, J., et al. Molecular wires as chemical sensors. Science. 287 (5453), 622-625 (2000).
- Wang, J. Carbon-nanotube based electrochemical biosensors: A review. Electroanalysis. 17 (1), 7-14 (2005).
- Layqah, L. A., Eissa, S. An electrochemical immunosensor for the coronavirus associated with the Middle East respiratory syndrome using an array of gold nanoparticle-modified carbon electrodes. Microchimica Acta. 186 (4), 224-234 (2019).
- Vermisoglou, E., et al. Human virus detection with graphene-based materials. Biosensors and Bioelectronics. 166, 112436 (2020).
- Mostafavi, E., Dubey, A. K., Teodori, L., Ramakrishna, S., Kaushik, A. SARS-CoV-2 Oomicron variant: A next phase of the COVID-19 pandemic and a call to arms for system sciences and precision medicine. MedComm. 3 (1), 119 (2022).
- Ali, M. A., et al. Sensing of COVID-19 antibodies in seconds via aerosol jet printed three dimensional electrodes. Advanced Materials. 33 (7), 2006647 (2020).
- Ganbold, E., Sharma, P. K., Kim, E. -. S., Lee, D. -. N., Kim, N. -. Y. Capacitive humidity sensor with a rapid response time on a GO-doped P(VDF-TrFE)/LiCl composite for noncontact sensing applications. Chemosensors. 11 (2), 122 (2023).
- Shivani, T., et al. Antibacterial and antiviral high-performance nanosystems to mitigate new SARS-CoV-2 variants of concern. Current Opinion in Biomedical Engineering. 21, 100363 (2022).
- Kujawska, M., Mostafavi, E., Kaushik, A. SARS-CoV-2 getting into the brain; Neurological phenotype of COVID-19, and management by nano-biotechnology. Neural Regeneration Research. 18 (3), 519-520 (2022).
- Kang, P., Wang, M. C., Nam, S. Bioelectronics with two-dimensional materials. Microelectronic Engineering. 161, 18-35 (2016).
- Syama, S., Mohanan, P. V. Comprehensive application of graphene: Emphasis on biomedical concerns. Nano-Micro Letters. 11, 6 (2019).
- Chaudhary, V., Kaushik, A., Furukawa, H., Khosla, A. Review-Towards 5th generation AI and IoT driven sustainable intelligent sensors based on 2D MXenes and borophene. ECS Sensors Plus. 1, 013601 (2022).
- Sharma, P. K., et al. Perspectives on 2D-borophene flatland for smart bio-sensing. Materials Letters. 308, 131089 (2022).
- Sharma, P. K., Khondakar, K. R., Kaushik, A. K., et al. Nanotechnology and its application: A review. Nanotechnology in Cancer Management. Precise Diagnostics Toward Personalized Health Care. 1 (1), 1-33 (2021).
- Rawat, P., et al. Emergence of high-performing and ultra-fast 2D-graphene nano-biosensing system. Materials Letters. 308, 131241 (2022).
- Ganbold, E., et al. Highly sensitive interdigitated capacitive humidity sensors based on sponge-like nanoporous PVDF/LiCl composite for real-time monitoring. ACS Applied Materials & Interfaces. 15 (3), 4559-4568 (2023).
- Feng, J., Guo, Z. Wettability of graphene: From influencing factors and reversible conversions to potential applications. Nanoscale Horizons. 4, 339-364 (2019).
- Flynn, S. P., et al. qua-Art: A demonstration of hydrophilic and hydrophobic surfaces fabricated by plasma enhanced chemical vapor deposition. Chemical Education. 94 (2), 221-225 (2017).
- Bhardwaj, S. K., Yadav, P., Ghosh, S., Basu, T., Mahapatro, A. K. Biosensing test-bed using electrochemically deposited reduced graphene oxide. ACS Applied Materials & Interfaces. 8 (37), 24350-24360 (2016).
- Reddicherla, U., Seyed, M. G., Sonwal, S., Gokana, M. R., Yun, S. H. Portable electrochemical sensing methodologies for on-site detection of pesticide residues in fruits and vegetables. Coordination Chemistry Reviews. 453, 214305 (2022).
- Reddicherla, U., et al. Colorimetric based on-site sensing strategies for the rapid detection of pesticides in agricultural foods: New horizons, perspectives, and challenges. Coordination Chemistry Reviews. 446, 214061 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon