Method Article
Полная эндоскопическая хирургия резекции гамартомы гипоталамуса
В этой статье
Резюме
Гипоталамические гамартомы являются редкими, неопухолевыми врожденными пороками развития, возникающими в основном из нижнего гипоталамуса или трубчатого цинереума. Хирургическое лечение является одним из наиболее эффективных вариантов, и хирургический подход должен быть точно определен для каждого пациента. В данной статье мы опишем полноэндоскопическую технику резекции гипоталамических гамартом.
Аннотация
Гамартомы гипоталамуса (ГГ) являются редкими аномалиями развития нижнего гипоталамуса, которые часто вызывают рефрактерную эпилепсию, включая эластические припадки. Хирургическая резекция является эффективным методом лечения лекарственно-устойчивой эпилепсии и эндокринопатии в подходящей группе пациентов. Можно использовать открытую хирургию, эндоскопическую хирургию, абляционные процедуры и стереотаксическую радиохирургию. В данном исследовании мы стремились описать полноэндоскопический подход к резекции гипогонадного гипогонадизма. Метод включает в себя использование системы интраоперационной ультрасонографии (УЗИ), системы жесткого эндоскопа с углом наклона 30° наружным диаметром 2,7 мм с двумя рабочими каналами, стилета с внешним диаметром 3,8 мм, монополярного коагуляционного электрода, волоконно-оптического световода и эндозрительной системы. Микрощипцы и монополярная электрокоагуляция являются двумя основными хирургическими инструментами для удаления гипогонадизма. Протокол прост в применении после прохождения определенной кривой обучения и короче, чем открытые хирургические подходы. Это приводит к меньшей кровопотере. Полная эндоскопическая хирургия гипогонадотропного гипогонадотропного гипогонадотропного гипогонадизма является минимально инвазивным методом, который может быть применен безопасно и эффективно с хорошими судорожными и эндокринологическими исходами. Он обеспечивает низкую боль в области хирургического вмешательства и раннюю мобилизацию.
Введение
Гипоталамические гамартомы (ГГ) представляют собой неопухолевые, гетеротрофные ткани, которые содержат нейрональную и глиальную ткань в аномальном распределении. Уровень заболеваемости ГГ составляет 1 на 50 000-1 000 000 человек с преобладанием мужчин1. ГГ проявляются различными клиническими симптомами, такими как преждевременное половое созревание, когнитивные нарушения, поведенческие изменения и различные типы судорог, наиболее характерные для них эластические судороги. В большинстве случаев эластические припадки, как и другие типы припадков, чрезвычайно рефрактерны к противоэпилептическим препаратам (ПЭП)2,3.
Исходя из их морфологии и отношения к гипоталамусу, существует несколько классификаций гипогонадизма. Симптомы и тяжесть зависят в основном от размера, расположения, типа прикрепления и степени смещения гипоталамуса. Судороги и поведенческие, когнитивные и гормональные проблемы в основном возникают из-за сидячих ГГ. Педункулированные ГГ в основном вызывают преждевременное половое созревание 4,5,6.
Судороги можно контролировать хирургическим путем либо резекции, либо разъединения поражения. Наиболее благоприятные исходы были получены при почти тотальных или тотальных резекциях4. Основная цель – предотвратить распространение эпилептического взрыва и тем самым остановить вторичные генерализованные припадки. Открытая хирургия, будь то птериональный, транскаллозальный или трансвентрикулярный доступ, приводит к хорошим хирургическим результатам; Тем не менее, процент осложнений высок, до 30%. Лазерные и радиочастотные операции по разъединению на основе термокоагуляции, стереотаксическая радиохирургия и сфокусированный ультразвук также описываются как альтернативы открытой хирургии. Подход к лечению следует подбирать индивидуально, так как решающее значение имеет гипоталамическая область и близкие структуры 5,6,7.
Возможность того, что эндоскопический подход может привести к резекции HH, была впервые описана в 2003году8. Другие авторы также показали целесообразность эндоскопической резекции и операций по разъединению при гипогонадотропном гипогонадотропном гипогонадоартрите. Эти исследования привели нас к выводу, что, особенно при сидячих внутригипоталамических гипоталамических гипоталамических гипогонадизах, возможен полноэндоскопический подход 7,9,10,11. Хирургическими показаниями в основном являются неизлечимые с медицинской точки зрения эластические судороги, нейроповеденческое ухудшение и трудноизлечимая эндокринопатия. Потенциальными факторами риска для хирургического вмешательства в основном являются потеря памяти, эндокринопатия, поведенческие и когнитивные проблемы, а также потеря зрения. В связи с последними технологическими достижениями в нейроэндоскопии и хирургических инструментах, это исследование было направлено на описание нашей техники полного эндоскопического подхода для резекции гипогонадизма 3,12,13.
ПРЕЗЕНТАЦИЯ КЛИНИЧЕСКОГО СЛУЧАЯ:
15-летний мальчик родился в срок путем нормальных вагинальных родов. Первые приступы у пациента были 7 лет назад. Перинатальный анамнез был ничем не примечательным. Первые приступы характеризовались эластическими припадками; Однако уже через 2 года приступы изменили характер, приобретя тонизирующий тип. Частота приступов составляла 9-10 раз в сутки. При неврологическом обследовании выявлена умеренная умственная отсталость и отсутствовал неврологический дефицит. С начала приступов пациенту вводили карбамазепин, вальпроевую кислоту, фенобарбитал, ламотриджин, леветирацетам, клобазам в различных комбинациях. Но улучшения в его состоянии не произошло. Магнитно-резонансная томография (МРТ) выявила гамартому правого гипоталамуса. Рутинная электроэнцефалография (ЭЭГ) кожи головы показала активный эпилептогенный очаг в правой лобно-центральной и височной областях. Во время видео-ЭЭГ было зафиксировано 10 приступов. Электрографический разряд имел правостороннее происхождение. Иктальная и интериктальная однофотонная эмиссионная компьютерная томография (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ) не вносили вклада. Нейропсихологические тесты (НПТ) не проводились, так как пациент не был готов к сотрудничеству. У пациента не было эндокринологических проблем, таких как преждевременное половое созревание, и все гормональные параметры были в пределах нормы. Поскольку у пациента были неизлечимые с медицинской точки зрения судороги и умеренная умственная отсталость, было принято решение о хирургической резекции ГГ.
У пациента не было никаких осложнений после операции, а также он не испытывал несахарного диабета (НИ) или каких-либо других эндокринопатий. Офтальмологическое обследование было в норме, центральной гиперфагии или лихорадки не было. Пациентка была выписана на 5-е сутки послеоперационного периода. На25-м месяце после операции он находился под наблюдением без судорог, класс Энгеля 1. Контрольная МРТ через 2 года после операции показала отсутствие рецидива гипогонадотропного гипогонадотропного гипогонадизма. Пациент и его родственники заявили, что у пациента был более высокий уровень образования и когнитивных способностей; Тем не менее, тестирование в отношении нейрокогнитивных способностей не применялось.
протокол
Протокол исследования был одобрен институциональным наблюдательным советом медицинского факультета Стамбульского университета. Для участия в этом исследовании было получено информированное согласие пациентов.
1. Предоперационные процедуры
ПРИМЕЧАНИЕ: Предоперационная оценка аналогична оценке любого другого пациента с неизлечимой эпилепсией. Необходимо провести рутинный мониторинг электроэнцефалографии (ЭЭГ) кожи головы и видео-ЭЭГ, интериктальную и иктальную однофотонную эмиссионную компьютерную томографию (ОФЭКТ), магнитно-резонансную томографию (МРТ), нейропсихологический тест (НПТ), офтальмологическую оценку с периметрией и эндокринологическую оценку.
- Под общей эндотрахеальной анестезией уложите пациента в положение лежа на спине, согнув голову на трехзубом зажиме для головы Мэйфилда.
ПРИМЕЧАНИЕ: Пациенту могут быть назначены модификации на основе геля, если он моложе 18 месяцев. - Планируйте разрез на точке Кохера, которая находится на 3 см латеральнее средней линии и на 1 см впереди коронарного шва. Коронарный шов может быть очерчен с помощью пальпации.
ПРИМЕЧАНИЕ: Точка входа может быть отрегулирована с помощью системы интраоперационной ультрасонографии (iUSG) для оптимальной траектории к границе HH и границе нормальной ткани. Оптические или безрамочные электромагнитные нейронавигационные системы являются альтернативой iUSG для достижения правильной траектории. - Перед началом первичной хирургической процедуры установите систему iUSG с помощью зонда с отверстием для заусенцев. В большинстве случаев ГГ желудочки имеют нормальный размер. Размер желудочка можно увидеть на предоперационной МРТ.
- Отрегулируйте систему жесткого эндоскопа на 30° в соответствии с предпочтительным положением хирурга. Нейроэндоскоп имеет наружный диаметр 2,7 мм с двумя рабочими каналами. Тубус нейроэндоскопа имеет наружный диаметр 3,8 мм и стилет.
- Установите другие инструменты, такие как монополярный коагуляционный электрод, волоконно-оптический световод и эндозрительную систему.
- Продезинфицируйте место операции тампонами, смоченными в имеющемся в продаже растворе повидон-йода не менее 10 раз. Задрапируйте периаурикулярную область стерильными одеялами.
- Отрегулируйте параметры баланса белого и четкости камеры. Для проверки можно использовать любую стерильную белую повязку и стерильные письменные материалы.
2. Хирургическая техника
- Сделайте вертикальный надрез кожи размером примерно 3 см на острие Кохера с помощью лезвия с 20 номерами. После прохождения кожи, соединительной ткани и галеи сделайте надрез надкостницы. Поместите автоматический ретрактор, закрывающий кожу, подкожную клетчатку и надкостницу, чтобы обнажить кость. Войдите в правый желудочек, так как это недоминантное полушарие, если нет анатомических трудностей.
- Откройте отверстие для заусенцев диаметром 14 мм. Размер составляет 14 мм из-за использования iUSG, который подходит только для преобразователя с заусенцами.
- Расширьте отверстие заусенца медиально или латерально в соответствии с ультразвуковым изображением, визуализируя соответствующую траекторию к HH.
- Орошайте поле изотоническим раствором для четкой визуализации коронального разреза желудочков. Представьте чехол со стилетом на уровне отверстия Монро в виде короны.
- Извлеките стилет из тубуса, а затем введите эндоскоп.
- Под прямой визуализацией проведите эндоскоп через отверстие Монро. Визуализируйте ГГ, выступающий из пола и боковой стенки третьего желудочка. При прямом зрении обычно оцениваются границы выступающего гипогонадика и нормальной ткани.
- Коагулируют очаг поражения путем монополярного прижигания, вводимого из рабочего канала. Удалите очаг поражения с помощью микрощипцов. Продолжайте рассекать до тех пор, пока не будут достигнуты пиальная и паутинная мембраны. Полная резекция и разъединение могут быть подтверждены с помощью послеоперационной МРТ.
- Добиться гемостаза можно с помощью орошения изотоническим солевым раствором или монополярной коагуляции. Массивное кровотечение обычно не происходит; в случае возникновения может потребоваться оставление наружного желудочкового дренажа (БВВЭ) или переход к открытой микроскопической хирургии.
- После гемостаза завершите процедуру удалением эндоскопической системы. Сшить подкожную клетчатку 3-0 Викрилом и кожу 3-0 проленом.
3. Послеоперационные процедуры и последующее наблюдение
- Начните пероральный прием через 6 ч после операции. Мобилизуйте пациентов на следующий день после операции.
- Наблюдайте за пациентом сразу после операции на предмет ранних осложнений, таких как преходящая потеря памяти, увеличение веса, инфаркт таламуса и гипоталамуса, несахарный диабет, гипофизарная недостаточность и нарушения зрения.
ПРИМЕЧАНИЕ: Эндоскоп может вызвать повреждение свода, зрительного нерва и тракта, а также гипоталамуса. Монополярное прижигание может вызвать аналогичное разрушение за счет теплового эффекта. - Следите за балансом потребления и вывода пациента. Попросите пациента и его родственников записать количество жидкости, потребляемой каждым пациентом, и рассчитать диурез. Если у пациента имеется гипофизарная недостаточность, следует применять заместительную терапию гидрокортизоном.
- Продолжайте прием противоэпилептических препаратов (ПЭП) до тех пор, пока не будет установлено адекватное последующее наблюдение. ПЭП может быть уменьшен в зависимости от статуса исхода припадка и контрольной электроэнцефалограммы (ЭЭГ).
- После выписки наблюдайте пациента на 2-й неделе,1-м месяце,3-м месяце и6-м месяце.
Результаты
Представлен пример пациента, получавшего полное эндоскопическое лечение по поводу резекции ГГ. Предоперационная МРТ, интраоперационная эндоскопическая проекция и послеоперационная МРТ показаны на рисунках 1, 2 и 3. Кровопотеря во время процедуры была минимальной, поэтому ее невозможно было измерить. Процедура короткая для хирурга, имеющего опыт в нейроэндоскопии. В рассматриваемом случае продолжительность операции составила 52 мин. Метод требует лишь небольшого разреза, быстрого послеоперационного восстановления и скорейшего возвращения к работе. Пациент обычно выписывается на 1-е сутки после операции, если не возникает осложнений. Поскольку это операция по резекции и разъединению, хорошие результаты судорог достигаются в раннем послеоперационном периоде.
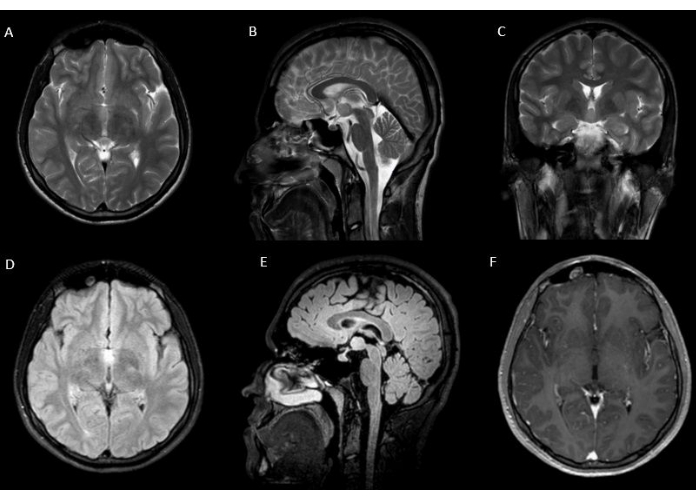
Рисунок 1: Предоперационные изображения поражения. На предоперационных изображениях T2 (A) аксиального, (B) сагиттального, (C) коронального, (D) T2 FLAIR аксиального и (E) сагиттального изображения видно поражение размером 8 x 11 x 14 мм, расположенное в нижнем третьем желудочке, выступающем из правой области гипоталамуса. (F) Поражение не усиливается при введении гадолиния. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
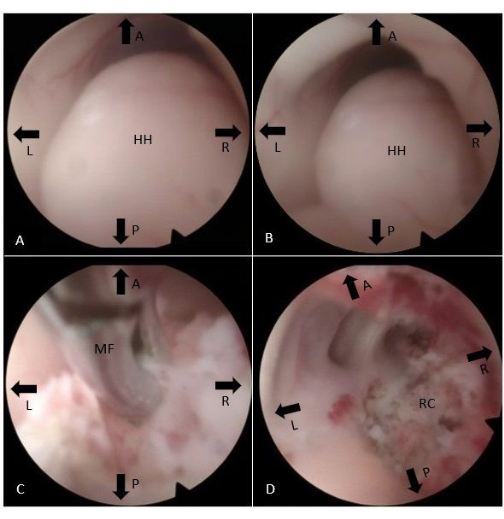
Рисунок 2: Эндоскопический интраоперационный обзор. (A, B) Виден HH, выпячивающийся в третий желудочек с правой стороны. (В) Монополярное прижигание и микрощипцы используются для рассечения и отсоединения ГГ от гипоталамического тела. (D) В конце процедуры визуализируется резекционная полость. Сокращения: a = передний, p = задний, l = левый, r = правый, HH = гипоталамическая гамартома, MF = микрощипцы, RC = резекционная полость. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
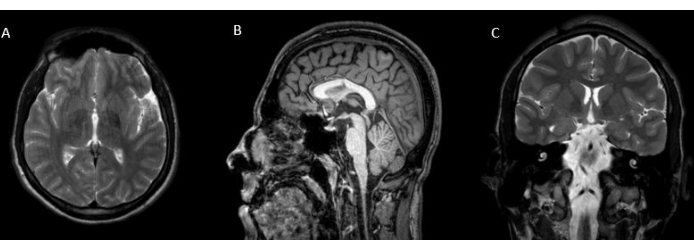
Рисунок 3: Послеоперационные изображения поражения. Послеоперационные T2 (A) аксиальные, (B) T2 сагиттальные и (C) корональные изображения показывают полную резекцию и разъединение гипогонадина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В 2003 году Делаланд классифицировал ГГ на четыре подтипа. ГГ 1-го типа представляют собой небольшие ножчатые поражения, прикрепленные к цинерее бугра, ГГ 2-го типа представляют собой поражения, выступающие в третий желудочек, ГГ 3-го типа представляют собой комбинацию ГГ 1-го и 2-го типов, а ГГ 4-го типа представляют собой крупные поражения с широким прикреплением к обоим органам молочной железы и гипоталамусу и имеют расширение до межножечнойцистерны8. В зависимости от локализации ГГ были описаны различные подходы к открытой хирургии. Для ГГ вблизи межножечной цистерны возможен птериональный доступ, а для поражений вблизи третьего желудочка – трансвентрикулярный или транскаллозальный доступы. Риск осложнений увеличивается, если поражение прикрепляется к молочным тельцам и цинерее клубней. Разрушение тел молочной железы может вызвать нейропсихологические эффекты, а трубчатый цинереум может привести к плохим эндокринологическим исходам12.
Птериональный подход представляет собой короткий и прямой путь к супраселлярной цистерне; Однако доступ к третьему желудочку ограничен, а близость внутренней сонной артерии и ветвей, зрительного нерва и хиазмы, третьего черепного нерва и инфундибулума делает хирургические маневры более ограниченными 8,14. В связи с этими ограничениями для пациентов Делаланда типа 2 и 4 HHs15 используются трансвентрикулярный и транскаллезальный доступы. Тем не менее, отчеты показали повышенный риск ухудшения памяти при использовании этого метода. Дефицит памяти в основном связан с повреждением форнице при транскаллозальном межжелудочковом доступе и разрушением тела молочной железы при трансвентрикулярном доступе16,17.
Стереотаксическая радиохирургия с помощью Гамма-ножа является еще одной альтернативой лечения гипогонадизма. Несмотря на отсроченное действие радиохирургии, сообщалось о многообещающих результатах. Медиана числа приступов снизилась с 6,2 до 0,3. Медиана предельной дозы составила 17 Гр (от 13 до 26)19,20,21,22. Стереотаксическая лазерная интерстициальная термотерапия (ЛИТТ) является еще одним вариантом лечения, включающим стереотаксическую установку лазерного зонда. В литературе показано, что, независимо от размера ГГ, стереотаксическая ЛИТТ снижает заболеваемость по сравнению с открытой операцией 23,24,25. В недавних исследованиях было предложено проводить радиочастотную термокоагуляцию (РФ-ТС) под контролем стереоэлектроэнцефалографии (СЭЭГ). Это позволяет одновременно применять RF-TC во время записи, тем самым обеспечивая более точное поражение26,27.
В данной технической записке описан полноэндоскопический подход к ГГ. Этот метод также является столь же малоинвазивным, как и стереотаксический подход. Кроме того, он не требует применения стереотаксической системы и наведения на цель методом слияния с МРТ. Пункция желудочков может быть легко выполнена с помощью интраоперационной системы УЗИ. Он не требует предоперационной подготовки, а значит, является быстрым. Возможна прямая визуализация ГГ, а резекция поражения возможна, несмотря на лазерную абляцию или термокоагуляцию. Ранние приступы и эндокринологические улучшения обычно оцениваются 7,10,24. Он лучше всего подходит для Delalande тип 2 HHs10. Кроме того, Choi et al. описали важность хирургии разъединения при лечении гипогонадмагистотропного гипогонадизма. Они показали, что большинство внутрижелудочковых и других типов ГГ являются отличными кандидатами для эндоскопической хирургии. Они показали, что 90% пациентов имели более чем 50% контроля над приступами после операции. Несмотря на резецированный объем, отключение считается более критичным. Таким образом, даже для более крупных HH, операция по разъединению может быть выполнена в отдельных случаях 5,28,29. Однако, несмотря на свои преимущества, полноэндоскопическая методика имеет ограничения. Обычно это нецелесообразно при поражениях, которые распространяются на межножечную цистерну. Он несет такой же риск поражений, прикрепленных к телам молочной железы и трубочному цинереуму11. В послеоперационном периоде возможна досрочная мобилизация и возвращение к работе.
В заключение, хирургические методы должны быть выбраны в соответствии с местоположением ГГ и адаптированы для каждого пациента. Полная эндоскопическая резекция гипогонадотропного гипогонадизма является безопасным и эффективным подходом, особенно при поражениях, распространяющихся на третий желудочек. Разрыв связи должен учитываться при каждой операции и является более важным, чем частота резекции. Судороги и эндокринологические исходы аналогичны другим методам. Это минимально инвазивный метод, который обеспечивает короткое пребывание в больнице и раннее обретение функционального статуса.
Раскрытие информации
Авторы не сообщают о конфликте интересов в отношении материалов или методов, использованных в данном исследовании.
Благодарности
Источника финансирования для этого исследования нет.
Материалы
| Name | Company | Catalog Number | Comments |
| Burr-hole probe of intraoperative ultrasound system | Hitachi | UST-52114P | Aloka Linear UST-52114P, Frequency Range: 8 – 3 MH, Scan Angle: 90° FOV |
| Fiberoptic light guide | RiwoSpine | 806635231 | 80663523 fiber light cable Ø 3.5 mm, TL 2.3 m, 8095.09 adaptor endoscope side, 8095.07 adaptor projector side |
| Intraoperative Ultrasound system | Hitachi | Hitachi Arietta 70, Tokyo, Japan | |
| Microforceps | RiwoSpine | 89240.3023 | |
| Monopolar-coagulating electrode | RiwoSpine | 8922095000 | |
| Rigid neuroendoscope | Karl Storz | 8921092051 | 30° Hopkins pediatric telescope, outside diameter 2.7 mm |
| Sheath for the telescope | Karl Storz | 892209510 | 3.8 mm outside diameter with two working channels |
Ссылки
- Kerrigan, J. F., et al. Hypothalamic hamartoma: Neuropathology and epileptogenesis. Epilepsia. 58, 22-31 (2017).
- Gascon, G. G., Lombroso, C. T. Epileptic (Gelastic) Laughter. Epilepsia. 12, 63-76 (1971).
- Berkovic, S. F., et al. Hypothalamic hamartoma and seizures: a treatable epileptic encephalopathy. Epilepsia. 44 (7), 969-973 (2003).
- Wait, S. D., Abla, A. A., Killory, B. D., Nakaji, P., Rekate, H. L. Surgical approaches to hypothalamic hamartomas. Neurosurg Focus. 30 (2), E2 (2011).
- Choi, J. U., et al. Endoscopic disconnection for hypothalamic hamartoma with intractable seizure. Report of four cases. J Neurosurg. 100, 506-511 (2004).
- Shim, K. W., et al. Treatment modality for intractable epilepsy in hypothalamic hamartomatous lesions. Neurosurgery. 62 (4), 847-856 (2008).
- Shim, K. W., Park, E. K., Kim, D. S. Endoscopic treatment of hypothalamic hamartomas. J Korean Neurosurg Soc. 60 (3), 294-300 (2017).
- Delalande, O., Fohlen, M. Disconnecting surgical treatment of hypothalamic hamartoma in children and adults with refractory epilepsy and proposal of a new classification. Neurol Med Chir (Tokyo). 43 (2), 61-68 (2003).
- Valdueza, J. M., et al. Hypothalamic hamartomas: with special reference to gelastic epilepsy and surgery. Neurosurgery. 34 (6), 949-958 (1994).
- Chibbaro, S., et al. Pure endoscopic management of epileptogenic hypothalamic hamartomas. Neurosurg Rev. 40 (4), 647-653 (2017).
- Ng, Y. T., et al. Endoscopic resection of hypothalamic hamartomas for refractory symptomatic epilepsy. Neurology. 70, 1543-1548 (2008).
- Bourdillon, P., et al. Surgical treatment of hypothalamic hamartomas. Neurosurg Rev. 44 (2), 753-762 (2021).
- Feiz-Erfan, I., et al. Surgical strategies for approaching hypothalamic hamartomas causing gelastic seizures in the pediatric population: transventricular compared with skull base approaches. J Neurosurg. 103, 325-332 (2005).
- Dorfmüller, G., Fohlen, M., Bulteau, C., Delalande, O. Surgical disconnection of hypothalamic hamartomas. Neurochirurgie. 54, 315-319 (2008).
- Ng, Y. T., et al. Endoscopic resection of hypothalamic hamartomas for refractory symptomatic epilepsy. Neurology. 70 (17), 1543-1548 (2008).
- Rosenfeld, J. V., Freeman, J. L., Harvey, A. S. Operative technique: The anterior transcallosal transseptal interforniceal approach to the third ventricle and resection of hypothalamic hamartomas. J Clin Neurosci. 11 (7), 738-744 (2004).
- Rosenfeld, J. V., Feiz-Erfan, I. Hypothalamic hamartoma treatment: surgical resection with the transcallosal approach. Semin Pediatr Neurol. 14 (2), 88-98 (2007).
- Ng, Y. T., et al. Transcallosal resection of hypothalamic hamartoma for intractable epilepsy. Epilepsia. 47 (7), 1192-1202 (2006).
- Castinetti, F., Brue, T., Morange, I., Carron, R., Régis, J. Gamma Knife radiosurgery for hypothalamic hamartoma preserves endocrine functions. Epilepsia. 58, 72-76 (2017).
- Akai, T., Okamoto, K., Iizuka, H., Kakinuma, H., Nojima, T. Treatments of hamartoma with neuroendoscopic surgery and stereotactic radiosurgery: a case report. Minim Invasive Neurosurg. 45 (4), 235-239 (2002).
- Abla, A. A., et al. Gamma Knife surgery for hypothalamic hamartomas and epilepsy: patient selection and outcomes. J Neurosurg. 113, 207-214 (2010).
- Selch, M. T., et al. Linear accelerator stereotactic radiosurgery for the treatment of gelastic seizures due to hypothalamic hamartoma. Minim Invasive Neurosurg. 48 (5), 310-314 (2005).
- Hoppe, C., Helmstaedter, C. Laser interstitial thermotherapy (LiTT) in pediatric epilepsy surgery. Seizure. 77, 69-75 (2020).
- Calisto, A., et al. Endoscopic disconnection of hypothalamic hamartomas: safety and feasibility of robot-assisted, thulium laser-based procedures. J Neurosurg Pediatr. 14 (6), 563-572 (2014).
- Curry, D. J., Raskin, J., Ali, I., Wilfong, A. A. MR-guided laser ablation for the treatment of hypothalamic hamartomas. Epilepsy Res. 142, 131-134 (2018).
- Wei, P. H., et al. Stereoelectroencephalography-guided radiofrequency thermocoagulation for hypothalamic hamartomas: Preliminary evidence. World Neurosurg. 114, e1073-e1078 (2018).
- Bourdillon, P., et al. Stereo electroencephalography-guided radiofrequency thermocoagulation (SEEG-guided RF-TC) in drug-resistant focal epilepsy: Results from a 10-year experience. Epilepsia. 58 (1), 85-93 (2017).
- Wethe, J. V., et al. Cognitive functioning before and after surgical resection for hypothalamic hamartoma and epilepsy. Neurology. 81 (12), 1044-1050 (2013).
- Choi, J. U., Kim, D. S. Treatment modalities for intractable epilepsy in hypothalamic hamartoma. Adv Tech Stand Neurosurg. 39, 117-130 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены