Method Article
視床下部過誤腫切除術の全内視鏡手術
要約
視床下部過誤腫は、主に視床下部または塊茎から発生するまれな非腫瘍性先天性奇形です。外科的治療は最も効果的な選択肢の1つであり、外科的アプローチは患者ごとに正確に決定する必要があります。ここでは、視床下部過誤腫を切除するための完全内視鏡技術について説明します。
要約
視床下部過誤腫 (HH) は、下視床下部のまれな発達異常であり、しばしば難治性てんかんを引き起こします これには、弾性発作が含まれます。外科的切除は、薬剤耐性てんかんや内分泌障害を適切な患者群で治療するための有効な方法です。開腹手術、内視鏡手術、切除術、定位放射線手術などが利用できます。本研究では、HH切除術の完全内視鏡的アプローチについて述べることを目指した。この技術には、術中超音波検査(USG)システム、外径2.7mm、2つの作業チャネルを持つ30°硬性内視鏡システム、外径3.8mmのスタイレット、モノポーラ凝固電極、光ファイバーライトガイド、およびエンドビジョンシステムの使用が含まれます。マイクロ鉗子とモノポーラ電気焼灼は、HH除去のための2つの主要な手術器具です。このプロトコルは、特定の学習曲線を通過した後でも簡単に適用でき、開腹手術のアプローチよりも短くなります。それはより少ない失血につながります。HHの完全内視鏡手術は、安全かつ効果的に適用でき、良好な発作と内分泌学的転帰をもたらす低侵襲技術です。手術部位の痛みを軽減し、早期の動員を実現します。
概要
視床下部過誤腫(HH)は、ニューロン組織とグリア組織を異常な分布で含む非腫瘍性の従属栄養組織です。HHの発生率は、男性が優勢な50,000〜1,000,000人に1人です1。HHは、思春期早発症、認知障害、行動の変化、さまざまな種類の発作、最も特徴的な弾性発作など、さまざまな臨床症状を示します。ほとんどの弾性発作は、他のタイプの発作と同様に、抗てんかん薬(AED)に対して非常に抵抗性です2,3。
それらの形態と視床下部との関係に基づいて、HHにはいくつかの分類があります。症状と重症度は、主に視床下部変位のサイズ、場所、付着タイプ、および程度によって異なります。発作や行動、認知、ホルモンの問題は、主に無茎性HHsに起因します。有茎性HHsは主に思春期早発症を引き起こします4,5,6。
発作は、病変の切除または切断のいずれかによって外科的に制御することができます。最も良好な結果は、ほぼ全切除または全切除から得られました4。主な目標は、てんかん性バーストの広がりを防ぎ、二次的な全般性発作を止めることです。開腹手術は、翼状、経神経蓋、または経心室アプローチのいずれかで、良好な手術結果をもたらします。しかし、合併症の発生率は高く、最大30%です。レーザーおよび高周波熱凝固術に基づく切断手術、定位放射線手術、および集束超音波も、開腹手術の代替手段として説明されています。視床下部領域と密接な構造が重要であるため、治療アプローチは個別に選択する必要があります5,6,7。
内視鏡的アプローチがHH切除を達成できる可能性は、2003年に最初に説明されました8。他の著者も、HHに対する内視鏡的切除および切断手術の実現可能性を示しています。これらの研究により、特に無茎性視床下部HHでは、完全内視鏡的アプローチが可能であると私たちは信じるようになりました7,9,10,11。外科的適応は、主に医学的難治性弾性発作、神経行動学的悪化、難治性内分泌障害です。手術の潜在的な危険因子は、主に記憶喪失、内分泌障害、行動的および認知的問題、および視力喪失です。神経内視鏡検査および手術器具の最近の技術的進歩に伴い、この研究は、HH切除3,12,13のための完全内視鏡的アプローチの技術を説明することを目的としています。
ケースプレゼンテーション:
15歳の男の子が正期産で正常な経腟分娩で生まれた。この患者さんは7年前に初めて発作を起こしました。周産期の病歴は目立たなかった。最初の発作は、弾力性発作によって特徴付けられました。しかし、2年後には発作が性格を変え、強壮剤タイプになりました。発作頻度は1日9-10回であった。神経学的検査では、中等度の精神遅滞が認められ、神経学的欠損は認められませんでした。発作の初めから、患者にはカルバマゼピン、バルプロ酸、フェノバルビタール、ラモトリギン、レベチラセタム、およびクロバザムをさまざまな組み合わせで投与されました。.しかし、彼の状態は改善しませんでした。磁気共鳴画像法(MRI)により、右視床下部の過誤腫が明らかになりました。定期的な頭皮脳波計 (EEG) では、右前頭中心領域と側頭領域に活発なてんかん原性の焦点が示されました。ビデオ脳波検査では、10回の発作が記録されました。電位放電は右側起源を示しました。発作期および発作間期の単一光子放出型コンピュータ断層撮影法(SPECT)および陽電子放出断層撮影法(PET)は寄与しませんでした。神経心理学的検査(NPT)は、患者が協力的ではなかったため、実施されなかった。患者は思春期早発症などの内分泌学的問題を抱えておらず、すべてのホルモンパラメータは正常範囲内にありました。内科的に難治性発作を呈し、中等度の精神遅滞を呈したため,HHの外科的切除が決定された。
手術後の合併症はなく、尿崩症(DI)やその他の内分泌障害もありませんでした。眼科検査は正常で、中枢性過食症や発熱はありませんでした。患者は術後5日目に退院しました。手術後25ヶ月目 で、発作のないエンゲルクラス1のフォローアップを受けました。術後2年の対照MRIでは、HHの再発は示されませんでした。患者とその親族は、患者の教育レベルと認知力が優れていると述べました。しかし、神経認知に関するテストは適用されませんでした。
プロトコル
研究プロトコルは、イスタンブール大学医学部の治験審査委員会によって承認されました。この研究では、患者からインフォームド コンセントが得られました。
1. 術前処置
注:術前評価は、他の医学的に難治性てんかん患者と同様です。定期的な頭皮脳波計 (EEG) モニタリングとビデオ脳波モニタリング、発作間欠および発作期の単一光子放出型コンピューター断層撮影法 (SPECT)、磁気共鳴画像法 (MRI)、神経心理学的検査 (NPT)、視野測定による眼科的評価、および内分泌学的評価を完了する必要があります。
- 全身気管内麻酔下で、患者を仰臥位に置き、頭を曲げて3本柱のメイフィールドヘッドクランプに置きます。.
注:患者は、18か月未満の場合、ゲルベースの修飾を行うことができます。 - 正中線から 3 cm 横、冠状縫合糸から 1 cm 前方にある Kocher のポイントで切開を計画します。冠状縫合糸は触診によって輪郭を描くことができます。
注:エントリーポイントは、術中超音波検査(iUSG)システムを使用して調整でき、HHインターフェースと正常組織インターフェースへの最適な軌道を得ることができます。光学式またはフレームレスの電磁ニューロナビゲーションシステムは、適切な軌道を達成するためのiUSGの代替品です。 - 一次手術を開始する前に、バリ穴プローブを使用してiUSGシステムをセットします。HHのほとんどの症例は、正常なサイズの心室を持っています。心室のサイズは、術前のMRIで見ることができます。
- 30°硬性内視鏡システムは、外科医の好みの位置に合わせて調整します。神経内視鏡の外径は2.7mmで、2つのワーキングチャンネルがあります。神経内視鏡のシースの外径は3.8mmで、スタイレットが付いています。
- モノポーラ凝固電極、光ファイバーライトガイド、エンドビジョンシステムなどの他の機器を設定します。
- 市販のポビドンヨード溶液に少なくとも10x浸した綿棒で手術部位を消毒します。耳介周囲領域を滅菌毛布で覆います。
- ホワイトバランスとカメラの鮮明度オプションを調整します。滅菌済みの白いドレッシングと滅菌済みの筆記資料をチェックに使用できます。
2.手術手技
- 20番のブレードを使用して、コッヘルの先端に約3cmの垂直な皮膚切開を行います。皮膚、結合組織、および前庭を通過した後、骨膜を切開します。皮膚、皮下組織、骨膜を覆う自動リトラクターを配置して、骨を露出させます。解剖学的困難がない限り、右心室は非支配的な半球であるため、右心室に入ります。
- 直径14mmのバリ穴を開けます。サイズは、バリ穴プローブにのみ適合するiUSGを使用しているため、14mmです。
- 超音波画像に従ってバリ穴を内側または横方向に拡張し、HHへの適切な軌道を視覚化します。
- 等張性生理食塩水でフィールドを灌漑し、心室の冠状部分を明確に視覚化します。コロナルビューでモンローの孔のレベルでスタイレット付きのシースを紹介します。
- シースからスタイレットを取り外してから、内視鏡を導入します。
- 直接視覚化の下で、内視鏡をモンローの孔を通して進めます。床から突き出たHHと第3脳室の側壁を視覚化します。直視は通常、突き出たHHと正常組織の限界を評価します。
- 作業チャネルから導入された単極性焼灼によって病変を凝固させます。マイクロ鉗子で病変を取り除きます。軟膜とくも膜に到達するまで解剖を続けます。完全な切除と切断は、術後MRIで確認できます。
- 等張生理食塩水または単極性凝固による灌漑により止血を達成します。通常、大量の出血は発生しません。万が一の事態が発生した場合、外部心室ドレナージ(EVD)を退出するか、開腹顕微鏡手術への転換が必要になることがあります。
- 止血後、内視鏡システムを取り外して手順を完了します。皮下組織を3-0 Vicrylで縫合し、皮膚を3-0プロレンで縫合します。
3. 術後の処置とフォローアップ
- 術後6時間で経口摂取を開始します。手術の翌日に患者を動員します。
- 手術直後の患者様に、一過性記憶喪失、体重増加、視床・視床下部梗塞、尿崩症、下垂体機能不全、視覚障害などの早期合併症がないかモニタリングします。
注:内視鏡は、円蓋、視交叉と視交叉管、視床下部に損傷を与える可能性があります。単極性焼灼は、熱効果を通じて同様の破壊を引き起こす可能性があります。 - 患者の摂取量と出力のバランスを監視します。患者と親戚に、すべての患者の水分摂取量を書き留め、尿量を計算するように依頼します。患者が下垂体機能不全を患っている場合は、ヒドロコルチゾン補充療法を適用する必要があります。.
- 適切なフォローアップが確立されるまで、抗てんかん薬(AED)を継続します。AEDは、発作の結果に応じて減らし、脳波(EEG)を制御することができます。
- 退院後、2 週目、1 か月目 、3 か月目 、6 か月目に 患者をフォローアップします。
結果
HH切除のための完全内視鏡的アプローチによって治療された患者の例が提示されました。術前MRI、術中内視鏡図、術後MRIを図1、図2、図3に示します。手術中の出血は最小限であったため、測定できませんでした。この手順は、神経内視鏡検査の経験を積んだ外科医の略です。表現されたケースでは、操作時間は52分でした。この方法では、小さな切開、術後の迅速な回復、および早期の職場復帰のみが必要です。合併症に遭遇しなければ、患者は通常、術後1日目に退院します。切除・切断手術であるため、術後早期に良好な発作結果が得られます。
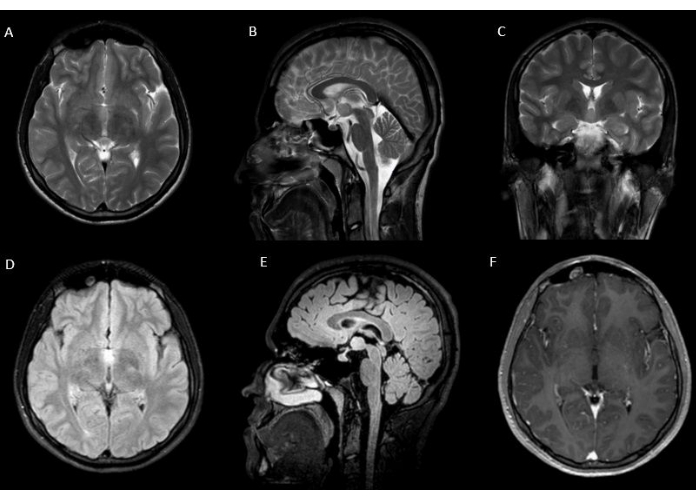
図1:病変の術前画像。 術前の T2 (A) 軸方向、(B) 矢状、(C) 冠状、(D) T2 FLAIR 軸方向、および (E) 矢状画像は、右視床下部領域から突き出た下第三脳室に位置する 8 x 11 x 14 mm の病変を示しています。(F)病変はガドリニウム投与で増強されません。. この図の拡大版を表示するには、ここをクリックしてください。
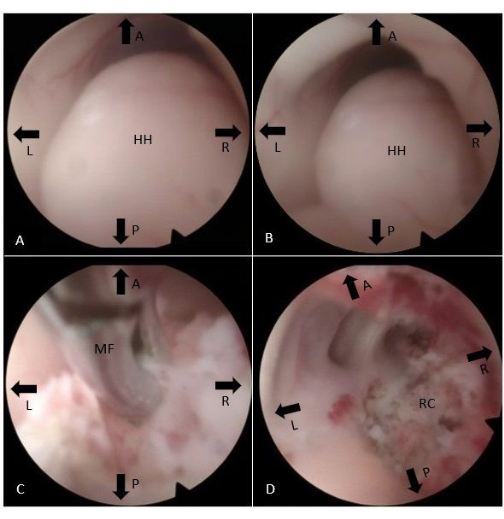
図2:内視鏡的術中図(A、B)右側から第3脳室に膨らんだHHが見られます。(C)単極性焼灼器と微小鉗子は、視床下部の体からHHを解剖して切断するために使用されます。(D) 切除腔は、手順の最後に視覚化されます。略語:A =前部、P =後部、L =左、R =右、HH =視床下部過誤腫、MF =微小鉗子、RC =切除腔。この図の拡大版を表示するには、ここをクリックしてください。
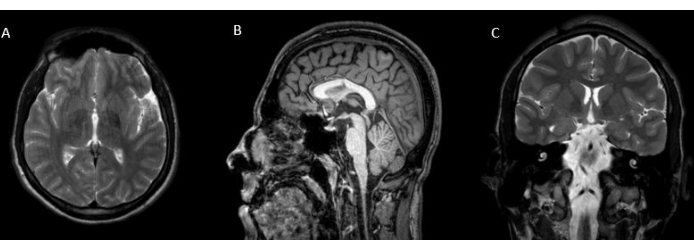
図3:病変の術後画像。 術後 T2 (A) 軸方向、(B) T2 FLAIR 矢状、および (C) 冠状画像は、HH の全切除と切断を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
2003年、DelalandeはHHを4つのサブタイプに分類しました。1型HHは塊茎状骨に付着した小さな脚状病変、2型HHは第3脳室に突出する病変、3型は1型と2型を組み合わせたもの、4型HHは乳頭体と視床下部の両方に広く付着し、脚間槽8に延長した大きな病変である.HHの位置に応じて、さまざまな開腹手術のアプローチが説明されています。脚間槽付近のHHsには翼状アプローチ、第3脳室付近の病変には経心室アプローチまたは経脳梁アプローチが可能です。病変が乳頭体と塊茎シネリウムに付着している場合、合併症のリスクが増加します。乳頭体の破壊は神経心理学的影響を引き起こす可能性があり、塊茎シネレウムは内分泌学的転帰不良を引き起こす可能性があります12。
プテリオナルアプローチは、上槽への短くて直接的なルートです。しかし、第3脳室へのアクセスは限られており、内頸動脈と枝、視神経、視交叉、第3脳神経、およびインファンディブルムの近くでは、手術操作がより制限されています8,14。これらの制限により、経心室および経脳梁アプローチは、Delalande タイプ 2 および 4 の HHs15 に使用されます。しかし、この手法による記憶障害のリスクが増加するという報告がありました。記憶障害は、主に経脳梁間アプローチ中の乳頭損傷と経脳室アプローチ中の乳頭体の破壊に起因します16,17。
ガンマナイフによる定位放射線手術は、HHの別の治療法です。放射線手術の作用が遅れているにもかかわらず、有望な結果が報告されています。発作回数の中央値は6.2回から0.3回に減少しました。限界線量中央値は17Gy(13〜26)19,20,21,22であった。定位レーザー間質温熱療法(LITT)は、レーザープローブの定位留置を含む別の治療オプションです。文献では、HH のサイズに関係なく、定位 LITT は開腹手術 23,24,25 と比較して罹患率を低下させることが示されています。最近の研究では、立体脳波法(SEEG)ガイド下高周波熱凝固法(RF-TC)が提案されています。これにより、記録中にRF-TCを同時に適用できるため、より正確な病変26,27が得られます。
このテクニカルノートでは、HHに対する完全内視鏡的アプローチについて説明します。この手法は、定位アプローチと同じくらい低侵襲性でもあります。また、定位システムの適用やMRIとの融合によるターゲティングも必要ありません。心室穿刺は、術中USGシステムによって容易に達成することができます。術前の準備が不要なため、迅速です。HHの直接視覚化が可能であり、レーザーアブレーションまたは熱凝固にもかかわらず病変切除が可能です。早期発作と内分泌学的改善は通常評価されます7,10,24。これは、Delalandeタイプ2 HHs10に最適です。さらに、Choiらは、HHの治療における切断手術の重要性について説明しました。彼らは、ほとんどの脳室内およびその他のタイプのHHが内視鏡手術の優れた候補であることを示しました。その結果、90%の患者が手術後に50%以上の発作コントロールを持っていたことが明らかになりました。切除された量にもかかわらず、切断はより重要であると考えられています。したがって、より大きなHHの場合でも、選択された症例5,28,29に対して切断手術を行うことができます。ただし、その利点にもかかわらず、完全内視鏡技術には制限があります。通常、脚間槽に広がる病変には対応できません。乳頭体や塊茎に付着した病変についても同じリスクがあります11。術後の期間では、早期の動員と仕事への復帰が可能です。
結論として、手術技術はHHの位置に応じて決定し、患者ごとに調整する必要があります。HHの全内視鏡的切除は、特に第3脳室に広がる病変において、安全で効果的なアプローチです。切断は各手術で考慮されるべきであり、切除率よりも重要です。発作と内分泌学的転帰は、他の技術と同様です。これは、短期間の入院と機能状態の早期獲得を可能にする低侵襲技術です。
開示事項
著者らは、この研究で使用された材料または方法に関して利益相反はないと報告しています。
謝辞
この研究のための資金源はありません。
資料
| Name | Company | Catalog Number | Comments |
| Burr-hole probe of intraoperative ultrasound system | Hitachi | UST-52114P | Aloka Linear UST-52114P, Frequency Range: 8 – 3 MH, Scan Angle: 90° FOV |
| Fiberoptic light guide | RiwoSpine | 806635231 | 80663523 fiber light cable Ø 3.5 mm, TL 2.3 m, 8095.09 adaptor endoscope side, 8095.07 adaptor projector side |
| Intraoperative Ultrasound system | Hitachi | Hitachi Arietta 70, Tokyo, Japan | |
| Microforceps | RiwoSpine | 89240.3023 | |
| Monopolar-coagulating electrode | RiwoSpine | 8922095000 | |
| Rigid neuroendoscope | Karl Storz | 8921092051 | 30° Hopkins pediatric telescope, outside diameter 2.7 mm |
| Sheath for the telescope | Karl Storz | 892209510 | 3.8 mm outside diameter with two working channels |
参考文献
- Kerrigan, J. F., et al. Hypothalamic hamartoma: Neuropathology and epileptogenesis. Epilepsia. 58, Suppl 2 22-31 (2017).
- Gascon, G. G., Lombroso, C. T. Epileptic (Gelastic) Laughter. Epilepsia. 12, 63-76 (1971).
- Berkovic, S. F., et al. Hypothalamic hamartoma and seizures: a treatable epileptic encephalopathy. Epilepsia. 44 (7), 969-973 (2003).
- Wait, S. D., Abla, A. A., Killory, B. D., Nakaji, P., Rekate, H. L. Surgical approaches to hypothalamic hamartomas. Neurosurg Focus. 30 (2), E2(2011).
- Choi, J. U., et al. Endoscopic disconnection for hypothalamic hamartoma with intractable seizure. Report of four cases. J Neurosurg. 100, 5 Suppl Pediatrics 506-511 (2004).
- Shim, K. W., et al. Treatment modality for intractable epilepsy in hypothalamic hamartomatous lesions. Neurosurgery. 62 (4), 847-856 (2008).
- Shim, K. W., Park, E. K., Kim, D. S. Endoscopic treatment of hypothalamic hamartomas. J Korean Neurosurg Soc. 60 (3), 294-300 (2017).
- Delalande, O., Fohlen, M. Disconnecting surgical treatment of hypothalamic hamartoma in children and adults with refractory epilepsy and proposal of a new classification. Neurol Med Chir (Tokyo). 43 (2), 61-68 (2003).
- Valdueza, J. M., et al. Hypothalamic hamartomas: with special reference to gelastic epilepsy and surgery. Neurosurgery. 34 (6), 949-958 (1994).
- Chibbaro, S., et al. Pure endoscopic management of epileptogenic hypothalamic hamartomas. Neurosurg Rev. 40 (4), 647-653 (2017).
- Ng, Y. T., et al. Endoscopic resection of hypothalamic hamartomas for refractory symptomatic epilepsy. Neurology. 70, 1543-1548 (2008).
- Bourdillon, P., et al. Surgical treatment of hypothalamic hamartomas. Neurosurg Rev. 44 (2), 753-762 (2021).
- Feiz-Erfan, I., et al. Surgical strategies for approaching hypothalamic hamartomas causing gelastic seizures in the pediatric population: transventricular compared with skull base approaches. J Neurosurg. 103, 4 Suppl 325-332 (2005).
- Dorfmüller, G., Fohlen, M., Bulteau, C., Delalande, O. Surgical disconnection of hypothalamic hamartomas. Neurochirurgie. 54, 315-319 (2008).
- Ng, Y. T., et al. Endoscopic resection of hypothalamic hamartomas for refractory symptomatic epilepsy. Neurology. 70 (17), 1543-1548 (2008).
- Rosenfeld, J. V., Freeman, J. L., Harvey, A. S. Operative technique: The anterior transcallosal transseptal interforniceal approach to the third ventricle and resection of hypothalamic hamartomas. J Clin Neurosci. 11 (7), 738-744 (2004).
- Rosenfeld, J. V., Feiz-Erfan, I. Hypothalamic hamartoma treatment: surgical resection with the transcallosal approach. Semin Pediatr Neurol. 14 (2), 88-98 (2007).
- Ng, Y. T., et al. Transcallosal resection of hypothalamic hamartoma for intractable epilepsy. Epilepsia. 47 (7), 1192-1202 (2006).
- Castinetti, F., Brue, T., Morange, I., Carron, R., Régis, J. Gamma Knife radiosurgery for hypothalamic hamartoma preserves endocrine functions. Epilepsia. 58, Suppl 2 72-76 (2017).
- Akai, T., Okamoto, K., Iizuka, H., Kakinuma, H., Nojima, T. Treatments of hamartoma with neuroendoscopic surgery and stereotactic radiosurgery: a case report. Minim Invasive Neurosurg. 45 (4), 235-239 (2002).
- Abla, A. A., et al. Gamma Knife surgery for hypothalamic hamartomas and epilepsy: patient selection and outcomes. J Neurosurg. 113, Suppl 207-214 (2010).
- Selch, M. T., et al. Linear accelerator stereotactic radiosurgery for the treatment of gelastic seizures due to hypothalamic hamartoma. Minim Invasive Neurosurg. 48 (5), 310-314 (2005).
- Hoppe, C., Helmstaedter, C. Laser interstitial thermotherapy (LiTT) in pediatric epilepsy surgery. Seizure. 77, 69-75 (2020).
- Calisto, A., et al. Endoscopic disconnection of hypothalamic hamartomas: safety and feasibility of robot-assisted, thulium laser-based procedures. J Neurosurg Pediatr. 14 (6), 563-572 (2014).
- Curry, D. J., Raskin, J., Ali, I., Wilfong, A. A. MR-guided laser ablation for the treatment of hypothalamic hamartomas. Epilepsy Res. 142, 131-134 (2018).
- Wei, P. H., et al. Stereoelectroencephalography-guided radiofrequency thermocoagulation for hypothalamic hamartomas: Preliminary evidence. World Neurosurg. 114, e1073-e1078 (2018).
- Bourdillon, P., et al. Stereo electroencephalography-guided radiofrequency thermocoagulation (SEEG-guided RF-TC) in drug-resistant focal epilepsy: Results from a 10-year experience. Epilepsia. 58 (1), 85-93 (2017).
- Wethe, J. V., et al. Cognitive functioning before and after surgical resection for hypothalamic hamartoma and epilepsy. Neurology. 81 (12), 1044-1050 (2013).
- Choi, J. U., Kim, D. S. Treatment modalities for intractable epilepsy in hypothalamic hamartoma. Adv Tech Stand Neurosurg. 39, 117-130 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved