Method Article
Инновационная вставка, напечатанная на 3D-принтере, предназначена для простого 2D- и 3D-культивирования клеток
В этой статье
Резюме
В этой статье недавно разработанный вкладыш, напечатанный на 3D-принтере, представлен в качестве модели совместной культуры и подтвержден путем изучения паракринной межклеточной связи между эндотелиальными клетками и кератиноцитами.
Аннотация
Классический анализ непрямой коммуникации между различными типами клеток обуславливает необходимость использования кондиционированных сред. Более того, производство кондиционированных сред остается трудоемким и далеким от физиологических и патологических состояний. Несмотря на то, что несколько моделей кокультивирования коммерчески доступны, они по-прежнему ограничены специфическими анализами и в основном предназначены для двух типов клеток.
Здесь используются напечатанные на 3D-принтере вставки, совместимые с многочисленными функциональными анализами. Вкладыш позволяет разделить одну лунку 6-луночной пластины на четыре отсека. Можно установить широкий спектр комбинаций. Кроме того, в каждой стенке компартментов спроектированы окна таким образом, чтобы потенциальная межклеточная коммуникация между каждым компартментом была возможна в питательной среде в зависимости от объема. Например, паракринная межклеточная коммуникация может быть изучена между четырьмя типами клеток в монослое, в 3D (сфероиды) или путем объединения обоих. Кроме того, в один и тот же отсек можно поместить различные типы клеток в формате 2D или 3D (органоиды). Отсутствие дна во вставках, напечатанных на 3D-принтере, позволяет использовать обычные условия культивирования на пластине, возможное нанесение покрытия на пластину, содержащую вкладыш, и прямую визуализацию с помощью оптической микроскопии. Наличие нескольких компартментов дает возможность собирать различные типы клеток независимо друг от друга или использовать в каждом компартменте разные реагенты для экстракции РНК или белка. В данном исследовании представлена подробная методология использования нового вкладыша, напечатанного на 3D-принтере, в качестве системы совместного культивирования. Чтобы продемонстрировать некоторые возможности этой гибкой и простой модели, ранее опубликованные функциональные тесты клеточной коммуникации были выполнены в новых 3D-печатных вставках и продемонстрировали свою воспроизводимость. Напечатанные на 3D-принтере вставки и традиционная клеточная культура с использованием кондиционированных сред привели к аналогичным результатам. В заключение, напечатанная на 3D-принтере вставка, представляет собой простое устройство, которое может быть адаптировано к многочисленным моделям кокультур с адгезивными типами клеток.
Введение
In vivo клетки общаются друг с другом либо напрямую (контакт с клетками), либо опосредованно (путем секреции молекул). Для изучения клеточной коммуникации могут быть разработаны различные модели кокультур, такие как прямая кокультура (различные типы клеток находятся в прямом взаимодействии в одном и том же колодце) и компартментализированная кокультура (различные типы клеток находятся в непрямом взаимодействии в разных компартментах культуральной системы)1. Кроме того, кондиционированные среды могут быть использованы для систем совместного культивирования, где непрямое взаимодействие обеспечивается за счет того, что секретируемые молекулы, содержащиеся в кондиционированных средах эффекторного типа клеток, переносятся в клетку-ответчиктипа 1.
В случае исследований паракринной клеточной коммуникации непрямые системы кокультур предоставляют модели, которые в полной мере отражают клеточные взаимодействия in vivo. Были разработаны и коммерциализированы системы косвенного совместного культивирования, позволившие создать модели косвенной кокультуры 2,3. К сожалению, большинство косвенных систем совместного культивирования предусматривают только два отсека. Другие системы косвенного совместного культивирования предусматривают несколько компартментов, но они менее масштабируемы по сравнению с системой, представленной в настоящей рукописи. Некоторые из них не позволяют провести классическую визуализацию под микроскопом, и в них часто представлены специфические методы нанесения. В нескольких исследованиях паракринная связь между различными типами клеток исследуется с помощью моделиусловной среды 4,5,6,7. Это более простой способ исследования по сравнению с системами косвенной совместной культуры, поскольку он не требует установления конкретных методов или материалов1. С другой стороны, приготовление кондиционированных сред занимает много времени и позволяет получить информацию только об односторонней клеточной сигнализации (от эффектора к ответителю)1.
В данной работе предложен новый, простой способ исследования клеточной коммуникации. Позволяя комбинировать несколько типов клеток в прямом или косвенном взаимодействии, а также в 2D или 3D форматах, напечатанные вставки предоставляют множество преимуществ для простой настройки моделей совместного культивирования. Напечатанная на 3D-принтере вставка, адаптированная для установки в лунки 6-луночных планшетов, имеет круглую форму и позволяет разделить лунку на четыре отсека (два больших и два маленьких; Рисунок 1А). Напечатанные на 3D-принтере вставки характеризуются отсутствием дна. Таким образом, ячейки находятся в непосредственном контакте с пластиной, на которую ставится вкладыш. Кроме того, каждый отсек может быть покрыт независимо от других. Кроме того, поведение клеток можно легко проследить под оптическими микроскопами. Наличие коммуникационных окон в каждой стенке вставки позволяет добавлять в оптимальное время общую среду для проведения различных экспериментов по со-культуре. Для изучения прямой и/или косвенной связи между несколькими типами клеток могут быть выполнены многочисленные комбинации кокультивирования. Например, может быть спроектирована модель непрямой кокультуры между четырьмя различными типами клеток в монослое и/или в 3D (сфероиды). Комбинация моделей прямой и непрямой совместной культуры также может быть выполнена путем смешивания различных типов клеток в одном и том же компартменте. Влияние сложных структур (органоидов, тканевых эксплантов и т.д.) на различные типы клеток может быть еще одним примером моделей, которые могут быть созданы. Кроме того, напечатанные на 3D-принтере вкладыши совместимы с функциональными анализами клеточной биологии (пролиферация, миграция, образование псевдотрубок, дифференцировка и т. д.) и биохимическими тестами (выделение ДНК, РНК, белка, липидов и т. д.). Наконец, напечатанные на 3D-принтере вкладыши обеспечивают широкий спектр экспериментальных схем моделей кокультур с возможностью одновременного комбинирования различных анализов в одном эксперименте в разных отсеках.
Представлены некоторые возможности напечатанных на 3D-принтере вставок, чтобы проверить их в качестве быстрой и простой в использовании модели совместной культуры. По сравнению с ранее опубликованным исследованием, проведенным по коммуникации паракринных клеток, продемонстрирована способность напечатанных на 3D-принтере вставок быть ценной моделью кокультуры. Для оценки этого момента было проведено сравнение регуляции пролиферации и миграции эндотелиальных клеток кератиноцитами между напечатанной на 3D-принтере системой вкладышей и классической системой с использованием кондиционированных сред. Напечатанные на 3D-принтере вставки позволяют быстро получать результаты, аналогичные традиционным системам, использующим кондиционированные носители. Действительно, напечатанные на 3D-принтере вставки обеспечивают надежную модель для изучения клеточных взаимодействий в обоих направлениях без необходимости производства кондиционированных сред и с возможностью параллельного выполнения анализов пролиферации и миграции в одном и том же эксперименте.
В заключение в данной работе предлагается новая и готовая к использованию модель для изучения клеточной коммуникации. Совместимые со всеми типами адгезивных клеток, напечатанные на 3D-принтере вставки позволяют выполнять многочисленные комбинации кокультур, которые направлены на то, чтобы быть ближе к условиям in vivo .
протокол
ПРИМЕЧАНИЕ: 3D-вставки (Рисунок 1A) приобретаются в промышленных масштабах и печатаются с использованием фотополимерной смолы, биосовместимой с клеточными культурами и автоклавированием (см. Таблицу материалов). В этом разделе описан подробный протокол для создания модели совместной культуры с помощью вставок (см. рис. 1B). Также приведены некоторые примеры приложений.
1. Размещение стерилизованного вкладыша в 6-луночные планшеты
- Смешайте два компонента, входящие в комплект (см. Таблицу материалов), пищевой кремний (реагент А) и катализатор (реагент В), в соотношении 10:1 (v/v) в соответствии с инструкциями производителя. (Рисунок 1Ba). Используйте шпатель, стерилизованную 70% этанолом, чтобы смешать два компонента.
ПРИМЕЧАНИЕ: Объем приготовляемой кремниевой смеси зависит от количества закрепляемых вставок. Избыток катализатора может привести к слишком быстрому затвердеванию кремниевой смеси. - Нанесите вставки на силиконовую смесь пинцетом так, чтобы смесь равномерно распределилась по нижнему краю вставок (рисунок 1Bb). Поместите вставки в лунки 6-луночного планшета и слегка надавите на пластины, чтобы убедиться, что вставки находятся в тесном контакте с планшетом, чтобы избежать утечки среды для клеточной культуры (Рисунок 1Bc).
- Поставьте пластину при температуре 37 °C, чтобы поддержать процесс затвердевания кремния в течение 1 часа.
ПРИМЕЧАНИЕ: Время затвердевания зависит от количества добавленного катализатора. - После застывания простерилизовать пластины со вкладышами, погрузив их в ванну с 70% этиловым спиртом на срок от 30 мин до 1 ч.
- Выбросьте спирт с помощью пипетки и дайте планшету высохнуть (крышка открыта) в течение ночи в колпаке для клеточных культур.
ПРИМЕЧАНИЕ: Спирт должен быть полностью испарен перед выполнением следующего шага, чтобы избежать фиксации клеток и токсичности. Готовую к использованию пластину, содержащую вкладыши, можно хранить в течение нескольких дней перед использованием в сухом и стерильном состоянии при комнатной температуре.
2. Покрытия, такие как поли-L-лизин или поли-HEMA (дополнительный этап)
ПРИМЕЧАНИЕ: В этом эксперименте покрытие не выполняется, и приведены шаги, информирующие о возможности нанесения покрытия на пластины.
- Приготовьте раствор для покрытия в соответствии с инструкциями производителя.
- Рассмотрим объем 200-400 мкл для самых больших отсеков и объем 50-100 мкл для самых маленьких отсеков для покрытия вставки. Добавьте раствор для покрытия в отдельные отсеки.
- Дайте покрытию высохнуть в соответствии с указаниями производителя в стерильных условиях.
3. Засев клеток
- Культивирование кератиноцитов наружной оболочки корня (KORS) и дермальных микрососудистых эндотелиальных клеток человека (HDMEC) в соответствии с рекомендациями производителя. Приготовьте клеточную суспензию, как только клетки достигнут слияния.
- Выбросьте среду из колб и добавьте 5 мл трипсина, чтобы отделить клетки (см. Таблицу материалов).
- Поместите колбу с KORS при температуре 37 °C с 5% CO2 на 5 минут. Инкубируйте колбу с HDMEC в течение 5 минут при комнатной температуре.
- Раствор трипсина, содержащий KORS, смешать с 5 мл среды мезенхимальных стволовых клеток (МСКМ) с добавлением 5% фетальной бычьей сыворотки (FBS) и факторов роста (базальная среда с набором добавок, см. таблицу материалов). Раствор трипсина, содержащий HDMEC, смешивают с 5 мл эндотелиальной клеточной среды (ECM) с добавлением 5% FBS и факторов роста (см. таблицу материалов).
- Переложите клетки в стерильную коническую пробирку объемом 15 мл. Центрифугируйте суспензии KORS и HDMEC при 200 x g в течение 5 мин при комнатной температуре.
- Выбросьте надосадочную жидкость и повторно суспендируйте клетки в 2 мл соответствующей среды.
- Смешайте 10 мкл клеточной суспензии с 10 мкл трипанового синего красителя (см. таблицу материалов).
- Добавьте 10 мкл смеси в камеру счетного предметного стекла.
- Вставьте ползунок для подсчета клеток в систему подсчета клеток (см. Таблицу материалов) и определите номер ячейки и жизнеспособность.
- Приготовьте клеточную суспензию в концентрации 0,5 x 105 клеток/мл в соответствующей среде.
ПРИМЕЧАНИЕ: Если для разных типов клеток требуется разное время адгезии и/или для достижения идеального слияния, посев клеток может быть выполнен в разные моменты времени в зависимости от типа клеток.
- Распределите пипеткой от 800 мкл до 1 мл клеточной суспензии в отдельные большие отсеки и 100-150 мкл в отдельные малые отсеки.
- Засейте KORS в дозе 1 x 10 5 клеток/мл в MSCM с добавлением5% FBS и факторов роста в одном из больших отсеков.
- Семенной HDMEC в ECM с добавлением 5% FBS и факторов роста в дозе 2,5 x 103 клеток/мл в малых компартментах и 1,25 x 105 клеток/мл в другом большом компартменте.
ПРИМЕЧАНИЕ: Анализ пролиферации может быть выполнен в малых компартментах, а анализ миграции и жизнеспособности может быть выполнен в больших компартментах. Концентрация засеянных клеток была оптимизирована в соответствии с рекомендациями производителя. Такая концентрация обеспечивает хорошую жизнеспособность клеток через 24-48 ч инкубации.
- Поместите планшет для клеточной культуры при температуре 37 °C с 5%CO2 или в обычных условиях, чтобы обеспечить адгезию и/или созревание клеток.
ПРИМЕЧАНИЕ: Инкубируйте клетки в течение 24-48 ч без смены среды. При необходимости среда отсеков может быть изменена независимо.
4. Реализация совместной культуры ( Рисунок 1Bd)
ПРИМЕЧАНИЕ: Реализация совместной культуры соответствует времени, когда добавляется общая среда. Добавление уникальной среды для всех типов клеток в различных компартментах обеспечивает возможность паракринной связи между клетками благодаря наличию коммуникационных окон (яйцевидных отверстий в стенках 3D-печатных вставок). Чтобы внедрить совместную культуру, выполните шаги 4.1-4.3.
- Опорожните питательные среды из различных отсеков вкладышей с помощью пипетки. В случае культуры 3D-сфероидных клеток очень осторожно утилизируйте среду.
- Промойте ячейки 1 мл теплого PBS с температурой 37 °C в больших отсеках и 200 мкл теплого PBS с температурой 37 °C в маленьких отсеках. Обеспечьте бережную стирку, чтобы не отсоединить клетки.
- Добавьте 3 мл общей среды, подобранной так, чтобы она была совместима со всеми типами клеток.
ПРИМЕЧАНИЕ: В данном исследовании используется базальный ECM (без FBS и факторов роста). Убедитесь, что среда покрывает все отсеки (уровень над коммуникационными окнами [яйцевидные отверстия в стенах], как показано на рисунке 1А). - Поместите планшет с кокультурами при температуре 37 °C с 5% CO2 на 24-48 ч.
5. Наблюдение за клетками, подсчет и выскабливание
- Наблюдайте за морфологией и подсчитывайте количество клеток различных компартментов во время эксперимента под оптическим микроскопом через 24-48 ч инкубации.
ПРИМЕЧАНИЕ: Ожидаемое количество ячеек зависит от используемых типов клеток (размер, морфология и т.д.) и от размера отсека. В этом эксперименте в больших отсеках подсчитывают от 0,5 x 10 6-1 x10 6 KORS/мл и от 0,25 x 10 6-0,75 x 10 6 HDMECs/мл. - Отделите клетки с помощью трипсина для подсчета клеточной суспензии.
ПРИМЕЧАНИЕ: Для решения для отделения клеток рассмотрите объем 100-500 мкл для самых больших компартментов и объем 10-50 мкл для самых маленьких компартментов. - Проверьте жизнеспособность с помощью окрашивания трипановым синим (см. шаги 3.1.6-3.1.8).
6. Очистка вставок для вторичной переработки
- Снимите вкладыши с 6-луночной пластины в конце эксперимента, слегка покрутив (Рисунок 1Be).
- Снимите силикон со вставок, потянув за него. При необходимости с помощью шпателя удалите остатки силикона, прилипшие к стенкам вставок (рисунок 1Bf).
- Промойте вкладыши обычными моющими средствами для клеточных культур и чистящими средствами (пример приведен в таблице материалов).
- Стерилизуйте вкладыши для дальнейшего использования в автоклаве (твердый цикл, 121 °C в течение 20 минут) или погрузив их в ванну с 70% этанолом на 1 час.
ПРИМЕЧАНИЕ: На этом этапе описываются два примера возможных анализов (анализы пролиферации и миграции) с использованием напечатанных на 3D-принтере вставок (рис. 1Bd).
7. Анализ пролиферации клеток - WST-1
- Выполните шаги 1-3.1 для культивирования клеток.
ПРИМЕЧАНИЕ: Выполните шаги, описанные в этом разделе, чтобы внедрить систему кокультивирования, чтобы исследовать влияние секретома KORS на пролиферацию HDMEC. Ячейки KORS используются для сравнения данных, опубликованных ранее8.- Высевают KORS в дозе 1 x 10 5 клеток/мл в среду мезенхимальных стволовых клеток (МСКМ) с добавлением5% FBS и факторов роста в больших компартментах.
- Поместите планшет для клеточной культуры при температуре 37 °C с 5%CO2 на 24 часа.
- Высевают HDMEC в эндотелиальную клеточную среду (ECM) с добавлением 5% FBS и факторов роста в дозе 2,5 x 103 клеток/мл в небольших компартментах.
- Поместите планшет с клеточной культурой при температуре 37 °C с 5% CO2 на 24-48 ч.
- Выбросьте среду из всех отсеков и внедрите систему кокультивирования, добавив 3 мл недополненного базального ECM (общая среда для клеточных культур для всех отсеков вкладышей, напечатанных на 3D-принтере).
- Разводят WST-1 в общей клеточной культуре ECM (окончательное разведение 1:10) для приготовления раствора WST-1.
ПРИМЕЧАНИЕ: Для объема раствора WST-1 приготовьте не менее 500 мкл дополнительного раствора для заготовки. - Выбросьте питательную среду из вкладыша с помощью пипетирования.
- Добавьте раствор WST-1 в выбранные отсеки (150 мкл для маленьких отсеков и 600 мкл для больших). Поставьте пластину при температуре 37 °C с 5% CO2.
- По истечении оптимального 30-минутного времени инкубации клеток перенесите 100 мкл инкубационной среды из каждого состояния на 96-луночный планшет.
- Оцените колориметрическую реакцию с помощью микропланшетного ридера в диапазоне от 420 нм до 480 нм.
- Наденьте пластину на микропланшет считывателя и нажмите на кнопку редактирования нового протокола.
- Выберите конкретный тип используемой 96-луночной пластины (см. Таблицу материалов) и длину волны 450 нм.
- Нажмите на кнопку начать измерение.
8. Анализ миграции клеток - устройство с двумя миграционными камерами
- Выполните шаги 1-3.1 для культивирования клеток.
ПРИМЕЧАНИЕ: Выполните шаги, описанные в этом разделе, чтобы внедрить систему кокультивирования, чтобы исследовать влияние секретома KORS на пролиферацию HDMEC.- Засейте KORS в дозе 1 x 10 5 клеток/мл в MSCM с добавлением5% FBS и факторов роста в одном из больших отсеков.
- Поместите планшет для клеточной культуры при температуре 37 °C с 5%CO2 на 24 часа.
- Поместите устройство с двумя миграционными камерами в другой большой отсек вкладышей.
- Засейте HDMEC в ECM , добавив 5% FBS и факторы роста в 7 x 105 клеток/лунку устройства с двумя миграционными камерами.
- Поместите планшет для клеточной культуры при температуре 37 °C с 5%CO2 на 24 часа.
- Утилизируйте носитель и устройство с двумя миграционными камерами через 24 часа или в оптимальное время в зависимости от типа мигрируемой ячейки. Реализуйте систему кокультивирования, добавив 3 мл недополненного базальногоEC M.
ПРИМЕЧАНИЕ: Действуйте осторожно, чтобы не отсоединить ячейки. Если клетки действительно чувствительны к отслоению, вызванному добавлением общей среды, снимите устройство с двумя миграционными камерами после добавления общей среды.
- Понаблюдайте и сделайте снимок поверхности, покрытой клетками в разные моменты времени, под фазово-контрастным микроскопом при 10-кратном увеличении.
ПРИМЕЧАНИЕ: Снимки сделаны с помощью фазово-контрастного микроскопа (см. Таблицу материалов). Снимки сохраняются на USB-накопителе, а затем анализируются с помощью плагина инструмента для заживления ран программного обеспечения (см. Таблицу материалов). - Измерьте непокрытую поверхность с помощью классического программного обеспечения для количественного анализа.
- Откройте изображение в программе и активируйте инструмент для заживления ран, доступный в списке макросов.
- Нажмите на кнопку m , чтобы измерить непокрытую поверхность изображения миграции.
- Непокрытая поверхность рассчитывается по следующей формуле:
Процент покрытия = ([средняя площадь без ячеек в момент T0 − средняя площадь без ячеек в момент времени T]/средняя площадь без ячеек в момент T0) × 100.
ПРИМЕЧАНИЕ: Напечатанные на 3D-принтере вкладыши полностью адаптированы к большинству методов клеточной биологии (таких как анализ образования псевдотрубок, 3D-культуры) и для биохимических экспериментов (таких как экстракция ДНК, РНК, белка).
Результаты
В настоящей работе была описана оптимизированная система кокультур для получения устойчивых, надежных и значимых данных, сопоставимых с классическими методами, за счет использования условных сред. Напечатанные на 3D-принтере вставки имитируют условия микроокружения in vivo различных типов клеток при взаимодействии, преодолевая трудности и трудоемкое производство кондиционированных сред перед экспериментами. Ранее опубликованное исследование было проведено повторно для анализа косвенных взаимодействий между двумя типами клеток, присутствующих в волосяных фолликулах: микрососудистыми эндотелиальными клетками человека (HDMEC) и человеческими кератиноцитами наружной оболочки корня (KORS)8. Продемонстрирована воспроизводимость результатов, полученных при использовании 3D-печатных вставок, по сравнению с классическим методом исследования косвенных взаимодействий между HDMEC и KORS с использованием кондиционированных сред. Условия культивирования клеток, ранее описанные в исследовании8, были такими же, как и в настоящей работе. Они были адаптированы с учетом размеров напечатанных на 3D-принтере вставок (см. протокол). Прежде всего, фенотип и жизнеспособность клеток были сопоставимы между двумя условиями (кондиционированные среды против .3D-печатных вкладышей) для всех типов клеток (рис. 2). Действительно, 90% жизнеспособности наблюдалось в лунках 6-луночных планшетов (рис. 2А и табл. 1), а в напечатанных на 3D-принтере вставках (рис. 2Б и табл. 1) для KORS. Жизнеспособность HDMEC составила 85% в лунках 6-луночной пластины (рис. 2C и табл. 2) по сравнению с 86% в напечатанных на 3D-принтере пластинах (рис. 2D и табл. 2). Данные о жизнеспособности клеток рассчитывались автоматическим счетчиком клеток (Таблица материалов) следующим образом: количество жизнеспособных клеток, деленное на общее количество клеток (мертвые + жизнеспособные клетки). Средние данные были получены путем расчета процента жизнеспособности, полученного в шести независимых экспериментах, в которых было выполнено два повторения (см. табл. 1 и табл. 2).
Эти результаты показали, что напечатанная на 3D-принтере вставка не изменила поведение или жизнеспособность клетки по сравнению с обычной культурой на 6-луночных планшетах. Таким образом, напечатанные на 3D-принтере вставки были признаны новой моделью совместной культуры.
Проанализированы ранее продемонстрированныепараметры 8 непрямой клеточной коммуникации. Для всех экспериментов внедрение сокультуры вкладыша, напечатанного на 3D-принтере, осуществлялось по протоколам в соответствии с классическими условиями культивирования (см. предыдущую работу8).
Во-первых, были оценены непрямые клеточные коммуникации между KORS и HDMEC во вставках, напечатанных на 3D-принтере, путем анализа пролиферации клеток и сравнения с классическим методом с использованием кондиционированных сред (рис. 3). В присутствии KORS во вставках (+ KORS) пролиферация HDMEC достоверно увеличивалась в 1,5 раза через 24 ч и в 3,1 раза через 48 ч по сравнению с контрольным состоянием без KORS (Control) (рис. 3А). Эти результаты согласовывались с результатами, полученными в экспериментах с условными средами (рис. 3Б). Действительно, было показано, что KORSCM значительно увеличивает пролиферацию HDMEC в 1,5 раза через 24 ч и в 2,1 раза через 48 ч.
Напечатанная на 3D-принтере модель совместной культуры вкладышей была протестирована для определения влияния KORS на миграцию HDMEC. Ранее этот эффект был продемонстрирован в классической системе кокультуры с использованием условных сред8 (рис. 4). В контрольном состоянии без KORS (Control) HDMEC мигрировали и покрывали примерно 44% площади раны через 24 ч (рис. 4A). В присутствии KORS (+ KORS) наблюдался сильный и значительный рост миграции HDMEC. Действительно, кинетика заживления раны показала, что 43%, 67% и 99% площади раны были покрыты HDMEC через 3 ч, 12 ч и 24 ч соответственно. Эти результаты согласуются с результатами, полученными ранее8, где было показано, что KORSCM аналогичным образом увеличивает миграцию HDMEC (рис. 4B).

Рисунок 1: Рабочий процесс, показывающий реализацию культуры 3D-печатной вставки от очистки до переработки вставки . (A) Репрезентативное изображение вкладыша, напечатанного на 3D-принтере. (В) Проиллюстрирован репрезентативный пример анализов, представленных в данной рукописи. Обратите внимание, что анализ на пролиферацию может быть выполнен в одном отсеке вкладыша, напечатанного на 3D-принтере, параллельно с анализом миграции, выполняемым в другом отсеке с использованием устройства с двумя миграционными камерами, размещенного в других отсеках вкладышей, напечатанных на 3D-принтере. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
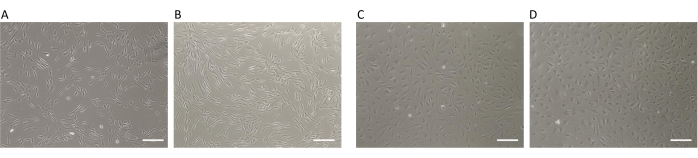
Рисунок 2: Жизнеспособность KORS и HDMEC. (A,B) Морфология KORS (10x) в (A) лунке 6-луночной пластины и (B) во вставке, напечатанной на 3D-принтере. (С,Д) Морфология HDMEC (10x) в (C) лунке с 6-луночной пластиной и (D) во вставке, напечатанной на 3D-принтере. Масштабная линейка: 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
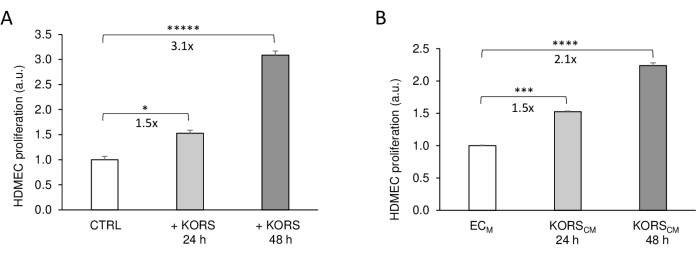
Рисунок 3: Влияние KORS на пролиферацию HDMEC. (A) Пролиферацию HDMEC измеряли с помощью колориметрического анализа с использованием красителя WST-1 во вставке, напечатанной на 3D-принтере, в отсутствие KORS (control = CTRL) или в присутствии KORS (+ KORS) в течение 24 ч или 48 ч. (B) Пролиферацию HDMEC измеряли колориметрическим анализом с использованием красителя WST-1 в присутствии среды для культуры базальных клеток ECM или KORSCM в течение 24 ч или 48 ч. Результаты выражены в виде среднего ± SEM, n = 8 повторений, и было проведено два независимых эксперимента. *p < 0,05, ***p < 0,001, ****p < 0,0001 и *****p < 0,00001. KORS инкубировали в ECM без FBS и факторов роста. Через 48 ч эту кондиционированную среду собирали и хранили при температуре −80 °C для экспериментов. Эта цифра изменена с 8 и воспроизведена с разрешения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Влияние KORS на миграцию HDMEC. (A) Миграция HDMEC во вставке, напечатанной на 3D-принтере, в отсутствие KORS (control = CTRL) или в присутствии KORS (+ KORS) показана и количественно выражена в процентах восстановления. (B) Миграция HDMEC в ECM или KORSCM показана и количественно выражена в процентах восстановления. Полученные результаты выражены в виде среднего ± SEM, n=3 репликации, при этом на одну репликацию было проанализировано три поля, проведено два независимых эксперимента. **p<0.01, *****p<0.00001. Масштабная линейка: 200 мкм. KORS инкубировали в ECM без FBS и факторов роста. Через 48 ч эту кондиционированную среду собирали и хранили при -80 °C для экспериментов. Эта цифра изменена с 8 и воспроизведена с разрешения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Количество 1 | Количество 2 | Значить | Итого среднее | ||
| 6-луночный планшет | Репликация 1 | 95% | 84% | 90% | 90% |
| Репликация 2 | 90% | 88% | 89% | ||
| Репликация 3 | 85% | 89% | 87% | ||
| Репликация 4 | 97% | 89% | 93% | ||
| Репликация 5 | 88% | 94% | 91% | ||
| Репликация 6 | 86% | 92% | 89% | ||
| Вкладыш, напечатанный на 3D-принтере | Репликация 1 | 92% | 89% | 91% | 91% |
| Репликация 2 | 91% | 80% | 86% | ||
| Репликация 3 | 93% | 92% | 93% | ||
| Репликация 4 | 94% | 98% | 96% | ||
| Репликация 5 | 88% | 86% | 87% | ||
| Репликация 6 | 93% | 97% | 95% |
Таблица 1: Измерение жизнеспособности KORS. Жизнеспособность KORS измеряли в лунке 6-луночного планшета и во вставке, напечатанной на 3D-принтере, с использованием окрашивания трипановым синим и автоматического подсчета.
| Количество 1 | Количество 2 | Значить | Итого среднее | ||
| 6-луночный планшет | Репликация 1 | 90% | 88% | 89% | 85% |
| Репликация 2 | 79% | 78% | 79% | ||
| Репликация 3 | 71% | 75% | 73% | ||
| Репликация 4 | 86% | 82% | 84% | ||
| Репликация 5 | 91% | 88% | 90% | ||
| Репликация 6 | 99% | 94% | 97% | ||
| Вкладыш, напечатанный на 3D-принтере | Репликация 1 | 99% | 86% | 93% | 86% |
| Репликация 2 | 80% | 75% | 78% | ||
| Репликация 3 | 79% | 80% | 80% | ||
| Репликация 4 | 98% | 85% | 92% | ||
| Репликация 5 | 85% | 78% | 82% | ||
| Репликация 6 | 89% | 93% | 91% |
Таблица 2: Измерение жизнеспособности HDMEC. Жизнеспособность HDMEC измеряли в лунке 6-луночного планшета и во вставке, напечатанной на 3D-принтере, с использованием окрашивания трипановым синим и автоматического подсчета.
Обсуждение
Непрямая клеточная коммуникация обычно исследуется с использованием кондиционированных сред или устройств для совместной культивации. Подготовка условной среды занимает много времени на начальном этапе экспериментов, и этот метод ограничен односторонним анализом эффектов. Предыдущее исследование Colin-Pierre et al.8 С использованием кондиционированных сред была проведена непрямая клеточная коммуникация между двумя типами клеток (HDMEC и KORS). Данные предыдущего исследования продемонстрировали влияние кондиционированных сред KORS на пролиферацию HDMEC и влияние кондиционированных сред KORS на миграцию HDMEC, образование псевдотрубок и экспрессию GPC18. В настоящем исследовании описан более простой и быстрый способ изучения непрямой клеточной коммуникации. Фактически, напечатанные на 3D-принтере вставки обеспечивают гибкость в дизайне экспериментов и различных комбинациях клеточных культур. Чтобы валидировать эти напечатанные на 3D-принтере вставки в качестве модели для кокультур, пролиферация и миграция клеток были проанализированы и сравнены с предыдущим исследованием с использованием кондиционированных сред8. В обоих исследованиях анализ заживления ран проводили с помощью устройства с двумя миграционными камерами (Culture-Insert 2 Well in μ-Dish 35 мм), помещенных в лунку, содержащую или не содержащую вкладыш. Этот прибор для испытания миграции9,10 отличается от тестов с нуля11,12 тем, что след, оставленный стенкой (имитирующей рану), разделяющей две камеры, постоянен. Поэтому он обладает высокой воспроизводимостью. Результаты настоящего исследования привели к аналогичному выводу по сравнению с экспериментами на условных носителях. Напечатанные на 3D-принтере вставки не изменяют поведение клетки и адаптированы для создания независимых покрытий компартментов, способствующих адгезии клеток. Тем не менее, вставки, напечатанные на 3D-принтере, также позволяют создавать покрытие из поли-HEMA, например, для обеспечения низкого прикрепления культуры сфероида/органоида. Непрямая связь между HDMEC и KORS была исследована в качестве примера многочисленных применений, обеспечиваемых напечатанными на 3D-принтере вставками.
Это новое устройство, применимое к адгезивным типам клеток, которые требуют или не требуют специального покрытия, обеспечивает значительную экономию времени на создание модели совместной культуры. Действительно, четыре отсека напечатанных на 3D-принтере вкладышей позволяют культивировать несколько типов клеток в монослое или в 3D (агрегаты или сфероиды) в одной лунке с различными комбинациями. Например, можно проанализировать косвенную связь четырех типов клеток в монослое, в 3D (сфероиды) или их комбинацию. В ходе экспериментов сфероиды культивировались во вставках, напечатанных на 3D-принтере, с использованием покрытия poly-HEMA (данные не показаны). Сфероиды состояли из клеток, засеянных в 3D из-за низкой соединительной пластины и перенесенных через 48 ч на 3D-печатную вставку для анализа. Через несколько дней культивирования наблюдался рост сфероидов. Эти результаты показывают, что напечатанная на 3D-принтере вставка может быть использована для отслеживания роста 3D-клеток после переноса сфероидов так же, как и в культуральном планшете13,14. Более того, смесь различных типов клеток может быть собрана вместе в одном и том же отсеке в 2D или 3D (органоиды) для изучения как прямой, так и непрямой клеточной коммуникации. Действительно, широкий диапазон модульности, предлагаемый 3D-печатными вкладышами, характеризует эту инновационную систему кокультивирования клеток. Кроме того, наличие коммуникационных окон позволяет использовать в общей среде для всех типов клеток в выбранное время без помощи кондиционированных сред. Таким образом, этот метод не применим к клеткам, культивируемым в суспензии. Стенки, разделяющие четыре отсека, позволяют производить посев, сбор урожая и анализ каждого типа клеток независимо от других. Может быть сделано несколько применений, таких как анализ образования псевдотрубок и пролиферации, миграции, анализа ДНК, РНК, белка и других анализов. Напечатанные на 3D-принтере вставки также дают возможность, например, анализировать влияние молекул или внеклеточных везикул. Более того, тот факт, что эти вставки были изготовлены с помощью 3D-печати, предоставляет многочисленные возможности для компоновки отсеков и многочисленных функциональных анализов.
Тем не менее, необходимо тщательно продумать критический этап герметизации пластины, напечатанной на 3D-принтере. Действительно, гомогенный передел кремния имеет решающее значение для обеспечения герметизации и предотвращения утечки среды клеточной культуры или клеток из одного отсека в другой. Чтобы избежать каких-либо проблем, следует убедиться, что силикон покрывает ту часть напечатанных на 3D-принтере вставок, которая будет соприкасаться с пластиной. Перед посевом клеток следует проверить правильность герметизации, добавив питательную среду в один отсек и наблюдая за отсутствием утечки среды в других отсеках. Время высыхания кремния после инкубации в ванне с 70% этанолом также является критическим этапом. Действительно, оставшиеся следы алкоголя могут привести к фиксации клеток и токсичности. Чтобы избежать каких-либо проблем, необходимо соблюдать время высыхания.
В заключение, напечатанные на 3D-принтере, вставки совместимы с большинством адгезивных типов клеток для культуры в 2D или 3D и позволяют проводить многочисленные эксперименты. Они могут быть адаптированы для многочисленных исследований с использованием кокультур и могут стать новым инструментом для изучения непрямой клеточной коммуникации. Напечатанные на 3D-принтере вставки являются модульными, гибкими, масштабируемыми и могут использоваться для создания экспериментальных моделей для изучения физиологических патологий, таких как ракология, иммунология или ангиогенез.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Это исследование было проведено в сотрудничестве с BASF Beauty Care Solutions. Г-жа Чарли Колин-Пьер (Charlie Colin-Pierre) является докторантом BASF/CNRS.
Мы хотели бы поблагодарить г-на Мехди Селлами за концепцию вставок, напечатанных на 3D-принтере.
Материалы
| Name | Company | Catalog Number | Comments |
| Autoclave | Getinge | APHP | Solid cycle, 121 °C for 20 min |
| Biomed Clear | Formlabs | RS-F2-BMCL-01 | Impression performed by 3D-Morphoz company (Reims, France) |
| Cell culture detergents | Tounett | A18590/0116 | |
| Cell Proliferation Reagent WST-1 | Roche | 11,64,48,07,001 | |
| Counting slide | NanoEnTek | EVE-050 | |
| Culture-Insert 2 Well in μ-Dish 35 mm | Ibidi | 80206 | two-migration chambers device. |
| Endothelial cell medium | ScienCell | 1001 | Basal medium +/- 25 mL of fetal bovine serum (FBS, 0025), 5 mL of endothelial cell growth supplement (ECGS, 1052), and 5 mL of penicillin/streptomycin solution (P/S, 0503). |
| EVE Automated cell counter | NanoEnTek | NESCT-EVE-001E | |
| EVOS XL Core | Fisher Scientific | AMEX1200 | 10x of magnification |
| Food silicon reagent and catalyst kit | Artificina | RTV 3428 A and B | (10:1) |
| FORM 3B printer | Formlabs | PKG-F3B-WSVC-DSP-BASIC | Impression performed by 3D-Morphoz company |
| Human Dermal Microvascular Endothelial Cells (HDMEC) | ScienCell | 2000 | |
| Keratinocytes of Outer Root Sheath (KORS ) | ScienCell | 2420 | |
| Macro Wound Healing Tool Software | ImageJ | Software used for the measurement of the uncovered surface (for migration assays) | |
| Mesenchymal stem cell medium | ScienCell | 7501 | Basal medium +/-25 mL of fetal bovine serum (FBS, 0025), 5 mL of mesenchymal stem cell growth supplement (MSCGS, 7552), and 5 mL of penicillin/streptomycin solution (P/S, 0503) |
| Microplate reader SPECTRO star NANO | BMG Labtech | BMG LABTECH software | |
| PBS | Promocell | C-40232 | Without Ca2+ / Mg2+ |
| Trypan Blue Stain | NanoEnTek | EBT-001 | |
| Trypsin / EDTA | Promocell | C-41020 | Incubation of KORS at 37 °C with 5% CO2 for 5 min. Incubation of HDMECs for 5 min at room temperature |
| 96-well plate Nunclon Delta Surface | Thermoscientific | 167008 |
Ссылки
- Regier, M. C., Alarid, E. T., Beebe, D. J. Progress towards understanding heterotypic interactions in multi-culture models of breast cancer. Integrative Biology. 8 (6), 684-692 (2016).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Mesenchymal stem cell isolation from pulp tissue and co-culture with cancer cells to study their interactions. Journal of Visualized Experiments. (143), e58825(2019).
- Lin, J., et al. Long non-coding RNA UBE2CP3 enhances HCC cell secretion of VEGFA and promotes angiogenesis by activating ERK1/2/HIF-1α/VEGFA signalling in hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 113(2018).
- Soares, N. L., et al. Carbon monoxide modulation of microglia-neuron communication: Anti-neuroinflammatory and neurotrophic role. Molecular Neurobiology. 59 (2), 872-889 (2022).
- Al Halawani, A., Abdulkhalek, L., Mithieux, S. M., Weiss, A. S. Tropoelastin promotes the formation of dense, interconnected endothelial networks. Biomolecules. 11 (9), 1318(2021).
- Mercatali, L., et al. Development of a human preclinical model of osteoclastogenesis from peripheral blood monocytes co-cultured with breast cancer cell lines. Journal of Visualized Experiments. (127), e56311(2017).
- Orona, N. S., Astort, F., Maglione, G. A., Yakisich, J. S., Tasat, D. R. Direct and indirect effect of air particles exposure induce Nrf2-dependent cardiomyocyte cellular response in vitro. Cardiovascular Toxicology. 19 (6), 575-587 (2019).
- Colin-Pierre, C., et al. The glypican-1/HGF/C-met and glypican-1/VEGF/VEGFR2 ternary complexes regulate hair follicle angiogenesis. Frontiers in Cell and Developmental Biology. 9, 781172(2021).
- Toubal, A., et al. The NC1 domain of type XIX collagen inhibits melanoma cell migration. European Journal of Dermatology. 20 (6), 712-718 (2010).
- Wu, A. -L., et al. Role of growth factors and internal limiting membrane constituents in müller cell migration. Experimental Eye Research. 202, 108352(2021).
- Oudart, J. -B., et al. Plasmin releases the anti-tumor peptide from the NC1 domain of collagen XIX. Oncotarget. 6 (6), 3656-3668 (2015).
- Martinotti, S., Ranzato, E. Scratch wound healing assay. Methods in Molecular Biology. 2109, 225-229 (2020).
- Cattin, S., Ramont, L., Rüegg, C. Characterization and in vivo validation of a three-dimensional multi-cellular culture model to study heterotypic interactions in colorectal cancer cell growth, invasion and metastasis. Frontiers in Bioengineering and Biotechnology. 6, 97(2018).
- Ma, Y. N., et al. Three-dimensional spheroid culture of adipose stromal vascular cells for studying adipogenesis in beef cattle. Animal. 12 (10), 2123-2129 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены