Method Article
Ein innovativer 3D-gedruckter Einsatz, der für einfache 2D- und 3D-Zellkulturen entwickelt wurde
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird ein neu entworfener 3D-gedruckter Einsatz als Modell der Co-Kultur vorgestellt und durch die Untersuchung der parakrinen interzellulären Kommunikation zwischen Endothelzellen und Keratinozyten validiert.
Zusammenfassung
Die klassischen Analysen der indirekten Kommunikation zwischen verschiedenen Zelltypen erfordern den Einsatz konditionierter Medien. Darüber hinaus ist die Herstellung von konditionierten Medien nach wie vor zeitaufwändig und weit entfernt von physiologischen und pathologischen Zuständen. Obwohl einige Modelle der Co-Kultur kommerziell erhältlich sind, bleiben sie auf spezifische Assays beschränkt und eignen sich hauptsächlich für zwei Arten von Zellen.
Hier kommen 3D-gedruckte Inserts zum Einsatz, die mit zahlreichen funktionellen Assays kompatibel sind. Der Einsatz ermöglicht die Aufteilung einer Vertiefung einer 6-Well-Platte in vier Kammern. Eine Vielzahl von Kombinationen kann eingestellt werden. Darüber hinaus sind in jeder Wand der Kompartimente Fenster so gestaltet, dass eine potentielle interzelluläre Kommunikation zwischen jedem Kompartiment im Nährmedium volumenabhängig möglich ist. Zum Beispiel kann die parakrine interzelluläre Kommunikation zwischen vier Zelltypen in Monolayern, in 3D (Sphäroide) oder durch Kombination beider untersucht werden. Darüber hinaus kann ein Mix aus verschiedenen Zelltypen im selben Kompartiment im 2D- oder 3D-Format (Organoide) ausgesät werden. Das Fehlen eines Bodens in den 3D-gedruckten Einsätzen ermöglicht die üblichen Kulturbedingungen auf der Platte, eine mögliche Beschichtung auf der Platte, die den Einsatz enthält, und eine direkte Visualisierung durch optische Mikroskopie. Die Mehrfachkompartimente bieten die Möglichkeit, verschiedene Zelltypen unabhängig voneinander zu sammeln oder in jedem Kompartiment unterschiedliche Reagenzien für die RNA- oder Proteinextraktion zu verwenden. In dieser Studie wird eine detaillierte Methodik vorgestellt, um den neuen 3D-gedruckten Einsatz als Co-Kultursystem zu verwenden. Um die verschiedenen Fähigkeiten dieses flexiblen und einfachen Modells zu demonstrieren, wurden zuvor veröffentlichte funktionelle Assays der Zellkommunikation in den neuen 3D-gedruckten Inserts durchgeführt und als reproduzierbar nachgewiesen. Die 3D-gedruckten Einsätze und die konventionelle Zellkultur mit konditionierten Medien führten zu ähnlichen Ergebnissen. Zusammenfassend lässt sich sagen, dass es sich bei dem 3D-gedruckten Einsatz um ein einfaches Gerät handelt, das an zahlreiche Modelle von Co-Kulturen mit adhärenten Zelltypen angepasst werden kann.
Einleitung
In vivo kommunizieren Zellen entweder direkt (Zellkontakt) oder indirekt (durch Sekretion von Molekülen) miteinander. Um die Zellkommunikation zu untersuchen, können verschiedene Kokulturmodelle entwickelt werden, wie z. B. die direkte Co-Kultur (die verschiedenen Zelltypen befinden sich in direkter Interaktion im selben Well) und die kompartimentierte Co-Kultur (die verschiedenen Zelltypen befinden sich in indirekter Wechselwirkung in verschiedenen Kompartimenten eines Kultursystems)1. Darüber hinaus können konditionierte Medien für Co-Kultursysteme verwendet werden, bei denen die indirekte Wechselwirkung dadurch ermöglicht wird, dass sezernierte Moleküle, die in den konditionierten Medien eines Effektorzelltyps enthalten sind, auf eine Responderzelle Typ1 übertragen werden.
Im Falle von parakrinen Zellkommunikationsstudien liefern indirekte Co-Kultursysteme Modelle, die Zellinteraktionen in vivo stark widerspiegeln. Indirekte Kokultursysteme wurden entwickelt und kommerzialisiert, was die Etablierung indirekter Cokulturmodelle ermöglicht 2,3. Leider bieten die meisten indirekten Co-Kultursysteme nur zwei Kompartimente. Andere indirekte Co-Kultur-Systeme bieten mehrere Kompartimente, aber sie sind weniger skalierbar im Vergleich zu dem System, über das im vorliegenden Manuskript berichtet wird. Einige von ihnen erlauben keine klassische Visualisierung unter dem Mikroskop und stellen oft spezifische Anwendungsmethoden vor. In mehreren Studien wird die parakrine Kommunikation zwischen verschiedenen Zelltypen mit dem konditionierten Medienmodell 4,5,6,7 untersucht. Dies ist eine einfachere Art der Untersuchung im Vergleich zu indirekten Co-Kultursystemen, da keine spezifischen Methoden oder Materialien festgelegt werden müssen1. Auf der anderen Seite ist die Herstellung von konditionierten Medien zeitaufwändig und liefert nur Informationen über die einseitige Zellsignalisierung (Effektor zu Responder)1.
In dieser Arbeit wird ein neuer, einfacher Weg zur Untersuchung der Zellkommunikation vorgeschlagen. Durch die Kombination mehrerer Zelltypen in direkter oder indirekter Interaktion und in 2D- oder 3D-Formaten bieten die gedruckten Inserts zahlreiche Vorteile für den einfachen Aufbau von Co-Kulturmodellen. Der 3D-gedruckte Einsatz ist für die Platzierung in den Vertiefungen von 6-Well-Platten geeignet und ist kreisförmig und ermöglicht die Trennung des Wells in vier Kammern (zwei große Fächer und zwei kleine Fächer; Abbildung 1A). Die 3D-gedruckten Einsätze zeichnen sich durch das Fehlen eines Bodens aus. Somit stehen die Zellen in direktem Kontakt mit der Platte, auf der der Einsatz platziert wird. Darüber hinaus kann jedes Fach unabhängig von den anderen beschichtet werden. Darüber hinaus kann das Zellverhalten leicht unter dem Lichtmikroskop verfolgt werden. Das Vorhandensein von Kommunikationsfenstern in jeder Wand des Einsatzes ermöglicht es, zum optimalen Zeitpunkt ein gemeinsames Medium hinzuzufügen, um verschiedene Experimente der Co-Kultur durchzuführen. Zahlreiche Kombinationen von Kokulturen können durchgeführt werden, um die direkte und/oder indirekte Kommunikation zwischen mehreren Zelltypen zu untersuchen. So kann beispielsweise ein Modell der indirekten Co-Kultur zwischen vier verschiedenen Zelltypen in Monolayer und/oder in 3D (Sphäroide) entworfen werden. Eine Kombination aus direkten und indirekten Kokulturmodellen kann auch durch das Mischen verschiedener Zelltypen im selben Kompartiment durchgeführt werden. Die Wirkung komplexer Strukturen (Organoide, Gewebeexplantation usw.) auf verschiedene Zelltypen könnte ein weiteres Beispiel für Modelle sein, die erstellt werden können. Darüber hinaus sind die 3D-gedruckten Inserts kompatibel mit zellbiologischen Funktionsassays (Proliferation, Migration, Pseudoröhrenbildung, Differenzierung usw.) und mit biochemischen Tests (Extraktion von DNA, RNA, Protein, Lipiden usw.). Schließlich bieten die 3D-gedruckten Inserts eine breite Palette von experimentellen Schemata von Co-Kulturmodellen mit der Möglichkeit, gleichzeitig verschiedene Assays im selben Experiment in den verschiedenen Kompartimenten zu kombinieren.
Einige Kapazitäten der 3D-gedruckten Einsätze werden vorgestellt, um sie als schnelles und einfach zu bedienendes Co-Kulturmodell zu validieren. Im Vergleich zu einer bereits veröffentlichten Studie zur parakrinen Zellkommunikation wird die Fähigkeit der 3D-gedruckten Inserts als wertvolles Co-Kultur-Modell demonstriert. Um diesen Punkt zu beurteilen, wurde die Regulation der Endothelzellproliferation und -migration durch Keratinozyten zwischen dem 3D-gedruckten Insert-System und dem klassischen System unter Verwendung konditionierter Medien verglichen. Die 3D-gedruckten Einsätze ermöglichen es, im Vergleich zum herkömmlichen System mit konditionierten Medien schnell ähnliche Ergebnisse zu erzielen. In der Tat bieten die 3D-gedruckten Inserts ein robustes Modell, um Zellinteraktionen in beide Richtungen zu untersuchen, ohne dass konditionierte Medien hergestellt werden müssen, und mit der Möglichkeit, die Proliferations- und Migrationsassays im selben Experiment parallel durchzuführen.
Abschließend wird in dieser Arbeit ein neues und gebrauchsfertiges Modell zur Untersuchung der Zellkommunikation vorgeschlagen. Die 3D-gedruckten Einsätze sind mit allen adhärenten Zelltypen kompatibel und ermöglichen die Durchführung zahlreicher Kombinationen von Co-Kulturen, die darauf abzielen, näher an In-vivo-Bedingungen zu sein.
Protokoll
HINWEIS: Die 3D-Einsätze (Abbildung 1A) werden kommerziell beschafft und mit einem Photopolymerharz gedruckt, das mit Zellkultur und Autoklavieren biokompatibel ist (siehe Materialtabelle). In diesem Abschnitt wird ein detailliertes Protokoll zur Etablierung des Co-Kultur-Modells durch Inserts beschrieben (siehe Abbildung 1B). Es werden auch einige Anwendungsbeispiele bereitgestellt.
1. Einsetzen des sterilisierten Einsatzes in die 6-Well-Platten
- Mischen Sie die beiden im Kit enthaltenen Komponenten (siehe Materialtabelle), Lebensmittelsilizium (Reagenz A) und Katalysator (Reagenz B), in einem Verhältnis von 10:1 (v/v) gemäß den Anweisungen des Herstellers. (Abbildung 1Ba). Verwenden Sie einen sterilisierten Spatel mit 70 % Ethanol, um die beiden Komponenten zu mischen.
HINWEIS: Das Volumen der herzustellenden Siliziummischung hängt von der Anzahl der zu fixierenden Einsätze ab. Ein Überschuss an Katalysator kann dazu führen, dass das Siliziumgemisch zu schnell erstarrt. - Bringen Sie die Einsätze mit einer Pinzette auf die Silikonmischung auf, so dass sich die Mischung homogen am unteren Rand der Einsätze verteilt (Abbildung 1Bb). Setzen Sie die Einsätze in die Vertiefungen einer 6-Well-Platte ein und üben Sie sanften Druck auf die Einsätze aus, um sicherzustellen, dass die Einsätze in engem Kontakt mit der Platte stehen, um ein Auslaufen des Zellkulturmediums zu vermeiden (Abbildung 1Bc).
- Stellen Sie die Platte auf 37 °C, um den Erstarrungsprozess des Siliziums für 1 h zu unterstützen.
HINWEIS: Die Erstarrungszeit hängt von der Menge des zugegebenen Katalysators ab. - Nach dem Erstarren sterilisieren Sie die Platten mit den Einsätzen, indem Sie sie 30 Minuten bis 1 Stunde lang in ein 70%iges Ethanolbad tauchen.
- Entsorgen Sie den Alkohol durch Pipettieren und lassen Sie die Platte über Nacht (Deckel offen) in einer Zellkulturhaube trocknen.
HINWEIS: Der Alkohol muss vollständig verdampft sein, bevor der nächste Schritt durchgeführt wird, um Zellfixierung und Toxizität zu vermeiden. Die gebrauchsfertige Platte mit den Einsätzen kann vor der Verwendung unter trockenen und sterilen Bedingungen bei Raumtemperatur mehrere Tage gelagert werden.
2. Beschichtungen wie Poly-L-Lysin oder Poly-HEMA (optionaler Schritt)
HINWEIS: In diesem Experiment wird keine Beschichtung durchgeführt, und die Schritte werden bereitgestellt, um über die Möglichkeit der Beschichtung der Einsätze zu informieren.
- Bereiten Sie die Beschichtungslösung gemäß den Anweisungen des Herstellers vor.
- Berücksichtigen Sie ein Volumen von 200-400 μl für die größten Kompartimente und ein Volumen von 50-100 μl für die kleinsten Kompartimente für die Beschichtung des Einsatzes. Geben Sie die Beschichtungslösung in die einzelnen Fächer.
- Lassen Sie die Beschichtung nach Herstellerangaben unter sterilen Bedingungen trocknen.
3. Aussaat der Zellen
- Kultivieren Sie die Keratinozyten der äußeren Wurzelscheide (KORS) und humane dermale mikrovaskuläre Endothelzellen (HDMECs), wie vom Hersteller empfohlen. Bereiten Sie die Zellsuspension vor, sobald die Zellen Konfluenz erreicht haben.
- Verwerfen Sie das Medium aus den Kolben und fügen Sie 5 ml Trypsin hinzu, um die Zellen zu lösen (siehe Materialtabelle).
- Den Kolben mit dem KORS 5 Minuten lang bei 37 °C mit 5 % CO2 erhitzen. Den Kolben mit den HDMECs 5 min bei Raumtemperatur inkubieren.
- Mischen Sie die Trypsinlösung, die KORS enthält, mit 5 ml mesenchymalem Stammzellmedium (MSCM), ergänzt mit 5 % fötalem Kälberserum (FBS) und Wachstumsfaktoren (Basalmedium mit Ergänzungskit, siehe Materialtabelle). Mischen Sie die Trypsinlösung, die die HDMECs enthält, mit 5 ml Endothelzellmedium (ECM), ergänzt mit 5 % FBS und Wachstumsfaktoren (siehe Materialtabelle).
- Die Zellen werden in ein steriles konisches 15-ml-Röhrchen überführt. Die KORS- und HDMEC-Suspensionen werden bei 200 x g für 5 min bei Raumtemperatur zentrifugiert.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 2 mL des jeweiligen Mediums.
- Mischen Sie 10 μl der Zellsuspension mit 10 μl Trypanblaufarbstoff (siehe Materialtabelle).
- Geben Sie 10 μl der Mischung in die Kammer des Zählobjektträgers.
- Legen Sie den Zählschieber in das Zellzählsystem ein (siehe Materialtabelle) und ermitteln Sie die Zellzahl und die Lebensfähigkeit.
- Bereiten Sie die Zellsuspension in einer Konzentration von 0,5 x 105 Zellen/ml im jeweiligen Medium vor.
HINWEIS: Wenn die verschiedenen Zelltypen unterschiedliche Adhärenzzeiten und/oder das Erreichen der idealen Konfluenz erfordern, kann die Zellimpfung je nach Zelltyp zu unterschiedlichen Zeitpunkten erfolgen.
- 800 μL bis 1 mL der Zellsuspension mit einer Pipette in die einzelnen großen Kompartimente und 100-150 μL in die einzelnen kleinen Kompartimente verteilen.
- Säen Sie die KORS mit 1 x 10 5 Zellen/ml in MSC M, ergänzt mit5 % FBS und Wachstumsfaktoren in einem der großenKompartimente .
- Seed HDMEC in ECM , ergänzt mit 5% FBS und Wachstumsfaktoren bei 2,5 x 103 Zellen/ml in den kleinen Kompartimenten und bei 1,25 x 105 Zellen/ml in den anderen großen Kompartimenten.
HINWEIS: Der Proliferationsassay kann in den kleinen Kompartimenten durchgeführt werden, und die Migrations- und Viabilitätsassays können in den großen Kompartimenten durchgeführt werden. Die Konzentration der ausgesäten Zellen wurde nach den Empfehlungen des Herstellers optimiert. Diese Konzentration ermöglicht eine gute Lebensfähigkeit der Zellen nach 24-48 h Inkubation.
- Platzieren Sie die Zellkulturplatte bei 37 °C mit 5 %CO2 oder unter den üblichen Bedingungen, um die Zelladhäsion und/oder -reifung zu ermöglichen.
HINWEIS: Inkubieren Sie die Zellen 24-48 Stunden lang, ohne das Medium zu wechseln. Bei Bedarf kann das Medium der Fächer unabhängig voneinander gewechselt werden.
4. Implementierung der Co-Kultur (Abbildung 1Bd)
HINWEIS: Die Implementierung der Co-Kultur entspricht dem Zeitpunkt, zu dem das gemeinsame Medium hinzugefügt wird. Die Hinzufügung eines einzigartigen Mediums für alle Zelltypen in den verschiedenen Kompartimenten bietet die Möglichkeit einer parakrinen Kommunikation zwischen den Zellen aufgrund des Vorhandenseins von Kommunikationsfenstern (eiförmige Löcher in den Wänden der 3D-gedruckten Einsätze). Führen Sie die Schritte 4.1 bis 4.3 aus, um die Co-Kultur zu implementieren.
- Entleeren Sie das Nährmedium mit einer Pipette aus den verschiedenen Fächern der Einsätze. Im Falle einer 3D-Sphäroidzellkultur ist das Medium sehr vorsichtig zu entsorgen.
- Spülen Sie die Zellen mit 1 ml 37 °C warmem PBS in den großen Fächern und 200 μl 37 °C warmem PBS in den kleinen Kammern. Achten Sie auf eine sanfte Wäsche, um die Zellen nicht abzulösen.
- Fügen Sie 3 ml eines gängigen Mediums hinzu, das so ausgewählt wurde, dass es für alle Zelltypen kompatibel ist.
HINWEIS: In dieser Studie wird der basale ECM (ohne FBS und Wachstumsfaktoren) verwendet. Stellen Sie sicher, dass das Medium alle Fächer abdeckt (Ebene über den Kommunikationsfenstern [eiförmige Löcher in den Wänden], wie in Abbildung 1A dargestellt). - Die Platte mit den Co-Kulturen für 24-48 h bei 37 °C mit 5 %CO2 platzieren.
5. Beobachtung, Zählen und Schaben von Zellen
- Beobachten Sie die Morphologie und zählen Sie die Zellzahl der verschiedenen Kompartimente während des Experiments unter einem Lichtmikroskop nach 24-48 h Inkubation.
HINWEIS: Die erwartete Anzahl der Zellen hängt von den verwendeten Zelltypen (Größe, Morphologie usw.) und von der Kompartimentgröße ab. In diesem Experiment werden zwischen 0,5 x 10 6-1 x 10 6 KORS/ml und zwischen 0,25 x 10 6-0,75 x 10 6 HDMECs/ml in den großen Kompartimenten gezählt. - Trennen Sie die Zellen mit Trypsin für die Zählung der Zellsuspensionen.
HINWEIS: Berücksichtigen Sie für die Zellablösungslösung ein Volumen von 100-500 μl für die größten Kompartimente und ein Volumen von 10-50 μl für die kleinsten Kompartimente. - Prüfen Sie die Viabilität mit Hilfe der Trypanblau-Färbung (siehe Schritte 3.1.6-3.1.8).
6. Einlegereinigung für das Recycling
- Entfernen Sie die Einsätze am Ende des Experiments durch eine leichte Drehung von der 6-Well-Platte (Abbildung 1Be).
- Entfernen Sie das Silikon von den Einsätzen, indem Sie es abziehen. Entfernen Sie bei Bedarf mit einem Spatel das restliche Silikon, das an den Wänden der Einsätze klebt (Abbildung 1Bf).
- Waschen Sie die Einsätze mit herkömmlichen Zellkulturreinigern und Reinigungsmitteln (Beispiel in der Materialtabelle).
- Sterilisieren Sie die Einsätze für die spätere Verwendung in einem Autoklaven (Feststoffzyklus, 121 °C für 20 min) oder durch Eintauchen in ein 70%iges Ethanolbad für 1 h.
HINWEIS: In diesem Schritt werden zwei Beispiele für mögliche Assays (Proliferations- und Migrationsassays) unter Verwendung der 3D-gedruckten Einsätze beschrieben (Abbildung 1Bd).
7. Zellproliferations-Assay - WST-1-Assay
- Befolgen Sie die Schritte 1-3.1, um die Zellen zu kultivieren.
HINWEIS: Befolgen Sie den Schritt in diesem Abschnitt, um das Co-Kultursystem zu implementieren, um die Wirkung des KORS-Sekretoms auf die HDMEC-Proliferation zu untersuchen. KORS-Zellen werden verwendet, um die zuvor veröffentlichten Daten zu vergleichen8.- Säen Sie die KORS mit 1 x 10 5 Zellen/ml in mesenchymalem Stammzellmedium (MSCM), ergänzt mit5% FBS und Wachstumsfaktoren in den großen Kompartimenten.
- Die Zellkulturplatte wird für 24 h bei 37 °C mit 5 % CO2 platziert.
- Aussaat der HDMECs in Endothelzellmedium (ECM), ergänzt mit 5% FBS und Wachstumsfaktoren bei 2,5 x 103 Zellen/ml in den kleinen Kompartimenten.
- Die Zellkulturplatte wird für 24-48 h bei 37 °C mit 5 %CO2 platziert.
- Entsorgen Sie die Medien aus allen Kompartimenten und implementieren Sie das Co-Kultur-System durch Zugabe von 3 ml nicht supplementiertem basales ECM (gemeinsames Zellkulturmedium für alle Kompartimente der 3D-gedruckten Einsätze).
- WST-1 wird im gemeinsamen Zellkulturmedium ECM verdünnt (1:10 Endverdünnung), um die WST-1-Lösung herzustellen.
HINWEIS: Bereiten Sie für das Volumen der WST-1-Lösung mindestens 500 μl zusätzliche Lösung für den Rohling vor. - Entsorgen Sie das Zellkulturmedium durch Pipettieren aus dem Einsatz.
- Geben Sie die WST-1-Lösung in die ausgewählten Kompartimente (150 μl für die kleinen Kompartimente und 600 μl für die großen Kompartimente). Die Platte wird auf 37 °C mit 5 % CO2 gestellt.
- Nach der optimalen 30-minütigen Zellinkubationszeit werden 100 μl des Inkubationsmediums aus jeder Bedingung auf eine 96-Well-Platte übertragen.
- Beurteilen Sie die kolorimetrische Reaktion mit einem Mikroplatten-Reader zwischen 420 nm und 480 nm.
- Legen Sie die Platte auf den Mikroplatten-Reader und klicken Sie auf die Schaltfläche Neues Protokoll bearbeiten.
- Wählen Sie den spezifischen Typ der verwendeten 96-Well-Platte (siehe Materialtabelle) und die Wellenlänge von 450 nm.
- Klicken Sie auf den Button Messung starten.
8. Zellmigrationsassay - Gerät mit zwei Migrationskammern
- Befolgen Sie die Schritte 1-3.1, um die Zellen zu kultivieren.
HINWEIS: Befolgen Sie die Schritte in diesem Abschnitt, um das Co-Kultursystem zu implementieren und die Wirkung des KORS-Sekretoms auf die HDMEC-Proliferation zu untersuchen.- Säen Sie die KORS mit 1 x 10 5 Zellen/ml in MSC M, ergänzt mit5 % FBS und Wachstumsfaktoren in einem der großenKompartimente .
- Die Zellkulturplatte wird für 24 h bei 37 °C mit 5 % CO2 platziert.
- Legen Sie die beiden Migrationskammern in das andere große Fach mit Einsätzen.
- Die HDMECs in ECM , ergänzt mit 5 % FBS und Wachstumsfaktoren, werden bei 7 x 105 Zellen/Well der beiden Migrationskammern ausgesät.
- Die Zellkulturplatte wird für 24 h bei 37 °C mit 5 % CO2 platziert.
- Entsorgen Sie das Medium und die beiden Migrationskammern nach 24 Stunden oder zu einem optimalen Zeitpunkt, je nach Zelltyp, der migriert. Implementieren Sie das Co-Kultursystem durch Zugabe von 3 ml nicht supplementiertem basalem ECM.
HINWEIS: Gehen Sie vorsichtig vor, um die Zellen nicht zu lösen. Wenn die Zellen sehr empfindlich auf eine Ablösung reagieren, die durch die Zugabe von gemeinsamem Medium hervorgerufen wird, ziehen Sie die beiden Migrationskammern nach der Zugabe des gemeinsamen Mediums ab.
- Beobachten und fotografieren Sie die von den Zellen bedeckte Oberfläche zu verschiedenen Zeitpunkten unter einem Phasenkontrastmikroskop mit 10-facher Vergrößerung.
HINWEIS: Die Bilder wurden mit einem Phasenkontrastmikroskop aufgenommen (siehe Materialtabelle). Die Bilder werden auf einem USB-Stick gespeichert und dann vom Wundheilungswerkzeug-Plugin der Software analysiert (siehe Materialtabelle). - Messen Sie die freigelegte Oberfläche mit einer klassischen quantitativen Analysesoftware.
- Öffnen Sie das Bild in der Software und aktivieren Sie das Wundheilungswerkzeug, das in der Makroliste verfügbar ist.
- Klicken Sie auf die Schaltfläche m , um die unbedeckte Oberfläche des Migrationsbildes zu messen.
- Die freiliegende Fläche wird nach folgender Formel berechnet:
Prozentsatz der Abdeckung = ([mittlere Fläche ohne Zellen bei T0 − Fläche ohne Zellen zum Zeitpunkt T]/mittlere Fläche ohne Zellen bei T0) × 100.
HINWEIS: Die 3D-gedruckten Einsätze sind vollständig an die meisten Techniken der Zellbiologie (z. B. Pseudoröhrchenbildungsassay, 3D-Kulturen) und für biochemische Experimente (z. B. Extraktion von DNA, RNA, Protein) angepasst.
Ergebnisse
In der vorliegenden Arbeit wurde ein optimiertes Co-Kultursystem beschrieben, um durch die Verwendung von konditionierten Medien robuste, zuverlässige und signifikante Daten zu erhalten, die mit klassischen Methoden vergleichbar sind. Die 3D-gedruckten Inserts ahmen die in vivo Mikroumgebungsbedingungen verschiedener Zelltypen im Zusammenspiel nach, indem sie die Schwierigkeiten und die zeitaufwändige Herstellung von konditionierten Medien im Vorfeld der Experimente überwinden. Eine zuvor veröffentlichte Studie wurde erneut durchgeführt, um die indirekten Wechselwirkungen zwischen zwei Zelltypen zu analysieren, die in Haarfollikeln vorhanden sind: menschliche mikrovaskuläre Endothelzellen (HDMECs) und menschliche Keratinozyten der äußeren Wurzelscheide (KORS)8. Hier wurde die Reproduzierbarkeit der Ergebnisse, die durch die Verwendung der 3D-gedruckten Inserts erzielt wurden, im Vergleich zur klassischen Methode mit konditionierten Medien zur Untersuchung indirekter Wechselwirkungen zwischen HDMECs und KORS demonstriert. Die zuvor in der Studie8 beschriebenen Zellkulturbedingungen waren die gleichen wie in der vorliegenden Arbeit. Sie wurden unter Berücksichtigung der Abmessungen der 3D-gedruckten Einsätze angepasst (siehe Protokoll). Zunächst waren der Phänotyp und die Zellviabilität zwischen den beiden Bedingungen (konditionierte Medien vs. .3D gedruckte Inserts) für alle Zelltypen vergleichbar (Abbildung 2). In der Tat wurde eine Lebensfähigkeit von 90 % in den Vertiefungen der 6-Well-Platten (Abbildung 2A und Tabelle 1) und 91 % in den 3D-gedruckten Einsätzen (Abbildung 2B und Tabelle 1) für KORS beobachtet. Die Viabilität von HDMECs betrug 85 % in den Wells der 6-Well-Platte (Abbildung 2C und Tabelle 2) gegenüber 86 % in den 3D-gedruckten Einsätzen (Abbildung 2D und Tabelle 2). Die Daten für die Zellviabilität wurden vom automatisierten Zellzähler (Materialtabelle) wie folgt berechnet: die Anzahl der lebensfähigen Zellen geteilt durch die Anzahl der Gesamtzellen (tote + lebensfähige Zellen). Die Mittelwerte wurden durch Berechnung der prozentualen Viabilität ermittelt, die in sechs unabhängigen Experimenten mit zwei Wiederholungen erzielt wurde (siehe Tabelle 1 und Tabelle 2).
Diese Ergebnisse deuteten darauf hin, dass der 3D-gedruckte Einsatz das Zellverhalten oder die Lebensfähigkeit im Vergleich zur üblichen Kultur auf 6-Well-Platten nicht veränderte. Daher wurden die 3D-gedruckten Inserts als neues Modell der Co-Kultur validiert.
Die zuvor gezeigten Parameter8 der indirekten Zellkommunikation wurden analysiert. Für alle Experimente wurde die Implementierung der 3D-gedruckten Co-Kultur nach den Protokollen in Übereinstimmung mit den klassischen Kulturbedingungen realisiert (siehe vorherige Arbeit8).
Zunächst wurde die indirekte Zellkommunikation zwischen KORS und HDMECs in den 3D-gedruckten Inserts durch Analyse der Zellproliferation bewertet und mit der klassischen Methode unter Verwendung konditionierter Medien verglichen (Abbildung 3). In Gegenwart von KORS in den Inserts (+ KORS) stieg die HDMEC-Proliferation signifikant um das 1,5-fache nach 24 h und um das 3,1-fache nach 48 h im Vergleich zur Kontrollbedingung ohne KORS (Kontrolle) an (Abbildung 3A). Diese Ergebnisse stimmten mit denen überein, die durch Experimente mit konditionierten Medien erzielt wurden (Abbildung 3B). Tatsächlich konnte gezeigt werden, dass das KORSCM die HDMEC-Proliferation nach 24 Stunden um das 1,5-fache und nach 48 Stunden um das 2,1-fache erhöht.
Das 3D-gedruckte Insert-Co-Kulturmodell wurde getestet, um die Wirkung von KORS auf die HDMEC-Migration zu bestimmen. Dieser Effekt wurde bereits im klassischen Co-Kultursystem mit konditionierten Mediennachgewiesen 8 (Abbildung 4). In der Kontrollbedingung ohne KORS (Kontrolle) wanderten die HDMECs und bedeckten nach 24 h etwa 44 % der Wundfläche (Abbildung 4A). In Gegenwart von KORS (+ KORS) wurde ein starker und signifikanter Anstieg der HDMEC-Migration beobachtet. Tatsächlich zeigte die Kinetik der Wundheilung, dass 43 %, 67 % und 99 % der Wundfläche nach 3 h, 12 h bzw. 24 h mit HDMECs bedeckt waren. Diese Ergebnisse stimmten mitdenen überein, die zuvor 8 erzielt wurden, wo gezeigt wurde, dass das KORSCM die HDMEC-Migration in ähnlicher Weise erhöht (Abbildung 4B).

Abbildung 1: Workflow, der die Implementierung der 3D-gedruckten Einlege-Co-Kultur von der Reinigung bis zum Recycling der Einlage zeigt . (A) Ein repräsentatives Bild des 3D-gedruckten Einsatzes. (B) Ein repräsentatives Beispiel für die in diesem Manuskript vorgestellten Assays ist illustriert. Es ist zu beachten, dass ein Proliferationsassay in einem Kompartiment des 3D-gedruckten Einsatzes parallel zu einem Migrationsassay durchgeführt werden kann, der in dem anderen Fach unter Verwendung eines Geräts mit zwei Migrationskammern durchgeführt wird, das in den anderen Kompartimenten des 3D-gedruckten Einsatzes platziert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
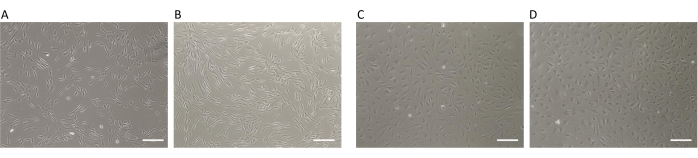
Abbildung 2: KORS- und HDMEC-Viabilität. (A,B) KORS-Morphologie (10x) in (A) einer Vertiefung einer 6-Well-Platte und (B) in einem 3D-gedruckten Einsatz. (C,D) HDMEC-Morphologie (10x) in (C) einer Vertiefung mit 6-Well-Platte und (D) in einem 3D-gedruckten Einsatz. Maßstab: 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
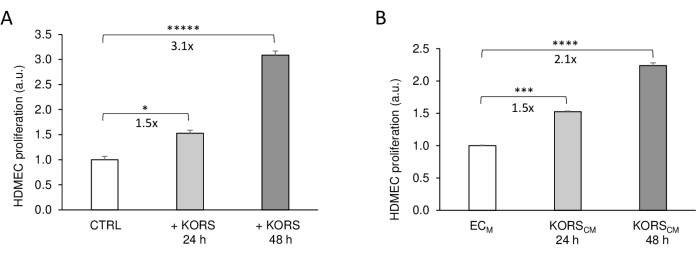
Abbildung 3: Wirkung von KORS auf die HDMEC-Proliferation. (A) Die HDMEC-Proliferation wurde mittels kolorimetrischem Assay unter Verwendung des WST-1-Farbstoffs im 3D-gedruckten Einsatz in Abwesenheit von KORS (Kontrolle = CTRL) oder in Gegenwart von KORS (+ KORS) für 24 h oder 48 h gemessen. (B) Die HDMEC-Proliferation wurde mittels kolorimetrischem Assay unter Verwendung des WST-1-Farbstoffs in Gegenwart von EC M-Basalzellkulturmedium oder KORSCM gemessen für 24 h oder 48 h. Die Ergebnisse werden als Mittelwert ± SEM ausgedrückt, n = 8 Wiederholungen, und es wurden zwei unabhängige Experimente durchgeführt. *p < 0,05, ***p < 0,001, ****p < 0,0001 und *****p < 0,00001. Die KORS wurden in ECM ohne FBS und Wachstumsfaktoren inkubiert. Nach 48 h wurde dieses konditionierte Medium gesammelt und bei −80 °C für die Experimente gelagert. Diese Zahl wurde von 8 abgeändert und mit freundlicher Genehmigung reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Auswirkung von KORS auf die HDMEC-Migration. (A) Die Migration von HDMEC im 3D-gedruckten Insert in Abwesenheit von KORS (Kontrolle = CTRL) oder in Gegenwart von KORS (+ KORS) wird dargestellt und als Prozentsatz der Wiederfindung quantifiziert. (B) Die Migration von HDMECs in der EGM oder KORSCM wird als Prozentsatz der Wiederfindung dargestellt und quantifiziert. Die Ergebnisse werden als Mittelwert ± REM ausgedrückt, n=3 Replikationen, und pro Replikat wurden drei Felder analysiert, zwei unabhängige Experimente wurden durchgeführt. **p<0,01, *****p<0,00001. Maßstab: 200 μm. Die KORS wurden in ECM ohne FBS und Wachstumsfaktoren inkubiert. Nach 48 h wurde dieses konditionierte Medium gesammelt und bei -80 °C für die Experimente gelagert. Diese Zahl wurde von 8 abgeändert und mit freundlicher Genehmigung reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Graf 1 | Graf 2 | Bedeuten | Gesamtmittelwert | ||
| 6-Well-Platte | Replizieren 1 | 95% | 84% | 90% | 90% |
| Replizieren 2 | 90% | 88% | 89% | ||
| Replizieren 3 | 85% | 89% | 87% | ||
| Replizieren 4 | 97% | 89% | 93% | ||
| Replizieren 5 | 88% | 94% | 91% | ||
| Replizieren 6 | 86% | 92% | 89% | ||
| 3D-gedruckte Einlage | Replizieren 1 | 92% | 89% | 91% | 91% |
| Replizieren 2 | 91% | 80% | 86% | ||
| Replizieren 3 | 93% | 92% | 93% | ||
| Replizieren 4 | 94% | 98% | 96% | ||
| Replizieren 5 | 88% | 86% | 87% | ||
| Replizieren 6 | 93% | 97% | 95% |
Tabelle 1: KORS-Viabilitätsmessung. Die KORS-Viabilität wurde in einer Vertiefung einer 6-Well-Platte und in einem 3D-gedruckten Einsatz mittels Trypanblau-Färbung und automatischer Zählung gemessen.
| Graf 1 | Graf 2 | Bedeuten | Gesamtmittelwert | ||
| 6-Well-Platte | Replizieren 1 | 90% | 88% | 89% | 85% |
| Replizieren 2 | 79% | 78% | 79% | ||
| Replizieren 3 | 71% | 75% | 73% | ||
| Replizieren 4 | 86% | 82% | 84% | ||
| Replizieren 5 | 91% | 88% | 90% | ||
| Replizieren 6 | 99% | 94% | 97% | ||
| 3D-gedruckte Einlage | Replizieren 1 | 99% | 86% | 93% | 86% |
| Replizieren 2 | 80% | 75% | 78% | ||
| Replizieren 3 | 79% | 80% | 80% | ||
| Replizieren 4 | 98% | 85% | 92% | ||
| Replizieren 5 | 85% | 78% | 82% | ||
| Replizieren 6 | 89% | 93% | 91% |
Tabelle 2: HDMEC-Viabilitätsmessung. Die HDMEC-Viabilität wurde in einer Vertiefung einer 6-Well-Platte und in einem 3D-gedruckten Einsatz mittels Trypanblau-Färbung und automatischer Zählung gemessen.
Diskussion
Die indirekte Zellkommunikation wird üblicherweise mit konditionierten Medien oder Co-Kultursystemen untersucht. Die konditionierte Medienaufbereitung ist im Vorfeld der Experimente zeitaufwändig und beschränkt sich auf einseitige Effektanalysen. Die vorherige Studie von Colin-Pierre et al.8 unter Verwendung konditionierter Medien wurde die indirekte Zellkommunikation zwischen zwei Zelltypen (HDMECs und KORS) durchgeführt. Die Daten dieser früheren Studie zeigten die Wirkung von KORS-konditionierten Medien auf die HDMEC-Proliferation und die Wirkung von KORS-konditionierten Medien auf die HDMEC-Migration, die Pseudoröhrenbildung und die GPC1-Expression8. In der vorliegenden Studie wird ein einfacherer und schnellerer Weg beschrieben, um die indirekte Zellkommunikation zu untersuchen. Tatsächlich ermöglichen 3D-gedruckte Einsätze Flexibilität bei der Versuchsplanung und mehrere Kombinationen von Zellkulturen. Um diese 3D-gedruckten Inserts als Modell für Co-Kulturen zu validieren, wurden Zellproliferation und Zellmigration analysiert und mit der vorherigen Studie unter Verwendung konditionierter Medien verglichen8. In beiden Studien wurde der Wundheilungsassay mit einem Gerät mit zwei Migrationskammern (Culture-Insert 2 Well in μ-Dish 35 mm) durchgeführt, das in dem Well platziert wurde, der den Insert enthielt oder nicht. Diese Migrationstestvorrichtung 9,10 unterscheidet sich von den Scratch-Assays11,12 durch die Tatsache, dass der Fußabdruck, der von der Wand (die die Wunde simuliert) hinterlassen wird, die die beiden Kammern begrenzt, konstant ist. Daher ist es in hohem Maße reproduzierbar. Die Ergebnisse der vorliegenden Studie führen zu einem ähnlichen Ergebnis im Vergleich zu konditionierten Medienexperimenten. Die 3D-gedruckten Einsätze verändern das Zellverhalten nicht und sind so angepasst, dass sie unabhängige Kompartimentbeschichtungen herstellen, die die Zelladhärenz fördern. Die 3D-gedruckten Einsätze ermöglichen jedoch auch die Herstellung einer Beschichtung mit Poly-HEMA, z. B. um eine geringe Anhaftung für die Kultur des Sphäroids/Organoids zu induzieren. Die indirekte Kommunikation zwischen HDMECs und KORS wurde hier als Beispiel für die vielfältigen Anwendungen der 3D-gedruckten Einsätze untersucht.
Dieses neue Gerät ist auf adhärente Zelltypen anwendbar, die eine spezielle Beschichtung benötigen oder nicht, und bietet eine erhebliche Zeitersparnis bei der Etablierung des Co-Kulturmodells. In der Tat ermöglichen die vier Kompartimente der 3D-gedruckten Einsätze die Kultivierung mehrerer Zelltypen in Monolayer oder in 3D (Aggregate oder Sphäroide) im selben Well mit unterschiedlichen Kombinationen. So kann beispielsweise die indirekte Kommunikation von vier Zelltypen in Monolayern, in 3D (Sphäroide) oder einer Kombination aus beidem analysiert werden. Während der Experimente wurden Sphäroide in den 3D-gedruckten Inserts mit einer Poly-HEMA-Beschichtung kultiviert (Daten nicht gezeigt). Die Sphäroide bestanden aus Zellen, die aufgrund der Bindungsplatte mit geringer Befestigung in 3D ausgesät und nach 48 h zur Analyse in den 3D-gedruckten Einsatz übertragen wurden. Nach mehrtägiger Kultur wurde das Wachstum der Sphäroide beobachtet. Diese Ergebnisse zeigen, dass der 3D-gedruckte Einsatz verwendet werden kann, um das 3D-Zellwachstum nach dem Transfer der Sphäroide auf die gleiche Weise wie in einer Kulturplatte13,14 zu verfolgen. Darüber hinaus kann eine Mischung verschiedener Zelltypen im selben Kompartiment in 2D oder 3D (Organoide) zusammengestellt werden, um sowohl die direkte als auch die indirekte Zellkommunikation zu untersuchen. In der Tat zeichnet die breite Palette an Modularität, die die 3D-gedruckten Einsätze bieten, dieses innovative Zell-Co-Kultur-System aus. Darüber hinaus ermöglicht das Vorhandensein der Kommunikationsfenster die Verwendung in einem gemeinsamen Medium für alle Zelltypen zu einem ausgewählten Zeitpunkt ohne die Unterstützung von konditionierten Medien. Daher ist diese Technik nicht auf Zellen anwendbar, die in Suspension kultiviert wurden. Die Wände, die die vier Kompartimente voneinander trennen, ermöglichen die Aussaat, Ernte und Analyse jedes Zelltyps unabhängig von den anderen. Es könnten verschiedene Anwendungen durchgeführt werden, wie z. B. Assays zur Bildung von Pseudoröhrchen und Proliferation, Migration, DNA, RNA, Proteine und andere Analysen. Die 3D-gedruckten Einsätze bieten zudem die Möglichkeit, beispielsweise die Wirkung von Molekülen oder extrazellulären Vesikeln zu analysieren. Darüber hinaus bietet die Tatsache, dass diese Einsätze im 3D-Druck hergestellt wurden, zahlreiche Möglichkeiten für die Fächeranordnung und zahlreiche Funktionstests.
Der kritische Schritt der 3D-gedruckten Einsatzversiegelung in der Platte muss jedoch sorgfältig bedacht werden. In der Tat ist eine homogene Verteilung des Siliziums entscheidend, um die Abdichtung zu gewährleisten und das Austreten von Zellkulturmedium oder Zellen von einem Kompartiment in ein anderes zu verhindern. Um Probleme zu vermeiden, sollte man darauf achten, dass das Silikon den Teil der 3D-gedruckten Einsätze bedeckt, der mit der Platte in Kontakt kommt. Vor der Aussaat der Zellen sollte die korrekte Abdichtung überprüft werden, indem man Zellkulturmedium in ein Kompartiment gibt und beobachtet, dass in den anderen Kompartimenten kein Medium austritt. Auch die Trocknungszeit des Siliziums nach der Inkubation im 70%igen Ethanolbad ist ein kritischer Schritt. In der Tat könnten die verbleibenden Spuren von Alkohol zu Zellfixierung und Toxizität führen. Um Probleme zu vermeiden, muss die Trocknungszeit eingehalten werden.
Zusammenfassend lässt sich sagen, dass die 3D-gedruckten Inserts mit den meisten adhärenten Zelltypen für die Kultur in 2D oder 3D kompatibel sind und zahlreiche Experimentiermethoden ermöglichen. Sie können für zahlreiche Kokulturstudien adaptiert werden und könnten ein neues Werkzeug zur Untersuchung der indirekten Zellkommunikation darstellen. Die 3D-gedruckten Einsätze sind modulierbar, flexibel, skalierbar und können zur Entwicklung von experimentellen Modellen für Studien von Physiopathologien wie Krebserkrankungen, Immunologie oder Angiogenese verwendet werden.
Offenlegungen
Die Autoren erklären, dass es keine konkurrierenden finanziellen Interessen gibt.
Danksagungen
Diese Studie wurde in Zusammenarbeit mit BASF Beauty Care Solutions durchgeführt. Frau Charlie Colin-Pierre ist eine von BASF / CNRS finanzierte Doktorandin.
Wir danken Herrn Mehdi Sellami für die Konzeption der 3D-gedruckten Einsätze.
Materialien
| Name | Company | Catalog Number | Comments |
| Autoclave | Getinge | APHP | Solid cycle, 121 °C for 20 min |
| Biomed Clear | Formlabs | RS-F2-BMCL-01 | Impression performed by 3D-Morphoz company (Reims, France) |
| Cell culture detergents | Tounett | A18590/0116 | |
| Cell Proliferation Reagent WST-1 | Roche | 11,64,48,07,001 | |
| Counting slide | NanoEnTek | EVE-050 | |
| Culture-Insert 2 Well in μ-Dish 35 mm | Ibidi | 80206 | two-migration chambers device. |
| Endothelial cell medium | ScienCell | 1001 | Basal medium +/- 25 mL of fetal bovine serum (FBS, 0025), 5 mL of endothelial cell growth supplement (ECGS, 1052), and 5 mL of penicillin/streptomycin solution (P/S, 0503). |
| EVE Automated cell counter | NanoEnTek | NESCT-EVE-001E | |
| EVOS XL Core | Fisher Scientific | AMEX1200 | 10x of magnification |
| Food silicon reagent and catalyst kit | Artificina | RTV 3428 A and B | (10:1) |
| FORM 3B printer | Formlabs | PKG-F3B-WSVC-DSP-BASIC | Impression performed by 3D-Morphoz company |
| Human Dermal Microvascular Endothelial Cells (HDMEC) | ScienCell | 2000 | |
| Keratinocytes of Outer Root Sheath (KORS ) | ScienCell | 2420 | |
| Macro Wound Healing Tool Software | ImageJ | Software used for the measurement of the uncovered surface (for migration assays) | |
| Mesenchymal stem cell medium | ScienCell | 7501 | Basal medium +/-25 mL of fetal bovine serum (FBS, 0025), 5 mL of mesenchymal stem cell growth supplement (MSCGS, 7552), and 5 mL of penicillin/streptomycin solution (P/S, 0503) |
| Microplate reader SPECTRO star NANO | BMG Labtech | BMG LABTECH software | |
| PBS | Promocell | C-40232 | Without Ca2+ / Mg2+ |
| Trypan Blue Stain | NanoEnTek | EBT-001 | |
| Trypsin / EDTA | Promocell | C-41020 | Incubation of KORS at 37 °C with 5% CO2 for 5 min. Incubation of HDMECs for 5 min at room temperature |
| 96-well plate Nunclon Delta Surface | Thermoscientific | 167008 |
Referenzen
- Regier, M. C., Alarid, E. T., Beebe, D. J. Progress towards understanding heterotypic interactions in multi-culture models of breast cancer. Integrative Biology. 8 (6), 684-692 (2016).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Mesenchymal stem cell isolation from pulp tissue and co-culture with cancer cells to study their interactions. Journal of Visualized Experiments. (143), e58825(2019).
- Lin, J., et al. Long non-coding RNA UBE2CP3 enhances HCC cell secretion of VEGFA and promotes angiogenesis by activating ERK1/2/HIF-1α/VEGFA signalling in hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 113(2018).
- Soares, N. L., et al. Carbon monoxide modulation of microglia-neuron communication: Anti-neuroinflammatory and neurotrophic role. Molecular Neurobiology. 59 (2), 872-889 (2022).
- Al Halawani, A., Abdulkhalek, L., Mithieux, S. M., Weiss, A. S. Tropoelastin promotes the formation of dense, interconnected endothelial networks. Biomolecules. 11 (9), 1318(2021).
- Mercatali, L., et al. Development of a human preclinical model of osteoclastogenesis from peripheral blood monocytes co-cultured with breast cancer cell lines. Journal of Visualized Experiments. (127), e56311(2017).
- Orona, N. S., Astort, F., Maglione, G. A., Yakisich, J. S., Tasat, D. R. Direct and indirect effect of air particles exposure induce Nrf2-dependent cardiomyocyte cellular response in vitro. Cardiovascular Toxicology. 19 (6), 575-587 (2019).
- Colin-Pierre, C., et al. The glypican-1/HGF/C-met and glypican-1/VEGF/VEGFR2 ternary complexes regulate hair follicle angiogenesis. Frontiers in Cell and Developmental Biology. 9, 781172(2021).
- Toubal, A., et al. The NC1 domain of type XIX collagen inhibits melanoma cell migration. European Journal of Dermatology. 20 (6), 712-718 (2010).
- Wu, A. -L., et al. Role of growth factors and internal limiting membrane constituents in müller cell migration. Experimental Eye Research. 202, 108352(2021).
- Oudart, J. -B., et al. Plasmin releases the anti-tumor peptide from the NC1 domain of collagen XIX. Oncotarget. 6 (6), 3656-3668 (2015).
- Martinotti, S., Ranzato, E. Scratch wound healing assay. Methods in Molecular Biology. 2109, 225-229 (2020).
- Cattin, S., Ramont, L., Rüegg, C. Characterization and in vivo validation of a three-dimensional multi-cellular culture model to study heterotypic interactions in colorectal cancer cell growth, invasion and metastasis. Frontiers in Bioengineering and Biotechnology. 6, 97(2018).
- Ma, Y. N., et al. Three-dimensional spheroid culture of adipose stromal vascular cells for studying adipogenesis in beef cattle. Animal. 12 (10), 2123-2129 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten