Method Article
Un insert innovant imprimé en 3D conçu pour permettre des cultures cellulaires 2D et 3D simples
Dans cet article
Résumé
Dans cet article, un insert nouvellement conçu imprimé en 3D est présenté comme un modèle de co-culture et validé par l’étude de la communication intercellulaire paracrine entre les cellules endothéliales et les kératinocytes.
Résumé
Les analyses classiques de la communication indirecte entre différents types de cellules nécessitent l’utilisation de milieux conditionnés. De plus, la production de milieux conditionnés reste chronophage et éloignée des conditions physiologiques et pathologiques. Bien que quelques modèles de co-culture soient disponibles dans le commerce, ils restent limités à des tests spécifiques et concernent principalement deux types de cellules.
Ici, on utilise des inserts imprimés en 3D qui sont compatibles avec de nombreux tests fonctionnels. L’insert permet la séparation d’un puits d’une plaque à 6 puits en quatre compartiments. Un large éventail de combinaisons peut être défini. De plus, des fenêtres sont conçues dans chaque paroi des compartiments de manière à ce que la communication intercellulaire potentielle entre chaque compartiment soit possible dans le milieu de culture d’une manière dépendante du volume. Par exemple, la communication intercellulaire paracrine peut être étudiée entre quatre types de cellules en monocouche, en 3D (sphéroïdes), ou en combinant les deux. De plus, un mélange de différents types de cellules peut être ensemencé dans le même compartiment au format 2D ou 3D (organoïdes). L’absence de fond dans les inserts imprimés en 3D permet les conditions de culture habituelles sur la plaque, un éventuel revêtement sur la plaque contenant l’insert, et une visualisation directe par microscopie optique. Les multiples compartiments offrent la possibilité de collecter différents types de cellules indépendamment ou d’utiliser, dans chaque compartiment, différents réactifs pour l’extraction d’ARN ou de protéines. Dans cette étude, une méthodologie détaillée est fournie pour utiliser le nouvel insert imprimé en 3D comme système de co-culture. Pour démontrer plusieurs capacités de ce modèle flexible et simple, des tests fonctionnels de communication cellulaire précédemment publiés ont été effectués dans les nouveaux inserts imprimés en 3D et se sont avérés reproductibles. Les inserts imprimés en 3D et la culture cellulaire conventionnelle à l’aide de milieux conditionnés ont conduit à des résultats similaires. En conclusion, l’insert imprimé en 3D est un dispositif simple qui peut être adapté à de nombreux modèles de co-cultures avec des types de cellules adhérentes.
Introduction
In vivo, les cellules communiquent entre elles soit directement (contact cellulaire), soit indirectement (par sécrétion de molécules). Pour étudier la communication cellulaire, différents modèles de co-culture peuvent être développés, tels que la co-culture directe (les différents types de cellules sont en interaction directe dans le même puits) et la co-culture compartimentée (les différents types de cellules sont en interaction indirecte dans différents compartiments d’un système de culture)1. De plus, les milieux conditionnés peuvent être utilisés pour les systèmes de co-culture, où l’interaction indirecte est rendue possible par le transfert de molécules sécrétées contenues dans le milieu conditionné d’un type de cellule effectrice à une cellule répondeusede type 1.
Dans le cas des études de communication cellulaire paracrine, les systèmes de co-culture indirecte fournissent des modèles qui reflètent fortement les interactions cellulaires in vivo. Des systèmes de co-culture indirecte ont été développés et commercialisés, permettant la mise en place de modèles de co-culture indirecte 2,3. Malheureusement, la plupart des systèmes de co-culture indirecte ne comportent que deux compartiments. D’autres systèmes de co-culture indirecte offrent plusieurs compartiments, mais ils sont moins évolutifs que le système décrit dans le présent manuscrit. Certains d’entre eux ne permettent pas une visualisation classique au microscope, et ils présentent souvent des méthodes d’application spécifiques. Dans plusieurs études, la communication paracrine entre différents types de cellules est sondée par le modèle de milieu conditionné 4,5,6,7. Il s’agit d’une méthode d’investigation plus facile par rapport aux systèmes de co-culture indirects, car elle ne nécessite pas de méthodes ou de matériaux spécifiques pour être établie1. D’autre part, la préparation des milieux conditionnés prend du temps et ne fournit des informations que sur la signalisation cellulaire unidirectionnelle (effecteur à répondeur)1.
Dans cet article, une nouvelle façon simple d’étudier la communication cellulaire est proposée. Permettant la combinaison de plusieurs types de cellules en interaction directe ou indirecte et dans des formats 2D ou 3D, les inserts imprimés présentent de nombreux avantages pour mettre en place facilement des modèles de co-culture. Adapté pour être placé dans les puits de plaques de 6 puits, l’insert imprimé en 3D est circulaire et permet de séparer le puits en quatre compartiments (deux grands compartiments et deux petits compartiments ; Graphique 1A). Les inserts imprimés en 3D se caractérisent par l’absence de fond. Ainsi, les cellules sont en contact direct avec la plaque sur laquelle l’insert est placé. De plus, chaque compartiment peut être revêtu indépendamment des autres. De plus, le comportement des cellules peut être facilement suivi au microscope optique. La présence de fenêtres de communication dans chaque paroi de l’insert permet l’ajout, au moment optimal, d’un support commun pour réaliser différentes expériences de co-culture. De nombreuses combinaisons de co-culture peuvent être réalisées pour étudier la communication directe et/ou indirecte entre plusieurs types de cellules. Par exemple, un modèle de co-culture indirecte entre quatre types de cellules différentes en monocouche et/ou en 3D (sphéroïdes) peut être conçu. Une combinaison de modèles de co-culture directe et indirecte peut également être réalisée en mélangeant différents types de cellules dans le même compartiment. L’effet de structures complexes (organoïdes, explants de tissus, etc.) sur différents types de cellules pourrait être un autre exemple de modèles qui peuvent être réalisés. De plus, les inserts imprimés en 3D sont compatibles avec les tests fonctionnels de biologie cellulaire (prolifération, migration, formation de pseudotubes, différenciation, etc.) et avec les tests de biochimie (extraction d’ADN, d’ARN, de protéines, de lipides, etc.). Enfin, les inserts imprimés en 3D offrent un large éventail de schémas expérimentaux de modèles de co-culture avec la possibilité de combiner simultanément différents tests dans la même expérience dans les différents compartiments.
Certaines capacités des inserts imprimés en 3D sont présentées pour les valider en tant que modèle de co-culture rapide et facile à utiliser. Par rapport à une étude précédemment publiée sur la communication des cellules paracrines, la capacité des inserts imprimés en 3D à être un modèle de co-culture précieux est démontrée. Pour évaluer ce point, la régulation de la prolifération et de la migration des cellules endothéliales par les kératinocytes a été comparée entre le système d’insertion imprimé en 3D et le système classique utilisant des milieux conditionnés. Les inserts imprimés en 3D permettent d’obtenir rapidement des résultats similaires par rapport au système conventionnel utilisant des supports conditionnés. En effet, les inserts imprimés en 3D fournissent un modèle robuste pour étudier les interactions cellulaires dans les deux sens sans avoir besoin de produire des milieux conditionnés et avec la possibilité d’effectuer en parallèle les tests de prolifération et de migration dans la même expérience.
Pour conclure, dans cet article, un nouveau modèle prêt à l’emploi pour étudier la communication cellulaire est proposé. Compatibles avec tous les types de cellules adhérentes, les inserts imprimés en 3D permettent d’effectuer de nombreuses combinaisons de co-culture qui visent à se rapprocher des conditions in vivo .
Protocole
REMARQUE : Les inserts 3D (Figure 1A) sont achetés dans le commerce et sont imprimés à l’aide d’une résine photopolymère biocompatible avec la culture cellulaire et l’autoclavage (voir le tableau des matériaux). Dans cette section, un protocole détaillé pour établir le modèle de co-culture par inserts est décrit (voir la figure 1B). Quelques exemples d’applications sont également fournis.
1. Mise en place de l’insert stérilisé dans les plaques à 6 puits
- Mélangez les deux composants fournis dans le kit (voir tableau des matériaux), le silicium alimentaire (réactif A) et le catalyseur (réactif B), dans un rapport de 10 :1 (v/v) selon les instructions du fabricant. (Figure 1Ba). Utilisez une spatule stérilisée à l’éthanol à 70 % pour mélanger les deux composants.
REMARQUE : Le volume du mélange de silicium à préparer dépend du nombre d’inserts à fixer. Un excès de catalyseur peut entraîner une solidification trop rapide du mélange de silicium. - Appliquez les inserts sur le mélange de silicone à l’aide d’une pince à épiler de manière à ce que le mélange soit uniformément réparti sur le bord inférieur des inserts (Figure 1Bb). Placez les inserts dans les puits d’une plaque à 6 puits et appliquez une légère pression sur les inserts pour vous assurer que les inserts sont en contact étroit avec la plaque afin d’éviter toute fuite du milieu de culture cellulaire (Figure 1Bc).
- Placez la plaque à 37 °C pour soutenir le processus de solidification du silicium pendant 1 h.
REMARQUE : Le temps de solidification dépend de la quantité de catalyseur qui a été ajoutée. - Après solidification, stériliser les plaques avec les inserts en les plongeant dans un bain d’éthanol à 70% pendant 30 min à 1 h.
- Jetez l’alcool par pipetage et laissez sécher la plaque (couvercle ouvert) pendant la nuit dans une hotte de culture cellulaire.
REMARQUE : L’alcool doit être complètement évaporé avant d’effectuer l’étape suivante pour éviter la fixation cellulaire et la toxicité. La plaque prête à l’emploi contenant les inserts peut être conservée pendant plusieurs jours avant utilisation dans des conditions sèches et stériles à température ambiante.
2. Revêtements tels que la poly-L-lysine ou la poly-HEMA (étape facultative)
REMARQUE : Le revêtement n’est pas effectué dans cette expérience et les étapes sont fournies pour informer sur la possibilité de revêtement des inserts.
- Préparez la solution de revêtement selon les instructions du fabricant.
- Considérez un volume de 200 à 400 μL pour les plus grands compartiments et un volume de 50 à 100 μL pour les plus petits compartiments pour le revêtement de l’insert. Ajoutez la solution de revêtement dans les compartiments individuels.
- Laissez sécher le revêtement comme indiqué par le fabricant dans des conditions stériles.
3. Ensemencement des cellules
- Cultivez les kératinocytes de la gaine radiculaire externe (KORS) et les cellules endothéliales microvasculaires dermiques humaines (HDMEC) selon les recommandations du fabricant. Préparez la suspension cellulaire une fois que les cellules atteignent la confluence.
- Jeter le milieu des flacons et ajouter 5 mL de trypsine pour détacher les cellules (voir le tableau des matériaux).
- Placer la fiole contenant le KORS à 37 °C avec 5% de CO2 pendant 5 min. Incuber le flacon contenant les HDMEC pendant 5 min à température ambiante.
- Mélanger la solution de trypsine contenant le KORS avec 5 mL de milieu de cellules souches mésenchymateuses (MSCM) complété par 5 % de sérum de veau fœtal (FBS) et de facteurs de croissance (milieu basal avec trousse de supplémentation, voir le tableau des matériaux). Mélanger la solution de trypsine contenant les HDMEC avec 5 mL de milieu cellulaire endothélial (ECM) complété par 5 % de FBS et de facteurs de croissance (voir le tableau des matériaux).
- Transférer les cellules dans un tube conique stérile de 15 ml. Centrifuger les suspensions KORS et HDMEC à 200 x g pendant 5 min à température ambiante.
- Jeter le surnageant et remettre les cellules en suspension dans 2 mL du milieu respectif.
- Mélanger 10 μL de la suspension cellulaire avec 10 μL de colorant bleu trypan (voir le tableau des matériaux).
- Ajouter 10 μL du mélange dans la chambre de la lame de comptage.
- Insérez la lame de comptage dans le système de comptage des cellules (voir le tableau des matériaux) et détectez le numéro de cellule et la viabilité.
- Préparez la suspension cellulaire à une concentration de 0,5 x 105 cellules/mL dans le milieu respectif.
REMARQUE : Si les différents types de cellules nécessitent des temps d’adhérence différents et/ou pour atteindre la confluence idéale, l’ensemencement des cellules peut être effectué à des moments différents selon les types de cellules.
- Distribuer 800 μL à 1 mL de suspension cellulaire dans les grands compartiments individuels et 100 à 150 μL dans les petits compartiments individuels à l’aide d’une pipette.
- Ensemencer le KORS à raison de 1 x 10 5 cellules/mL dans du MSCM complété par5% de FBS et des facteurs de croissance dans l’un des grands compartiments.
- Semence HDMEC dans ECM complétée par 5 % de FBS et de facteurs de croissance à 2,5 x 103 cellules/mL dans les petits compartiments et à 1,25 x 105 cellules/mL dans l’autre grand compartiment.
REMARQUE : L’essai de prolifération peut être effectué dans les petits compartiments, et les tests de migration et de viabilité peuvent être effectués dans les grands compartiments. La concentration des cellules ensemencées a été optimisée selon les recommandations du fabricant. Cette concentration permet une bonne viabilité des cellules après 24 à 48 h d’incubation.
- Placer la plaque de culture cellulaire à 37 °C avec 5 % de CO2 ou dans les conditions habituelles pour permettre l’adhésion et/ou la maturation des cellules.
REMARQUE : Incuber les cellules pendant 24 à 48 h sans changer le milieu. Si nécessaire, le support des compartiments peut être modifié indépendamment.
4. Mise en œuvre de la co-culture (Figure 1Bd)
NOTE : La mise en place de la co-culture correspond au moment où le milieu commun est ajouté. L’ajout d’un milieu unique pour tous les types de cellules dans les différents compartiments offre la possibilité d’une communication paracrine entre les cellules en raison de la présence de fenêtres de communication (trous ovoïdes dans les parois des inserts imprimés en 3D). Pour mettre en œuvre la co-culture, suivez les étapes 4.1 à 4.3.
- Videz les milieux de culture des différents compartiments des inserts à l’aide d’une pipette. Dans le cas d’une culture de cellules sphéroïdes 3D, jetez le milieu très doucement.
- Rincez les cellules avec 1 mL de PBS chaud à 37 °C dans les grands compartiments et 200 μL de PBS chaud à 37 °C dans les petits compartiments. Assurez-vous d’un lavage doux pour ne pas détacher les cellules.
- Ajouter 3 mL d’un milieu commun choisi pour être compatible avec tous les types de cellules.
NOTA : Dans cette étude, l’ECbasale M (sans FBS ni facteurs de croissance) est utilisée. Assurez-vous que le support recouvre tous les compartiments (niveau au-dessus des fenêtres de communication [trous ovoïdes dans les murs], comme illustré à la figure 1A). - Placer la plaque contenant les co-cultures à 37 °C avec 5 % de CO2 pendant 24 à 48 h.
5. Observation, comptage et grattage des cellules
- Observer la morphologie et compter le nombre de cellules des différents compartiments pendant l’expérience sous un microscope optique après 24-48 h d’incubation.
NOTE : Le nombre de cellules attendues dépend des types de cellules utilisées (taille, morphologie, etc.) et de la taille du compartiment. Dans cette expérience, entre 0,5 x 10 6-1 x 10 6 KORS/mL et entre 0,25 x 106-0,75 x 106 HDMECs/mL sont comptés dans les grands compartiments. - Détachez les cellules à l’aide de trypsine pour le comptage des suspensions cellulaires.
REMARQUE : Pour la solution de détachement des cellules, considérez un volume de 100 à 500 μL pour les plus grands compartiments et un volume de 10 à 50 μL pour les plus petits compartiments. - Vérifiez la viabilité à l’aide d’une coloration au bleu trypan (voir les étapes 3.1.6 à 3.1.8).
6. Nettoyage des inserts pour le recyclage
- Retirez les inserts de la plaque à 6 puits à la fin de l’expérience en les tournant légèrement (Figure 1Be).
- Retirez le silicone des inserts en le tirant. Si nécessaire, utilisez une spatule pour retirer le silicium restant collé aux parois des inserts (Figure 1Bf).
- Lavez les inserts avec des détergents et des produits de nettoyage conventionnels pour cultures cellulaires (exemple fourni dans le tableau des matériaux).
- Stériliser les inserts pour une utilisation ultérieure en autoclave (cycle solide, 121 °C pendant 20 min) ou en les immergeant dans un bain d’éthanol à 70% pendant 1 h.
NOTE : À partir de cette étape, deux exemples de tests possibles (tests de prolifération et de migration) sont décrits à l’aide des inserts imprimés en 3D (Figure 1Bd).
7. Essai de prolifération cellulaire - Essai WST-1
- Suivez les étapes 1 à 3.1 pour cultiver les cellules.
REMARQUE : Suivez l’étape décrite dans cette section pour mettre en œuvre le système de co-culture afin d’étudier l’effet du sécrétome KORS sur la prolifération HDMEC. Les cellules KORS sont utilisées pour comparer les données publiées précédemment8.- Ensemencer le KORS à raison de 1 x 10 5 cellules/mL dans un milieu de cellules souches mésenchymateuses (MSCM) complété par5 % de FBS et des facteurs de croissance dans les grands compartiments.
- Placer la plaque de culture cellulaire à 37 °C avec 5 % de CO2 pendant 24 h.
- Ensemencer les HDMECs dans un milieu de cellules endothéliales (ECM) complété par 5% de FBS et de facteurs de croissance à raison de 2,5 x 103 cellules/mL dans les petits compartiments.
- Placez la plaque de culture cellulaire à 37 °C avec 5 % de CO2 pendant 24 à 48 h.
- Éliminer les milieux de tous les compartiments et mettre en œuvre le système de co-culture par l’ajout de 3 mL d’ECM basale non supplémentée (milieu de culture cellulaire commun à tous les compartiments des inserts imprimés en 3D).
- Diluer WST-1 dans le milieu de culture cellulaire commun ECM (dilution finale 1 :10) pour préparer la solution WST-1.
REMARQUE : Pour le volume de la solution WST-1, préparer au moins 500 μL de solution supplémentaire pour le blanc. - Éliminez le milieu de culture cellulaire de l’insert par pipetage.
- Ajouter la solution WST-1 aux compartiments sélectionnés (150 μL pour les petits compartiments et 600 μL pour les grands compartiments). Placez l’assiette à 37 °C avec 5 % de CO2.
- Après le temps d’incubation cellulaire optimal de 30 minutes, transférez 100 μL du milieu d’incubation de chaque condition sur une plaque à 96 puits.
- Évaluer la réaction colorimétrique à l’aide d’un lecteur de microplaques entre 420 nm et 480 nm.
- Placez la plaque sur le lecteur de microplaques et cliquez sur le bouton modifier un nouveau protocole.
- Sélectionnez le type spécifique de plaque à 96 puits (voir le tableau des matériaux) utilisé et la longueur d’onde de 450 nm.
- Cliquez sur le bouton démarrer la mesure.
8. Test de migration cellulaire - dispositif à deux chambres de migration
- Suivez les étapes 1 à 3.1 pour cultiver les cellules.
REMARQUE : Suivez les étapes de cette section pour mettre en œuvre le système de co-culture afin d’étudier l’effet du sécrétome KORS sur la prolifération HDMEC.- Ensemencer le KORS à raison de 1 x 10 5 cellules/mL dans du MSCM complété par5% de FBS et des facteurs de croissance dans l’un des grands compartiments.
- Placer la plaque de culture cellulaire à 37 °C avec 5 % de CO2 pendant 24 h.
- Placez le dispositif à deux chambres de migration dans l’autre grand compartiment d’inserts.
- Ensemencer les HDMECs dans ECM complété par 5% de FBS et de facteurs de croissance à 7 x 105 cellules/puits du dispositif à deux chambres de migration.
- Placer la plaque de culture cellulaire à 37 °C avec 5 % de CO2 pendant 24 h.
- Jetez le milieu et le dispositif à deux chambres de migration après 24 h ou à un moment optimal selon le type de cellule qui migre. Mettre en œuvre le système de co-culture par l’ajout de 3 mL d’ECM basale non supplémentée.
REMARQUE : Procédez avec précaution pour ne pas détacher les cellules. Si les cellules sont vraiment sensibles au décollement induit par l’ajout de milieu commun, retirez le dispositif à deux chambres de migration après l’ajout du milieu commun.
- Observez et prenez une photo de la surface recouverte par les cellules à différents moments sous un microscope à contraste de phase à un grossissement de 10x.
REMARQUE : Les photos sont prises à l’aide d’un microscope à contraste de phase (voir le tableau des matériaux). Les images sont enregistrées sur une clé USB puis analysées par le plugin d’outil de cicatrisation du logiciel (voir Table des matériaux). - Mesurez la surface non couverte à l’aide d’un logiciel d’analyse quantitative classique.
- Ouvrez l’image sur le logiciel et activez l’outil de cicatrisation disponible dans la liste des macros.
- Cliquez sur le bouton m pour mesurer la surface non couverte de l’image de migration.
- La surface non couverte est calculée selon la formule suivante :
Pourcentage de couverture = ([surface moyenne sans cellules à T0 − surface sans cellules à l’instant T]/surface moyenne sans cellules à T0) × 100.
NOTE : Les inserts imprimés en 3D sont totalement adaptés à la plupart des techniques de biologie cellulaire (telles que le test de formation de pseudotubes, les cultures 3D) et pour les expériences de biochimie (telles que l’extraction d’ADN, d’ARN, de protéines).
Résultats
Dans le présent travail, un système de co-culture optimisé a été décrit pour obtenir des données robustes, fiables et significatives comparables aux méthodes classiques grâce à l’utilisation de milieux conditionnés. Les inserts imprimés en 3D imitent les conditions du microenvironnement in vivo de différents types de cellules en interaction en surmontant les difficultés et la production fastidieuse de milieux conditionnés en amont des expériences. Une étude précédemment publiée a été remenée pour analyser les interactions indirectes entre deux types de cellules présentes dans les follicules pileux : les cellules endothéliales microvasculaires humaines (HDMEC) et les kératinocytes humains de la gaine radiculaire externe (KORS)8. Ici, la reproductibilité des résultats obtenus en utilisant les inserts imprimés en 3D par rapport à la méthode classique utilisant des milieux conditionnés pour étudier les interactions indirectes entre les HDMECs et KORS a été démontrée. Les conditions de culture cellulaire décrites précédemment dans l’étude8 étaient les mêmes que dans ce travail. Ils ont été adaptés en tenant compte des dimensions des inserts imprimés en 3D (voir le protocole). Tout d’abord, le phénotype et la viabilité cellulaire étaient comparables entre les deux conditions (milieux conditionnés vs inserts imprimés .3D) pour tous les types de cellules (Figure 2). En effet, une viabilité de 90 % a été observée dans les puits des plaques à 6 puits (Figure 2A et Tableau 1), et 91 % a été observée dans les inserts imprimés en 3D (Figure 2B et Tableau 1) pour KORS. La viabilité des HDMEC était de 85 % dans les puits de la plaque à 6 puits (Figure 2C et Tableau 2) contre 86 % dans les inserts imprimés en 3D (Figure 2D et Tableau 2). Les données relatives à la viabilité des cellules ont été calculées par le compteur automatisé de cellules (Table des matériaux) comme suit : le nombre de cellules viables divisé par le nombre total de cellules (cellules mortes + cellules viables). Les données moyennes ont été obtenues en calculant le pourcentage de viabilité obtenu dans six expériences indépendantes dans lesquelles deux répétitions ont été effectuées (voir les tableaux 1 et 2).
Ces résultats ont indiqué que l’insert imprimé en 3D n’a pas modifié le comportement ou la viabilité de la cellule par rapport à la culture habituelle sur des plaques à 6 puits. Par conséquent, les inserts imprimés en 3D ont été validés comme un nouveau modèle de co-culture.
Les paramètres8 précédemment démontrés de la communication cellulaire indirecte ont été analysés. Pour toutes les expériences, la mise en œuvre de la co-culture d’inserts imprimés en 3D a été réalisée en suivant les protocoles en accord avec les conditions de culture classiques (voir travaux précédents8).
Tout d’abord, les communications cellulaires indirectes entre KORS et HDMECs dans les inserts imprimés en 3D ont été évaluées en analysant la prolifération cellulaire et comparées à la méthode classique utilisant des milieux conditionnés (Figure 3). En présence de KORS dans les inserts (+ KORS), la prolifération HDMEC a augmenté de manière significative de 1,5 fois après 24 h et de 3,1 fois après 48 h par rapport à la condition de contrôle sans KORS (Control) (Figure 3A). Ces résultats sont conformes à ceux obtenus par des expériences sur milieux conditionnés (Figure 3B). En effet, il a été démontré que le KORSCM augmentait significativement la prolifération HDMEC de 1,5 fois après 24 h et de 2,1 fois après 48 h.
Le modèle de co-culture d’inserts imprimé en 3D a été testé pour déterminer l’effet de KORS sur la migration HDMEC. Cet effet a déjà été démontré dans le système classique de co-culture utilisant des milieux conditionnés8 (Figure 4). Dans la condition de contrôle sans KORS (contrôle), les HDMEC ont migré et ont couvert environ 44 % de la zone de la plaie après 24 h (Figure 4A). En présence de KORS (+ KORS), une augmentation forte et significative de la migration HDMEC a été observée. En effet, la cinétique de cicatrisation de la plaie a montré que 43 %, 67 % et 99 % de la surface de la plaie étaient recouverts de HDMEC après 3 h, 12 h et 24 h, respectivement. Ces résultats étaient conformes à ceux obtenus précédemment8, où il a été démontré que leKORS CM augmentait la migration HDMEC d’une manière similaire (Figure 4B).

Figure 1 : Flux de travail montrant la mise en œuvre de la co-culture de l’insert imprimé en 3D, du nettoyage au recyclage de l’insert. (A) Une image représentative de l’insert imprimé en 3D. (B) Un exemple représentatif des essais présentés dans ce manuscrit est illustré. Notez qu’un test de prolifération peut être effectué dans un compartiment de l’insert imprimé en 3D en parallèle d’un test de migration effectué dans l’autre compartiment à l’aide d’un dispositif à deux chambres de migration placé dans les autres compartiments des inserts imprimés en 3D. Veuillez cliquer ici pour voir une version agrandie de cette figure.
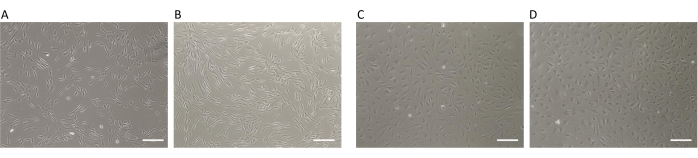
Figure 2 : Viabilité de KORS et HDMEC. (A,B) Morphologie KORS (10x) dans (A) un puits d’une plaque à 6 puits et (B) dans un insert imprimé en 3D. (C,D) Morphologie HDMEC (10x) dans (C) un puits de plaque à 6 puits et (D) dans un insert imprimé en 3D. Barre d’échelle : 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
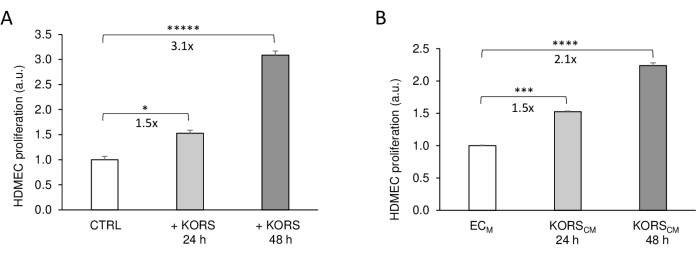
Figure 3 : Effet de KORS sur la prolifération HDMEC. (A) La prolifération HDMEC a été mesurée par dosage colorimétrique utilisant le colorant WST-1 dans l’insert imprimé en 3D en l’absence de KORS (témoin = CTRL) ou en présence de KORS (+ KORS) pendant 24 h ou 48 h. (B) La prolifération HDMEC a été mesurée par dosage colorimétrique utilisant le colorant WST-1 en présence d’un milieu de culture cellulaire basal ECM ou KORSCM pendant 24 h ou 48 h. Les résultats sont exprimés en moyenne ± MEB, n = 8 répétitions, et deux expériences indépendantes ont été réalisées. *p < 0,05, ***p < 0,001, ****p < 0,0001 et *****p < 0,00001. Les KORS ont été incubés dans ECM sans FBS ni facteurs de croissance. Après 48 h, ce milieu conditionné a été recueilli et stocké à −80 °C pour les expériences. Cette figure a été modifiée à partir de 8 et reproduite avec autorisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Effet de KORS sur la migration HDMEC. (A) La migration de HDMEC dans l’insert imprimé en 3D en l’absence de KORS (contrôle = CTRL) ou en présence de KORS (+ KORS) est indiquée et quantifiée sous forme de pourcentage de récupération. (B) La migration des HDMEC dans l’ECM ou le KORSCM est indiquée et quantifiée sous forme de pourcentage de récupération. Les résultats sont exprimés sous la forme de la moyenne ± MEB, n = 3 répétitions, et trois champs ont été analysés par répétition, deux expériences indépendantes ont été réalisées. **p<0,01, *****p<0,00001. Barre d’échelle : 200 μm. Les KORS ont été incubés dans ECM sans FBS ni facteurs de croissance. Après 48 h, ce milieu conditionné a été collecté et stocké à -80 °C pour les expériences. Cette figure a été modifiée à partir de 8 et reproduite avec autorisation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Chef d’accusation 1 | Chef d’accusation 2 | Méchant | Moyenne totale | ||
| Plaque à 6 puits | Répliquer 1 | 95% | 84% | 90% | 90% |
| Répliquer 2 | 90% | 88% | 89% | ||
| Répliquer 3 | 85% | 89% | 87% | ||
| Répliquer 4 | 97% | 89% | 93% | ||
| Répliquer 5 | 88% | 94% | 91% | ||
| Répliquer 6 | 86% | 92% | 89% | ||
| Insert imprimé en 3D | Répliquer 1 | 92% | 89% | 91% | 91% |
| Répliquer 2 | 91% | 80% | 86% | ||
| Répliquer 3 | 93% | 92% | 93% | ||
| Répliquer 4 | 94% | 98% | 96% | ||
| Répliquer 5 | 88% | 86% | 87% | ||
| Répliquer 6 | 93% | 97% | 95% |
Tableau 1 : Mesure de la viabilité de KORS. La viabilité de KORS a été mesurée dans un puits d’une plaque à 6 puits et dans un insert imprimé en 3D à l’aide d’une coloration au bleu trypan et d’un comptage automatique.
| Chef d’accusation 1 | Chef d’accusation 2 | Méchant | Moyenne totale | ||
| Plaque à 6 puits | Répliquer 1 | 90% | 88% | 89% | 85% |
| Répliquer 2 | 79% | 78% | 79% | ||
| Répliquer 3 | 71% | 75% | 73% | ||
| Répliquer 4 | 86% | 82% | 84% | ||
| Répliquer 5 | 91% | 88% | 90% | ||
| Répliquer 6 | 99% | 94% | 97% | ||
| Insert imprimé en 3D | Répliquer 1 | 99% | 86% | 93% | 86% |
| Répliquer 2 | 80% | 75% | 78% | ||
| Répliquer 3 | 79% | 80% | 80% | ||
| Répliquer 4 | 98% | 85% | 92% | ||
| Répliquer 5 | 85% | 78% | 82% | ||
| Répliquer 6 | 89% | 93% | 91% |
Tableau 2 : Mesure de la viabilité HDMEC. La viabilité HDMEC a été mesurée dans un puits d’une plaque à 6 puits et dans un insert imprimé en 3D à l’aide d’une coloration au bleu trypan et d’un comptage automatique.
Discussion
La communication cellulaire indirecte est couramment étudiée à l’aide de milieux conditionnés ou de dispositifs de système de co-culture. La préparation des milieux conditionnés prend beaucoup de temps en amont des expériences, et cette méthode est limitée à des analyses unilatérales des effets. L’étude précédente de Colin-Pierre et al.8 à l’aide de milieux conditionnés a été menée sur la communication cellulaire indirecte entre deux types de cellules (HDMECs et KORS). Les données de cette étude précédente ont démontré l’effet des milieux conditionnés par KORS sur la prolifération des HDMEC et l’effet des milieux conditionnés par KORS sur la migration des HDMEC, la formation de pseudotubes et l’expression de GPC18. Dans la présente étude, un moyen plus simple et plus rapide d’étudier la communication cellulaire indirecte est décrit. En fait, les inserts imprimés en 3D permettent une flexibilité dans la conception expérimentale et de multiples combinaisons de culture cellulaire. Pour valider ces inserts imprimés en 3D en tant que modèle pour les co-cultures, la prolifération et la migration cellulaires ont été analysées et comparées à l’étude précédente à l’aide de milieux conditionnés8. Dans les deux études, l’essai de cicatrisation a été réalisé à l’aide d’un dispositif à deux chambres de migration (Culture-Insert 2 Well in μ-Dish 35 mm) placé dans le puits contenant ou non l’insert. Ce dispositif d’essai de migration9,10 se distingue des tests11,12 par le fait que l’empreinte laissée par la paroi (simulant la plaie) délimitant les deux chambres est constante. Par conséquent, il est hautement reproductible. Les résultats de la présente étude ont conduit à une conclusion similaire par rapport aux expériences sur les milieux conditionnés. Les inserts imprimés en 3D n’altèrent pas le comportement des cellules et sont adaptés pour réaliser des revêtements de compartiments indépendants favorisant l’adhérence des cellules. Cependant, les inserts imprimés en 3D permettent également de réaliser un revêtement avec du poly-HEMA, par exemple, pour induire une faible fixation pour la culture du sphéroïde/organoïde. La communication indirecte entre les HDMEC et KORS a été étudiée ici comme un exemple des multiples applications fournies par les inserts imprimés en 3D.
Applicable aux types de cellules adhérentes qui nécessitent ou non un enrobage spécifique, ce nouveau dispositif permet un gain de temps significatif pour la mise en place du modèle de co-culture. En effet, les quatre compartiments des inserts imprimés en 3D permettent la culture de plusieurs types de cellules en monocouche ou en 3D (agrégats ou sphéroïdes) dans un même puits avec différentes combinaisons. Par exemple, la communication indirecte de quatre types de cellules en monocouche, en 3D (sphéroïdes), ou une combinaison des deux peut être analysée. Au cours des expériences, des sphéroïdes ont été cultivés dans les inserts imprimés en 3D à l’aide d’un revêtement poly-HEMA (données non présentées). Les sphéroïdes étaient constitués de cellules ensemencées en 3D grâce à la plaque de liaison à faible fixation et transférées après 48 h dans l’insert imprimé en 3D pour analyses. Après plusieurs jours de culture, la croissance des sphéroïdes a été observée. Ces résultats démontrent que l’insert imprimé en 3D peut être utilisé pour suivre la croissance cellulaire en 3D après le transfert des sphéroïdes de la même manière que dans une plaque de culture13,14. De plus, un mélange de différents types de cellules peut être assemblé dans le même compartiment en 2D ou en 3D (organoïdes) pour étudier à la fois la communication cellulaire directe et indirecte. En effet, la large gamme de modularité offerte par les inserts imprimés en 3D caractérise ce système innovant de co-culture cellulaire. De plus, la présence de fenêtres de communication permet une utilisation dans un milieu commun pour tous les types de cellules à un moment choisi sans l’aide de médias conditionnés. Ainsi, cette technique n’est pas applicable aux cellules cultivées en suspension. Les parois séparant les quatre compartiments permettent l’ensemencement, la récolte et l’analyse de chaque type de cellule indépendamment des autres. Plusieurs applications pourraient être faites, telles que les tests de formation de pseudotubes et la prolifération, la migration, l’ADN, l’ARN, les protéines et d’autres analyses. Les inserts imprimés en 3D offrent également la possibilité d’analyser l’effet de molécules ou de vésicules extracellulaires, par exemple. De plus, le fait que ces inserts aient été réalisés par impression 3D offre de nombreuses possibilités d’agencement des compartiments et de nombreux tests fonctionnels.
Cependant, l’étape critique de l’étanchéité de l’insert imprimé en 3D dans la plaque doit être examinée avec soin. En effet, une répartition homogène du silicium est cruciale pour assurer l’étanchéité et éviter les fuites de milieu de culture cellulaire ou de cellules d’un compartiment à l’autre. Pour éviter tout problème, il faut s’assurer que le silicone recouvre la partie des inserts imprimés en 3D qui sera en contact avec la plaque. Avant d’ensemencer les cellules, il faut vérifier l’étanchéité correcte en ajoutant du milieu de culture cellulaire dans un compartiment et en observant l’absence de fuite de milieu dans les autres compartiments. Le temps de séchage du silicium après l’incubation dans le bain d’éthanol à 70% est également une étape critique. En effet, les traces d’alcool restantes pourraient entraîner une fixation cellulaire et une toxicité. Pour éviter tout problème, le temps de séchage doit être respecté.
Pour conclure, les inserts imprimés en 3D sont compatibles avec la plupart des types de cellules adhérentes pour la culture en 2D ou 3D et permettent de nombreuses méthodes d’expérimentation. Ils peuvent être adaptés pour de nombreuses études de co-culture et peuvent fournir un nouvel outil pour étudier la communication cellulaire indirecte. Les inserts imprimés en 3D sont modulables, flexibles, évolutifs et peuvent être utilisés pour concevoir des modèles expérimentaux pour des études de physiopathologies telles que le cancer, l’immunologie ou l’angiogenèse.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas d’intérêts financiers concurrents.
Remerciements
Cette étude a été réalisée en collaboration avec BASF Beauty Care Solutions. Mme Charlie Colin-Pierre est doctorante financée par BASF et le CNRS.
Nous tenons à remercier M. Mehdi Sellami pour la conception des inserts imprimés en 3D.
matériels
| Name | Company | Catalog Number | Comments |
| Autoclave | Getinge | APHP | Solid cycle, 121 °C for 20 min |
| Biomed Clear | Formlabs | RS-F2-BMCL-01 | Impression performed by 3D-Morphoz company (Reims, France) |
| Cell culture detergents | Tounett | A18590/0116 | |
| Cell Proliferation Reagent WST-1 | Roche | 11,64,48,07,001 | |
| Counting slide | NanoEnTek | EVE-050 | |
| Culture-Insert 2 Well in μ-Dish 35 mm | Ibidi | 80206 | two-migration chambers device. |
| Endothelial cell medium | ScienCell | 1001 | Basal medium +/- 25 mL of fetal bovine serum (FBS, 0025), 5 mL of endothelial cell growth supplement (ECGS, 1052), and 5 mL of penicillin/streptomycin solution (P/S, 0503). |
| EVE Automated cell counter | NanoEnTek | NESCT-EVE-001E | |
| EVOS XL Core | Fisher Scientific | AMEX1200 | 10x of magnification |
| Food silicon reagent and catalyst kit | Artificina | RTV 3428 A and B | (10:1) |
| FORM 3B printer | Formlabs | PKG-F3B-WSVC-DSP-BASIC | Impression performed by 3D-Morphoz company |
| Human Dermal Microvascular Endothelial Cells (HDMEC) | ScienCell | 2000 | |
| Keratinocytes of Outer Root Sheath (KORS ) | ScienCell | 2420 | |
| Macro Wound Healing Tool Software | ImageJ | Software used for the measurement of the uncovered surface (for migration assays) | |
| Mesenchymal stem cell medium | ScienCell | 7501 | Basal medium +/-25 mL of fetal bovine serum (FBS, 0025), 5 mL of mesenchymal stem cell growth supplement (MSCGS, 7552), and 5 mL of penicillin/streptomycin solution (P/S, 0503) |
| Microplate reader SPECTRO star NANO | BMG Labtech | BMG LABTECH software | |
| PBS | Promocell | C-40232 | Without Ca2+ / Mg2+ |
| Trypan Blue Stain | NanoEnTek | EBT-001 | |
| Trypsin / EDTA | Promocell | C-41020 | Incubation of KORS at 37 °C with 5% CO2 for 5 min. Incubation of HDMECs for 5 min at room temperature |
| 96-well plate Nunclon Delta Surface | Thermoscientific | 167008 |
Références
- Regier, M. C., Alarid, E. T., Beebe, D. J. Progress towards understanding heterotypic interactions in multi-culture models of breast cancer. Integrative Biology. 8 (6), 684-692 (2016).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Mesenchymal stem cell isolation from pulp tissue and co-culture with cancer cells to study their interactions. Journal of Visualized Experiments. (143), e58825(2019).
- Lin, J., et al. Long non-coding RNA UBE2CP3 enhances HCC cell secretion of VEGFA and promotes angiogenesis by activating ERK1/2/HIF-1α/VEGFA signalling in hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 113(2018).
- Soares, N. L., et al. Carbon monoxide modulation of microglia-neuron communication: Anti-neuroinflammatory and neurotrophic role. Molecular Neurobiology. 59 (2), 872-889 (2022).
- Al Halawani, A., Abdulkhalek, L., Mithieux, S. M., Weiss, A. S. Tropoelastin promotes the formation of dense, interconnected endothelial networks. Biomolecules. 11 (9), 1318(2021).
- Mercatali, L., et al. Development of a human preclinical model of osteoclastogenesis from peripheral blood monocytes co-cultured with breast cancer cell lines. Journal of Visualized Experiments. (127), e56311(2017).
- Orona, N. S., Astort, F., Maglione, G. A., Yakisich, J. S., Tasat, D. R. Direct and indirect effect of air particles exposure induce Nrf2-dependent cardiomyocyte cellular response in vitro. Cardiovascular Toxicology. 19 (6), 575-587 (2019).
- Colin-Pierre, C., et al. The glypican-1/HGF/C-met and glypican-1/VEGF/VEGFR2 ternary complexes regulate hair follicle angiogenesis. Frontiers in Cell and Developmental Biology. 9, 781172(2021).
- Toubal, A., et al. The NC1 domain of type XIX collagen inhibits melanoma cell migration. European Journal of Dermatology. 20 (6), 712-718 (2010).
- Wu, A. -L., et al. Role of growth factors and internal limiting membrane constituents in müller cell migration. Experimental Eye Research. 202, 108352(2021).
- Oudart, J. -B., et al. Plasmin releases the anti-tumor peptide from the NC1 domain of collagen XIX. Oncotarget. 6 (6), 3656-3668 (2015).
- Martinotti, S., Ranzato, E. Scratch wound healing assay. Methods in Molecular Biology. 2109, 225-229 (2020).
- Cattin, S., Ramont, L., Rüegg, C. Characterization and in vivo validation of a three-dimensional multi-cellular culture model to study heterotypic interactions in colorectal cancer cell growth, invasion and metastasis. Frontiers in Bioengineering and Biotechnology. 6, 97(2018).
- Ma, Y. N., et al. Three-dimensional spheroid culture of adipose stromal vascular cells for studying adipogenesis in beef cattle. Animal. 12 (10), 2123-2129 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon