Method Article
簡単な2Dおよび3D細胞培養を可能にするように設計された革新的な3Dプリントインサート
要約
この論文では、新しく設計された3Dプリントインサートを共培養のモデルとして提示し、内皮細胞とケラチノサイト間のパラクリン細胞間コミュニケーションの研究を通じて検証します。
要約
異なる細胞タイプ間の間接的なコミュニケーションの古典的な分析では、馴化培地を使用する必要があります。さらに、馴化培地の製造は依然として時間がかかり、生理学的および病理学的状態からはほど遠い。共培養のいくつかのモデルが市販されていますが、それらは特定のアッセイに限定されたままであり、主に2種類の細胞用です。
ここでは、多数の機能アッセイに適合する3Dプリントインサートが使用されています。インサートにより、6ウェルプレートの1ウェルを4つのコンパートメントに分離できます。幅広い組み合わせを設定できます。さらに、コンパートメントの各壁に窓が設計されているため、各コンパートメント間の潜在的な細胞間コミュニケーションが培地内で体積依存的に可能です。例えば、パラクリンの細胞間コミュニケーションは、単層、3D(スフェロイド)、または両方を組み合わせることによって、4つの細胞タイプ間で研究することができます。さらに、異なる細胞タイプのミックスを2Dまたは3D(オルガノイド)フォーマットで同じコンパートメントに播種することができます。3Dプリントされたインサートに底がないため、プレート上の通常の培養条件、インサートを含むプレートへのコーティング、および光学顕微鏡による直接可視化が可能になります。複数のコンパートメントにより、異なる細胞タイプを個別に収集したり、各コンパートメントでRNAまたはタンパク質抽出に異なる試薬を使用したりすることができます。この研究では、新しい3Dプリントインサートを共培養システムとして使用するための詳細な方法論を提供します。この柔軟でシンプルなモデルのいくつかの能力を実証するために、以前に公開された細胞コミュニケーションの機能アッセイが新しい3Dプリントインサートで実行され、再現性があることが実証されました。3Dプリントされたインサートと、馴化培地を使用した従来の細胞培養でも、同様の結果が得られました。結論として、3Dプリントインサートは、接着細胞タイプとの共培養の多数のモデルに適応できるシンプルなデバイスです。
概要
生体内では、細胞は直接的(細胞接触)または間接的(分子の分泌による)のいずれかで互いに通信します。細胞コミュニケーションを研究するために、直接共培養(異なる細胞タイプが同じウェル内で直接相互作用する)や区画化共培養(異なる細胞タイプが培養システムの異なるコンパートメントで間接的に相互作用する)1など、さまざまな共培養モデルを開発できます。さらに、馴化培地は共培養系に使用でき、エフェクター細胞タイプの馴化培地に含まれる分泌分子がレスポンダー細胞タイプ1に移されることによって間接的な相互作用が可能になります。
パラクリン細胞コミュニケーション研究の場合、間接共培養システムは、in vivoでの細胞相互作用を強く反映するモデルを提供します。間接共培養システムが開発・実用化され、間接共培養モデルの確立が可能となった2,3。残念ながら、ほとんどの間接共培養システムは2つのコンパートメントしか提供しません。他の間接共培養システムは複数のコンパートメントを提供しますが、本稿で報告されているシステムと比較して拡張性が低くなります。それらのいくつかは顕微鏡下での古典的な視覚化を可能にしません、そしてそれらはしばしば特定の適用方法を提示します。いくつかの研究では、異なる細胞型間のパラクリン通信が馴化培地モデル4,5,6,7によって調査されています。これは、特定の方法や材料を確立する必要がないため、間接的な共培養システムと比較して調査が容易です1。一方、馴化培地の調製には時間がかかり、一方向の細胞シグナル伝達(エフェクターからレスポンダー)に関する情報のみを提供します1。
この論文では、細胞コミュニケーションを調査する新しい簡単な方法を提案します。直接的または間接的な相互作用および2Dまたは3Dフォーマットで複数の細胞タイプを組み合わせることができるプリントインサートは、共培養モデルを簡単に設定するための多くの利点を提供します。6ウェルプレートのウェルに配置するのに適した3Dプリントインサートは円形で、ウェルを4つのコンパートメント(2つの大きなコンパートメントと2つの小さなコンパートメント; 図1A)。3Dプリントされたインサートは、底部がないことを特徴としています。したがって、セルはインサートが配置されているプレートと直接接触しています。さらに、各コンパートメントは他のコンパートメントとは独立してコーティングすることができます。さらに、細胞の挙動は光学顕微鏡で簡単に追跡できます。インサートの各壁に通信窓が存在するため、最適なタイミングで共通の培地を追加して、共培養のさまざまな実験を行うことができます。共培養の多数の組み合わせを実行して、複数の細胞タイプ間の直接的および/または間接的なコミュニケーションを研究することができます。例えば、単層および/または3D(スフェロイド)の4つの異なる細胞タイプ間の間接共培養のモデルを設計できます。直接的および間接的な共培養モデルの組み合わせは、同じコンパートメント内で異なる細胞型を混合することによっても行うことができる。異なる細胞型に対する複雑な構造(オルガノイド、組織外植片など)の影響は、作成可能なモデルの別の例である可能性があります。さらに、3Dプリントされたインサートは、細胞生物学の機能アッセイ(増殖、遊走、偽管形成、分化など)および生化学試験(DNA、RNA、タンパク質、脂質などの抽出)と互換性があります。最後に、3Dプリントされたインサートは、共培養モデルの幅広い実験スキームを提供し、異なるコンパートメントでの同じ実験で同時に異なるアッセイを組み合わせる可能性があります。
3Dプリントされたインサートのいくつかの能力は、迅速で使いやすい共培養モデルとして検証するために提示されます。パラクリン細胞のコミュニケーションに関して実施された以前に発表された研究と比較して、3Dプリントされたインサートが貴重な共培養モデルになる能力が実証されています。この点を評価するために、ケラチノサイトによる内皮細胞の増殖と遊走の調節を、3Dプリントされたインサートシステムと馴化培地を使用した古典的なシステムとの間で比較しました。3Dプリントされたインサートは、馴化培地を使用する従来のシステムと比較して、同様の結果を迅速に得ることができます。実際、3Dプリントされたインサートは、馴化培地を製造する必要がなく、同じ実験で増殖アッセイと遊走アッセイを並行して実行する可能性なしに、両方向の細胞相互作用を研究するための堅牢なモデルを提供します。
結論として、この論文では、細胞コミュニケーションを研究するための新しいすぐに使用できるモデルが提案されています。すべての接着細胞タイプと互換性があり、3Dプリントされたインサートは、 in vivo 条件に近づくことを目的とした共培養の多数の組み合わせを実行できます。
プロトコル
注:3Dインサート(図1A)は商業的に調達され、細胞培養およびオートクレーブと生体適合性のあるフォトポリマー樹脂を使用して印刷されます( 材料表を参照)。このセクションでは、インサートによる共培養モデルを確立するための詳細なプロトコルについて説明します( 図1Bを参照)。アプリケーションの例もいくつか提供されています。
1. 滅菌済みインサートの6ウェルプレートへの配置
- キットに含まれている2つの成分( 材料の表を参照)、食品シリコン(試薬A)と触媒(試薬B)を、製造元の指示に従って10:1(v / v)の比率で混合します。(図1Ba)。70%エタノール滅菌スパチュラを使用して、2つの成分を混合します。
注意: 準備するシリコン混合物の量は、固定するインサートの数によって異なります。触媒が過剰になると、シリコン混合物の固化が速すぎる可能性があります。 - ピンセットを使用してシリコンミックスにインサートを適用し、混合物がインサートの下端に均一に分布するようにします(図1Bb)。インサートを6ウェルプレートのウェルに入れ、インサートに穏やかな圧力を加えて、インサートがプレートに密着し、細胞培養培地の漏れを防ぎます(図1Bc)。
- プレートを37°Cに置き、シリコンの凝固プロセスを1時間サポートします。
注:凝固の時間は、添加された触媒の量によって異なります。 - 固化後、プレートを70%エタノール浴に30分から1時間浸して、インサートでプレートを滅菌します。
- ピペッティングでアルコールを廃棄し、細胞培養フードでプレートを一晩乾燥させます(蓋を開けます)。
注:細胞固定と毒性を避けるために、次のステップを実行する前にアルコールを完全に蒸発させる必要があります。インサートを含むすぐに使用できるプレートは、室温で乾燥した無菌状態で使用する前に数日間保存できます。
2.ポリ-L-リジン、ポリ-HEMAなどのコーティング(オプションステップ)
注:この実験ではコーティングは実行されず、インサートをコーティングする可能性について通知するための手順が提供されています。
- 製造元の指示に従ってコーティング液を調製します。
- 最大のコンパートメントには200〜400 μLの容量、インサートのコーティングには最小のコンパートメントには50〜100 μLの容量を検討してください。コーティング溶液を個々のコンパートメントに追加します。
- 無菌条件下でメーカーが指示したようにコーティングを乾燥させます。
3.細胞の播種
- 外根鞘のケラチノサイト(KORS)およびヒト皮膚微小血管内皮細胞(HDMEC)をメーカーの推奨に従って培養します。細胞がコンフルエントに達したら、細胞懸濁液を調製します。
- フラスコから培地を廃棄し、5 mLのトリプシンを加えて細胞を剥離します( 材料表を参照)。
- KORSを入れたフラスコを5%CO2 で37°Cで5分間置きます。HDMECを含むフラスコを室温で5分間インキュベートします。
- KORSを含むトリプシン溶液を、5%ウシ胎児血清(FBS)および成長因子を添加した間葉系幹細胞培地(MSCM)5 mLと混合します(サプリメントキットを含む基礎培地、 材料表を参照)。HDMECを含むトリプシン溶液を、5%FBSおよび成長因子を添加した5 mLの内皮細胞培地(ECM)と混合します( 材料の表を参照)。
- 細胞を15 mLの滅菌コニカルチューブに移します。KORSおよびHDMEC懸濁液を200 x gで室温で5分間遠心分離します。
- 上清を廃棄し、細胞をそれぞれの培地2 mLに再懸濁します。
- 10 μLの細胞懸濁液を10 μLのトリパンブルー色素と混合します( 材料の表を参照)。
- 10μLの混合物を計数スライドのチャンバーに加える。
- カウントスライドをセルカウントシステムに挿入し( 材料表を参照)、細胞数と生存率を検出します。
- それぞれの培地に0.5 x 105 細胞/mLの濃度で細胞懸濁液を調製します。
注:異なる細胞タイプが異なる接着時間を必要とする場合、および/または理想的なコンフルエントに到達するために、細胞タイプに応じて異なる時点で細胞播種を行うことができます。
- 800 μL〜1 mLの細胞懸濁液を個々の大きなコンパートメントに、100〜150 μLをピペットで個々の小さなコンパートメントに分配します。
- 大きなコンパートメントの1つに5%FBSと成長因子を添加したMSCMに1 x 105細胞/ mLでKORSを播種します。
- ECM 中のシードHDMECに、小さなコンパートメントに2.5 x 103 細胞/ mLで、他の大きなコンパートメントに1.25 x 105 細胞/ mLで5%FBSと成長因子を添加しました。
注:増殖アッセイは小さなコンパートメントで実行でき、遊走および生存率アッセイは大きなコンパートメントで実行できます。播種された細胞の濃度は、メーカーの推奨に従って最適化されています。この濃度は、24〜48時間のインキュベーション後の細胞の良好な生存率を可能にする。
- 細胞培養プレートを5%CO2 で37°Cに置くか、通常の条件下で置き、細胞の接着および/または成熟を可能にします。
注:培地を交換せずに細胞を24〜48時間インキュベートします。必要に応じて、コンパートメントの媒体を個別に変更できます。
4. 共培養の実施(図1Bd)
注:共培養の実施は、共通培地が追加された時点に対応する。異なるコンパートメント内のすべての細胞タイプに固有の培地を追加することで、通信窓(3Dプリントインサートの壁にある卵形の穴)が存在するため、細胞間のパラクリン通信が可能になります。共同培養を実装するには、手順 4.1-4.3 に従います。
- ピペットを使用して、インサートの異なるコンパートメントの培地を空にします。3Dスフェロイド細胞培養の場合は、培地を非常に穏やかに廃棄してください。
- 大きなコンパートメントでは1 mLの37°C温かいPBSで細胞をすすぎ、小さなコンパートメントでは200 μLの37°C温かいPBSで細胞をすすぎます。細胞を剥がさないように穏やかに洗浄してください。
- すべての細胞タイプに適合するように選択された共通培地3 mLを追加します。
注:この研究では、基礎ECM (FBSと成長因子なし)が使用されます。媒体がすべてのコンパートメント( 図1Aに示すように、通信窓[壁の卵形の穴]の上の高さ)をカバーしていることを確認します。 - 共培養を含むプレートを5%CO2 で37°Cで24〜48時間置きます。
5. 細胞の観察、計数、スクレイピング
- 形態を観察し、24〜48時間のインキュベーション後に光学顕微鏡下で実験中に異なるコンパートメントの細胞数を数えます。
注:予想される細胞数は、使用する細胞の種類(サイズ、形態など)とコンパートメントのサイズによって異なります。この実験では、0.5 x 10 6-1 x 10 6 KORS/mL と 0.25 x 10 6-0.75 x 10 6 HDMEC/mL の間で大きなコンパートメントでカウントされます。 - 細胞懸濁計数のためにトリプシンを使用して細胞を剥離します。
注:細胞剥離溶液の場合、最大のコンパートメントの場合は100〜500 μLの容量、最小のコンパートメントの場合は10〜50 μLの容量を考慮してください。 - トリパンブルー染色を使用して生存率を確認します(手順3.1.6-3.1.8を参照)。
6.リサイクルのためのインサートクリーニング
- 実験の最後に、6ウェルプレートからインサートを少しひねって取り外します(図1Be)。
- シリコンをインサートから引き抜いて取り外します。必要に応じて、スパチュラを使用して、インサートの壁に付着している残りのシリコンを取り除きます(図1Bf)。
- 従来の細胞培養用洗剤と洗浄剤( 材料表の例)でインサートを洗浄します。
- オートクレーブ(固体サイクル、121°Cで20分間)で使用するために、または70%エタノール浴に1時間浸して、インサートを滅菌します。
注:このステップから、3Dプリントされたインサートを使用して可能なアッセイ(増殖アッセイと遊走アッセイ)の2つの例について説明します(図1Bd)。
7. 細胞増殖アッセイ - WST-1アッセイ
- 手順1〜3.1に従って細胞を培養します。
注:このセクションの手順に従って、HDMEC増殖に対するKORSセクレトームの影響を調べるために共培養システムを実装します。KORSセルは、以前に公開されたデータを比較するために使用されます8。- 大きなコンパートメントに5%FBSと成長因子を添加した間葉系幹細胞培地(MSCM)に1 x 105細胞/ mLでKORSを播種します。
- 細胞培養プレートを5%CO2 で37°Cで24時間置きます。
- HDMECを、5%FBSと成長因子を2.5 x 103細胞/mLで補充した内皮細胞培地(ECM)に小さなコンパートメントに播種します。
- 細胞培養プレートを5%CO2 で37°Cで24〜48時間置きます。
- すべてのコンパートメントから培地を廃棄し、3 mLの非添加基礎ECM (3Dプリントインサートのすべてのコンパートメントに共通の細胞培養培地)を添加して共培養システムを実装します。
- WST-1をECM 共通細胞培養培地(1:10最終希釈)で希釈し、WST-1溶液を調製します。
注意: WST-1溶液の容量については、ブランク用に少なくとも500μLの追加溶液を準備してください。 - 細胞培養培地をピペッティングでインサートから廃棄します。
- 選択したコンパートメントにWST-1溶液を追加します(小さなコンパートメントの場合は150 μL、大きなコンパートメントの場合は600 μL)。プレートを5%CO2で37°Cに置きます。
- 最適な30分の細胞インキュベーション時間の後、各条件から100 μLのインキュベーション培地を96ウェルプレートに移します。
- 420 nm〜480 nmのマイクロプレートリーダーを使用して比色反応を評価します。
- プレートをマイクロプレートリーダーに置き、ボタンをクリックします 新しい プロトコルを編集する.
- 使用する96ウェルプレート( 材料表参照)の特定のタイプと波長450 nmを選択します。
- ボタンをクリックしてください 測定を開始します。
8.細胞遊走アッセイ-2つの遊走チャンバー装置
- 手順1〜3.1に従って細胞を培養します。
注:このセクションの手順に従って共培養システムを実装し、HDMEC増殖に対するKORSセクレトームの影響を調査します。- 大きなコンパートメントの1つに5%FBSと成長因子を添加したMSCMに1 x 105細胞/ mLでKORSを播種します。
- 細胞培養プレートを5%CO2 で37°Cで24時間置きます。
- 2つの移行チャンバーデバイスをインサートの他の大きなコンパートメントに入れます。
- 5%FBSと成長因子を添加したECM にHDMECを2つの移行チャンバーデバイスの7 x 105 細胞/ウェルで播種します。
- 細胞培養プレートを5%CO2 で37°Cで24時間置きます。
- 培地と2つの遊走チャンバー装置は、24時間後、または遊走する細胞の種類に応じて最適な時間に廃棄します。3 mLの非添加基礎ECMを添加して共培養システムを実施します。
注意: セルを切り離さないように注意してください。細胞が共通培地の添加によって誘発される剥離に対して本当に敏感である場合は、共通培地の添加後に2つの遊走チャンバー装置を引き抜く。
- 異なる時点で細胞で覆われた表面を、位相差顕微鏡で10倍の倍率で観察し、写真を撮ります。
注意: 写真は位相差顕微鏡で撮影されています( 材料表を参照)。写真はUSBキーに保存され、ソフトウェアの創傷治癒ツールプラグインによって分析されます( 材料表を参照)。 - 従来の定量分析ソフトウェアを使用して、覆われていない表面を測定します。
- ソフトウェアで画像を開き、マクロリストで利用可能な創傷治癒ツールをアクティブにします。
- mボタンをクリックして、移行画像の覆われていない表面を測定します。
- 覆われていないサーフェスは、次の式に従って計算されます。
カバレッジの割合 = ([T0 にセルがない平均面積 - 時刻 T0 にセルがない面積]/T0 にセルがない平均面積) × 100。
注:3Dプリントされたインサートは、細胞生物学(偽管形成アッセイ、3D培養など)および生化学実験(DNA、RNA、タンパク質の抽出など)のほとんどの技術に完全に適合しています。
結果
本研究では、馴化培地を使用して、従来の方法に匹敵する堅牢で信頼性が高く、有意なデータを取得するために、最適化された共培養システムについて説明しました。3Dプリントされたインサートは、実験における上流のコンディショニング培地の困難さと時間のかかる生産を克服することにより、相互作用における異なる細胞タイプのin vivo微小環境条件を模倣します。毛包に存在する2つの細胞タイプ、ヒト微小血管内皮細胞(HDMEC)とヒト外根鞘(KORS)間の間接的な相互作用を分析するために、以前に発表された研究が再実施されました8。ここでは、HDMECとKORS間の間接的な相互作用を調査するために馴化培地を使用する従来の方法と比較して、3D印刷されたインサートを使用して得られた結果の再現性が実証されました。研究8で前述した細胞培養条件は、本研究と同じであった。それらは、3Dプリントされたインサートの寸法を考慮して調整されました(プロトコルを参照)。まず、表現型と細胞生存率は、すべての細胞タイプについて、2つの条件(馴化培地と.3D印刷インサート)の間で同等でした(図2)。実際、KORSについては、6ウェルプレートのウェルで90%の生存率が観察され(図2Aおよび表1)、3Dプリントされたインサート(図2Bおよび表1)では91%が観察されました。HDMECの生存率は、6ウェルプレートのウェルで85%(図2Cおよび表2)であったのに対し、3Dプリントインサートでは86%でした(図2Dおよび表2)。 細胞生存率のデータは、自動細胞カウンター(材料表)によって次のように計算されました:生細胞数を総細胞数(死細胞+生細胞)で割ったもの。平均データは、2回の反復が行われた6つの独立した実験で得られた生存率を計算することによって得られた(表1および表2を参照)。
これらの結果は、3Dプリントされたインサートが、6ウェルプレートでの通常の培養と比較して、細胞の挙動や生存率を変えないことを示しました。したがって、3Dプリントされたインサートは、共培養の新しいモデルとして検証されました。
間接的な細胞通信の以前に実証されたパラメータ8 を分析した。すべての実験について、3Dプリントされたインサート共培養の実装は、古典的な培養条件に従ったプロトコルに従って実現されました(以前の研究8を参照)。
まず、3DプリントインサートにおけるKORSとHDMEC間の間接的な細胞通信を、細胞増殖を分析し、馴化培地を使用した古典的な方法と比較することによって評価しました(図3)。インサートにKORSが存在する場合(+KORS)、HDMECの増殖は、KORSなしの対照条件(対照)と比較して、24時間後に1.5倍、48時間後に3.1倍に有意に増加しました(図3A)。これらの結果は、馴化培地実験により得られたものと一致した(図3B)。実際、KORSCM は、HDMECの増殖を24時間後に1.5倍、48時間後に2.1倍に有意に増加させることが示されました。
3Dプリントされたインサート共培養モデルをテストして、HDMEC移行に対するKORSの影響を判断しました。この効果は、馴化培地を用いた 古典的な共培養系で以前に実証されています8(図4)。KORS(コントロール)なしの対照条件では、HDMECは移動し、24時間後に創傷領域の約44%をカバーしました(図4A)。KORS(+ KORS)の存在下では、HDMEC移行の強力かつ有意な増加が観察された。実際、創傷治癒の動態は、創傷領域の43%、67%、および99%が、それぞれ3時間、12時間、および24時間後にHDMECによって覆われていることを示しました。これらの結果は、以前に得られたものと一致した8、ここでKORSCM は、同様の方法でHDMEC移行を増加させることが示された(図4B)。

図1:インサートの洗浄からリサイクルまでの3Dプリントインサート共培養の実装を示すワークフロー 。 (A)3Dプリントされたインサートの代表的な写真。(B)本原稿に提示されたアッセイの代表例を示す。増殖アッセイは、3Dプリントされたインサートの一方の区画において、3Dプリントされたインサートの他の区画に配置された2つの移行チャンバー装置を用いて他方の区画において実施される移動アッセイと並行して行うことができることに留意されたい。 この図の拡大版を表示するには、ここをクリックしてください。
図2:KORSとHDMECの実行率。 (A,B)KORSの形態(10倍)(A)6ウェルプレートのウェルおよび(B)3Dプリントインサート。(C,D)HDMEC形態(10x)(C)ウェルの6ウェルプレートおよび(D)3Dプリントインサート。スケールバー:200 μm。 この図の拡大版を表示するには、ここをクリックしてください。
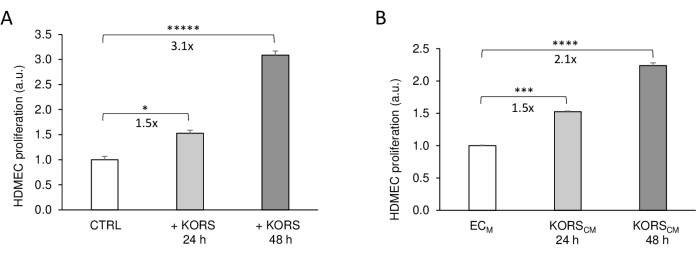
図3:HDMEC増殖に対するKONSの影響 。 (A)HDMEC増殖は、KORS非存在下(対照=CTRL)またはKORS(+ KORS)の存在下で24時間または48時間、3Dプリントインサート中のWST-1色素を用いた比色アッセイによって測定した。 (B)HDMEC増殖は、ECM 基礎細胞培養培地またはKORSCM の存在下でWST-1色素を用いた比色アッセイによって測定した24時間または48時間。結果は、SEM±平均、n = 8反復として表され、2つの独立した実験が実施されました。*p < 0.05, **p < 0.001, ****p < 0.0001, および ****p < 0.00001.KORSは、FBSおよび成長因子を含まないECM 中でインキュベートされた。48時間後、この馴化培地を回収し、実験のために-80°Cで保存した。このフィギュアは 8 から修正し、許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:HDMEC移行に対するKORSの影響 。 (A)KORS非存在下(対照= CTRL)またはKORS存在下(+ KORS)での3Dプリントインサート内のHDMECの移行を示し、回収率として定量化します。(B)ECM またはKORSCM におけるHDMECの移行を示し、回収率として定量化します。結果は、SEM±平均として表され、n = 3回の反復、および反復ごとに3つのフィールドを分析し、2つの独立した実験を実施した。**p<0.01, ******p<0.00001.スケールバー:200μm。KORSは、FBSおよび成長因子を含まないECM 中でインキュベートされた。48時間後、この馴化培地を回収し、実験のために-80°Cで保存した。このフィギュアは 8 から修正し、許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。
| カウント 1 | カウント 2 | 意味する | 合計平均 | ||
| 6ウェルプレート | レプリケート 1 | 95% | 84% | 90% | 90% |
| レプリケート 2 | 90% | 88% | 89% | ||
| レプリケート 3 | 85% | 89% | 87% | ||
| レプリケート 4 | 97% | 89% | 93% | ||
| レプリケート 5 | 88% | 94% | 91% | ||
| レプリケート 6 | 86% | 92% | 89% | ||
| 3Dプリントインサート | レプリケート 1 | 92% | 89% | 91% | 91% |
| レプリケート 2 | 91% | 80% | 86% | ||
| レプリケート 3 | 93% | 92% | 93% | ||
| レプリケート 4 | 94% | 98% | 96% | ||
| レプリケート 5 | 88% | 86% | 87% | ||
| レプリケート 6 | 93% | 97% | 95% |
表1:KORS生存率測定。 KORS生存率は、6ウェルプレートのウェルと、トリパンブルー染色と自動計数を使用して3Dプリントインサートで測定されました。
| カウント 1 | カウント 2 | 意味する | 合計平均 | ||
| 6ウェルプレート | レプリケート 1 | 90% | 88% | 89% | 85% |
| レプリケート 2 | 79% | 78% | 79% | ||
| レプリケート 3 | 71% | 75% | 73% | ||
| レプリケート 4 | 86% | 82% | 84% | ||
| レプリケート 5 | 91% | 88% | 90% | ||
| レプリケート 6 | 99% | 94% | 97% | ||
| 3Dプリントインサート | レプリケート 1 | 99% | 86% | 93% | 86% |
| レプリケート 2 | 80% | 75% | 78% | ||
| レプリケート 3 | 79% | 80% | 80% | ||
| レプリケート 4 | 98% | 85% | 92% | ||
| レプリケート 5 | 85% | 78% | 82% | ||
| レプリケート 6 | 89% | 93% | 91% |
表2:HDMEC生存率測定。 HDMEC生存率は、6ウェルプレートのウェル内および3Dプリントインサート中で、トリパンブルー染色および自動計数を用いて測定した。
ディスカッション
間接的な細胞コミュニケーションは、一般的に馴化培地または共培養システムデバイスを使用して調査されます。馴化培地の調製は実験の上流に時間がかかり、この方法は片側効果分析に限定されています。Colin-Pierreらによる以前の研究 。馴 化培地を用いて8、2つの細胞型(HDMECsおよびKORS)間の間接的な細胞間通信を行った。この先行研究のデータは、HDMEC増殖に対するKORS馴化培地の効果と、HDMEC遊走、偽管形成、およびGPC1発現に対するKORS馴化培地の効果を示しました8。本研究では、間接的な細胞コミュニケーションを調べるためのより簡単で迅速な方法が説明されています。実際、3Dプリントされたインサートは、実験計画と細胞培養の複数の組み合わせに柔軟性をもたらします。これらの3Dプリントされたインサートを共培養のモデルとして検証するために、細胞増殖と細胞移動を分析し、馴化培地を使用した以前の研究と比較しました8。両方の研究において、創傷治癒アッセイは、インサートを含むまたは含まないウェルに配置された2つの移行チャンバーデバイス(35mmのμ皿中の2ウェルの培養−インサート)を用いて実施した。このマイグレーション試験装置9、10 は、2つのチャンバを区切る壁(創傷を模擬する)によって残されたフットプリントが一定であるという事実によってスクラッチアッセイ11、12 と異なる。そのため、再現性が高い。本研究の結果は、馴化培地実験と比較して同様の結論に至った。3Dプリントされたインサートは、細胞の挙動を変えず、細胞の接着を促進する独立したコンパートメントコーティングを行うように適合されています。ただし、3Dプリントされたインサートは、スフェロイド/オルガノイドの培養に対する低い付着を誘発するために、例えばpoly-HEMAでコーティングを行うこともできます。ここでは、HDMECとKORS間の間接通信を、3Dプリントされたインサートによって提供される複数のアプリケーションの例として調査しました。
この新しいデバイスは、特定のコーティングを必要とする、または必要としない接着細胞タイプに適用でき、共培養モデルの確立に大幅な時間節約を提供します。実際、3Dプリントされたインサートの4つのコンパートメントにより、同じウェル内で異なる組み合わせで、単層または3D(凝集体またはスフェロイド)で複数の細胞タイプを培養することができます。例えば、単層、3D(スフェロイド)、またはその両方の組み合わせの4つの細胞タイプの間接的なコミュニケーションを解析することができます。実験中、スフェロイドは、ポリHEMAコーティングを使用して3Dプリントされたインサートで培養されました(データは示されていません)。スフェロイドは、低付着結合プレートのために3Dで播種され、48時間後に分析のために3Dプリントされたインサートに移された細胞で構成されていました。数日間の培養後、スフェロイドの増殖が観察された。これらの結果は、3Dプリントされたインサートを使用して、培養プレート13、14の場合と同じ方法でスフェロイドの転写後の3D細胞増殖を追跡できることを示しています。さらに、異なる細胞タイプのミックスを2Dまたは3D(オルガノイド)の同じコンパートメントにまとめて、直接的および間接的な細胞コミュニケーションの両方を研究することができます。実際、3Dプリントされたインサートが提供する幅広いモジュール性は、この革新的な細胞共培養システムを特徴づけています。さらに、通信ウィンドウの存在により、馴化培地の助けを借りずに、選択された時間にすべての細胞型に共通の培地で使用することができます。したがって、この技術は浮遊状態で培養された細胞には適用できない。4つのコンパートメントを隔てる壁により、各細胞タイプを他の細胞タイプとは独立して播種、収穫、および分析できます。偽管形成アッセイおよび増殖、遊走、DNA、RNA、タンパク質、およびその他の分析など、いくつかのアプリケーションを作成できます。3Dプリントされたインサートは、例えば、分子や細胞外小胞の効果を分析する可能性も提供します。さらに、これらのインサートが3D印刷によって作られたという事実は、コンパートメントレイアウトと多数の機能アッセイに多くの可能性を提供します。
ただし、プレート内の3Dプリントインサートシーリングの重要なステップは慎重に検討する必要があります。実際、シリコンの均質な再分配は、シーリングを確実にし、あるコンパートメントから別のコンパートメントへの細胞培養培地または細胞の漏れを防ぐために重要です。問題を回避するには、3Dプリントされたインサートのプレートと接触する部分をシリコンが覆っていることを確認する必要があります。細胞を播種する前に、細胞培養培地を1つのコンパートメントに追加し、他のコンパートメントに培地の漏れがないことを観察して、正しいシーリングを確認する必要があります。70%エタノール浴中でのインキュベーション後のシリコンの乾燥時間も重要なステップである。確かに、アルコールの残りの痕跡は細胞固定と毒性につながる可能性があります。問題を回避するには、乾燥時間を尊重する必要があります。
結論として、3Dプリントされたインサートは、2Dまたは3Dでの培養用のほとんどの接着細胞タイプと互換性があり、さまざまな実験方法を可能にします。それらは多数の共培養研究に適応することができ、間接的な細胞コミュニケーションを調査するための新しいツールを提供する可能性があります。3Dプリントされたインサートは、モジュール式で柔軟性があり、スケーラブルで、癌学、免疫学、血管新生などの生理病理学の研究のための実験モデルの設計に使用できます。
開示事項
著者は、競合する金銭的利益を宣言していません。
謝辞
この調査は、BASFビューティーケアソリューションズと共同で行われました。チャーリー・コリン・ピエールは、BASF/CNRSが資金提供する博士号フェローです。
3Dプリントされたインサートの構想について、Mehdi Sellami氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Autoclave | Getinge | APHP | Solid cycle, 121 °C for 20 min |
| Biomed Clear | Formlabs | RS-F2-BMCL-01 | Impression performed by 3D-Morphoz company (Reims, France) |
| Cell culture detergents | Tounett | A18590/0116 | |
| Cell Proliferation Reagent WST-1 | Roche | 11,64,48,07,001 | |
| Counting slide | NanoEnTek | EVE-050 | |
| Culture-Insert 2 Well in μ-Dish 35 mm | Ibidi | 80206 | two-migration chambers device. |
| Endothelial cell medium | ScienCell | 1001 | Basal medium +/- 25 mL of fetal bovine serum (FBS, 0025), 5 mL of endothelial cell growth supplement (ECGS, 1052), and 5 mL of penicillin/streptomycin solution (P/S, 0503). |
| EVE Automated cell counter | NanoEnTek | NESCT-EVE-001E | |
| EVOS XL Core | Fisher Scientific | AMEX1200 | 10x of magnification |
| Food silicon reagent and catalyst kit | Artificina | RTV 3428 A and B | (10:1) |
| FORM 3B printer | Formlabs | PKG-F3B-WSVC-DSP-BASIC | Impression performed by 3D-Morphoz company |
| Human Dermal Microvascular Endothelial Cells (HDMEC) | ScienCell | 2000 | |
| Keratinocytes of Outer Root Sheath (KORS ) | ScienCell | 2420 | |
| Macro Wound Healing Tool Software | ImageJ | Software used for the measurement of the uncovered surface (for migration assays) | |
| Mesenchymal stem cell medium | ScienCell | 7501 | Basal medium +/-25 mL of fetal bovine serum (FBS, 0025), 5 mL of mesenchymal stem cell growth supplement (MSCGS, 7552), and 5 mL of penicillin/streptomycin solution (P/S, 0503) |
| Microplate reader SPECTRO star NANO | BMG Labtech | BMG LABTECH software | |
| PBS | Promocell | C-40232 | Without Ca2+ / Mg2+ |
| Trypan Blue Stain | NanoEnTek | EBT-001 | |
| Trypsin / EDTA | Promocell | C-41020 | Incubation of KORS at 37 °C with 5% CO2 for 5 min. Incubation of HDMECs for 5 min at room temperature |
| 96-well plate Nunclon Delta Surface | Thermoscientific | 167008 |
参考文献
- Regier, M. C., Alarid, E. T., Beebe, D. J. Progress towards understanding heterotypic interactions in multi-culture models of breast cancer. Integrative Biology. 8 (6), 684-692 (2016).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Mesenchymal stem cell isolation from pulp tissue and co-culture with cancer cells to study their interactions. Journal of Visualized Experiments. (143), e58825(2019).
- Lin, J., et al. Long non-coding RNA UBE2CP3 enhances HCC cell secretion of VEGFA and promotes angiogenesis by activating ERK1/2/HIF-1α/VEGFA signalling in hepatocellular carcinoma. Journal of Experimental & Clinical Cancer Research. 37 (1), 113(2018).
- Soares, N. L., et al. Carbon monoxide modulation of microglia-neuron communication: Anti-neuroinflammatory and neurotrophic role. Molecular Neurobiology. 59 (2), 872-889 (2022).
- Al Halawani, A., Abdulkhalek, L., Mithieux, S. M., Weiss, A. S. Tropoelastin promotes the formation of dense, interconnected endothelial networks. Biomolecules. 11 (9), 1318(2021).
- Mercatali, L., et al. Development of a human preclinical model of osteoclastogenesis from peripheral blood monocytes co-cultured with breast cancer cell lines. Journal of Visualized Experiments. (127), e56311(2017).
- Orona, N. S., Astort, F., Maglione, G. A., Yakisich, J. S., Tasat, D. R. Direct and indirect effect of air particles exposure induce Nrf2-dependent cardiomyocyte cellular response in vitro. Cardiovascular Toxicology. 19 (6), 575-587 (2019).
- Colin-Pierre, C., et al. The glypican-1/HGF/C-met and glypican-1/VEGF/VEGFR2 ternary complexes regulate hair follicle angiogenesis. Frontiers in Cell and Developmental Biology. 9, 781172(2021).
- Toubal, A., et al. The NC1 domain of type XIX collagen inhibits melanoma cell migration. European Journal of Dermatology. 20 (6), 712-718 (2010).
- Wu, A. -L., et al. Role of growth factors and internal limiting membrane constituents in müller cell migration. Experimental Eye Research. 202, 108352(2021).
- Oudart, J. -B., et al. Plasmin releases the anti-tumor peptide from the NC1 domain of collagen XIX. Oncotarget. 6 (6), 3656-3668 (2015).
- Martinotti, S., Ranzato, E. Scratch wound healing assay. Methods in Molecular Biology. 2109, 225-229 (2020).
- Cattin, S., Ramont, L., Rüegg, C. Characterization and in vivo validation of a three-dimensional multi-cellular culture model to study heterotypic interactions in colorectal cancer cell growth, invasion and metastasis. Frontiers in Bioengineering and Biotechnology. 6, 97(2018).
- Ma, Y. N., et al. Three-dimensional spheroid culture of adipose stromal vascular cells for studying adipogenesis in beef cattle. Animal. 12 (10), 2123-2129 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved