Method Article
CRISPR/Cas9 Редактирование генов гемопоэтических стволовых и прогениторных клеток для применения генной терапии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол описывает оптимизированную процедуру культивирования гемопоэтических стволовых и клеток-предшественников (HSPC) для надежного приживления генетически отредактированных клеток in vivo.
Аннотация
CRISPR/Cas9 является очень универсальным и эффективным инструментом редактирования генов, широко используемым для коррекции различных генетических мутаций. Возможность генных манипуляций с гемопоэтическими стволовыми и прогениторными клетками (HSPCs) in vitro делает HSPC идеальной клеткой-мишенью для генной терапии. Однако HSPC умеренно теряют свой потенциал приживления и многолинейной репопуляции в культуре ex vivo . В настоящем исследовании описаны идеальные условия культивирования, которые улучшают приживление HSPC и генерируют увеличенное количество генно-модифицированных клеток in vivo. В текущем отчете показаны оптимизированные условия культивирования in vitro , включая тип питательных сред, уникальные добавки коктейля с малыми молекулами, концентрацию цитокинов, пластины клеточной культуры и плотность культуры. В дополнение к этому, оптимизированная процедура редактирования генов HSPC, наряду с проверкой событий редактирования генов, предоставляется. Для валидации in vivo отображается генетически отредактированная инфузия HSPCs и анализ после приживления у реципиентов мышей. Результаты показали, что система культивирования увеличивает частоту функциональных ГСК in vitro, что приводит к надежному приживлению генетически отредактированных клеток in vivo.
Введение
Недоступность для доноров, соответствующих лейкоцитарному антигену человека (HLA), в условиях аллогенной трансплантации и быстрое развитие очень универсальных и безопасных инструментов генной инженерии делают аутологичную трансплантацию гемопоэтических стволовых клеток (HSCT) лечебной стратегией лечения наследственных заболеваний крови 1,2. Аутологичная генная терапия гемопоэтическим стволовым и прогениторным клетками (HSPC) включает в себя сбор HSPC пациентов, генетические манипуляции, коррекцию болезнетворных мутаций и трансплантацию генно-скорректированных HSPC пациенту 3,4. Однако успешный результат генной терапии зависит от качества трансплантируемого генно-модифицированного трансплантата. Этапы генной манипуляции и культура ex vivo HSPC влияют на качество трансплантата, уменьшая частоту долговременных гемопоэтических стволовых клеток (LT-HSC), что требует инфузии больших доз генно-манипулируемых HSPC 2,5,6.
Несколько малых молекул, включая SR1 и UM171, в настоящее время используются для расширения HSPC пуповинной крови надежно 7,8. Для взрослых HSPC из-за более высокого выхода клеток, полученного при мобилизации, устойчивое расширение не требуется. Тем не менее, сохранение стволовых связей изолированных HSPC в культуре ex vivo имеет решающее значение для применения генной терапии. Поэтому подход, ориентированный на обогащение культуры гемопоэтическими стволовыми клетками (ГСК), разработан с использованием комбинации малых молекул: ресвератрола, UM729 и SR1 (RUS)7. Оптимизированные условия культивирования HSPC способствуют обогащению ГСК, что приводит к увеличению частоты генно-модифицированных ГСК in vivo, и уменьшают потребность в генном манипулировании большими дозами HSPC, способствуя экономически эффективным подходам генной терапии8.
Здесь описан комплексный протокол для культуры HSPC, а также инфузия и анализ генетически отредактированных клеток in vivo.
протокол
Эксперименты in vivo на иммунодефицитных мышах были одобрены и проведены в соответствии с руководящими принципами Комитета по этике животных Института (IAEC), Христианского медицинского колледжа, Веллор, Индия. Образцы периферической крови, мобилизованные гранулоцитарным колониестимулирующим фактором (G-CSF), были взяты у здоровых доноров человека с информированного согласия после получения одобрения Институционального наблюдательного совета (IRB).
1. Выделение мононуклеарных клеток периферической крови (PBMNC) и очистка CD34 + клеток
- Выполните изоляцию PBMNC, выполнив следующие действия.
ПРИМЕЧАНИЕ: Для культуры HSPC in vitro и редактирования генов, начиная по крайней мере с 1 x 106 HSPC / группа является идеальным. Для анализа приживления in vivo число начальных клеток, по меньшей мере, 5 x 106 HSPC/группа, является идеальным, если группа содержит восемь мышей, и каждая мышь наполнена по меньшей мере 6 x 105 клетками. Для получения достаточного количества НБМНК (~1 х 109) для проведения процедуры рекомендуется начиная с 20 мл мобилизованной периферической крови (мПБ).- После сбора mPB разбавляют 20 мл mPB стерильным 1x фосфат-буферным физиологическим раствором (PBS) в соотношении 1:1.
ПРИМЕЧАНИЕ: Эффективность мобилизации G-CSF может варьироваться между лицами9, и, следовательно, количество HSPC, полученных из 20 мл мобилизованной крови, варьируется между донорами. - Добавьте 10 мл градиентной среды плотности (Lymphoprep, см. Таблицу материалов) в пробирку объемом 50 мл и проложите разбавленную кровь через боковые стороны трубки в соотношении 1:2.
ПРИМЕЧАНИЕ: Наклон трубки объемом 50 мл под углом 20° при добавлении разбавленной крови предотвращает ее смешивание с лимфопрепом, что приводит к четкому разделению компонентов крови после центрифугирования. - Центрифуга при 600 x g в течение 30 мин при комнатной температуре (RT) со скоростью ускорения 1 м/с² и скоростью замедления 1 м/с². Отбросьте верхний слой (плазму) с помощью серологической пипетки и соберите пушистый слой, присутствующий в интерфазе (PBMNC) над средним слоем градиента плотности.
ПРИМЕЧАНИЕ: Аспирируйте пальто с помощью серологической пипетки, осторожно закручивая ее по бокам трубки. Избегайте сбора большего объема интерфазы при аспирации пышной шерсти, чтобы предотвратить загрязнение гранулоцитами и эритроцитами. - Переложите НБМНК в свежую коническую трубку объемом 50 мл и разбавьте клеточную суспензию 1x PBS в соотношении 1:2.
ПРИМЕЧАНИЕ: Разбавить клеточную суспензию 1x PBS в соотношении 1:4, если при аспирации пышного слоя был собран избыток интерфазы. - Центрифугируют клеточную суспензию при 200 х г в течение 5 мин при комнатной температуре со скоростью ускорения 9 м/с² и скоростью замедления 7 м/с² и отбрасывают супернатант с помощью серологической пипетки. Добавьте к грануле 30 мл ледяного буфера лизиса RBC (см. таблицу 7) и инкубируйте во льду в течение 10 мин. Перемешивать, переворачивая трубку каждые 2 мин.
- Центрифуга при 200 х г в течение 5 мин при комнатной температуре со скоростью ускорения 9 м/с² и скоростью замедления 7 м/с² и выбросьте супернатант. Повторите шаги 1.1.5.-1.1.6. до тех пор, пока покраснение гранул не исчезнет. Повторно суспендируют гранулу базальной средой (IMDM, см. Таблицу материалов) и выполняют подсчет клеток с использованием трипан-синего цвета в камереНойбауэра 10.
ПРИМЕЧАНИЕ: Изолированные PBMNC могут быть немедленно использованы для очистки CD34+ HSPC. В качестве альтернативы, PBMNC могут быть криоконсервированы и восстановлены, когда это необходимо для обогащения CD34+ . Для криоконсервации центрифугу 5 х 108 ячеек при 200 х г в течение 5 мин и добавляют 4 мл криосреды, содержащей IMDM: FBS: DMSO (см. Таблицу материалов) в соотношении 7:2:1. - Перенесите флаконы на криооосветитель с температурой 1 °C и храните при температуре −80 °C в течение 12 ч. Переложите и храните криовиалы в контейнере с жидким азотом для длительного хранения.
- После сбора mPB разбавляют 20 мл mPB стерильным 1x фосфат-буферным физиологическим раствором (PBS) в соотношении 1:1.
- Возродите криоконсервированные НБМНК.
- Полуоттравьте криовиалы на водяной бане при температуре 37 °C легким закручиванием в течение <1 мин. Переложите клеточную суспензию криовиала на трубку объемом 50 мл, содержащую ИМДМ в соотношении 1:10.
- Центрифугируют клеточную суспензию при 200 х г в течение 5 мин при комнатной температуре со скоростью ускорения 9 м/с² и скоростью замедления 7 м/с² и выбрасывают супернатант с помощью серологической пипетки.
- Очистите клетки CD34+ от PBMNC, выполнив следующие действия.
- Подготовьте очистительный буфер стерильным 1x PBS, содержащим 2% фильтрованной фетальной бычьей сыворотки (FBS). Повторное суспендирование гранулы ячейки PBMNC в буфере согласно таблице 1.
ПРИМЕЧАНИЕ: Буфер должен быть свободным от Ca++ и Mg++ . - Переложите клеточную суспензию, содержащую 1 х 108-5 х 108 клеток свежих или криоконсервированных ПБМНК, в полистирольную трубку круглого дна объемом 5 мл (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Добавьте ДНКазу (см. Таблицу материалов) в конечной концентрации 100 мкг/мл в клеточную суспензию для предотвращения слипания клеток. Мы использовали коммерчески доступный комплект для очистки CD34, содержащий человеческий коктейль CD34 Positive Selection Cocktail и Dextran Rapid Spheres (см. Таблицу материалов). - Добавьте коммерчески доступный человеческий коктейль CD34 Positive Selection Cocktail (см. Таблицу материалов) в концентрации 100 мкл/мл клеток и осторожно повторно суспендируйте.
- Инкубировать на RT в течение 30 мин и осторожно повторно суспендировать клеточную суспензию каждые 5 мин. Добавьте 50 мкл/мл коммерчески доступных быстрых сфер Декстрана (см. Таблицу материалов) и осторожно повторно суспендируйте.
ПРИМЕЧАНИЕ: Вращайте сферы декстрана на высокой скорости в течение 5 с, чтобы частицы выглядели равномерно диспергированными, а затем добавляйте их в ячейки. - Инкубировать на RT в течение 15 мин и осторожно повторно суспендировать клеточную суспензию каждые 5 мин. Сделайте клеточную суспензию общим объемом 2,5 мл с буфером очистки и аккуратно повторно суспендируйте ее.
- Поместите трубку в коммерчески доступный иммуномагнитный магнит без колонны (см. Таблицу материалов) и инкубируйте в течение 5 мин при РТ. После инкубации инвертируйте магнит и отбрасывайте супернатант одним непрерывным движением.
ПРИМЕЧАНИЕ: Клетки CD34+ , помеченные Dextran Rapid Spheres, остаются притянутыми к сторонам трубки магнитным полем. Трубку необходимо удерживать в перевернутом положении в течение 2-3 с. Избегайте дрожания или смывания капель, которые остаются свисающими со рта трубки. - Снимите трубку с магнита и добавьте 2,5 мл буфера очистки. Повторите шаги 1.3.6-1.3.7 пять раз.
ПРИМЕЧАНИЕ: Во время добавления буфера очистки расположите трубку под острым углом и добавьте буфер, закручивая трубку, так как ячейки могут прилипать к поверхностным стенкам при инвертировании магнита. - После завершения пяти промывок извлеките трубку из магнита, добавьте 4 мл 1x стерильного PBS и повторно суспендируйте клеточную суспензию. Перенесите клеточную суспензию в 15 мл центрифужной трубки и сделайте ее до 10 мл с 1x PBS. Выполните подсчет клеток с помощью трипан-синего цвета в камереНойбауэра 10.
- Центрифуга при 200 х g в течение 5 мин при RT (ускорение ~9 м/с², замедление ~7 м/с²) и выбросьте супернатант пипеткой. Чтобы культивировать HSPC, повторно суспендируйте клетки в питательных средах HSPC, как указано в шаге 2.1.
ПРИМЕЧАНИЕ: Избытки очищенных HSPCs криоконсервировали в коммерчески доступной криоконсервационной среде (см. Таблицу материалов) при плотности 9 x 106 клеток/мл после культивирования HSPC в течение 12 ч в питательных средах HSPC.
- Подготовьте очистительный буфер стерильным 1x PBS, содержащим 2% фильтрованной фетальной бычьей сыворотки (FBS). Повторное суспендирование гранулы ячейки PBMNC в буфере согласно таблице 1.
- Оживите криоконсервированные HSPC.
- Разморозьте криовиалы в течение <1 мин на водяной бане с температурой 37 °C легким закручиванием. Перенесите клеточную суспензию в криовиале в пробирку объемом 50 мл.
- Добавьте 1% BSA, повторно суспендированный в 1x PBS капля за каплей с постоянным перемешиванием и сделайте это до 20 мл. Центрифуга при 200 х г в течение 5 мин при комнатной температуре со скоростью ускорения 9 м/с² и скоростью замедления 7 м/с² и выбросьте супернатант с помощью серологической пипетки.
- Повторите шаг 1.4.2. 1х. Повторное суспендирование клеток в культуральной среде и культуре HSPC, как описано в шаге 2.1.
2. Культура очищенных HSPC in vitro
- Подготавливают питательные среды с использованием SFEM-II с SCF (240 нг/мл), FLT3 (240 нг/мл), TPO (80 нг/мл), IL6 (40 нг/мл) и 1x антибиотиком-антимикотиком (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Настоятельно рекомендуется использовать свежеприготовленные питательные среды. Однако носитель можно хранить при 4 °C в течение 24 ч после приготовления. - Повторно суспендировать гранулу CD34+ с культуральной средой, добавить 3 мкл коктейля RUS/мл среды (Ресвератрол, 10 мкМ; УМ729, 500 нМ; СтемРегинин-1, 750 нМ; см. Таблицу материалов) и культивировать клетки при 37 °C с 5% CO2.
ПРИМЕЧАНИЕ: UM171 (10 нм) может быть использован для замены UM729 (500 нМ), поскольку оба имеют одинаковое влияние на поддержание ствола HSPC7. Флаконы нельзя замораживать-размораживать более двух раз. - Первоначально засевают очищенные клетки при слиянии 5 х 105/мл в коммерчески доступные дельта-поверхностно обработанные 6-луночные пластины (см. Таблицу материалов) для удаления адгезивных клеток.
- Пересеивают клетки в суспензии при слиянии 2 х 105 клеток/мл в новую 6-луночную пластину после 6 ч очистки.
- Охарактеризовать стволовость HSPC с помощью проточной цитометрии перед редактированием генов.
- Для анализа проточной цитометрии возьмите 1 x 105 клеток в 100 мкл 1x PBS и добавьте 3 мкл (75 нг) CD34 PE, 4 мкл (100 нг) CD133 FITC и 4 мкл (100 нг) CD90 APC (см. Таблицу материалов).
- Инкубировать пробирку при РТ в течение 20 мин в темноте. Промыть клетки 2 мл 1x PBS 2x и центрифугу при 200 x g в течение 5 мин при RT. Выбросить супернатант пипеткой, повторно суспендировать гранулу ячейки 150 мкл 1x PBS и получить ее в проточной цитометрии.
ПРИМЕЧАНИЕ: Если процентное содержание клеток CD34+ составляет <90%, увеличьте количество промывок до шести раз на шаге 1.3.7. Посейте очищенные HSPC в культуральную среду и через 6 ч соберите только клетки в суспензии. Большинство CD34-клеток прилипают к культуральной пластине.
3. Редактирование генов HSPC
- Выполняют восстановление направляющей РНК.
ПРИМЕЧАНИЕ: Синтетические сгРНК с модификациями фосфоротиоата, нацеленные на локус CCR5, были получены из коммерческих источников (см. Таблицу материалов).- Для восстановления установите термомиксатор при 37 °C и предварительно разогрейте буфер 1x TE (см. Таблицу материалов) при 37 °C в течение 10 мин. Центрифугировать синтетический химически модифицированный флакон sgRNA при 11 000 х г в течение 1 мин при 4 °C.
- К флакону сгРНК, содержащему 1,5 нМ лиофилизированной сгРНК, добавляют 15 мкл 1x TE буфера, получая конечную концентрацию 100 пМ/мкл.
- Инкубировать в термомешателе при 37 °C в течение 30-40 с с с минимальным встряхиванием. После короткого спина соберите 15 мкл сгРНК и храните в виде 1 мкл аликвоты (100 пМ/мкл) при −80 °C для будущего использования в течение 1 года.
ПРИМЕЧАНИЕ: Избегайте повторного замораживания-оттаивания. Рекомендуется максимум один цикл замораживания-оттаивания аликвотированной гРНК.
- Выполните нуклеофекцию, выполнив следующие действия.
- На 3-й день посева подсчитайте клетки с помощью улучшенной камеры подсчета клетокНойбауэра 10.
- Для получения РНП (для нуклеофекции 2 х 105 клеток) возьмите 1 мкл сгРНК, нацеленной на ген CCR5 (100 пМ) в пробирке объемом 0,5 мл, и добавьте 2,65 мкл Cas9 (50 пМ) путем осторожного закручивания вокруг дна флакона. Инкубировать в RT в течение 10 мин.
ПРИМЕЧАНИЕ: последовательность гРНК: (CCR5) TGACATCAATTATTATACATCGG. - Для буферного приготовления добавляют 16,4 мкл раствора первичной клетки Р3 и 3,6 мкл добавки, поставляемой с коммерческим набором нуклеофекции (см. Таблицу материалов), и инкубируют на RT в течение 10 мин. Подготовьте культуральную среду (этап 2.1.) и предварительно зажмите ее при 37 °C в культуральной пластине перед нуклеофекцией.
- Гранула 2 х 105 ячеек центрифугированием при 200 х г в течение 5 мин при РТ и осторожно выбрасываем супернатант с помощью пипетки, не нарушая гранулу. Повторно суспендируют гранулу с 20 мкл буфера, приготовленного на стадии 3.2.3. и осторожно повторно суспендировать его.
- Аккуратно смешайте клеточную суспензию с подготовленным комплексом RNP (стадия 3.2.2.) без пузырьков воздуха. Перенесите суспензию на коммерческую нуклеофекционную полосу (см. Таблицу материалов) и выберите импульсный код DZ100 для электропорации ячеек с помощью 4D-нуклеофектора (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Конечный объем клеточной суспензии, включая буфер и компоненты RNP, не должен превышать более 27 мкл/электропорацию. - Для экспериментального контроля гранулы 2 х 105 неотредактированных ГСПК путем центрифугирования при 200 х г в течение 5 мин при РТ и повторного суспендирования гранулы с 20 мкл буфера, приготовленного на стадии 3.2.3. без комплекса РНП.
- Добавьте 100 мкл предварительно инкубированной культуральной среды (стадия 3.2.3.) к электропорированным клеткам и оставьте клетки нетронутыми в течение 10 мин в нуклеофекционной полоске при РТ. После 10 мин инкубации перенесите содержимое на культуральную пластину в соответствии с экспериментальными требованиями.
ПРИМЕЧАНИЕ: Этот протокол может быть применен к негомологичному конечному соединению (NHEJ), опосредованному целевым разрушением любого геномного локуса с использованием целевой гРНК. Тот же протокол может быть применен для введения больших делеций путем включения двойной гРНК на шаге 3.2.2. 11. Кроме того, после 10 минут инкубации RNP тот же протокол может быть использован для редактирования генов на основе гомологической направленной репарации (HDR) при наличии донорского шаблона12. Протокол был подтвержден целевым нарушением AAVS1, псевдо-β-глобина, β-глобина и локуса CCR5 7,8.
4. Валидация событий редактирования генов в HSPC
- Выполните извлечение ДНК.
- Через 72 ч после нуклеофекции выполните подсчет клеток, используя трипан синий в камере Нойбауэра. Соберите 1 x 105 генетически отредактированных HSPC для извлечения ДНК.
- Центрифугируйте ячейки при 11 000 х г в течение 5 мин при RT и выбросьте супернатант с помощью пипетки. Повторно суспендируйте гранулу 1 мл 1x PBS и повторите центрифугирование и выбросьте супернатант. К грануле добавляют 20 мкл быстроэкстракционного раствора (см. Таблицу материалов) на 1 х 105 ячеек и повторно суспендируют гранулу.
- Инкубировать смесь в термоциклере при 68 °C в течение 30 мин. После короткого отжима инкубируют смесь в термоциклере при 98 °C в течение 10 мин. Измерьте концентрацию ДНК в сыром лизате с помощью спектрофотометра13.
- Выполняют амплификацию генно-отредактированного локуса методом ПЦР.
- Используя Primer3 (см. Таблицу материалов), спроектируйте локус-специфические грунтовки, охватывающие участок двухцепочечного разрыва (DSB) с размерами ампликонов в пределах 400-700 bp (таблица 2).
ПРИМЕЧАНИЕ: Primer3 - это веб-инструмент с открытым исходным кодом для разработки праймеров ПЦР. - Подготовьте реакционную смесь, как указано в таблице 3 , и запустите термоциклер с условиями цикла, указанными в таблице 4. Чтобы подтвердить усиление желаемого локуса, смешайте 5 мкл продукта ПЦР с 6-кратным нагрузочным красителем и нагрузкой на электрофорез 2% агарозного геля, выполненный с использованием буфера TAE.
ПРИМЕЧАНИЕ: Компоненты буфера TAE приведены в таблице 7. - Бегите в течение 30-40 мин при 100 В и обнаруживайте ампликон с помощью гелевой системы визуализации (см. Таблицу материалов). В соответствии с протоколом производителя очистки ПЦР (см. Таблицу материалов), очистите амплифицированный продукт ПЦР.
- Измерьте концентрацию очищенного продукта ПЦР с помощью нанокапельного спектрофотометра (см. Таблицу материалов).
- Используя Primer3 (см. Таблицу материалов), спроектируйте локус-специфические грунтовки, охватывающие участок двухцепочечного разрыва (DSB) с размерами ампликонов в пределах 400-700 bp (таблица 2).
- Выполните секвенирование Сэнгера и удаление терминатора свободного красителя, выполнив следующие действия.
- Готовят реакционную смесь, как показано в таблице 5. Запустите термоциклер с условиями езды на велосипеде, как указано в таблице 6.
- Добавьте 10 мкл реагента HighPrep DTR (см. Таблицу материалов) и 40 мкл 85% этанола к 10 мкл образца ПЦР в пробирке объемом 1,5 мл и перемешайте его путем энергичного пипетирования около 8x-10x.
- Инкубируйте смесь на RT в течение 5 мин и поместите трубку 1,5 мл на магнитную разделительную подставку на 5 мин. Удалите супернатант с помощью пипетки и добавьте 100 мкл 85% этанола.
- Отбросьте супернатант и повторите шаг 4.3.3. 1х. Выньте трубки объемом 1,5 мл из магнитного стенда и инкубируйте их при 37 °C в течение 10 минут в термомексировщике для сушки этанола.
- Энергично повторно суспендировать шарики 40 мкл воды без нуклеазы и инкубировать на RT в течение 5 мин. Поместите трубку на магнитную разделительную подставку на 5 мин, и выполните секвенирование Сэнгера в соответствии с опубликованными отчетами14,15.
- Выполните оценку частоты инделирования с помощью анализа ДВС16.
- Используйте Synthego (см. Таблицу материалов) для анализа ICE.
- Загрузите файлы ab1 отредактированных и неотредактированных образцов и последовательностей гРНК и нажмите на анализ, чтобы получить частоту Indels.
5. Трансплантация генетически отредактированных HSPC
- Предварительно обусловливают коммерчески доступные NOD scid гамма-мышь (NSG)17 и NOD. CG-KitW-41JTyr+PrkdcscidIL2rgtm1Wjl/ThomJ (NBSGW)18 мышей (см. Таблицу материалов) для трансплантации костного мозга.
- Для предварительной подготовки мышей NSG выберите 6-8-недельных самок мышей и разделите их на контрольные и отредактированные группы путем слепой рандомизации.
- Поместите мышей NSG в клетки для пирогов и облучите при 3,5 Гр с использованием коммерчески доступного облучателя (см. Таблицу материалов) за 6-8 ч до трансплантации HSPC.
ПРИМЕЧАНИЕ: Рекомендуется взвешивать мышей перед облучением, а мыши весом >20 г будут подвергаться облучению. - Для предварительного кондиционирования 6-8-недельных самцов и самок мышей NBSGW вводят бусульфан (см. Таблицу материалов) через внутрибрюшинную (IP) инъекцию в дозе 12,5 мг/кг массы тела за 48 ч до трансплантации HSPC.
ПРИМЕЧАНИЕ: Кондиционирование бусульфана увеличивает приживление человеческих HSPC в костном мозге мыши и уменьшает потребность в вливании больших доз генетически отредактированных HSPC19. Идеальный диапазон дозы бусульфана для кондиционирования составляет от 10 мг / кг до 15 мг / кг массы тела. Увеличение доз бусульфана приведет к серьезным проблемам со смертностью.
- Подготовьте клеточную суспензию к трансплантации костного мозга.
- После 10 мин инкубации генетически отредактированных HSPC в полоске нуклеофекции (см. шаг 3.2.7.) перенесут клеточную суспензию в 10 мл 1x PBS. Подсчитайте клетки, используя улучшенную камеру подсчета клетокНойбауэра 10.
- Для инфузии одной мыши гранулируют 6 х 105 клеток в пробирке объемом 1,5 мл путем центрифугирования при 200 х г в течение 5 мин при РТ и осторожно выбрасывают надосадочное вещество с помощью пипетки, не нарушая гранулу. Повторно суспендировать ячейку гранулы со 100 мкл 1x PBS.
- Вливайте HSPC путем инъекции в хвостовую вену, следуя приведенным ниже шагам.
- Поместите предварительно подготовленную мышь NSG или NBSGW в ограничитель мыши (см. Таблицу материалов).
- Удерживайте хвост мыши и осторожно нажмите на вилку, чтобы удерживать мышь. Аккуратно протрите хвост мыши 70% этанолом. Аспират 100 мкл клеточной суспензии в 31 г инсулинового шприца.
ПРИМЕЧАНИЕ: Строго избегайте пузырьков в продукте инфузии, осторожно постукивая по шприцу или осторожно перемещая поршень. - Направляйте свет от инфракрасной лампы на хвост в течение 30-40 с, покрывая область тела мыши складками папиросной бумаги. Аккуратно вставьте коническую часть иглы в левую или правую хвостовую вену под углом 20°.
- Поднимите хвост левым указательным пальцем, чтобы удержать его в плоской оси шприцем. Толкните плунжер, чтобы влить клеточную суспензию в вену. Нанесите мягкое давление на проколотую область папиросной бумагой и вытащите иглу.
- После 30 секунд применения мягкого давления выньте мышь из ограничителя и перенесите ее в клетку.
6. Оценка потенциала краткосрочного приживления
- После 4 недель трансплантации HSPC человека оцените кратковременное приживление путем сбора крови через орбитальный венозный синус в гепаринизированной трубке с использованием пипетки Пастера.
- Обезболить животное препаратом кетамина (90-120 мг/кг) и ксилазина (8-12 мг/кг) с помощью внутрибрюшинной (IP) инъекции перед забором пробы.
ПРИМЕЧАНИЕ: Осторожно надавите на задние конечности анестезируемой мыши, чтобы подтвердить потерю чувствительности. - После обезболивания расположите животное в вентральном лежачем состоянии и осторожно подержите мышь, чтобы открыть глаз, что позволяет глобусу глаза слегка выступать.
- Аккуратно вставьте пипетку Пастера в медиальный кантус глаза под мигательную мембрану под углом 30°-45°. Поместив пипетку Пастера в нужное положение, приложите небольшое давление к трубке и начните осторожно вращать трубку.
ПРИМЕЧАНИЕ: Кровь попадет в трубку капиллярным действием, как только ретроорбитальное сплетение будет проколото.
- Обезболить животное препаратом кетамина (90-120 мг/кг) и ксилазина (8-12 мг/кг) с помощью внутрибрюшинной (IP) инъекции перед забором пробы.
- После сбора 50-80 мкл периферической крови осторожно вынимают пипетку из медиального цанта глаза.
- Чтобы остановить кровотечение вокруг орбиты глаза, закройте веки и приложите мягкое давление, используя кусок марли.
- Окрашивают клетки соответствующими антителами (табл. 8) и инкубируют клетки в темноте в течение 25-30 мин при РТ.
- Для лизиса эритроцитов к клеточной суспензии добавляют 3 мл 1x буфера лизиса RBC (таблица 7) и инкубируют в течение 10 мин во льду.
- Центрифуга при 200 х г в течение 5 мин при РТ и выбросьте супернатант с помощью пипетки. Повторите шаг 6.4. до тех пор, пока покраснение гранулы не исчезнет.
- Добавьте 2 мл 1x PBS и центрифугу при 200 х г в течение 5 мин при RT, чтобы удалить клеточный мусор, связанный с лизисом эритроцитов.
- Добавьте 150 мкл 1x PBS к грануле, а затем приступайте к иммунофенотипированию для проточной цитометрии для оценки процента приживленных клеток человека7.
7. Оценка долгосрочного потенциала приживления
- Усыплите мышей.
- Жертвуют пересаженных мышей на 16-й неделе для анализа приживления, вводя 100% АСФИКСИЮCO2 20 в клетку мышей в течение 1-2 мин.
- Подтверждают эвтаназию путем констатации остановки сердца и дыхания и отсутствия мышечных движений с легким защемлением задних конечностей. Если оба условия соблюдены, то удалите мышей из клетки.
- Чтобы оценить клеточный химеризм человека, соберите клетки из костного мозга.
- Изолируйте клетки из костного мозга, следуя приведенным ниже шагам.
- После эвтаназии сделайте вертикальный разрез на 1 см выше уретры и вытяните до 1 см ниже диафрагмы. Срежьте горизонтально по углам разрезанной области, чтобы широко открыть брюшную область.
- Рассекните бедренную и большеберцовую кости и удалите мягкие ткани, прикрепленные к бедренной и большеберцовой кости, ножницами. Аккуратно протрите папиросной бумагой и сделайте небольшое отверстие диаметром не выше 0,2 см на дне микроцентрифужной трубки объемом 0,5 мл с помощью скальпеля.
- Удалите проксимальные концы костей с помощью скальпеля и поместите кости разрезанной стороной лицом к отверстию микроцентрифугирующей трубки объемом 0,5 мл. Поместите трубку объемом 0,5 мл с костями в трубку объемом 1,5 мл, содержащую 100 мкл стерильного 1x PBS.
- Закройте крышку, раскрутите трубки в течение 3 мин при 1000 х г в стерильных условиях при РТ и выбросьте трубки объемом 0,5 мл, содержащие кости с пустой полостью костного мозга. Добавьте 1 мл 1x PBS в реакционную трубку 1,5 мл, содержащую костный мозг, и осторожно повторно суспендируйте клетки примерно не менее чем в 10 раз, используя пипетку 1 мл.
- Перенесите 1 мл клеточной суспензии в трубку объемом 15 мл, содержащую 9 мл буфера лизиса эритроцитов. Инкубировать клетки во льду в течение 7 мин с мягкой инверсией трубок каждые 2 мин.
- Через 7 мин центрифуга при 200 х g в течение 5 мин при RT с ускорением 9 м/с² и разгоном 7 м/с². Повторите шаг 7.2.5. до тех пор, пока не будет наблюдаться прозрачная бледно-белая гранула.
- Повторно суспендируйте клетки 10 мл стерильного 1x DPBS и фильтруйте суспензию клеток костного мозга с помощью клеточного ситечка 40 мкм на трубке 15 мл. Промыть клеточный ситечко 2 мл 1x PBS 2x, чтобы избежать потери клеток.
- Центрифугу в течение 5 мин при 200 х г, RT, и выбросьте супернатант с помощью пипетки. Повторное суспендирование клеток с 10 мл ИМДМ с ДНКазой-I в рабочей концентрации 100 мкг/мл.
- Возьмите 1 х 106 мононуклеарных клеток в трубке FACS для анализа приживления с помощью проточной цитометрии. Чтобы оценить частоту редактирования генов в приживленных мононуклеарных клетках костного мозга, гранулируют 1 х 106 мононуклеарных клеток при 11 000 х г в течение 5 мин при РТ и отбрасывают супернатант с помощью пипетки.
8. Иммунофенотипирование
- Инкубируют клетки костного мозга 1,5 мкл очищенного рекомбинантного белка Fc человека (см. Таблицу материалов) в течение 15 мин при 4 °C перед окрашиванием антителами.
ПРИМЕЧАНИЕ: Используемый здесь человеческий белок Fc разработан для блокирования окрашивания неспецифических антител, вызванного рецепторами для IgG; тем самым, повышается специфичность маркировки антител 7,21,22. Перед окрашиванием антител клетками-мишенями проводят титрование антител. Настоятельно рекомендуется включать элементы управления FMO и изотипы при работе над многоцветным флоуцитометрическим анализом. - Чтобы определить процент приживления клеток человека проточным цитометром, возьмите 1 х 106 мононуклеарных клеток в трубке FACS и окрашивайте клетки, как указано в таблице 8.
- Инкубируют клетки в темноте в течение 25-30 мин при РТ. Центрифугу при 200 х г в течение 5 мин при РТ и выбрасывают супернатант с помощью пипетки.
- Приобретите клетки с помощью проточного цитометра, закройте популяцию клеток (P1) с помощью прямого (FSC) и бокового рассеяния (SSC) мононуклеарных клеток и отрегулируйте напряжение в соответствии с популяцией клеток. Получить 50 000 клеточных событий в популяции P1.
- Для анализа популяций лейкоцитов человека в костном мозге мыши удалите клетки CD45+ человека и CD45.1 мыши из популяции клеток P1 с помощью программного обеспечения для анализа данных проточной цитометрии (см. Таблицу материалов).
- Рассчитайте приживление клеток человека, используя следующую формулу8:
% приживления = (% hCD45) / (% hCD45 + % mCD45) × 100.
ПРИМЕЧАНИЕ: Порог для приживления человека считался 0,1% положительным для CD45. - Кроме того, проанализируйте процент клеток hCD34+ из клеток CD45+ человека, чтобы оценить долгосрочные клетки репопуляции. Чтобы оценить многолинейное восстановление приживленных клеток человека, окрашивают 100 мкл клеточной суспензии в соответствии с таблицей 9.
ПРИМЕЧАНИЕ: Антитела должны быть титрованы перед экспериментами. - Используя программное обеспечение для проточной цитометрии, закройте hCD45 из популяции клеток P1 и, из hCD45, количественно оцените процентное содержание hCD19, hCD3 и hCD13 (лимфоидные и миелоидные подмножества).
9. Оценка частоты редактирования генов в приживленных мононуклеарных клетках костного мозга
- К грануле мононуклеарной клетки костного мозга добавляют 50 мкл быстроэкстракционного раствора (см. Таблицу материалов) на 5 х 105 клеток и повторно суспендируют гранулу.
- Инкубировать смесь в термоциклере при 68 °C в течение 30 мин. После короткого отжима инкубируют смесь в термоциклере при 98 °C в течение 10 мин.
- Измерьте концентрацию ДНК в сыром лизате с помощью спектрофотометра. Выполните шаги 4.2.-4.4. проверить частоту редактирования генов с помощью анализа ICE 8,15.
Результаты
Настоящее исследование определяет идеальные условия культивирования HSPC, которые облегчают удержание CD34 + CD133 + CD90 + HSC в культуре ex vivo. Чтобы продемонстрировать обогащение культуры ГСК наряду с усиленной генерацией генно-модифицированных ГСК, приведены оптимизированные процедуры выделения PBMNC, очистки клеток CD34+, культуры, редактирования генов, трансплантации, характеристики приживления и генно-модифицированных клеток in vivo (рисунок 1). После очистки, оценку проточной цитометрии проводили для проверки маркеров HSPC, а HSPC культивировали в течение 72 ч. После 72 ч культивирования HSPC были нуклеоффицированы Cas9 RNP и культивировались в течение дополнительных 2 дней. Оптимизированные условия культивирования, содержащие коктейль RUS, показали повышенную жизнеспособность и более высокую частоту CD34+CD133+CD90+ ГСК и повышенную частоту редактирования генов (рисунок 2). Чтобы дополнительно продемонстрировать, что оптимизированные условия культивирования увеличивают частоту генно-модифицированных клеток in vivo, HSPC 3-го дня, нацеленные на локус CCR5, были отредактированы генами и введены в сублетально облученных мышей NSG. Приживление клеток человека в костном мозге мыши (БМ) анализировали через 16 недель после инфузии (рисунок 3А). Анализ проточной цитометрии клеток CD45+ (hCD45) человека у мышей NSG показал повышенное приживление в условиях культивирования (рисунок 3B,C). Анализ частоты редактирования генов в клетках BM мышей показал повышенное приживление генетически отредактированных HSPC в условиях культуры, дополненных RUS (рисунок 3D).
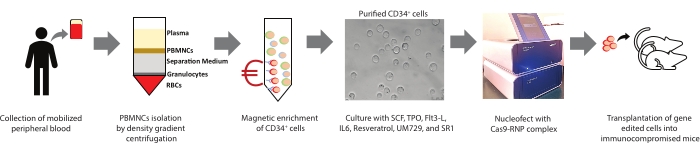
Рисунок 1: Резюме настоящего исследования. Представлено графическое резюме процедуры, связанной с выделением PBMNC, магнитным обогащением клеток CD34+ из PBMNC, культивированием, характеристикой гемопоэтических стволовых и прогениторных клеток человека (HSPC), редактированием генов и трансплантацией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Коктейль RUS обогащает частоту ГСК. MPB-HSPC культивировали в культуральной среде стволовых клеток, содержащей цитокины с носителем (DMSO) и коктейль RUS в течение 3 дней и отредактированные геном с 25 pM Cas9-RNP. Генетически отредактированные клетки были проанализированы FACS на наличие маркеров для HSPC 48 h после нуклеофекции. (A) Графики потока представляют живую популяцию клеток (7AAD-) и CD34+ CD90+ . (B) Процентная доля и частота индел-паттернов, проанализированных за 72 часа после редактирования в группе DMSO и RUS. (C) Абсолютное число CD34+ CD90+ клеток, проанализированных через 48 ч после редактирования (n = 2) (донор = 1). (D) Абсолютное число проанализированных общих ядерных клеток (ТНК) через 48 ч после редактирования (n = 2) (донор = 1). Полосы ошибок представляют среднее значение ± SEM, *p ≤ 0,05 (непарный t-тест). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
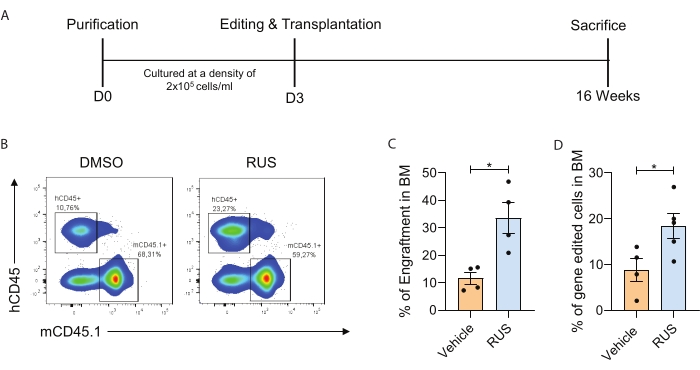
Рисунок 3: Оптимизированные условия культивирования увеличивают частоту генно-модифицированных клеток in vivo. (A) Схематическое представление эксперимента. (B) Репрезентативный график FACS, показывающий ячейки hCD45+ в БМ мыши. Вставка относится к клеткам человека (слева) и клеткам мыши (справа). HSPC культивировали в течение 3 дней, генно редактировали с помощью sgRNA на 3-й день и трансплантировали сразу после электропорации. (C) Приживление клеток человека в БМ мышей через 16 недель после инфузии (n = 4). (D) Химеризм генно-модифицированных клеток человека (hCD45+ генно-отредактированных клеток) в мышином БМ через 16 недель после инфузии (n = 4) (донор = 1). Каждая точка представляет отдельную мышь, а точки данных взяты из отдельного эксперимента. Полосы погрешностей представляют среднее значение ± SEM, *p≤ 0,05 (непарный t-тест). Рисунок адаптирован с разрешения Christopher et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Количество ячеек | Буфер очистки (мл) |
| < 1 x 107 ячеек | 0.1 |
| 1 х 107 - 1 х 108 ячеек | 0.5 |
| 1 - 5 x 108 ячеек | 1 |
Таблица 1: Объем буфера очистки для подготовки клеточной суспензии для очистки клеток CD34+ .
| Название грунтовки | Последовательность |
| CCR5 Вперед | CAGAGCCAAGCTCTCCATCCATC |
| Реверс CCR5 | АГАГАГКАААКАКА |
| CCR5 секвенирование Прямая грунтовка | AATGTAGACATCTATGTAGG |
Таблица 2: Последовательность праймеров для усиления локуса CCR5.
| Компоненты | Реакция 50 мкл |
| Буфер (5x) | 10 мкл |
| Прямая грунтовка (10 мкМ) | 1 мкл |
| Обратная грунтовка (10 мкМ) | 1 мкл |
| дНТП | 4 мкл |
| Полимераза | 1 мкл |
| Геномная ДНК | 200 нг |
| Вода без нуклеаз | до 50 мкл |
Таблица 3: Реакционная смесь для амплификации локуса CCR5 с помощью ПЦР.
| Стремянка | Длительность | Температура | Количество циклов |
| Начальная денатурация | 1 мин | 95 °С | 1 |
| Денатурация | 10 с | 98 °С | 35 |
| Отжиг | 15 с | 56 °С | |
| Расширение | 30 с | 68 °С | |
| Окончательное продление | 1 мин | 72 °С | 1 |
| Держать | ∞ | 15 °С |
Таблица 4: Термоциклерные условия для усиления локуса CCR5.
| Компоненты | Реакция 10 мкл |
| Буфер (5x) | 2 мкл |
| грунтовка (2 мкМ) | 1.6 мкл |
| RR микс | 0.75 мкл |
| Продукт для очистки ПЦР | 80 нг |
| Вода без нуклеаз | до 10 мкл |
Таблица 5: Реакционная смесь для секвенирования ПЦР Сэнгера.
| Стремянка | Длительность | Температура | Количество циклов |
| Денатурация | 15 с | 96 °С | 27 |
| Отжиг | 20 с | 55 °С | |
| Расширение | 4 мин | 60 °С | |
| Держать | ∞ | 15 °С |
Таблица 6: Термоциклерные условия для секвенирования ПЦР Сэнгера.
| Буфер | Состав |
| 10x буфер лизиса RBC – 100 мл (pH – 7,3) | 8,26 г NH4Cl, 1,19 г NaHCO3, 200 мкл ЭДТА (0,5 М, рН8) |
| 50x TAE буфер (pH – 8,3) | Растворите 50 мМ ЭДТА натриевой соли, 2 М Трис, 1 М ледниковой уксусной кислоты в 1 л воды |
Таблица 7: Буферные составы
| Антитела | Том |
| Античеловеческий CD45 APC | 3 мкл |
| Анти-мышь CD45.1 PerCP-Cy5 | 4.5 мкл |
| Анти-мышь CD34 PE | 3 мкл |
Таблица 8: Антитела, используемые для оценки приживления клеток человека.
| Антитела | Том |
| Античеловеческий CD45 APC | 3 мкл |
| Анти-мышь CD19 PerCP | 15 мкл |
| Анти-мышь CD13 PE | 15 мкл |
| Анти-мышь CD3 PE-Cy7 | 2 мкл |
Таблица 9: Антитела, используемые для оценки доли многолинейных клеток, полученных из приживленных HSPC.
Обсуждение
Успешный результат генной терапии HSPC зависит преимущественно от качества и количества приживляемых ГСК в трансплантате. Тем не менее, функциональные свойства ГСК сильно влияют на подготовительном этапе продуктов генной терапии, в том числе культурой in vitro и токсичностью, связанной с процедурой генной манипуляции. Чтобы преодолеть эти ограничения, мы определили идеальные условия культивирования HSPCs, которые сохраняют стволовысть CD34 + CD133 + CD90 + HSC в культуре ex vivo. Многие исследовательские группы использовали SR1 или UM171 или другие молекулы в качестве автономных молекул для расширения HSPC пуповинной крови (UCB) in vitro23,24. В предыдущем исследовании использовалась комбинация SR1 и UM17125. Малые молекулы и цитокины питательной среды были специально оптимизированы для мобилизованных взрослых HSPC и их применения в аутологичной генной терапии. Скрининговый эксперимент показал, что объединение трех малых молекул ресвератрола, UM729 и SR1 важно для генерации большого количества клеток CD34 + CD90 + и ингибирования пролиферации дифференцированных и совершенных клеток-предшественников. UM729 в коктейле RUS может быть заменен на UM171. Однако коммерческие закупки UM171 менее осуществимы. Концентрации цитокинов взяты из протокола, который был использован в клинических исследованиях26 для уменьшения вариабельности в процессе масштабирования. Цитокиновый коктейль содержит IL6 вместо IL3 для минимизации пролиферации предшественника и истощения HSC in vitro27. Приготовление свежих аликвот культуральной среды (базальная среда + RUS + цитокиновые коктейли) рекомендуется для уменьшения экспериментальной вариации и получения высокой воспроизводимости. Протокол применим как для NHEJ-, так и для HDR-опосредованного редактирования генов. В частности, культура HSPC за 48-72 ч до электропорации и 24 ч после электропорации имеет решающее значение для редактирования генов HDR. Оптимизированные условия культивирования должны способствовать редактированию генов HDR путем сохранения стволовых клеток. Было также отмечено, что условия культивирования способствуют лентивирусной трансдукции в долгосрочных ГСК. Это говорит о том, что, если вирусные частицы, такие как AAV6 или IDLV, используются в качестве донора HDR, ожидается, что эффективность редактирования HDR улучшится, поскольку оптимизированные условия культивирования способствуют донорской доставке в HSC.
Для оценки результатов редактирования генов, включая NHEJ и HDR, анализ NGS, зондовый или ddPCR-анализ или секвенирование Сэнгера 7,8,28 с последующей деконволюцией с использованием онлайн-инструментов (ICE / ICE Knock-In)16 из-за его надежного количественного характера. Альтернативно, анализ эндонуклеазы Т7 может быть выполнен на отредактированных образцах ДНК, а фрагментированные полосы ДНК могут быть количественно определены с использованием ImageJ. Однако подход к анализу эндонуклеазы Т7 менее точен, чем анализ деконволюции, и нацелен на секвенирование следующего поколения.
Протокол трансплантации также оптимизирован путем кондиционирования мышей NBSGW бусульфаном, что позволяет низким дозам клеток оценивать приживление и репопуляцию HSPC. В целом, эта процедура должна уменьшить дозы HSPC, необходимые для генных манипуляций, и повысить доступность генной терапии HSPC в развивающихся странах.
В настоящем исследовании были продемонстрированы протоколы выделения PBMNC, очистки CD34+ HSPC, редактирования и валидации генов, а также оценки приживленных генетически отредактированных HSPC в костном мозге мыши. Также было доказано, что оптимизированная культура HSPC обогащает CD34 + CD133 + CD90 + HSPC и увеличивает химеризм генетически отредактированных клеток in vivo.
Раскрытие информации
Авторы заявляют, что конкурирующих финансовых интересов не существует.
Благодарности
Авторы хотят отметить персонал установки проточной цитометрии и животноводческой установки CSCR. A.C. финансируется стипендией ICMR-SRF, K.V.K. финансируется стипендией DST-INSPIRE, а P.B. финансируется стипендией CSIR-JRF. Эта работа финансировалась Департаментом биотехнологии правительства Индии (грант No BT/PR26901/MED/31/377/2017 и BT/PR31616/MED/31/408/2019)
Материалы
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector® X Unit | LONZA BIOSCIENCE | AAF-1003X | |
| 4D-Nucleofector™ X Kit ( 16-well Nucleocuvette™ Strips) | LONZA BIOSCIENCE | V4XP-3032 | |
| Antibiotic-Antimycotic (100X) | THERMO SCIENTIFIC | 15240096 | |
| Anti-human CD45 APC | BD BIOSCIENCE | 555485 | |
| Anti-human CD13 PE | BD BIOSCIENCE | 555394 | |
| Anti-human CD19 PerCP | BD BIOSCIENCE | 340421 | |
| Anti-human CD3 PE-Cy7 | BD BIOSCIENCE | 557749 | |
| Anti-human CD90 APC | BD BIOSCIENCE | 561971 | |
| Anti-human CD133/1 | Miltenyibiotec | 130-113-673 | |
| Anti-human CD34 PE | BD BIOSCIENCE | 348057 | |
| Anti-mouse CD45.1 PerCP-Cy5 | BD BIOSCIENCE | 560580 | |
| Blood Irradator-2000 | BRIT (Department of Biotechnology, India) | BI 2000 | |
| Cell culture dish (delta surface-treated 6-well plates) | NUNC (THERMO SCIENTIFIC) | 140675 | |
| CrysoStor CS10 | BioLife solutions | #07952 | |
| Busulfan | CELON LABS (60mg/10mL) | - | |
| Guide-it Recombinant Cas9 | TAKARA BIO | 632640 | |
| Cas9-eGFP | SIGMA | C120040 | |
| Centrifuge tube-15ml | CORNING | 430790 | |
| Centrifuge tube-50ml | NUNC (THERMO SCIENTIFIC) | 339652 | |
| DMSO | MPBIO | 219605590 | |
| DNAase | STEMCELL TECHNOLOGIES | 6469 | |
| Dulbecco′s Phosphate Buffered Saline- 1X | HYCLONE | SH30028.02 | |
| EasySep™ Human CD34 Positive Selection Kit II | STEMCELL TECHNOLOGIES | 17856 | |
| EasySep magnet | STEMCELL TECHNOLOGIES | 18000 | |
| Electrophoresis unit | ORANGE INDIA | HDS0036 | |
| FBS | THERMO SCIENTIFIC | 10270106 | |
| Flow cytometer – ARIA III | BD BIOSCIENCE | - | |
| FlowJo | BD BIOSCIENCE | - | |
| Flt3-L | PEPROTECH | 300-19-1000 | |
| Gel imaging system | CELL BIOSCIENCES | 11630453 | |
| HighPrep DTR reagent | MAGBIOGENOMICS | DT-70005 | |
| Human BD Fc Block | BD BIOSCIENCE | 553141 | |
| IL6 | PEPROTECH | 200-06-50 | |
| IMDM media | THERMO SCIENTIFIC | 12440053 | |
| Infrared lamp | MURPHY | - | |
| Insulin syringe 6mm 31G | BD BIOSCIENCE | 324903 | |
| Ketamine | KETMIN 50 | - | |
| Loading dye 6X | TAKARA BIO | 9156 | |
| Lymphoprep | STEMCELL TECHNOLOGIES | 7851 | |
| Mice Restrainer | AVANTOR | TV-150 | |
| Nano drop spectrophotometer | THERMO SCIENTIFIC | ND-2000C | |
| Neubauer cell counting chamber | ROHEM INSTRUMENTS | CC-3073 | |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) | The Jackson Laboratory | RRID:IMSR_JAX:005557 | |
| NOD,B6.SCID Il2rγ−/−KitW41/W41 (NBSGW) | The Jackson Laboratory | RRID:IMSR_JAX:026622 | |
| Nunc delta 6-well plate | THERMO SCIENTIFIC | 140675 | |
| Polystyrene round-bottom tube | BD | 352008 | |
| P3 primary cell Nucleofection solution | LONZA BIOSCIENCE | PBP3-02250 | |
| Pasteur pipette | FISHER SCIENTIFIC | 13-678-20A | |
| PCR clean-up kit | TAKARA BIO | 740609.25 | |
| Mouse Pie Cage | FISCHER SCIENTIFIC | 50-195-5140 | |
| polystyrene round-bottom tube (12 x 75 mm) | STEMCELL TECHNOLOGIES | 38007 | |
| Primer3 | Whitehead Institute for Biomedical Research | https://primer3.ut.ee/ | |
| QuickExtract™ DNA Extraction Solution | Lucigen | QE09050 | |
| Reserveratrol | STEMCELL TECHNOLOGIES | 72862 | |
| SCF | PEPROTECH | 300-07-1000 | |
| SFEM-II | STEMCELL TECHNOLOGIES | 9655 | |
| sgRNA | SYNTHEGO | - | |
| SPINWIN | TARSON | 1020 | |
| StemReginin 1 | STEMCELL TECHNOLOGIES | 72342 | |
| ICE analysis tool | SYNTHEGO | https://ice.synthego.com/ | |
| Tris-EDTA buffer solution (TE) 1X | SYNTHEGO | Supplied with gRNA | |
| Thermocycler | APPLIED BIOSYSTEMS | 4375305 | |
| TPO | PEPROTECH | 300-18-1000 | |
| Trypan blue | HIMEDIA LABS | TCL046 | |
| UM171 | STEMCELL TECHNOLOGIES | 72914 | |
| UM729 | STEMCELL TECHNOLOGIES | 72332 | |
| Xylazine | XYLAXIN - INDIAN IMMUNOLOGICALS LIMITED | - |
Ссылки
- Staal, F. J. T., Aiuti, A., Cavazzana, M. Autologous stem-cell-based gene therapy for inherited disorders: State of the art and perspectives. Frontiers in Pediatrics. 7, 443(2019).
- Naldini, L. Genetic engineering of hematopoiesis: Current stage of clinical translation and future perspectives. EMBO Molecular Medicine. 11 (3), 9958(2019).
- Srivastava, A., Shaji, R. V. Cure for thalassemia major - From allogeneic hematopoietic stem cell transplantation to gene therapy. Haematologica. 102 (2), 214-223 (2017).
- Venkatesan, V., Srinivasan, S., Babu, P., Thangavel, S. Manipulation of developmental gamma-globin gene expression: An approach for healing hemoglobinopathies. Molecular and Cellular Biology. 41 (1), 00253(2020).
- Mazurier, F., Gan, O. I., McKenzie, J. L., Doedens, M., Dick, J. E. Lentivector-mediated clonal tracking reveals intrinsic heterogeneity in the human hematopoietic stem cell compartment and culture-induced stem cell impairment. Blood. 103 (2), 545-552 (2004).
- Piras, F., et al. Lentiviral vectors escape innate sensing but trigger p53 in human hematopoietic stem and progenitor cells. EMBO Molecular Medicine. 9 (9), 1198-1211 (2017).
- Christopher, A. C., et al. Preferential expansion of human CD34+CD133+CD90+ hematopoietic stem cells enhances gene-modified cell frequency for gene therapy. Human Gene Therapy. 33 (3-4), 188-201 (2021).
- Karuppusamy, K. V., et al. The CCR5 gene edited CD34+ CD90+ hematopoietic stem cell population serves as an optimal graft source for HIV gene therapy. Frontiers in Immunology. 13, 792684(2022).
- Hopman, R. K., DiPersio, J. F. Advances in stem cell mobilization. Blood reviews. 28 (1), 31-40 (2014).
- Hoffman, T. L. Counting Cells. Cell Biology: A laboratory handbook. 1, Elsevier. Chapter 3 21-24 (2006).
- Antoniani, C., et al. Induction of fetal hemoglobin synthesis by CRISPR/Cas9-mediated editing of the human b-globin locus. Blood. 131 (17), 1960-1973 (2018).
- Azhagiri, M. K. K., Babu, P., Venkatesan, V., Thangavel, S. Homology-directed gene-editing approaches for hematopoietic stem and progenitor cell gene therapy. Stem Cell Research & Therapy. 12, 500(2021).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565(2010).
- Bagchi, A., et al. Direct generation of immortalized erythroid progenitor cell lines from peripheral blood mononuclear cells. Cells. 10 (3), 1-18 (2021).
- Ravi, R., et al. Identification of novel HPFH-like mutations by CRISPR base editing that elevates the expression of fetal hemoglobin. eLife. 11, 65421(2020).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. CRISPR Journal. 5 (1), 123-130 (2022).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2Rγnull mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rγ-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
- Leonard, A., et al. Low-dose busulfan reduces human CD34+ cell doses required for engraftment in c-kit mutant immunodeficient mice. Molecular Therapy - Methods & Clinical Development. 15, 430-437 (2019).
- Tateno, A., Sakai, K., Koya, N., Aoki, T. Effects of total asphyxia on the development of synaptic junctions in the brains of mice. Acta Paediatrica Japonica; Overseas Edition. 34 (1), 1-5 (1992).
- Audigé, A., et al. Long-term leukocyte reconstitution in NSG mice transplanted with human cord blood hematopoietic stem and progenitor cells. BMC Immunology. 18 (1), 1-15 (2017).
- Nimmerjahn, F., Ravetch, J. V. Fc-receptors as regulators of immunity. Advances in immunology. 96, 179-204 (2007).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Ngom, M., et al. UM171 enhances lentiviral gene transfer and recovery of primitive human hematopoietic cells. Molecular Therapy - Methods & Clinical Development. 10, 156-164 (2018).
- Park, Y. S., et al. Enhancement of proliferation of human umbilical cord blood-derived CD34+ hematopoietic stem cells by a combination of hyper-interleukin-6 and small molecules. Biochemistry and Biophysics Reports. 29, 101214(2022).
- Aiuti, A., et al. Lentivirus-based gene therapy of hematopoietic stem cells in Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151(2013).
- Rai, R., et al. Optimized cell culture conditions promote ex-vivo manipulation and expansion of primitive hematopoietic stem cells for therapeutic gene editing. bioRxiv. , (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12 (1), 1-9 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены