Method Article
Edición génica CRISPR/Cas9 de células madre y progenitoras hematopoyéticas para aplicaciones de terapia génica
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe un procedimiento optimizado de cultivo de células madre y progenitoras hematopoyéticas (HSPC) para el injerto robusto de células editadas genéticamente in vivo.
Resumen
CRISPR/Cas9 es una herramienta de edición de genes altamente versátil y eficiente adoptada ampliamente para corregir diversas mutaciones genéticas. La viabilidad de la manipulación génica de células madre y progenitoras hematopoyéticas (HSPC) in vitro hace que las HSPC sean una célula diana ideal para la terapia génica. Sin embargo, las HSPC pierden moderadamente su potencial de injerto y repoblación multilinaje en el cultivo ex vivo . En el presente estudio, se describen las condiciones ideales de cultivo que mejoran el injerto de HSPC y generan un mayor número de células modificadas genéticamente in vivo. El informe actual muestra condiciones de cultivo in vitro optimizadas, incluido el tipo de medio de cultivo, la suplementación única de cóctel de moléculas pequeñas, la concentración de citoquinas, las placas de cultivo celular y la densidad de cultivo. Además de eso, se proporciona un procedimiento optimizado de edición de genes HSPC, junto con la validación de los eventos de edición de genes. Para la validación in vivo , se muestran los análisis de infusión y post-injerto de HSPC editados genéticamente en receptores de ratón. Los resultados demostraron que el sistema de cultivo aumentó la frecuencia de HSC funcionales in vitro, lo que resultó en un injerto robusto de células editadas genéticamente in vivo.
Introducción
La inaccesibilidad a donantes compatibles con antígenos leucocitarios humanos (HLA) en entornos de trasplante alogénico y el rápido desarrollo de herramientas de ingeniería genética altamente versátiles y seguras hacen del trasplante autólogo de células madre hematopoyéticas (TCMH) una estrategia de tratamiento curativo para los trastornos sanguíneos hereditarios 1,2. La terapia génica autóloga con células madre hematopoyéticas y progenitoras (HSPC) implica la recolección de HSPC de los pacientes, la manipulación genética, la corrección de mutaciones causantes de enfermedades y el trasplante de HSPC corregidas genéticamente en el paciente 3,4. Sin embargo, el resultado exitoso de la terapia génica depende de la calidad del injerto trasplantable modificado genéticamente. Los pasos de manipulación génica y el cultivo ex vivo de HSPC afectan la calidad del injerto al disminuir la frecuencia de células madre hematopoyéticas a largo plazo (LT-HSCs), lo que requiere la infusión de grandes dosis de HSPC manipuladas genéticamente 2,5,6.
Varias moléculas pequeñas, incluyendo SR1 y UM171, se están empleando actualmente para expandir robustamente las HSPC de la sangre del cordón umbilical 7,8. Para las HSPC adultas, debido al mayor rendimiento celular obtenido en la movilización, no se requiere una expansión robusta. Sin embargo, la retención del tallo de las HSPC aisladas en cultivo ex vivo es crucial para sus aplicaciones de terapia génica. Por lo tanto, se desarrolla un enfoque centrado en el enriquecimiento en cultivo de células madre hematopoyéticas (HSC) utilizando una combinación de moléculas pequeñas: resveratrol, UM729 y SR1 (RUS)7. Las condiciones optimizadas de cultivo de HSPC promueven el enriquecimiento de HSCs, resultando en una mayor frecuencia de HSCs modificadas genéticamente in vivo, y reducen la necesidad de manipular genes grandes dosis de HSPCs, facilitando enfoques de terapia génica rentables8.
Aquí, se describe un protocolo integral para el cultivo de HSPCs, junto con la infusión y el análisis de células editadas genéticamente in vivo.
Protocolo
Los experimentos in vivo en ratones inmunodeficientes fueron aprobados y realizados siguiendo las directrices del Comité de Ética Animal del Instituto (IAEC), Christian Medical College, Vellore, India. Las muestras de sangre periférica movilizadas por el factor estimulante de colonias de granulocitos (G-CSF) se recolectaron de donantes humanos sanos con consentimiento informado después de obtener la aprobación de la Junta de Revisión Institucional (IRB).
1. Aislamiento de células mononucleares de sangre periférica (PBMNCs) y purificación de células CD34+
- Realice el aislamiento PBMNC siguiendo los pasos a continuación.
NOTA: Para el cultivo in vitro de HSPC y la edición de genes, comenzar con al menos 1 x 106 HSPCs/grupo es ideal. Para el análisis de injerto in vivo , un número de células iniciales de al menos 5 x 10 6 HSPCs/grupo es ideal si un grupo contiene ocho ratones y cada ratón está infundido con al menos6 x 105 células. Para obtener un número suficiente de PBMNC (~1 x 109) para el procedimiento, se recomienda comenzar con 20 ml de sangre periférica movilizada (mPB).- Después de la recolección de mPB, diluir 20 ml de mPB con solución salina estéril 1x tamponada con fosfato (PBS) en una proporción de 1:1.
NOTA: La eficacia de la movilización del G-CSF puede variar entre los individuos9, y por lo tanto, el número de CPHS obtenidos de 20 ml de sangre movilizada varía entre los donantes. - Agregue 10 ml de medio de gradiente de densidad (Lymphoprep, consulte la Tabla de materiales) a un tubo de 50 ml y coloque la sangre diluida a través de los lados del tubo en una proporción de 1: 2.
NOTA: Inclinar el tubo de 50 ml en un ángulo de 20° mientras se agrega la sangre diluida evita que se mezcle con Lymphoprep, lo que lleva a una separación clara de los componentes sanguíneos después de la centrifugación. - Centrífuga a 600 x g durante 30 min a temperatura ambiente (RT) con una velocidad de aceleración de 1 m/s² y una velocidad de deceleración de 1 m/s². Desechar la capa superior (plasma) con una pipeta serológica y cosechar la capa leucocitaria presente en la interfase (PBMNC) por encima de la capa media de gradiente de densidad.
NOTA: Aspirar la capa leucocitaria con una pipeta serológica girándola suavemente a los lados del tubo. Evite recoger un mayor volumen de interfase mientras aspira la capa leucocitaria para evitar la contaminación de granulocitos y glóbulos rojos. - Transfiera los PBMNC a un tubo cónico fresco de 50 ml y diluya la suspensión celular con 1x PBS en una proporción de 1: 2.
NOTA: Diluir la suspensión celular con 1x PBS en una proporción de 1:4 si se recogió un exceso de interfase mientras se aspiraba la capa leucocitaria. - Centrifugar la suspensión celular a 200 x g durante 5 min a temperatura ambiente con una aceleración de 9 m/s² y una velocidad de deceleración de 7 m/s² y desechar el sobrenadante con una pipeta serológica. Agregue 30 ml de tampón de lisis de glóbulos rojos helado (ver Tabla 7) al pellet e incubar en hielo durante 10 minutos. Mezclar invirtiendo el tubo cada 2 min.
- Centrifugar a 200 x g durante 5 min a temperatura ambiente con una velocidad de aceleración de 9 m/s² y una velocidad de desaceleración de 7 m/s², y desechar el sobrenadante. Repita los pasos 1.1.5.-1.1.6. hasta que el enrojecimiento del pellet desaparezca. Resuspender el pellet con medios basales (IMDM, ver Tabla de materiales) y realizar un recuento de células utilizando azul de tripano en una cámara Neubauer10.
NOTA: Los PBMNC aislados se pueden usar inmediatamente para purificar CD34+ HSPCs. Alternativamente, los PBMNCs pueden ser criopreservados y revividos siempre que sea necesario para el enriquecimiento CD34+. Para la criopreservación, centrifugar 5 x 108 células a 200 x g durante 5 min y añadir 4 ml de medios criogénicos que contengan IMDM: FBS: DMSO (ver Tabla de materiales) en una proporción de 7:2:1. - Transfiera los viales a un refrigerador criogénico a 1 °C y guárdelos a -80 °C durante un máximo de 12 h. Transfiera y almacene los crioviales en un recipiente de nitrógeno líquido para su almacenamiento a largo plazo.
- Después de la recolección de mPB, diluir 20 ml de mPB con solución salina estéril 1x tamponada con fosfato (PBS) en una proporción de 1:1.
- Revivir los PBMNC criopreservados.
- Descongelar a media los crioviales en un baño maría a 37 °C girando suavemente durante <1 min. Transfiera la suspensión celular del criovial a un tubo de 50 ml que contenga IMDM en una proporción de 1:10.
- Centrifugar la suspensión celular a 200 x g durante 5 min a temperatura ambiente con una velocidad de aceleración de 9 m/s² y una velocidad de deceleración de 7 m/s², y desechar el sobrenadante con una pipeta serológica.
- Purifice las células CD34 + de PBMNC siguiendo los pasos a continuación.
- Preparar el tampón de purificación con 1x PBS estéril que contenga 2% de suero bovino fetal filtrado (FBS). Resuspender el pellet de células PBMNC en el tampón de acuerdo con la Tabla 1.
NOTA: El tampón debe estar libre de Ca++ y Mg++. - Transfiera la suspensión celular que contiene 1 x 10 8-5 x 108 células de PBMNC frescos o criopreservados al tubo de fondo redondo de poliestireno de 5 ml (consulte la Tabla de materiales).
NOTA: Agregue DNasa (consulte la Tabla de materiales) a una concentración final de 100 μg/ml a la suspensión celular para evitar la aglutinación celular. Utilizamos un kit disponible comercialmente para la purificación de CD34 que contiene el cóctel de selección positiva de CD34 humano y las esferas rápidas de dextrano (ver Tabla de materiales). - Agregue el cóctel de selección positiva de CD34 humano disponible comercialmente (consulte la tabla de materiales) a la concentración de 100 μL / ml de células y resuspenda suavemente.
- Incubar a RT durante 30 min y resuspender suavemente la suspensión celular cada 5 min. Agregue 50 μL/ml de esferas rápidas de Dextrano disponibles comercialmente (consulte la Tabla de materiales) y vuelva a suspender suavemente.
NOTA: Realice un vórtice de las esferas de dextrano a alta velocidad durante 5 s para asegurarse de que las partículas aparezcan dispersas uniformemente y luego agréguelas a las células. - Incubar a RT durante 15 min y resuspender suavemente la suspensión celular cada 5 min. Haga la suspensión celular a un volumen total de 2.5 mL con tampón de purificación y vuelva a suspenderla suavemente.
- Coloque el tubo en un imán inmunomagnético libre de columna disponible comercialmente (consulte la Tabla de materiales) e incube durante 5 minutos en RT. Después de la incubación, invierta el imán y deseche el sobrenadante en un movimiento continuo.
NOTA: Las células CD34+ marcadas con Dextran Rapid Spheres permanecen atraídas a los lados del tubo por el campo magnético. El tubo debe mantenerse en posición invertida durante 2-3 s. Evite temblar o secar las gotas que quedan colgando de la boca del tubo. - Retire el tubo del imán y agregue 2.5 ml de tampón de purificación. Repita los pasos 1.3.6-1.3.7 cinco veces.
NOTA: Durante la adición del tampón de purificación, coloque el tubo en un ángulo agudo y agregue amortiguador girando el tubo, ya que las células podrían adherirse a las paredes de la superficie mientras invierten el imán. - Después de completar cinco lavados, retire el tubo del imán, agregue 4 ml de PBS estéril 1x y vuelva a suspender la suspensión celular. Transfiera la suspensión celular al tubo de centrífuga de 15 ml y enfríe hasta 10 ml con 1x PBS. Realizar un recuento de células utilizando azul de tripano en una cámara de Neubauer10.
- Centrifugar a 200 x g durante 5 min a RT (aceleración ~9 m/s², desaceleración ~7 m/s²) y desechar el sobrenadante con una pipeta. Para cultivar las HSPC, resuspenda las células en medios de cultivo HSPC, como se mencionó en el paso 2.1.
NOTA: Los excesos de HSPC purificados se criopreservaron en un medio de criopreservación disponible comercialmente (ver Tabla de materiales) a una densidad de 9 x 106 células/ml después de cultivar los HSPC durante 12 h en medios de cultivo HSPC.
- Preparar el tampón de purificación con 1x PBS estéril que contenga 2% de suero bovino fetal filtrado (FBS). Resuspender el pellet de células PBMNC en el tampón de acuerdo con la Tabla 1.
- Revivir los HSPC criopreservados.
- Descongele los crioviales durante <1 min en un baño de agua a 37 °C mediante un suave remolino. Transfiera la suspensión celular en el criovial a un tubo de 50 ml.
- Agregue 1% de BSA resuspendido en 1x PBS gota a gota con agitación constante y enhebra hasta 20 mL. Centrifugar a 200 x g durante 5 min a temperatura ambiente con una aceleración de 9 m/s² y una velocidad de desaceleración de 7 m/s² y desechar el sobrenadante con una pipeta serológica.
- Repita el paso 1.4.2. 1x. Vuelva a suspender las células en medios de cultivo y cultivo de HSPC como se describe en el paso 2.1.
2. Cultivo in vitro de HSPC purificadas
- Preparar los medios de cultivo utilizando SFEM-II con SCF (240 ng/mL), FLT3 (240 ng/mL), TPO (80 ng/mL), IL6 (40 ng/mL) y 1x antibiótico-antimicótico (ver Tabla de materiales).
NOTA: Se recomienda encarecidamente los medios de cultivo recién preparados. Sin embargo, el medio puede almacenarse a 4 °C durante un máximo de 24 h después de la preparación. - Resuspender el pellet CD34+ con los medios de cultivo, añadir 3 μL de cóctel RUS/ml de medio (Resveratrol, 10 μM; UM729, 500 nM; StemReginin-1, 750 nM; ver Tabla de materiales), y cultivar las células a 37 °C con 5% deCO2.
NOTA: UM171 (10 nm) se puede utilizar para sustituir UM729 (500 nM) ya que ambos tienen efectos similares en el mantenimiento del vástago HSPC7. Los viales no se pueden congelar y descongelar más de dos veces. - Inicialmente, siembre las células purificadas en una confluencia de 5 x 105 / ml en placas de 6 pocillos tratadas en superficie delta disponibles comercialmente (consulte la Tabla de materiales) para eliminar las células adherentes.
- Vuelva a sembrar las células en la suspensión en una confluencia de 2 x 105 células/ml en una nueva placa de 6 pocillos después de 6 h de purificación.
- Caracterizar el tallo de las HSPC utilizando citometría de flujo antes de la edición génica.
- Para el análisis de citometría de flujo, tome 1 x 105 células en 100 μL de 1x PBS y agregue 3 μL (75 ng) de CD34 PE, 4 μL (100 ng) de CD133 FITC y 4 μL (100 ng) de CD90 APC (ver Tabla de materiales).
- Incubar el tubo a RT durante 20 minutos en la oscuridad. Lavar las células con 2 mL de 1x PBS 2x y centrifugar a 200 x g durante 5 min a RT. Desechar el sobrenadante con una pipeta, resuspender el pellet celular con 150 μL de 1x PBS, y adquirirlo en citometría de flujo.
NOTA: Si el porcentaje de células CD34+ es <90%, aumente el número de lavados hasta seis veces en el paso 1.3.7. Sembrar las HSPC purificadas en medios de cultivo y, después de 6 h, recoger sólo las células en la suspensión. La mayoría de las células CD34- se adhieren a la placa de cultivo.
3. Edición genética de HSPCs
- Realizar la reconstitución guía del ARN.
NOTA: El sgRNA sintético con modificaciones de fosforotioato dirigidas al locus CCR5 se obtuvo de fuentes comerciales (ver Tabla de materiales).- Para la reconstitución, ajuste el mezclador térmico a 37 °C y precaliente el tampón 1x TE (consulte la Tabla de materiales) a 37 °C durante 10 min. Centrifugar el vial de sgRNA sintético modificado químicamente a 11.000 x g durante 1 min a 4 °C.
- Al vial de sgRNA que contiene 1,5 nM de sgRNA liofilizado, agregue 15 μL de tampón TE 1x, produciendo una concentración final de 100 pM/μL. Resuspenda suavemente hasta 5x, girando la punta alrededor de las esquinas.
- Incubar en el mezclador térmico a 37 °C durante 30-40 s con una agitación mínima. Después de un giro corto, recolectar 15 μL de sgRNA y almacenar como alícuotas de 1 μl (100 pM/μL) a -80 °C para su uso futuro hasta por 1 año.
NOTA: Evite la congelación y descongelación repetidas. Se recomienda un máximo de un ciclo de congelación-descongelación de ARNg alícitado.
- Realice la nucleofección siguiendo los pasos a continuación.
- En el día 3 de cultivo, contar las células utilizando la cámara mejorada de recuento de células10 de Neubauer.
- Para la preparación de RNP (para nucleofecting 2 x 10 5 células), tomar 1 μL de sgRNA dirigido al gen CCR5 (100 pM) en un tubo de0,5 ml y añadir 2,65 μL de Cas9 (50 pM) girando suavemente alrededor del fondo del vial. Incubar en RT durante 10 min.
NOTA: secuencia de ARNg: (CCR5) TGACATCAATTATTATACATCGG. - Para la preparación tampón, añadir 16,4 μL de solución de células primarias P3 y 3,6 μL de suplemento, provisto del kit de nucleofección comercial (ver Tabla de materiales), e incubar a RT durante 10 min. Preparar los medios de cultivo (paso 2.1.) y preincubarlos a 37 °C en la placa de cultivo antes de la nucleofección.
- Granular 2 x 10 5 células centrifugando a 200 x g durante5 min a RT y desechar suavemente el sobrenadante con una pipeta sin alterar el pellet. Resuspender el pellet con 20 μL del tampón preparado en la etapa 3.2.3. y resuspenderlo suavemente.
- Mezclar suavemente la suspensión celular con el complejo RNP preparado (paso 3.2.2.) sin burbujas de aire. Transfiera la suspensión a la tira de nucleofección comercial (consulte la Tabla de materiales) y seleccione el código de pulso DZ100 para electropolar las células utilizando el nucleofector 4D (consulte la Tabla de materiales).
NOTA: El volumen final de la suspensión celular, incluidos los componentes tampón y RNP, no debe exceder más de 27 μL/electroporación. - Para el control experimental, granular 2 x 10 5 HSPC sin editar centrifugando a 200 x g durante5 min a RT, y resuspender el pellet con 20 μL del tampón preparado en la etapa 3.2.3. sin complejo RNP.
- Añadir 100 μL de medios de cultivo preincubados (paso 3.2.3.) a las células electroporadas y dejar las células inalteradas durante 10 minutos en la tira de nucleofección a RT. Después de 10 minutos de incubación, transfiera el contenido a la placa de cultivo según los requisitos experimentales.
NOTA: Este protocolo se puede aplicar a la interrupción dirigida mediada por la unión de extremos no homólogos (NHEJ) de cualquier locus genómico utilizando ARNg específico del objetivo. Se puede aplicar el mismo protocolo para introducir grandes deleciones mediante la inclusión de ARNg dual en el paso 3.2.2. 11. Además, después de 10 min de incubación de RNP, el mismo protocolo puede ser utilizado para la edición de genes basada en la reparación dirigida por homología (HDR) cuando se proporciona una plantilla de donante12. El protocolo ha sido validado por la interrupción dirigida de AAVS1, pseudo β-globina, β-globina y el locusCCR5 7,8.
4. Validación de eventos de edición de genes en HSPCs
- Realizar la extracción de ADN.
- Después de 72 h después de la nucleofección, realizar un recuento de células utilizando azul de tripano en una cámara Neubauer. Recolectar 1 x 105 HSPC editadas genéticamente para la extracción de ADN.
- Centrifugar las células a 11.000 x g durante 5 min a RT y desechar el sobrenadante con una pipeta. Resuspender el pellet con 1 mL de 1x PBS y repetir la centrifugación y desechar el sobrenadante. Añadir al pellet 20 μL de solución de extracto rápido (ver Tabla de materiales) por 1 x 105 células y resuspender el pellet.
- Incubar la mezcla en un termociclador a 68 °C durante 30 min. Después de un breve giro, incubar la mezcla en un termociclador a 98 °C durante 10 min. Medir la concentración de ADN en el lisado crudo utilizando un espectrofotómetro13.
- Realizar la amplificación del locus editado genéticamente por PCR.
- Usando Primer3 (ver Tabla de materiales), diseñe los cebadores específicos del locus que abarcan el sitio de rotura de doble cadena (DSB) con tamaños de amplicón que oscilan entre 400-700 pb (Tabla 2).
NOTA: Primer3 es una herramienta de código abierto basada en la web para diseñar cebadores de PCR. - Prepare la mezcla de reacción como se indica en la Tabla 3 y haga funcionar el termociclador con las condiciones de ciclo mencionadas en la Tabla 4. Para confirmar la amplificación del locus deseado, mezcle 5 μL de producto de PCR con 6x colorante de carga y cargue sobre la electroforesis en gel de agarosa al 2% realizada con tampón TAE.
NOTA: Los componentes del búfer TAE se proporcionan en la Tabla 7. - Ejecute durante 30-40 minutos a 100 V y detecte el amplicón utilizando un sistema de imágenes en gel (consulte la Tabla de materiales). De acuerdo con el protocolo del fabricante de purificación por PCR (consulte la Tabla de materiales), limpie el producto de PCR amplificado.
- Mida la concentración del producto de PCR purificado utilizando un espectrofotómetro de nanogotas (consulte la Tabla de materiales).
- Usando Primer3 (ver Tabla de materiales), diseñe los cebadores específicos del locus que abarcan el sitio de rotura de doble cadena (DSB) con tamaños de amplicón que oscilan entre 400-700 pb (Tabla 2).
- Realice la secuenciación de Sanger y la eliminación del terminador de tinte libre siguiendo los pasos a continuación.
- Preparar la mezcla de reacción como se muestra en la Tabla 5. Haga funcionar el termociclador con las condiciones de ciclo como se menciona en la Tabla 6.
- Agregue 10 μL de reactivo HighPrep DTR (consulte la Tabla de materiales) y 40 μL de etanol al 85% a 10 μL de muestra de PCR en un tubo de 1.5 ml y mezcle con un pipeteo vigoroso aproximadamente 8x-10x.
- Incubar la mezcla a RT durante 5 min y colocar el tubo de 1,5 ml en el soporte de separación magnética durante 5 min. Retire el sobrenadante con una pipeta y agregue 100 μL de etanol al 85%.
- Desechar el sobrenadante y repetir el paso 4.3.3. 1x. Saque los tubos de 1,5 ml del soporte del imán e incubarlos a 37 °C durante 10 minutos en un mezclador térmico para secar el etanol.
- Resuspender vigorosamente las perlas con 40 μL de agua libre de nucleasas e incubar a RT durante 5 min. Colocar el tubo en el soporte de separación magnética durante 5 min, y realizar la secuenciación de Sanger siguiendo los informes publicados14,15.
- Realizar una evaluación de frecuencia indel mediante análisis ICE16.
- Utilice Synthego (consulte la Tabla de materiales) para el análisis de ICE.
- Cargue archivos ab1 de muestras editadas y no editadas y secuencias de ARNg y haga clic en analizar para obtener la frecuencia de los Indels.
5. Trasplante de HSPC editadas genéticamente
- Preacondicionar el ratón gamma scid (NSG) NOD disponible comercialmente17 y NOD. CG-KitW-41JTyr+PrkdcscidIL2rgtm1Wjl/ThomJ (NBSGW)18 ratones (ver Tabla de materiales) para trasplante de médula ósea.
- Para el preacondicionamiento de ratones NSG, elija ratones hembra de 6-8 semanas de edad y sepárelos en grupos de control y editados por aleatorización ciega.
- Coloque los ratones NSG en las jaulas de tarta e irradie a 3.5 Gy usando un irradiador disponible comercialmente (ver Tabla de materiales) 6-8 h antes del trasplante de HSPC.
NOTA: Se recomienda pesar los ratones antes de la irradiación, y los ratones que pesen >20 g serán sometidos a irradiación. - Para el preacondicionamiento de ratones NBSGW machos y hembras de 6-8 semanas de edad, inyecte busulfano (ver Tabla de materiales) a través de inyección intraperitoneal (IP) a una dosis de 12.5 mg/kg de peso corporal 48 h antes del trasplante de HSPC.
NOTA: El acondicionamiento con busulfano aumenta el injerto de HSPC humanas en la médula ósea del ratón y disminuye la necesidad de infundir grandes dosis de HSPC editadas genéticamente19. El rango ideal de dosis de busulfano para el acondicionamiento es entre 10 mg/kg y 15 mg/kg de peso corporal. El aumento de las dosis de busulfano dará lugar a graves problemas de mortalidad.
- Preparar la suspensión celular para el trasplante de médula ósea.
- Después de 10 min de incubación de las HSPC editadas genéticamente en la tira de nucleofección (ver paso 3.2.7.), transferir la suspensión celular a 10 ml de 1x PBS. Cuente las células utilizando la cámara de conteo de células mejorada10 de Neubauer.
- Para la infusión de un ratón, pellet 6 x 10 5 células en un tubo de 1,5 ml centrifugando a 200 x g durante5 min a RT y desechar suavemente el sobrenadante con una pipeta sin alterar el pellet. Resuspender el pellet celular con 100 μL de 1x PBS.
- Infunda las HSPC mediante inyección en la vena de la cola siguiendo los pasos a continuación.
- Coloque el ratón NSG o NBSGW preacondicionado en el sistema de retención del ratón (consulte la Tabla de materiales).
- Sostenga la cola del mouse y empuje suavemente el tapón para sujetar el mouse. Limpie suavemente la cola del ratón con etanol al 70%. Aspirar 100 μL de la suspensión celular en una jeringa de insulina de 31 G.
NOTA: Evite estrictamente las burbujas en el producto de infusión golpeando suavemente la jeringa o moviendo suavemente el émbolo. - Dirija la luz de la lámpara infrarroja a la cola durante 30-40 s, cubriendo el área del cuerpo del ratón con pliegues de papel de seda. Inserte suavemente la parte biselada de la aguja en la vena caudal izquierda o derecha en un ángulo de 20°.
- Levante la cola con el dedo índice izquierdo para mantenerla en el eje plano con la jeringa. Empuje el émbolo para infundir la suspensión celular en la vena. Aplique una presión suave cerca de la región perforada con papel de seda y saque la aguja.
- Después de 30 s de aplicar una presión suave, retire el ratón del sistema de sujeción y transfiéralo a su jaula.
6. Evaluación del potencial de injerto a corto plazo
- Después de 4 semanas de trasplante de HSPC humano, evaluar el injerto a corto plazo mediante la recolección de sangre a través del seno venoso orbitario en un tubo heparinizado utilizando una pipeta Pasteur.
- Anestesiar al animal con ketamina (90-120 mg/kg) y xilazina (8-12 mg/kg) mediante inyección intraperitoneal (IP) antes de la recogida de la muestra.
NOTA: Aplique presión suavemente en las extremidades posteriores del ratón anestesiado para confirmar la pérdida de sensibilidad. - Después de anestesiar, coloque al animal en decúbito ventral y frote suavemente el ratón para abrir el ojo, lo que permite que el globo del ojo sobresalga ligeramente.
- Inserte suavemente la pipeta Pasteur en el canto medial del ojo debajo de la membrana nictilante en un ángulo de 30°-45°. Después de colocar la pipeta Pasteur en la posición correcta, aplique una ligera presión en el tubo y comience a girar suavemente el tubo.
NOTA: La sangre entrará en el tubo por acción capilar tan pronto como se perfore el plexo retroorbital.
- Anestesiar al animal con ketamina (90-120 mg/kg) y xilazina (8-12 mg/kg) mediante inyección intraperitoneal (IP) antes de la recogida de la muestra.
- Después de recoger 50-80 μL de sangre periférica, retire suavemente la pipeta del canto medial del ojo.
- Para detener el sangrado alrededor de la órbita del ojo, cierre los párpados y aplique una presión suave con un trozo de gasa.
- Teñir las células con los anticuerpos respectivos (Tabla 8) e incubar las células en la oscuridad durante 25-30 min en RT.
- Para la lisis de glóbulos rojos, a la suspensión celular, agregue 3 ml de 1x tampón de lisis de glóbulos rojos (Tabla 7) e incube durante 10 minutos en hielo.
- Centrifugar a 200 x g durante 5 min a RT y desechar el sobrenadante con una pipeta. Repita el paso 6.4. hasta que el enrojecimiento del pellet desaparezca.
- Agregue 2 ml de 1x PBS y centrifugar a 200 x g durante 5 minutos a RT para eliminar los restos celulares asociados con la lisis de glóbulos rojos.
- Añadir 150 μL de 1x PBS al pellet y luego proceder con el inmunofenotipado para citometría de flujo para evaluar el porcentaje de células humanas injertadas7.
7. Evaluación del potencial de injerto a largo plazo
- Eutanasia a los ratones.
- Sacrificar los ratones trasplantados en la semana 16 para el análisis de injerto introduciendo 100% de asfixia deCO2 20 dentro de la jaula de ratones durante 1-2 min.
- Confirme la eutanasia determinando el paro cardíaco y respiratorio y la ausencia de movimientos musculares con un suave pellizco de las extremidades posteriores. Si se cumplen ambas condiciones, retire los ratones de la jaula.
- Para evaluar el quimerismo de las células humanas, recoja las células de la médula ósea.
- Aísle las células de la médula ósea siguiendo los pasos a continuación.
- Después de la eutanasia, haga una incisión vertical 1 cm por encima de la uretra y extienda hasta 1 cm por debajo del diafragma. Corte horizontalmente en las esquinas del área incisa para abrir ampliamente la región abdominal.
- Diseccionar el fémur y la tibia y retirar los tejidos blandos unidos al fémur y la tibia con unas tijeras. Frote suavemente con papel de seda y haga un pequeño orificio con un diámetro no superior a 0,2 cm en la parte inferior de un tubo de microcentrífuga de 0,5 ml con un bisturí.
- Retire los extremos proximales de los huesos con un bisturí y coloque los huesos con el lado cortado mirando hacia el orificio del tubo de microcentrifugación de 0,5 ml. Coloque el tubo de 0,5 ml con los huesos en el tubo de 1,5 ml que contiene 100 μL de 1x PBS estéril.
- Cierre la tapa, gire los tubos durante 3 minutos a 1000 x g en condiciones estériles a RT y deseche los tubos de 0,5 ml que contienen huesos con una cavidad medular vacía. Añadir 1 ml de 1x PBS al tubo de reacción de 1,5 ml que contiene médula ósea y resuspender suavemente las células aproximadamente no menos de 10x con una pipeta de 1 ml.
- Transfiera 1 ml de la suspensión celular a un tubo de 15 ml que contenga 9 ml de tampón de lisis RBC. Incubar las células en hielo durante 7 min con una inversión suave de los tubos cada 2 min.
- Después de 7 min, centrifugar a 200 x g durante 5 min a RT con una aceleración de 9 m/s² y una desaceleración de 7 m/s². Repita el paso 7.2.5. hasta que se observa una bolita blanca pálida clara.
- Resuspender las células con 10 ml de 1x DPBS estéril y filtrar la suspensión de células de médula ósea utilizando un filtro de células de 40 μm en un tubo de 15 ml. Enjuague el colador celular con 2 ml de 1x PBS 2x para evitar la pérdida de células.
- Centrifugar durante 5 min a 200 x g, RT, y desechar el sobrenadante con una pipeta. Resuspender las células con 10 ml de IMDM con DNasa-I a una concentración de trabajo de 100 μg/ml.
- Tomar 1 x 106 células mononucleares en un tubo FACS para el análisis de injerto por citometría de flujo. Para evaluar la frecuencia de edición génica en células mononucleares de médula ósea injertadas, granular 1 x 106 células mononucleares a 11.000 x g durante 5 min a RT y desechar el sobrenadante usando una pipeta.
8. Inmunofenotipado
- Incubar las células de la médula ósea con 1,5 μL de una proteína Fc humana recombinante purificada (ver Tabla de materiales) durante 15 min a 4 °C antes de teñir con anticuerpos.
NOTA: La proteína Fc humana utilizada aquí está formulada para bloquear la tinción de anticuerpos no específicos causada por receptores para IgG; Por lo tanto, aumenta la especificidad del etiquetado de anticuerpos 7,21,22. Antes de la tinción de anticuerpos de las células diana, realice la titulación de anticuerpos. Se recomienda encarecidamente incluir controles FMO y controles de isotipo mientras se trabaja en el análisis flowcitométrico multicolor. - Para determinar el porcentaje de injerto de células humanas por citómetro de flujo, tomar 1 x 106 células mononucleares en un tubo FACS y teñir las células como se menciona en la Tabla 8.
- Incubar las células en la oscuridad durante 25-30 min a RT. Centrifugar a 200 x g durante 5 min a RT y desechar el sobrenadante con una pipeta.
- Adquiera las células mediante un citómetro de flujo, compuerta la población celular (P1) utilizando dispersiones hacia adelante (FSC) y laterales (SSC) de células mononucleares, y ajuste el voltaje de acuerdo con la población celular. Adquirir 50.000 eventos celulares en la población P1.
- Para analizar las poblaciones de leucocitos humanos en la médula ósea del ratón, compuerta las células CD45+ humanas y CD45.1 de ratón de la población de células P1 utilizando un software de análisis de datos de citometría de flujo (ver Tabla de materiales).
- Calcule el injerto de células humanas utilizando la siguiente fórmula8:
% de injerto = (% hCD45) / (% hCD45 + % mCD45) × 100.
NOTA: El umbral para el injerto humano se consideró positivo al 0,1% para CD45. - Además, analice el porcentaje de células hCD34 + de células CD45 + humanas para evaluar las células de repoblación a largo plazo. Para evaluar la reconstitución multilinaje de las células humanas injertadas, teñir 100 μL de suspensión celular siguiendo la Tabla 9.
NOTA: Los anticuerpos deben ser titulados antes de los experimentos. - Usando el software de citometría de flujo, compuerta el hCD45 de la población de células P1 y, a partir de hCD45, cuantifique el porcentaje de hCD19, hCD3 y hCD13 (subconjuntos linfoides y mieloides).
9. Evaluación de la frecuencia de edición génica en células mononucleares de médula ósea injertadas
- A la gránula de células mononucleares de médula ósea, añadir 50 μL de solución de extracto rápido (ver Tabla de materiales) para 5 x 105 células y resuspender el pellet.
- Incubar la mezcla en un termociclador a 68 °C durante 30 min. Después de un breve giro, incubar la mezcla en un termociclador a 98 °C durante 10 min.
- Mida la concentración de ADN en el lisado crudo utilizando un espectrofotómetro. Siga los pasos 4.2.-4.4. validar la frecuencia de edición génica mediante análisis ICE 8,15.
Resultados
El presente estudio identifica las condiciones ideales de cultivo de HSPC que facilitan la retención de CD34 + CD133 + CD90 + HSC en cultivo ex vivo. Para demostrar el enriquecimiento del cultivo de HSC junto con la generación mejorada de HSC modificadas genéticamente, se proporcionan los procedimientos optimizados para el aislamiento de PBMNC, purificación de células CD34 +, cultivo, edición de genes, trasplante, caracterización de injertos y células modificadas genéticamente in vivo (Figura 1). Después de la purificación, se realizó una evaluación de citometría de flujo para verificar los marcadores HSPC y se cultivaron HSPC durante 72 h. Después de 72 h de cultivo, las HSPC fueron nucleofecadas con Cas9 RNP y cultivadas durante 2 días adicionales. Las condiciones de cultivo optimizadas que contienen el cóctel RUS mostraron una mayor viabilidad y una mayor frecuencia de las HSC CD34+CD133+CD90+ y una mayor frecuencia de edición de genes (Figura 2). Para demostrar aún más que las condiciones de cultivo optimizadas aumentan la frecuencia de células modificadas genéticamente in vivo, las HSPC del día 3 dirigidas al locus CCR5 fueron editadas genéticamente e infundidas en ratones NSG irradiados subletalmente. El injerto de células humanas en médula ósea de ratón (BM) se analizó 16 semanas después de la infusión (Figura 3A). El análisis de citometría de flujo de células CD45+ (hCD45) humanas en ratones NSG mostró un aumento del injerto en las condiciones de cultivo (Figura 3B, C). El análisis de la frecuencia de edición de genes en las células BM de ratón mostró un aumento del injerto de HSPC editadas genéticamente en condiciones de cultivo suplementadas con RUS (Figura 3D).
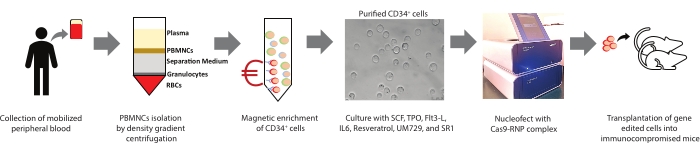
Figura 1: Resumen del presente estudio. Se representa un resumen gráfico del procedimiento involucrado en el aislamiento de PBMNC, el enriquecimiento magnético de células CD34 + de PBMNC, el cultivo, la caracterización de células madre y progenitoras hematopoyéticas humanas (HSPC), la edición de genes y el trasplante. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El cóctel RUS enriquece la frecuencia de las HSC. Los mPB-HSPCs fueron cultivados en los medios de cultivo de células madre que contenían citoquinas con vehículo (DMSO) y cóctel RUS durante 3 días y editados genéticamente con 25 pM de Cas9-RNP. Las células editadas genéticamente fueron analizadas por FACS para los marcadores de HSPC 48 h después de la nucleofección. (A) Los diagramas de flujo representan la población de células vivas (7AAD-) y CD34+ CD90+. (B) El porcentaje y la frecuencia de patrones indel analizados 72 h después de la edición en el grupo DMSO y tratado con RUS. (C) El número absoluto de células CD34+ CD90+ analizadas 48 h después de la edición (n = 2) (donante = 1). (D) El número absoluto de células nucleadas totales (TNC) analizadas 48 h después de la edición (n = 2) (donante = 1). Las barras de error representan la media ± SEM, *p ≤ 0,05 (prueba t no pareada). Haga clic aquí para ver una versión más grande de esta figura.
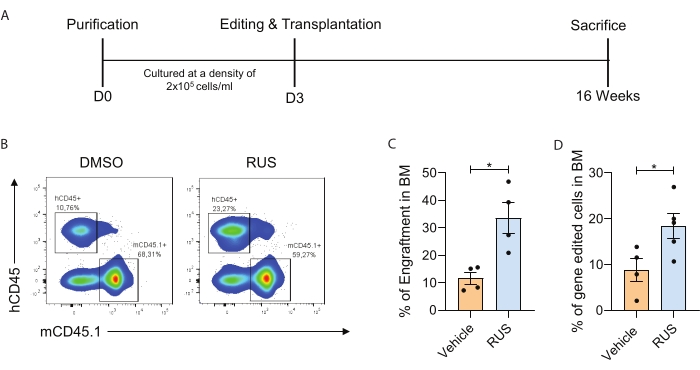
Figura 3: Las condiciones de cultivo optimizadas aumentan la frecuencia de células modificadas genéticamente in vivo. (A) Representación esquemática del experimento. (B) Gráfico representativo del FACS que muestra las células hCD45+ en el BM del ratón. El recuadro se refiere a células humanas (izquierda) y células de ratón (derecha). Las HSPC se cultivaron durante 3 días, se editaron genéticamente con sgRNA el día 3 y se trasplantaron inmediatamente después de la electroporación. (C) El injerto de células humanas en BM de ratón a las 16 semanas después de la infusión (n = 4). (D) Quimerismo de células humanas modificadas genéticamente (células editadas genéticamente hCD45+) en BM de ratón a las 16 semanas después de la infusión (n = 4) (donante = 1). Cada punto representa un ratón individual, y los puntos de datos son de un experimento individual. Las barras de error representan la media ± SEM, *p≤ 0,05 (prueba t no pareada). La figura está adaptada con permiso de Christopher et al.7. Haga clic aquí para ver una versión más grande de esta figura.
| Recuento de células | Tampón de purificación (ml) |
| < 1 x 107 celdas | 0.1 |
| 1 x 107 - 1 x 108 celdas | 0.5 |
| 1 - 5 x 108 celdas | 1 |
Tabla 1: El volumen del tampón de purificación para preparar la suspensión celular para la purificación celular CD34+ .
| Nombre de la cartilla | Secuencia |
| CCR5 hacia adelante | CAGAGCCAAGCTCTCCATC |
| CCR5 Reverso | AGAGACGCAAACACAGCCA |
| Secuenciación CCR5 Cebador directo | AATGTAGACATCTATGTAGG |
Tabla 2: Secuencia de cebadores para amplificar el locus CCR5.
| Componentes | Reacción de 50 μL |
| Búfer (5x) | 10 μL |
| Cebador directo (10 μM) | 1 μL |
| Cebador inverso (10 μM) | 1 μL |
| dNTP | 4 μL |
| Polimerasa | 1 μL |
| ADN genómico | 200 ng |
| Agua libre de nucleasas | hasta 50 μL |
Tabla 3: La mezcla de reacción para amplificar el locus CCR5 mediante PCR.
| Pasos | Duración | Temperatura | Nº de ciclos |
| Desnaturalización inicial | 1 minuto | 95 °C | 1 |
| Desnaturalización | 10 s | 98 °C | 35 |
| Recocido | 15 s | 56 °C | |
| Extensión | 30 s | 68 °C | |
| Prórroga final | 1 minuto | 72 °C | 1 |
| Sostener | ∞ | 15 °C |
Tabla 4: Condiciones del termociclador para amplificar el locus CCR5.
| Componentes | Reacción de 10 μL |
| Búfer (5x) | 2 μL |
| imprimación (2 μM) | 1,6 μL |
| Mezcla RR | 0,75 μL |
| Producto de limpieza de PCR | 80 ng |
| Agua libre de nucleasas | hasta 10 μL |
Tabla 5: La mezcla de reacciones para la secuenciación de PCR de Sanger.
| Pasos | Duración | Temperatura | Nº de ciclos |
| Desnaturalización | 15 s | 96 °C | 27 |
| Recocido | 20 s | 55 °C | |
| Extensión | 4 minutos | 60 °C | |
| Sostener | ∞ | 15 °C |
Tabla 6: Condiciones del termociclador para la PCR secuencial de Sanger.
| Búfer | Composición |
| Tampón de lisis 10x RBC – 100 ml (pH – 7.3) | 8,26 g de NH4Cl, 1,19 g de NaHCO3, 200 μL de EDTA (0,5 M, pH 8) |
| Tampón TAE 50x (pH – 8.3) | Disolver 50 mM de sal sódica EDTA, 2 M de Tris, 1 M de ácido acético glacial en 1 L de agua |
Tabla 7: Composiciones de búfer
| Anticuerpos | Volumen |
| Anti-humano CD45 APC | 3 μL |
| Anti-ratón CD45.1 PerCP-Cy5 | 4,5 μL |
| Anti-ratón CD34 PE | 3 μL |
Tabla 8: Anticuerpos utilizados para evaluar el injerto de células humanas.
| Anticuerpos | Volumen |
| Anti-humano CD45 APC | 3 μL |
| Anti-ratón CD19 PerCP | 15 μL |
| Anti-ratón CD13 PE | 15 μL |
| Anti-ratón CD3 PE-Cy7 | 2 μL |
Tabla 9: Anticuerpos utilizados para evaluar la proporción de células multilinaje derivadas de HSPC injertadas.
Discusión
El resultado exitoso de la terapia génica HSPC depende predominantemente de la calidad y cantidad de HSC injertables en el injerto. Sin embargo, las propiedades funcionales de las HSC se ven muy afectadas durante la fase preparatoria de los productos de terapia génica, incluso por el cultivo in vitro y la toxicidad asociada con el procedimiento de manipulación génica. Para superar estas limitaciones, hemos identificado condiciones ideales de cultivo de HSPC que conservan el tallo de las HSC CD34 + CD133 + CD90 + en cultivo ex vivo. Muchos grupos de investigación han utilizado SR1 o UM171 u otras moléculas como moléculas independientes para expandir las HSPC de la sangre del cordón umbilical (UCB) in vitro23,24. Un estudio previo utilizó una combinación de SR1 y UM17125. Las moléculas pequeñas y citoquinas del medio de cultivo se optimizaron específicamente para las HSPC adultas movilizadas y su aplicación en la terapia génica autóloga. El experimento de detección mostró que la combinación de tres moléculas pequeñas Resveratrol, UM729 y SR1, es importante para generar un alto número de células CD34 + CD90 + e inhibir la proliferación de células progenitoras diferenciadas y comprometidas. El UM729 en el cóctel RUS se puede reemplazar con UM171. Sin embargo, la adquisición comercial de UM171 es menos factible. Las concentraciones de citoquinas se adoptan del protocolo empleado en los estudios clínicos26 para reducir las variabilidades durante el proceso de escalado. El cóctel de citoquinas contiene IL6 en lugar de IL3 para minimizar la proliferación de progenitores y el agotamiento de HSC in vitro27. Se recomienda preparar alícuotas frescas de los medios de cultivo (medios basales + RUS + cócteles de citoquinas) para reducir la variación experimental y obtener una alta reproducibilidad. El protocolo es aplicable tanto para la edición de genes mediada por NHEJ como por HDR. En particular, el cultivo de HSPC de 48-72 h antes de la electroporación y 24 h después de la electroporación es crucial para la edición del gen HDR. Las condiciones de cultivo optimizadas deberían beneficiar la edición de genes HDR al preservar las células madre. También se observó que las condiciones de cultivo ayudan a la transducción lentiviral en HSC a largo plazo. Esto sugiere que, si las partículas virales como AAV6 o IDLV se utilizan como donante HDR, se espera que la eficiencia de edición HDR mejore, ya que las condiciones de cultivo optimizadas promueven la entrega de donantes en HSC.
Para evaluar los resultados de la edición de genes, incluyendo NHEJ y HDR, se sugiere el análisis NGS, el análisis de sonda o ddPCR, o la secuenciación de Sanger 7,8,28, seguido de la deconvolución utilizando herramientas en línea (ICE/ICE Knock-In)16, debido a su robusta naturaleza cuantitativa. Alternativamente, se puede realizar un ensayo de endonucleasa T7 en muestras de ADN editadas, y las bandas de ADN fragmentadas se pueden cuantificar utilizando ImageJ. Sin embargo, el enfoque del ensayo de endonucleasa T7 es menos preciso que el análisis de deconvolución y se dirige a la secuenciación de próxima generación.
El protocolo de trasplante también se optimiza mediante el acondicionamiento de los ratones NBSGW con busulfano, lo que permite dosis bajas de células para evaluar el injerto y la repoblación de HSPC. En general, este procedimiento debe reducir las dosis de CPEH necesarias para la manipulación génica y aumentar la accesibilidad de la terapia génica con CPEH en los países en desarrollo.
En el presente estudio, se demostraron los protocolos para el aislamiento de PBMNC, la purificación de CD34 + HSPC, la edición y validación de genes y la evaluación de las HSPC editadas genéticamente injertadas en médula ósea de ratón. También se ha demostrado que el cultivo optimizado de HSPC enriquece CD34+CD133+CD90+ HSPCs y aumenta el quimerismo de las células editadas genéticamente in vivo.
Divulgaciones
Los autores declaran que no existen intereses financieros contrapuestos.
Agradecimientos
Los autores quieren reconocer al personal de la instalación de citometría de flujo y la instalación de animales de CSCR. A. C. está financiado por una beca ICMR-SRF, K. V. K. está financiado por una beca DST-INSPIRE y P. B. está financiado por una beca CSIR-JRF. Este trabajo fue financiado por el Departamento de Biotecnología del Gobierno de la India (subvención no. BT / PR26901 / MED / 31/377 / 2017 y BT / PR31616 / MED / 31/408 / 2019)
Materiales
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector® X Unit | LONZA BIOSCIENCE | AAF-1003X | |
| 4D-Nucleofector™ X Kit ( 16-well Nucleocuvette™ Strips) | LONZA BIOSCIENCE | V4XP-3032 | |
| Antibiotic-Antimycotic (100X) | THERMO SCIENTIFIC | 15240096 | |
| Anti-human CD45 APC | BD BIOSCIENCE | 555485 | |
| Anti-human CD13 PE | BD BIOSCIENCE | 555394 | |
| Anti-human CD19 PerCP | BD BIOSCIENCE | 340421 | |
| Anti-human CD3 PE-Cy7 | BD BIOSCIENCE | 557749 | |
| Anti-human CD90 APC | BD BIOSCIENCE | 561971 | |
| Anti-human CD133/1 | Miltenyibiotec | 130-113-673 | |
| Anti-human CD34 PE | BD BIOSCIENCE | 348057 | |
| Anti-mouse CD45.1 PerCP-Cy5 | BD BIOSCIENCE | 560580 | |
| Blood Irradator-2000 | BRIT (Department of Biotechnology, India) | BI 2000 | |
| Cell culture dish (delta surface-treated 6-well plates) | NUNC (THERMO SCIENTIFIC) | 140675 | |
| CrysoStor CS10 | BioLife solutions | #07952 | |
| Busulfan | CELON LABS (60mg/10mL) | - | |
| Guide-it Recombinant Cas9 | TAKARA BIO | 632640 | |
| Cas9-eGFP | SIGMA | C120040 | |
| Centrifuge tube-15ml | CORNING | 430790 | |
| Centrifuge tube-50ml | NUNC (THERMO SCIENTIFIC) | 339652 | |
| DMSO | MPBIO | 219605590 | |
| DNAase | STEMCELL TECHNOLOGIES | 6469 | |
| Dulbecco′s Phosphate Buffered Saline- 1X | HYCLONE | SH30028.02 | |
| EasySep™ Human CD34 Positive Selection Kit II | STEMCELL TECHNOLOGIES | 17856 | |
| EasySep magnet | STEMCELL TECHNOLOGIES | 18000 | |
| Electrophoresis unit | ORANGE INDIA | HDS0036 | |
| FBS | THERMO SCIENTIFIC | 10270106 | |
| Flow cytometer – ARIA III | BD BIOSCIENCE | - | |
| FlowJo | BD BIOSCIENCE | - | |
| Flt3-L | PEPROTECH | 300-19-1000 | |
| Gel imaging system | CELL BIOSCIENCES | 11630453 | |
| HighPrep DTR reagent | MAGBIOGENOMICS | DT-70005 | |
| Human BD Fc Block | BD BIOSCIENCE | 553141 | |
| IL6 | PEPROTECH | 200-06-50 | |
| IMDM media | THERMO SCIENTIFIC | 12440053 | |
| Infrared lamp | MURPHY | - | |
| Insulin syringe 6mm 31G | BD BIOSCIENCE | 324903 | |
| Ketamine | KETMIN 50 | - | |
| Loading dye 6X | TAKARA BIO | 9156 | |
| Lymphoprep | STEMCELL TECHNOLOGIES | 7851 | |
| Mice Restrainer | AVANTOR | TV-150 | |
| Nano drop spectrophotometer | THERMO SCIENTIFIC | ND-2000C | |
| Neubauer cell counting chamber | ROHEM INSTRUMENTS | CC-3073 | |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) | The Jackson Laboratory | RRID:IMSR_JAX:005557 | |
| NOD,B6.SCID Il2rγ−/−KitW41/W41 (NBSGW) | The Jackson Laboratory | RRID:IMSR_JAX:026622 | |
| Nunc delta 6-well plate | THERMO SCIENTIFIC | 140675 | |
| Polystyrene round-bottom tube | BD | 352008 | |
| P3 primary cell Nucleofection solution | LONZA BIOSCIENCE | PBP3-02250 | |
| Pasteur pipette | FISHER SCIENTIFIC | 13-678-20A | |
| PCR clean-up kit | TAKARA BIO | 740609.25 | |
| Mouse Pie Cage | FISCHER SCIENTIFIC | 50-195-5140 | |
| polystyrene round-bottom tube (12 x 75 mm) | STEMCELL TECHNOLOGIES | 38007 | |
| Primer3 | Whitehead Institute for Biomedical Research | https://primer3.ut.ee/ | |
| QuickExtract™ DNA Extraction Solution | Lucigen | QE09050 | |
| Reserveratrol | STEMCELL TECHNOLOGIES | 72862 | |
| SCF | PEPROTECH | 300-07-1000 | |
| SFEM-II | STEMCELL TECHNOLOGIES | 9655 | |
| sgRNA | SYNTHEGO | - | |
| SPINWIN | TARSON | 1020 | |
| StemReginin 1 | STEMCELL TECHNOLOGIES | 72342 | |
| ICE analysis tool | SYNTHEGO | https://ice.synthego.com/ | |
| Tris-EDTA buffer solution (TE) 1X | SYNTHEGO | Supplied with gRNA | |
| Thermocycler | APPLIED BIOSYSTEMS | 4375305 | |
| TPO | PEPROTECH | 300-18-1000 | |
| Trypan blue | HIMEDIA LABS | TCL046 | |
| UM171 | STEMCELL TECHNOLOGIES | 72914 | |
| UM729 | STEMCELL TECHNOLOGIES | 72332 | |
| Xylazine | XYLAXIN - INDIAN IMMUNOLOGICALS LIMITED | - |
Referencias
- Staal, F. J. T., Aiuti, A., Cavazzana, M. Autologous stem-cell-based gene therapy for inherited disorders: State of the art and perspectives. Frontiers in Pediatrics. 7, 443(2019).
- Naldini, L. Genetic engineering of hematopoiesis: Current stage of clinical translation and future perspectives. EMBO Molecular Medicine. 11 (3), 9958(2019).
- Srivastava, A., Shaji, R. V. Cure for thalassemia major - From allogeneic hematopoietic stem cell transplantation to gene therapy. Haematologica. 102 (2), 214-223 (2017).
- Venkatesan, V., Srinivasan, S., Babu, P., Thangavel, S. Manipulation of developmental gamma-globin gene expression: An approach for healing hemoglobinopathies. Molecular and Cellular Biology. 41 (1), 00253(2020).
- Mazurier, F., Gan, O. I., McKenzie, J. L., Doedens, M., Dick, J. E. Lentivector-mediated clonal tracking reveals intrinsic heterogeneity in the human hematopoietic stem cell compartment and culture-induced stem cell impairment. Blood. 103 (2), 545-552 (2004).
- Piras, F., et al. Lentiviral vectors escape innate sensing but trigger p53 in human hematopoietic stem and progenitor cells. EMBO Molecular Medicine. 9 (9), 1198-1211 (2017).
- Christopher, A. C., et al. Preferential expansion of human CD34+CD133+CD90+ hematopoietic stem cells enhances gene-modified cell frequency for gene therapy. Human Gene Therapy. 33 (3-4), 188-201 (2021).
- Karuppusamy, K. V., et al. The CCR5 gene edited CD34+ CD90+ hematopoietic stem cell population serves as an optimal graft source for HIV gene therapy. Frontiers in Immunology. 13, 792684(2022).
- Hopman, R. K., DiPersio, J. F. Advances in stem cell mobilization. Blood reviews. 28 (1), 31-40 (2014).
- Hoffman, T. L. Counting Cells. Cell Biology: A laboratory handbook. 1, Elsevier. Chapter 3 21-24 (2006).
- Antoniani, C., et al. Induction of fetal hemoglobin synthesis by CRISPR/Cas9-mediated editing of the human b-globin locus. Blood. 131 (17), 1960-1973 (2018).
- Azhagiri, M. K. K., Babu, P., Venkatesan, V., Thangavel, S. Homology-directed gene-editing approaches for hematopoietic stem and progenitor cell gene therapy. Stem Cell Research & Therapy. 12, 500(2021).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565(2010).
- Bagchi, A., et al. Direct generation of immortalized erythroid progenitor cell lines from peripheral blood mononuclear cells. Cells. 10 (3), 1-18 (2021).
- Ravi, R., et al. Identification of novel HPFH-like mutations by CRISPR base editing that elevates the expression of fetal hemoglobin. eLife. 11, 65421(2020).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. CRISPR Journal. 5 (1), 123-130 (2022).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2Rγnull mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rγ-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
- Leonard, A., et al. Low-dose busulfan reduces human CD34+ cell doses required for engraftment in c-kit mutant immunodeficient mice. Molecular Therapy - Methods & Clinical Development. 15, 430-437 (2019).
- Tateno, A., Sakai, K., Koya, N., Aoki, T. Effects of total asphyxia on the development of synaptic junctions in the brains of mice. Acta Paediatrica Japonica; Overseas Edition. 34 (1), 1-5 (1992).
- Audigé, A., et al. Long-term leukocyte reconstitution in NSG mice transplanted with human cord blood hematopoietic stem and progenitor cells. BMC Immunology. 18 (1), 1-15 (2017).
- Nimmerjahn, F., Ravetch, J. V. Fc-receptors as regulators of immunity. Advances in immunology. 96, 179-204 (2007).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Ngom, M., et al. UM171 enhances lentiviral gene transfer and recovery of primitive human hematopoietic cells. Molecular Therapy - Methods & Clinical Development. 10, 156-164 (2018).
- Park, Y. S., et al. Enhancement of proliferation of human umbilical cord blood-derived CD34+ hematopoietic stem cells by a combination of hyper-interleukin-6 and small molecules. Biochemistry and Biophysics Reports. 29, 101214(2022).
- Aiuti, A., et al. Lentivirus-based gene therapy of hematopoietic stem cells in Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151(2013).
- Rai, R., et al. Optimized cell culture conditions promote ex-vivo manipulation and expansion of primitive hematopoietic stem cells for therapeutic gene editing. bioRxiv. , (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12 (1), 1-9 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados