Method Article
造血干细胞和祖细胞的CRISPR/Cas9基因编辑用于基因治疗应用
* 这些作者具有相同的贡献
摘要
本协议描述了一种优化的造血干细胞和祖细胞(HSPC)培养程序,用于 体内基因编辑细胞的稳健植入。
摘要
CRISPR / Cas9是一种高度通用和高效的基因编辑工具,广泛用于纠正各种基因突变。体 外 对造血干细胞和祖细胞(HSPCs)进行基因操作的可行性使HSPCs成为基因治疗的理想靶细胞。然而,HSPC在 离体 培养中适度失去其植入和多谱系再种群潜力。在本研究中,描述了改善HSPC植入并在 体内产生更多基因修饰细胞的理想培养条件。当前报告显示了优化的 体外 培养条件,包括培养基类型、独特的小分子混合物补充剂、细胞因子浓度、细胞培养板和培养密度。除此之外,还提供了优化的HSPC基因编辑程序,以及基因编辑事件的验证。为了 体内 验证,显示小鼠受体的基因编辑HSPC输注和植入后分析。结果表明,培养系统增加了 体外 功能性HSC的频率,从而在 体内对基因编辑细胞进行了稳健的植入。
引言
在同种异体移植环境中无法获得人类白细胞抗原(HLA)匹配的供体,以及高度通用和安全的基因工程工具的快速发展,使自体造血干细胞移植(HSCT)成为遗传性血液疾病的治愈性治疗策略1,2。自体造血干细胞和祖细胞(HSPC)基因治疗涉及收集患者的HSPC,基因操作,纠正致病突变以及将基因校正的HSPC移植到患者体内3,4。然而,基因治疗的成功结果取决于可移植基因修饰移植物的质量。HSPC的基因操作步骤和离体培养通过降低长期造血干细胞(LT-HSCs)的频率来影响移植物的质量,因此需要输注大剂量的基因操纵HSPCs2,5,6。
目前正采用几种小分子,包括SR1和UM171,以稳健地扩增脐带血HSPCs7,8。对于成年HSPC,由于在动员中获得更高的细胞产量,因此不需要稳健的扩增。然而,在离体培养中保留分离的HSPC的干性对其基因治疗应用至关重要。因此,使用小分子组合开发了专注于造血干细胞(HSC)培养富集的方法:白藜芦醇,UM729和SR1(RUS)7。优化的HSPC培养条件促进了HSC的富集,导致体内基因修饰HSC的频率增加,并减少了基因操纵大剂量HSPC的需求,促进了具有成本效益的基因治疗方法8。
在这里,描述了HSPC培养的综合方案,以及 体内基因编辑细胞的输注和分析。
研究方案
免疫缺陷小鼠的体内实验由印度韦洛尔基督教医学院动物伦理委员会(IAEC)批准并按照其指南进行。在获得机构审查委员会(IRB)批准后,在知情同意的情况下,从健康人类供体收集粒细胞集落刺激因子(G-CSF)动员的外周血样本。
1. 外周血单核细胞(PBMNCs)的分离和CD34 + 细胞的纯化
- 按照以下步骤执行 PBMNC 隔离。
注意:对于体外HSPC培养和基因编辑,从至少1 x 106个HSPC/组开始是理想的。对于体内植入分析,如果一组包含8只小鼠并且每只小鼠注入至少6 x 105个细胞,则起始细胞数至少为5 x 106 HSPC/组是理想的。为了获得足够数量的PBMNCs(~1 x 109),建议从20mL动员外周血(mPB)开始。- 收集 mPB 后,用无菌 1x 磷酸盐缓冲盐水 (PBS) 以 1:1 的比例稀释 20 mL mPB。
注意:G-CSF动员的效率可能因个体而异9,因此,从20 mL动员的血液中获得的HSPC数量因供体而异。 - 将 10 mL 密度梯度培养基(Lymphoprep,参见 材料表)加入 50 mL 试管中,并以 1:2 的比例将稀释的血液分层穿过试管的侧面。
注意:在加入稀释的血液的同时,将 50 mL 管倾斜 20° 角可防止其与 Lymphoprep 混合,从而在离心后明确分离血液成分。 - 在室温(RT)下以600 x g 离心30分钟,加速度为1 m / s²,减速速率为1 m / s²。使用血清移液管丢弃上层(血浆),并收获密度梯度介质层上方的间期(PBMNCs)处存在的血沉棕黄层。
注意:使用血清移液管在管子侧面轻轻旋转来吸出血沉棕黄层。吸出血沉棕黄层时避免收集更多的间期,以防止粒细胞和红细胞污染。 - 将PBMNC转移到新鲜的50 mL锥形管中,并用1x PBS以1:2的比例稀释细胞悬液。
注意:如果在吸出血沉棕黄层时收集了过量的间期,则用 1x PBS 以 1:4 的比例稀释细胞悬液。 - 在室温下以9m / s²的加速度和7m / s²的减速速率以200 x g 离心细胞悬液5分钟,并使用血清移液管弃去上清液。向沉淀中加入 30 mL 冰冷的 RBC 裂解缓冲液(参见 表 7),并在冰中孵育 10 分钟。每2分钟倒置试管进行混合。
- 在室温下以200 x g 离心5分钟,加速度为9m / s²,减速速率为7m / s²,并弃去上清液。重复步骤 1.1.5.-1.1.6。直到颗粒发红消失。用基础培养基(IMDM,参见 材料表)重悬沉淀,并在Neubauer室10中使用台盼蓝进行细胞计数。
注意:分离的PBMNC可以立即用于纯化CD34 + HSPC。 或者,PBMNC可以在CD34 +富集需要时冷冻保存和复活。为了冷冻保存,以200 x g 离心5 x 108细胞5分钟,并以7:2:1的比例加入4 mL含有IMDM:FBS:DMSO(参见材料表)的冷冻培养基。 - 将小瓶转移到1°C低温冷却器中,并在-80°C下储存长达12小时。将冷冻管转移并储存在液氮容器中以长期储存。
- 收集 mPB 后,用无菌 1x 磷酸盐缓冲盐水 (PBS) 以 1:1 的比例稀释 20 mL mPB。
- 恢复冷冻保存的PBMNC。
- 在37°C水浴中轻轻旋转<1分钟,将冷冻管解冻一半。将冷冻管的细胞悬液以1:10的比例转移到含有IMDM的50mL管中。
- 在室温下以9m / s²的加速度和7m / s²的减速速率以200 x g 离心细胞悬液5分钟,并使用血清移液管弃去上清液。
- 按照以下步骤从PBMNC中纯化CD34 + 细胞。
- 用含有2%过滤胎牛血清(FBS)的无菌1x PBS制备纯化缓冲液。根据 表1将PBMNC细胞沉淀重悬于缓冲液中。
注意:缓冲液必须不含 Ca++ 和 Mg++。 - 将含有 1 x 10 8-5 x 108 个新鲜或冷冻保存的 PBMNC 细胞的细胞悬液转移到 5 mL 聚苯乙烯圆底管中(参见材料表)。
注意:将终浓度为100μg/ mL的DNase(见 材料表)添加到细胞悬液中,以防止细胞结块。我们使用市售的CD34纯化试剂盒,其中包含人CD34阳性选择鸡尾酒和葡聚糖快速球体(见 材料表)。 - 加入市售的人CD34阳性选择混合物(参见 材料表),浓度为100μL/mL细胞,轻轻重悬。
- 在室温下孵育30分钟,每5分钟轻轻重悬一次细胞悬液。加入 50 μL/mL 市售葡聚糖快速球体(参见 材料表)并轻轻重悬。
注意:高速涡旋葡聚糖球体5秒,以确保颗粒均匀分散,然后将它们添加到细胞中。 - 在室温下孵育15分钟,每5分钟轻轻重悬一次细胞悬液。用纯化缓冲液使细胞悬液的总体积为2.5 mL,然后轻轻重悬。
- 将管放入市售的免疫磁性无柱磁铁中(参见 材料表),并在室温下孵育5分钟。孵育后,倒置磁铁并以连续运动丢弃上清液。
注意:右旋糖酐快速球体标记的CD34 + 细胞仍然被磁场吸引到管的侧面。管子必须在倒置位置保持2-3秒。避免颤抖或吸干残留在管口的液滴。 - 从磁体上取下试管并加入 2.5 mL 纯化缓冲液。重复步骤1.3.6-1.3.7五次。
注意:在添加纯化缓冲液期间,将管子定位为锐角并通过旋转管来添加缓冲液,因为细胞可能会在反转磁铁时粘附在表面壁上。 - 完成五次洗涤后,从磁铁上取下试管,加入 4 mL 的 1x 无菌 PBS,并重悬细胞悬液。将细胞悬液转移到 15 mL 离心管中,并用 1x PBS 使其达到 10 mL。在Neubauer室10中使用台盼蓝进行细胞计数。
- 在室温下以200× g 离心5分钟(加速度~9m / s²,减速~7m / s²),并用移液管弃去上清液。要培养HSPC,如步骤2.1中所述,将细胞重悬于HSPC培养基中。
注意:在HSPC培养基中培养HSPC12小时后,将过量纯化的HSPC以9 x 106个细胞/ mL的密度在市售冷冻保存培养基(参见材料表)中冷冻保存。
- 用含有2%过滤胎牛血清(FBS)的无菌1x PBS制备纯化缓冲液。根据 表1将PBMNC细胞沉淀重悬于缓冲液中。
- 恢复冷冻保存的HSPC。
- 通过轻轻旋转在37°C水浴中解冻冷冻管<1分钟。将冷冻管中的细胞悬液转移到 50 mL 管中。
- 加入 1% BSA 重悬于 1x PBS 中,一滴一滴地不断搅拌,使其达到 20 mL。在室温下以200 x g 离心5分钟,加速度为9m / s²,减速速率为7m / s²,并使用血清移液管弃去上清液。
- 重复步骤 1.4.2。1x.如步骤2.1所述,将细胞重悬于HSPC培养基和培养物中。
2. 纯化HSPC的 体外 培养
- 使用 SFEM-II 与 SCF (240 ng/mL)、FLT3 (240 ng/mL)、TPO (80 ng/mL)、IL6 (40 ng/mL) 和 1x 抗生素-抗真菌剂制备培养基(参见 材料表)。
注意:强烈建议使用新鲜制备的培养基。然而,培养基可以在制备后在4°C下储存长达24小时。 - 用培养基重悬CD34 + 沉淀,加入3μLRUS鸡尾酒/ mL培养基(白藜芦醇,10μM;UM729, 500 nM;茎雷蛋白-1, 750 nM;参见 材料表),并在37°C下用5%CO2培养细胞。
注意:UM171 (10 nm) 可用于替代 UM729 (500 nM),因为两者对 HSPC 干性维持的影响相似7.小瓶的冻融不能超过两次。 - 最初,将纯化的细胞以5 x 105 / mL的汇合度接种在市售的delta表面处理的6孔板中(参见 材料表)以去除贴壁细胞。
- 纯化6小时后,在新的6孔板中以2 x 105 个细胞/ mL的汇合度重新接种悬浮液中的细胞。
- 在基因编辑之前使用流式细胞术表征HSPC的干性。
- 对于流式细胞术分析,在 100 μL 的 1x PBS 中取 1 x 105 个细胞,然后加入 3 μL (75 ng) CD34 PE、4 μL (100 ng) CD133 FITC 和 4 μL (100 ng) CD90 APC(参见 材料表)。
- 将管在室温下在黑暗中孵育20分钟。用 2 mL 1x PBS 2x 洗涤细胞,并在室温下以 200 x g 离心 5 分钟。 用移液管弃去上清液,用 150 μL 1x PBS 重悬细胞沉淀,并在流式细胞术中获取。
注意:如果CD34 + 细胞的百分比为<90%,则在步骤1.3.7中将洗涤次数最多增加六次。将纯化的HSPC接种在培养基中,6小时后,仅收集悬浮液中的细胞。大多数CD34- 细胞粘附在培养板上。
3. HSPC的基因编辑
- 执行引导RNA重建。
注意:具有针对CCR5位点的硫代磷酸修饰的合成sgRNA是从商业来源获得的(见 材料表)。- 对于复溶,将热混合器设置为37°C,并将1x TE缓冲液(参见 材料表)在37°C下预热10分钟。将合成的化学修饰的sgRNA小瓶在4°C下以11,000× g 离心1分钟。
- 向含有 1.5 nM 冻干 sgRNA 的 sgRNA 小瓶中,加入 15 μL 1x TE 缓冲液,最终浓度为 100 pM/μL。 轻轻重悬至 5 倍,将吸头在角落旋转。
- 在37°C的热混合器中以最小的振荡孵育30-40秒。短时间旋转后,收集 15 μL sgRNA 并在 −80 °C 下储存为 1 μl 等分试样 (100 pM/μL),以备将来使用长达 1 年。
注意:避免反复冻融。建议最多有一个等分 gRNA 的冻融循环。
- 按照以下步骤进行核转染。
- 在培养的第3天,使用Neubauer改进的细胞计数室10对细胞进行计数。
- 对于RNP制备(用于核苷转染2 x 10 5细胞),在0.5 mL管中取1 μL靶向CCR5基因(100 pM)的sgRNA,并通过在小瓶底部轻轻旋转来加入2.65 μL Cas9(50 pM)。在室温下孵育10分钟。
注意:gRNA序列:(CCR5)TGACATCAATTATTATACATCGG。 - 对于缓冲液制备,加入 16.4 μL P3 原代细胞溶液和 3.6 μL 添加剂,随商业核转染试剂盒一起提供(参见 材料表),并在室温下孵育 10 分钟。制备培养基(步骤2.1.)并在核转染前将其在37°C下在培养板中预孵育。
- 通过在室温下以200×g离心5分钟来沉淀2 x 105细胞,并使用移液管轻轻弃去上清液而不会干扰沉淀。用步骤3.2.3中制备的20μL缓冲液重悬沉淀。并轻轻地重新悬浮。
- 将细胞悬液与制备的RNP复合物(步骤3.2.2)轻轻混合,无气泡。将悬浮液转移到商业核连接条上(参见材料表)并选择脉冲代码DZ100以使用4D核电孔器电穿孔细胞(参见材料表)。
注意:细胞悬液的最终体积,包括缓冲液和RNP组分,不得超过27μL/电穿孔。 - 对于实验对照,通过在室温下以200×g离心5分钟来沉淀2 x 105未经编辑的HSPC,并用步骤3.2.3中制备的20μL缓冲液重悬沉淀。没有RNP复合体。
- 向电穿孔细胞中加入 100 μL 预孵育培养基(步骤 3.2.3.),并在室温下将细胞在核连接条中不受干扰 10 分钟。孵育10分钟后,根据实验要求将内容物转移到培养板中。
注意:该协议可应用于使用靶标特异性gRNA的非同源末端连接(NHEJ)介导的任何基因组位点的靶向破坏。通过在步骤3.2.2中包括双gRNA,可以应用于引入大缺失的相同方案。11. 此外,在RNP孵育10分钟后,当提供供体模板时,相同的方案可用于基于同源定向修复(HDR)的基因编辑12。该协议已通过 AAVS1、伪β-珠蛋白、β-珠蛋白和 CCR5 位点7,8 的靶向破坏得到验证。
4. HSPC中基因编辑事件的验证
- 进行DNA提取。
- 核转染后72小时后,在Neubauer室中使用台盼蓝进行细胞计数。收集 1 x 105 个 基因编辑的 HSPC 用于 DNA 提取。
- 在室温下以11,000× g 离心细胞5分钟,并使用移液管弃去上清液。用 1 mL 的 1x PBS 重悬沉淀并重复离心并弃去上清液。向沉淀中加入 20 μL 快速提取溶液(参见 材料表)用于 1 x 105 个细胞并重悬沉淀。
- 将混合物在68°C的热循环仪中孵育30分钟。短旋转后,将混合物在98°C的热循环仪中孵育10分钟。使用分光光度计13测量粗裂解物中DNA的浓度。
- 通过PCR对基因编辑的位点进行扩增。
- 使用引物3(见 材料表),设计跨越双链断裂(DSB)位点的位点特异性引物,扩增子大小在400-700 bp之间(表2)。
注意:Primer3是一个基于Web的开源工具,用于设计PCR引物。 - 如表 3 所示制备反应混合物,并在 表4中提到的循环条件下运行热循环仪。为了确认所需基因座的扩增,将 5 μL PCR 产物与 6x 上样染料混合,并上样到使用 TAE 缓冲液制成的 2% 琼脂糖凝胶电泳中。
注意: 表 7 中提供了 TAE 缓冲器组件。 - 在100V下运行30-40分钟,并使用凝胶成像系统检测扩增子(参见 材料表)。根据PCR纯化制造商方案(见 材料表),清理扩增的PCR产物。
- 使用纳米滴分光光度计测量纯化的PCR产物的浓度(参见 材料表)。
- 使用引物3(见 材料表),设计跨越双链断裂(DSB)位点的位点特异性引物,扩增子大小在400-700 bp之间(表2)。
- 按照以下步骤执行 Sanger 测序和游离染料终止子去除。
- 制备反应混合物如 表5所示。在 表6中提到的循环条件下运行热循环仪。
- 在 1.5 mL 管中将 10 μL HighPrep DTR 试剂(参见 材料表)和 40 μL 85% 乙醇加入 10 μL PCR 样品中,并通过剧烈移液约 8x-10x 混合。
- 将混合物在室温下孵育5分钟,并将1.5mL管放在磁分离架上5分钟。使用移液管除去上清液,加入 100 μL 85% 乙醇。
- 弃去上清液并重复步骤4.3.3。1x.从磁铁支架中取出1.5mL管,并在37°C下在热混合器中孵育10分钟以干燥乙醇。
- 用 40 μL 无核酸酶水剧烈重悬磁珠,并在室温下孵育 5 分钟。将试管放在磁分离支架上5分钟,并按照发表的报告14,15进行Sanger测序。
- 通过ICE分析进行插入缺失频率评估16.
- 使用Synthego(参见 材料表)进行ICE分析。
- 上传已编辑和未编辑的样品和gRNA序列的ab1文件,然后单击分析以获取插入缺失的频率。
5. 基因编辑HSPC的移植
- 对市售的NOD scid γ小鼠(NSG)17 和NOD进行预处理。CG-KitW-41JTyr+PrkdcscidIL2rgtm1Wjl/ThomJ(NBSGW)18 只小鼠(见 材料表)用于骨髓移植。
- 对于预处理NSG小鼠,选择6-8周龄的雌性小鼠,并通过盲法随机化将它们分成对照组和编辑组。
- 将NSG小鼠放入饼笼中,并在HSPC移植前6-8小时使用市售辐照器(参见 材料表)以3.5Gy照射。
注意:建议在照射前称量小鼠,体重>20克的小鼠将受到辐照。 - 对于预处理6-8周龄的雄性和雌性NBSGW小鼠,在HSPC移植前48小时通过腹膜内(IP)注射以12.5mg / kg体重的剂量注射白消安(见 材料表)。
注意:白消安调节增加了人类HSPC在小鼠骨髓中的植入,并减少了输注大剂量基因编辑HSPC的需要19。用于调理的白消安剂量的理想范围在10毫克/千克至15毫克/千克体重之间。白消安剂量的增加将导致严重的死亡率问题。
- 准备用于骨髓移植的细胞悬液。
- 在核转染条中孵育基因编辑的HSPC10分钟后(参见步骤3.2.7.),将细胞悬液转移到10mL的1x PBS中。使用Neubauer改进的细胞计数室10对细胞进行计数。
- 对于一只小鼠的输注,通过在室温下以200×g离心5分钟,在1.5mL管中沉淀6 x 105个细胞,并使用移液管轻轻丢弃上清液而不干扰沉淀。用 100 μL 1x PBS 重悬细胞沉淀。
- 按照以下步骤通过尾静脉注射输注 HSPC。
- 将预处理的NSG或NBSGW鼠标放入鼠标约束器中(参见 材料表)。
- 握住鼠标尾巴并轻轻推动插头以约束鼠标。用70%乙醇轻轻擦拭小鼠尾巴。在31G胰岛素注射器中吸出100μL细胞悬液。
注意:通过轻轻敲击注射器或轻轻移动柱塞,严格避免输液产品中的气泡。 - 将红外灯的光引导到尾巴上30-40秒,用薄纸的褶皱覆盖小鼠的身体区域。以20°角轻轻地将针的斜面部分插入左尾静脉或右尾静脉。
- 用左手食指抬起尾巴,用注射器将其保持在平面轴上。推动柱塞将细胞悬液注入静脉。用薄纸在穿孔区域附近轻轻按压,然后拔出针头。
- 施加温和的压力 30 秒后,将鼠标从约束器中取出并将其转移到笼子中。
6. 短期植入潜力的评估
- 在人HSPC移植4周后,通过使用巴斯德移液管在肝素化管中通过眶静脉窦收集血液来评估短期植入。
- 在样品采集之前,通过腹膜内(IP)注射用氯胺酮(90-120mg / kg)和甲苯噻嗪(8-12mg / kg)制剂麻醉动物。
注意:轻轻地对麻醉小鼠的后肢施加压力以确认感觉丧失。 - 麻醉后,将动物置于腹侧卧位,轻轻揉搓鼠标以睁开眼睛,使眼球略微突出。
- 以 30°-45° 角将巴斯德移液管轻轻插入眼内眦膜下方。将巴斯德移液器置于适当位置后,对管施加轻微压力并开始轻轻旋转管。
注意:一旦眶后神经丛被刺穿,血液将通过毛细血管作用进入管子。
- 在样品采集之前,通过腹膜内(IP)注射用氯胺酮(90-120mg / kg)和甲苯噻嗪(8-12mg / kg)制剂麻醉动物。
- 收集50-80μL外周血后,轻轻地从眼睛的内眦中取出移液器。
- 要停止眼眶周围的出血,请闭上眼睑并使用一块纱布轻轻按压。
- 用相应的抗体染色细胞(表8),并在室温下在黑暗中孵育细胞25-30分钟。
- 对于红细胞裂解,向细胞悬液中加入 3 mL 的 1x RBC 裂解缓冲液(表 7),并在冰中孵育 10 分钟。
- 在室温下以200× g 离心5分钟,并使用移液管弃去上清液。重复步骤 6.4。直到颗粒的发红消失。
- 加入 2 mL 的 1x PBS,并在室温下以 200 x g 离心 5 分钟,以去除与红细胞裂解相关的细胞碎片。
- 向沉淀中加入 150 μL 1x PBS,然后进行流式细胞术的免疫表型分析,以评估移植人细胞的百分比7.
7. 长期植入潜力的评估
- 对小鼠实施安乐死。
- 在第16周处死移植的小鼠进行植入分析,方法是在小鼠笼内引入100%CO2 窒息201-2 分钟。
- 通过确定心脏和呼吸骤停以及后肢是否没有肌肉运动来确认安乐死。如果同时满足这两个条件,则将小鼠从笼子中取出。
- 为了评估人类细胞嵌合体,从骨髓中收集细胞。
- 按照以下步骤从骨髓中分离细胞。
- 安乐死后,在尿道上方 1 厘米处做一个垂直切口,并延伸到横膈膜下方 1 厘米。在切口区域的角落水平切割,以广泛打开腹部区域。
- 解剖股骨和胫骨,并用剪刀去除附着在股骨和胫骨上的软组织。用薄纸轻轻擦洗,并使用手术刀在 0.5 mL 微量离心管底部开一个直径不大于 0.2 cm 的小孔。
- 使用手术刀取出骨头的近端,并将骨头切面朝向 0.5 mL 微量离心管的孔放置。将装有骨头的 0.5 mL 管放入含有 100 μL 无菌 1x PBS 的 1.5 mL 管中。
- 关闭盖子,在室温无菌条件下以1000× g 旋转试管3分钟,并丢弃含有空骨髓腔的骨的0.5mL管。将 1 mL 的 1x PBS 加入含有骨髓的 1.5 mL 反应管中,并使用 1 mL 移液管轻轻重悬细胞约不少于10x。
- 将 1 mL 细胞悬液转移到含有 9 mL 红细胞裂解缓冲液的 15 mL 管中。将细胞在冰中孵育7分钟,每2分钟轻轻倒置试管。
- 7分钟后,在室温下以200× g 离心5分钟,加速度为9 m / s²,去加速度为7 m / s²。重复步骤 7.2.5。直到观察到透明的淡白色颗粒。
- 用 10 mL 无菌 1x DPBS 重悬细胞,并使用 15 mL 管上的 40 μm 细胞过滤器过滤骨髓细胞悬液。用 2 mL 1x PBS 2x 冲洗细胞过滤器,以避免细胞损失。
- 以200× g,RT离心5分钟,并使用移液管弃去上清液。用 10 mL IMDM 和 DNase-I 重悬细胞,工作浓度为 100 μg/mL。
- 在FACS管中取1 x 106个单核细胞,通过流式细胞术进行植入分析。为了评估移植骨髓单核细胞中的基因编辑频率,在室温下以11,000×g沉淀1 x 106个单核细胞5分钟,并使用移液管弃去上清液。
8. 免疫表型
- 用1.5μL纯化的重组人Fc蛋白(参见 材料表)在4°C孵育骨髓细胞15分钟,然后用抗体染色。
注意:此处使用的人Fc蛋白旨在阻断由IgG受体引起的非特异性抗体染色;因此,它增加了抗体标记的特异性7,21,22。在对靶细胞进行抗体染色之前,进行抗体滴定。强烈建议在进行多色流式细胞术分析时包括FMO对照和同种型对照。 - 为了通过流式细胞仪确定人细胞植入的百分比,在FACS管中取1 x 106 个单核细胞并如 表8所述对细胞进行染色。
- 将细胞在室温下在黑暗中孵育25-30分钟。 在室温下以200× g 离心5分钟,并使用移液管弃去上清液。
- 通过流式细胞仪采集细胞,使用单核细胞的正向(FSC)和侧向散射(SSC)门控细胞群(P1),并根据细胞群调节电压。在 P1 群体中获取 50,000 个细胞事件。
- 为了分析小鼠骨髓中的人类白细胞群,使用流式细胞术数据分析软件从P1细胞群中分离人CD45 + 细胞和小鼠CD45.1(参见 材料表)。
- 使用以下公式8计算人体细胞的植入:
植入百分比 = (% hCD45) / (% hCD45 + % mCD45) × 100。
注意:人类植入的阈值被认为是CD45的0.1%阳性。 - 此外,分析来自人CD45 +细胞的hCD34 +细胞的百分比,以评估长期再增殖细胞。为了评估移植人细胞的多谱系重建,按照表9对100μL细胞悬液进行染色。
注意:实验前需要滴定抗体。 - 使用流式细胞术软件,从 P1 细胞群中分离 hCD45,并从 hCD45 中定量 hCD19、hCD3 和 hCD13(淋巴和骨髓亚群)的百分比。
9. 评估移植骨髓单核细胞的基因编辑频率
- 向骨髓单核细胞沉淀中,加入 50 μL 快速提取溶液(参见 材料表)用于 5 x 105 细胞并重悬沉淀。
- 将混合物在68°C的热循环仪中孵育30分钟。短旋转后,将混合物在98°C的热循环仪中孵育10分钟。
- 使用分光光度计测量粗裂解物中DNA的浓度。按照步骤 4.2.-4.4.使用ICE分析8,15验证基因编辑频率。
结果
本研究确定了理想的HSPC培养条件,以促进CD34 + CD133 + CD90 + HSC在离体培养中的保留。为了证明HSC的培养富集以及基因修饰HSC的增强生成,提供了PBMNC分离,CD34 +细胞纯化,培养,基因编辑,移植,植入表征和体内基因修饰细胞的优化程序(图1)。纯化后,进行流式细胞术评估以检查HSPC标志物,并将HSPC培养72 h。培养72小时后,用Cas9 RNP核化HSPC并再培养2天。含有RUS鸡尾酒的优化培养条件显示CD34 + CD133 + CD90 + HSC的活力和更高的频率以及增加的基因编辑频率(图2)。为了进一步证明优化的培养条件增加了体内基因修饰细胞的频率,对靶向CCR5位点的第3天HSPC进行了基因编辑并注入亚致死辐照的NSG小鼠中。输注后16周分析小鼠骨髓(BM)中人类细胞的植入(图3A)。NSG小鼠中人CD45+(hCD45)细胞的流式细胞术分析显示,在培养条件下植入增加(图3B,C)。对小鼠BM细胞中基因编辑频率的分析显示,在补充RUS的培养条件下,基因编辑的HSPC的植入增加(图3D)。
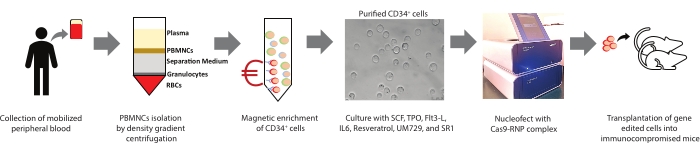
图1:本研究报告摘要。 展示了分离PBMNCs所涉及的程序,CD34 + 细胞从PBMNC中的磁富集,培养,人造血干细胞和祖细胞(HSPCs)的表征,基因编辑和移植的过程的图形摘要。 请点击此处查看此图的大图。

图 2:RUS 鸡尾酒丰富了 HSC 的频率。将mPB-HSPC在含有载体(DMSO)和RUS混合物的细胞因子的干细胞培养基中培养3天,并用25 pM的Cas9-RNP进行基因编辑。通过FACS分析基因编辑的细胞在核转染后48小时对HSPC的标记进行分析。(A)流动图代表活细胞(7AAD-)和CD34 + CD90 +群体。(B)在DMSO和RUS处理组中分析72 h后编辑的插入缺失模式的百分比和频率。(C)CD34 + CD90 +细胞的绝对数量分析48小时后编辑(n = 2)(供体= 1)。(D)分析48小时后编辑(n = 2)(供体= 1)的总有核细胞(TNC)的绝对数量。误差条表示 SEM 的平均值± *p ≤ 0.05(未配对 t 检验)。请点击此处查看此图的大图。
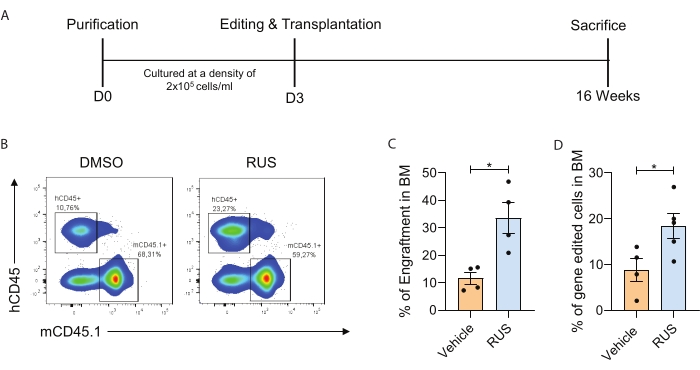
图3:优化的培养条件增加了体内基因修饰细胞的频率。 (A)实验示意图。(B)具有代表性的FACS图,显示小鼠BM中的hCD45 +细胞。插图是指人类细胞(左)和小鼠细胞(右)。HSPC培养3天,第3天用sgRNA进行基因编辑,电穿孔后立即移植。(C)输注后16周将人类细胞植入小鼠BM(n = 4)。(D)输注后16周小鼠BM中人类基因修饰细胞(hCD45 +基因编辑细胞)嵌合(n = 4)(供体= 1)。每个点代表单个鼠标,数据点来自单个实验。误差条表示 SEM ±平均值,*p≤ 0.05(未配对 t 检验)。该图经克里斯托弗等人许可改编7。请点击此处查看此图的大图。
| 细胞计数 | 纯化缓冲液(毫升) |
| < 1 x 107 细胞 | 0.1 |
| 1 x 107 - 1 x 108 细胞 | 0.5 |
| 1 - 5 x 108 细胞 | 1 |
表1:制备用于CD34+ 细胞纯化的细胞悬液的纯化缓冲液的体积。
| 引物名称 | 序列 |
| CCR5 转发 | CAGAGCCAAGCTCTCCATC |
| CCR5 反向 | AGAGACGCAAACACAGCCA |
| CCR5测序正向引物 | AATGTAGACATCTATGTAGG |
表2:用于扩增CCR5位点的引物序列。
| 组件 | 50 μL 反应 |
| 缓冲液 (5x) | 10 微升 |
| 正向引物 (10 μM) | 1 微升 |
| 反向底漆 (10 μM) | 1 微升 |
| dNTP | 4 微升 |
| 聚合酶 | 1 微升 |
| 基因组脱氧核糖核酸 | 200 纳克 |
| 无核酸酶水 | 高达 50 μL |
表3:使用PCR扩增CCR5位点的反应混合物。
| 步骤 | 期间 | 温度 | 周期数 |
| 初始变性 | 1 分钟 | 95 °C | 1 |
| 变性 | 10 秒 | 98 °C | 35 |
| 退火 | 15 秒 | 56 °C | |
| 外延 | 30 秒 | 68 °C | |
| 最终延期 | 1 分钟 | 72 °C | 1 |
| 拿 | ∞ | 15 °C |
表4:扩增CCR5位点的热循环仪条件。
| 组件 | 10 μL 反应 |
| 缓冲液 (5x) | 2 微升 |
| 底漆 (2 μM) | 1.6 微升 |
| RR 混合物 | 0.75 微升 |
| PCR净化产品 | 80 纳克 |
| 无核酸酶水 | 高达 10 μL |
表5:用于桑格测序PCR的反应混合物。
| 步骤 | 期间 | 温度 | 周期数 |
| 变性 | 15 秒 | 96 °C | 27 |
| 退火 | 20 秒 | 55 °C | |
| 外延 | 4 分钟 | 60 °C | |
| 拿 | ∞ | 15 °C |
表 6:桑格测序 PCR 的热循环仪条件。
| 缓冲区 | 组成 |
| 10x RBC 裂解缓冲液 – 100 mL (pH – 7.3) | 8.26 克 NH4Cl、1.19 克 NaHCO3、200 μL EDTA(0.5 M,pH8) |
| 50x TAE 缓冲液 (pH – 8.3) | 将50 mM EDTA钠盐,2 M Tris,1 M冰醋酸溶解在1L水中 |
表7:缓冲液组合物
| 抗体 | 卷 |
| 抗人类CD45 APC | 3 微升 |
| 抗小鼠CD45.1 PerCP-Cy5 | 4.5 微升 |
| 抗鼠标 CD34 聚乙烯 | 3 微升 |
表8:用于评估人类细胞植入的抗体。
| 抗体 | 卷 |
| 抗人类CD45 APC | 3 微升 |
| 抗小鼠 CD19 全氯化碳 | 15 微升 |
| 抗鼠标 CD13 聚乙烯 | 15 微升 |
| 抗小鼠CD3 PE-Cy7 | 2 微升 |
表9:用于评估来自移植HSPC的多谱系细胞比例的抗体。
讨论
HSPC基因治疗的成功结果主要取决于移植物中可移植HSC的质量和数量。然而,HSC的功能特性在基因治疗产品的准备阶段受到很大影响,包括体外培养和与基因操作程序相关的毒性。为了克服这些限制,我们已经确定了理想的HSPC培养条件,这些条件在离体培养中保留了CD34 + CD133 + CD90 + HSC的干性。许多研究小组使用SR1或UM171或其他分子作为独立分子在体外扩增脐带血(UCB)HSPCs23,24。之前的一项研究使用了SR1和UM17125的组合。培养基的小分子和细胞因子针对动员的成人HSPC及其在自体基因治疗中的应用进行了专门优化。筛选实验表明,结合白藜芦醇、UM729和SR1三种小分子,对于产生大量CD34+CD90+细胞和抑制分化和承诺祖细胞的增殖具有重要意义。RUS鸡尾酒中的UM729可以用UM171代替。但是,UM171的商业采购不太可行。细胞因子浓度采用临床研究26中使用的方案,以减少放大过程中的变异性。细胞因子混合物含有IL6而不是IL3,以最大限度地减少体外祖细胞增殖和HSC耗竭27。建议制备培养基的新鲜等分试样(基础培养基+ RUS +细胞因子混合物),以减少实验变异并获得高重现性。该协议适用于NHEJ和HDR介导的基因编辑。特别是,电穿孔前48-72小时和电穿孔后24小时的HSPC培养对于HDR基因编辑至关重要。优化的培养条件应有利于HDR基因编辑,保留干细胞。还观察到培养条件有助于长期HSC中的慢病毒转导。这表明,如果将AAV6或IDLV等病毒颗粒用作HDR供体,则HDR编辑效率有望提高,因为优化的培养条件促进了供体递送到HSC。
为了评估基因编辑结果,包括NHEJ和HDR,建议使用NGS分析,探针或ddPCR分析或Sanger测序7,8,28,然后使用在线工具(ICE / ICE敲入)16进行反卷积,因为它具有强大的定量性质。或者,可以对编辑的DNA样品进行T7核酸内切酶测定,并且可以使用ImageJ定量片段化的DNA条带。然而,T7 核酸内切酶测定方法不如反卷积分析精确,并且针对二代测序。
移植方案还通过用白消安调节NBSGW小鼠来优化,使低细胞剂量能够评估HSPC植入和再增殖。总体而言,该程序必须减少基因操作所需的HSPC剂量,并提高HSPC基因治疗在发展中国家的可及性。
本研究展示了PBMNC分离、CD34+ HSPC纯化、基因编辑和验证以及小鼠骨髓中移植基因编辑HSPC的评估方案。还证明,优化的HSPC培养物富集CD34 + CD133 + CD90 + HSPC,并增加体内基因编辑细胞的嵌合性。
披露声明
作者声明不存在相互竞争的经济利益。
致谢
作者要感谢CSCR流式细胞术设施和动物设施的工作人员。A.C.由ICMR-SRF研究金资助,K.V.K.由DST-INSPIRE研究金资助,P.B.由CSIR-JRF研究金资助。 这项工作由印度政府生物技术部资助(拨款号BT/PR26901/MED/31/377/2017和BT/PR31616/MED/31/408/2019)
材料
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector® X Unit | LONZA BIOSCIENCE | AAF-1003X | |
| 4D-Nucleofector™ X Kit ( 16-well Nucleocuvette™ Strips) | LONZA BIOSCIENCE | V4XP-3032 | |
| Antibiotic-Antimycotic (100X) | THERMO SCIENTIFIC | 15240096 | |
| Anti-human CD45 APC | BD BIOSCIENCE | 555485 | |
| Anti-human CD13 PE | BD BIOSCIENCE | 555394 | |
| Anti-human CD19 PerCP | BD BIOSCIENCE | 340421 | |
| Anti-human CD3 PE-Cy7 | BD BIOSCIENCE | 557749 | |
| Anti-human CD90 APC | BD BIOSCIENCE | 561971 | |
| Anti-human CD133/1 | Miltenyibiotec | 130-113-673 | |
| Anti-human CD34 PE | BD BIOSCIENCE | 348057 | |
| Anti-mouse CD45.1 PerCP-Cy5 | BD BIOSCIENCE | 560580 | |
| Blood Irradator-2000 | BRIT (Department of Biotechnology, India) | BI 2000 | |
| Cell culture dish (delta surface-treated 6-well plates) | NUNC (THERMO SCIENTIFIC) | 140675 | |
| CrysoStor CS10 | BioLife solutions | #07952 | |
| Busulfan | CELON LABS (60mg/10mL) | - | |
| Guide-it Recombinant Cas9 | TAKARA BIO | 632640 | |
| Cas9-eGFP | SIGMA | C120040 | |
| Centrifuge tube-15ml | CORNING | 430790 | |
| Centrifuge tube-50ml | NUNC (THERMO SCIENTIFIC) | 339652 | |
| DMSO | MPBIO | 219605590 | |
| DNAase | STEMCELL TECHNOLOGIES | 6469 | |
| Dulbecco′s Phosphate Buffered Saline- 1X | HYCLONE | SH30028.02 | |
| EasySep™ Human CD34 Positive Selection Kit II | STEMCELL TECHNOLOGIES | 17856 | |
| EasySep magnet | STEMCELL TECHNOLOGIES | 18000 | |
| Electrophoresis unit | ORANGE INDIA | HDS0036 | |
| FBS | THERMO SCIENTIFIC | 10270106 | |
| Flow cytometer – ARIA III | BD BIOSCIENCE | - | |
| FlowJo | BD BIOSCIENCE | - | |
| Flt3-L | PEPROTECH | 300-19-1000 | |
| Gel imaging system | CELL BIOSCIENCES | 11630453 | |
| HighPrep DTR reagent | MAGBIOGENOMICS | DT-70005 | |
| Human BD Fc Block | BD BIOSCIENCE | 553141 | |
| IL6 | PEPROTECH | 200-06-50 | |
| IMDM media | THERMO SCIENTIFIC | 12440053 | |
| Infrared lamp | MURPHY | - | |
| Insulin syringe 6mm 31G | BD BIOSCIENCE | 324903 | |
| Ketamine | KETMIN 50 | - | |
| Loading dye 6X | TAKARA BIO | 9156 | |
| Lymphoprep | STEMCELL TECHNOLOGIES | 7851 | |
| Mice Restrainer | AVANTOR | TV-150 | |
| Nano drop spectrophotometer | THERMO SCIENTIFIC | ND-2000C | |
| Neubauer cell counting chamber | ROHEM INSTRUMENTS | CC-3073 | |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) | The Jackson Laboratory | RRID:IMSR_JAX:005557 | |
| NOD,B6.SCID Il2rγ−/−KitW41/W41 (NBSGW) | The Jackson Laboratory | RRID:IMSR_JAX:026622 | |
| Nunc delta 6-well plate | THERMO SCIENTIFIC | 140675 | |
| Polystyrene round-bottom tube | BD | 352008 | |
| P3 primary cell Nucleofection solution | LONZA BIOSCIENCE | PBP3-02250 | |
| Pasteur pipette | FISHER SCIENTIFIC | 13-678-20A | |
| PCR clean-up kit | TAKARA BIO | 740609.25 | |
| Mouse Pie Cage | FISCHER SCIENTIFIC | 50-195-5140 | |
| polystyrene round-bottom tube (12 x 75 mm) | STEMCELL TECHNOLOGIES | 38007 | |
| Primer3 | Whitehead Institute for Biomedical Research | https://primer3.ut.ee/ | |
| QuickExtract™ DNA Extraction Solution | Lucigen | QE09050 | |
| Reserveratrol | STEMCELL TECHNOLOGIES | 72862 | |
| SCF | PEPROTECH | 300-07-1000 | |
| SFEM-II | STEMCELL TECHNOLOGIES | 9655 | |
| sgRNA | SYNTHEGO | - | |
| SPINWIN | TARSON | 1020 | |
| StemReginin 1 | STEMCELL TECHNOLOGIES | 72342 | |
| ICE analysis tool | SYNTHEGO | https://ice.synthego.com/ | |
| Tris-EDTA buffer solution (TE) 1X | SYNTHEGO | Supplied with gRNA | |
| Thermocycler | APPLIED BIOSYSTEMS | 4375305 | |
| TPO | PEPROTECH | 300-18-1000 | |
| Trypan blue | HIMEDIA LABS | TCL046 | |
| UM171 | STEMCELL TECHNOLOGIES | 72914 | |
| UM729 | STEMCELL TECHNOLOGIES | 72332 | |
| Xylazine | XYLAXIN - INDIAN IMMUNOLOGICALS LIMITED | - |
参考文献
- Staal, F. J. T., Aiuti, A., Cavazzana, M. Autologous stem-cell-based gene therapy for inherited disorders: State of the art and perspectives. Frontiers in Pediatrics. 7, 443 (2019).
- Naldini, L. Genetic engineering of hematopoiesis: Current stage of clinical translation and future perspectives. EMBO Molecular Medicine. 11 (3), 9958 (2019).
- Srivastava, A., Shaji, R. V. Cure for thalassemia major - From allogeneic hematopoietic stem cell transplantation to gene therapy. Haematologica. 102 (2), 214-223 (2017).
- Venkatesan, V., Srinivasan, S., Babu, P., Thangavel, S. Manipulation of developmental gamma-globin gene expression: An approach for healing hemoglobinopathies. Molecular and Cellular Biology. 41 (1), 00253 (2020).
- Mazurier, F., Gan, O. I., McKenzie, J. L., Doedens, M., Dick, J. E. Lentivector-mediated clonal tracking reveals intrinsic heterogeneity in the human hematopoietic stem cell compartment and culture-induced stem cell impairment. Blood. 103 (2), 545-552 (2004).
- Piras, F., et al. Lentiviral vectors escape innate sensing but trigger p53 in human hematopoietic stem and progenitor cells. EMBO Molecular Medicine. 9 (9), 1198-1211 (2017).
- Christopher, A. C., et al. Preferential expansion of human CD34+CD133+CD90+ hematopoietic stem cells enhances gene-modified cell frequency for gene therapy. Human Gene Therapy. 33 (3-4), 188-201 (2021).
- Karuppusamy, K. V., et al. The CCR5 gene edited CD34+ CD90+ hematopoietic stem cell population serves as an optimal graft source for HIV gene therapy. Frontiers in Immunology. 13, 792684 (2022).
- Hopman, R. K., DiPersio, J. F. Advances in stem cell mobilization. Blood reviews. 28 (1), 31-40 (2014).
- Hoffman, T. L. Counting Cells. Cell Biology: A laboratory handbook. 1, 21-24 (2006).
- Antoniani, C., et al. Induction of fetal hemoglobin synthesis by CRISPR/Cas9-mediated editing of the human b-globin locus. Blood. 131 (17), 1960-1973 (2018).
- Azhagiri, M. K. K., Babu, P., Venkatesan, V., Thangavel, S. Homology-directed gene-editing approaches for hematopoietic stem and progenitor cell gene therapy. Stem Cell Research & Therapy. 12, 500 (2021).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565 (2010).
- Bagchi, A., et al. Direct generation of immortalized erythroid progenitor cell lines from peripheral blood mononuclear cells. Cells. 10 (3), 1-18 (2021).
- Ravi, R., et al. Identification of novel HPFH-like mutations by CRISPR base editing that elevates the expression of fetal hemoglobin. eLife. 11, 65421 (2020).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. CRISPR Journal. 5 (1), 123-130 (2022).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2Rγnull mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rγ-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
- Leonard, A., et al. Low-dose busulfan reduces human CD34+ cell doses required for engraftment in c-kit mutant immunodeficient mice. Molecular Therapy - Methods & Clinical Development. 15, 430-437 (2019).
- Tateno, A., Sakai, K., Koya, N., Aoki, T. Effects of total asphyxia on the development of synaptic junctions in the brains of mice. Acta Paediatrica Japonica; Overseas Edition. 34 (1), 1-5 (1992).
- Audigé, A., et al. Long-term leukocyte reconstitution in NSG mice transplanted with human cord blood hematopoietic stem and progenitor cells. BMC Immunology. 18 (1), 1-15 (2017).
- Nimmerjahn, F., Ravetch, J. V. Fc-receptors as regulators of immunity. Advances in immunology. 96, 179-204 (2007).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Ngom, M., et al. UM171 enhances lentiviral gene transfer and recovery of primitive human hematopoietic cells. Molecular Therapy - Methods & Clinical Development. 10, 156-164 (2018).
- Park, Y. S., et al. Enhancement of proliferation of human umbilical cord blood-derived CD34+ hematopoietic stem cells by a combination of hyper-interleukin-6 and small molecules. Biochemistry and Biophysics Reports. 29, 101214 (2022).
- Aiuti, A., et al. Lentivirus-based gene therapy of hematopoietic stem cells in Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151 (2013).
- Rai, R., et al. Optimized cell culture conditions promote ex-vivo manipulation and expansion of primitive hematopoietic stem cells for therapeutic gene editing. bioRxiv. , (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12 (1), 1-9 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。