Method Article
עריכת גנים CRISPR/Cas9 של תאי גזע ותאי אב המטופויאטיים ליישומי ריפוי גנטי
* These authors contributed equally
In This Article
Summary
הפרוטוקול הנוכחי מתאר הליך אופטימלי של תרבית גזע ותאי אב המטופויאטיים (HSPC) לחריטה חזקה של תאים שעברו עריכה גנטית in vivo.
Abstract
CRISPR/Cas9 הוא כלי רב-תכליתי ויעיל ביותר לעריכת גנים שאומץ באופן נרחב לתיקון מוטציות גנטיות שונות. ההיתכנות של מניפולציה גנטית של תאי גזע ותאי אב המטופויאטיים (HSPCs) במבחנה הופכת את HSPCs לתא מטרה אידיאלי לריפוי גנטי. עם זאת, HSPCs מאבדים באופן מתון את פוטנציאל החריטה והריבוי שלהם בתרבות ex vivo . במחקר הנוכחי מתוארים תנאי תרבית אידיאליים המשפרים את השתלת HSPC ומייצרים מספר גדל והולך של תאים מהונדסים גנטית in vivo. הדו"ח הנוכחי מציג תנאים אופטימליים בתרבית מבחנה, כולל סוג המדיה של התרבית, תוספת קוקטיילים ייחודית של מולקולות קטנות, ריכוז ציטוקינים, צלחות תרביות תאים וצפיפות תרבית. בנוסף לכך, הליך עריכת גנים ממוטב של HSPC, יחד עם אימות אירועי עריכת הגנים, מסופקים. לצורך אימות in vivo , מוצגים עירוי HSPCs בעריכה גנטית וניתוח לאחר חריטה במקבלי עכברים. התוצאות הראו כי מערכת התרבית הגבירה את התדירות של HSCs תפקודיים במבחנה, וכתוצאה מכך השתלה חזקה של תאים שעברו עריכה גנטית in vivo.
Introduction
חוסר הנגישות לתורמים תואמי אנטיגן לויקוציטים אנושיים (HLA) במסגרות השתלה אלוגניות והפיתוח המהיר של כלי הנדסה גנטית רב-תכליתיים ובטוחים ביותר הופכים את השתלת תאי הגזע ההמטופוייטיים האוטולוגיים (HSCT) לאסטרטגיית טיפול מרפאת בהפרעות הדם התורשתיות 1,2. טיפול גנטי אוטולוגי בגזע המטופויאטי ובתאי אב (HSPC) כולל איסוף של HSPCs של חולים, מניפולציה גנטית, תיקון מוטציות הגורמות למחלות והשתלת HSPCs מתוקנים גנטית לחולה 3,4. עם זאת, התוצאה המוצלחת של הטיפול הגנטי מסתמכת על איכות השתל המהונדס גנטית. שלבי מניפולציית הגנים ותרביית ex vivo של HSPCs משפיעים על איכות השתל על ידי הפחתת התדירות של תאי גזע המטופויאטיים ארוכי טווח (LT-HSCs), מה שמחייב עירוי של מינונים גדולים של HSPCs שעברו מניפולציה גנטית 2,5,6.
מספר מולקולות קטנות, כולל SR1 ו-UM171, משמשות כיום להרחבת HSPCs בדם טבוריבעוצמה של 7,8. עבור HSPCs בוגרים, בשל תפוקת התאים הגבוהה יותר המתקבלת בגיוס, אין צורך בהרחבה חזקה. עם זאת, שמירה על הגבעול של HSPCs מבודדים בתרבית ex vivo היא חיונית עבור יישומי הטיפול הגנטי שלה. לכן, גישה המתמקדת בהעשרת תרבית של תאי גזע המטופויאטיים (HSCs) מפותחת באמצעות שילוב של מולקולות קטנות: רזברטרול, UM729 ו-SR1 (RUS)7. תנאי התרבית הממוטבים של HSPC מקדמים את העשרת תאי ה-HSCs, וכתוצאה מכך את התדירות המוגברת של תאי HSCs מהונדסים גנטית in vivo, ומפחיתים את הצורך במניפולציה של גנים במינונים גדולים של HSPCs, מה שמקל על גישות חסכוניות לטיפול גנטי8.
כאן מתואר פרוטוקול מקיף לתרבית HSPCs, יחד עם עירוי וניתוח של תאים שעברו עריכה גנטית in vivo.
Protocol
ניסויי in vivo בעכברים מדוכאי חיסון אושרו על ידי ובוצעו בהתאם להנחיות ועדת האתיקה של המכון לבעלי חיים (IAEC), כריסטיאן מדיקל קולג', ולורה, הודו. דגימות דם היקפיות מגויסות של גורם מגרה מושבת גרנולוציטים (G-CSF) נאספו מתורמים אנושיים בריאים בהסכמה מדעת לאחר קבלת אישור מועצת הביקורת המוסדית (IRB).
1. בידוד תאי דם חד-גרעיניים היקפיים (PBMNCs) וטיהור תאי CD34 +
- בצע בידוד PBMNC בהתאם לשלבים הבאים.
הערה: עבור תרבית HSPC במבחנה ועריכת גנים, התחלה של לפחות 1 x 106 HSPCs / קבוצה היא אידיאלית. עבור ניתוח תחריט in vivo , מספר תא התחלתי של לפחות 5 x 10 6 HSPCs/קבוצה הוא אידיאלי אם קבוצה מכילה שמונה עכברים וכל עכבר הוא חדור לפחות6 x 105 תאים . כדי להשיג מספר מספיק של PBMNCs (~ 1 x 109) עבור ההליך, החל מ 20 מ"ל של דם היקפי מגויס (mPB) מומלץ.- לאחר איסוף ה-mPB, יש לדלל 20 מ"ל של mPB עם תמיסת מלח סטרילית 1x עם אגירת פוספט (PBS) ביחס של 1:1.
הערה: היעילות של גיוס G-CSF עשויה להשתנות בין אנשים9, ולכן, מספר HSPCs המתקבלים מ 20 מ"ל של דם מגויס משתנה בין תורמים. - הוסף 10 מ"ל של מדיום גרדיאנט צפיפות (לימפופר, ראה טבלת חומרים) לצינור 50 מ"ל ושכב את הדם המדולל דרך דפנות הצינור ביחס של 1:2.
הערה: הטיית הצינור של 50 מ"ל בזווית של 20° תוך הוספת הדם המדולל מונעת ממנו להתערבב עם לימפופר, מה שמוביל להפרדה ברורה של מרכיבי הדם לאחר צנטריפוגה. - צנטריפוגה ב-600 x גרם למשך 30 דקות בטמפרטורת החדר (RT) עם קצב האצה של 1 מ'/ש'² וקצב האטה של 1 מ'/ש'. השליכו את השכבה העליונה (פלזמה) באמצעות פיפטה סרולוגית וקצרו את ציפוי באפי הנמצא באינטרפאזה (PBMNCs) מעל השכבה הבינונית של גרדיאנט הצפיפות.
הערה: שאפו את ציפוי באפי באמצעות פיפטה סרולוגית על ידי סיבובו בעדינות על דפנות הצינור. הימנעו מאיסוף נפח גבוה יותר של אינטרפאזה בזמן שאתם שואפים לפרווה בצבע באפי כדי למנוע זיהום גרנולוציטים ו-RBC. - העבירו את ה-PBMNCs לצינור חרוטי טרי של 50 מ"ל ודללו את מתלי התאים עם PBS אחד ביחס של 1:2.
הערה: דלל את מתלה התא עם 1x PBS ביחס של 1:4 אם נאסף עודף של אינטרפאזה תוך כדי שאיפת ציפוי באפי. - צנטריפוגה של מתלה התא ב 200 x g במשך 5 דקות בטמפרטורת החדר עם קצב האצה של 9 m/s² וקצב האטה של 7 m/s² ולהשליך את supernatant באמצעות פיפטה סרולוגית. הוסיפו 30 מ"ל של חיץ תסיסה RBC קר כקרח (ראו טבלה 7) לכדור ודגרו בקרח למשך 10 דקות. מערבבים על ידי היפוך הצינור כל 2 דקות.
- צנטריפוגה בגודל 200 x גרם למשך 5 דקות בטמפרטורת החדר עם קצב תאוצה של 9 m/s² וקצב האטה של 7 m/s², ולהשליך את הסופרנטנט. חזור על שלבים 1.1.5.-1.1.6. עד שאדמומיות הכדור נעלמת. השהה את הכדור עם מדיה בסיסית (IMDM, ראה טבלת חומרים) ובצע ספירת תאים באמצעות טריפאן כחול בתא נויבאואר10.
הערה: ניתן להשתמש באופן מיידי ב- PBMNCs המבודדים כדי לטהר CD34+ HSPCs. לחלופין, ניתן להקיא ולהחיות את ה- PBMNCs בכל פעם שיש צורך בהעשרת CD34+. לשימור בהקפאה, צנטריפוגה 5 x 108 תאים ב 200 x גרם במשך 5 דקות ולהוסיף 4 מ"ל של מדיה cryo המכילה IMDM: FBS: DMSO (ראה טבלת חומרים) ביחס של 7:2:1. - העבירו את הבקבוקונים ל-cryocooler בטמפרטורה של 1°C ואחסנו אותם בטמפרטורה של 80°C- למשך עד 12 שעות. העבירו ואחסנו את הקריוביאלים במיכל חנקן נוזלי לאחסון לטווח ארוך.
- לאחר איסוף ה-mPB, יש לדלל 20 מ"ל של mPB עם תמיסת מלח סטרילית 1x עם אגירת פוספט (PBS) ביחס של 1:1.
- להחיות את PBMNCs בהקפאה.
- חצי להפשיר את cryovials באמבט מים 37 מעלות צלזיוס על ידי מערבולת עדינה במשך <1 דקות. העבר את תרחיף התא של הקריוביאלי לצינור 50 מ"ל המכיל IMDM ביחס של 1:10.
- צנטריפוגה של מתלה התא ב 200 x g במשך 5 דקות בטמפרטורת החדר עם קצב האצה של 9 m/s² וקצב האטה של 7 m/s², ולהשליך את supernatant באמצעות פיפטה סרולוגית.
- נקה את תאי CD34+ מ- PBMNCs בהתאם לשלבים הבאים.
- הכינו את חיץ הטיהור עם PBS סטרילי 1x המכיל 2% סרום בקר עוברי מסונן (FBS). השהה את גלולת התא PBMNC במאגר לפי טבלה 1.
הערה: המאגר חייב להיות נטול Ca++ ו-Mg++ . - העבר את מתלה התאים המכיל 1 x 10 8-5 x 108 תאים של PBMNCs טריים או בהקפאה לצינור הפוליסטירן בעל התחתית העגולה של 5 מ"ל (ראה טבלת חומרים).
הערה: יש להוסיף DNase (ראו טבלת חומרים) בריכוז סופי של 100 מיקרוגרם/מ"ל לתרחיף התא כדי למנוע היווצרות גושים בתאים. השתמשנו בערכה זמינה מסחרית לטיהור CD34 המכילה קוקטייל בחירה חיובית CD34 אנושי וכדורי דקסטרן מהירים (ראו טבלת חומרים). - הוסף קוקטייל בחירה חיובית של Human CD34 הזמין מסחרית (ראה טבלת חומרים) בריכוז של 100 μL/mL של תאים והשב בעדינות.
- יש לדגור ב-RT למשך 30 דקות ולהשהות בעדינות את מתלה התא כל 5 דקות. הוסף 50 μL/mL של כדורים מהירים של דקסטרן הזמינים מסחרית (ראה טבלת חומרים) והשעה בעדינות.
הערה: מערבבים את כדורי הדקסטרן במהירות גבוהה במשך 5 שניות כדי להבטיח שהחלקיקים ייראו מפוזרים באופן שווה ולאחר מכן להוסיף אותם לתאים. - יש לדגור ב-RT למשך 15 דקות ולהשהות בעדינות את מתלה התא כל 5 דקות. הפוך את מתלה התא לנפח כולל של 2.5 מ"ל עם חיץ טיהור והשעה אותו בעדינות.
- הכניסו את הצינור למגנט חיסוני ללא עמודות מסחריות (ראו טבלת חומרים) ודגרה למשך 5 דקות ב-RT. לאחר הדגירה, הפוך את המגנט והשלך את הסופרנטנט בתנועה רציפה אחת.
הערה: תאי CD34+ המתויגים ב-Dextran Rapid Spheres נשארים נמשכים לצידי הצינור על ידי השדה המגנטי. הצינור חייב להיות מוחזק במצב הפוך במשך 2-3 שניות. הימנעו מרעד או מהכתמת הטיפות שנותרו תלויות מפי הצינור. - הסר את הצינור מן המגנט ולהוסיף 2.5 מ"ל של חיץ טיהור. חזור על שלבים 1.3.6-1.3.7 חמש פעמים.
הערה: במהלך הוספת חיץ הטיהור, מקם את הצינור בזווית חדה והוסף חיץ על ידי סיבוב הצינור, מכיוון שהתאים עשויים להיצמד לדפנות פני השטח תוך היפוך המגנט. - לאחר השלמת חמש כביסות, הסר את הצינור מהמגנט, הוסף 4 מ"ל של PBS סטרילי 1x, והשעה את השעיית התא. העבר את מתלה התא לצינור הצנטריפוגה של 15 מ"ל והפוך אותו לעד 10 מ"ל עם PBS אחד. בצע ספירת תאים באמצעות טריפאן כחול בתא נויבאואר10.
- צנטריפוגה ב 200 x g במשך 5 דקות ב- RT (תאוצה ~ 9 m / s², האטה ~ 7 m / s²) ולהשליך את supernatant עם פיפטה. כדי לתרבת את ה-HSPCs, יש לתלות מחדש את התאים במדיית תרבית HSPC, כפי שצוין בשלב 2.1.
הערה: העודפים של HSPCs מטוהרים הוקפאו במדיום שימור בהקפאה זמין מסחרית (ראה טבלת חומרים) בצפיפות של 9 x 106 תאים למ"ל לאחר גידול HSPCs במשך 12 שעות במדיית תרבית HSPC.
- הכינו את חיץ הטיהור עם PBS סטרילי 1x המכיל 2% סרום בקר עוברי מסונן (FBS). השהה את גלולת התא PBMNC במאגר לפי טבלה 1.
- להחיות את HSPCs בהקפאה.
- להפשיר את cryovials במשך < 1 דקות באמבט מים 37 מעלות צלזיוס על ידי מערבולת עדינה. העבר את ההשעיה התאית בקריביאל לצינור של 50 מ"ל.
- הוסף 1% BSA החייאה ב 1x PBS טיפה אחר טיפה עם תסיסה מתמדת ולהפוך אותו עד 20 מ"ל. צנטריפוגה בגודל 200 x גרם למשך 5 דקות בטמפרטורת החדר עם קצב תאוצה של 9 m/s² וקצב האטה של 7 m/s² והשלכת הסופרנטנט באמצעות פיפטה סרולוגית.
- חזור על שלב 1.4.2. 1x. השהה את התאים במדיה ובתרבית תרבית HSPC כמתואר בשלב 2.1.
2. תרבות חוץ גופית של HSPCs מטוהרים
- הכן את מדיית התרבית באמצעות SFEM-II עם SCF (240 ננוגרם/מ"ל), FLT3 (240 נ"ג/מ"ל), TPO (80 נ"ג/מ"ל), IL6 (40 נ"ג/מ"ל) ואנטיביוטי-אנטי-מיקוטי אחד (ראו טבלת חומרים).
הערה: מומלץ מאוד להשתמש במדיה תרבותית טרייה. עם זאת, ניתן לאחסן את המדיה בטמפרטורה של 4 מעלות צלזיוס עד 24 שעות לאחר ההכנה. - השהה את גלולת CD34+ עם מדיית התרבית, הוסף 3 μL של קוקטייל RUS / מ"ל של מדיה (רסברטרול, 10 μM; UM729, 500 ננומטר; StemReginin-1, 750 nM; ראה טבלת חומרים), ותרבית את התאים ב-37 מעלות צלזיוס עם 5% CO2.
הערה: ניתן להשתמש ב-UM171 (10 ננומטר) כדי להחליף את UM729 (500 ננומטר) מכיוון שלשניהם יש השפעות דומות על תחזוקת גזע HSPC7. לא ניתן להפשיר את הבקבוקונים יותר מפעמיים. - בתחילה, זרעו את התאים המטוהרים במפגש של 5 x 105/מ"ל בלוחות דלתא שטופלו על פני השטח באופן מסחרי (ראו טבלת חומרים) כדי להסיר את התאים הדביקים.
- זרעו מחדש את התאים בתרחיף במפגש של 2 x 105 תאים למ"ל בצלחת חדשה של 6 בארות לאחר 6 שעות של טיהור.
- אפיינו את הגבעול של ה-HSPCs באמצעות ציטומטריה של זרימה לפני עריכת גנים.
- לניתוח ציטומטריה של זרימה, קח 1 x 105 תאים ב - 100 μL של 1x PBS והוסף 3 μL (75 ננוגרם) של CD34 PE, 4 μL (100 ננוגרם) של CD133 FITC, ו- 4 μL (100 ננוגרם) של CD90 APC (ראה טבלת חומרים).
- דגרו את הצינור ב-RT למשך 20 דקות בחושך. לשטוף את התאים עם 2 מ"ל של 1x PBS 2x וצנטריפוגה ב 200 x גרם במשך 5 דקות ב RT. להשליך את supernatant עם פיפטה, להשעות את כדור התא עם 150 μL של 1x PBS, ולרכוש אותו ציטומטריה זרימה.
הערה: אם אחוז תאי CD34+ הוא <90%, הגדל את מספר השטיפות עד שש פעמים בשלב 1.3.7. זרעו את ה- HSPCs המטוהרים במדיה התרבית, ולאחר 6 שעות, אספו רק את התאים בהשעיה. רוב תאי ה-CD34 נצמדים לצלחת התרבית.
3. עריכת גנים של HSPCs
- בצע שחזור RNA מדריך.
הערה: sgRNA סינתטי עם שינויי זרחן המכוונים למוקד CCR5 התקבלו ממקורות מסחריים (ראה טבלת חומרים).- לצורך בנייה מחדש, כוון את מערבל התרמו-טמפרטורה ל-37°C וחמם מראש את מאגר TE 1x (ראו טבלת חומרים) ב-37°C למשך 10 דקות. צנטריפוגה של בקבוקון sgRNA סינתטי שעבר שינוי כימי ב-11,000 x g למשך דקה אחת ב-4 מעלות צלזיוס.
- לבקבוקון sgRNA המכיל 1.5 ננומטר של sgRNA ליופילי, הוסף 15 μL של מאגר TE 1x, המניב ריכוז סופי של 100 pM/μL. יש להשהות בעדינות עד פי 5, תוך סיבוב הקצה מעבר לפינות.
- דגירה במערבל התרמו-טמפרטורה ב-37°C למשך 30-40 שניות עם ניעור מינימלי. לאחר סיבוב קצר, אסוף 15 μL של sgRNA ואחסן כ- 1 μl aliquots (100 pM/μL) ב- −80 °C לשימוש עתידי עד שנה אחת.
הערה: יש להימנע מהפשרה חוזרת ונשנית בהקפאה. מומלץ לכל היותר מחזור הפשרה אחד של gRNA אליציטוט.
- בצע נוקלאוקציה לפי השלבים הבאים.
- ביום השלישי של התרבית, ספרו את התאים באמצעות תא ספירת התאיםהמשופר של נויבאואר 10.
- לצורך הכנת RNP (ליצירת גרעין של 2 x 10 5 תאים), קח 1 μL של sgRNA המכוון לגן CCR5 (100 pM) בצינור0.5 מ "ל והוסף 2.65 μL של Cas9 (50 pM) על ידי מערבולת עדינה סביב החלק התחתון של הבקבוקון. דגירה ב- RT במשך 10 דקות.
הערה: רצף gRNA: (CCR5) TGACATCAATTATTATACATCGG. - להכנת חיץ, יש להוסיף 16.4 μL של תמיסת תאים ראשוניים P3 ו-3.6 μL של תוספת, המסופקת עם ערכת הנוקלאופקציה המסחרית (ראו טבלת חומרים), ולדגור ב-RT למשך 10 דקות. הכינו את מדיית התרבית (שלב 2.1.) והניחו אותה מראש בטמפרטורה של 37 מעלות צלזיוס בצלחת התרבית לפני הנוקלאופקציה.
- גלולה 2 x 10 5 תאים על ידי צנטריפוגה ב 200 x גרם במשך 5 דקות ב RT בעדינות להשליך את supernatant באמצעות פיפטה מבלי להפריע את הכדור. השהה את הכדור עם 20 μL של החיץ מוכן בשלב 3.2.3. ולהשעות אותו בעדינות.
- ערבבו בעדינות את מתלה התא עם קומפלקס ה-RNP המוכן (שלב 3.2.2.) ללא בועות אוויר. מעבירים את המתלה לרצועת הגרעין המסחרית (ראו טבלת חומרים) ובוחרים את קוד הפולס DZ100 כדי לחשמל את התאים באמצעות הנוקלאופקטור הארבע-ממדי (ראו טבלת חומרים).
הערה: הנפח הסופי של מתלה התא, כולל רכיבי המאגר וה-RMP, לא יעלה על יותר מ-27 μL/אלקטרופורציה. - עבור הבקרה הניסויית, גלולה 2 x 10 5 HSPCs לא ערוך על ידי צנטריפוגה ב 200 x g במשך5 דקות ב RT, ו להשעות את הכדור עם 20 μL של המאגר מוכן בשלב 3.2.3. ללא קומפלקס RNP.
- הוסיפו 100 μL של מדיית תרבית מודגרת מראש (שלב 3.2.3.) לתאים האלקטרופואטים והשאירו את התאים ללא הפרעה למשך 10 דקות ברצועת הגרעין ב-RT. לאחר 10 דקות של דגירה, מעבירים את התוכן לצלחת התרבית בהתאם לדרישות הניסוי.
הערה: פרוטוקול זה יכול להיות מיושם על צירוף קצה לא הומולוגי (NHEJ) - הפרעה ממוקדת בתיווך של כל מוקד גנומי באמצעות gRNA ספציפי למטרה. ניתן ליישם את אותו פרוטוקול להצגת מחיקות גדולות על ידי הכללת gRNA כפול בשלב 3.2.2. 11. יתר על כן, לאחר 10 דקות של דגירה של RNP, ניתן להשתמש באותו פרוטוקול לעריכת גנים מבוססת תיקון מכוון הומולוגי (HDR) כאשר הוא מסופק עם תבנית תורם12. הפרוטוקול אומת על ידי שיבוש ממוקד של AAVS1, פסאודו β-גלובין, β-גלובין, ואת CCR5 לוקוס 7,8.
4. אימות של אירועי עריכת גנים ב- HSPCs
- בצע מיצוי DNA.
- לאחר 72 שעות לאחר הנוקלאופקציה, בצע ספירת תאים באמצעות טריפן כחול בתא נויבאואר. אסוף 1 x 105 HSPCs ערוכים גנטית למיצוי DNA.
- צנטריפוגה של התאים ב 11,000 x g במשך 5 דקות ב RT ולהשליך את supernatant באמצעות פיפטה. השהה את הכדור עם 1 מ"ל של 1x PBS וחזור על הצנטריפוגה והשלך את supernatant. לכדור, יש להוסיף 20 μL של תמיסת מיצוי מהירה (ראה טבלת חומרים) עבור 1 x 105 תאים ולתלות מחדש את הכדור.
- דגרו את התערובת בתרמוציקלר בטמפרטורה של 68 מעלות צלזיוס למשך 30 דקות. לאחר סיבוב קצר, דגרו את התערובת בתרמוציקלר בטמפרטורה של 98 מעלות צלזיוס למשך 10 דקות. מדוד את ריכוז הדנ"א בליזאט הגולמי באמצעות ספקטרופוטומטר13.
- בצע את ההגברה של לוקוס ערוך גנטית על ידי PCR.
- באמצעות פריימר3 (ראו טבלת חומרים), עצבו את הפריימרים הספציפיים ללוקוס המשתרעים על פני אתר השבר הדו-גדילי (DSB) עם גדלי אמפליקון הנעים בין 400-700 bp (טבלה 2).
הערה: Primer3 הוא כלי קוד פתוח מבוסס אינטרנט לתכנון פריימרים PCR. - הכינו את תערובת התגובה כפי שמופיעה בטבלה 3 והפעילו את התרמו-ציקלר עם תנאי המחזור המוזכרים בטבלה 4. כדי לאשר את ההגברה של הלוקוס הרצוי, יש לערבב 5 μL של מוצר PCR עם צבע העמסה של 6x ולהעמיס על אלקטרופורזה של ג'ל אגרוז 2% המיוצרת באמצעות חיץ TAE.
הערה: רכיבי מאגר TAE מסופקים בטבלה 7. - הפעל במשך 30-40 דקות ב-100 וולט וזהה את האמפליקון באמצעות מערכת הדמיית ג'ל (ראה טבלת חומרים). על פי פרוטוקול יצרן טיהור PCR (ראה טבלת חומרים), נקה את מוצר ה- PCR המוגבר.
- מדוד את הריכוז של מוצר ה-PCR המטוהר באמצעות ספקטרופוטומטר ננו-טיפות (ראו טבלת חומרים).
- באמצעות פריימר3 (ראו טבלת חומרים), עצבו את הפריימרים הספציפיים ללוקוס המשתרעים על פני אתר השבר הדו-גדילי (DSB) עם גדלי אמפליקון הנעים בין 400-700 bp (טבלה 2).
- בצע ריצוף סנגר והסרת שליחות קטלנית של צבע ללא תשלום בהתאם לשלבים הבאים.
- הכינו את תערובת התגובה כפי שמוצג בטבלה 5. הפעל את התרמו-ציקלר עם תנאי הרכיבה המוזכרים בטבלה 6.
- הוסף 10 μL של מגיב DTR HighPrep (ראה טבלת חומרים) ו-40 μL של 85% אתנול ל-10 μL של דגימת PCR בצינור של 1.5 מ"ל וערבב אותו על ידי פיפטינג נמרץ בערך 8x-10x.
- דגרו את התערובת ב-RT למשך 5 דקות והניחו את הצינור בגודל 1.5 מ"ל על מעמד ההפרדה המגנטי למשך 5 דקות. הסר את הסופרנטנט באמצעות פיפטה והוסף 100 μL של 85% אתנול.
- השליכו את הסופר-נטנט וחזרו על שלב 4.3.3. 1x. הוציאו את צינורות ה-1.5 מ"ל ממעמד המגנטים ודגרו אותם בטמפרטורה של 37 מעלות צלזיוס למשך 10 דקות במערבל תרמו כדי לייבש את האתנול.
- יש להשעות במרץ את החרוזים ב-40 מיקרו-ליטר של מים נטולי נוקלאז ולדגור ב-RT למשך 5 דקות. הניחו את הצינור על מעמד ההפרדה המגנטי למשך 5 דקות, ובצעו ריצוף סנגר בעקבות דיווחיםשפורסמו 14,15.
- בצע הערכת תדירות אינדל על ידי ניתוח ICE16.
- השתמש ב- Synthego (ראה טבלת חומרים) לניתוח ICE.
- העלה קבצי ab1 של דגימות ערוכות ולא ערוכות ורצפי gRNA ולחץ על ניתוח כדי לקבל את התדירות של האינדלים.
5. השתלת HSPCs שעברו עריכה גנטית
- התנה מראש את עכבר הגמא NOD scid (NSG)17 ו- NOD הזמינים מסחרית. CG-KitW-41JTyr+PrkdcscidIL2rgtm1Wjl/ThomJ (NBSGW)18 עכברים (ראו טבלת חומרים) להשתלת מח עצם.
- לחימום מוקדם של עכברי NSG, בחרו נקבות עכברים בנות 6-8 שבועות והפרידו אותן לקבוצות בקרה ועריכה על ידי אקראיות עיוורת.
- הניחו את עכברי ה-NSG בכלובי העוגה והקרינו ב-3.5 Gy באמצעות מקרין זמין מסחרית (ראו טבלת חומרים) 6-8 שעות לפני השתלת HSPC.
הערה: מומלץ לשקול את העכברים לפני ההקרנה, ועכברים במשקל >20 גרם יהיו נתונים להקרנה. - לחימום מוקדם של עכברי NBSGW זכרים ונקבות בני 6-8 שבועות, יש להזריק בוסולפן (ראו טבלת חומרים) באמצעות הזרקה תוך-צפקית (IP) במינון של 12.5 מ"ג/ק"ג משקל גוף 48 שעות לפני השתלת HSPC.
הערה: התניית בוסולפן מגבירה את החריטה של HSPCs אנושיים במח העצם של העכבר ומפחיתה את הצורך בהחדרת מינונים גדולים של HSPCs שעברו עריכה גנטית19. הטווח האידיאלי של מינון בוסולפן לריכוך הוא בין 10 מ"ג/ק"ג ל-15 מ"ג/ק"ג משקל גוף. מינונים גבוהים יותר של בוסולפן יגרמו לבעיות תמותה קשות.
- הכן את תרחיף התאים להשתלת מח עצם.
- לאחר 10 דקות של דגירה של HSPCs בעריכת גנים ברצועת הנוקלאוקציה (ראה שלב 3.2.7.), העבר את תרחיף התא ל -10 מ"ל של PBS אחד. ספרו את התאים באמצעות תא ספירת התאיםהמשופר של נויבאואר 10.
- עבור עירוי של עכבר אחד, גלולה 6 x 105 תאים בצינור 1.5 מ"ל על ידי צנטריפוגה ב 200 x g במשך 5 דקות ב RT בעדינות להשליך את supernatant באמצעות פיפטה מבלי להפריע גלולה. השהה את כדור התא עם 100 μL של 1x PBS.
- החדירו את ה- HSPCs על ידי הזרקת וריד זנב בעקבות השלבים הבאים.
- הנח את עכבר NSG או NBSGW המותנה מראש במרסנת העכבר (ראה טבלת חומרים).
- החזק את זנב העכבר ודחף בעדינות את התקע כדי לרסן את העכבר. נגבו בעדינות את זנב העכבר עם 70% אתנול. שאפו 100 μL של תרחיף התא במזרק אינסולין 31 גרם.
הערה: יש להימנע לחלוטין מבועות במוצר העירוי על ידי הקשה עדינה על המזרק או הזזת הבוכנה בעדינות. - כוון את האור ממנורת האינפרא אדום על הזנב במשך 30-40 שניות, המכסה את אזור הגוף של העכבר בקפלים של נייר טישו. הכנס בעדינות את החלק המשופע של המחט לתוך וריד הזנב השמאלי או הימני בזווית של 20 מעלות.
- הרם את הזנב עם האצבע המורה השמאלית כדי לשמור אותו בציר המישורי עם המזרק. לדחוף את הבוכנה כדי להחדיר את ההשעיה התא לתוך הווריד. הפעל לחץ עדין ליד האזור המנוקב עם נייר טישו ומשוך את המחט.
- לאחר 30 שניות של הפעלת לחץ עדין, הסר את העכבר מהמרסן והעבר אותו לכלוב שלו.
6. הערכת פוטנציאל השתלה לטווח קצר
- לאחר 4 שבועות של השתלת HSPC אנושית, להעריך את החריטה לטווח קצר על ידי איסוף דם דרך הסינוס הוורידי האורביטלי בצינור הפריני באמצעות פיפטה פסטר.
- הרדימו את בעל החיים באמצעות קטמין (90-120 מ"ג/ק"ג) וקסילזין (8-12 מ"ג/ק"ג) באמצעות הזרקה תוך-צפקית (IP) לפני איסוף הדגימה.
הערה: הפעל בעדינות לחץ על הגפיים האחוריות של העכבר המרדים כדי לאשר את אובדן התחושה. - לאחר ההרדמה, מקם את החיה בגחון ושפשף בעדינות את העכבר כדי לפתוח את העין, מה שמאפשר לכדור הארץ של העין לבלוט מעט.
- הכנס בעדינות את פיפטה פסטר לתוך הקנטוס המדיאלי של העין מתחת לקרום הניקטינג בזווית של 30°-45°. לאחר הצבת פיפטה פסטר במיקום הנכון, הפעל לחץ קל על הצינור והתחל לסובב את הצינור בעדינות.
הערה: הדם ייכנס לצינור בפעולה נימית ברגע שמנוקב מקלעת הרטרו-מסלולית.
- הרדימו את בעל החיים באמצעות קטמין (90-120 מ"ג/ק"ג) וקסילזין (8-12 מ"ג/ק"ג) באמצעות הזרקה תוך-צפקית (IP) לפני איסוף הדגימה.
- לאחר איסוף 50-80 μL של דם היקפי, בעדינות למשוך את פיפטה מן canthus המדיאלי של העין.
- כדי להפסיק את הדימום סביב מסלול העין, לסגור את העפעפיים ולהפעיל לחץ עדין באמצעות חתיכת גזה.
- הכתימו את התאים בנוגדנים המתאימים (טבלה 8) ודגרו על התאים בחושך למשך 25-30 דקות ב-RT.
- עבור תזה RBC, לתרחיף התא, הוסף 3 מ"ל של חיץ ליזה RBC 1x (טבלה 7) ודגרה במשך 10 דקות בקרח.
- צנטריפוגה ב 200 x גרם במשך 5 דקות ב RT ולהשליך את supernatant באמצעות פיפטה. חזור על שלב 6.4. עד שהאדמומיות של הכדור נעלמת.
- הוסף 2 מ"ל של PBS 1x וצנטריפוגה ב 200 x g במשך 5 דקות ב- RT כדי להסיר את פסולת התא הקשורה לתזה של RBC.
- הוסף 150 μL של 1x PBS לכדור ולאחר מכן המשך עם אימונופנוטיפ עבור ציטומטריה זרימה כדי להעריך את אחוז התאים האנושיים המושתלים7.
7. הערכת פוטנציאל השתלה לטווח ארוך
- להרדים את העכברים.
- הקריבו את העכברים המושתלים בשבוע 16 לניתוח חריטה על ידי החדרת 100% CO 2 חנק20 בתוך כלוב העכברים למשך 1-2 דקות.
- אשר המתת חסד על ידי בירור דום לב ונשימה והעדר תנועות שרירים עם צביטה עדינה של הגפיים האחוריות. אם שני התנאים מתקיימים, הסר את העכברים מהכלוב.
- כדי להעריך כימריזם של תאים אנושיים, אסוף את התאים ממח העצם.
- לבודד תאים ממח העצם בעקבות השלבים הבאים.
- לאחר המתת חסד, לבצע חתך אנכי 1 ס"מ מעל השופכה ולהאריך עד 1 ס"מ מתחת לסרעפת. חותכים אופקית בפינות האזור המשופע כדי לפתוח לרווחה את אזור הבטן.
- נתחו את עצם הירך ואת השוקה והסירו את הרקמות הרכות המחוברות לעצם הירך והשוקה באמצעות מספריים. לשפשף בעדינות עם נייר טישו ולעשות חור קטן עם קוטר לא גבוה מ 0.2 ס"מ בתחתית צינור microcentrifuge 0.5 מ"ל באמצעות אזמל.
- הסר את הקצוות הפרוקסימליים של העצמות באמצעות אזמל והנח את העצמות כאשר הצד החתך פונה לכיוון החור של צינור microcentrifugation 0.5 מ"ל. מניחים את הצינור של 0.5 מ"ל עם העצמות בצינור 1.5 מ"ל המכיל 100 מיקרוL של PBS סטרילי 1x.
- סוגרים את המכסה, מסובבים את הצינורות במשך 3 דקות ב-1000 x גרם בתנאים סטריליים ב-RT, ומשליכים את הצינורות של 0.5 מ"ל המכילים עצמות עם חלל מח ריק. הוסף 1 מ"ל של 1x PBS לצינור התגובה של 1.5 מ"ל המכיל מח עצם ושלח בעדינות את התאים בערך לא פחות מפי 10 באמצעות פיפטה של 1 מ"ל.
- העבר 1 מ"ל של מתלה התא לצינור 15 מ"ל המכיל 9 מ"ל של חיץ ליזה RBC. לדגור את התאים בקרח במשך 7 דקות עם היפוך עדין של הצינורות כל 2 דקות.
- לאחר 7 דקות, צנטריפוגה ב-200 x g למשך 5 דקות ב-RT עם תאוצה של 9 m/s² ותאוצה של 7 m/s². חזור על שלב 7.2.5. עד שנצפה כדור לבן בהיר וברור.
- השהה את התאים עם 10 מ"ל של DPBS סטרילי 1x וסננו את תרחיף מח העצם באמצעות מסננת תאים של 40 מיקרומטר על צינור 15 מ"ל. שטפו את מסננת התאים עם 2 מ"ל של 1x PBS 2x כדי למנוע אובדן של תאים.
- צנטריפוגה במשך 5 דקות ב 200 x גרם, RT, ולהשליך את supernatant באמצעות פיפטה. החזירו את התאים עם 10 מ"ל של IMDM עם DNase-I בריכוז תקין של 100 מיקרוגרם/מ"ל.
- קח 1 x 106 תאים חד-גרעיניים בצינור FACS לניתוח חריטה על ידי ציטומטריה של זרימה. כדי להעריך את תדירות עריכת הגנים בתאים חד-גרעיניים של מח עצם מושתלים, גלולה 1 x 106 תאים חד-גרעיניים ב-11,000 x g למשך 5 דקות ב-RT והשליכו את הסופר-נאטנט באמצעות פיפטה.
8. אימונופנוטיפינג
- דגירה של תאי מח העצם עם 1.5 μL של חלבון Fc אנושי רקומביננטי מטוהר (ראו טבלת חומרים) למשך 15 דקות ב-4 מעלות צלזיוס לפני הכתמת נוגדנים.
הערה: חלבון ה-Fc האנושי המשמש כאן פותח כדי לחסום כתמים של נוגדנים לא ספציפיים הנגרמים על-ידי קולטנים ל-IgG; ובכך, הוא מגדיל את הספציפיות של תיוג נוגדנים 7,21,22. לפני צביעת נוגדנים של תאי המטרה, בצע טיטרציה של נוגדנים. מומלץ מאוד לכלול בקרות FMO ובקרות איזוטיפ תוך כדי עבודה על ניתוח זרימות מרובה-צבעים. - כדי לקבוע את אחוז השתלת התאים האנושיים על ידי ציטומטר זרימה, קח 1 x 106 תאים חד-גרעיניים בצינור FACS והכתים את התאים כפי שצוין בטבלה 8.
- דגירה של התאים בחושך למשך 25-30 דקות ב-RT. צנטריפוגה ב-200 x g למשך 5 דקות ב-RT והשליכו את הסופר-נאטנט באמצעות פיפטה.
- רכשו את התאים על ידי ציטומטר זרימה, שער את אוכלוסיית התאים (P1) באמצעות פיזור קדימה (FSC) ופיזור צדדי (SSC) של תאים חד-גרעיניים, והתאימו את המתח בהתאם לאוכלוסיית התא. לרכוש 50,000 אירועים סלולריים באוכלוסיית P1.
- כדי לנתח אוכלוסיות לויקוציטים אנושיים במח עצם של עכבר, שער את תאי CD45+ האנושיים ואת CD45.1 של העכבר מאוכלוסיית תאי P1 באמצעות תוכנה לניתוח נתוני ציטומטריה של זרימה (ראו טבלת חומרים).
- חשב את החריטה של תאים אנושיים באמצעות הנוסחה8 הבאה:
% של חריטה = (% hCD45) / (% hCD45 + % mCD45) × 100.
הערה: הסף להשתלה אנושית נחשב לחיובי של 0.1% עבור CD45. - יתר על כן, נתח את אחוז תאי hCD34+ מתאי CD45+ אנושיים כדי להעריך את תאי ההתרבות מחדש לטווח הארוך. כדי להעריך את השחזור הרב-שכבתי של התאים האנושיים המושתלים, יש להכתים 100 μL של תרחיף התאים בעקבות טבלה 9.
הערה: יש לבדוק את הנוגדנים לפני הניסויים. - באמצעות תוכנת ציטומטריה של זרימה, שער את hCD45 מאוכלוסיית תאי P1, ומ- hCD45, כמת את אחוז hCD19, hCD3 ו- hCD13 (תת-קבוצות לימפואידיות ומיאלואידים).
9. הערכת תדירות עריכת גנים בתאים חד-גרעיניים של מח עצם מושתלים
- לכדור התא החד-גרעיני של מח העצם, יש להוסיף 50 μL של תמיסת מיצוי מהירה (ראו טבלת חומרים) עבור 5 x 105 תאים ולהשהות את הכדור.
- דגרו את התערובת בתרמוציקלר בטמפרטורה של 68 מעלות צלזיוס למשך 30 דקות. לאחר סיבוב קצר, דגרו את התערובת בתרמוציקלר בטמפרטורה של 98 מעלות צלזיוס למשך 10 דקות.
- מדוד את ריכוז הדנ"א בליזאט הגולמי באמצעות ספקטרופוטומטר. בצע את שלבים 4.2.-4.4. כדי לאמת את תדירות עריכת הגנים באמצעות ניתוח ICE 8,15.
תוצאות
המחקר הנוכחי מזהה תנאי תרבית HSPC אידיאליים המאפשרים שמירה של CD34+CD133+CD90+ HSCs בתרבית ex vivo. כדי להדגים את העשרת התרבית של HSCs יחד עם הדור המשופר של תאי HSCs מהונדסים גנטית, מסופקים ההליכים הממוטבים לבידוד PBMNC, טיהור תאי CD34+, תרבית, עריכת גנים, השתלה, אפיון השתלה ותאים מהונדסים גנטית in vivo (איור 1). לאחר הטיהור, בוצעה הערכת ציטומטריה של זרימה כדי לבדוק את סמני HSPC, ו- HSPCs תורבתו במשך 72 שעות. לאחר 72 שעות של תרבית, ה-HSPCs הודבקו ב-Cas9 RNP וגודלו בתרבית במשך יומיים נוספים. תנאי התרבית הממוטבים שהכילו את קוקטייל ה-RUS הראו כדאיות מוגברת ותדירות גבוהה יותר של CD34+CD133+CD90+ HSCs ותדירות מוגברת של עריכת גנים (איור 2). כדי להדגים עוד יותר שתנאי התרבית הממוטבים מגבירים את התדירות של תאים מהונדסים גנטית in vivo, ה-HSPCs של היום השלישי המכוונים למוקד CCR5 נערכו גנטית והוכנסו לעכברי NSG מוקרנים תת-קטלניים. השתלת תאים אנושיים במח עצם של עכבר (BM) נותחה 16 שבועות לאחר העירוי (איור 3A). ניתוח ציטומטריה של זרימה של תאי CD45+ אנושיים (hCD45) בעכברי NSG הראה חריטה מוגברת בתנאי התרבית (איור 3B,C). ניתוח של תדירות עריכת הגנים בתאי ה-BM של העכבר הראה חריטה מוגברת של HSPCs שעברו עריכה גנטית בתנאי תרבית של תוספי RUS (איור 3D).
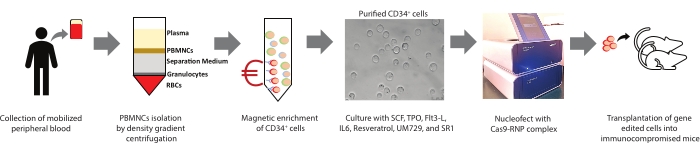
איור 1: סיכום המחקר הנוכחי. סיכום גרפי של ההליך הכרוך בבידוד PBMNCs, העשרה מגנטית של תאי CD34+ מ- PBMNCs, תרבות, אפיון של גזע המטופויאטי אנושי ותאי אב (HSPCs), עריכת גנים והשתלה מיוצגת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: קוקטייל RUS מעשיר את התדירות של HSCs. ה-mPB-HSPCs גודלו בתרבית בתרבית תאי גזע המכילה ציטוקינים עם קוקטייל רכב (DMSO) ו-RUS במשך 3 ימים ונערכו גנטית עם 25 pM של Cas9-RNP. התאים שעברו עריכה גנטית נותחו על ידי FACS עבור הסמנים עבור HSPCs 48 שעות לאחר הנוקלאופקציה. (A) חלקות זרימה מייצגות את אוכלוסיית התאים החיים (7AAD-) ו-CD34+ CD90+. (B) האחוז והתדירות של תבניות indel נותחו 72 שעות לאחר עריכה בקבוצה שטופלה ב- DMSO ו- RUS. (C) המספר המוחלט של תאי CD34+ CD90+ שנותחו 48 שעות לאחר העריכה (n = 2) (תורם = 1). (D) המספר המוחלט של סך כל התאים בעלי הגרעין (TNC) שנותחו 48 שעות לאחר העריכה (n = 2) (תורם = 1). קווי שגיאה מייצגים ממוצע ± SEM, *p ≤ 0.05 (t-test לא מזווג). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
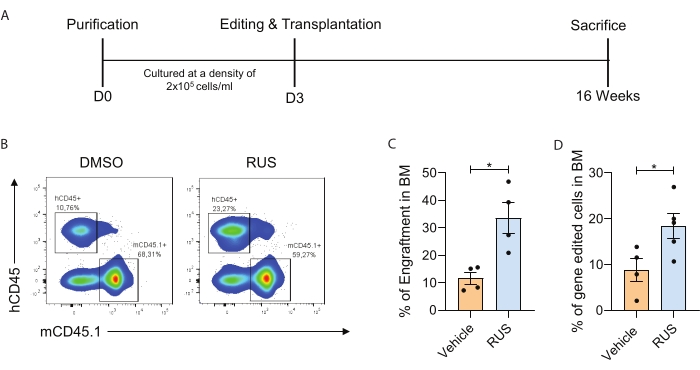
איור 3: תנאי תרבית אופטימליים מגבירים את התדירות של תאים מהונדסים גנטית in vivo. (A) ייצוג סכמטי של הניסוי. (B) תרשים FACS מייצג המציג את תאי hCD45+ בעכבר BM. הכניסה מתייחסת לתאים אנושיים (משמאל) ולתאי עכבר (מימין). HSPCs עברו תרבית במשך 3 ימים, נערכו גנטית עם sgRNA ביום 3, והושתלו מיד לאחר האלקטרופורציה. (C) השתלת תאים אנושיים ב-BM של עכבר ב-16 שבועות לאחר העירוי (n = 4). (D) הכימריזם של התא האנושי שעבר שינוי גנטי (hCD45+ תאים שעברו עריכה גנטית) ב-BM של עכבר ב-16 שבועות לאחר העירוי (n = 4) (תורם = 1). כל נקודה מייצגת עכבר בודד, ונקודות הנתונים הן מניסוי בודד. קווי שגיאה מייצגים ממוצע ± SEM, *p≤ 0.05 (t-test לא משויך). הדמות מותאמת באישורם של כריסטופר ואחרים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| ספירת תאים | חיץ טיהור (מ"ל) |
| < 1 x 107 תאים | 0.1 |
| 1 x 107 - 1 x 108 תאים | 0.5 |
| 1 - 5 x 108 תאים | 1 |
טבלה 1: נפח מאגר הטיהור להכנת התרחיף הסלולרי לטיהור תאי CD34+ .
| שם פריימר | רצף |
| CCR5 קדימה | CAGAGCCAAGCTCTCCATC |
| CCR5 הפוך | AGAGACGCAAACACAGCCA |
| פריימר רצף CCR5 קדימה | AATGTAGACATCTATGTAGG |
טבלה 2: רצף פריימרים להגברת לוקוס CCR5.
| רכיבים | תגובת 50 μL |
| חיץ (5x) | 10 מיקרוגרם |
| פריימר קדמי (10 μM) | 1 מיקרון |
| פריימר הפוך (10 μM) | 1 מיקרון |
| dNTP | 4 מיקרון |
| פולימראז | 1 מיקרון |
| דנ"א גנומי | 200 ננוגרם |
| מים נטולי נוקליז | עד 50 μL |
טבלה 3: תערובת התגובה להגברת לוקוס CCR5 באמצעות PCR.
| שלבים | משך | טמפרטורה | לא של מחזורים |
| דנטורציה ראשונית | 1 דקות | 95 °C | 1 |
| דנטורציה | 10 שניות | 98 °C | 35 |
| חישול | 15 שניות | 56 °C | |
| סיומת | 30 שניות | 68 °C | |
| הארכה סופית | 1 דקות | 72 °C | 1 |
| אחז | ∞ | 15 מעלות צלזיוס |
טבלה 4: תנאי תרמוציקלר להגברת לוקוס CCR5.
| רכיבים | תגובת 10 μL |
| חיץ (5x) | 2 מיקרון |
| פריימר (2 מיקרומטר) | 1.6 מיקרון |
| תערובת RR | 0.75 מיקרון |
| מוצר ניקוי PCR | 80 ננוגרם |
| מים נטולי נוקליז | עד 10 μL |
טבלה 5: תערובת התגובה לריצוף PCR של סנגר.
| שלבים | משך | טמפרטורה | לא של מחזורים |
| דנטורציה | 15 שניות | 96 °C | 27 |
| חישול | 20 שניות | 55 °C | |
| סיומת | 4 דק' | 60 מעלות צלזיוס | |
| אחז | ∞ | 15 מעלות צלזיוס |
טבלה 6: תנאי תרמו-ציקלר לריצוף PCR של סנגר.
| מאגר | הרכב |
| 10x מאגר תזה RBC – 100 מ"ל (pH – 7.3) | 8.26 גרם של NH4Cl, 1.19 גרם של NaHCO3, 200 μL של EDTA (0.5 M, pH8) |
| 50x חיץ TAE (pH – 8.3) | להמיס 50 mM מלח נתרן EDTA, 2 M טריס, 1 M חומצה אצטית קרחונית ב 1 ליטר מים |
טבלה 7: קומפוזיציות חיץ
| נוגדנים | נפח |
| נגמ"ש CD45 אנטי-אנושי | 3 מיקרון |
| CD45.1 נגד העכבר PerCP-Cy5 | 4.5 מיקרון |
| CD34 PE נגד עכבר | 3 מיקרון |
טבלה 8: נוגדנים המשמשים להערכת השתלת תאים אנושיים.
| נוגדנים | נפח |
| נגמ"ש CD45 אנטי-אנושי | 3 מיקרון |
| נגד העכבר CD19 PerCP | 15 מיקרוגרם |
| CD13 PE נגד עכבר | 15 מיקרוגרם |
| CD3 נגד עכבר PE-Cy7 | 2 מיקרון |
טבלה 9: נוגדנים המשמשים להערכת חלקם של תאים רב-שכבתיים שמקורם ב-HSPCs מושתלים.
Discussion
התוצאה המוצלחת של טיפול גנטי HSPC מסתמכת בעיקר על האיכות והכמות של HSCs הניתנים להשתלה בשתל. עם זאת, התכונות התפקודיות של HSCs מושפעות מאוד במהלך שלב ההכנה של מוצרי ריפוי גנטי, כולל על ידי תרבית חוץ גופית ורעילות הקשורה להליך מניפולציה גנטית. כדי להתגבר על מגבלות אלה, זיהינו תנאי תרבות HSPCs אידיאליים השומרים על הגבעול של CD34+CD133+CD90+ HSCs בתרבות ex vivo. קבוצות מחקר רבות השתמשו ב-SR1 או ב-UM171 או במולקולות אחרות כמולקולות עצמאיות להרחבת דם טבורי (UCB) HSPCs במבחנה23,24. מחקר קודם השתמש בשילוב של SR1 ו- UM17125. המולקולות הקטנות והציטוקינים של מדיום התרבית הותאמו במיוחד עבור HSPCs בוגרים מגויסים ויישומן בטיפול גנטי אוטולוגי. ניסוי הסינון הראה כי שילוב של שלוש מולקולות קטנות רזברטרול, UM729 ו-SR1, חשוב ליצירת מספר גבוה של תאי CD34+CD90+ ולעיכוב התפשטותם של תאי אב ממוינים ומחויבים. ניתן להחליף את ה-UM729 בקוקטייל RUS ב-UM171. עם זאת, הרכש המסחרי של UM171 הוא פחות ריאלי. ריכוזי הציטוקינים מאומצים מהפרוטוקול שנעשה בו שימוש במחקרים קליניים26 כדי להפחית את השונות בתהליך ההרחבה. קוקטייל הציטוקינים מכיל IL6 במקום IL3 כדי למזער את תפוצת האבות ואת תשישות HSC במבחנה27. מומלץ להכין אליקוטים טריים של מדיה תרבותית (מדיה בסיסית + RUS + קוקטיילים ציטוקינים) כדי להפחית את השונות הניסויית ולקבל שכפול גבוה. הפרוטוקול ישים הן לעריכת גנים בתיווך NHEJ והן לעריכת גנים בתיווך HDR. בפרט, תרבית HSPC של 48-72 שעות לפני אלקטרופורציה ו-24 שעות לאחר אלקטרופורציה היא חיונית לעריכת גנים HDR. תנאי התרבית הממוטבים אמורים להועיל לעריכת גנים HDR על ידי שימור תאי הגזע. כמו כן, נצפה כי תנאי התרבית מסייעים להתמרה לנטי-ויראלית ב-HSCs ארוכי טווח. זה מצביע על כך שאם חלקיקים נגיפיים כמו AAV6 או IDLV משמשים כתורם HDR, יעילות עריכת ה- HDR צפויה להשתפר, מכיוון שתנאי התרבית הממוטבים מקדמים את העברת התורם ל- HSCs.
כדי להעריך את תוצאות עריכת הגנים, כולל NHEJ ו- HDR, מוצע ניתוח NGS, ניתוח בדיקה או ddPCR, או ריצוף סנגר 7,8,28, ולאחר מכן פירוק באמצעות כלים מקוונים (ICE/ICE Knock-In)16, בשל אופיו הכמותי החזק. לחלופין, ניתן לבצע בדיקת אנדונוקלאז T7 על דגימות דנ"א ערוכות, וניתן לכמת את רצועות הדנ"א המקוטעות באמצעות ImageJ. עם זאת, גישת הבדיקה של אנדונוקלאז T7 היא פחות מדויקת מניתוח פירוק ומכוונת לריצוף מהדור הבא.
פרוטוקול ההשתלה מותאם גם על ידי התאמת עכברי NBSGW עם busulfan, המאפשר מינונים נמוכים של תאים כדי להעריך את השתלת HSPC ואת אכלוס מחדש. באופן כללי, הליך זה חייב להפחית את המינונים של HSPCs הדרושים למניפולציה גנטית ולהגדיל את הנגישות של טיפול גנטי HSPC במדינות מתפתחות.
במחקר הנוכחי הודגמו הפרוטוקולים לבידוד PBMNC, טיהור CD34+ HSPC, עריכה ואימות של גנים והערכה של HSPCs המושתלים בעריכת גנים במח עצם של עכבר. כמו כן, הוכח כי תרבית HSPC הממוטבת מעשירה את CD34+CD133+CD90+ HSPCs ומגבירה את הכימריזם של תאים שעברו עריכה גנטית in vivo.
Disclosures
המחברים מצהירים כי לא קיימים אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים רוצים להודות לצוות של מתקן ציטומטריה זרימה ומתקן בעלי חיים של CSCR. A. C. ממומן על ידי מלגת ICMR-SRF, K. V. K. ממומן על ידי מלגת DST-INSPIRE, ו- P. B. ממומן על ידי מלגת CSIR-JRF. עבודה זו מומנה על ידי המחלקה לביוטכנולוגיה, ממשלת הודו (מענק מס' BT/PR26901/MED/31/377/2017 ו-BT/PR31616/MED/31/408/2019)
Materials
| Name | Company | Catalog Number | Comments |
| 4D-Nucleofector® X Unit | LONZA BIOSCIENCE | AAF-1003X | |
| 4D-Nucleofector™ X Kit ( 16-well Nucleocuvette™ Strips) | LONZA BIOSCIENCE | V4XP-3032 | |
| Antibiotic-Antimycotic (100X) | THERMO SCIENTIFIC | 15240096 | |
| Anti-human CD45 APC | BD BIOSCIENCE | 555485 | |
| Anti-human CD13 PE | BD BIOSCIENCE | 555394 | |
| Anti-human CD19 PerCP | BD BIOSCIENCE | 340421 | |
| Anti-human CD3 PE-Cy7 | BD BIOSCIENCE | 557749 | |
| Anti-human CD90 APC | BD BIOSCIENCE | 561971 | |
| Anti-human CD133/1 | Miltenyibiotec | 130-113-673 | |
| Anti-human CD34 PE | BD BIOSCIENCE | 348057 | |
| Anti-mouse CD45.1 PerCP-Cy5 | BD BIOSCIENCE | 560580 | |
| Blood Irradator-2000 | BRIT (Department of Biotechnology, India) | BI 2000 | |
| Cell culture dish (delta surface-treated 6-well plates) | NUNC (THERMO SCIENTIFIC) | 140675 | |
| CrysoStor CS10 | BioLife solutions | #07952 | |
| Busulfan | CELON LABS (60mg/10mL) | - | |
| Guide-it Recombinant Cas9 | TAKARA BIO | 632640 | |
| Cas9-eGFP | SIGMA | C120040 | |
| Centrifuge tube-15ml | CORNING | 430790 | |
| Centrifuge tube-50ml | NUNC (THERMO SCIENTIFIC) | 339652 | |
| DMSO | MPBIO | 219605590 | |
| DNAase | STEMCELL TECHNOLOGIES | 6469 | |
| Dulbecco′s Phosphate Buffered Saline- 1X | HYCLONE | SH30028.02 | |
| EasySep™ Human CD34 Positive Selection Kit II | STEMCELL TECHNOLOGIES | 17856 | |
| EasySep magnet | STEMCELL TECHNOLOGIES | 18000 | |
| Electrophoresis unit | ORANGE INDIA | HDS0036 | |
| FBS | THERMO SCIENTIFIC | 10270106 | |
| Flow cytometer – ARIA III | BD BIOSCIENCE | - | |
| FlowJo | BD BIOSCIENCE | - | |
| Flt3-L | PEPROTECH | 300-19-1000 | |
| Gel imaging system | CELL BIOSCIENCES | 11630453 | |
| HighPrep DTR reagent | MAGBIOGENOMICS | DT-70005 | |
| Human BD Fc Block | BD BIOSCIENCE | 553141 | |
| IL6 | PEPROTECH | 200-06-50 | |
| IMDM media | THERMO SCIENTIFIC | 12440053 | |
| Infrared lamp | MURPHY | - | |
| Insulin syringe 6mm 31G | BD BIOSCIENCE | 324903 | |
| Ketamine | KETMIN 50 | - | |
| Loading dye 6X | TAKARA BIO | 9156 | |
| Lymphoprep | STEMCELL TECHNOLOGIES | 7851 | |
| Mice Restrainer | AVANTOR | TV-150 | |
| Nano drop spectrophotometer | THERMO SCIENTIFIC | ND-2000C | |
| Neubauer cell counting chamber | ROHEM INSTRUMENTS | CC-3073 | |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) | The Jackson Laboratory | RRID:IMSR_JAX:005557 | |
| NOD,B6.SCID Il2rγ−/−KitW41/W41 (NBSGW) | The Jackson Laboratory | RRID:IMSR_JAX:026622 | |
| Nunc delta 6-well plate | THERMO SCIENTIFIC | 140675 | |
| Polystyrene round-bottom tube | BD | 352008 | |
| P3 primary cell Nucleofection solution | LONZA BIOSCIENCE | PBP3-02250 | |
| Pasteur pipette | FISHER SCIENTIFIC | 13-678-20A | |
| PCR clean-up kit | TAKARA BIO | 740609.25 | |
| Mouse Pie Cage | FISCHER SCIENTIFIC | 50-195-5140 | |
| polystyrene round-bottom tube (12 x 75 mm) | STEMCELL TECHNOLOGIES | 38007 | |
| Primer3 | Whitehead Institute for Biomedical Research | https://primer3.ut.ee/ | |
| QuickExtract™ DNA Extraction Solution | Lucigen | QE09050 | |
| Reserveratrol | STEMCELL TECHNOLOGIES | 72862 | |
| SCF | PEPROTECH | 300-07-1000 | |
| SFEM-II | STEMCELL TECHNOLOGIES | 9655 | |
| sgRNA | SYNTHEGO | - | |
| SPINWIN | TARSON | 1020 | |
| StemReginin 1 | STEMCELL TECHNOLOGIES | 72342 | |
| ICE analysis tool | SYNTHEGO | https://ice.synthego.com/ | |
| Tris-EDTA buffer solution (TE) 1X | SYNTHEGO | Supplied with gRNA | |
| Thermocycler | APPLIED BIOSYSTEMS | 4375305 | |
| TPO | PEPROTECH | 300-18-1000 | |
| Trypan blue | HIMEDIA LABS | TCL046 | |
| UM171 | STEMCELL TECHNOLOGIES | 72914 | |
| UM729 | STEMCELL TECHNOLOGIES | 72332 | |
| Xylazine | XYLAXIN - INDIAN IMMUNOLOGICALS LIMITED | - |
References
- Staal, F. J. T., Aiuti, A., Cavazzana, M. Autologous stem-cell-based gene therapy for inherited disorders: State of the art and perspectives. Frontiers in Pediatrics. 7, 443 (2019).
- Naldini, L. Genetic engineering of hematopoiesis: Current stage of clinical translation and future perspectives. EMBO Molecular Medicine. 11 (3), 9958 (2019).
- Srivastava, A., Shaji, R. V. Cure for thalassemia major - From allogeneic hematopoietic stem cell transplantation to gene therapy. Haematologica. 102 (2), 214-223 (2017).
- Venkatesan, V., Srinivasan, S., Babu, P., Thangavel, S. Manipulation of developmental gamma-globin gene expression: An approach for healing hemoglobinopathies. Molecular and Cellular Biology. 41 (1), 00253 (2020).
- Mazurier, F., Gan, O. I., McKenzie, J. L., Doedens, M., Dick, J. E. Lentivector-mediated clonal tracking reveals intrinsic heterogeneity in the human hematopoietic stem cell compartment and culture-induced stem cell impairment. Blood. 103 (2), 545-552 (2004).
- Piras, F., et al. Lentiviral vectors escape innate sensing but trigger p53 in human hematopoietic stem and progenitor cells. EMBO Molecular Medicine. 9 (9), 1198-1211 (2017).
- Christopher, A. C., et al. Preferential expansion of human CD34+CD133+CD90+ hematopoietic stem cells enhances gene-modified cell frequency for gene therapy. Human Gene Therapy. 33 (3-4), 188-201 (2021).
- Karuppusamy, K. V., et al. The CCR5 gene edited CD34+ CD90+ hematopoietic stem cell population serves as an optimal graft source for HIV gene therapy. Frontiers in Immunology. 13, 792684 (2022).
- Hopman, R. K., DiPersio, J. F. Advances in stem cell mobilization. Blood reviews. 28 (1), 31-40 (2014).
- Hoffman, T. L. Counting Cells. Cell Biology: A laboratory handbook. 1, 21-24 (2006).
- Antoniani, C., et al. Induction of fetal hemoglobin synthesis by CRISPR/Cas9-mediated editing of the human b-globin locus. Blood. 131 (17), 1960-1973 (2018).
- Azhagiri, M. K. K., Babu, P., Venkatesan, V., Thangavel, S. Homology-directed gene-editing approaches for hematopoietic stem and progenitor cell gene therapy. Stem Cell Research & Therapy. 12, 500 (2021).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565 (2010).
- Bagchi, A., et al. Direct generation of immortalized erythroid progenitor cell lines from peripheral blood mononuclear cells. Cells. 10 (3), 1-18 (2021).
- Ravi, R., et al. Identification of novel HPFH-like mutations by CRISPR base editing that elevates the expression of fetal hemoglobin. eLife. 11, 65421 (2020).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. CRISPR Journal. 5 (1), 123-130 (2022).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2Rγnull mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- McIntosh, B. E., et al. Nonirradiated NOD,B6.SCID Il2rγ-/- Kit(W41/W41) (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 4 (2), 171-180 (2015).
- Leonard, A., et al. Low-dose busulfan reduces human CD34+ cell doses required for engraftment in c-kit mutant immunodeficient mice. Molecular Therapy - Methods & Clinical Development. 15, 430-437 (2019).
- Tateno, A., Sakai, K., Koya, N., Aoki, T. Effects of total asphyxia on the development of synaptic junctions in the brains of mice. Acta Paediatrica Japonica; Overseas Edition. 34 (1), 1-5 (1992).
- Audigé, A., et al. Long-term leukocyte reconstitution in NSG mice transplanted with human cord blood hematopoietic stem and progenitor cells. BMC Immunology. 18 (1), 1-15 (2017).
- Nimmerjahn, F., Ravetch, J. V. Fc-receptors as regulators of immunity. Advances in immunology. 96, 179-204 (2007).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Ngom, M., et al. UM171 enhances lentiviral gene transfer and recovery of primitive human hematopoietic cells. Molecular Therapy - Methods & Clinical Development. 10, 156-164 (2018).
- Park, Y. S., et al. Enhancement of proliferation of human umbilical cord blood-derived CD34+ hematopoietic stem cells by a combination of hyper-interleukin-6 and small molecules. Biochemistry and Biophysics Reports. 29, 101214 (2022).
- Aiuti, A., et al. Lentivirus-based gene therapy of hematopoietic stem cells in Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151 (2013).
- Rai, R., et al. Optimized cell culture conditions promote ex-vivo manipulation and expansion of primitive hematopoietic stem cells for therapeutic gene editing. bioRxiv. , (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12 (1), 1-9 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved