Method Article
Миллисекундная водородно-дейтериевая масс-спектрометрия для изучения структурной динамики альфа-синуклеина в физиологических условиях
В этой статье
Резюме
Структурный ансамбль мономерного альфа-синуклеина влияет на его физиологическую функцию и физико-химические свойства. Настоящий протокол описывает, как выполнить миллисекундную масс-спектрометрию водорода/дейтерия-обмена и последующий анализ данных для определения конформационной информации о мономере этого внутренне неупорядоченного белка в физиологических условиях.
Аннотация
Альфа-синуклеин (aSyn) является внутренне неупорядоченным белком, фибриллярные агрегаты которого в изобилии присутствуют в тельцах Леви и нейритах, которые являются отличительными признаками болезни Паркинсона. Тем не менее, большая часть его биологической активности, а также его агрегация, централизованно включает растворимую мономерную форму белка. Выяснение молекулярных механизмов биологии и патофизиологии aSyn требует структурно высокоразрешенных методов и чувствительно к биологическим условиям. Его изначально развернутые, метастабильные структуры делают мономерный aSyn трудноразрешимым для многих методов структурной биологии. Здесь описано применение одного из таких подходов: водородно-дейтерий-обменной масс-спектрометрии (HDX-MS) на миллисекундной шкале времени для изучения белков с низкой термодинамической стабильностью и слабыми факторами защиты, такими как aSyn. В миллисекундной шкале времени данные HDX-MS содержат информацию о доступности растворителя и водородно-связанной структуре aSyn, которые теряются при более длительном времени маркировки, в конечном итоге давая структурное разрешение до уровня аминокислот. Таким образом, HDX-MS может предоставлять информацию с высоким структурным и временным разрешением о конформационной динамике и термодинамике, внутри- и межмолекулярных взаимодействиях, а также структурном влиянии мутаций или изменений на условия окружающей среды. Несмотря на широкое применение, показано, как получать, анализировать и интерпретировать миллисекундные измерения HDX-MS в мономерном aSyn.
Введение
Болезнь Паркинсона (БП) является нейродегенеративным заболеванием, поражающим миллионы людей во всем мире1. Он характеризуется образованием цитоплазматических включений, известных как тельца Леви и нейриты Леви в области черной субстанции мозга. Было обнаружено, что эти цитоплазматические включения содержат агрегаты внутренне неупорядоченного белка aSyn2. При БП и других синуклеинопатиях aSyn превращается из растворимого неупорядоченного состояния в нерастворимое, высокоструктурированное болезненное состояние. В своей родной форме мономерный aSyn принимает широкий спектр конформаций, стабилизированных дальнодействующими электростатическими взаимодействиями между его N- и C-концами и гидрофобными взаимодействиями между его C-концом и областью неамилоидного бета-компонента (NAC) 3,4,5,6. Любые нарушения в этих стабилизирующих взаимодействиях, такие как мутации, посттрансляционные модификации и изменения в локальной среде, могут привести к неправильному сворачиванию мономера, тем самым запуская процесс агрегации7.
В то время как существует огромное количество исследований олигомерной и фибриллярной форм aSyn 8,9,10,11, существует острая необходимость изучить мономерную форму белка и лучше понять, какие конформеры функциональны (и как), а какие склонны к агрегированию 8,9,10,11 . Будучи внутренне неупорядоченным, всего 14 кДа в размере и трудно кристаллизующимся, мономер aSyn не поддается большинству структурных биологических методов. Однако одним из методов, способных измерить конформационную динамику мономерного aSyn, является миллисекундный HDX-MS, который недавно породил важные структурные наблюдения, которые было бы сложно или невозможно получить в противном случае 12,13,14. Миллисекундный HDX-MS чувствительно измеряет среднее значение конформационного ансамбля белка путем мониторинга изотопного обмена на амидных водородах, что указывает на доступность растворителей и участие в сети водородных связей определенной области белка на миллисекундной шкале времени. Необходимо подчеркнуть миллисекундный аспект HDX-MS, поскольку из-за его изначально развернутой, метастабильной природы aSyn демонстрирует очень быструю кинетику водородообмена, которая проявляется значительно ниже нижнего предела обычных систем HDX-MS. Например, большая часть молекулы aSyn полностью обменяла водород на дейтерий во внутриклеточных условиях менее чем за 1 с. В настоящее время несколько лабораторий создали приборы для быстрого смешивания; В этом случае используется прототип быстромиссирующего гасящего прибора, способного выполнять HDX-MS с мертвым временем 50 мс и временным разрешением 1 мс15. В то время как миллисекундный HDX-MS в последнее время имеет острое значение в изучении aSyn, он представляет собой ценность для изучения внутренне неупорядоченных белков / областей более широко и большого количества белков с петлями / областями, которые только слабо стабильны. Например, пептидные препараты (например, инсулин; GLP-1/глюкагон; tirzepatide) и белки пептидного слияния (например, ингибитор ВИЧ FN3-L35-T1144) являются основными форматами лекарств, где информация о структуре и стабильности фазы раствора может быть критическим фактором для принятия решений о разработке лекарств, и, тем не менее, пептидный фрагмент часто только слабо стабилен и трудноизлечим HDX-MS в секундной шкалевремени 16,17,18,19,20 . Было показано, что эмерджентные методы HDX-MS с маркировкой в секундах/минутах доменов получают структурную информацию для G-квадруплексов ДНК, но должно быть возможно распространить ее на более разнообразные олигонуклеотидные структуры путем применения миллисекунд hdX-MS21.
Эксперименты HDX-MS могут быть выполнены на трех различных уровнях: (1) снизу вверх (при этом меченый белок переваривается протеолитически), (2) средний-нижний (при этом меченый белок переваривается протеолитически, а полученные пептиды фрагментируются далее методами мягкой фрагментации) и (3) сверху вниз (при этом методы мягкой фрагментации непосредственно фрагментируют меченый белок)22 . Таким образом, субмолекулярные данные HDX-MS позволяют локализовать обменное поведение в определенных областях белка, что делает критически важным наличие адекватного охвата последовательностей для таких экспериментов. Структурное разрешение любого эксперимента HDX-MS зависит от количества протеолитических пептидов или фрагментов, полученных из белка при переваривании или мягкой фрагментации, соответственно. В каждом из трех типов экспериментов, описанных выше, изменение амидного обмена на каждом пептиде / фрагменте отображается обратно на первичную структуру белка, чтобы указать на поведение локализованных областей белка. В то время как самое высокое структурное разрешение достигается за счет мягкой фрагментации, описание этих экспериментов выходит за рамки текущего исследования, которое фокусируется на измерении конформаций мономеров aSyn. Отличные результаты могут быть получены с помощью широко применяемого рабочего процесса «снизу вверх», описанного здесь.
Здесь представлены процедуры по следующим вопросам: (1) как подготовить и обработать образцы aSyn и буферы HDX-MS, (2) как выполнить отображение пептидов для эксперимента HDX-MS снизу вверх, (3) как получить данные HDX-MS о мономерном aSyn в физиологических условиях, особенно в миллисекундной временной области (с использованием специально разработанного инструмента; также были описаны альтернативные инструменты для миллисекундной маркировки), и (4) как обрабатывать и анализировать данные HDX-MS. Здесь приведены примеры методов, использующих мономерный aSyn при физиологическом рН (7,40) в двух условиях раствора. Хотя эти процедуры критически полезны при изучении aSyn, они могут быть применены к любому белку и не ограничиваются внутренне неупорядоченными белками.
протокол
1. Экспрессия белка и очистка aSyn
- Подготовьте aSyn в соответствии с ранее опубликованным отчетом9.
- Диализуйте в безопасный буфер хранения (например, Tris, pH 7,2).
- При необходимости концентрируйте образец (например, микроцентрифужные трубки со спиновым фильтром с использованием MWCO 3 кДа, 14 000 х г в течение приблизительно 10-30 мин, см. Таблицу материалов).
ПРИМЕЧАНИЕ: Рекомендуется не концентрироваться чрезмерно. Целостность мономерного ансамбля не была проверена выше 25 мкМ. - Аликвота и хранение при −80 °C
ПРИМЕЧАНИЕ: Мономерный белок aSyn стабилен до 1 года в этих условиях хранения.
2. Подготовка буфера HDX
ПРИМЕЧАНИЕ: Поскольку Tris имеет высокий температурный коэффициент, измерение pH должно быть скорректировано на температуру, при которой будет проводиться реакция HDX, которая составляет 20 °C в этом протоколе.
- Подготовьте равновесный буфер для состояния А и состояния В путем взвешивания 0,002 моль Tris в 100 мл воды класса LC-MS. Для состояния B добавьте 29,8 мг KCl, 14,2 мг MgCl2, 36,8 г CaCl2 и 836 мг NaCl в буфер Tris. Отрегулируйте pH до 7,40 ± 0,05.
ПРИМЕЧАНИЕ: Равновесный буфер должен содержать условия, при которых aSyn должен быть изучен. В этом случае она составляет 20 мМ Трис при рН 7,4 +/− солей. - Подготовьте буфер маркировки для состояния А и состояния В путем взвешивания 0,002 моль Tris в 100 мл дейтерированной воды. Для состояния B добавьте 29,8 мг KCl, 14,2 мг MgCl2, 36,8 г CaCl2 и 836 мг NaCl в буфер маркировки Tris. pD буфера маркировки соответствует pH равновесного буфера. Так как pH = pD - 0,41, отрегулируйте так, чтобы рН-метр считывал 6,99 ± 0,05 23,24.
ПРИМЕЧАНИЕ: Маркировочный буфер должен иметь те же компоненты, что и равновесный буфер, за исключением того, что он подготовлен с использованием дейтерированной воды. - Подготовьте буфер закалки, взвесив 0,010 моль Tris и 0,050 моль мочевины, и сделайте до 100 мл водой класса LC-MS. Отрегулируйте pH до 2,50 ± 0,05 при 0,5 °C.
ПРИМЕЧАНИЕ: Перед экспериментами HDX необходимо выполнить буферный экран закалки, чтобы определить лучший буфер закалки для интересующего белка. Различные концентрации и комбинации денатурантов (например, мочевины и гидрохлорида гуанидиния) и восстановителей (например, трис(2-карбоксиэтил)фосфина) проверяются вместе с физическими параметрами, такими как улавливающий объем и температура, для эффективного развертывания и переваривания закаленного белка. Буфер закалки, включающий 100 мМ Tris и 0,5 М мочевины при рН 2,50, является оптимальным для настоящего исследования. - Подготовьте буфер для промывки колонки пищеварения, взвесив 0,125 моля гидрохлорида гуанидия в стеклянную бутылку Duran. Добавьте 25 мл метанола и 250 мкл муравьиной кислоты. Внесите до 250 мл с водой класса LC-MS.
ПРИМЕЧАНИЕ: Для колонки энзимата BEH pepsin (см. Таблицу материалов) используйте буфер промывки колонны из 0,5 М гидрохлорида гуанидия, 10% (v/v) метанола и 0,1% (v/v) муравьиной кислоты. - Подготовьте шприц слабой промывки путем пипетки 0,5 мкл муравьиной кислоты в 249,5 мл воды марки LC-MS.
- Приготовьте шприц сильной промывкой, смешав равные части воды класса LC-MS, метанола, ацетонитрила и изопропанола. Добавьте муравьиную кислоту до конечной концентрации 2% (v/v).
ПРИМЕЧАНИЕ: Для предотвращения перекрестного загрязнения между различными буферами и белком и для очистки отверстия для инъекции крайне важно, чтобы были приготовлены растворы для промывки шприцев и чтобы путь потока к клапану (часто называемый «промывочным вкладышем») был полностью загрунтован жидкостью. Муравьиная кислота необязательна для слабой промывки шприца.
3. Процедура пептидного картирования
- Подготовьте образец, выполнив следующие действия.
- Фильтр размороженного белка aSyn из морозильной камеры с температурой −80 °C со шприцевыми фильтрами 0,22 мкм. Измерьте поглощение фильтрованного исходного белка при 280 нм, чтобы определить концентрацию по закону Бира-Ламберта. Разбавляют белок до концентрации 5 мкМ в равновесном буфере (стадия 2.1.).
ПРИМЕЧАНИЕ: Закон Бира-Ламберта: A = εcl, где A — поглощение, ε — коэффициент вымирания белка на измеряемой длине волны (здесь 280 нм) с единицами M−1см−1, c — концентрация белка в M, а l — длина пути в см. Для дикого типа aSyn26 ε = 5960 M−1см−1.
- Фильтр размороженного белка aSyn из морозильной камеры с температурой −80 °C со шприцевыми фильтрами 0,22 мкм. Измерьте поглощение фильтрованного исходного белка при 280 нм, чтобы определить концентрацию по закону Бира-Ламберта. Разбавляют белок до концентрации 5 мкМ в равновесном буфере (стадия 2.1.).
- Настройте метод жидкостной хроматографии.
- Создайте впускной файл со временем загрузки/улавливания 3 мин при давлении 7000-9000 фунтов на кв. дюйм с последующим градиентом от 5% ацетонитрила до 40% ацетонитрила за 7 мин с последующими повторными этапами промывки 5%-95% ацетонитрила-воды в течение 10 мин.
- Убедитесь, что блокировка распыления (например, лейцина энкефалина, см. Таблица материалов) течет при 2000 фунтов на квадратный дюйм и подключается к датчику распыления источника масс-спектрометра.
- Настройка методов масс-спектрометрии MSE .
ПРИМЕЧАНИЕ: MSE представляет собой широкополосный метод сбора данных, не имеющий массовой изоляции предшественников. Таким образом, все ионы в пределах выбранного диапазона m/z фрагментируются дополнительно с использованием диссоциации, вызванной столкновением (CID)27.- В файле метода MS выберите MSE Continuum и настройте время получения от 2 до 10 минут, источник электрораспыления и режим положительного разрешения. Приобретайте MSE более 50-2000 Da, сканируя каждые 0,3 с.
- Для функции 1 (низкая энергия) установите ловушку и передайте энергии столкновения равными 4 В. Для функции 2 (высокая энергия) настройте энергию столкновения передачи рампы постоянной при 4 В, а энергию столкновения ловушки - как указано в таблице 1 для каждого уровня энергии отображения.
ПРИМЕЧАНИЕ: Также могут использоваться ионно-подвижные методы MSE . Альтернативные методы сопоставления (например, получение данных, зависящее от данных, или DDA) могут использоваться по усмотрению пользователя.
- Настройте робота-автосэмплера (см. Таблицу материалов).
- Добавьте 50 мкл белка 5 мкМ в общий флакон для восстановления. Поместите флакон в положение образца в правой камере HDX. Убедитесь, что эта камера находится при температуре 0,5 °C.
- Добавьте один флакон реагента равновесного буфера и два флакона с реагентами буфера маркировки к позициям реагента один, два и три в левой камере HDX. Убедитесь, что эта камера находится при температуре 20 °C, установив регулятор температуры Пельтье (см. Таблицу материалов). Добавьте один флакон реагента буфера закалки в положение реагента в правой камере HDX.
- Добавьте восемь флаконов с общим восстановлением в реакционных положениях левой камеры HDX и восемь флаконов с максимальным восстановлением в реакционных позициях правой камеры HDX.
ПРИМЕЧАНИЕ: Для обеспечения полной очистки и максимальной воспроизводимости дозируемых объемов рекомендуется выполнять шприцевую мойку и грунтовую мойку на шприцах автосамплера. Например, выполните последовательность (1) слабой промывки, (2) сильной стирки, (3) слабой промывки перед началом экспериментов по картированию. Эта последовательность может быть повторена широко, и рекомендуется делать это до 20x или до тех пор, пока шприц не будет полностью смачен. - Настройте примерный список с соответствующими методами LC и MS в программном обеспечении для планирования и запустите расписание.
ПРИМЕЧАНИЕ: Для настоящего исследования Chronos используется в качестве программного обеспечения для планирования (см. Таблицу материалов).
- Обработайте данные сопоставления.
- Идентификация пептидов из файлов картографического эксперимента с помощью соответствующего программного обеспечения (см. Таблицу материалов).
- Импортируйте идентификационные данные пептидов в DynamX (см. Таблицу материалов), используя следующие пороговые параметры пептида: минимальная интенсивность = 5000, минимальная длина последовательности = 0, максимальная длина последовательности = 40, минимальные продукты = 1, минимальные продукты на аминокислоту = 0,25, минимальные последовательные продукты = 2, минимальная сумма интенсивности для продуктов = 0, минимальная оценка = 0 и максимальная ошибка MH+ (ppm) = 0.
ПРИМЕЧАНИЕ: Альтернативно, получить оптимизированные настройки в соответствии с рекомендуемым рабочим процессом28. - Выберите Данные в меню и нажмите Импорт результатов PLGS. Нажмите кнопку Добавить , чтобы выбрать соответствующие файлы данных для спектрального назначения. Когда все они будут добавлены, нажмите «Далее» и введите вышеуказанные настройки фильтра. Затем нажмите кнопку Готово.
- Вручную курируйте изотопные назначения для получения окончательной карты пептидного покрытия aSyn в DynamX.
4. Миллисекундное исследование обмена водорода/дейтерия
- Очистите прототип прибора FastHDX (см. Таблицу материалов) перед началом экспериментов HDX.
- Откройте совместимый графический интерфейс программного обеспечения HDX и позвольте системе инициализироваться.
- Введите температуру камеры отбора проб как 20 °C и камеру закалки как 0,5 °C. Нажмите «Установить», чтобы применить новые температуры.
- Установите центрифужные трубки с водой класса LC-MS на всех входах.
- На вкладке Titrator Plumbing Delivery (Доставка титратора) проверьте левый и правый шприцы и нажмите Prime , чтобы удалить все скрытые пузырьки воздуха в трубках. Повторяйте до тех пор, пока все пузырьки не исчезнут.
- На вкладке Макросы установите все флажки для шприцев. Нажмите « Калибровка шприцев в домашнем положении». Нажмите на Петлю загрузки стирального шприца. Нажмите «Вымыть все объемы цикла смешивания».
- Повторите шаг 4.1.5. В 1 раза больше.
- Если в буферных шприцах появляются пузырьки, дегазируйте, отсоединив шприц и выбросив пузырь вертикально. Замените шприц и выполните повторную калибровку в нулевое положение.
- Настройте прототип прибора FastHDX для экспериментов HDX.
- Добавьте 500 мкл отфильтрованной 5 мкМ aSyn во флакон с общим восстановлением и поместите в настольный холодильник, чтобы предотвратить олигомеризацию и агрегацию, вызванную температурой.
- Добавьте 50 мл буферов равновесия, маркировки и закалки в каждый буфер (2. Этапы подготовки буфера HDX 1-3) на входе в левую и правую камеры.
- Добавить 50 мл буфера для промывки колонн (2. Этап 4 приготовления буфера HDX до входа промывки пепсина.
- Чтобы загрунтовать линии промывки белка и колонки 1x, проверьте левый и правый шприцы на вкладке Titrator Plumbing Delivery и нажмите Prime один раз.
ПРИМЕЧАНИЕ: Любое последующее нажатие на Prime вызовет дополнительные повторы основного процесса, что приведет к потреблению большого количества образца белка. Рекомендуется избегать этого, даже если есть задержка в программном обеспечении после попытки нажатия кнопки. - Повторите шаги 4.1.5. 1х.
- На вкладке Поток ручного закалки введите необходимые настройки, описанные в шагах 4.2.7.-4.2.10.
- Для эксперимента с временным курсом введите время в миллисекундах с помощью кнопки Символические точки . Если требуются реплики, добавьте одну и ту же точку времени несколько раз, например, для трехкратного значения 50 мс необходимо ввести 50 50 50. Примерный список в программном обеспечении масс-спектрометра (здесь используется MassLynx, см. Таблица материалов) должен точно соответствовать этим временным точкам.
ПРИМЕЧАНИЕ: Имена файлов и/или текст образца карт-спектрометра должны использоваться для обеспечения постоянной записи времени маркировки HDX, соответствующего тем, которые введены в графический интерфейс программного обеспечения FastHDX. Время маркировки для каждого запуска образца больше нигде не будет храниться. - Установите для параметра Время ловушки (мин) значение времени треппинга. Здесь это 3.00.
- Установите Ожидание ВЭЖХ (мин) = (время ловушки + время выполнения + 1,5 мин).
ПРИМЕЧАНИЕ: Например, для эксперимента с 3-минутным траппингом и 17-минутным градиентом это будет 21,50 мин. - Щелкните поле Выполнить пустое только в том случае, если между примерами запусков выполняются пустые эксперименты. Если да, убедитесь, что запись (т.е. допустимая строка в списке примеров) в программном обеспечении для пустого запуска после каждого запуска примера.
- Как только пример списка будет готов на программном обеспечении, выделите соответствующие записи и запустите запуск в программном обеспечении, нажав кнопку Play и FastHDX в программном обеспечении.
ПРИМЕЧАНИЕ: Из-за скремблирования водорода/дейтерия методы MS или методы мягкой фрагментации (диссоциация переноса электронов, диссоциация захвата электронов и ультрафиолетовая фотодиссоциация) могут быть использованы только29. Для aSyn при физиологическом рН 7,40 наиболее применимы временные точки в диапазоне от 50 мс до 300 с, поскольку они охватывают всю кривую поглощения дейтерия8.
5. Обработка данных
- Загрузите файл спектрально назначенных пептидов из экспериментов по картированию пептидов. Откройте меню «Файл» и нажмите « Открыть » в программном обеспечении DynamX (см. Таблицу материалов).
- Импортируйте необработанные файлы в предпочтительное программное обеспечение для измерения массы (например, DynamX, HDExaminer и т. Д.). Откройте меню «Данные» и нажмите на MS Files. Нажмите на New State , чтобы создать состояния для каждого изученного состояния белка.
- Нажмите « Новая экспозиция», чтобы добавить каждую точку времени HDX. Нажмите «Новый RAW », чтобы импортировать файлы .raw. Перетащите каждый .raw файл в нужное место. Нажмите OK , когда закончите.
- Автоматически сначала назначайте изотопы (это происходит автоматически после шага 5.2. выше), а затем вручную курируйте изотопное назначение для обеспечения высокого качества данных.
- Экспортируйте данные кластера в файл .csv со столбцами в следующем порядке: имя белка, начальный номер последовательности, порядковый конечный номер, последовательность, модификация, фрагмент, максимально возможное поглощение, масса моноизотопных видов, название состояния, время экспозиции, имя файла, заряд, время удержания, интенсивность и центроид.
- Откройте меню «Данные » в программном обеспечении для измерения массы и нажмите «Экспорт данных кластера».
6. Анализ данных
- Загрузите экспортированные данные кластера в предпочтительное программное обеспечение для анализа HDX. Здесь используется HDfleX30 (см. Таблицу материалов).
- Подгоняйте экспериментальные данные для всех пептидов и состояний, выбирая соответствующие методы коррекции обратного обмена, чтобы получить наблюдаемые константы скорости для реакции HDX.
- Рассчитайте порог глобальной значимости предпочтительным методом (HDfleX поддерживает несколько вариантов для этого) и выполните тестирование гибридной значимости для определения существенных различий между сравниваемыми состояниями31,32.
ПРИМЕЧАНИЕ: Если наблюдаемая разница больше глобального порога, а p-значение меньше выбранного доверительного уровня (например, 95%), разница считается значительной.
Результаты
Из-за его внутренне неупорядоченной природы трудно уловить сложные структурные изменения в aSyn при физиологическом рН. HDX-MS контролирует изотопный обмен на магистральных амидных водородах, исследуя конформационную динамику и взаимодействия белков. Это один из немногих методов получения этой информации с высоким структурным и временным разрешением. Этот протокол широко применим к широкому спектру белков и буферных условий, и это иллюстрируется измерением кинетики обмена aSyn в двух различных условиях раствора: состоянии A и состоянии B8, как определено на этапах 2.1.-2.2.
Сначала был проведен картографический эксперимент на aSyn, и получена карта пептидного покрытия, как показано на рисунке 1. Карта охватывает 100% последовательности белка и имеет среднюю избыточность 3,79. Значение 100% покрытия указывает на то, что все аминокислоты в белке были обнаружены в белковых перевариваниях и позволит провести всесторонний анализ обменного поведения aSyn. Значение избыточности указывает на количество перекрывающихся пептидов. Более высокое значение избыточности увеличивает структурное разрешение конечной карты, учитывая субтрактивное сглаживание данных для перекрывающихся пептидов32.
С помощью прототипа прибора с быстрым перемешиванием (см. Таблицу материалов) были собраны высококачественные данные HDX-MS в миллисекундной шкале времени на aSyn при рН 7,4 в состоянии A и состоянии B (рисунок 2). После изотопного присвоения в DynamX были получены «сырые» кривые поглощения дейтерия, как показано на рисунке 3A. Он показывает кривые поглощения для трех пептидов, выбранных в каждом белковом домене. Отображается инкорпорация дейтерия с течением времени. Ось X находится на миллисекундной шкале времени, которая согласуется с очень быстрой кинетикой aSyn в физиологических условиях. Красная затененная область показывает данные, обычно получаемые от обычных приборов HDX, с начальными измерениями от 30 с. Важно отметить, что это не может быть дополнительно уменьшено с помощью манипуляций с рН для так называемого «расширения временного окна»; этот подход недействителен для изучения внутренне неупорядоченных белков/областей, поскольку сдвиг рН будет нарушать конформационный ансамбль слабостабильного полипептида. Как видно здесь, большая часть aSyn полностью обменивается на 1 с (рисунок 3C). Это показывает важность миллисекундных измерений HDX для мономерного aSyn, поскольку захватывается полная кинетическая кривая поглощения для обменной реакции, что дает наиболее точное измерение конформаций мономеров.
HDfleX выполнил обратную обменную коррекцию с использованием плато дейтериевого включения. Впоследствии точки данных были установлены в соответствии с уравнением 1, обеспечивающим наблюдаемую константу скорости, k obs, указывающую на доступность растворителя и участие водородной связи этого конкретного пептида (рисунок 3B).
 Уравнение 1
Уравнение 1
где Dt — включение дейтерия в момент времени t, nExp — число экспоненциальных фаз, N — максимальное число лабильных водородов, kobs — постоянная наблюдаемого обменного курса, а β — коэффициент растяжения30,33.
После подгонки кривой площадь поглощения под установленной кривой может быть рассчитана путем интегрирования встроенной функции, описывающей кривую поглощения в экспериментальном временном окне. Был проведен анализ статистической значимости между зоной поглощения двух государств. Во-первых, порог глобальной значимости для области поглощения был рассчитан в HDfleX на доверительном уровне 95%. Затем были сгенерированы графики разности площадей поглощения, показывающие разницу между состоянием A и состоянием B на двух уровнях структурного разрешения: пептидного разрешения (рисунок 4A) и аминокислотного разрешения (рисунок 4B). График разницы в разрешении пептидов показывает разницу в площади поглощения между состоянием A и состоянием B для каждого отдельного пептида, в то время как график разницы в разрешении аминокислот показывает разницу в площади поглощения между состоянием A и состоянием B, сплющенную по всей аминокислотной последовательности aSyn30,34. Оба графика указывают на общее увеличение поглощения дейтерия во всем мономере aSyn в состоянии B по сравнению с состоянием A. Этот вывод может быть оправдан путем изучения графиков поглощения дейтерия на рисунке 3, где кривая поглощения состояния В всегда выше кривой поглощения состояния А. Кроме того, можно видеть, что величина разницы в площади поглощения намного выше на С-конце. Опять же, это может быть оправдано прослеживанием до исходных кривых поглощения, где С-концевые пептиды (пептиды 124-140, показанные на рисунке 3) показывают гораздо больший разрыв между кривыми поглощения, чем остальная часть белка. В заключение, условия раствора в состоянии В вызывают увеличение воздействия растворителя или уменьшение участия в сети водородных связей по всему белку, но в большей степени на С-конце.

Рисунок 1: Карта пептидного покрытия дикого типа aSyn с общим количеством 30 пептидов и 100% покрытием последовательности. Три домена aSyn выделены следующим образом: N-конец (синий), неамилоидная бета-компонентная область (желтый) и C-конец (красный). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Рабочий процесс для миллисекундного эксперимента HDX-MS на aSyn. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Пример графиков поглощения из трех пептидов, выбранных в трех доменах aSyn для состояния A (желтый) и состояния B (синий). (A) График неподготовленного и необменного скорректированного поглощения. (B) Установленные и скорректированные участки поглощения с обратным обменом. Красная затененная область представляет данные, получаемые обычными системами HDX-MS, обычно начиная с 30 с. Полосы погрешностей соответствуют стандартному отклонению трех реплик. (C) График тепловой карты процентного поглощения дейтерия через аминокислотную последовательность за точку времени. Цветовая шкала представляет процент поглощения дейтерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
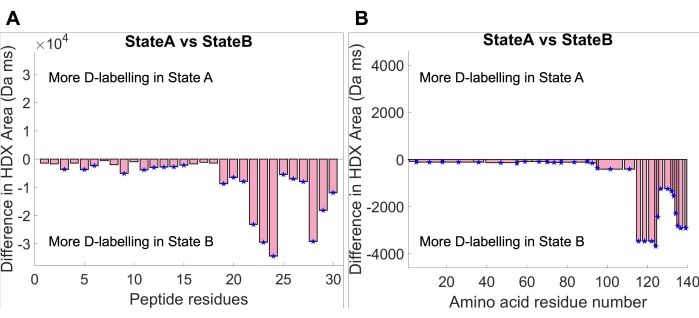
Рисунок 4: Графики разности площадей поглощения при максимальном времени плато кривой (14 084 мс). (A) Графики разрешения остатков пептидов показывают разницу в площади поглощения каждого пептида между состоянием A и состоянием B. (B) График разрешения аминокислот показывает разницу в площади поглощения между состоянием A и состоянием B, сплющенную по всей аминокислотной последовательности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Отображение энергетического уровня | Напряжение рампы (В) |
| Низкий | 20-40 |
| Терпимая | 25-45 |
| Высокий | 30-50 |
| Очень высокий | 35-55 |
Таблица 1: Отображение уровней энергии и соответствующих напряжений передаточной рампы.
Обсуждение
В настоящей статье описаны следующие процедуры: (1) проведение экспериментов по пептидному картированию на мономерном aSyn для получения наивысшего охвата последовательностей, (2) получение миллисекундных данных HDX-MS на мономерном aSyn в физиологических условиях и (3) выполнение анализа данных и интерпретации полученных данных HDX-MS. Предоставляемые процедуры, как правило, просты в выполнении, каждый эксперимент по маркировке обычно длится всего около 8 ч для трех реплик и восьми временных точек, а эксперимент сопоставления длится всего около 2 ч. Учитывая полностью автоматизированные приборы, используемые здесь, полный набор данных может быть получен за 1 день. Однако при обработке образцов и подготовке буферов необходимо позаботиться о том, чтобы измерения выводились из слабо стабильного белка (или белковых областей) в желаемом состоянии. Важно отметить, что предыдущее исследование показало, что различные условия хранения, такие как замораживание и лиофилизация, привели к появлению различных конформеров мономера aSyn и что важно охарактеризовать потенциальное влияние обработки образцов на конформационный ансамбль мономераaSyn 10. Действительно, HDX-MS является высокочувствительной мерой таких конформационных возмущений с динамическим диапазоном от микросекунд до, по крайней мере, месяцев. Кроме того, при строгом изучении только мономера aSyn настоятельно рекомендуется удалять нежелательные олигомеры и фибриллы, которые могли образоваться в образце при хранении или обработке. Кроме того, буферы HDX-MS должны жестко контролироваться в пределах 0,05 от желаемого pH или pD, так как любые расхождения значительно повлияют на внутренний обменный курс и приведут к нежелательным ошибкам. Также важно отметить, что сравнение условий раствора для любого белка, который отличается рН, температурой или составом соли, изменит внутреннюю скорость. Поэтому эти данные потребуют дальнейших корректировок, таких как применение поправочного коэффициента pH35 или эмпирического поправочного коэффициента 8,30.
С точки зрения приборостроения, не существует коммерчески доступных систем, позволяющих получать миллисекундные данные HDX-MS. Несколько исследовательских групп разработали свои собственные системы, от систем закалки-потока 13,15,36 до микрофлюидных чипов 37,38,39 для захвата быстрой кинетики обмена определенных белков. Другой метод, который был использован для достижения миллисекундной временной шкалы данных HDX-MS, известен как метод временного расширения 40,41, в соответствии с которым рН буферов уменьшается, чтобы замедлить кинетику обмена. Однако этот метод не применим к aSyn (или к любым слабо стабильным свойствам белка), поскольку (1) понижение pH резко изменяет плотность заряда белка и увеличивает скорость агрегации 8,42, и (2) конформеры aSyn являются только метастабильными и, вероятно, будут нарушены этими изменениями pH. По этим причинам рекомендуется поддерживать постоянный рН в буферах HDX-MS при изучении мономерных конформаций aSyn, если это не физиологически значимо, и использовать миллисекундный инструмент маркировки.
Большая часть мономера aSyn полностью обменивается в течение 1 с, и самое большее, для полного обмена с дейтерием (рисунок 3) требуется примерно 15 с при физиологически значимом рН 7,4 (отражающем внутриклеточные цитозольные состояния в пресинапсе). Использование обычных систем HDX-MS, начиная с 30 с, нецелесообразно, так как данные HDX-MS будут соответствовать плато реакции обмена, что не дает никакой полезной конформационной информации. Однако нижний предел измерения миллисекундного прибора HDX (соответствующий «мертвому времени» 50 мс) позволяет контролировать реакцию обмена от ~25% завершения для мономера aSyn при рН 7,4. Это позволило нам захватить большую часть кинетической кривой поглощения. Приведение кривой поглощения дейтерия к уравнению 1 обеспечивает важную кинетическую информацию; она соответствует оценке наблюдаемой константы скорости, k obs. Хотя здесь это не рассматривается, можно проводить эксперименты по кинетике агрегации и исследовать фибрилловые морфологии aSyn в тех же условиях решения, что и эксперименты HDX-MS, поскольку HDX-MS очень устойчив к широкому диапазону буферов8. Так, например, kobs из эксперимента HDX-MS можно соотнести с результатами экспериментов по агрегации, чтобы понять, какие конформации наиболее склонны к определенному поведению агрегации и морфологии фибрилов.
Для простого случая дифференциальных экспериментов HDX-MS, где необходимо сравнить два или более условий или вариантов белка, площадь под установленной кривой поглощения может быть интегрирована для каждого состояния и сопоставлена друг с другом. В этом исследовании области поглощения для состояния A и состояния B сравнивались на двух различных уровнях структурного разрешения: пептидное разрешение и аминокислотное разрешение, оба из которых имеют различные сильные стороны и проблемы. Например, данные о разрешении пептидов более точно отражают необработанные спектральные данные и подверглись наименьшей обработке. Однако «сплющенные» данные о разрешении аминокислот позволяют объединять как пептидную, так и мягкую фрагментационную информацию в один выход, а не разделять необъединяемые выходы и, в конечном счете, представлять данные с самым высоким структурным разрешением. Одним из ограничений масс-спектрометрического обнаружения маркировки HDX является проблема получения аминокислотного разрешения. Хотя методы «мягкой фрагментации», такие как диссоциация переноса электронов (ETD), диссоциация захвата электронов (ECD) и ультрафиолетовая фотодиссоциация (UVPD), доказали свою эффективность в создании более высоких разрешений, они остаются сложными, непредсказуемыми и неэффективными 30,43,44,45,46,47,48.
По сравнению с другими структурными методами, миллисекундный HDX-MS имеет уникальное преимущество, заключающееся в захвате конформационной динамики мономерного aSyn с высоким структурным и временным разрешением. Поскольку кинетика быстрого обмена мономера больше не является ограничивающим фактором, дальнейшие исследования могут быть выполнены на мономерном aSyn с различными мутациями, посттрансляционными модификациями, солевыми компонентами и концентрациями и партнерами по связыванию при физиологическом рН. Корреляция результатов HDX-MS с функциональными исследованиями, такими как кинетика агрегации и морфология фибрилл, может дать представление о конформерах, которые либо способствуют нормальной клеточной функции, либо подвержены заболеваниям. В конечном счете, ожидается, что такая миллисекундная HDX-MS может иметь решающее значение для обнаружения целевых препаратов, которые стабилизируют конкретные физиологически переносимые конформеры.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
NS финансируется Бриллиантовой юбилейной стипендией Совета университета. JJP поддерживается стипендией UKRI Future Leaders Fellowship [Номер гранта: MR/T02223X/1].
Материалы
| Name | Company | Catalog Number | Comments |
| 1 × 100 mm ACQUITY BEH 1.7 μm C18 column | Waters Corporation | 186002346 | Analytical column |
| Acetonitrile HPLC grade >99.9% HiPerSolv | VWR | 20060.420 | For LC mobile phases |
| CaCl2 | Sigma Aldrich | C5670 | Salt for HDX buffers |
| Chronos | Axel Semrau (Purchased from Waters Corporation) | 667006090 | Scheduling software to enable multiple HDX-MS sample injections automatically. Alternative software is available from other vendors e.g. HDXDirector or LEAP Shell |
| Deuterium chloride | Goss Scientific (Cambridge Isotope Laboratories) | DLM-2-50 | For HDX labelling buffers |
| Deuterium oxide (99.9% D2O) | Goss Scientific (Cambridge Isotope Laboratories) | DLM-4 | Deuterated water |
| DynamX 3.0 | Waters Corporation | 176016027 | Isotopic assignment and deuterium incorporation calculation |
| Enzymate BEH Pepsin Column | Waters Corporation | 186007233 | Pepsin digestion column |
| Formic Acid, 99.0% LC/MS Grade | Fisher Scientific | 10596814 | For LC mobile phases |
| Guanidinium hydrochloride | Sigma Aldrich | RDD001-500G | Chaotrope/Denaturant |
| HDfleX | University of Exeter | N/A | https://ore.exeter.ac.uk/repository/handle/10871/127982 |
| KCl | Sigma Aldrich | P3911 | Salt for HDX buffers |
| LEAP HDX-2 CTC PAL sampling robot | Waters Corporation | 725000637 | Autosampler robot |
| Leucine enkephalin | Waters Corporation | 186006013 | For mass spectrometry lockspray calibration. |
| MassLynx | Waters Corporation | 667004007 | Software controlling inlet methods and mass spectrometer |
| Maximum recovery vials | Waters Corporation | 600000670CV | 100 pack including caps - used for quench tray in LEAP HDX-2 |
| MgCl2 | Sigma Aldrich | M8266 | Salt for HDX buffers |
| Millipore 0.22 µm syringe filters | Millipore | N9CA7069B | Syringe filters |
| ms2min | Applied Photophysics Ltd | N/A | fast-mix quench-flow millisecond hdx instrument |
| NaCl | Sigma Aldrich | S9888 | Salt for HDX buffers |
| Peltier temperature controller | LEAP Technologies Inc. | HP115-COOL/D | Peltier controller to set precise temperature of chambers in the LEAP robot. |
| ProteinLynx Global Server 3.0 | Waters Corporation | 715001030 | Peptide identification software. Alternative software is available from other vendors. |
| Reagent pot caps | Waters Corporation | 186004632 | 100 pack |
| Reagent pots for LEAP HDX-2 | Waters Corporation | 186001420 | 100 pack excluding caps - used for buffers in LEAP HDX-2 |
| Sodium deuteroxide (99.5% in D2O) | Goss Scientific (Cambridge Isotope Laboratories) | DLM-57 | For HDX labelling buffers |
| Spin filter microcentrifuge tubes (3 kDa MWCO) | Amicon (Merck Sigma Aldrich) | UFC5003 | Micro centrifuge tubes to concentrate protein. This facilitates buffer exchange and accurate sample loading for HDX-MS experiments. |
| Synapt G2-Si mass spectrometer | Waters Corporation | 176850035 | Mass spectrometer |
| Total recovery vials | Waters Corporation | 600000671CV | 100 pack including caps - used for labelling tray in LEAP HDX-2 |
| Tris-HCl | Sigma Aldrich | T3253-250G | Buffer |
| Trizma base | Sigma Aldrich | T60040-B2005 | Buffer |
| Urea | Sigma Aldrich | U5378-1KG | Chaotrope/Denaturant |
| VanGuard 2.1 x 5 mm ACQUITY BEH C18 column | Waters Corporation | 186004623 | Trap desalting column |
Ссылки
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology. 17 (11), 939-953 (2018).
- Breydo, L., Wu, J. W., Uversky, V. N. α-Synuclein misfolding and Parkinson's disease. Biochimica et Biophysica Acta (BBA): Molecular Basis of Disease. 1822 (2), 261-285 (2012).
- Dedmon, M. M., Lindorff-Larsen, K., Christodoulou, J., Vendruscolo, M., Dobson, C. M. Mapping long-range interactions in α-synuclein using spin-label NMR and ensemble molecular dynamics simulations. Journal of the American Chemical Society. 127 (2), 476-477 (2005).
- Esteban-Martín, S., Silvestre-Ryan, J., Bertoncini, C. W., Salvatella, X. Identification of fibril-like tertiary contacts in soluble monomeric α-synuclein. Biophysical Journal. 105 (5), 1192-1198 (2013).
- McClendon, S., Rospigliosi, C. C., Eliezer, D. Charge neutralization and collapse of the C-terminal tail of alpha-synuclein at low pH. Protein Science. 18 (7), 1531-1540 (2009).
- Ranjan, P., Kumar, A. Perturbation in long-range contacts modulates the kinetics of amyloid formation in α-synuclein familial mutants. ACS Chemical Neuroscience. 8 (10), 2235-2246 (2017).
- Villar-Piqué, A., da Fonseca, T. L., Outeiro, T. F. Structure, function and toxicity of alpha-synuclein: the Bermuda triangle in synucleinopathies. Journal of Neurochemistry. 139, Suppl 1 240-255 (2015).
- Seetaloo, N., Zacharopoulou, M., Stephens, A. D., Schierle, G. S. K., Phillips, J. J. Local structural dynamics of alpha-synuclein correlate with aggregation in different physiological conditions. bioRxiv. , (2022).
- Stephens, A. D., et al. Extent of N-terminus exposure of monomeric alpha-synuclein determines its aggregation propensity. Nature Communications. 11 (1), 2820(2020).
- Stephens, A. D., et al. Different structural conformers of monomeric α-synuclein identified after lyophilizing and freezing. Analytical Chemistry. 90 (11), 6975-6983 (2018).
- Lautenschläger, J., et al. C-terminal calcium binding of α-synuclein modulates synaptic vesicle interaction. Nature Communications. 9 (1), 712(2018).
- Oganesyan, I., Lento, C., Tandon, A., Wilson, D. J. Conformational dynamics of α-synuclein during the interaction with phospholipid nanodiscs by millisecond hydrogen-deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 32 (5), 1169-1179 (2021).
- Keppel, T. R., Weis, D. D. Analysis of disordered proteins using a simple apparatus for millisecond quench-flow H/D exchange. Analytical Chemistry. 85 (10), 5161-5168 (2013).
- Al-Naqshabandi, M. A., Weis, D. D. Quantifying protection in disordered proteins using millisecond hydrogen exchange-mass spectrometry and peptic reference peptides. Biochemistry. 56 (31), 4064-4072 (2017).
- Kish, M., et al. Allosteric regulation of glycogen phosphorylase solution phase structural dynamics at high spatial resolution. bioRxiv. , (2019).
- El-Amine, M., et al. Mechanisms of tolerance induction by a gene-transferred peptide-IgG fusion protein expressed in B lineage cells. Journal of Immunology. 165 (10), 5631-5636 (2000).
- Kishimoto, S., et al. Site-specific chemical conjugation of antibodies by using affinity peptide for the development of therapeutic antibody format. Bioconjugate Chemistry. 30 (3), 698-702 (2019).
- Xu, W., et al. A protein-based, long-acting HIV-1 fusion inhibitor with an improved pharmacokinetic profile. Pharmaceuticals. 15 (4), 424(2022).
- Frías, J. P., et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. The New England Journal of Medicine. 385 (6), 503-515 (2021).
- Gerstein, H. C., et al. Cardiovascular and renal outcomes with efpeglenatide in type 2 diabetes. The New England Journal of Medicine. 385 (10), 896-907 (2021).
- Largy, E., Gabelica, V. Native hydrogen/deuterium exchange mass spectrometry of structured DNA oligonucleotides. Analytical Chemistry. 92 (6), 4402-4410 (2020).
- Marcsisin, S. R., Engen, J. R. Hydrogen exchange mass spectrometry: What is it and what can it tell us. Analytical and Bioanalytical Chemistry. 397 (3), 967-972 (2010).
- Glasoe, P. K., Long, F. A. Use of glass electrodes to measure acidities in deuterium oxide. Journal of Physical Chemistry. 64 (1), 188-190 (1960).
- Krȩzel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Mayerhöfer, T. G., Pahlow, S., Popp, J. The Bouguer-Beer-Lambert law: Shining light on the obscure. ChemPhysChem. 21 (18), 2029-2046 (2020).
- Gasteiger, E., et al. The Proteomics Protocols Handbook. , Springer. New York. 571-607 (2005).
- Bateman, R. H., et al. A novel precursor ion discovery method on a hybrid quadrupole orthogonal acceleration time-of-flight (Q-TOF) mass spectrometer for studying protein phosphorylation. Journal of the American Society for Mass Spectrometry. 13 (7), 792-803 (2002).
- Sørensen, L., Salbo, R. Optimized workflow for selecting peptides for HDX-MS data analyses. Journal of the American Society for Mass Spectrometry. 29 (11), 2278-2281 (2018).
- Demmers, J. A. A., Rijkers, D. T. S., Haverkamp, J., Killian, J. A., Heck, A. J. R. Factors affecting gas-phase deuterium scrambling in peptide ions and their implications for protein structure determination. Journal of the American Chemical Society. 124 (37), 11191-11198 (2002).
- Seetaloo, N., Kish, M., Phillips, J. J. HDfleX: Software for flexible high structural resolution of hydrogen/deuterium-exchange mass spectrometry data. Analytical Chemistry. 94 (11), 4557-4564 (2022).
- Hageman, T. S., Weis, D. D. Reliable identification of significant differences in differential hydrogen exchange-mass spectrometry measurements using a hybrid significance testing approach. Analytical Chemistry. 91 (13), 8008-8016 (2019).
- Hageman, T. S., Weis, D. D. A structural variant approach for establishing a detection limit in differential hydrogen exchange-mass spectrometry measurements. Analytical Chemistry. 91 (13), 8017-8024 (2019).
- Chetty, P. S., et al. Helical structure and stability in human apolipoprotein A-I by hydrogen exchange and mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19005-19010 (2009).
- Keppel, T. R., Weis, D. D. Mapping residual structure in intrinsically disordered proteins at residue resolution using millisecond hydrogen/deuterium exchange and residue averaging. Journal of the American Society for Mass Spectrometry. 26 (4), 547-554 (2015).
- Li, J., Rodnin, M. V., Ladokhin, A. S., Gross, M. L. Hydrogen-deuterium exchange and mass spectrometry reveal the pH-dependent conformational changes of diphtheria toxin T domain. Biochemistry. 53 (43), 6849-6856 (2014).
- Roder, H., Elöve, G. A., Englander, S. W. Structural characterization of folding intermediates in cytochrome c by H-exchange labelling and proton NMR. Nature. 335 (6192), 700-704 (1988).
- Rob, T., et al. Measuring dynamics in weakly structured regions of proteins using microfluidics-enabled subsecond H/D exchange mass spectrometry. Analytical Chemistry. 84 (8), 3771-3779 (2012).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13 (13), 2528-2532 (2013).
- Svejdal, R. R., Dickinson, E. R., Sticker, D., Kutter, J. P., Rand, K. D. Thiol-ene microfluidic chip for performing hydrogen/deuterium exchange of proteins at subsecond time scales. Analytical Chemistry. 91 (2), 1309-1317 (2018).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of The American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Coales, S. J., E, S. Y., Lee, J. E., Ma, A., Morrow, J. A., Hamuro, Y. Expansion of time window for mass spectrometric measurement of amide hydrogen/deuterium exchange reactions. Rapid Communications in Mass Spectrometry. 24 (24), 3585-3592 (2010).
- Hoyer, W., et al. Dependence of alpha-synuclein aggregate morphology on solution conditions. Journal of Molecular Biology. 322 (2), 383-393 (2002).
- Rand, K. D., Pringle, S. D., Morris, M., Engen, J. R., Brown, J. M. ETD in a traveling wave ion guide at tuned Z-spray ion source conditions allows for site-specific hydrogen/deuterium exchange measurements. Journal of the American Society for Mass Spectrometry. 22 (10), 1784-1793 (2011).
- Kan, Z. Y., Ye, X., Skinner, J. J., Mayne, L., Englander, S. W. ExMS2: An integrated solution for hydrogen-deuterium exchange mass spectrometry data analysis. Analytical Chemistry. 91 (11), 7474-7481 (2019).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Characterizing short-lived protein folding intermediates by top-down hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (20), 8591-8597 (2010).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Mistarz, U. H., et al. Photodissociation mass spectrometry accurately localizes sites of backbone deuteration in peptides. Analytical Chemistry. 90 (2), 1077-1080 (2017).
- Phillips, J. J., et al. Rate of asparagine deamidation in a monoclonal antibody correlating with hydrogen exchange rate at adjacent downstream residues. Analytical Chemistry. 89 (4), 2361-2368 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены