Method Article
قياس الطيف الكتلي لتبادل الهيدروجين / الديوتيريوم بالمللي ثانية لدراسة الديناميات الهيكلية ألفا سينوكلين في ظل الظروف الفسيولوجية
In This Article
Summary
تؤثر المجموعة الهيكلية لألفا سينوكلين أحادي اللون على وظيفتها الفسيولوجية وخصائصها الفيزيائية الكيميائية. يصف هذا البروتوكول كيفية إجراء قياس الطيف الكتلي لتبادل الهيدروجين / الديوتيريوم بالمللي ثانية وتحليلات البيانات اللاحقة لتحديد المعلومات التوافقية عن مونومر هذا البروتين المضطرب جوهريا في ظل الظروف الفسيولوجية.
Abstract
ألفا سينوكلين (aSyn) هو بروتين مضطرب في جوهره ، حيث تكون مجاميع الألياف وفيرة في أجسام ليوي والأعصاب ، والتي هي السمات المميزة لمرض باركنسون. ومع ذلك ، فإن الكثير من نشاطه البيولوجي ، وكذلك تجميعه ، ينطوي بشكل مركزي على شكل مونومر قابل للذوبان من البروتين. يتطلب توضيح الآليات الجزيئية لبيولوجيا aSyn والفيزيولوجيا المرضية طرقا عالية الحل هيكليا وحساسة للظروف البيولوجية. هياكلها المستقرة في الأصل تجعل aSyn الأحادي المستعصي على العديد من تقنيات البيولوجيا الهيكلية. هنا ، يتم وصف تطبيق أحد هذه النهج: قياس الطيف الكتلي لتبادل الهيدروجين / الديوتيريوم (HDX-MS) على مقياس زمني بالمللي ثانية لدراسة البروتينات ذات الاستقرار الديناميكي الحراري المنخفض وعوامل الحماية الضعيفة ، مثل aSyn. على النطاق الزمني للميلي ثانية ، تحتوي بيانات HDX-MS على معلومات حول إمكانية الوصول إلى المذيبات والبنية المستعبدة بالهيدروجين ل aSyn ، والتي يتم فقدانها في أوقات وضع العلامات الأطول ، مما يؤدي في النهاية إلى دقة هيكلية تصل إلى مستوى الأحماض الأمينية. لذلك ، يمكن أن يوفر HDX-MS معلومات بدقة هيكلية وزمنية عالية حول الديناميات التوافقية والديناميكا الحرارية ، والتفاعلات داخل الجزيئات وفيما بينها ، والتأثير الهيكلي للطفرات أو التغييرات في الظروف البيئية. على الرغم من أنه قابل للتطبيق على نطاق واسع ، إلا أنه تم توضيح كيفية الحصول على قياسات HDX-MS بالمللي ثانية وتحليلها وتفسيرها في aSyn الأحادية.
Introduction
مرض باركنسون (PD) هو مرض تنكسي عصبي يؤثر على ملايين الأشخاص في جميع أنحاء العالم1. يتميز بتكوين شوائب سيتوبلازمية تعرف باسم أجسام ليوي وعصب ليوي في المادة السوداء في الدماغ في منطقة كومباكتا. وقد وجد أن هذه الشوائب السيتوبلازمية تحتوي على مجاميع من البروتين المضطرب جوهريا aSyn2. في PD وغيرها من اعتلالات synucleinopathies ، يتحول aSyn من حالة مضطربة قابلة للذوبان إلى حالة مرضية غير قابلة للذوبان وعالية الهيكلة. في شكله الأصلي ، يعتمد aSyn الأحادي مجموعة واسعة من التكوينات المستقرة من خلال التفاعلات الكهروستاتيكية طويلة المدى بين التفاعلات N- و C-termini والتفاعلات الكارهة للماء بين منطقة C-terminus ومكون بيتا غير الأميلويد (NAC)3،4،5،6. أي اضطرابات في تلك التفاعلات المستقرة، مثل الطفرات، والتعديلات اللاحقة للترجمة، والتغيرات في البيئة المحلية، يمكن أن تؤدي إلى سوء طي المونومر، وبالتالي إطلاق عملية التجميع7.
في حين أن هناك قدرا هائلا من الأبحاث حول الأشكال قليلة القلة والألياف من aSyn 8,9,10,11 ، هناك حاجة ماسة لدراسة الشكل الأحادي للبروتين وفهم أفضل للمطابقات الوظيفية (وكيف) والتي هي عرضة لتجميع 8,9,10,11 . نظرا لكونه مضطربا في جوهره ، وحجمه 14 كيلوداد فقط ، ويصعب تبلوره ، فإن مونومر aSyn غير قابل لمعظم التقنيات البيولوجية الهيكلية. ومع ذلك ، فإن إحدى التقنيات القادرة على قياس الديناميكيات التوافقية ل aSyn الأحادي هي HDX-MS بالمللي ثانية ، والتي ولدت مؤخرا ملاحظات هيكلية مهمة من شأنها أن تكون صعبة أو مستحيلة الحصول عليها بخلاف ذلك12،13،14. يقيس Millisecond HDX-MS بحساسية متوسط المجموعة التوافقية للبروتين من خلال مراقبة تبادل النظائر في هيدروجين الأميد ، مما يشير إلى إمكانية الوصول إلى المذيبات ومشاركة شبكة الترابط الهيدروجيني لمنطقة بروتين معينة على مقياس زمني بالمللي ثانية. من الضروري التأكيد على جانب المللي ثانية من HDX-MS لأنه ، نظرا لطبيعته المستقرة أصلا ، يعرض aSyn حركية سريعة جدا لتبادل الهيدروجين تظهر أقل بكثير من الحد الأدنى لأنظمة HDX-MS التقليدية. على سبيل المثال ، قام معظم جزيء aSyn باستبدال الهيدروجين بالكامل بالديوتيريوم تحت ظروف داخل الخلايا في أقل من 1 ثانية. وقد قامت عدة مختبرات الآن ببناء أجهزة سريعة الخلط. في هذه الحالة ، يتم استخدام نموذج أولي لأداة تدفق التبريد سريعة الخلط القادرة على أداء HDX-MS مع وقت ميت يبلغ 50 مللي ثانية ودقة زمنية تبلغ 1 مللي ثانية15. في حين أن HDX-MS بالمللي ثانية كان مؤخرا مهما للغاية في دراسة aSyn ، إلا أنه سيكون ذا قيمة في دراسة البروتينات / المناطق المضطربة داخليا على نطاق أوسع وعدد كبير من البروتينات ذات الحلقات / المناطق التي تكون مستقرة بشكل ضعيف فقط. على سبيل المثال ، أدوية الببتيد (على سبيل المثال ، الأنسولين; GLP-1 / الجلوكاجون. tirzepatide) وبروتينات اندماج الببتيد (على سبيل المثال ، مثبط فيروس نقص المناعة البشرية FN3-L35-T1144) هي أشكال دوائية رئيسية حيث يمكن أن تكون المعلومات الهيكلية والمستقرة في مرحلة الحل مدخلا حاسما لقرارات تطوير الأدوية ، ومع ذلك ، فإن الببتيد moiety غالبا ما يكون مستقرا بشكل ضعيف ومستعصيا بواسطة HDX-MS في الثواني الزمنية16،17،18،19،20 . وقد ثبت أن طرق HDX-MS الناشئة مع وضع العلامات في نطاقات الثواني / الدقائق تستمد معلومات هيكلية للحمض النووي G-quadruplexes ، ولكن يجب أن يكون من الممكن توسيع نطاق ذلك ليشمل هياكل قليلة النوكليوتيد الأكثر تنوعا عن طريق تطبيق HDX-MS21 بالمللي ثانية.
يمكن إجراء تجارب HDX-MS على ثلاثة مستويات مختلفة: (1) من أسفل إلى أعلى (حيث يتم هضم البروتين المسمى بشكل بروتيني) ، (2) من الوسط إلى الأسفل (حيث يتم هضم البروتين المسمى بشكل بروتيني ، ويتم تفتيت الببتيدات الناتجة بشكل أكبر بواسطة تقنيات التجزئة الناعمة) ، و (3) من أعلى إلى أسفل (حيث تقوم تقنيات التجزئة الناعمة بتجزئة البروتين المسمى مباشرة)22 . وبالتالي ، فإن بيانات HDX-MS دون الجزيئية تسمح لنا بتوطين سلوك التبادل إلى مناطق محددة من البروتين ، مما يجعل من الأهمية بمكان الحصول على تغطية تسلسل كافية لمثل هذه التجارب. تعتمد الدقة الهيكلية لأي تجربة HDX-MS على عدد الببتيدات المحللة للبروتين أو الشظايا المشتقة من البروتين عند الهضم أو التجزئة الناعمة ، على التوالي. في كل نوع من أنواع التجارب الثلاثة الموضحة أعلاه ، يتم تعيين التغيير في تبادل الأميد في كل ببتيد / جزء مرة أخرى على البنية الأساسية للبروتين للإشارة إلى سلوك المناطق الموضعية من البروتين. في حين يتم تحقيق أعلى دقة هيكلية من خلال التجزئة الناعمة ، فإن وصف هذه التجارب خارج نطاق الدراسة الحالية ، التي تركز على قياس تشكيلات مونومر aSyn. يمكن الحصول على نتائج ممتازة من خلال سير العمل "من أسفل إلى أعلى" المطبق بشكل شائع والموضح هنا.
هنا ، يتم توفير إجراءات حول (1) كيفية إعداد عينات aSyn والمخازن المؤقتة HDX-MS والتعامل معها ، (2) كيفية إجراء رسم خرائط الببتيد لتجربة HDX-MS من أسفل إلى أعلى ، (3) كيفية الحصول على بيانات HDX-MS على aSyn الأحادي في ظل الظروف الفسيولوجية ، وتحديدا في مجال الوقت بالمللي ثانية (باستخدام أداة مصممة خصيصا ؛ كما تم وصف الأدوات البديلة لوضع العلامات بالمللي ثانية) ، و (4) كيفية معالجة وتحليل بيانات HDX-MS. يتم توضيح الطرق التي تستخدم aSyn الأحادي عند درجة الحموضة الفسيولوجية (7.40) في حالتين من ظروف الحل هنا. على الرغم من أنها مفيدة للغاية في دراسة aSyn ، إلا أنه يمكن تطبيق هذه الإجراءات على أي بروتين ولا تقتصر على البروتينات المضطربة في جوهرها.
Protocol
1. التعبير عن البروتين وتنقية aSyn
- قم بإعداد aSyn بعد تقرير نشر مسبقا9.
- قم بالتحويل إلى مخزن مؤقت آمن للتخزين (على سبيل المثال ، Tris ، الرقم الهيدروجيني 7.2 ).
- إذا لزم الأمر، ركز العينة (على سبيل المثال، أنابيب أجهزة الطرد المركزي الدقيقة ذات المرشح المغزلي باستخدام 3 كيلو دالتون MWCO، 14000 × جم لمدة 10-30 دقيقة تقريبا، انظر جدول المواد).
ملاحظة: ينصح بعدم التركيز بشكل مفرط. لم يتم التحقق من سلامة مجموعة المونومر بعد 25 ميكرومتر. - Aliquot وتخزينها في -80 درجة مئوية
ملاحظة: بروتين مونومر aSyn مستقر لمدة تصل إلى 1 سنة في ظروف التخزين هذه.
2. إعداد المخزن المؤقت HDX
ملاحظة: نظرا لأن Tris لديه معامل درجة حرارة مرتفع ، يجب ضبط قياس الرقم الهيدروجيني لدرجة الحرارة التي سيتم عندها إجراء تفاعل HDX ، وهي 20 درجة مئوية في هذا البروتوكول.
- قم بإعداد مخزن مؤقت للتوازن للحالة A والحالة B عن طريق وزن 0.002 مول من Tris إلى 100 مل من الماء LC-MS. بالنسبة للحالة B ، أضف 29.8 ملغ من KCl ، و 14.2 ملغ من MgCl 2 ، و 36.8 جم من CaCl2 ، و 836 mg من كلوريد الصوديوم إلى مخزن Tris المؤقت. اضبط الرقم الهيدروجيني على 7.40 ± 0.05.
ملاحظة: يجب أن يحتوي المخزن المؤقت للتوازن على الشروط التي سيتم فيها دراسة aSyn. في هذه الحالة ، يكون 20 mM Tris عند درجة الحموضة 7.4 +/− الأملاح. - قم بإعداد مخزن مؤقت لوضع العلامات للحالة A والحالة B عن طريق وزن 0.002 مول من Tris إلى 100 مل من الماء المنزوع التثنية. بالنسبة للحالة B ، أضف 29.8 ملغ من KCl ، و 14.2 ملغ من MgCl 2 ، و 36.8 جم من CaCl2 ، و 836 mg من كلوريد الصوديوم إلى المخزن المؤقت لوضع العلامات على Tris. يتوافق pD للمخزن المؤقت لوضع العلامات مع الرقم الهيدروجيني للمخزن المؤقت للتوازن. نظرا لأن الرقم الهيدروجيني = pD - 0.41 ، اضبط بحيث يقرأ مقياس الأس الهيدروجيني 6.99 ± 0.0523,24.
ملاحظة: يجب أن يحتوي المخزن المؤقت لوضع العلامات على نفس مكونات المخزن المؤقت للتوازن، باستثناء أنه يتم إعداده باستخدام الماء المخفف. - قم بإعداد المخزن المؤقت للإرواء عن طريق وزن 0.010 مول من Tris و 0.050 mol من اليوريا وقم بعمل ما يصل إلى 100 مل بالماء LC-MS. اضبط الرقم الهيدروجيني على 2.50 ± 0.05 عند 0.5 درجة مئوية.
ملاحظة: يجب إجراء شاشة تخزين مؤقت للإرواء قبل تجارب HDX لتحديد أفضل مخزن مؤقت للإرواء للبروتين محل الاهتمام. يتم فحص تركيزات ومجموعات مختلفة من المسكرات (على سبيل المثال ، اليوريا وهيدروكلوريد غوانيدينيوم) والعوامل المختزلة (على سبيل المثال ، tris(2-carboxyethyl) phosphine) ، جنبا إلى جنب مع المعلمات الفيزيائية مثل حجم المحاصرة ودرجة الحرارة ، لتكشف وهضم البروتين المروي بشكل فعال. يعد المخزن المؤقت للإرواء الذي يتكون من 100 mM Tris و 0.5 M urea عند درجة الحموضة 2.50 مثاليا لهذه الدراسة. - تحضير المخزن المؤقت لغسل عمود الهضم عن طريق وزن 0.125 مول من هيدروكلوريد جوانيدينيوم في زجاجة دوران زجاجية. أضف 25 مل من الميثانول و 250 ميكرولتر من حمض الفورميك. اصنع ما يصل إلى 250 مل بماء LC-MS.
ملاحظة: بالنسبة لعمود البيبسين Enzymate BEH (انظر جدول المواد) ، استخدم مخزن مؤقت لغسل العمود من 0.5 M هيدروكلوريد جوانيدينيوم ، و 10٪ (v / v) ميثانول ، و 0.1٪ (v / v) حمض الفورميك. - تحضير الغسيل الضعيف للحقنة عن طريق سحب 0.5 ميكرولتر من حمض الفورميك إلى 249.5 مل من الماء LC-MS.
- تحضير حقنة غسل قوية عن طريق خلط أجزاء متساوية من الماء LC-MS الصف ، الميثانول ، الأسيتونيتريل ، والأيزوبروبانول. أضف حمض الفورميك إلى تركيز نهائي بنسبة 2٪ (v / v).
ملاحظة: لمنع التلوث المتبادل بين المخازن المؤقتة المختلفة والبروتين ولتمكين تنظيف منفذ الحقن، من الأهمية بمكان إعداد محاليل غسل المحاقن وأن يكون مسار التدفق إلى الصمام (غالبا ما يسمى "بطانة الغسيل") جاهزا بالكامل بالسائل. حمض الفورميك اختياري لغسل المحقنة الضعيف.
3. إجراء رسم خرائط الببتيد
- قم بإعداد النموذج باتباع الخطوة أدناه.
- قام الفلتر بإذابة مخزون بروتين aSyn من الفريزر -80 درجة مئوية مع مرشحات حقنة 0.22 ميكرومتر. قم بقياس امتصاص بروتين المرق المصفى عند 280 نانومتر لتحديد التركيز بواسطة قانون بير لامبرت. قم بتخفيف البروتين إلى تركيز 5 ميكرومتر في مخزن التوازن العازل (الخطوة 2.1).
ملاحظة: قانون بير لامبرت: A = εcl ، حيث A هو الامتصاص ، ε هو معامل انقراض البروتين عند الطول الموجي المقاس (280 نانومتر هنا) مع الوحدات M−1 cm−1، c هو تركيز البروتين في M ، و l هو طول المسار بالسنتيمتر. بالنسبة ل aSyn26 من النوع البري ، ε = 5960 M−1 cm−1.
- قام الفلتر بإذابة مخزون بروتين aSyn من الفريزر -80 درجة مئوية مع مرشحات حقنة 0.22 ميكرومتر. قم بقياس امتصاص بروتين المرق المصفى عند 280 نانومتر لتحديد التركيز بواسطة قانون بير لامبرت. قم بتخفيف البروتين إلى تركيز 5 ميكرومتر في مخزن التوازن العازل (الخطوة 2.1).
- قم بإعداد طريقة الكروماتوغرافيا السائلة.
- قم بإنشاء ملف مدخل مع وقت تحميل / محاصرة من 3 دقائق عند ضغط 7000-9000 رطل لكل بوصة مربعة ، متبوعا بتدرج من 5٪ acetonitrile إلى 40٪ acetonitrile في 7 دقائق ، تليها خطوات غسيل متكررة من 5٪ -95٪ acetonitrile-water لمدة 10 دقائق.
- تأكد من أن رذاذ القفل (على سبيل المثال ، leucine enkephalin ، انظر جدول المواد) يتدفق بسرعة 2000 رطل لكل بوصة مربعة ومتصل بمسبار رذاذ قفل المصدر لمطياف الكتلة.
- قم بإعدادطرق قياس الطيف الكتلي MS E.
ملاحظة: MSE هي طريقة اكتساب مستقلة عن بيانات النطاق العريض مع عدم وجود عزل جماعي للسلائف. ولذلك، فإن جميع الأيونات داخل نطاق m/z المحدد مجزأة أكثر باستخدام التفكك الناجم عن التصادم (CID)27.- في ملف أسلوب MS، اختر MSE Continuum وقم بإعداد وقت اكتساب بين 2-10 دقائق، ومصدر الرش الكهربائي، ووضع الدقة الإيجابية. احصل على MSE أكثر من 50-2000 Da ، والمسح الضوئي كل 0.3 ثانية.
- بالنسبة للوظيفة 1 (الطاقة المنخفضة)، قم بإعداد المصيدة ونقل طاقات التصادم لتكون 4 فولت. بالنسبة للدالة 2 (الطاقة العالية)، قم بإعداد طاقة تصادم نقل المنحدر لتكون ثابتة عند 4 فولت وطاقة تصادم المصيدة لتكون كما هو مذكور في الجدول 1 لكل مستوى طاقة رسم خرائط.
ملاحظة: يمكن أيضا استخدام طرق MSE للتنقل الأيوني. يمكن استخدام طرق رسم الخرائط البديلة (على سبيل المثال ، الحصول على البيانات المعتمدة أو DDA) وفقا لتقدير المستخدم.
- قم بإعداد روبوت أخذ العينات التلقائي (انظر جدول المواد).
- أضف 50 ميكرولتر من بروتين 5 ميكرومتر إلى قارورة استرداد كاملة. ضع القارورة في وضع العينة في الغرفة اليمنى HDX. تأكد من أن هذه الغرفة عند 0.5 درجة مئوية.
- أضف قارورة كاشف واحدة من المخزن المؤقت للتوازن وقارورتين كاشفتين لوضع العلامات على المخزن المؤقت إلى مواضع الكاشف واحد واثنين وثلاثة في الغرفة اليسرى HDX. تأكد من أن هذه الغرفة عند 20 درجة مئوية عن طريق ضبط وحدة التحكم في درجة حرارة بلتييه (انظر جدول المواد). أضف قارورة كاشف واحدة من المخزن المؤقت للإرواء إلى وضع الكاشف في الغرفة اليمنى HDX.
- أضف ثماني قوارير استرداد إجمالية في مواضع التفاعل في الغرفة اليسرى HDX وثمانية قوارير استرداد قصوى في مواضع التفاعل في الغرفة اليمنى HDX.
ملاحظة: لضمان التنظيف الكامل والحد الأقصى من قابلية التكرار للأحجام التي تم الاستغناء عنها ، ينصح بإجراء غسل حقنة وغسل رئيسي على محاقن أخذ العينات التلقائية. على سبيل المثال ، قم بتنفيذ سلسلة من (1) غسل ضعيف ، (2) غسل قوي ، (3) غسل ضعيف قبل بدء تجارب رسم الخرائط. يمكن تكرار هذا التسلسل على نطاق واسع ، ويوصى بالقيام بذلك حتى 20x أو حتى يتم ترطيب المحقنة بالكامل. - قم بإعداد قائمة نموذجية باستخدام أساليب LC و MS المناسبة في برنامج الجدولة وابدأ الجدول.
ملاحظة: بالنسبة لهذه الدراسة، يستخدم كرونوس كبرنامج جدولة (انظر جدول المواد).
- معالجة بيانات رسم الخرائط.
- تحديد الببتيدات من ملفات تجربة رسم الخرائط باستخدام البرامج المناسبة (انظر جدول المواد).
- استيراد بيانات تعريف الببتيد إلى DynamX (انظر جدول المواد) باستخدام معلمات عتبة الببتيد التالية: الحد الأدنى للكثافة = 5000 ، الحد الأدنى لطول التسلسل = 0 ، الحد الأقصى لطول التسلسل = 40 ، الحد الأدنى للمنتجات = 1 ، الحد الأدنى للمنتجات لكل حمض أميني = 0.25 ، الحد الأدنى للمنتجات المتتالية = 2 ، الحد الأدنى لكثافة المجموع للمنتجات = 0 ، الحد الأدنى للدرجة = 0 ، والحد الأقصى لخطأ MH+ (جزء في المليون) = 0.
ملاحظة: بدلا من ذلك، اشتق الإعدادات المحسنة وفقا لسير عمل موصى به28. - حدد البيانات من القائمة وانقر على استيراد نتائج PLGS. انقر فوق إضافة لاختيار ملفات البيانات ذات الصلة للتخصيص الطيفي. عند إضافة كل شيء ، انقر فوق التالي وأدخل إعدادات الفلتر أعلاه. ثم انقر فوق إنهاء.
- تنظيم التعيينات النظيرية يدويا للحصول على خريطة تغطية الببتيد النهائية ل aSyn في DynamX.
4. دراسة تبادل الهيدروجين / الديوتيريوم بالمللي ثانية
- قم بتنظيف أداة النموذج الأولي FastHDX (انظر جدول المواد) قبل بدء تجارب HDX.
- افتح واجهة المستخدم الرسومية لبرنامج HDX المتوافق واسمح للنظام بالتهيئة.
- أدخل درجة حرارة غرفة العينة على أنها 20 درجة مئوية وغرفة التبريد على أنها 0.5 درجة مئوية. انقر فوق تعيين لتطبيق درجات الحرارة الجديدة.
- قم بإعداد أنابيب الطرد المركزي بمياه LC-MS في جميع المداخل.
- في علامة التبويب تسليم السباكة المعايرة ، تحقق من كل من المحاقن اليسرى واليمنى وانقر فوق Prime لإزالة أي فقاعات هواء كامنة في الأنابيب. كرر ذلك حتى تختفي جميع الفقاعات.
- في علامة التبويب وحدات الماكرو ، حدد كافة المربعات الخاصة بالمحاقن. انقر على معايرة المحاقن موقف المنزل. انقر على غسل حلقة تحميل المحاقن. انقر على غسل جميع أحجام حلقة الخلط.
- كرر الخطوة 4.1.5. 1 مرة أكثر.
- إذا ظهرت أي فقاعات في المحاقن العازلة ، فقم بإزالة الغاز عن طريق فصل المحقنة وإخراج الفقاعة عموديا. استبدل المحقنة وأعد معايرتها إلى الموضع الصفري.
- قم بإعداد أداة FastHDX النموذجية لتجارب HDX.
- أضف 500 لتر من aSyn 5 μM المفلترة في قارورة استرداد كاملة وضعها داخل ثلاجة على الطاولة لمنع قلة القلة والتجميع الناجم عن درجة الحرارة.
- أضف 50 مل من المخازن المؤقتة للتوازن ووضع العلامات والتبريد إلى كل مخزن مؤقت (2. خطوات إعداد المخزن المؤقت HDX 1-3) مدخل في الغرف اليسرى واليمنى.
- أضف 50 مل من المخزن المؤقت لغسل العمود (2. HDX المخزن المؤقت خطوة إعداد 4) إلى مدخل غسل البيبسين.
- لتهيئة خطوط غسيل البروتين والأعمدة 1x ، تحقق من كل من المحاقن اليسرى واليمنى في علامة التبويب Titrator Plumbing Delivery وانقر فوق Prime مرة واحدة.
ملاحظة: أي نقرة لاحقة على Prime ستسبب تكرارات إضافية للعملية الأولية ، مما يؤدي إلى استهلاك كميات كبيرة من عينة البروتين. ينصح بالحرص على تجنب ذلك ، حتى عندما يكون هناك تأخير في البرنامج بعد محاولة النقر فوق زر. - كرر الخطوات 4.1.5. 1x.
- في علامة التبويب تدفق التبريد اليدوي ، أدخل الإعدادات المطلوبة، الموضحة في الخطوات 4.2.7.-4.2.10.
- بالنسبة لتجربة دورة زمنية، أدخل الأوقات بالمللي ثانية باستخدام زر النقاط الرمزية . إذا كانت النسخ المتماثلة مطلوبة، أضف نفس النقطة الزمنية عدة مرات، على سبيل المثال، للحصول على ثلاثة أضعاف من 50 مللي ثانية، يجب إدخال 50 50 50. يجب أن تتطابق قائمة العينات في برنامج مقياس الطيف الكتلي (يتم استخدام MassLynx هنا ، انظر جدول المواد) مع تلك النقاط الزمنية بالضبط.
ملاحظة: يجب استخدام أسماء ملفات قائمة عينة مطياف الكتلة و/أو نص العينة لضمان سجل دائم لأوقات وضع العلامات HDX المقابلة لتلك التي تم إدخالها في واجهة المستخدم الرسومية لبرنامج FastHDX. لن يتم تخزين أوقات وضع العلامات لكل عينة تشغيل في أي مكان آخر. - اضبط وقت الملائمة (بالدقائق) ليكون طول وقت الملائمة. هنا ، هو 3.00.
- اضبط الانتظار حتى HPLC (دقائق) = (وقت الملائمة + وقت التشغيل + 1.5 دقيقة).
ملاحظة: على سبيل المثال، بالنسبة لتجربة مع محاصرة لمدة 3 دقائق وتدرج لمدة 17 دقيقة، سيكون هذا 21.50 دقيقة. - انقر فوق المربع تشغيل فارغ فقط في حالة تشغيل تجارب فارغة بين عمليات تشغيل العينة. إذا كانت الإجابة بنعم ، فتأكد من إدخال (أي صف صالح في قائمة العينات) في البرنامج للتشغيل الفارغ بعد كل تشغيل عينة.
- بمجرد أن تصبح قائمة العينات جاهزة على البرنامج ، قم بتمييز الإدخالات المناسبة وابدأ التشغيل في البرنامج بالنقر فوق الزر " تشغيل" و FastHDX في البرنامج.
ملاحظة: بسبب تدافع الهيدروجين / الديوتيريوم ، يمكن استخدام طرق MS فقط أو تقنيات التجزئة الناعمة (تفكك نقل الإلكترون ، وتفكك التقاط الإلكترون ، وتفكك الأشعة فوق البنفسجية)29 فقط. بالنسبة ل aSyn عند درجة حموضة فسيولوجية تبلغ 7.40 ، فإن النقاط الزمنية التي تتراوح من 50 مللي ثانية إلى 300 ثانية هي الأكثر قابلية للتطبيق لأنها تغطي منحنى امتصاص الديوتيريوم8 بأكمله.
5. معالجة البيانات
- قم بتحميل ملف الببتيدات المعينة طيفيا من تجارب رسم خرائط الببتيد. افتح القائمة ملف وانقر على فتح في برنامج DynamX (انظر جدول المواد).
- استيراد الملفات الخام إلى برنامج قياس الكتلة المفضل (على سبيل المثال ، DynamX ، HDExaminer ، إلخ). افتح قائمة "البيانات" وانقر على ملفات MS. انقر فوق حالة جديدة لإنشاء حالات لكل حالة بروتين تمت دراستها.
- انقر فوق التعرض الجديد لإضافة كل نقطة زمنية HDX. انقر فوق RAW جديد لاستيراد ملفات .raw. اسحب كل ملف .raw إلى الموضع الصحيح. انقر فوق موافق عند الانتهاء.
- قم بتعيين النظائر تلقائيا أولا (وهذا تلقائي بعد الخطوة 5.2. أعلاه) ، ثم قم بتنظيم تعيين النظائر يدويا لضمان جودة بيانات عالية.
- تصدير بيانات الكتلة إلى ملف .csv يحتوي على أعمدة بالترتيب التالي: اسم البروتين، رقم بداية التسلسل، رقم نهاية التسلسل، التسلسل، التعديل، الشظايا، أقصى امتصاص ممكن، كتلة الأنواع أحادية النظائر، اسم الحالة، وقت التعرض، اسم الملف، الشحنة، وقت الاستبقاء، الكثافة، والمركز.
- افتح قائمة البيانات في برنامج قياس الكتلة وانقر على تصدير بيانات المجموعة.
6. تحليل البيانات
- قم بتحميل بيانات الكتلة المصدرة إلى برنامج تحليل HDX المفضل. هنا ، يتم استخدام HDfleX30 (انظر جدول المواد).
- تناسب البيانات التجريبية لجميع الببتيدات والحالات ، واختيار طرق تصحيح التبادل الخلفي المناسبة للحصول على ثوابت معدل الملاحظة لتفاعل HDX.
- احسب عتبة الأهمية العالمية بالطريقة المفضلة (يدعم HDfleX عدة خيارات لذلك) وقم بإجراء اختبار الدلالة الهجينة لتحديد الاختلافات الكبيرة عبر الولايات مقارنة ب31,32.
ملاحظة: إذا كان الفرق الملحوظ أكبر من العتبة العالمية وكانت القيمة p أقل من مستوى الثقة المختار (على سبيل المثال، 95٪)، يعتبر الفرق كبيرا.
النتائج
نظرا لطبيعته المضطربة في جوهره ، من الصعب التقاط التغيرات الهيكلية المعقدة في aSyn عند درجة الحموضة الفسيولوجية. يراقب HDX-MS تبادل النظائر في هيدروجينات أميد العمود الفقري ، ويبحث في ديناميكيات وتفاعلات تكوين البروتين. إنها واحدة من التقنيات القليلة للحصول على هذه المعلومات بدقة هيكلية وزمنية عالية. ينطبق هذا البروتوكول على نطاق واسع على مجموعة واسعة من البروتينات وظروف التخزين المؤقت ، ويتجلى ذلك في قياس حركية التبادل ل aSyn في حالتين مختلفتين من المحلول: الحالة A والحالة B8 ، كما هو محدد في الخطوات 2.1.-2.2.
أولا ، تم إجراء تجربة رسم خرائط على aSyn ، وتم الحصول على خريطة تغطية الببتيد ، كما هو موضح في الشكل 1. تغطي الخريطة 100٪ من تسلسل البروتين ويبلغ متوسط التكرار 3.79. تشير قيمة التغطية بنسبة 100٪ إلى أن جميع الأحماض الأمينية في البروتين تم العثور عليها في هضم البروتين وستمكن من إجراء تحليل شامل لسلوك تبادل aSyn. تشير قيمة التكرار إلى عدد الببتيدات المتداخلة. وتزيد قيمة التكرار الأعلى من الدقة الهيكلية للخريطة النهائية، نظرا للتسطيح المطروح للبيانات للببتيدات المتداخلة32.
وباستخدام النموذج الأولي لأداة التدفق التبخيري سريع الخلط (انظر جدول المواد)، جمعت بيانات HDX-MS عالية الجودة وذات مقياس زمني ميلي ثانية عن aSyn عند الرقم الهيدروجيني 7.4 في الحالة ألف والحالة باء (الشكل 2). وبعد تعيين نظير في DynamX، تم الحصول على منحنيات امتصاص الديوتيريوم "الخام"، كما هو مبين في الشكل 3A. يظهر منحنيات امتصاص لثلاثة ببتيدات مختارة عبر كل مجال بروتين. يتم عرض دمج الديوتيريوم بمرور الوقت. يقع المحور x على مقياس زمني بالمللي ثانية ، والذي يتوافق مع الحركيات السريعة جدا ل aSyn في الظروف الفسيولوجية. تظهر المنطقة المظللة باللون الأحمر البيانات التي يتم الحصول عليها عادة من أدوات HDX التقليدية ، مع قياسات تبدأ من 30 ثانية. والأهم من ذلك، أنه لا يمكن زيادة تخفيض هذا عن طريق التلاعب بالأس الهيدروجيني لما يسمى ب "توسيع النافذة الزمنية"؛ هذا النهج غير صالح لدراسة البروتينات / المناطق المضطربة في جوهرها ، لأن تحول الرقم الهيدروجيني سيزعج المجموعة التوافقية للببتيد المتعدد المستقر بشكل ضعيف. كما يتضح هنا ، يتم تبادل معظم aSyn بالكامل بواسطة 1 s (الشكل 3C). يوضح هذا أهمية قياسات HDX بالمللي ثانية ل aSyn الأحادي حيث يتم التقاط منحنى الامتصاص الحركي الكامل لتفاعل التبادل ، مما يؤدي إلى القياس الأكثر دقة لتشكيلات المونومر.
قام HDfleX بإجراء تصحيح التبادل الخلفي باستخدام دمج الديوتيريوم الهضبة. وتم تركيب نقاط البيانات لاحقا وفقا للمعادلة 1، مما يوفر ثابت معدل ملحوظ، kobs، مما يدل على إمكانية الوصول إلى المذيبات ومشاركة الترابط الهيدروجيني لهذا الببتيد المعين (الشكل 3B).
 المعادلة 1
المعادلة 1
حيث D t هو دمج الديوتيريوم في الوقت t ، nExp هو عدد المراحل الأسية ، N هو الحد الأقصى لعدد الهيدروجين الشفوي ، kobs هو ثابت سعر الصرف المرصود ، و β هو عامل تمدد30,33.
بعد تركيب المنحنى ، يمكن حساب منطقة الامتصاص تحت المنحنى المجهز عن طريق دمج الوظيفة المجهزة التي تصف منحنى الامتصاص داخل النافذة الزمنية التجريبية. تم إجراء تحليلات ذات دلالة إحصائية بين منطقة الاستيعاب في الدولتين. أولا ، تم حساب عتبة الأهمية العالمية لمنطقة الامتصاص في HDfleX عند مستوى ثقة قدره 95٪. ثم تم إنشاء مخططات فرق مساحة الامتصاص ، مما يدل على الفرق بين الحالة A والحالة B على مستويين من الدقة الهيكلية: دقة الببتيد (الشكل 4A) واستبانة الأحماض الأمينية (الشكل 4B). يوضح مخطط فرق دقة الببتيد الفرق في منطقة الامتصاص بين الحالة A والحالة B لكل ببتيد فردي ، بينما يوضح مخطط فرق دقة الأحماض الأمينية الفرق في منطقة الامتصاص بين الحالة A والحالة B المسطحة عبر تسلسل الأحماض الأمينية بالكامل من aSyn30,34. تشير كلتا المخططين إلى امتصاص أكبر للديوتيريوم بشكل عام في جميع أنحاء مونومر aSyn في الحالة B مقارنة بالحالة A. يمكن تبرير هذه النتيجة من خلال فحص مخططات امتصاص الديوتيريوم في الشكل 3 ، حيث يكون منحنى امتصاص الحالة B دائما أعلى من منحنى امتصاص الحالة A. علاوة على ذلك ، يمكن ملاحظة أن حجم الفرق في منطقة الامتصاص أعلى بكثير في المحطة C. مرة أخرى ، يمكن تبرير ذلك من خلال التتبع مرة أخرى إلى منحنيات الامتصاص الأصلية ، حيث تظهر الببتيدات الطرفية C (الببتيدات 124-140 الموضحة في الشكل 3) فجوة أكبر بكثير بين منحنيات الامتصاص من بقية البروتين. في الختام ، تسبب ظروف الحل في الحالة B زيادة في التعرض للمذيبات أو انخفاضا في مشاركة شبكة الترابط الهيدروجيني في جميع أنحاء البروتين ولكن أكثر من ذلك في المحطة C.

الشكل 1: خريطة تغطية الببتيد ل aSyn من النوع البري مع ما مجموعه 30 ببتيدا وتغطية تسلسل 100٪. يتم تمييز المجالات الثلاثة ل aSyn على النحو التالي: N-terminus (أزرق) ، ومنطقة مكون بيتا غير أميلويد (أصفر) ، و C-terminus (أحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: سير العمل لتجربة HDX-MS بالمللي ثانية على aSyn. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: مثال على مخططات الامتصاص من ثلاثة ببتيدات مختارة عبر المجالات الثلاثة ل aSyn للحالة A (الأصفر) والحالة B (الأزرق). (A) مؤامرة الامتصاص المصححة غير المجهزة وغير التبادلية الخلفية. (ب) قطع الامتصاص المصححة والمجهزة والتبادل الخلفي. تمثل المنطقة المظللة باللون الأحمر البيانات التي يمكن الحصول عليها بواسطة أنظمة HDX-MS التقليدية ، والتي تبدأ عادة من 30 ثانية. تتوافق أشرطة الخطأ مع الانحراف المعياري للنسخ المتماثلة الثلاثة. (ج) مخطط خريطة الحرارة للنسبة المئوية لامتصاص الديوتيريوم عبر تسلسل الأحماض الأمينية لكل نقطة زمنية. يمثل شريط اللون النسبة المئوية لامتصاص الديوتيريوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
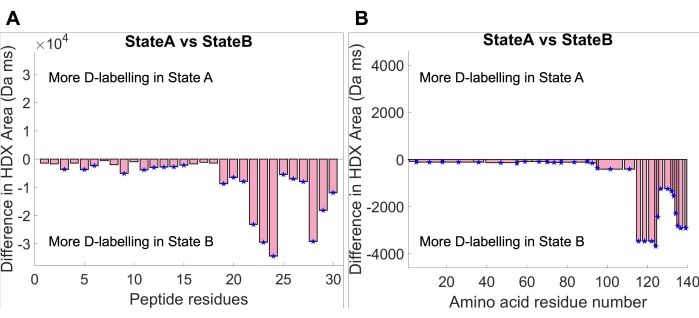
الشكل 4: مخططات فرق مساحة الامتصاص عند أقصى وقت لهضبة المنحنى (14084 مللي ثانية) (أ) تظهر مخططات استبانة بقايا الببتيد فرق منطقة امتصاص كل ببتيد بين الحالة ألف والحالة ب. (ب) مخطط استبانة الأحماض الأمينية الذي يوضح فرق مساحة الامتصاص بين الحالة ألف والحالة باء التي تم تسويتها عبر تسلسل الأحماض الأمينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رسم خرائط مستوى الطاقة | الجهد المنحدر (V) |
| منخفض | 20-40 |
| متوسط | 25-45 |
| عال | 30-50 |
| مرتفع جدا | 35-55 |
الجدول 1: رسم خرائط لمستويات الطاقة والجهد اللاحق لمنحدر النقل.
Discussion
في هذه المقالة ، يتم وصف الإجراءات التالية: (1) إجراء تجارب رسم خرائط الببتيد على aSyn الأحادي للحصول على أعلى تغطية تسلسلية ، (2) الحصول على بيانات HDX-MS بالمللي ثانية على aSyn الأحادي في ظل الظروف الفسيولوجية ، و (3) إجراء تحليل البيانات وتفسير بيانات HDX-MS الناتجة. الإجراءات المقدمة سهلة التنفيذ بشكل عام ، وعادة ما تستمر كل تجربة وضع علامات حوالي 8 ساعات فقط لثلاث نسخ متماثلة وثماني نقاط زمنية ، وتستمر تجربة رسم الخرائط حوالي 2 ساعة فقط. بالنظر إلى الأجهزة الآلية بالكامل المستخدمة هنا ، يمكن الحصول على مجموعة بيانات كاملة في يوم 1. ومع ذلك ، عند التعامل مع العينات وإعداد المخازن المؤقتة ، يجب توخي الحذر لضمان اشتقاق القياسات من البروتين المستقر بشكل ضعيف (أو مناطق البروتين) في الحالة المطلوبة. الأهم من ذلك ، أظهرت دراسة سابقة أن ظروف التخزين المختلفة ، مثل التجميد والتجميد ، أدت إلى مطابقات مختلفة لمونومر aSyn وأنه من المهم توصيف التأثير المحتمل لمعالجة العينات على المجموعة التوافقية لمونومر aSyn10. في الواقع ، HDX-MS هو مقياس حساس للغاية لمثل هذه الاضطرابات التوافقية ، مع نطاق ديناميكي من ميكروثانية إلى أشهر على الأقل. بالإضافة إلى ذلك ، إذا كانت تدرس بدقة مونومر aSyn فقط ، ينصح بشدة بالترشيح لإزالة الأوليغومرات والألياف غير المرغوب فيها التي قد تكون تشكلت في العينة عند التخزين أو المناولة. وعلاوة على ذلك، يجب التحكم بإحكام في المخازن المؤقتة HDX-MS في حدود 0.05 من الرقم الهيدروجيني أو pD المطلوب، لأن أي تناقضات ستؤثر بشكل كبير على سعر الصرف الجوهري وتؤدي إلى أخطاء غير مرغوب فيها. من المهم أيضا ملاحظة أن المقارنات بين ظروف المحلول لأي بروتين يختلف في درجة الحموضة أو درجة الحرارة أو تكوين الملح ستغير المعدل الداخلي. ولذلك، ستتطلب هذه البيانات مزيدا من التصحيحات، مثل تطبيق عامل تعديل الأس الهيدروجيني 35 أو عامل التصحيح التجريبي 8,30.
من حيث الأجهزة ، لا توجد أنظمة متاحة تجاريا تسمح بالحصول على بيانات HDX-MS بالمللي ثانية. طورت العديد من المجموعات البحثية أنظمتها الخاصة ، من أنظمة تدفق التبريد13،15،36 إلى رقائق الموائع الدقيقة37،38،39 لالتقاط حركية التبادل السريع لبعض البروتينات. تعرف طريقة أخرى تم استخدامها لتحقيق بيانات HDX-MS ذات المقياس الزمني بالمللي ثانية باسم طريقة التوسع الزمني40,41 ، حيث يتم تقليل الرقم الهيدروجيني للمخازن المؤقتة لإبطاء حركية التبادل. ومع ذلك ، لا تنطبق هذه الطريقة على aSyn (أو على أي ميزات بروتين مستقرة بشكل ضعيف) حيث أن (1) خفض الرقم الهيدروجيني يغير بشكل كبير كثافة شحنة البروتين ويزيد من معدل التجميع 8,42 ، و (2) تكون مطابقات aSyn مستقرة فقط ومن المحتمل أن تنزعج من هذه التغييرات في الأس الهيدروجيني. لهذه الأسباب ، يوصى بالحفاظ على درجة حموضة متسقة في المخازن المؤقتة HDX-MS عند دراسة تشكيلات aSyn الأحادية ، ما لم تكن ذات صلة من الناحية الفسيولوجية ، واستخدام أداة وضع العلامات بالمللي ثانية.
معظم مونومر aSyn يتبادل بالكامل في غضون 1 ثانية ، وعلى الأكثر ، يستغرق الأمر حوالي 15 ثانية للتبادل الكامل مع الديوتيريوم (الشكل 3) عند درجة حموضة ذات صلة فسيولوجيا تبلغ 7.4 (تعكس الظروف الخلوية داخل الخلايا في ما قبل المشبك العصبي). إن استخدام أنظمة HDX-MS التقليدية ، بدءا من 30 ثانية غير مناسب لأن بيانات HDX-MS تتوافق مع هضبة تفاعل التبادل ، والتي لا توفر أي معلومات توافقية مفيدة. ومع ذلك ، فإن الحد الأدنى لقياس أداة HDX بالمللي ثانية (المقابلة ل "الوقت الميت" البالغ 50 مللي ثانية) يتيح مراقبة تفاعل التبادل من إكمال ~ 25٪ لمونومر aSyn عند درجة الحموضة 7.4. سمح لنا ذلك بالتقاط غالبية منحنى الامتصاص الحركي. يوفر تركيب منحنى امتصاص الديوتيريوم مع المعادلة 1 معلومات حركية مهمة. وهو يتوافق مع تقدير ثابت المعدل المرصود ، kobs. على الرغم من عدم تغطيتها هنا ، إلا أنه من الممكن إجراء تجارب حركية التجميع وفحص مورفولوجيا الألياف في aSyn تحت نفس ظروف الحل مثل تجارب HDX-MS لأن HDX-MS متسامح للغاية مع مجموعة واسعة من المخازن المؤقتة8. وهكذا ، على سبيل المثال ، يمكن ربط kobs من تجربة HDX-MS بنتائج تجارب التجميع لاكتساب نظرة ثاقبة حول أي التكوينات هي الأكثر عرضة لبعض سلوكيات التجميع ومورفولوجيا الليف.
بالنسبة للحالة البسيطة لتجارب HDX-MS التفاضلية ، حيث يجب مقارنة شرطين أو أكثر من متغيرات البروتين ، يمكن دمج المنطقة الموجودة تحت منحنى الامتصاص المجهز لكل حالة ومقارنتها ببعضها البعض. وفي هذه الدراسة، تمت مقارنة مناطق الاستيعاب في الدولة ألف والدولة باء على مستويين مختلفين من الاستبانة الهيكلية: استبانة الببتيد واستبانة الأحماض الأمينية، وكلاهما له نقاط قوة وتحديات متميزة. فعلى سبيل المثال، تعكس بيانات استبانة الببتيد البيانات الطيفية الخام بشكل أوثق وخضعت لأقل قدر من المعالجة. ومع ذلك ، فإن بيانات استبانة الأحماض الأمينية "المسطحة" تسمح بدمج كل من معلومات الببتيد والتجزئة الناعمة في ناتج واحد بدلا من مخرجات منفصلة غير قابلة للدمج ، وفي النهاية ، تقدم البيانات بأعلى دقة هيكلية. أحد القيود المفروضة على الكشف عن قياس الطيف الكتلي لوضع العلامات HDX هو التحدي المتمثل في الحصول على دقة الأحماض الأمينية. في حين أن تقنيات "التجزئة الناعمة" ، مثل تفكك نقل الإلكترون (ETD) ، وتفكك التقاط الإلكترون (ECD) ، والتفكك الضوئي فوق البنفسجي (UVPD) ، أثبتت فعاليتها في توليد دقة أعلى ، إلا أنها لا تزال صعبة وغير متوقعة وغير فعالة30،43،44،45،46،47،48.
بالمقارنة مع التقنيات الهيكلية الأخرى ، يتمتع HDX-MS بالمللي ثانية بميزة فريدة تتمثل في التقاط الديناميكيات التوافقية ل aSyn الأحادي بدقة هيكلية وزمنية عالية. نظرا لأن حركية التبادل السريع للمونومر لم تعد عاملا مقيدا ، يمكن إجراء المزيد من الدراسات على aSyn الأحادي مع طفرات مختلفة ، وتعديلات ما بعد الترجمة ، ومكونات الملح وتركيزاته ، وشركاء الربط في درجة الحموضة الفسيولوجية. يمكن أن يوفر ربط نتائج HDX-MS بالدراسات الوظيفية ، مثل حركية التجميع ومورفولوجيا الألياف ، نظرة ثاقبة على المطابقات التي إما تعزز الوظيفة الخلوية الطبيعية أو تكون عرضة للأمراض. في نهاية المطاف، من المتوقع أن يكون هذا المللي ثانية HDX-MS حاسما لاكتشاف الأدوية المستهدفة التي تعمل على استقرار مطابقات محددة مقبولة من الناحية الفسيولوجية.
Disclosures
ويعلن صاحبا البلاغ عدم وجود مصالح متنافسة.
Acknowledgements
يتم تمويل NS من قبل منحة اليوبيل الماسي لمجلس الجامعة. يتم دعم JJP من خلال زمالة UKRI Future Leaders [رقم المنحة: MR/T02223X/1].
Materials
| Name | Company | Catalog Number | Comments |
| 1 × 100 mm ACQUITY BEH 1.7 μm C18 column | Waters Corporation | 186002346 | Analytical column |
| Acetonitrile HPLC grade >99.9% HiPerSolv | VWR | 20060.420 | For LC mobile phases |
| CaCl2 | Sigma Aldrich | C5670 | Salt for HDX buffers |
| Chronos | Axel Semrau (Purchased from Waters Corporation) | 667006090 | Scheduling software to enable multiple HDX-MS sample injections automatically. Alternative software is available from other vendors e.g. HDXDirector or LEAP Shell |
| Deuterium chloride | Goss Scientific (Cambridge Isotope Laboratories) | DLM-2-50 | For HDX labelling buffers |
| Deuterium oxide (99.9% D2O) | Goss Scientific (Cambridge Isotope Laboratories) | DLM-4 | Deuterated water |
| DynamX 3.0 | Waters Corporation | 176016027 | Isotopic assignment and deuterium incorporation calculation |
| Enzymate BEH Pepsin Column | Waters Corporation | 186007233 | Pepsin digestion column |
| Formic Acid, 99.0% LC/MS Grade | Fisher Scientific | 10596814 | For LC mobile phases |
| Guanidinium hydrochloride | Sigma Aldrich | RDD001-500G | Chaotrope/Denaturant |
| HDfleX | University of Exeter | N/A | https://ore.exeter.ac.uk/repository/handle/10871/127982 |
| KCl | Sigma Aldrich | P3911 | Salt for HDX buffers |
| LEAP HDX-2 CTC PAL sampling robot | Waters Corporation | 725000637 | Autosampler robot |
| Leucine enkephalin | Waters Corporation | 186006013 | For mass spectrometry lockspray calibration. |
| MassLynx | Waters Corporation | 667004007 | Software controlling inlet methods and mass spectrometer |
| Maximum recovery vials | Waters Corporation | 600000670CV | 100 pack including caps - used for quench tray in LEAP HDX-2 |
| MgCl2 | Sigma Aldrich | M8266 | Salt for HDX buffers |
| Millipore 0.22 µm syringe filters | Millipore | N9CA7069B | Syringe filters |
| ms2min | Applied Photophysics Ltd | N/A | fast-mix quench-flow millisecond hdx instrument |
| NaCl | Sigma Aldrich | S9888 | Salt for HDX buffers |
| Peltier temperature controller | LEAP Technologies Inc. | HP115-COOL/D | Peltier controller to set precise temperature of chambers in the LEAP robot. |
| ProteinLynx Global Server 3.0 | Waters Corporation | 715001030 | Peptide identification software. Alternative software is available from other vendors. |
| Reagent pot caps | Waters Corporation | 186004632 | 100 pack |
| Reagent pots for LEAP HDX-2 | Waters Corporation | 186001420 | 100 pack excluding caps - used for buffers in LEAP HDX-2 |
| Sodium deuteroxide (99.5% in D2O) | Goss Scientific (Cambridge Isotope Laboratories) | DLM-57 | For HDX labelling buffers |
| Spin filter microcentrifuge tubes (3 kDa MWCO) | Amicon (Merck Sigma Aldrich) | UFC5003 | Micro centrifuge tubes to concentrate protein. This facilitates buffer exchange and accurate sample loading for HDX-MS experiments. |
| Synapt G2-Si mass spectrometer | Waters Corporation | 176850035 | Mass spectrometer |
| Total recovery vials | Waters Corporation | 600000671CV | 100 pack including caps - used for labelling tray in LEAP HDX-2 |
| Tris-HCl | Sigma Aldrich | T3253-250G | Buffer |
| Trizma base | Sigma Aldrich | T60040-B2005 | Buffer |
| Urea | Sigma Aldrich | U5378-1KG | Chaotrope/Denaturant |
| VanGuard 2.1 x 5 mm ACQUITY BEH C18 column | Waters Corporation | 186004623 | Trap desalting column |
References
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology. 17 (11), 939-953 (2018).
- Breydo, L., Wu, J. W., Uversky, V. N. α-Synuclein misfolding and Parkinson's disease. Biochimica et Biophysica Acta (BBA): Molecular Basis of Disease. 1822 (2), 261-285 (2012).
- Dedmon, M. M., Lindorff-Larsen, K., Christodoulou, J., Vendruscolo, M., Dobson, C. M. Mapping long-range interactions in α-synuclein using spin-label NMR and ensemble molecular dynamics simulations. Journal of the American Chemical Society. 127 (2), 476-477 (2005).
- Esteban-Martín, S., Silvestre-Ryan, J., Bertoncini, C. W., Salvatella, X. Identification of fibril-like tertiary contacts in soluble monomeric α-synuclein. Biophysical Journal. 105 (5), 1192-1198 (2013).
- McClendon, S., Rospigliosi, C. C., Eliezer, D. Charge neutralization and collapse of the C-terminal tail of alpha-synuclein at low pH. Protein Science. 18 (7), 1531-1540 (2009).
- Ranjan, P., Kumar, A. Perturbation in long-range contacts modulates the kinetics of amyloid formation in α-synuclein familial mutants. ACS Chemical Neuroscience. 8 (10), 2235-2246 (2017).
- Villar-Piqué, A., da Fonseca, T. L., Outeiro, T. F. Structure, function and toxicity of alpha-synuclein: the Bermuda triangle in synucleinopathies. Journal of Neurochemistry. 139, Suppl 1 240-255 (2015).
- Seetaloo, N., Zacharopoulou, M., Stephens, A. D., Schierle, G. S. K., Phillips, J. J. Local structural dynamics of alpha-synuclein correlate with aggregation in different physiological conditions. bioRxiv. , (2022).
- Stephens, A. D., et al. Extent of N-terminus exposure of monomeric alpha-synuclein determines its aggregation propensity. Nature Communications. 11 (1), 2820(2020).
- Stephens, A. D., et al. Different structural conformers of monomeric α-synuclein identified after lyophilizing and freezing. Analytical Chemistry. 90 (11), 6975-6983 (2018).
- Lautenschläger, J., et al. C-terminal calcium binding of α-synuclein modulates synaptic vesicle interaction. Nature Communications. 9 (1), 712(2018).
- Oganesyan, I., Lento, C., Tandon, A., Wilson, D. J. Conformational dynamics of α-synuclein during the interaction with phospholipid nanodiscs by millisecond hydrogen-deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 32 (5), 1169-1179 (2021).
- Keppel, T. R., Weis, D. D. Analysis of disordered proteins using a simple apparatus for millisecond quench-flow H/D exchange. Analytical Chemistry. 85 (10), 5161-5168 (2013).
- Al-Naqshabandi, M. A., Weis, D. D. Quantifying protection in disordered proteins using millisecond hydrogen exchange-mass spectrometry and peptic reference peptides. Biochemistry. 56 (31), 4064-4072 (2017).
- Kish, M., et al. Allosteric regulation of glycogen phosphorylase solution phase structural dynamics at high spatial resolution. bioRxiv. , (2019).
- El-Amine, M., et al. Mechanisms of tolerance induction by a gene-transferred peptide-IgG fusion protein expressed in B lineage cells. Journal of Immunology. 165 (10), 5631-5636 (2000).
- Kishimoto, S., et al. Site-specific chemical conjugation of antibodies by using affinity peptide for the development of therapeutic antibody format. Bioconjugate Chemistry. 30 (3), 698-702 (2019).
- Xu, W., et al. A protein-based, long-acting HIV-1 fusion inhibitor with an improved pharmacokinetic profile. Pharmaceuticals. 15 (4), 424(2022).
- Frías, J. P., et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. The New England Journal of Medicine. 385 (6), 503-515 (2021).
- Gerstein, H. C., et al. Cardiovascular and renal outcomes with efpeglenatide in type 2 diabetes. The New England Journal of Medicine. 385 (10), 896-907 (2021).
- Largy, E., Gabelica, V. Native hydrogen/deuterium exchange mass spectrometry of structured DNA oligonucleotides. Analytical Chemistry. 92 (6), 4402-4410 (2020).
- Marcsisin, S. R., Engen, J. R. Hydrogen exchange mass spectrometry: What is it and what can it tell us. Analytical and Bioanalytical Chemistry. 397 (3), 967-972 (2010).
- Glasoe, P. K., Long, F. A. Use of glass electrodes to measure acidities in deuterium oxide. Journal of Physical Chemistry. 64 (1), 188-190 (1960).
- Krȩzel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Mayerhöfer, T. G., Pahlow, S., Popp, J. The Bouguer-Beer-Lambert law: Shining light on the obscure. ChemPhysChem. 21 (18), 2029-2046 (2020).
- Gasteiger, E., et al. The Proteomics Protocols Handbook. , Springer. New York. 571-607 (2005).
- Bateman, R. H., et al. A novel precursor ion discovery method on a hybrid quadrupole orthogonal acceleration time-of-flight (Q-TOF) mass spectrometer for studying protein phosphorylation. Journal of the American Society for Mass Spectrometry. 13 (7), 792-803 (2002).
- Sørensen, L., Salbo, R. Optimized workflow for selecting peptides for HDX-MS data analyses. Journal of the American Society for Mass Spectrometry. 29 (11), 2278-2281 (2018).
- Demmers, J. A. A., Rijkers, D. T. S., Haverkamp, J., Killian, J. A., Heck, A. J. R. Factors affecting gas-phase deuterium scrambling in peptide ions and their implications for protein structure determination. Journal of the American Chemical Society. 124 (37), 11191-11198 (2002).
- Seetaloo, N., Kish, M., Phillips, J. J. HDfleX: Software for flexible high structural resolution of hydrogen/deuterium-exchange mass spectrometry data. Analytical Chemistry. 94 (11), 4557-4564 (2022).
- Hageman, T. S., Weis, D. D. Reliable identification of significant differences in differential hydrogen exchange-mass spectrometry measurements using a hybrid significance testing approach. Analytical Chemistry. 91 (13), 8008-8016 (2019).
- Hageman, T. S., Weis, D. D. A structural variant approach for establishing a detection limit in differential hydrogen exchange-mass spectrometry measurements. Analytical Chemistry. 91 (13), 8017-8024 (2019).
- Chetty, P. S., et al. Helical structure and stability in human apolipoprotein A-I by hydrogen exchange and mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19005-19010 (2009).
- Keppel, T. R., Weis, D. D. Mapping residual structure in intrinsically disordered proteins at residue resolution using millisecond hydrogen/deuterium exchange and residue averaging. Journal of the American Society for Mass Spectrometry. 26 (4), 547-554 (2015).
- Li, J., Rodnin, M. V., Ladokhin, A. S., Gross, M. L. Hydrogen-deuterium exchange and mass spectrometry reveal the pH-dependent conformational changes of diphtheria toxin T domain. Biochemistry. 53 (43), 6849-6856 (2014).
- Roder, H., Elöve, G. A., Englander, S. W. Structural characterization of folding intermediates in cytochrome c by H-exchange labelling and proton NMR. Nature. 335 (6192), 700-704 (1988).
- Rob, T., et al. Measuring dynamics in weakly structured regions of proteins using microfluidics-enabled subsecond H/D exchange mass spectrometry. Analytical Chemistry. 84 (8), 3771-3779 (2012).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13 (13), 2528-2532 (2013).
- Svejdal, R. R., Dickinson, E. R., Sticker, D., Kutter, J. P., Rand, K. D. Thiol-ene microfluidic chip for performing hydrogen/deuterium exchange of proteins at subsecond time scales. Analytical Chemistry. 91 (2), 1309-1317 (2018).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of The American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Coales, S. J., E, S. Y., Lee, J. E., Ma, A., Morrow, J. A., Hamuro, Y. Expansion of time window for mass spectrometric measurement of amide hydrogen/deuterium exchange reactions. Rapid Communications in Mass Spectrometry. 24 (24), 3585-3592 (2010).
- Hoyer, W., et al. Dependence of alpha-synuclein aggregate morphology on solution conditions. Journal of Molecular Biology. 322 (2), 383-393 (2002).
- Rand, K. D., Pringle, S. D., Morris, M., Engen, J. R., Brown, J. M. ETD in a traveling wave ion guide at tuned Z-spray ion source conditions allows for site-specific hydrogen/deuterium exchange measurements. Journal of the American Society for Mass Spectrometry. 22 (10), 1784-1793 (2011).
- Kan, Z. Y., Ye, X., Skinner, J. J., Mayne, L., Englander, S. W. ExMS2: An integrated solution for hydrogen-deuterium exchange mass spectrometry data analysis. Analytical Chemistry. 91 (11), 7474-7481 (2019).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Characterizing short-lived protein folding intermediates by top-down hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (20), 8591-8597 (2010).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Mistarz, U. H., et al. Photodissociation mass spectrometry accurately localizes sites of backbone deuteration in peptides. Analytical Chemistry. 90 (2), 1077-1080 (2017).
- Phillips, J. J., et al. Rate of asparagine deamidation in a monoclonal antibody correlating with hydrogen exchange rate at adjacent downstream residues. Analytical Chemistry. 89 (4), 2361-2368 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved