Method Article
ספקטרומטריית מסות חילופי מימן/דאוטריום של אלפיות השנייה לחקר הדינמיקה המבנית של אלפא-סינוקלאין בתנאים פיזיולוגיים
In This Article
Summary
ההרכב המבני של אלפא-סינוקלאין מונומרי משפיע על תפקודו הפיזיולוגי ועל תכונותיו הפיזיקוכימיות. הפרוטוקול הנוכחי מתאר כיצד לבצע ספקטרומטריית מסות חילופי מימן/דאוטריום של אלפיות השנייה וניתוחי נתונים מאוחרים יותר כדי לקבוע מידע קונפורמי על המונומר של חלבון זה בעל הפרעה פנימית בתנאים פיזיולוגיים.
Abstract
אלפא-סינוקלאין (aSyn) הוא חלבון בעל הפרעה פנימית, שאגרגטי הפיברילאר שלו מצויים בשפע בגופי לוי ובנוייריטים, שהם סימני ההיכר של מחלת הפרקינסון. עם זאת, חלק גדול מהפעילות הביולוגית שלו, כמו גם הצבירה שלו, כוללים באופן מרכזי את צורת המונומר המסיסה של החלבון. הבהרת המנגנונים המולקולריים של הביולוגיה והפתופיזיולוגיה של aSyn דורשת שיטות פתורות מאוד מבחינה מבנית והיא רגישה לתנאים ביולוגיים. המבנים המטא-יציבים שלה, המתגלגלים באופן מקורי, הופכים את ה-aSyn המונומרי לבלתי ניתן לתיקון לטכניקות רבות של ביולוגיה מבנית. כאן מתואר היישום של גישה אחת כזו: ספקטרומטריית מסה של חילופי מימן/דאוטריום (HDX-MS) על ציר הזמן של אלפית השנייה לחקר חלבונים עם יציבות תרמודינמית נמוכה וגורמי הגנה חלשים, כגון aSyn. בקנה מידה של אלפית השנייה, נתוני HDX-MS מכילים מידע על נגישות הממס ועל המבנה הקשור למימן של aSyn, אשר הולכים לאיבוד בזמני תיוג ארוכים יותר, ובסופו של דבר מניבים רזולוציה מבנית עד לרמת חומצות האמינו. לכן, HDX-MS יכול לספק מידע ברזולוציות מבניות וטמפורליות גבוהות על דינמיקה קונפורמציה ותרמודינמיקה, אינטראקציות תוך-מולקולריות ובין-מולקולריות, וההשפעה המבנית של מוטציות או שינויים בתנאים הסביבתיים. למרות שהוא ישים באופן נרחב, הוא מודגם כיצד לרכוש, לנתח ולפרש מדידות HDX-MS של אלפיות השנייה ב- aSyn מונומרי.
Introduction
מחלת פרקינסון (PD) היא מחלה נוירודגנרטיבית המשפיעה על מיליוני אנשים ברחבי העולם1. הוא מאופיין על ידי היווצרות של תכלילים ציטופלסמיים הידועים בשם גופי לוי ונויריטים לוי באזור substantia nigra pars compacta של המוח. תכלילים ציטופלסמיים אלה נמצאו כמכילים אגרגטים של החלבון aSyn2 בעל הפרעה פנימית. ב-PD ובסינוקלינופתיות אחרות, aSyn הופך ממצב של הפרעה מסיסה למצב מחלה בלתי מסיס ומובנה מאוד. בצורתו המקורית, aSyn מונומרית מאמצת מגוון רחב של קונפורמציות המיוצבות על ידי אינטראקציות אלקטרוסטטיות ארוכות טווח בין N ו-C-termini שלה לבין אינטראקציות הידרופוביות בין C-terminus שלה לבין רכיב בטא שאינו עמילואידי (NAC) באזור 3,4,5,6. כל שיבוש באותן אינטראקציות מייצבות, כגון מוטציות, שינויים לאחר תרגום ושינויים בסביבה המקומית, יכול להוביל לקיפול שגוי של המונומר, ובכך לעורר את תהליך הצבירה7.
בעוד שקיימת כמות עצומה של מחקר על הצורות האוליגומריות והפיברילאריות של aSyn 8,9,10,11, יש צורך מכריע לחקור את הצורה המונומרית של החלבון ולהבין טוב יותר אילו קונפורמרים מתפקדים (וכיצד) ואילו נוטים לצבור 8,9,10,11 . בהיותו בעל הפרעה פנימית, רק בגודל 14 kDa, וקשה להתגבש, המונומר aSyn אינו מקובל על רוב הטכניקות הביולוגיות המבניות. עם זאת, טכניקה אחת המסוגלת למדוד את הדינמיקה הקונפורמיונלית של aSyn מונומרית היא אלפית השנייה HDX-MS, אשר יצרה לאחרונה תצפיות מבניות חשובות שיהיו מאתגרות או בלתי אפשריות להשיג אחרת 12,13,14. אלפית השנייה HDX-MS מודדת ברגישות את הממוצע של ההרכב הקונפורמציה של החלבון על ידי ניטור ההחלפה האיזוטופית באמיד מימן, מה שמעיד על נגישות ממסים והשתתפות ברשת קשרי מימן של אזור חלבון מסוים על ציר הזמן של אלפית השנייה. יש צורך להדגיש את ההיבט של אלפית השנייה של HDX-MS שכן, בשל אופיו המטא-יציב, המתגלגל באופן מקורי, aSyn מציג קינטיקה מהירה מאוד של חילופי מימן המתבטאת הרבה מתחת לגבול התחתון של מערכות HDX-MS קונבנציונליות. לדוגמה, רוב מולקולת aSyn החליפה לחלוטין מימן עבור דאוטריום בתנאים תוך תאיים בפחות משנייה אחת. מספר מעבדות בנו כעת מכשור ערבוב מהיר; במקרה זה, אב טיפוס של מכשיר זרימת מרווה מהיר בערבוב מהיר המסוגל לבצע HDX-MS עם זמן מת של 50 אלפיות השנייה ורזולוציה זמנית של 1 אלפיות השנייה משמש15. בעוד אלפית השנייה HDX-MS היה לאחרונה חשוב מאוד במחקר של aSyn, זה עומד להיות בעל ערך בחקר חלבונים / אזורים מופרעים במהותם באופן נרחב יותר ומספר רב של חלבונים עם לולאות / אזורים שהם רק יציבים חלשה. לדוגמה, תרופות פפטידיות (למשל, אינסולין; GLP-1/גלוקגון; tirzepatide) וחלבוני היתוך פפטידים (למשל, מעכב ה- HIV FN3-L35-T1144) הם פורמטים עיקריים של תרופות שבהן מידע מבני ויציבות בשלב התמיסה יכול להיות קלט קריטי להחלטות פיתוח תרופות, ובכל זאת, הפפטיד מואטי הוא לעתים קרובות רק יציב חלש ובלתי ניתן לתיקון על ידי HDX-MS בלוח הזמנים של השניות 16,17,18,19,20 . שיטות HDX-MS מתפתחות עם תיוג בתחומים של שניות/דקות הוכחו כמפיקות מידע מבני עבור דנ"א G-quadxes, אך יש לאפשר להרחיב זאת למבנים אוליגונוקלאוטידים מגוונים יותר על ידי יישום של אלפית השנייה HDX-MS21.
ניסויי HDX-MS יכולים להתבצע בשלוש רמות שונות: (1) מלמטה למעלה (לפיה החלבון המסומן מתעכל באופן פרוטאוליטי), (2) אמצע-מטה (לפיו החלבון המסומן מתעכל באופן פרוטאוליטי, והפפטידים המתקבלים מקוטעים עוד יותר על ידי טכניקות פיצול רך), ו-(3) מלמעלה למטה (לפיהם טכניקות פיצול רך מפרקות ישירות את החלבון המסומן)22 . לפיכך, נתוני HDX-MS תת-מולקולריים מאפשרים לנו להתאים את התנהגות החליפין לאזורים ספציפיים של חלבון, מה שהופך את זה לחיוני שיהיה כיסוי רצפים הולם לניסויים כאלה. הרזולוציה המבנית של כל ניסוי HDX-MS מסתמכת על מספר הפפטידים או השברים הפרוטאוליטיים שמקורם בחלבון בעת העיכול או בפיצול רך, בהתאמה. בכל אחד משלושת סוגי הניסויים שתוארו לעיל, השינוי בחילופי האמיד בכל פפטיד/מקטע ממופה בחזרה למבנה הראשוני של החלבון כדי להצביע על התנהגותם של אזורים מקומיים של החלבון. בעוד שהרזולוציה המבנית הגבוהה ביותר מושגת באמצעות פיצול רך, התיאור של ניסויים אלה הוא מחוץ לתחום המחקר הנוכחי, המתמקד במדידת קונפורמציות מונומר aSyn. תוצאות מצוינות ניתן להשיג עם זרימת העבודה הנפוצה "מלמטה למעלה" המתוארת כאן.
כאן, ניתנים נהלים על (1) כיצד להכין ולטפל בדגימות aSyn ובמאגרי HDX-MS, (2) כיצד לבצע מיפוי פפטידים עבור ניסוי HDX-MS מלמטה למעלה, (3) כיצד לרכוש נתוני HDX-MS על aSyn מונומרי בתנאים פיזיולוגיים, במיוחד בתחום הזמן של אלפית השנייה (באמצעות מכשיר שנבנה בהתאמה אישית; תוארו גם מכשירים חלופיים לתיוג אלפיות השנייה), וכן (4) כיצד לעבד ולנתח את נתוני HDX-MS. שיטות המשתמשות ב- aSyn מונומרי ב- pH פיזיולוגי (7.40) בשני מצבי תמיסה מודגמות כאן. למרות שהם שימושיים באופן קריטי במחקר של aSyn, הליכים אלה יכולים להיות מיושמים על כל חלבון ואינם מוגבלים לחלבונים עם הפרעה פנימית.
Protocol
1. ביטוי חלבונים וטיהור של aSyn
- הכן aSyn בעקבות דו"ח9 שפורסם בעבר.
- דיאליזה למאגר אחסון בטוח (למשל, Tris, pH 7.2 ).
- במידת הצורך, רכזו את הדגימה (לדוגמה, צינורות מיקרו-צנטריפוג' של מסנן ספין באמצעות 3 kDa MWCO, 14,000 x g למשך כ-10-30 דקות, ראו טבלת חומרים).
הערה: מומלץ לא להתרכז יתר על המידה. שלמות אנסמבל המונומרים לא אומתה מעבר ל-25 μM. - Aliquot וחנות ב- −80 °C
הערה: חלבון המונומר aSyn יציב עד שנה בתנאי אחסון אלה.
2. הכנת מאגר HDX
הערה: מכיוון שלטריס יש מקדם טמפרטורה גבוה, יש להתאים את מדידת ה- pH לטמפרטורה שבה תיעשה תגובת HDX, שהיא 20 מעלות צלזיוס בפרוטוקול זה.
- הכן חיץ שיווי משקל עבור מדינה A ומדינה B על ידי שקלול 0.002 מול של Tris לתוך 100 מ"ל של מים בדרגה LC-MS. עבור מצב B, הוסיפו 29.8 מ"ג של KCl, 14.2 מ"ג של MgCl2, 36.8 גרם CaCl2 ו-836 מ"ג של NaCl למאגר Tris. התאם את ה- pH ל- 7.40 ± 0.05.
הערה: מאגר שיווי המשקל חייב להכיל את התנאים שבהם יש לחקור את aSyn. במקרה זה, זה 20 mM Tris ב pH 7.4 +/− מלחים. - הכן את חיץ הסימון עבור מדינה A ומדינה B על ידי שקלול 0.002 מול של Tris לתוך 100 מ"ל של מים deuterated. עבור State B, יש להוסיף 29.8 מ"ג KCl, 14.2 מ"ג של MgCl2, 36.8 גרם CaCl2 ו-836 מ"ג NaCl למאגר הסימון Tris. ה-pD של מאגר הסימון מתאים ל-pH של מאגר שיווי המשקל. מכיוון ש- pH = pD - 0.41, התאם כך שמד ה- pH יקרא 6.99 ± 0.0523,24.
הערה: מאגר הסימון צריך לכלול את אותם רכיבים כמו מאגר שיווי המשקל, למעט העובדה שהוא מוכן באמצעות מים מטוהרים. - הכן חיץ מרווה על ידי שקילה של 0.010 מול של Tris ו- 0.050 מול של אוריאה ועשה עד 100 מ"ל עם מים בדרגה LC-MS. התאם את ה- pH ל- 2.50 ± 0.05 ב- 0.5 ° C .
הערה: יש לבצע מסך מאגר מרווה לפני ניסויי HDX כדי לזהות את מאגר המרווה הטוב ביותר עבור החלבון המעניין. ריכוזים ושילובים שונים של דנטורנטים (למשל, אוריאה וגואנידיניום הידרוכלוריד) וחומרים מחזרים (למשל, tris(2-carboxyethyl)phosphine) נבדקים, יחד עם פרמטרים פיזיקליים כגון לכידת נפח וטמפרטורה, כדי לפתוח ולעכל ביעילות את החלבון המרווה. מאגר מרווה הכולל 100 mM Tris ו-0.5 M אוריאה ב-pH 2.50 הוא אופטימלי למחקר הנוכחי. - הכינו את מאגר שטיפת עמודי העיכול על ידי שקילה של 0.125 מול של גואנידיניום הידרוכלוריד לבקבוק זכוכית דוראן. מוסיפים 25 מ"ל של מתנול ו-250 μL של חומצה פורמית. הוכנו עד 250 מ"ל עם מים בדרגה LC-MS.
הערה: עבור עמודת הפפסין Enzymate BEH (ראה טבלת חומרים), השתמש במאגר שטיפת עמודים של 0.5 M guanidinium hydrochloride, 10% (v/v) מתנול ו-0.1% (v/v) חומצה פורמית. - הכן את המזרק שטיפה חלשה על ידי צנרת 0.5 μL של חומצה פורמית לתוך 249.5 מ"ל של מים ברמה LC-MS.
- הכינו את המזרק חזק לשטוף על ידי ערבוב חלקים שווים של מים בדרגה LC-MS, מתנול, אצטוניטריל ואיזופרופנול. הוסיפו חומצה פורמית לריכוז סופי של 2% (v/v).
הערה: כדי למנוע זיהום צולב בין המאגרים השונים לבין החלבון וכדי לאפשר ניקוי של יציאת ההזרקה, חשוב מאוד שיהיו מוכנים תמיסות שטיפת מזרקים ושנתיב הזרימה לשסתום (המכונה לעתים קרובות "תוחם הכביסה") יהיה מוכן במלואו בנוזל. החומצה הפורמית היא אופציונלית לשטיפת המזרק החלשה.
3. הליך מיפוי פפטידים
- הכן את המדגם לאחר השלב שלהלן.
- המסנן הפשיר את מלאי החלבון ASyn מהמקפיא של −80 °C עם מסנני מזרקים של 0.22 מיקרומטר. מדוד את הספיגה של חלבון הציר המסונן ב-280 ננומטר כדי לקבוע את הריכוז על ידי חוק באר-למברט. דיללו את החלבון לריכוז של 5 מיקרומטר במאגר שיווי המשקל (שלב 2.1).
הערה: חוק באר-למברט: A = εcl, כאשר A הוא ספיגה, ε הוא מקדם ההכחדה של החלבון באורך הגל הנמדד (280 ננומטר כאן) עם יחידות M−1cm−1, c הוא ריכוז החלבון ב-M, ו-l הוא אורך הנתיב בס"מ. עבור aSyn26 מסוג פראי, ε = 5960 M−1ס"מ−1.
- המסנן הפשיר את מלאי החלבון ASyn מהמקפיא של −80 °C עם מסנני מזרקים של 0.22 מיקרומטר. מדוד את הספיגה של חלבון הציר המסונן ב-280 ננומטר כדי לקבוע את הריכוז על ידי חוק באר-למברט. דיללו את החלבון לריכוז של 5 מיקרומטר במאגר שיווי המשקל (שלב 2.1).
- הגדר את שיטת הכרומטוגרפיה הנוזלית.
- צור קובץ כניסה עם זמן טעינה/השמנה של 3 דקות בלחץ של 7000-9000 psi, ואחריו שיפוע של 5% אצטוניטריל ל-40% אצטוניטריל ב-7 דקות, ולאחר מכן שלבי שטיפה חוזרים ונשנים של 5%-95% אצטוניטריל-מים במשך 10 דקות.
- ודא שתרסיס המנעול (לדוגמה, לאוצין אנקפלין, ראה טבלת חומרים) זורם ב-2000 psi ומחובר לבדיקה של תרסיס נעילת המקור של ספקטרומטר המסה.
- הגדר את שיטות ספקטרומטריית המסות MSE .
הערה: MSE היא שיטת רכישה בלתי תלויה בנתונים בפס רחב ללא בידוד המוני מבשר. לכן, כל היונים בטווח m/z שנבחר מקוטעים עוד יותר באמצעות דיסוציאציה הנגרמת על ידי התנגשות (CID)27.- בקובץ שיטת MS, בחר MSE Continuum והגדר זמן רכישה בין 2-10 דקות, מקור אלקטרוספריי ומצב רזולוציה חיובית. רכשו את MSE מעל 50-2000 Da, וסרקו כל 0.3 שניות.
- עבור פונקציה 1 (אנרגיה נמוכה), הגדר את המלכודת והעביר את אנרגיות ההתנגשות כך שיהיו 4 V. עבור פונקציה 2 (אנרגיה גבוהה), הגדר את אנרגיית ההתנגשות של העברת הרמפה כקבועה ב- 4V ואת אנרגיית התנגשות המלכודת כך שתהיה כאמור בטבלה 1 עבור כל רמת אנרגיה במיפוי.
הערה: ניתן להשתמש גם בשיטות MSE של ניידות יונים. ניתן להשתמש בשיטות מיפוי חלופיות (לדוגמה, רכישה תלוית נתונים או DDA) לפי שיקול דעת המשתמש.
- הגדר את הרובוט autosampler (ראה טבלת חומרים).
- הוסף 50 μL של חלבון 5 μM לבקבוקון התאוששות כולל. מקם את הבקבוקון במיקום לדוגמה בתא הימני HDX. ודא שתא זה נמצא בטמפרטורה של 0 °C (5 °F).
- הוסף בקבוקון מגיב אחד של חיץ שיווי משקל ושני בקבוקונים מגיבים של מאגר תיוג למיקומי ריאגנטים אחד, שניים ושלושה בתא השמאלי HDX. ודא שתא זה נמצא בטמפרטורה של 20 °C (75 °F) על-ידי הגדרת בקר הטמפרטורה של Peltier (ראה טבלת חומרים). הוסף בקבוקון מגיב אחד של מאגר מרווה למיקום המגיב אחד בתא הימני HDX.
- הוסף שמונה בקבוקוני התאוששות כוללים במיקומי התגובה של התא השמאלי של HDX ושמונה בקבוקוני התאוששות מרביים במיקומי התגובה של התא הימני HDX.
הערה: כדי להבטיח ניקוי מלא ושכפול מרבי של נפחים מחולקים, מומלץ לבצע שטיפת מזרק ושטיפה ראשונית על מזרקי ההדגה האוטומטית. לדוגמה, בצע רצף של (1) שטיפה חלשה, (2) שטיפה חזקה, (3) שטיפה חלשה לפני תחילת ניסויי המיפוי. ניתן לחזור על רצף זה בהרחבה, ומומלץ לעשות זאת עד פי 20 או עד שהמזרק נרטב במלואו. - הגדר רשימה לדוגמה עם שיטות LC ו- MS מתאימות בתוכנת התזמון והתחל את לוח הזמנים.
הערה: עבור המחקר הנוכחי, Chronos משמשת כתוכנת התזמון (ראה טבלת חומרים).
- לעבד את נתוני המיפוי.
- זהה פפטידים מקבצי ניסוי המיפוי באמצעות תוכנה מתאימה (ראו טבלת חומרים).
- ייבוא נתוני זיהוי פפטידים ל- DynamX (ראה טבלת חומרים) באמצעות הפרמטרים הבאים של סף הפפטיד: עוצמה מינימלית = 5000, אורך רצף מינימלי = 0, אורך רצף מרבי = 40, מוצרים מינימליים = 1, מוצרים מינימליים לכל חומצת אמינו = 0.25, מוצרים עוקבים מינימליים = 2, עוצמת סכום מינימלית למוצרים = 0, ציון מינימלי = 0, ומקסימום MH + שגיאה (ppm) = 0.
הערה: לחלופין, גזור את ההגדרות הממוטבות בהתאם לזרימת עבודה מומלצת28. - בחר נתונים מהתפריט ולחץ על ייבוא תוצאות PLGS. לחץ על הוסף כדי לבחור את קבצי הנתונים הרלוונטיים עבור ההקצאה הספקטרלית. לאחר שכולם נוספו, לחץ על הבא והזן את הגדרות המסנן לעיל. לאחר מכן, לחץ על סיום.
- אצור באופן ידני משימות איזוטופיות כדי לקבל את מפת הכיסוי הפפטידית הסופית של aSyn ב- DynamX.
4. מחקר חילופי מימן/דאוטריום של אלפיות השנייה
- נקו את אב הטיפוס של מכשיר הטיפוס FastHDX (ראו טבלת חומרים) לפני שתתחילו בניסויי HDX.
- פתח את ממשק המשתמש הגרפי התואם של תוכנת HDX ואפשר למערכת לאתחל.
- הזן את טמפרטורת תא הדגימה כ - 20 ° C ואת תא המרווה כ - 0.5 ° C . לחץ על הגדר כדי להחיל את הטמפרטורות החדשות.
- הגדר את צינורות הצנטריפוגה עם מים ברמת LC-MS בכל הכניסות.
- בכרטיסייה Titrator Plumbing Delivery , בדקו את המזרקים השמאלי והימניים ולחצו על Prime כדי להסיר בועות אוויר סמויות בצינורות. חזרו על הפעולה עד שכל הבועות נעלמו.
- בכרטיסיה פקודות מאקרו , סמן את כל התיבות עבור המזרקים. לחץ על כיול מזרקים מיקום הבית. לחץ על שטיפת מזרק לולאת טעינה. לחץ על שטף את כל אמצעי האחסון של לולאת הערבוב.
- חזור על שלב 4.1.5. פי 1 יותר.
- אם מופיעות בועות כלשהן במזרקי החיץ, דגה על ידי ניתוק המזרק ופליטת הבועה אנכית. החלף את המזרק וכייל מחדש למצב אפס.
- הגדר את אב הטיפוס של מכשיר אב הטיפוס FastHDX לניסויים ב-HDX.
- הוסיפו 500 uL של 5 μM aSyn מסוננים בבקבוקון התאוששות כולל והניחו בתוך מקרר שולחני כדי למנוע אוליגומריזציה וצבירה הנגרמות על ידי טמפרטורה.
- הוסיפו 50 מ"ל של מאגרי שיווי משקל, תיוג ומרווה לכל מאגר (2). שלבי הכנת מאגר HDX 1-3) כניסה בתאים השמאלי והימני.
- הוסף 50 מ"ל של מאגר שטיפת עמודים (2). שלב הכנת חיץ HDX שלב 4) לכניסת הכביסה של פפסין.
- כדי להכין את קווי שטיפת החלבון והעמודה 1x, בדקו את המזרקים השמאליים והימניים בכרטיסייה Titrator Plumbing Delivery ולחצו על Prime פעם אחת.
הערה: כל לחיצה נוספת על Prime תגרום לחזרות נוספות של התהליך הראשוני, וכתוצאה מכך לצריכה של כמויות גדולות של דגימת חלבון. מומלץ להימנע מכך, גם כאשר יש עיכוב בתוכנה לאחר ניסיון ללחוץ על כפתור. - חזור על שלבים 4.1.5. פי 1.
- בכרטיסיה זרימת מרווה ידנית , הזן את ההגדרות הנדרשות, המוסברות בשלבים 4.2.7.-4.2.10.
- לניסוי במסלול זמן, הזן את הזמנים באלפיות השנייה באמצעות לחצן נקודות סימבוליות . אם נדרשים משכפלים, הוסף את אותה נקודת זמן מספר פעמים, למשל, עבור משולש של 50 אלפיות השנייה, יש להזין 50 50 50 50. רשימת הדגימות בתוכנת ספקטרומטר המסה (MassLynx משמש כאן, ראה טבלת חומרים) צריכה להתאים בדיוק לנקודות זמן אלה.
הערה: יש להשתמש בשמות הקבצים ו/או בטקסט לדוגמה של ספקטרומטר המסה כדי להבטיח תיעוד קבוע של זמני תיוג HDX המתאימים לאלה שהוזנו בממשק המשתמש הגרפי של תוכנת FastHDX. זמני תיוג עבור כל הרצה לדוגמה לא יאוחסנו בשום מקום אחר. - הגדר את זמן המלכודת (mins) כאורך זמן ההשמנה. הנה, השעה 3.00.
- הגדר המתנה עבור HPLC (דקות) = (זמן השמנה + זמן ריצה + 1.5 דקות).
הערה: לדוגמה, עבור ניסוי עם לכידה של 3 דקות ושיפוע של 17 דקות, זה יהיה 21.50 דקות. - לחץ על התיבה הפעל ריק רק אם אתה מפעיל ניסויים ריקים בין ריצות לדוגמה. אם כן, ודא ערך (כלומר, שורה חוקית ברשימה לדוגמה) בתוכנה עבור הריצה הריקה לאחר כל הפעלה לדוגמה.
- לאחר שהרשימה לדוגמה מוכנה בתוכנה, הדגש את הערכים המתאימים והתחל את הריצה בתוכנה על ידי לחיצה על לחצן הפעל ו - FastHDX בתוכנה.
הערה: בשל ערבול מימן/דאוטריום, שיטות MS בלבד או טכניקות פיצול רך (דיסוציאציה של העברת אלקטרונים, דיסוציאציה של לכידת אלקטרונים ופוטו-דיסוציאציה אולטרה-סגולה) יכולות לשמש רק29. עבור aSyn ב-pH פיזיולוגי של 7.40, נקודות זמן הנעות בין 50 אלפיות השנייה ל-300 שניות הן הישימות ביותר מכיוון שהן מכסות את כל עקומת ספיגת הדאוטריום8.
5. עיבוד נתונים
- טען את קובץ הפפטידים שהוקצו באופן ספקטרלי מניסויי מיפוי הפפטידים. פתח את תפריט הקובץ ולחץ על פתח בתוכנת DynamX (ראה טבלת חומרים).
- ייבא קבצים גולמיים לתוכנת מדידת המסה המועדפת (למשל, DynamX, HDExaminer וכו '). פתח את תפריט "נתונים" ולחץ על קבצי MS. לחץ על מצב חדש כדי ליצור מצבים עבור כל מצב חלבון שנחקר.
- לחץ על חשיפה חדשה כדי להוסיף כל נקודת זמן של HDX. לחץ על Raw חדש כדי לייבא את הקבצים .raw. גרור כל קובץ .raw למיקום הנכון. לחץ על אישור בסיום.
- תחילה הקצה איזוטופים באופן אוטומטי (זה אוטומטי לאחר שלב 5.2. לעיל), ולאחר מכן אצור ידנית את ההקצאה האיזוטופית כדי להבטיח איכות נתונים גבוהה.
- ייצא את נתוני האשכול לקובץ .csv עם עמודות בסדר הבא: שם חלבון, מספר התחלת רצף, מספר סיום רצף, רצף, שינוי, קטע, קליטה אפשרית מקסימלית, מסה של מינים מונואיזוטופיים, שם מדינה, זמן חשיפה, שם קובץ, מטען, זמן שמירה, עוצמה וצנטרואיד.
- פתח את תפריט הנתונים בתוכנת מדידת המונים ולחץ על ייצוא נתוני אשכולות.
6. ניתוח נתונים
- טען את נתוני האשכול המיוצאים לתוכנת ניתוח HDX המועדפת. כאן, HDfleX משמש30 (ראה טבלת חומרים).
- התאם את הנתונים הניסיוניים עבור כל הפפטידים והמצבים, ובחר את שיטות התיקון המתאימות להחלפה חוזרת כדי לקבל קבועי קצב נצפים עבור תגובת HDX.
- חשב סף מובהקות גלובלי בשיטה המועדפת (HDfleX תומך במספר אפשרויות לכך) ובצע בדיקות מובהקות היברידית כדי לקבוע את ההבדלים המשמעותיים בין המדינות לעומת31,32.
הערה: אם ההפרש שנצפה גדול מהסף הגלובלי וערך ה-p קטן מרמת הביטחון שנבחרה (למשל, 95%), ההפרש נחשב משמעותי.
תוצאות
בשל אופיו המופרע במהותו, קשה ללכוד את השינויים המבניים המורכבים ב- aSyn ב- pH פיזיולוגי. HDX-MS מנטרת חילופי איזוטופים במימן אמיד בעמוד השדרה, וחוקרת את הדינמיקה הקונפורמציה של החלבון ואת האינטראקציות. זוהי אחת הטכניקות הבודדות לרכוש מידע זה ברזולוציות מבניות וזמניות גבוהות. פרוטוקול זה ישים באופן נרחב למגוון רחב של חלבונים ותנאי חיץ, והדבר מודגם על ידי מדידת הקינטיקה החליפית של aSyn בשני תנאי פתרון שונים: מצב A ומצב B8, כהגדרתם בשלבים 2.1.-2.2.
ראשית, בוצע ניסוי מיפוי על aSyn, והושגה מפת כיסוי פפטידית, כפי שניתן לראות באיור 1. המפה מכסה 100% מרצף החלבונים ויש לה יתירות ממוצעת של 3.79. ערך הכיסוי של 100% מצביע על כך שכל חומצות האמינו בחלבון נמצאו בתקצירי החלבון ויאפשר ניתוח מקיף של התנהגות החליפין של aSyn. ערך היתירות מציין את מספר הפפטידים החופפים. ערך יתירות גבוה יותר מגדיל את הרזולוציה המבנית של המפה הסופית, בהינתן שיטוח תת-קרקעי של הנתונים עבור פפטידים חופפים32.
באמצעות אב הטיפוס של מכשיר זרימת מרווה בערבוב מהיר (ראו טבלת חומרים), נאספו נתונים באיכות גבוהה של HDX-MS בקנה מידה של אלפית השנייה על aSyn ב-pH 7.4 במצב A ובמצב B (איור 2). בעקבות הקצאה איזוטופית ב-DynamX, התקבלו עקומות ספיגת דאוטריום "גולמיות", כפי שניתן לראות באיור 3A. הוא מציג עקומות ספיגה עבור שלושה פפטידים שנבחרו בכל תחום חלבון. התאגדות הדאוטריום לאורך זמן מוצגת. ציר ה-x נמצא על ציר הזמן של אלפית השנייה, אשר מתיישר עם הקינטיקה המהירה מאוד של aSyn בתנאים פיזיולוגיים. האזור המוצל באדום מציג את הנתונים המתקבלים בדרך כלל ממכשירי HDX קונבנציונליים, עם מדידות התחלתיות מ-30 שניות. חשוב לציין, לא ניתן לצמצם זאת עוד יותר על ידי מניפולציית pH עבור מה שמכונה "הרחבת חלון זמן"; גישה זו אינה תקפה לחקר חלבונים/אזורים בעלי הפרעה פנימית, שכן שינוי ה-pH יפריע להרכב הקונפורמציה של הפוליפפטיד היציב החלש. כפי שניתן לראות כאן, רוב ה-aSyn מוחלף במלואו ב-1 שניות (איור 3C). זה מראה את החשיבות של מדידות HDX של אלפיות השנייה עבור aSyn מונומרי כאשר עקומת הספיגה הקינטית המלאה של תגובת החליפין נלכדת, מה שמניב את המדידה המדויקת ביותר של קונפורמציות המונומר.
HDfleX ביצע תיקון החלפה חוזרת באמצעות התאגדות דאוטריום מישורית. נקודות הנתונים הותקנו לאחר מכן על פי משוואה 1, וסיפקו קבוע קצב נצפה, kobs, המעיד על נגישות הממס ועל מעורבותו של אותו פפטיד מסוים (איור 3B).
 משוואה 1
משוואה 1
כאשר Dt הוא התאגדות הדאוטריום בזמן t, nExp הוא מספר הפאזות האקספוננציאליות, N הוא המספר המרבי של מימן לבילי, kobs הוא קבוע שער החליפין הנצפה, ו- β הוא גורם מתיחה30,33.
לאחר התאמת העקומה, ניתן לחשב את אזור הקליטה מתחת לעקומה המותקנת על ידי שילוב הפונקציה המותקנת המתארת את עקומת הקליטה בתוך חלון הזמן הניסיוני. בוצעו ניתוחי מובהקות סטטיסטית בין אזור הקליטה של שתי המדינות. ראשית, סף מובהקות גלובלי לאזור הקליטה חושב ב-HDfleX ברמת ביטחון של 95%. לאחר מכן נוצרו חלקות של הפרשי שטח ספיגה, שהראו את ההבדל בין מצב A למצב B בשתי רמות של רזולוציה מבנית: רזולוציה פפטידית (איור 4A) ורזולוציה של חומצות אמינו (איור 4B). תרשים הפרש הרזולוציה של הפפטיד מראה את ההבדל באזור הספיגה בין מצב A למצב B עבור כל פפטיד בודד, בעוד שחלוקת הפרש הרזולוציה של חומצות האמינו מראה את ההבדל באזור הספיגה בין מצב A למצב B המושטח על פני כל רצף חומצות האמינו של aSyn30,34. שתי המגרשים מצביעות על קליטה כוללת גדולה יותר של דאוטריום לאורך המונומר aSyn במדינה B בהשוואה למדינה A. ניתן להצדיק ממצא זה על ידי בחינת חלקות ספיגת הדאוטריום באיור 3, שבהן עקומת קליטת המדינה B נמצאת תמיד מעל עקומת הקליטה של מדינה א'. יתר על כן, ניתן לראות כי גודל ההבדל באזור הקליטה גבוה בהרבה ב- C-terminus. שוב, ניתן להצדיק זאת על ידי חזרה לעקומות הספיגה המקוריות, שבהן הפפטידים של C-terminal (פפטידים 124-140 המוצגים באיור 3) מראים פער גדול בהרבה בין עקומות הספיגה מאשר שאר החלבון. לסיכום, תנאי הפתרון במצב B גורמים לעלייה בחשיפה לממסים או לירידה בהשתתפות ברשת הקשר בין מימן לאורך החלבון, אך יותר מכך ב-C-terminus.

איור 1: מפת כיסוי פפטידית של aSyn מסוג פראי עם סך של 30 פפטידים וכיסוי רצפים של 100%. שלושת התחומים של aSyn מסומנים באופן הבא: N-terminus (כחול), אזור רכיב בטא שאינו עמילואיד (צהוב) ו- C-terminus (אדום). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: זרימת עבודה לניסוי HDX-MS של אלפית השנייה ב-aSyn. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: חלקות קליטה לדוגמה משלושה פפטידים שנבחרו בשלושת התחומים של aSyn עבור מדינה A (צהוב) ומצב B (כחול). (A) חלקת ספיגה מתוקנת שאינה כשירה ולא החלפה לאחור. (ב) חלקות קליטה מתוקנות של תיקון והחלפה חוזרת. האזור המוצל באדום מייצג נתונים הניתנים להשגה על-ידי מערכות HDX-MS קונבנציונליות, בדרך כלל החל מ-30 שניות. פסי שגיאה תואמים לסטיית התקן של שלושת המשכפלים. (C) מתווה מפת חום של אחוז ספיגת הדאוטריום על פני רצף חומצות האמינו בכל נקודת זמן. סרגל הצבעים מייצג את אחוז ספיגת הדאוטריום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
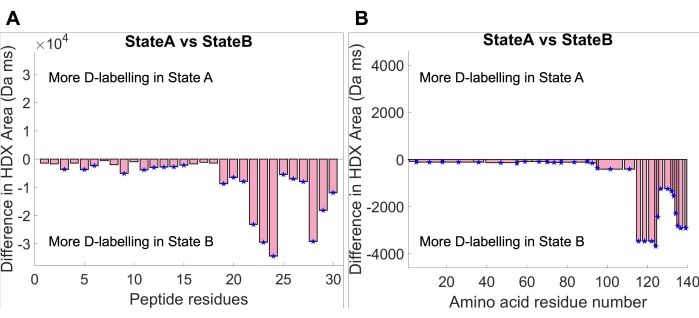
איור 4: חלקות הפרשי שטח קליטה בזמן מישור עקום מרבי (14,084 אלפיות השנייה). (A) חלקות רזולוציית שאריות פפטידיות מראות את הפרש שטח הספיגה של כל פפטיד בין מצב A למדינה B. (B) חלקת רזולוציה של חומצות אמינו המציגה את הפרש שטח הספיגה בין מדינה A למדינה B המושטחת על פני רצף חומצות האמינו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| מיפוי רמת האנרגיה | מתח רמפה (V) |
| נמוך | 20-40 |
| בינוני | 25-45 |
| גבוה | 30-50 |
| גבוה מאוד | 35-55 |
טבלה 1: מיפוי רמות האנרגיה ומתחי רמפת ההעברה המתאימים.
Discussion
במאמר הנוכחי מתוארים ההליכים הבאים: (1) ביצוע ניסויי מיפוי פפטידים על aSyn מונומרי כדי לקבל את כיסוי הרצף הגבוה ביותר, (2) רכישת נתוני HDX-MS של אלפיות השנייה על aSyn מונומרי בתנאים פיזיולוגיים, ו-(3) ביצוע ניתוח נתונים ופרשנות של נתוני HDX-MS המתקבלים. ההליכים המסופקים הם בדרך כלל פשוטים לביצוע, כל ניסוי תיוג נמשך בדרך כלל רק כ-8 שעות עבור שלושה שכפולים ושמונה נקודות זמן, וניסוי המיפוי נמשך רק כ-2 שעות. בהתחשב במכשור האוטומטי לחלוטין המשמש כאן, ניתן לרכוש מערך נתונים שלם תוך יום אחד. עם זאת, בעת טיפול בדגימות והכנת מאגרים, יש להקפיד על כך שהמדידות נגזרות מחלבון יציב חלש (או אזורי חלבון) במצב הרצוי. חשוב לציין שמחקר קודם הראה שתנאי אחסון שונים, כגון הקפאה וליופיליזציה, הביאו לקונפורמרים שונים של aSyn monomer, וכי חשוב לאפיין את ההשפעה הפוטנציאלית של טיפול בדגימה על ההרכב הקונפורמי של aSyn monomer10. ואכן, HDX-MS הוא מדד רגיש ביותר של הפרעות קונפורמיות כאלה, עם טווח דינמי בין מיקרו-שניות לחודשים לפחות. בנוסף, אם בוחנים בקפדנות רק את המונומר aSyn, מומלץ מאוד להסיר אוליגומרים ופיברילים לא רצויים שאולי נוצרו בדגימה בעת האחסון או הטיפול. יתר על כן, מאגרי HDX-MS צריכים להיות מבוקרים היטב בטווח של 0.05 מה- pH או ה- pD הרצויים, מכיוון שכל אי-התאמות ישפיעו באופן משמעותי על שיעור החליפין הפנימי ויובילו לשגיאות לא רצויות. חשוב גם לציין כי השוואות בין תנאי התמיסה עבור כל חלבון השונה ב-pH, בטמפרטורה או בהרכב המלח ישנו את הקצב הפנימי. לכן, נתונים אלה ידרשו תיקונים נוספים, כגון החלת גורם התאמת pH35 או גורם תיקון אמפירי 8,30.
במונחים של מכשור, אין מערכות זמינות מסחרית המאפשרות רכישה של נתוני HDX-MS של אלפית השנייה. מספר קבוצות מחקר פיתחו מערכות משלהן, ממערכות זרימה מרווה13,15,36 ועד שבבים מיקרופלואידיים37,38,39 כדי ללכוד את הקינטיקה של חילופי הדברים המהירים של חלבונים מסוימים. שיטה נוספת ששימשה להשגת נתוני HDX-MS בקנה מידה של אלפיות השנייה ידועה כשיטת הרחבת הזמן40,41, לפיה ה-pH של המאגרים מופחת כדי להאט את הקינטיקה של החליפין. עם זאת, שיטה זו אינה חלה על aSyn (או על תכונות חלבון יציבות חלשות) שכן (1) הורדת ה-pH משנה באופן דרסטי את צפיפות המטען של החלבון ומגבירה את קצב הצבירה 8,42, ו-(2) הקונפורמרים של aSyn הם רק מטא-יציבים וסביר להניח שהם יופרעו על ידי שינויי pH אלה. מסיבות אלה, מומלץ לשמור על pH עקבי במאגרי HDX-MS בעת לימוד קונפורמציות aSyn מונומריות, אלא אם כן הן רלוונטיות מבחינה פיזיולוגית, ולהפעיל מכשיר תיוג של אלפית השנייה.
רוב המונומר של aSyn מתחלף באופן מלא בתוך 1 שניות, ולכל היותר נדרשות כ-15 שניות כדי להחליף באופן מלא עם דאוטריום (איור 3) ב-pH רלוונטי מבחינה פיזיולוגית של 7.4 (המשקף מצבים ציטוזוליים תוך-תאיים בקדם-סינתזה). באמצעות מערכות HDX-MS קונבנציונליות, החל מ- 30 שניות אינה מתאימה מכיוון שנתוני HDX-MS יתאימו למישור של תגובת החליפין, שאינה מספקת מידע קונפורמי שימושי. עם זאת, הגבול התחתון של המדידה של מכשיר ה-HDX של אלפית השנייה (המקביל ל"זמן מת" של 50 אלפיות השנייה) מאפשר ניטור של תגובת החליפין מתוך השלמה של כ-25% עבור מונומר aSyn ב-pH 7.4. זה איפשר לנו ללכוד את רוב עקומת הספיגה הקינטית. התאמת עקומת קליטת הדאוטריום למשוואה 1 מספקת מידע קינטי חשוב; זה מתאים לאומדן של קבוע הקצב הנצפה, kobs. למרות שאינו מכוסה כאן, ניתן לבצע ניסויים בקינטיקה של צבירה ולבחון מורפולוגיות פיבריל של aSyn באותם תנאי פתרון כמו ניסויי HDX-MS מכיוון ש- HDX-MS סובלני מאוד למגוון רחב של מאגרים8. כך, למשל, ניתן לתאם את ה-kobs מניסוי HDX-MS עם התוצאות מניסויי הצבירה כדי לקבל תובנה לגבי אילו קונפורמציות נוטות ביותר להתנהגויות צבירה מסוימות ולמורפולוגיות פיבריל.
במקרה הפשוט של ניסויי HDX-MS דיפרנציאליים, שבהם יש להשוות בין שני תנאים או יותר או גרסאות חלבון, ניתן לשלב את השטח שמתחת לעקומת הספיגה המותאמת עבור כל מצב ולהשוות אותו לזה. במחקר זה, אזורי הקליטה של מדינה A ומדינה B הושוו בשתי רמות שונות של רזולוציה מבנית: רזולוציה של פפטידים ורזולוציה של חומצות אמינו, שלשניהם יש עוצמות ואתגרים שונים. לדוגמה, נתוני הרזולוציה של הפפטידים משקפים את הנתונים הספקטרליים הגולמיים בצורה הדוקה יותר ועברו את העיבוד הנמוך ביותר. עם זאת, נתוני הרזולוציה של חומצות האמינו "המשוטחות" מאפשרים לשלב הן מידע על פפטידים והן מידע על פיצול רך לפלט יחיד במקום להפריד פלטים בלתי ניתנים למיזוג, ובסופו של דבר להציג את הנתונים ברזולוציה המבנית הגבוהה ביותר. מגבלה אחת של זיהוי ספקטרומטריית המסה של תיוג HDX היא האתגר של קבלת רזולוציה של חומצות אמינו. בעוד שטכניקות "פיצול רך", כגון דיסוציאציה של העברת אלקטרונים (ETD), דיסוציאציה של לכידת אלקטרונים (ECD) ופוטודיסוציאציה אולטרה-סגולה (UVPD), הוכחו כיעילות ביצירת רזולוציות גבוהות יותר, הן עדיין מאתגרות, בלתי צפויות ולא יעילות 30,43,44,45,46,47,48.
בהשוואה לטכניקות מבניות אחרות, אלפית השנייה HDX-MS יש את היתרון הייחודי של לכידת הדינמיקה הקונפורמית של aSyn מונומרי ברזולוציות מבניות וזמניות גבוהות. מכיוון שהקינטיקה של ההחלפה המהירה של המונומר כבר אינה גורם מגביל, ניתן לבצע מחקרים נוספים על aSyn מונומרי עם מוטציות שונות, שינויים לאחר התרגום, מרכיבי מלח וריכוזים, ושותפי קשירת קשר ב- pH פיזיולוגי. קורלציה בין תוצאות HDX-MS לבין מחקרים פונקציונליים, כגון קינטיקה של צבירה ומורפולוגיות פיבריל, יכולה לספק תובנה לגבי קונפורמרים שמקדמים תפקוד תאי תקין או מועדים למחלות. בסופו של דבר, הצפי הוא ש-HDX-MS כזה של אלפית השנייה עשוי להיות חיוני לגילוי תרופות ממוקדות מטרה המייצבות קונפורמרים ספציפיים הנסבלים מבחינה פיזיולוגית.
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
NS ממומן על ידי מלגת יובל היהלומים של מועצת האוניברסיטה. JJP נתמך על ידי מלגת מנהיגי העתיד של UKRI [מספר מענק: MR/T02223X/1].
Materials
| Name | Company | Catalog Number | Comments |
| 1 × 100 mm ACQUITY BEH 1.7 μm C18 column | Waters Corporation | 186002346 | Analytical column |
| Acetonitrile HPLC grade >99.9% HiPerSolv | VWR | 20060.420 | For LC mobile phases |
| CaCl2 | Sigma Aldrich | C5670 | Salt for HDX buffers |
| Chronos | Axel Semrau (Purchased from Waters Corporation) | 667006090 | Scheduling software to enable multiple HDX-MS sample injections automatically. Alternative software is available from other vendors e.g. HDXDirector or LEAP Shell |
| Deuterium chloride | Goss Scientific (Cambridge Isotope Laboratories) | DLM-2-50 | For HDX labelling buffers |
| Deuterium oxide (99.9% D2O) | Goss Scientific (Cambridge Isotope Laboratories) | DLM-4 | Deuterated water |
| DynamX 3.0 | Waters Corporation | 176016027 | Isotopic assignment and deuterium incorporation calculation |
| Enzymate BEH Pepsin Column | Waters Corporation | 186007233 | Pepsin digestion column |
| Formic Acid, 99.0% LC/MS Grade | Fisher Scientific | 10596814 | For LC mobile phases |
| Guanidinium hydrochloride | Sigma Aldrich | RDD001-500G | Chaotrope/Denaturant |
| HDfleX | University of Exeter | N/A | https://ore.exeter.ac.uk/repository/handle/10871/127982 |
| KCl | Sigma Aldrich | P3911 | Salt for HDX buffers |
| LEAP HDX-2 CTC PAL sampling robot | Waters Corporation | 725000637 | Autosampler robot |
| Leucine enkephalin | Waters Corporation | 186006013 | For mass spectrometry lockspray calibration. |
| MassLynx | Waters Corporation | 667004007 | Software controlling inlet methods and mass spectrometer |
| Maximum recovery vials | Waters Corporation | 600000670CV | 100 pack including caps - used for quench tray in LEAP HDX-2 |
| MgCl2 | Sigma Aldrich | M8266 | Salt for HDX buffers |
| Millipore 0.22 µm syringe filters | Millipore | N9CA7069B | Syringe filters |
| ms2min | Applied Photophysics Ltd | N/A | fast-mix quench-flow millisecond hdx instrument |
| NaCl | Sigma Aldrich | S9888 | Salt for HDX buffers |
| Peltier temperature controller | LEAP Technologies Inc. | HP115-COOL/D | Peltier controller to set precise temperature of chambers in the LEAP robot. |
| ProteinLynx Global Server 3.0 | Waters Corporation | 715001030 | Peptide identification software. Alternative software is available from other vendors. |
| Reagent pot caps | Waters Corporation | 186004632 | 100 pack |
| Reagent pots for LEAP HDX-2 | Waters Corporation | 186001420 | 100 pack excluding caps - used for buffers in LEAP HDX-2 |
| Sodium deuteroxide (99.5% in D2O) | Goss Scientific (Cambridge Isotope Laboratories) | DLM-57 | For HDX labelling buffers |
| Spin filter microcentrifuge tubes (3 kDa MWCO) | Amicon (Merck Sigma Aldrich) | UFC5003 | Micro centrifuge tubes to concentrate protein. This facilitates buffer exchange and accurate sample loading for HDX-MS experiments. |
| Synapt G2-Si mass spectrometer | Waters Corporation | 176850035 | Mass spectrometer |
| Total recovery vials | Waters Corporation | 600000671CV | 100 pack including caps - used for labelling tray in LEAP HDX-2 |
| Tris-HCl | Sigma Aldrich | T3253-250G | Buffer |
| Trizma base | Sigma Aldrich | T60040-B2005 | Buffer |
| Urea | Sigma Aldrich | U5378-1KG | Chaotrope/Denaturant |
| VanGuard 2.1 x 5 mm ACQUITY BEH C18 column | Waters Corporation | 186004623 | Trap desalting column |
References
- Dorsey, E. R., et al. regional, and national burden of Parkinson's disease, 1990-2016: A systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology. 17 (11), 939-953 (2018).
- Breydo, L., Wu, J. W., Uversky, V. N. α-Synuclein misfolding and Parkinson's disease. Biochimica et Biophysica Acta (BBA): Molecular Basis of Disease. 1822 (2), 261-285 (2012).
- Dedmon, M. M., Lindorff-Larsen, K., Christodoulou, J., Vendruscolo, M., Dobson, C. M. Mapping long-range interactions in α-synuclein using spin-label NMR and ensemble molecular dynamics simulations. Journal of the American Chemical Society. 127 (2), 476-477 (2005).
- Esteban-Martín, S., Silvestre-Ryan, J., Bertoncini, C. W., Salvatella, X. Identification of fibril-like tertiary contacts in soluble monomeric α-synuclein. Biophysical Journal. 105 (5), 1192-1198 (2013).
- McClendon, S., Rospigliosi, C. C., Eliezer, D. Charge neutralization and collapse of the C-terminal tail of alpha-synuclein at low pH. Protein Science. 18 (7), 1531-1540 (2009).
- Ranjan, P., Kumar, A. Perturbation in long-range contacts modulates the kinetics of amyloid formation in α-synuclein familial mutants. ACS Chemical Neuroscience. 8 (10), 2235-2246 (2017).
- Villar-Piqué, A., da Fonseca, T. L., Outeiro, T. F. Structure, function and toxicity of alpha-synuclein: the Bermuda triangle in synucleinopathies. Journal of Neurochemistry. 139, Suppl 1 240-255 (2015).
- Seetaloo, N., Zacharopoulou, M., Stephens, A. D., Schierle, G. S. K., Phillips, J. J. Local structural dynamics of alpha-synuclein correlate with aggregation in different physiological conditions. bioRxiv. , (2022).
- Stephens, A. D., et al. Extent of N-terminus exposure of monomeric alpha-synuclein determines its aggregation propensity. Nature Communications. 11 (1), 2820(2020).
- Stephens, A. D., et al. Different structural conformers of monomeric α-synuclein identified after lyophilizing and freezing. Analytical Chemistry. 90 (11), 6975-6983 (2018).
- Lautenschläger, J., et al. C-terminal calcium binding of α-synuclein modulates synaptic vesicle interaction. Nature Communications. 9 (1), 712(2018).
- Oganesyan, I., Lento, C., Tandon, A., Wilson, D. J. Conformational dynamics of α-synuclein during the interaction with phospholipid nanodiscs by millisecond hydrogen-deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 32 (5), 1169-1179 (2021).
- Keppel, T. R., Weis, D. D. Analysis of disordered proteins using a simple apparatus for millisecond quench-flow H/D exchange. Analytical Chemistry. 85 (10), 5161-5168 (2013).
- Al-Naqshabandi, M. A., Weis, D. D. Quantifying protection in disordered proteins using millisecond hydrogen exchange-mass spectrometry and peptic reference peptides. Biochemistry. 56 (31), 4064-4072 (2017).
- Kish, M., et al. Allosteric regulation of glycogen phosphorylase solution phase structural dynamics at high spatial resolution. bioRxiv. , (2019).
- El-Amine, M., et al. Mechanisms of tolerance induction by a gene-transferred peptide-IgG fusion protein expressed in B lineage cells. Journal of Immunology. 165 (10), 5631-5636 (2000).
- Kishimoto, S., et al. Site-specific chemical conjugation of antibodies by using affinity peptide for the development of therapeutic antibody format. Bioconjugate Chemistry. 30 (3), 698-702 (2019).
- Xu, W., et al. A protein-based, long-acting HIV-1 fusion inhibitor with an improved pharmacokinetic profile. Pharmaceuticals. 15 (4), 424(2022).
- Frías, J. P., et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. The New England Journal of Medicine. 385 (6), 503-515 (2021).
- Gerstein, H. C., et al. Cardiovascular and renal outcomes with efpeglenatide in type 2 diabetes. The New England Journal of Medicine. 385 (10), 896-907 (2021).
- Largy, E., Gabelica, V. Native hydrogen/deuterium exchange mass spectrometry of structured DNA oligonucleotides. Analytical Chemistry. 92 (6), 4402-4410 (2020).
- Marcsisin, S. R., Engen, J. R. Hydrogen exchange mass spectrometry: What is it and what can it tell us. Analytical and Bioanalytical Chemistry. 397 (3), 967-972 (2010).
- Glasoe, P. K., Long, F. A. Use of glass electrodes to measure acidities in deuterium oxide. Journal of Physical Chemistry. 64 (1), 188-190 (1960).
- Krȩzel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Mayerhöfer, T. G., Pahlow, S., Popp, J. The Bouguer-Beer-Lambert law: Shining light on the obscure. ChemPhysChem. 21 (18), 2029-2046 (2020).
- Gasteiger, E., et al. The Proteomics Protocols Handbook. , Springer. New York. 571-607 (2005).
- Bateman, R. H., et al. A novel precursor ion discovery method on a hybrid quadrupole orthogonal acceleration time-of-flight (Q-TOF) mass spectrometer for studying protein phosphorylation. Journal of the American Society for Mass Spectrometry. 13 (7), 792-803 (2002).
- Sørensen, L., Salbo, R. Optimized workflow for selecting peptides for HDX-MS data analyses. Journal of the American Society for Mass Spectrometry. 29 (11), 2278-2281 (2018).
- Demmers, J. A. A., Rijkers, D. T. S., Haverkamp, J., Killian, J. A., Heck, A. J. R. Factors affecting gas-phase deuterium scrambling in peptide ions and their implications for protein structure determination. Journal of the American Chemical Society. 124 (37), 11191-11198 (2002).
- Seetaloo, N., Kish, M., Phillips, J. J. HDfleX: Software for flexible high structural resolution of hydrogen/deuterium-exchange mass spectrometry data. Analytical Chemistry. 94 (11), 4557-4564 (2022).
- Hageman, T. S., Weis, D. D. Reliable identification of significant differences in differential hydrogen exchange-mass spectrometry measurements using a hybrid significance testing approach. Analytical Chemistry. 91 (13), 8008-8016 (2019).
- Hageman, T. S., Weis, D. D. A structural variant approach for establishing a detection limit in differential hydrogen exchange-mass spectrometry measurements. Analytical Chemistry. 91 (13), 8017-8024 (2019).
- Chetty, P. S., et al. Helical structure and stability in human apolipoprotein A-I by hydrogen exchange and mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19005-19010 (2009).
- Keppel, T. R., Weis, D. D. Mapping residual structure in intrinsically disordered proteins at residue resolution using millisecond hydrogen/deuterium exchange and residue averaging. Journal of the American Society for Mass Spectrometry. 26 (4), 547-554 (2015).
- Li, J., Rodnin, M. V., Ladokhin, A. S., Gross, M. L. Hydrogen-deuterium exchange and mass spectrometry reveal the pH-dependent conformational changes of diphtheria toxin T domain. Biochemistry. 53 (43), 6849-6856 (2014).
- Roder, H., Elöve, G. A., Englander, S. W. Structural characterization of folding intermediates in cytochrome c by H-exchange labelling and proton NMR. Nature. 335 (6192), 700-704 (1988).
- Rob, T., et al. Measuring dynamics in weakly structured regions of proteins using microfluidics-enabled subsecond H/D exchange mass spectrometry. Analytical Chemistry. 84 (8), 3771-3779 (2012).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13 (13), 2528-2532 (2013).
- Svejdal, R. R., Dickinson, E. R., Sticker, D., Kutter, J. P., Rand, K. D. Thiol-ene microfluidic chip for performing hydrogen/deuterium exchange of proteins at subsecond time scales. Analytical Chemistry. 91 (2), 1309-1317 (2018).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of The American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Coales, S. J., E, S. Y., Lee, J. E., Ma, A., Morrow, J. A., Hamuro, Y. Expansion of time window for mass spectrometric measurement of amide hydrogen/deuterium exchange reactions. Rapid Communications in Mass Spectrometry. 24 (24), 3585-3592 (2010).
- Hoyer, W., et al. Dependence of alpha-synuclein aggregate morphology on solution conditions. Journal of Molecular Biology. 322 (2), 383-393 (2002).
- Rand, K. D., Pringle, S. D., Morris, M., Engen, J. R., Brown, J. M. ETD in a traveling wave ion guide at tuned Z-spray ion source conditions allows for site-specific hydrogen/deuterium exchange measurements. Journal of the American Society for Mass Spectrometry. 22 (10), 1784-1793 (2011).
- Kan, Z. Y., Ye, X., Skinner, J. J., Mayne, L., Englander, S. W. ExMS2: An integrated solution for hydrogen-deuterium exchange mass spectrometry data analysis. Analytical Chemistry. 91 (11), 7474-7481 (2019).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Characterizing short-lived protein folding intermediates by top-down hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (20), 8591-8597 (2010).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Mistarz, U. H., et al. Photodissociation mass spectrometry accurately localizes sites of backbone deuteration in peptides. Analytical Chemistry. 90 (2), 1077-1080 (2017).
- Phillips, J. J., et al. Rate of asparagine deamidation in a monoclonal antibody correlating with hydrogen exchange rate at adjacent downstream residues. Analytical Chemistry. 89 (4), 2361-2368 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved