Method Article
Исследование пространственного взаимодействия между астроцитами и нейронами в очищенном мозге
В этой статье
Резюме
Сочетание вирусной векторной трансдукции и очистки мозга с помощью метода CLARITY позволяет исследовать большое количество нейронов и астроцитов одновременно.
Аннотация
Сочетание вирусной векторной трансдукции и очистки тканей с помощью метода CLARITY позволяет одновременно исследовать несколько типов клеток головного мозга и их взаимодействия. Вирусная векторная трансдукция позволяет маркировать различные типы клеток различными цветами флуоресценции в одной и той же ткани. Клетки могут быть идентифицированы генетически по активности или проекции. Используя модифицированный протокол CLARITY, потенциальный размер выборки астроцитов и нейронов вырос на 2-3 порядка. Использование CLARITY позволяет визуализировать полные астроциты, которые слишком велики, чтобы поместиться в них целиком в срезы, и исследовать соматы со всеми их процессами. Кроме того, он дает возможность исследовать пространственное взаимодействие между астроцитами и различными типами нейрональных клеток, а именно количество пирамидных нейронов в каждом астроцитарном домене или близость между астроцитами и специфическими ингибирующими популяциями нейронов. В настоящем документе подробно описывается, как должны применяться эти методы.
Введение
В последние годы знания о функции астроцитов и о том, как они взаимодействуют с нейронными цепями, резко возросли. Астроциты могут влиять на пластичность 1,2, помогать в восстановлении нейронов после травмы 3,4 и даже индуцировать de novo нейрональное потенцирование, причем недавние исследования демонстрируют важность астроцитов в приобретении памяти и вознаграждении, ранее рассматриваемых как чисто нейронные функции 5,6,7 . Особенностью, представляющей особый интерес в исследованиях астроцитов, является пространственное расположение клеток, которые поддерживают уникальные пространственные организации в гиппокампе и других структурах мозга 8,9,10. В отличие от нейрональных дендритов, которые переплетаются между клеточными соматами, астроциты гиппокампа населяют визуально различимые территории с небольшим перекрытием между их процессами, создавая отчетливые домены 8,11,12,13. Доказательства, подтверждающие участие астроцитов в нейронных цепях, не подтверждают отсутствие подробного анатомического описания таких популяций и нейронов в их доменах14.
Процедуры трансдукции вирусных векторов, наряду с трансгенными животными (ТГ), были популяризированы в качестве набора инструментов для исследования структур, функций и клеточных взаимодействий мозга15,16. Использование различных промоторов позволяет нацеливаться на конкретные клетки в соответствии с их генетическими свойствами, уровнями активации17,18 или проекционными мишенями. Различные вирусы могут экспрессировать различные цветные флуорофоры в разных популяциях. Вирус может сочетаться с эндогенной экспрессией флуорофоров в ТГ, или ТГ животных можно использовать без необходимости в вирусах. Эти методы широко используются для маркировки нейронов, и некоторые лаборатории начали использовать их с модификациями, специализированными для нацеливания на другие типы клеток, такие как астроциты 5,9,19.
Метод CLARITY, впервые описанный в 2013 году20,21, позволяет изучать толстые срезы мозга, делая весь мозг прозрачным, оставляя микроскопические структуры нетронутыми. Объединив два метода — вирусную векторную трансдукцию и очистку тканей — теперь доступен вариант изучения пространственных взаимодействий между различными популяциями клеточных типов. Большинство исследований взаимодействия астроцитов и нейронов проводились на тонких срезах мозга, что приводило к изображениям неполных астроцитов из-за их больших доменов, тем самым радикально ограничивая количество анализируемых клеток. Использование метода CLARITY позволяет одновременно характеризовать одноклеточные популяции клеток в крупномасштабных объемах. Визуализация флуоресцентно помеченных клеточных популяций в чистом мозге не обеспечивает синаптического разрешения, но позволяет тщательно охарактеризовать пространственные взаимодействия между астроцитами и различными типами нейрональных клеток.
По этой причине мы использовали эти современные методы для исследования свойств астроцитов по всему дорсальному CA1, визуализируя всю пластинку (Stratum Radiatum, пирамидальный слой и Stratum Oriens). Мы измерили десятки тысяч астроцитов (с вирусной пенетрантностью >96%5), тем самым проанализировав информацию всей астроцитарной популяции вокруг CA1. При эффективном проникновении нейронных маркеров мы могли бы регистрировать взаимодействия между всей популяцией астроцитов CA1 и четырьмя типами нейронных клеток — парвальбумином (PV), соматостатином (SST), VIP-тормозными нейронами и возбуждающими пирамидальными клетками9.
Несколько экспериментов были проведены с использованием комбинации флуоресценции животных ТГ и разноцветных вирусных векторов (все ингибирующие клетки), в то время как другие (возбуждающие) использовали два вирусных вектора, экспрессирующих разные флуорофоры под разными промоторами9. В этой статье представлен подробный протокол, включая маркировку желаемых клеток в мозге, обеспечение прозрачности мозга с помощью модифицированной процедуры CLARITY, а также визуализацию и анализ полных структур мозга с использованием различных процедур и программного обеспечения.
протокол
Экспериментальные протоколы были одобрены Комитетом по уходу за животными и их использованию Еврейским университетом и соответствовали руководящим принципам Руководства Национального института здравоохранения по уходу за лабораторными животными и их использованию.
1. Вирусная векторная трансдукция
ПРИМЕЧАНИЕ: Вирусная векторная трансдукция используется для экспрессии флуорофоров в головном мозге.
- Используйте атлас (например, Allen Brain Atlas) для определения соответствующей координации целевой области.
ПРИМЕЧАНИЕ: 3D-атласы можно найти в Интернете (например, http://connectivity.brain-map.org/3d-viewer). - Используя стереотаксическую хирургию, вводите вирусные векторы в соответствующую структуру мозга. Подробный протокол см. вразделе 9 .
- Подождите 3-6 недель для выражения флуорофора.
ПРИМЕЧАНИЕ: Короткого периода времени достаточно, если необходимо отметить только тела клеток. Потребуется длительный период времени, если аксональные проекции имеют отношение к вопросу, так как флуорофорам требуется больше времени для экспрессии в аксонах, которые могут иметь длину в несколько миллиметров. - Заранее проверьте специфичность и пенетрантность экспрессии флуорофоров (как вирусной экспрессии, так и ТГ животных) (рисунок 1А). Прежде чем приступить к процедуре CLARITY, назначьте по крайней мере один мозг для тонких срезов и убедитесь, что экспрессия флуорофора является сильной и специфичной для особенности клетки-мишени.
2. ЯСНОСТЬ
ПРИМЕЧАНИЕ: Этот метод делает мозг прозрачным в течение 2-6 недель.
- Выполняйте транскраниальную перфузию на животных с использованием холодного фосфатно-буферного физиологического раствора (PBS) с последующим 4% параформальдегидом (PFA) в PBS. Удалите мозг и храните его в PFA на ночь при 4 °C в трубке 50 мл или аналогичном контейнере.
ПРИМЕЧАНИЕ: Перед проведением транскраниальной перфузии животное должно быть глубоко обезболено. В примерах, представленных в этом протоколе, всех животных анестезировали с использованием кетамина и ксилазина (90% и 10% соответственно). - Заменить PFA раствором гидрогеля (HS; см. таблицу 1) в течение 48 ч при 4 °C.
ПРИМЕЧАНИЕ: Не позволяйте материалам стать теплее, чем температура охлаждения (4-8 ° C) на этом этапе, иначе гидрогель полимеризуется. HS, используемый в этом протоколе, содержит 2% акриламида, в отличие от предыдущих протоколов, предполагающих 4% 22 или 1% 17. Выгода в 2% подробно описана в разделе обсуждения. При подготовке ТН ВЭД работают на ледяной поверхности. Храните при -20 °C. - Дегазация
ПРИМЕЧАНИЕ: Целью этого этапа является удаление всего свободного кислорода из ткани, поскольку O2 препятствует процессу полимеризации. Может быть использован любой газ, неотносящийся к О2 (например, N2, CO2); Рекомендуется N2 .- Перенесите N2 из резервуара через 5 мм (внутреннюю) гибкую трубку, соединенную с иглой 19 G на ее конце (рисунок 1B).
- Сделайте два небольших отверстия (шириной от иглы) в крышке трубки: одно для введения газа, а другое, чтобы позволить воздуху покинуть трубку (рисунок 1C).
- Прикрепите трубу от газа N2 к трубке и замените газы примерно на 30 мин при комнатной температуре (RT).
- Снимите трубу и немедленно запечатайте отверстия с помощью моделирующей глины на каждой трубке (рисунок 1D).
- Переместите дегазированные герметичные трубки в ванну с температурой 37 °C в течение 3,5 ч для полимеризации HS, который станет гелем. Будьте осторожны, чтобы не встряхнуть трубки (рисунок 1E).
- Извлеките мозг из трубки и аккуратно удалите полимеризованный гель вокруг нее с помощью лабораторных салфеток. Убедитесь, что к поверхности ткани не осталось остаточного геля, так как он может вступить в реакцию с раствором на следующих этапах, ингибируя процесс очистки тканей (рисунок 1F).
ПРИМЕЧАНИЕ: Поскольку гель содержал PFA, экстракция должна производиться под вытяжным кожухом. - Нарежьте мозг, если рассматриваемый вопрос требует только его части. Разделите его пополам или на очень толстые срезы, которые содержат все интересующие области (рисунок 1G).
- Поместите ломтики в первый очищающий раствор (CS1, см. таблицу 2) в новый контейнер и встряхните при 70 об/мин в течение 24 ч при 37 °C.
- Выполните описанные ниже шаги, чтобы перевести мозг из CS1 во второе очищающее решение (CS2, см. таблицу 2).
- Заранее подготовьте перфорированную трубку для мозга (рисунок 1Н).
- Разогрейте CS2 до 40-45 °C в стакане, достаточно большом, чтобы вместить трубку. Делайте это на конфорке с мешалкой. Убедитесь, что температура не достигает 55 °C, чтобы предотвратить отбеливание экспрессированных белков.
- Поместите стакан, заполненный CS2, и перфорированную трубку на перемешивающее устройство (стакан объемом 2 л на рисунке 1I). Установите умеренную скорость перемешивания, которая заставит жидкость течь, не искажая ткань.
ПРИМЕЧАНИЕ: В течение 2-6 недель ткань станет прозрачной (процесс начинается на периферии и движется внутрь к центральным структурам мозга). Решение о том, когда ткань «достаточно чистая», зависит от личного суждения. Мозг должен быть достаточно прозрачным для визуализации под микроскопом без помех (рисунок 1J недостаточно четкий; Рисунок 1K достаточно четкий). Превышение точки, в которой ткань достаточно прозрачна, может привести к потере жесткости ткани.
- Перевести из CS2 в PBST (0,5% Triton X-100 в PBS, см. Таблицу 2) в новом контейнере при 37 °C с легким встряхиванием (70 об/мин) в течение 24 ч.
ПРИМЕЧАНИЕ: В PBST ткань станет беловатой (рисунок 1L). Ясность вернется (и улучшится) при внедрении в решение для согласования показателей преломления (RIMS, см. шаг 2.14). - Замените PBST новым PBST. Хранить в тех же условиях (37 °C при легком встряхивании) еще 24 ч.
- Замените PBST снова на новый PBST и держите на RT в течение 24 часов.
- Перевод в PBS на RT в течение 24 ч.
- Замените PBS и оставьте в RT еще на 24 часа.
- Извлеките мозг из PBS и перенесите его в RIMS при 37 °C в течение ночи.
ПРИМЕЧАНИЕ: Первоначально рябь в RIMS может окружать мозг. Этот протокол был разработан и проверен с использованием двух конкретных коммерческих RIMS (см. таблицу 3). Однако протокол не должен отличаться при использовании других RIMS (коммерческих или самодельных). - Держите ткань на RT еще 24 ч или до тех пор, пока раствор не достигнет полного равновесия, т. е. когда ткань станет прозрачной, и раствор больше не будет содержать видимой ряби (рисунок 1M).
- Если ткань прозрачная, приступайте к камерной подготовке. Если в этот момент ткань становится белой, а не прозрачной (из-за агрегатов остаточных молекул SDS), снова очистите образец, повторив шаги 2.9 и 2.10, и перенесите ткань в CS2 (шаг 2.8) в течение нескольких дней, а затем все этапы до шага 2.15.
3. Подготовка камеры
ПРИМЕЧАНИЕ: Для каждого образца требуется слайд с камерой визуализации, в которую будет помещен образец.
- Поместите образец в середину слайда.
- Используя горячий клеевой пистолет, создайте стенки по краям затвора, почти такие же высокие, как ткань. Обязательно оставьте небольшой зазор (примерно 5 мм) в одном из углов (рисунок 2A,B).
- Нанесите 1-2 капли RIMS на образец, чтобы сохранить верхнюю поверхность влажной и предотвратить образование пузырьков между покровным листом и тканью.
- Сразу после нанесения капель RIMS добавьте последний слой горячего клея к стенкам (чтобы они достигли высоты мозга/среза) и сразу же прогрессируйте (пока горячий клей еще жидкий) к шагу 3.5.
- Запечатайте верхнюю часть чехлом, поместив его как можно более равномерно поверх еще теплого слоя горячего клея (рисунок 2C).
- Заполните камеру RIMS через зазор, оставленный в стенках горячего клея (рисунок 2D,E).
- Закройте зазор горячим клеем. Не оставляйте воздуха внутри (рисунок 2F).
- Если стенки горячего клея выходят за границы горки, вырежьте расширяющиеся края (рисунок 2G).
- Если объектив, используемый для визуализации, погружен, добавьте еще 2-3 мм клея к стенам над крышкой, чтобы погружной раствор прослужил более длительный период (рисунок 2H).
4. Визуализация (конфокальная или двухфотонная)
- Проверьте, может ли ступень удерживать камеру, так как толщина камеры может достигать нескольких миллиметров.
ПРИМЕЧАНИЕ: Например, конфокальный микроскоп (см. Таблицу материалов), используемый в этом протоколе, оснащен несколькими ступенями (например, круговой, прямоугольной). Какая бы ступень ни была выбрана для хранения камеры, она не имеет значения, если ее параметры соответствуют размерам камеры. - Работа с объективом с достаточным рабочим расстоянием, т.е. минимальным рабочим расстоянием ≥3 мм, так как интересующая область мозга может быть несколько миллиметров в глубину, а крышка может быть не совсем прямой, как это было размещено вручную.
ПРИМЕЧАНИЕ: В качестве демонстрации результаты, представленные на рисунке 1, видео 1 и видео 2 , были получены под двухфотонным микроскопом с использованием объектива погружения в воду 16x с рабочим расстоянием 3 мм и увеличением 2,4 для получения поля зрения 652 x 483 мкм и z-стека с интервалами 0,937 мкм между плоскостями. - Выполните многозонную визуализацию, которая может занять несколько часов или даже дней. Убедитесь, что на компьютере достаточно свободного места, так как размер каждого изображения может достигать десятков гигабит.
ПРИМЕЧАНИЕ: Визуализация CLARITY может привести к значительно большему количеству участков изображения в глубине. Поэтому интенсивности, используемые для захвата выражения, должны быть относительно низкими, чтобы предотвратить чрезмерную экспрессию во время суммирования изображения. - Для целей погружения регулярно проверяйте жидкость во время визуализации и при необходимости добавляйте дополнительную жидкость.
ПРИМЕЧАНИЕ: Во время визуализации данных, представленных в Видео 3, вода добавлялась на поверхность камеры каждые 6-8 ч для борьбы с испарением. - После получения изображения просмотрите и проанализируйте его с помощью нескольких различных пакетов программного обеспечения.
ПРИМЕЧАНИЕ: Рекомендуемое программное обеспечение включает Imaris и SyGlass как для визуализации, так и для анализа. Точный конвейер для оптимизированной реконструкции астроцитов с использованием программного обеспечения Imaris был описан ранее9. Короче говоря, особенностями Имариса, используемыми в этом исследовании, были нити для полной реконструкции клеточных структур и пятна для извлечения положения в пространстве всех сомат.
Результаты
Успешная очистка толстых срезов мозговой ткани приводит к новому кругу вопросов, которые можно задать относительно свойств больших клеточных популяций в отличие от свойств отдельных клеток или соседних групп клеток. Для достижения успешных результатов следует строго придерживаться протокола CLARITY, так как существует широкий спектр параметров, которые необходимо учитывать для уменьшения дисперсии между образцами (например, процент четкости, информация о флуоресценции, параметры опухания).
На рисунке 1 описан весь процесс очистки от валидации экспрессии флуоресцентного белка через все этапы метода очистки. На фиг.2 описано, как подготовить камеру для осветленной ткани, оптимальную для визуализации под двухфотонным или конфокальным микроскопом. Материалы, требуемые в этом протоколе, чрезвычайно недороги по сравнению с другими протоколами камерной подготовки.
На рисунке 3 представлен куб, описанный в Видео 1, где более 300 астроцитов показаны в очищенном участке части CA1 гиппокампа мыши. На рисунке 4 представлен куб, описанный в Видео 2, где как астроциты, так и возбуждающие нейрональные соматы показаны в толстой прозрачной ткани. На рисунке 5 показано целое полушарие, как описано в видео 3. Проекции нейронов головного мозга отображаются из дорсального CA1 (зеленый, GFP) и вентрального CA1 (красный, TdTomato).
Видео 1 представляет собой толстое изображение астроцитов гиппокампа (>300), полученное с помощью двухфотонного микроскопа после процедуры CLARITY. Флуоресценция обеспечивалась вирусной векторной трансдукцией, специфичной для астроцитов. Видео 2 представляет пространственную близость между астроцитами и ядрами пирамидальных клеток гиппокампа. Видео 3 прослеживает аксональные пучки по всему полушарию; Аксоны проецируются из первичной моторной коры и прослеживаются обратно от спинного мозга. Другой пучок прослеживается от дорсального гиппокампа к телам Supra Mammillary. Наконец, он прослеживает красный пучок аксонов от маммиллярных тел к их происхождению в вентральном гиппокампе. Все отмеченные клетки являются исключительно возбуждающими.

Рисунок 1: Подробное описание процесса очистки. (A) Валидация экспрессии флуорофора. В этом примере все астроциты в части CA1 гиппокампа мыши экспрессируют красный белок (TdTomato, изображенный в пурпурном цвете), и все возбуждающие нейроны экспрессируют зеленый белок в своих ядрах (H2B-GFP). Это изображение было получено с помощью 2-фотонного микроскопа. Изображение было получено с использованием 16-кратного объектива погружения в воду (0,8 NA) с увеличением 2,4 для получения поля зрения 652 x 483 мкм при 15,5 кадрах/с и z-стека с интервалами 0,937 мкм между плоскостями. Специфичность и пенетрантность были проверены иммуногистохимией9. (B) Для переноса газа N2 из резервуара в трубку, содержащую мозг, требуется труба с иглой на ее конце. (C) Воздух внутри трубки заменяется N2 путем создания двух отверстий, одно (верхняя стрелка) для притокаN2через иглу, соединенную с трубопроводом из бензобака, а другое (нижняя стрелка) для оттока. (D) Покрытие отверстий пластичной глиной сразу после дегазации предотвращает выход N2 из трубы. (E) Нагревание дегазированного раствора в течение 3,5 ч в теплой ванне. (F) Успешная полимеризация приводит к тому, что мозг встроен в гелеобразный HS. Пузырьки газа могут быть захвачены в полимере. (G) Сразу после извлечения из геля лучше всего разрезать мозг на нужную толщину. (H) Перфорированные трубы позволяют потоку раствора на мешалке достичь образца. (I) Мозги внутри перфорированных трубок удерживаются вертикально самодельным держателем размером, подходящим для 2-литрового стакана, стоящим на мешалке с конфоркой. (J) Пример мозга, который недостаточно ясен. Образец следует перемешивать в CS2 еще примерно одну неделю. (К) Пример достаточно ясного мозга. (L) При вставке прозрачного мозга в PBST ткань становится белее, чем раньше. Это изменение цвета происходит из-за Тритона и исчезнет при перемещении из этого решения в другое. (M) После >24 ч в RIMS мозг снова станет полностью прозрачным. Сокращения: GFP = зеленый флуоресцентный белок; NA = числовая диафрагма; HS = раствор гидрогеля; CS2 = клиринговое решение 2; PBST = фосфатно-буферный физиологический раствор, содержащий 0,5% тритона X-100; RIMS = Решение для согласования показателей преломления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Подготовка камеры. (A) Первый слой стен горячего клея покрывает края слайда и оставляет пространство, достаточно широкое, чтобы вместить мозг, не касаясь стен. В левом верхнем углу слайда остается одно отверстие. (B) Добавление слоя за слоем для достижения высоты ткани. (C) Прямой покров (белая стрелка) герметизирует камеру. (D) Камера, заполненная RIMS через отверстие в стенках камеры. (E) Камера заполнена RIMS, не оставляя пузырьков воздуха. (F) Герметизация отверстия в камере горячим клеем для предотвращения утечки. Вид сбоку. (G) На этом этапе любой остаток горячего клея, простирающийся по краям затвора, должен быть отрезан от камеры. (H) Полностью подготовленная камера, готовая к визуализации под микроскопом. Аббревиатура: RIMS = Решение для согласования показателей преломления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
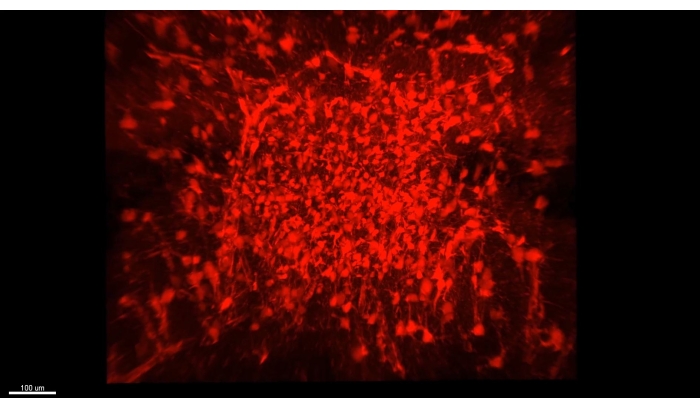
Рисунок 3: Все изображенные астроциты (AAV1-GFAP::TdTomato, красный) в очищенном гиппокампе. Один кадр из Видео 1 захватывает все изображенные астроциты (AAV1-GFAP::TdTomato, красный) в очищенном гиппокампе. Все подробности свойств изображения описаны в видео 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
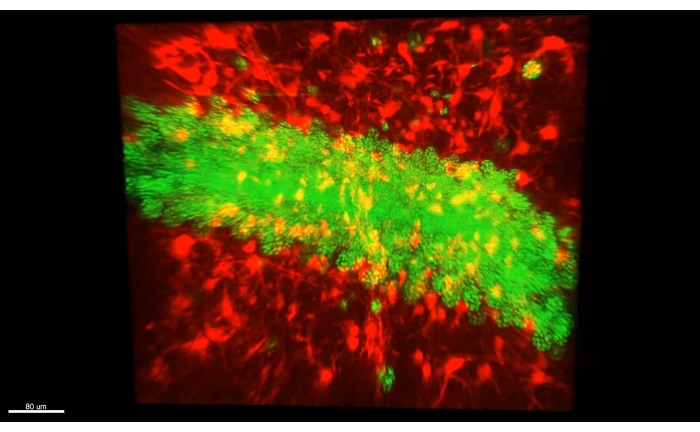
Рисунок 4: Астроциты (AAV1-GFAP::TdTomato, красный) и ядра пирамидальных клеток гиппокампа (AAV5-CaMKII::H2B-eGFP, зеленый) в толстой прозрачной ткани. Один кадр из Видео 2 , показывающий как астроциты (AAV1-GFAP::TdTomato, красный), так и ядра пирамидальных клеток гиппокампа (AAV5-CaMKII::H2B-eGFP, зеленый) в толстой прозрачной ткани. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
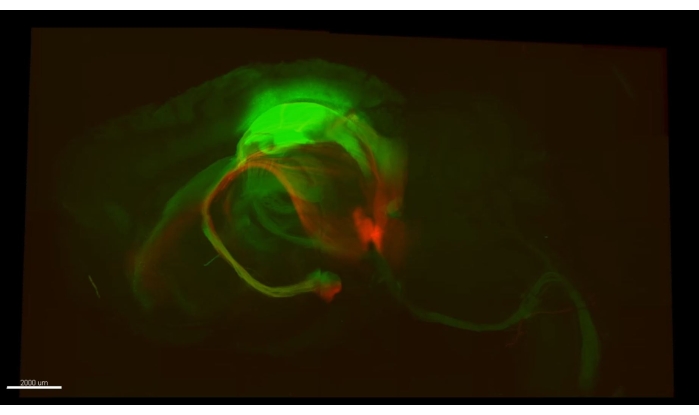
Рисунок 5: Зеленые аксоны (AAV5-CaMKII::eGFP, зеленый) и красные аксоны (AAV5-CaMKII::TdTomato). Один кадр из Видео 3 , показывающий оба типа аксонов, полученных из нескольких мест в мозге мыши, которые можно проследить по всему полушарию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: Кадры среза гиппокампа толщиной >1 мм дорсальных астроцитов CA1 гиппокампа (AAV1-GFAP::TdTomato, красный). Видео было получено с помощью двухфотонного микроскопа с использованием 16-кратного объектива (0,8 NA) с увеличением 2,4 после процедуры CLARITY. Подобно рисунку 1A, интервал z-стека был установлен равным 0,937 мкм. Флуоресценция обеспечивалась вирусной векторной трансдукцией, специфичной для астроцитов. Количество астроцитов в этом кубе составляет >300, и большинство процессов доступно для анализа в большинстве клеток. Сокращения: NA = числовая диафрагма; AAV = аденоассоциированный вирус; GFAP = глиальный фибриллярный кислый белок. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2: Астроциты и возбуждающие ядра нейронов в 3D-кубе. Куб содержит всю пластинку dCA1 в оптических условиях, указанных на рисунке 1A и видео 1. Этот куб демонстрирует пространственную близость между астроцитами (AAV1-GFAP::TdTomato, красный) и ядрами пирамидальных клеток гиппокампа (AAV5-CaMKII::H2B-eGFP, зеленый). Сокращения: AAV = аденоассоциированный вирус; GFAP = глиальный фибриллярный кислый белок; CAMKII = кальций/кальмодулин-зависимая протеинкиназа II; eGFP = усиленный зеленый флуоресцентный белок; H2B = гистон 2B. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 3: Трассировка аксональных пучков по всему полушарию. Зеленые аксоны (AAV5-CaMKII::eGFP, зеленый), заканчивающиеся в спинном мозге, легко прослеживаются до первичной моторной коры (более 7 мм друг от друга). От гиппокампа (дорсальная сторона) другой пучок прослеживается в сторону надмаммиллярных тел (большая часть вентральной стороны мозга), след длиной почти 3 мм. Во второй половине видео прослеживается красный пучок аксонов (AAV5-CaMKII::tdTomato), происходящий из вентрального гиппокампа обратно из их целевого местоположения в телах Маммиллари. Изображение было получено под сканирующим лазерным конфокальным микроскопом Olympus FV1000 с использованием 4-кратного объектива (0,16 NA), а несколько ROI были объединены с использованием функции MATL FluoView для представления всего полушария. Сокращения: AAV = аденоассоциированный вирус; CAMKII = кальций/кальмодулин-зависимая протеинкиназа II; eGFP = усиленный зеленый флуоресцентный белок; NA = числовая диафрагма; MATL = многозонная покадровая съемка. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
| Раствор гидрогеля (1 л) | |
| Материал | Количество |
| VA-044 Инициатор | 2.5 г |
| ПФА 4% | 900 мл |
| Акриламид (40%) | 50 мл |
| Бисакриламид (2%) | 50 мл |
Таблица 1: Приготовление раствора гидрогеля (1 л). Раствор гидрогеля необходимо приготовить на ледяной поверхности. Порядок, в котором смешиваются ингредиенты, не важен. Обратите внимание, что общий процент акриламида составляет 2%, в отличие от аналогичных протоколов, которые используют либо 1%17 , либо 4%22.
| Клиринговые решения (1 л) | ||
| Материал | Количество | |
| КС1 | CS2 | |
| Борная кислота (M.W. = 61,83 г/моль) | 12,366 г | 3.4 г |
| СДС | 80 г | 80 г |
| Основание Tris (M.W. = 121,14 г/моль) | 0 | 12.1 г |
| Дистиллированная вода (DW) | Заполнить до 1 л | Заполнить до 1 л |
| НаОХ | рН 8,5 | |
| 1 л фосфатно-буферного физиологического раствора с 0,5% тритона X-100 | ||
| Материал | Количество | |
| ПБС | 995 мл | |
| Тритон Х-100 | 5 мл | |
Таблица 2: Получение очистительных растворов 1 и 2 (1 л) и 1 л фосфатно-буферного физиологического раствора с 0,5% тритоном Х-100. Очищающие растворы можно приготовить заранее и держать при комнатной температуре в течение длительного периода. Любой раствор, содержащий борную кислоту и SDS, следует обрабатывать под вытяжным капюшоном, чтобы избежать вдыхания или контакта кожи с SDS или борной кислотой. NaOH в CS1 должен быть добавлен последним, чтобы установить pH на уровне 8,5. Каждый образец мозга должен быть помещен по крайней мере в 5-25 мл CS1 и храниться в течение ночи для достаточной диффузии. Сокращения: CS1 = клиринговое решение 1; SDS = додецилсульфат натрия; M.W. = молекулярная масса.
| Наименование продукта | Основное преимущество | Основной недостаток |
| РапиКлир | Образец остается прозрачным | Отек тканей |
| РапиКлир КС | Образец сжимается до нормального размера | Образец может потерять прозрачность |
Таблица 3: Варианты RIMS с преимуществами и недостатками. Rapiclear (RC, RI = 1,47) или CLARITY-specific Rapiclear (CSRC, RI = 1,45). Основное различие между этими двумя решениями заключается в том, что в то время как CSRC сжимает чистый мозг до его первоначального размера, rc-раствор этого не делает, оставляя очищенный образец слегка опухшим. Аббревиатура: RI = показатель преломления.
Обсуждение
Методы очистки тканей представляют собой революционный инструмент в исследованиях мозга, вызывая вопросы, которые ранее не могли быть заданы. Нацеливаясь на свойства небольшой группы клеток, одной клетки или даже одного синапса, CLARITY теперь позволяет нацеливаться на общие популяции клеток или функции связи на большие расстояния с помощью соответствующих флуорофоров.
Результат комбинации экспрессии флуорофора и процедуры CLARITY не является бинарным; многие факторы могут мешать процедуре, что приводит к неоптимальным результатам. Во-первых, экспрессия флуорофора должна быть проверена заранее. Поскольку процедура CLARITY вызывает некоторую потерю информации, достаточная экспрессия белка флуорофора имеет решающее значение для достоверности изображения в конце процесса CLARITY. Во-вторых, с транскраниальной перфузией нужно обращаться осторожно, следя за тем, чтобы вся кровь выходила из мозга, ведь автофлуоресценция крови приведет к недостоверным данным в толстых срезах. В-третьих, все параметры, обсуждаемые в протоколе, должны обрабатываться на каждом этапе процесса очистки с точностью, например, остатокO2 в HS до полимеризации или температурная неточность на каждой стадии предотвратит химическую реакцию между активными материалами.
Предыдущие протоколы17,22 рекомендуют различные концентрации акриламида в ГС. Основной целью акриламида является лучшая фиксация молекул с остатками аминов (белки и нуклеиновые кислоты). Незначительные изменения концентрации сильно влияют на весь процесс очистки: если фиксация слишком компактна, молекулы липидов не будут отрываться от ткани, а процесс очистки будет излишне затяжным или приведет к непрозрачности мозга. Более низкие концентрации акриламида, однако, не будут адекватно поддерживать структуру мозга, когда она лишена липидов. В этом протоколе процент акриламида устанавливается для обеспечения тонкого баланса фиксированной, но прозрачной ткани.
Большая часть процесса очистки происходит в CS2, и уровень прозрачности тканей должен проверяться ежедневно. Очистка PBST является важным шагом между растворами Clearing и решениями для согласования показателей преломления, поскольку она очищает остаточные молекулы SDS, которые могут взаимодействовать с RIMS. Также можно сохранить прозрачную ткань в ПБСТ (0,5%) на неопределенный срок, если камерная подготовка еще не нужна.
При размещении мозга в RIMS следует ознакомиться с преимуществами и ограничениями решений. Например, RapiClear вызовет полную прозрачность даже в почти очищенных тканях, но и вызовет некоторую припухлость, которой не стоит пренебрегать при анализе данных. Предыдущие измерения9 предполагают равное расширение вдоль всех осей (т.е. дорсовентральной, передне-задней и латерально-медиальной осей), что позволяет рассчитать индекс отека по сравнению с тонкими срезами из той же области мозга. Использование CLARITY-Specific RapiClear устраняет отек; однако, если какие-либо остатки SDS остаются в ткани, они будут накапливаться в непрозрачные массы.
Еще одним преимуществом этого модифицированного протокола является его стоимость. Предыдущие протоколы предлагают различные типы клея для создания камеры, которая может удерживать мозг в RIMS. В этом протоколе мы просто используем горячий клей. Он не реагирует с растворами, доступен для покупки везде, прост в использовании и значительно дешевле, чем клеи, предложенные ранее.
Данные, полученные в результате визуализации толстых образцов мозга, могут описывать целые клеточные популяции, связь между структурами мозга или отслеживание одного аксона на больших расстояниях (Видео 3). Хотя вопросы, касающиеся этих характеристик, задавались и раньше, достоверность данных, которые теперь достижимы с использованием толстых срезов мозга, значительно улучшается по сравнению с предыдущими, подверженными ошибкам методам наложения изображений с тонким срезом.
Процесс CLARITY обеспечивает успешную и равномерную очистку толстых срезов - от нескольких миллиметров до полной визуализации мозга. Пассивная очистка (т.е. не использование ETC) снижает риск нанесения вреда тканям и время, на которое образцы погружаются в очищающие растворы, чтобы это не влияло на высокую эффективность сохранения белка.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Этот проект получил финансирование от Европейского исследовательского совета (ERC) в рамках исследовательской и инновационной программы Европейского союза Horizon 2020 (грантовое соглашение No 803589), Израильского научного фонда (грант ISF No 1815/18) и канадско-израильских грантов (CIHR-ISF, грант No 2591/18). Мы благодарим Нехаму Новика за комментарий ко всей рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| AAV1-GFAP::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect astrocytes | |
| AAV5-CaMKII::eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| AAV5-CaMKII::H2B-eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neuronal nuclei | |
| AAV5-CaMKII::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| Acrylamide (40%) | Bio-rad | #161-0140 | |
| Bisacrylamide (2%) | Bio-rad | #161-0142 | |
| Boric acid | Sigma | #B7901 | Molecular weight - 61.83 g/mol |
| Confocal microscope, scanning, FV1000 | Olympus | 4x objective (UPlanSApo, 0.16 NA) | |
| Imaris software | Bitplane, UK | A software that allows 3D analysis of images | |
| NaOH | Sigma | #S5881 | |
| PBS | |||
| PFA 4% | EMS | #15710 | |
| RapiClear | SunJin lab | #RC147002 | |
| RapiClear CS | SunJin lab | #RCCS002 | |
| SDS | Sigma | #L3771 | |
| SyGlass software | A software that allows 3D analysis of images using virtual reality | ||
| Tris base 1 M | Bio-rad | #002009239100 | Molecular weight - 121.14 g/mol |
| Triton X-100 | ChemCruz | #sc-29112A | |
| Two photon microscope | Neurolabware | Ti:sapphire laser (Chameleon Discovery TPC, Coherent), GaAsP photo-multiplier tubes (Hamamatsu, H10770-40) , bandpass filter (Semrock), water immersion 16x objective (Nikon, 0.8 NA) | |
| VA-044 Initiator | Wako | #011-19365 |
Ссылки
- Perea, G., Navarrete, M., Araque, A. Tripartite synapses: astrocytes process and control synaptic information. Trends in Neurosciences. 32 (8), 421-431 (2009).
- Ciappelloni, S., et al. Aquaporin-4 surface trafficking regulates astrocytic process motility and synaptic activity in health and autoimmune disease. Cell Reports. 27 (13), 3860-3872 (2019).
- Sylvain, N. J., et al. The effects of trifluoperazine on brain edema, aquaporin-4 expression and metabolic markers during the acute phase of stroke using photothrombotic mouse model. Biochimica et Biophysica Acta. Biomembranes. 1863 (5), 183573(2021).
- Kitchen, P., et al. Targeting aquaporin-4 subcellular localization to treat central nervous system edema. Cell. 181 (4), 784-799 (2020).
- Adamsky, A., et al. Astrocytic activation generates de novo neuronal potentiation and memory enhancement. Cell. 174 (1), 59-71 (2018).
- Adamsky, A., Goshen, I. Astrocytes in memory function: pioneering findings and future directions. Neuroscience. 370, 14-26 (2018).
- Nagai, J., et al. Behaviorally consequential astrocytic regulation of neural circuits. Neuron. 109 (4), 576-596 (2021).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Refaeli, R., et al. Features of hippocampal astrocytic domains and their spatial relation to excitatory and inhibitory neurons. Glia. 69 (10), 2378-2390 (2021).
- Eilam, R., Aharoni, R., Arnon, R., Malach, R. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human. eLife. 5, 15915(2016).
- Bushong, E. A., Marton, M. E., Ellisman, M. H. Maturation of astrocyte morphology and the establishment of astrocyte domains during postnatal hippocampal development. International Journal of Developmental Neuroscience. 22 (2), 73-86 (2004).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. Journal of Comparative Neurology. 462 (2), 241-251 (2003).
- Bushong, E. A., Martone, M. E., Jones, Y. Z., Ellisman, M. H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. The Journal of Neuroscience. 22 (1), 183-192 (2002).
- Chai, H., et al. Neural circuit-specialized astrocytes: transcriptomic, proteomic, morphological, and functional evidence. Neuron. 95 (3), 531-549 (2017).
- Taniguchi, H., et al. A resource of Cre driver lines for genetic targeting of GABAergic neurons in cerebral cortex. Neuron. 71 (6), 995-1013 (2011).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159(2005).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- DeNardo, L. A., et al. Temporal evolution of cortical ensembles promoting remote memory retrieval. Nature Neuroscience. 22 (3), 460-469 (2019).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены