Method Article
クリア脳におけるアストロサイトとニューロンの空間的相互作用の解明
要約
CLARITY法を用いたウイルスベクター形質導入と脳クリアリングを組み合わせることで、多数のニューロンとアストロサイトを同時に調べることができます。
要約
CLARITY法を用いたウイルスベクター形質導入と組織クリアリングを組み合わせることで、数種類の脳細胞とその相互作用を同時に調べることができます。ウイルスベクター形質導入は、同じ組織内で異なる蛍光色の多様な細胞タイプのマーキングを可能にします。細胞は、活性または投影によって遺伝的に同定することができる。修正されたCLARITYプロトコルを使用して、アストロサイトおよびニューロンの潜在的なサンプルサイズは2〜3桁成長した。CLARITYを使用すると、スライスに全体収まるには大きすぎる完全なアストロサイトのイメージングと、すべてのプロセスによるソマタの検査が可能になります。さらに、アストロサイトと異なるニューロン細胞型との間の空間的相互作用、すなわち、各アストロサイトドメイン内の錐体ニューロンの数、またはアストロサイトと特定の阻害性ニューロン集団との間の近接性を調査する機会を提供する。このホワイト ペーパーでは、これらのメソッドをどのように適用するかを詳しく説明します。
概要
近年、アストロサイト機能とそれらがニューロン回路とどのように相互作用するかについての知識は劇的に増加しています。アストロサイトは可塑性1,2に影響を与え、ニューロンの損傷後の回復を補助し3,4、さらにはde novoニューロン増強を誘導することができ、最近の研究では、以前は純粋にニューロン機能と考えられていた記憶獲得と報酬におけるアストロサイトの重要性が示されている5,6,7.アストロサイト研究において特に興味深い特徴は、海馬および他の脳構造におけるユニークな空間組織を維持する細胞の空間配置である8,9,10。細胞体腫の間で絡み合うニューロン樹状突起とは異なり、海馬アストロサイトは、そのプロセスの間にわずかに重複して視覚的に区別可能な領域に生息し、別個のドメイン8、11、12、13を作り出す。ニューロン回路へのアストロサイトの関与を支持する証拠は、そのような集団およびそれらのドメイン内のニューロンの詳細な解剖学的記述の欠如を支持しない14。
ウイルスベクター形質導入手順は、トランスジェニック動物(TG)とともに、脳の構造、機能、および細胞相互作用を調査するためのツールセットとして普及している15,16。異なるプロモーターの利用は、それらの遺伝的特性、活性化レベル17、18、または投影標的に応じた特定の細胞の標的化を可能にする。異なるウイルスは、異なる集団で異なる色の蛍光色素を発現することができる。ウイルスは、TGにおける蛍光色素の内因性発現と組み合わせることができ、またはTG動物をウイルスを必要とせずに使用することができる。これらの技術はニューロンマーキングに広く使用されており、一部の研究室では、アストロサイト5、9、19などの他の細胞型を標的とすることに特化した修飾でそれらを使用し始めています。
201320,21で最初に記述されたCLARITY技術は、微視的構造をそのまま残しながら脳全体を透明にすることによって、厚い脳スライスの研究を可能にする。ウイルスベクター形質導入と組織クリアリングの2つの方法を組み合わせることで、異なる細胞型集団間の空間的相互作用を調べるオプションが利用可能になりました。ほとんどのアストロサイト-ニューロン相互作用研究は、薄い脳スライスに対して実施され、その結果、ドメインが大きいために不完全なアストロサイトの画像が得られ、分析された細胞の数が根本的に制限された。CLARITY技術を使用することで、大規模ボリューム内の細胞集団の単一セル分解能特性評価を同時に行うことができます。明瞭な脳内の蛍光タグ付き細胞集団をイメージングしてもシナプス分解能は得られませんが、アストロサイトとさまざまなニューロン細胞タイプとの間の空間的相互作用の徹底的な特徴付けが可能になります。
そのため、これらの最先端の技術を利用して、背側CA1全体のアストロサイトの特性を調査し、すべての薄層(ラディアタム層、ピラミッド層、オリエンス層)をイメージングしました。我々は数万のアストロサイト(ウイルス浸透度>96%5)を測定し、CA1周辺のアストロサイト集団全体の情報を解析した。ニューロンマーカーの効率的な浸透により、CA1アストロサイトの集団全体と、パルブアルブミン(PV)、ソマトスタチン(SST)、VIP阻害性ニューロン、および興奮性錐体細胞の4種類のニューロン細胞との間の相互作用を記録することができました9。
TG動物からの蛍光と異なる色のウイルスベクター(すべての阻害細胞)の組み合わせを用いていくつかの実験を実施し、一方、他の実験(興奮性)は、異なるプロモーター下で異なる蛍光団を発現する2つのウイルスベクターを利用した9。この論文では、脳内の所望の細胞のタグ付け、修正されたCLARITY手順を使用して脳を透明にすること、および様々な手順およびソフトウェアを使用して完全な脳構造を画像化および分析することを含む詳細なプロトコルを提示する。
プロトコル
実験プロトコルは、ヘブライ大学動物ケアおよび使用委員会によって承認され、実験動物のケアおよび使用のための国立衛生研究所ガイドのガイドラインを満たしていた。
1. ウイルスベクター形質導入
注: ウイルスベクター形質導入は、脳内で蛍光色素を発現するために使用されます。
- アトラス(例:Allen Brain Atlas)を使用して、ターゲット領域の関連する調整を見つけます。
注:3Dアトラスはオンラインで見つけることができます(例:http://connectivity.brain-map.org/3d-viewer)。 - 定位手術を使用して、ウイルスベクターを関連する脳構造に注入する。詳細なプロトコルについては、9 を参照してください。
- 蛍光色素分子の発現を3~6週間待ちます。
注: 細胞体のみをマークする必要がある場合は、短い時間で十分です。軸索突起が問題に関連する場合、蛍光色素分子が軸索内で発現するのに時間がかかるため、長い期間が必要になります(長さは数ミリメートルです)。 - 蛍光色素分子発現(ウイルス発現とTG動物の両方)の特異性と浸透度を事前に検証します(図1A)。CLARITY手順に進む前に、薄いスライス用に少なくとも1つの脳を指定し、蛍光色素分子の発現が強く、標的細胞の特徴に特異的であることを確認してください。
2. 明快さ
注:この方法は、2〜6週間以内に脳を透明にします。
- 冷たいリン酸緩衝生理食塩水(PBS)に続いてPBS中の4%パラホルムアルデヒド(PFA)を使用して動物に経頭蓋灌流を行います。脳を取り出し、50mLチューブまたは同様の容器中で4°Cで一晩PFA中に保管する。
注:経頭蓋灌流が行われる前に、動物は深く麻酔されなければなりません。このプロトコールに提示された実施例において、全ての動物を、ケタミンおよびキシラジン(それぞれ90%および10%)を用いて麻酔した。 - PFAをヒドロゲル溶液(HS; 表1参照)と交換し、4°Cで48時間処理する。
注:この段階で材料が冷凍温度(4-8°C)よりも暖かくならないようにしてください、さもなければヒドロゲルは重合します。このプロトコルで使用されるHSは、4%22または1%17を示唆する以前のプロトコルとは異なり、2%アクリルアミドを含む。2%の利点については、ディスカッションセクションで詳しく説明します。HSを準備するときは、氷のように冷たい表面で作業してください。-20°Cで保管してください。 - 脱 ガス
注:この段階の目的は、O2が重合プロセスを妨害するため、組織からすべての遊離酸素を除去することです。任意の非O2ガス(例えば、N2、CO2)を使用することができる。N2が推奨されます。- N2を、5mm(内部)の可撓性チューブを介してタンクから移送し、その端にある19G針に接続します(図1B)。
- チューブのキャップに2つの小さな穴(針幅)を作ります:1つはガスを導入するため、もう1つは空気がチューブから出ることができるようにします(図1C)。
- N2ガスからチューブに配管を取り付け、室温(RT)で約30分間ガスを交換します。
- パイプを取り外し、すぐにすべてのチューブのモデリング粘土で穴を密封します(図1D)。
- 脱気した密閉管を37°Cの槽に3.5時間移し、HSを重合させ、ゲル状になる。チューブを振らないように注意してください(図1E)。
- チューブから脳を抽出し、実験室のワイプを使用して周囲から重合ゲルを静かに取り除きます。以下のステップで溶液と反応し、組織クリアリングプロセスを阻害する可能性があるため、残留ゲルが組織の表面に付着したままにならないことを確認してください(図1F)。
注:ゲルにはPFAが含まれていたため、抽出はヒュームフードの下で行う必要があります。 - 目の前の質問が脳の一部だけを必要とする場合は、脳をスライスします。それを半分に分けるか、すべての関心領域を含む非常に厚いスライスに分割します(図1G)。
- スライスを新しい容器内の第1の透明化溶液(CS1、 表2参照)に入れ、70rpmで37°Cで24時間振とうする。
- 以下に説明する手順に従って、脳をCS1から2番目のクリアリングソリューション(CS2、 表2参照)に移します。
- 脳用の穴あきチューブを予め用意しておきます(図1H)。
- CS2をチューブを入れるのに十分な大きさのビーカーで40〜45°Cに予熱する。スターラー付きのホットプレートでこれを行います。発現タンパク質の漂白を防ぐために、温度が55°Cに達していないことを確認してください。
- CS2を充填したビーカーと有孔管とを攪拌装置( 図1Iでは2Lビーカー)の上に置く。組織を歪めることなく液体を流動させる適度な攪拌速度を設定します。
注:2〜6週間以内に、組織は透明になります(このプロセスは末梢から始まり、中枢脳構造に向かって内側に移動します)。組織がいつ「十分に明確」になるかの決定は、個人的な判断に委ねられています。脳は、干渉なしに顕微鏡下で画像化するために十分に透明でなければならない(図1J は十分に明確ではない。 図1Kは 十分に明確である)。組織が十分に透明である点を超えると、組織の剛性が失われる可能性があります。
- CS2からPBST(PBS中の0.5% Triton X-100、 表2参照)に新しい容器に移し、37°Cで24時間穏やかな振とう(70rpm)した。
注:PBSTでは、組織は白っぽくなります(図1L)。屈折率マッチングソリューション(RIMS、ステップ2.14参照)に埋め込まれると、明瞭さが戻り(そして改善)します。 - PBST を新しい PBST に置き換えます。同じ条件(穏やかな振とうで37°C)でさらに24時間保管してください。
- PBST を新しい PBST に再度交換し、RT で 24 時間待機します。
- RT で PBS に 24 時間転送します。
- PBS を交換し、RT でさらに 24 時間放置します。
- PBSから脳を取り出し、37°Cで一晩RIMSに移す。
注:最初は、RIMSの波紋が脳を囲むことがあります。このプロトコルは、2つの特定の商用RIMSを使用して設計および検証されました( 表3を参照)。ただし、他のRIMS(商用または自作)を使用する場合、プロトコルは変わらないはずです。 - さらに24時間、または溶液が完全な平衡に達するまで、すなわち組織が透明になり、溶液に目に見える波紋が含まれなくなるまで、組織をRTに保ちます(図1M)。
- 組織が透明である場合は、チャンバーの準備に進みます。この時点で、組織が透明ではなく白色になった場合(残留SDS分子の凝集体による)、ステップ2.9および2.10を繰り返してサンプルを再度洗浄し、組織をCS2に数日間移し(ステップ2.8)、続いてステップ2.15までのすべてのステップを実施した。
3. チャンバーの準備
メモ:各サンプルには、サンプルが置かれるイメージングチャンバーを備えたスライドが必要です。
- スライドの中央にサンプルを配置します。
- ホットグルーガンを使用して、スライドの端に組織とほぼ同じ高さの壁を作ります。角の1つに小さな隙間(約5 mm)を残してください(図2A、B)。
- サンプルにRIMSを1〜2滴塗布して、上面を湿らせ、カバースリップと組織の間に気泡が形成されるのを防ぎます。
- RIMS滴を塗布した直後に、ホットグルーの最後の層を壁に追加し(脳/スライスの高さに達するように)、すぐに(ホットグルーがまだ液体である間)ステップ3.5に進みます。
- 上部をカバースリップで密封し、まだ温かいホットグルー層の上にできるだけ均等に置きます(図2C)。
- ホットグルー壁に残された隙間からチャンバーをRIMSで満たします(図2D、E)。
- 熱い接着剤で隙間を塞ぎます。内部に空気を入れないでください(図2F)。
- ホットグルーの壁がスライドの境界を越えて伸びている場合は、伸びているエッジをカットします(図2G)。
- イメージングに使用する対物レンズが浸漬されている場合は、カバースリップの上の壁にさらに2~3mmの接着剤を追加して、浸漬溶液が長期間持続するようにします(図2H)。
4. イメージング(共焦点または二光子)
- チャンバーの厚さが数ミリメートルに達する可能性があるため、ステージがチャンバーを保持できるかどうかを確認します。
注:例えば、このプロトコルで使用される共焦点顕微鏡( 材料表を参照)は、いくつかの段階(例えば、円形、長方形)を備えている。チャンバを保持するためにどのステージが選択されても、そのパラメータがチャンバのサイズに適合する限り、無関係です。 - 十分な作動距離、すなわち最小作動距離≥3mmの対物レンズで作業し、関心領域の脳領域は数ミリメートルの深さであり、カバースリップは手動で配置されたように完全にまっすぐではない可能性がある。
注:デモンストレーションとして、 図1、ビデオ1、および ビデオ2に提示された結果は、3mmの作動距離と2.4倍の倍率で水浸漬16倍の対物レンズを使用して 2 光子顕微鏡下で得られ、652 x 483μmの視野と平面間の間隔が0.937μmのzスタックを得た。 - 複数エリアイメージングを実行しますが、これには数時間から数日かかる場合があります。各イメージのサイズが最大数十ギガビットに達する可能性があるため、コンピュータに十分な空きストレージがあることを確認してください。
注:クラリティイメージングでは、画像セクションの深さが大幅に増加する可能性があります。したがって、画像の要約中に過剰発現を防ぐために、式をキャプチャするために使用される強度は比較的低くする必要があります。 - 浸漬目標の場合は、イメージング中に液体を定期的にチェックし、必要に応じて追加の液体を補充します。
注: ビデオ3に示されているデータのイメージング中、蒸発と戦うために6〜8時間ごとにチャンバの表面に水が追加されました。 - イメージを取得したら、いくつかの異なるソフトウェアパッケージを使用してイメージを表示および分析します。
メモ: 推奨されるソフトウェアには、視覚化と分析の両方のための Imaris と SyGlass が含まれます。Imarisソフトウェアを使用してアストロサイトの再構成を最適化するための正確なパイプラインは、以前に説明されています9.要するに、この研究で使用されたイマリの特徴は、細胞構造を完全に再構築するためのフィラメントと、すべてのソマタの空間における位置を抽出するためのスポットでした。
結果
厚い脳組織スライスのクリアリングに成功すると、単一細胞または隣接する細胞群の特性とは対照的に、大きな細胞集団の特性に関して尋ねることができる新しい範囲の質問が生じる。成功する結果を達成するためには、サンプル間の分散を減らすために考慮する必要がある幅広いパラメータ(例えば、透明度の割合、蛍光情報、腫れ度パラメータ)があるため、CLARITYプロトコルに厳密に従う必要があります。
図1は 、蛍光タンパク質発現検証から透明化方法のすべての段階までの透明化プロセス全体を説明しています。 図2 は、清澄化された組織のためのチャンバーを調製する方法を記載し、二光子または共焦点顕微鏡下での画像化に最適な。このプロトコルで必要とされる材料は、チャンバ調製の他のプロトコルと比較して非常に安価である。
図3 は、 ビデオ1で説明した立方体を示しており、マウス海馬のCA1部分のクリアされたセクションに300以上のアストロサイトが示されています。 図4 は、 ビデオ2で説明した立方体を示しており、アストロサイトと興奮性ニューロン体腫の両方が厚い透明な組織で示されています。 図 5 は、 ビデオ 3 で説明したように、半球全体を示しています。脳全体のニューロン投影は、背側CA1(緑、GFP)および腹側CA1(赤、Tdトマト)から表示される。
ビデオ1 は、CLARITY手順の後に2光子顕微鏡で取得した海馬アストロサイト(>300)の厚い画像を示しています。蛍光は、アストロサイトに特異的なウイルスベクター形質導入によって提供された。 ビデオ2 は、アストロサイトと海馬錐体細胞の核との間の空間的近接性を示しています。 ビデオ3は 、半球全体にわたって軸索束をトレースします。軸索は一次運動皮質から突出しており、脊髄からさかのぼります。別の束は背側海馬からスープラ・マンミラリー体に向かって辿られる。最後に、それはマンミラリー体から腹側海馬の起源に向かって軸索の赤い束をたどります。マークされたすべての細胞は排他的に興奮性である。

図1:透明化プロセスの詳細な説明。(A)フルオロフォア発現の検証。この例では、マウス海馬のCA1部分のすべてのアストロサイトが赤色タンパク質を発現し(TdTomato、マゼンタで画像化)、すべての興奮性ニューロンが核内で緑色タンパク質(H2B-GFP)を発現する。この画像は、2光子顕微鏡を用いて取得した。画像は、倍率2.4の水浸漬16x対物レンズ(0.8NA)を使用して撮影され、15.5フレーム/秒で652 x 483μmの視野と、平面間の0.937μm間隔のzスタックを得た。特異性および浸透度を免疫組織化学9により検証した。(B)N2ガスをタンクから脳を保持するチューブに移すには、その端に針を備えたパイプが必要です。(C)チューブ内の空気をN2に置換し、ガスタンクから配管に接続された針を介してN2を流入させるための穴(上矢印)、流出用の穴(下矢印)を2つ作ります。(D)脱気直後にモデリング粘土で穴を覆うと、N2がチューブから出るのを防ぎます。(e)脱気溶液を温浴中で3.5時間加熱する。(f)重合の成功は、ゲル化したHSに埋め込まれた脳をもたらす。気泡がポリマーに閉じ込められる可能性があります。(g)ゲルから抽出した直後は、脳を所望の厚さに切断するための最良のポイントである。(H)穴あきチューブは、攪拌機上の溶液の流れがサンプルに到達することを可能にする。(I)穴あき管内の脳は、2Lビーカーに収まる大きさの自作ホルダーで垂直に保持し、ホットプレートスターラーの上に立てる。(J) 十分に明確でない脳の例。サンプルをCS2中でさらに約1週間撹拌する必要があります。(k)十分に明瞭な脳の例。(L)PBSTに澄んだ脳を挿入すると、組織が以前よりも白くなる。この色の変化はTritonによるもので、このソリューションから次のソリューションに移動すると消えます。(M)RIMSで>24時間後、脳は再び完全に透明になります。略語: GFP = 緑色蛍光タンパク質;NA = 開口数;HS = ヒドロゲル溶液;CS2 = クリアリングソリューション2;PBST = 0.5%トリトンX-100を含むリン酸緩衝生理食塩水;RIMS = 屈折率整合ソリューション。この図の拡大版を表示するには、ここをクリックしてください。

図2:チャンバーの準備 (A)ホットグルー壁の最初の層はスライドの端を覆い、壁に触れることなく脳を収容するのに十分な幅のスペースを残します。スライドの左上隅に 1 つの穴が残っています。(b)組織の高さに達するように層を重ねる。(C)ストレートカバースリップ(白い矢印)はチャンバーを密閉します。(D)チャンバ壁の穴を通してRIMSで満たされたチャンバ。(E)チャンバは気泡を残さないRIMSで満たされている。(F)チャンバー内の穴をホットグルーで密封し、漏れを防ぎます。側面図。(G) この段階では、スライドの端に伸びている熱い接着剤の残骸は、チャンバーから切り落とす必要があります。(h)完全に準備されたチャンバー、顕微鏡下でのイメージングの準備ができています。略語:RIMS = 屈折率マッチングソリューション。 この図の拡大版を表示するには、ここをクリックしてください。
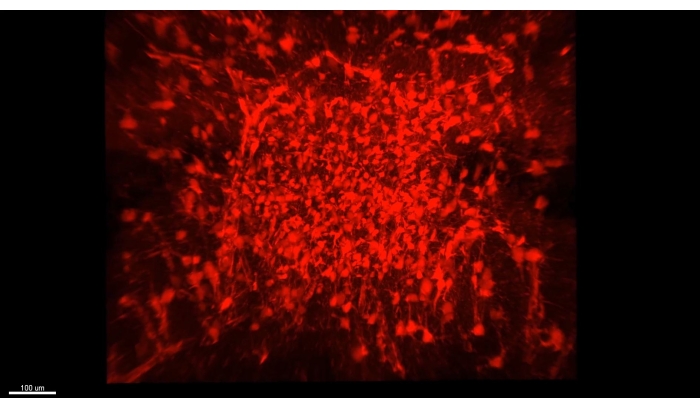
図3:クリアされた海馬におけるすべての画像化されたアストロサイト(AAV1-GFAP::TdTomato、赤)。 ビデオ1の1フレームで、クリアされた海馬内のすべての画像化されたアストロサイト(AAV1-GFAP::TdTomato、赤)をキャプチャしました。画像プロパティの詳細については、「ビデオ 1」を参照してください。この図の拡大版を表示するには、ここをクリックしてください。
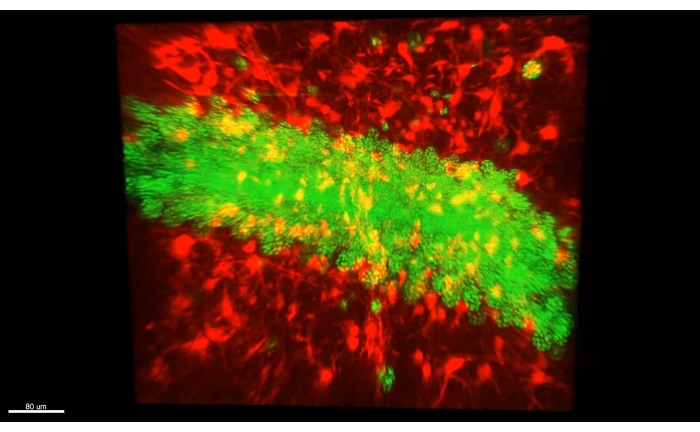
図4:アストロサイト(AAV1-GFAP::Tdトマト、赤)および海馬錐体細胞核(AAV5-CaMKII::H2B-eGFP、緑)の厚い透明組織。厚い透明組織におけるアストロサイト(AAV1-GFAP::TdTomato、赤)と海馬錐体細胞核(AAV5-CaMKII::H2B-eGFP、緑)の両方を示すビデオ2の1つのフレーム。この図の拡大版を表示するには、ここをクリックしてください。
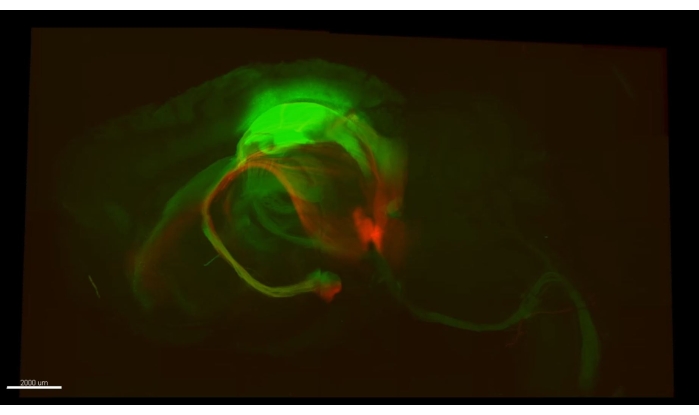
図5:緑色の軸索(AAV5-CaMKII::eGFP、緑色)および赤色軸索(AAV5-CaMKII::TdTomato)。ビデオ3の1つのフレームは、半球全体にわたって追跡できるマウス脳内のいくつかの位置に由来する両方のタイプの軸索を示しています。この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1:海馬背側CA1アストロサイトの厚さ>1mmのスライス(AAV1-GFAP::TdTomato、赤)の映像。 ビデオは、CLARITY手順に従って倍率2.4の16倍対物レンズ(0.8NA)を使用して2光子顕微鏡で取得されました。 図1Aと同様に、zスタック間隔は0.937μmに設定されました。蛍光は、アストロサイトに特異的なウイルスベクター形質導入によって提供された。この立方体内のアストロサイトの数は>300であり、ほとんどのプロセスはほとんどの細胞で分析に利用可能です。略語: NA = 開口数;AAV = アデノ随伴ウイルス;GFAP=グリア線維性酸性タンパク質。 このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2:3D立方体内のアストロサイトと興奮性ニューロン核。立方体には、図1Aおよびビデオ1で説明した光学条件下でのdCA1のすべての薄層が含まれています。この立方体は、アストロサイト(AAV1-GFAP::TdTomato、赤)と海馬錐体細胞の核(AAV5-CaMKII::H2B-eGFP、緑)との間の空間的近接性を示す。略語: AAV = アデノ随伴ウイルス;GFAP=グリア線維性酸性タンパク質;CAMKII = カルシウム/カルモジュリン依存性プロテインキナーゼII;eGFP = 増強された緑色蛍光タンパク質;H2B = ヒストン 2B。このビデオをダウンロードするには、ここをクリックしてください。
ビデオ 3: 半球全体にわたる軸索束のトレース。 脊髄で終わる緑色の軸索(AAV5-CaMKII::eGFP、緑色)は、一次運動皮質(7mm以上離れている)に容易にさかのぼります。海馬(背側)から、別の束がスープラマミラリー体(脳の最も腹側)に向かってトレースされ、長さ約3mmの痕跡があります。ビデオの後半は、腹側海馬に由来する軸索の赤い束(AAV5-CaMKII::tdTomato)を、マンミラリー体の標的位置からさかのぼってトレースします。画像は、4倍の対物レンズ(0.16NA)を使用してオリンパスの走査レーザー共焦点顕微鏡FV1000の下で撮影され、MATL FluoView-featureを使用して複数のROIを組み合わせて半球全体を提示しました。略語: AAV = アデノ随伴ウイルス;CAMKII = カルシウム/カルモジュリン依存性プロテインキナーゼII;eGFP = 増強された緑色蛍光タンパク質;NA = 開口数;MATL = 複数エリアのタイムラプス。 このビデオをダウンロードするには、ここをクリックしてください。
| ヒドロゲル溶液(1L) | |
| 材料 | 量 |
| VA-044 イニシエータ | 2.5グラム |
| PFA 4% | 900キロリットル |
| アクリルアミド (40%) | 50ミリリットル |
| ビサクリルアミド (2%) | 50ミリリットル |
表1:ヒドロゲル溶液(1L)の調製。 ヒドロゲル溶液は、氷冷した表面上に調製されなければならない。成分が混合される順序は重要ではない。アクリルアミドの合計の割合は、1%17 または4%22のいずれかを使用する同様のプロトコルとは異なり、2%であることに注意してください。
| クリアリングソリューション(1 L) | ||
| 材料 | 量 | |
| CS1 | CS2 | |
| ホウ酸 (M.W. = 61.83 グラム/モル) | 12.366グラム | 3.4グラム |
| ティッカー | 80グラム | 80グラム |
| トリス塩基 (M.W. = 121.14 g/mol) | 0 | 12.1グラム |
| 蒸留水(DW) | 1 Lまで充填 | 1 Lまで充填 |
| ナオオ | pH 8.5 | |
| 1 L のリン酸緩衝生理食塩水と 0.5% トリトン X-100 | ||
| 材料 | 量 | |
| ティッカー | 995キロリットル | |
| トリトンX-100 | 5キロリットル | |
表2:0.5%Triton X-100を用いた透明化溶液1および2(1L)および1Lのリン酸緩衝生理食塩水の調製。 透明化溶液は、事前に調製し、室温で長期間保持することができる。ホウ酸およびSDSを含む溶液は、吸入またはSDSまたはホウ酸との皮膚接触を避けるために、ヒュームフードの下で取り扱うべきである。CS1中のNaOHを最後に添加してpHを8.5に設定する必要があります。各脳サンプルは、少なくとも5〜25mLのCS1に入れ、十分な拡散のために一晩保管する必要があります。略語: CS1 = クリアリングソリューション 1;SDS = ドデシル硫酸ナトリウム;M.W. = 分子量。
| 製品名 | 主な利点 | 主な欠点 |
| ラピクリア | サンプルは透明に保たれます | 組織の腫れ |
| ラピクリアCS | サンプルが通常のサイズに縮小 | サンプルの透明度が失われる |
表3:長所と短所を持つRIMSオプション。 ラピクリア(RC、RI = 1.47)またはクラリティ固有のラピクリア(CSRC、RI = 1.45)。これら2つの溶液の主な違いは、CSRCが透明な脳を元のサイズに戻すのに対し、RC溶液は収縮せず、クリアされたサンプルがわずかに腫れたままになることです。略語: RI = 屈折率。
ディスカッション
組織クリアリング法は、脳研究における革命的なツールを提示し、以前は尋ねられなかった質問を招きます。CLARITYは、小さな細胞群、単一細胞、さらには単一のシナプスの特性を標的にすることから、関連する蛍光色素を使用することで、全細胞集団または長距離接続性特徴の標的化を可能にしました。
蛍光色素分子発現とCLARITY手順の組み合わせの結果はバイナリではありません。多くの要因が手順を妨げ、最適でない結果につながる可能性があります。まず、蛍光色素分子の発現を事前に検証する必要があります。CLARITY手順はいくらかの情報損失を引き起こすため、CLARITYプロセスの最後に画像の有効性を得るためには、十分な蛍光色素タンパク質の発現が不可欠です。第二に、経頭蓋灌流は慎重に処理されなければならず、血液の自家蛍光は厚いスライスの信頼性の低いデータにつながるため、すべての血液が脳から出ることを保証する。第3に、プロトコルで議論されるすべてのパラメータは、透明化プロセスの各ステップにおいて正確に取り扱われなければならず、例えば、重合前のHS中のO2 残基または各段階での温度不正確さは、活物質間の化学反応が起こるのを妨げるであろう。
以前のプロトコル17,22は、HS中のアクリルアミドの異なる濃度を推奨している。アクリルアミドの主な目的は、アミン残基(タンパク質および核酸)で分子をよりよく固定することです。濃度のわずかな変化は、クリアリングプロセス全体に大きく影響します:固定がコンパクトすぎると、脂質分子は組織から切断されず、クリアリングプロセスは不必要に長引くか、不透明な脳になります。しかし、アクリルアミドの濃度が低いと、脂質がなくなると脳の構造が適切に維持されません。このプロトコルでは、アクリルアミドパーセンテージは、固定されたまだ透明な組織の微妙なバランスを提供するために設定される。
クリアリングプロセスのほとんどはCS2で行われ、組織の透明度レベルは毎日テストする必要があります。PBSTクリーンアップは、RIMSと相互作用する可能性のある残留SDS分子を洗浄するため、クリアリング溶液と屈折率整合ソリューションとの間の重要なステップです。チャンバーの準備がまだ必要でない場合は、PBST(0.5%)中の透明な組織を無期限に保つことも可能です。
RIMSに脳を置くときは、ソリューションの利点と限界に精通する必要があります。例えば、RapiClearは、ほぼクリアされた組織でも完全な透明化を引き起こしますが、データを分析するときに無視してはならない腫れも引き起こします。以前の測定9 は、すべての軸(すなわち、背腹軸、前後軸、および側方 - 内側軸)に沿った等しい拡大を示唆しており、同じ脳領域からの薄いスライスと比較して腫脹の指標を計算することを可能にする。クラリティ固有のRapiClearを使用すると、腫れが解消されます。しかし、SDSの残り物が組織に残っていると、それらは不透明な塊に凝集します。
この変更されたプロトコルのもう1つの利点は、そのコストです。以前のプロトコルは、RIMSで脳を保持できるチャンバーを作成するために、異なる接着剤タイプを示唆している。このプロトコルでは、単にホットグルーを使用します。それは解決策と反応せず、どこでも購入でき、使いやすく、以前に提案された接着剤よりもはるかに安価です。
厚い脳サンプルのイメージングから取得したデータは、細胞集団全体、脳構造間の接続性、または長距離にわたる単一の軸索の追跡を記述することができます(ビデオ3)。これらの特性に関する質問は以前にも尋ねられたことがあるが、厚い脳のスライスを使用して達成可能なデータの有効性は、以前のミスの多い薄いスライス画像オーバーレイの方法を大幅に改善した。
CLARITYプロセスは、数ミリメートルからフルブレインイメージングまで、厚いスライスを成功裏かつ均一にクリアします。パッシブクリアリング(すなわち、ETCを使用しない)は、組織への害のリスクと、サンプルがクリアリング溶液に浸漬される時間を低減し、タンパク質保存の高効率に影響を与えないようにします。
開示事項
著者らは、開示する利益相反はありません。
謝辞
このプロジェクトは、欧州連合のHorizon 2020研究イノベーションプログラム(助成金契約No 803589)、イスラエル科学財団(ISF助成金No.1815/18)、カナダ-イスラエル助成金(CIHR-ISF、助成金No.2591/18)の下で、欧州研究評議会(ERC)から資金提供を受けています。原稿全体にコメントしてくれたNechama Novickに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| AAV1-GFAP::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect astrocytes | |
| AAV5-CaMKII::eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| AAV5-CaMKII::H2B-eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neuronal nuclei | |
| AAV5-CaMKII::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| Acrylamide (40%) | Bio-rad | #161-0140 | |
| Bisacrylamide (2%) | Bio-rad | #161-0142 | |
| Boric acid | Sigma | #B7901 | Molecular weight - 61.83 g/mol |
| Confocal microscope, scanning, FV1000 | Olympus | 4x objective (UPlanSApo, 0.16 NA) | |
| Imaris software | Bitplane, UK | A software that allows 3D analysis of images | |
| NaOH | Sigma | #S5881 | |
| PBS | |||
| PFA 4% | EMS | #15710 | |
| RapiClear | SunJin lab | #RC147002 | |
| RapiClear CS | SunJin lab | #RCCS002 | |
| SDS | Sigma | #L3771 | |
| SyGlass software | A software that allows 3D analysis of images using virtual reality | ||
| Tris base 1 M | Bio-rad | #002009239100 | Molecular weight - 121.14 g/mol |
| Triton X-100 | ChemCruz | #sc-29112A | |
| Two photon microscope | Neurolabware | Ti:sapphire laser (Chameleon Discovery TPC, Coherent), GaAsP photo-multiplier tubes (Hamamatsu, H10770-40) , bandpass filter (Semrock), water immersion 16x objective (Nikon, 0.8 NA) | |
| VA-044 Initiator | Wako | #011-19365 |
参考文献
- Perea, G., Navarrete, M., Araque, A. Tripartite synapses: astrocytes process and control synaptic information. Trends in Neurosciences. 32 (8), 421-431 (2009).
- Ciappelloni, S., et al. Aquaporin-4 surface trafficking regulates astrocytic process motility and synaptic activity in health and autoimmune disease. Cell Reports. 27 (13), 3860-3872 (2019).
- Sylvain, N. J., et al. The effects of trifluoperazine on brain edema, aquaporin-4 expression and metabolic markers during the acute phase of stroke using photothrombotic mouse model. Biochimica et Biophysica Acta. Biomembranes. 1863 (5), 183573(2021).
- Kitchen, P., et al. Targeting aquaporin-4 subcellular localization to treat central nervous system edema. Cell. 181 (4), 784-799 (2020).
- Adamsky, A., et al. Astrocytic activation generates de novo neuronal potentiation and memory enhancement. Cell. 174 (1), 59-71 (2018).
- Adamsky, A., Goshen, I. Astrocytes in memory function: pioneering findings and future directions. Neuroscience. 370, 14-26 (2018).
- Nagai, J., et al. Behaviorally consequential astrocytic regulation of neural circuits. Neuron. 109 (4), 576-596 (2021).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Refaeli, R., et al. Features of hippocampal astrocytic domains and their spatial relation to excitatory and inhibitory neurons. Glia. 69 (10), 2378-2390 (2021).
- Eilam, R., Aharoni, R., Arnon, R., Malach, R. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human. eLife. 5, 15915(2016).
- Bushong, E. A., Marton, M. E., Ellisman, M. H. Maturation of astrocyte morphology and the establishment of astrocyte domains during postnatal hippocampal development. International Journal of Developmental Neuroscience. 22 (2), 73-86 (2004).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. Journal of Comparative Neurology. 462 (2), 241-251 (2003).
- Bushong, E. A., Martone, M. E., Jones, Y. Z., Ellisman, M. H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. The Journal of Neuroscience. 22 (1), 183-192 (2002).
- Chai, H., et al. Neural circuit-specialized astrocytes: transcriptomic, proteomic, morphological, and functional evidence. Neuron. 95 (3), 531-549 (2017).
- Taniguchi, H., et al. A resource of Cre driver lines for genetic targeting of GABAergic neurons in cerebral cortex. Neuron. 71 (6), 995-1013 (2011).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159(2005).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- DeNardo, L. A., et al. Temporal evolution of cortical ensembles promoting remote memory retrieval. Nature Neuroscience. 22 (3), 460-469 (2019).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved