Method Article
Étude de l’interaction spatiale entre les astrocytes et les neurones dans les cerveaux nettoyés
Dans cet article
Résumé
La combinaison de la transduction du vecteur viral et de l’élimination du cerveau à l’aide de la méthode CLARITY permet d’étudier simultanément un grand nombre de neurones et d’astrocytes.
Résumé
La combinaison de la transduction des vecteurs viraux et de l’élimination des tissus à l’aide de la méthode CLARITY permet d’étudier simultanément plusieurs types de cellules cérébrales et leurs interactions. La transduction de vecteurs viraux permet le marquage de divers types de cellules dans différentes couleurs de fluorescence dans le même tissu. Les cellules peuvent être identifiées génétiquement par activité ou projection. En utilisant un protocole CLARITY modifié, la taille potentielle de l’échantillon d’astrocytes et de neurones a augmenté de 2 à 3 ordres de grandeur. L’utilisation de CLARITY permet l’imagerie d’astrocytes complets, qui sont trop gros pour tenir dans leur intégralité en tranches, et l’examen des somata avec tous leurs processus. En outre, il offre la possibilité d’étudier l’interaction spatiale entre les astrocytes et différents types de cellules neuronales, à savoir le nombre de neurones pyramidaux dans chaque domaine astrocytaire ou la proximité entre les astrocytes et des populations spécifiques de neurones inhibiteurs. Ce document décrit, en détail, comment ces méthodes doivent être appliquées.
Introduction
Au cours des dernières années, la connaissance de la fonction des astrocytes et de la façon dont ils interagissent avec les circuits neuronaux a considérablement augmenté. Les astrocytes peuvent influencer la plasticité 1,2, aider à la récupération neuronale post-blessure 3,4, et même induire une potentialisation neuronale de novo, avec des études récentes montrant l’importance des astrocytes dans l’acquisition de la mémoire et la récompense, auparavant considérées comme des fonctions purement neuronales 5,6,7 . Une caractéristique particulièrement intéressante dans la recherche sur les astrocytes est la disposition spatiale des cellules, qui maintiennent des organisations spatiales uniques dans l’hippocampe et d’autres structures cérébrales 8,9,10. Contrairement aux dendrites neuronales qui s’entrelacent entre les somata cellulaires, les astrocytes de l’hippocampe habitent des territoires visuellement distinguables avec un léger chevauchement entre leurs processus, créant des domaines distincts 8,11,12,13. Les preuves soutenant la participation des astrocytes dans les circuits neuronaux ne soutiennent pas l’absence de description anatomique détaillée de ces populations et des neurones dans leurs domaines14.
Les procédures de transduction des vecteurs viraux, ainsi que les animaux transgéniques (TG), ont été popularisés comme un ensemble d’outils pour étudier les structures cérébrales, les fonctions et les interactions cellulaires15,16. L’utilisation de différents promoteurs permet de cibler des cellules spécifiques en fonction de leurs propriétés génétiques, de leurs niveaux d’activation17,18 ou de leurs cibles de projection. Différents virus peuvent exprimer des fluorophores de différentes couleurs dans différentes populations. Un virus peut être combiné avec l’expression endogène de fluorophores dans la TG, ou les animaux TG peuvent être utilisés sans avoir besoin de virus. Ces techniques sont largement utilisées pour le marquage neuronal, et certains laboratoires ont commencé à les utiliser avec des modifications spécialisées pour cibler d’autres types de cellules, telles que les astrocytes 5,9,19.
La technique CLARITY, décrite pour la première fois en 201320,21, permet d’étudier des tranches de cerveau épaisses en rendant l’ensemble du cerveau transparent tout en laissant les structures microscopiques intactes. En combinant les deux méthodes - transduction du vecteur viral et nettoyage des tissus - l’option d’examiner les interactions spatiales entre différentes populations de type cellulaire est maintenant disponible. La plupart des études d’interaction astrocyte-neurone ont été réalisées sur de fines tranches de cerveau, ce qui a donné lieu à des images d’astrocytes incomplets en raison de leurs grands domaines, limitant ainsi radicalement le nombre de cellules analysées. L’utilisation de la technique CLARITY permet de caractériser simultanément la résolution unicellulaire des populations cellulaires dans des volumes à grande échelle. L’imagerie de populations cellulaires marquées par fluorescence dans des cerveaux clairs n’offre pas de résolution synaptique, mais permet une caractérisation approfondie des interactions spatiales entre les astrocytes et une variété de types de cellules neuronales.
Pour cette raison, nous avons exploité ces techniques de pointe pour étudier les propriétés des astrocytes dans l’ensemble du CA1 dorsal, en imageant toutes les lames (Stratum Radiatum, couche pyramidale et Stratum Oriens). Nous avons mesuré des dizaines de milliers d’astrocytes (avec une pénétrance virale de >96%5), analysant ainsi l’information de l’ensemble de la population astrocytaire autour de CA1. Avec une pénétrance efficace des marqueurs neuronaux, nous avons pu enregistrer les interactions entre l’ensemble de la population d’astrocytes CA1 et les quatre types de cellules neuronales- parvalbumine (PV), somatostatine (SST), neurones inhibiteurs VIP et cellules pyramidales excitatrices9.
Plusieurs expériences ont été réalisées en utilisant une combinaison de fluorescence d’animaux TG et de vecteurs viraux de couleurs différentes (toutes les cellules inhibitrices), tandis que d’autres (excitatrices) ont utilisé deux vecteurs viraux exprimant différents fluorophores sous différents promoteurs9. Cet article présente un protocole détaillé, y compris le marquage des cellules souhaitées dans le cerveau, rendant le cerveau transparent à l’aide d’une procédure CLARITY modifiée, ainsi que l’imagerie et l’analyse de structures cérébrales complètes, à l’aide de diverses procédures et logiciels.
Protocole
Les protocoles expérimentaux ont été approuvés par le Comité de soins et d’utilisation des animaux de l’Université hébraïque et respectaient les directives du Guide de l’Institut national de la santé pour le soin et l’utilisation des animaux de laboratoire.
1. Transduction du vecteur viral
REMARQUE: La transduction du vecteur viral est utilisée pour exprimer les fluorophores dans le cerveau.
- Utilisez un atlas (p. ex., Allen Brain Atlas) pour localiser la coordination pertinente de la zone cible.
REMARQUE : Les atlas 3D peuvent être consultés en ligne (p. ex., http://connectivity.brain-map.org/3d-viewer). - En utilisant la chirurgie stéréotaxique, injecter les vecteurs viraux dans la structure cérébrale pertinente. Voir9 pour un protocole détaillé.
- Attendez 3 à 6 semaines pour l’expression du fluorophore.
REMARQUE: Une courte période de temps suffit si seuls les corps cellulaires doivent être marqués. Une longue période de temps sera nécessaire si les projections axonales sont pertinentes pour la question, car il faut plus de temps pour que les fluorophores s’expriment dans les axones, qui peuvent mesurer plusieurs millimètres de long. - Valider au préalable la spécificité et la pénétrance de l’expression des fluorophores (tant de l’expression virale que des animaux TG) (Figure 1A). Avant de procéder à la procédure CLARITY, désignez au moins un cerveau pour les tranches minces et assurez-vous que l’expression du fluorophore est à la fois forte et spécifique à la caractéristique de la cellule cible.
2. CLARTÉ
REMARQUE: Cette méthode rend le cerveau transparent dans les 2-6 semaines.
- Effectuer une perfusion transcrânienne sur des animaux en utilisant une solution saline tamponnée au phosphate froid (PBS) suivie de 4% de paraformaldéhyde (PFA) dans le PBS. Retirez le cerveau et conservez-le dans du PFA pendant la nuit à 4 °C dans un tube de 50 mL ou un récipient similaire.
REMARQUE: Avant la perfusion transcrânienne, l’animal doit être profondément anesthésié. Dans les exemples présentés dans ce protocole, tous les animaux ont été anesthésiés à l’aide de kétamine et de xylazine (90% et 10%, respectivement). - Remplacer le PFA par une solution d’hydrogel (SH; voir tableau 1) pendant 48 h à 4 °C.
REMARQUE: Ne laissez pas les matériaux devenir plus chauds que la température de réfrigération (4-8 ° C) à ce stade, sinon l’hydrogel va polymériser. Le SH utilisé dans ce protocole contient 2% d’acrylamide, contrairement aux protocoles précédents suggérant 4%22 ou 1%17. L’avantage de 2% est détaillé dans la section de discussion. Lors de la préparation du SH, travaillez sur une surface glacée. Conservez-le à -20 °C. - Dégazage
REMARQUE: Le but de cette étape est d’éliminer tout l’oxygène libre du tissu car O2 interfère avec le processus de polymérisation. N’importe quel gaznonO2 peut être utilisé (par exemple,N2, CO2); N2 est recommandé.- Transférer le N2 du réservoir via un tube flexible de 5 mm (interne), relié à une aiguille de 19 G à son extrémité (Figure 1B).
- Faites deux petits trous (larges à l’aiguille) dans le bouchon du tube : l’un pour introduire le gaz et l’autre pour permettre à l’air de quitter le tube (Figure 1C).
- Fixez le tuyau du gazN2 au tube et remplacez les gaz pendant environ 30 minutes à température ambiante (RT).
- Retirez le tuyau et scellez immédiatement les trous avec de la pâte à modeler sur chaque tube (Figure 1D).
- Transférer les tubes scellés dégazés dans un bain à 37 °C pendant 3,5 h pour polymériser le SH, qui deviendra un gel. Veillez à ne pas secouer les tubes (Figure 1E).
- Extrayez le cerveau du tube et retirez doucement le gel polymérisé de son entourage à l’aide de lingettes de laboratoire. Assurez-vous qu’aucun gel résiduel ne reste attaché à la surface du tissu, car il pourrait réagir avec la solution dans les étapes suivantes, inhibant le processus de nettoyage des tissus (Figure 1F).
REMARQUE: Parce que le gel contenait du PFA, l’extraction doit être effectuée sous une hotte aspirante. - Tranchez le cerveau si la question à l’étude n’en nécessite qu’une partie. Divisez-le en deux ou en tranches très épaisses contenant toutes les zones d’intérêt (Figure 1G).
- Placer les tranches dans la première solution de nettoyage (CS1, voir tableau 2) dans un nouveau récipient et agiter à 70 tr/min pendant 24 h à 37 °C.
- Suivez les étapes décrites ci-dessous pour transférer le cerveau de CS1 à la deuxième solution de nettoyage (CS2, voir le tableau 2).
- Préparez à l’avance un tube perforé pour le cerveau (Figure 1H).
- Préchauffer CS2 à 40-45 °C dans un bécher suffisamment grand pour contenir le tube. Faites-le sur une plaque chauffante avec un agitateur. S’assurer que la température n’atteint pas 55 °C pour éviter le blanchiment des protéines exprimées.
- Placer le bécher rempli de CS2 et le tube perforé sur un dispositif d’agitation (un bécher de 2 L dans la figure 1I). Réglez un taux d’agitation modéré qui fera couler le liquide sans déformer le tissu.
REMARQUE: Dans les 2 à 6 semaines, le tissu deviendra transparent (le processus commence à la périphérie et se déplace vers l’intérieur vers les structures cérébrales centrales). La décision quant au moment où le tissu est « assez clair » dépend du jugement personnel. Le cerveau doit être suffisamment transparent pour l’imagerie au microscope sans interférence (la figure 1J n’est pas assez claire; Figure 1K assez claire). Dépasser le point où le tissu est suffisamment clair peut entraîner une perte de rigidité tissulaire.
- Transfert de CS2 dans PBST (0,5 % triton X-100 en PBS, voir tableau 2) dans un nouveau récipient à 37 °C avec une légère agitation (70 tr/min) pendant 24 h.
REMARQUE : Dans le PBST, le tissu deviendra blanchâtre (Figure 1L). La clarté reviendra (et s’améliorera) lorsqu’elle sera intégrée dans la solution de correspondance d’indice de réfraction (RIMS, voir l’étape 2.14). - Remplacez le PBST par un nouveau PBST. Conserver dans les mêmes conditions (37 °C avec une légère agitation) pendant encore 24 h.
- Remplacez à nouveau PBST par un nouveau PBST et maintenez à RT pendant 24 h.
- Transfert vers PBS à RT pendant 24 h.
- Remplacez le PBS et laissez à RT pendant 24 heures supplémentaires.
- Retirez le cerveau du PBS et transférez-le au RIMS à 37 °C pendant la nuit.
REMARQUE: Initialement, des ondulations dans le RIMS peuvent entourer le cerveau. Ce protocole a été conçu et validé à l’aide de deux RIMS commerciaux spécifiques (voir tableau 3). Cependant, le protocole ne doit pas différer lors de l’utilisation d’autres RIMS (commerciaux ou auto-fabriqués). - Maintenir le tissu à TA pendant encore 24 heures ou jusqu’à ce que la solution atteigne son plein équilibre, c’est-à-dire lorsque le tissu devient transparent et que la solution ne contient plus d’ondulations visibles (Figure 1M).
- Si le tissu est transparent, passez à la préparation de la chambre. Si, à ce stade, le tissu devient blanc au lieu d’être transparent (en raison d’agrégats de molécules résiduelles de FDS), nettoyez à nouveau l’échantillon en répétant les étapes 2.9 et 2.10 et transférez le tissu dans CS2 (étape 2.8) pendant quelques jours, suivi de toutes les étapes jusqu’à l’étape 2.15.
3. Préparation de la chambre
REMARQUE: Chaque échantillon nécessite une lame avec une chambre d’imagerie dans laquelle l’échantillon sera placé.
- Placez l’échantillon au milieu de la diapositive.
- À l’aide d’un pistolet à colle chaude, créez des murs sur les bords de la glissière, presque aussi hauts que le tissu. Assurez-vous de laisser un petit espace (environ 5 mm) à l’un des coins (Figure 2A,B).
- Appliquez 1-2 gouttes du RIMS sur l’échantillon pour garder la surface supérieure humide et empêcher la formation de bulles entre le couvercle et le tissu.
- Immédiatement après l’application des gouttes RIMS, ajoutez la dernière couche de colle chaude sur les parois (afin qu’elles atteignent la hauteur du cerveau / tranche) et progressez immédiatement (pendant que la colle chaude est encore liquide) à l’étape 3.5.
- Scellez le dessus avec un couvercle, en le plaçant aussi uniformément que possible sur le dessus de la couche de colle chaude encore chaude (Figure 2C).
- Remplissez la chambre avec le RIMS à travers l’espace laissé dans les parois de colle chaude (Figure 2D,E).
- Comblez l’écart avec de la colle chaude. Ne laissez pas d’air à l’intérieur (Figure 2F).
- Si les parois de colle chaude s’étendent au-delà des bordures de la glissière, coupez les bords d’extension (Figure 2G).
- Si l’objectif utilisé pour l’imagerie est immergé, ajoutez encore 2 à 3 mm de colle sur les parois au-dessus du couvercle afin que la solution d’immersion dure plus longtemps (Figure 2H).
4. Imagerie (confocale ou à deux photons)
- Vérifiez si la scène peut contenir la chambre, car l’épaisseur de la chambre peut atteindre plusieurs millimètres.
REMARQUE : Par exemple, le microscope confocal (voir la Table des matériaux) utilisé dans ce protocole est équipé de plusieurs étages (p. ex., circulaire, rectangulaire). L’étage choisi pour tenir la chambre n’est pas pertinent tant que ses paramètres correspondent à la taille de la chambre. - Travaillez avec un objectif avec une distance de travail suffisante, c’est-à-dire une distance de travail minimale ≥3 mm, car la région d’intérêt du cerveau peut être de quelques millimètres de profondeur et le couvercle peut ne pas être complètement droit car il a été placé manuellement.
REMARQUE : À titre de démonstration, les résultats présentés à la figure 1, à la vidéo 1 et à la vidéo 2 ont été obtenus au microscope à deux photons à l’aide d’un objectif 16x à immersion dans l’eau avec une distance de travail de 3 mm et un grossissement de 2,4 pour obtenir un champ de vision de 652 x 483 μm et une pile z avec des intervalles de 0,937 μm entre les plans. - Effectuez une imagerie multizone, ce qui peut prendre quelques heures, voire quelques jours. Assurez-vous qu’il y a suffisamment de stockage gratuit dans l’ordinateur car la taille de chaque image peut atteindre des dizaines de gigabits.
REMARQUE: L’imagerie CLARITY peut entraîner beaucoup plus de sections d’image en profondeur. Par conséquent, les intensités utilisées pour capturer l’expression doivent être relativement faibles pour éviter la surexpression pendant la sommation de l’image. - Pour les objectifs d’immersion, vérifiez régulièrement le liquide pendant l’imagerie et complétez avec du liquide supplémentaire si nécessaire.
REMARQUE: Lors de l’imagerie des données présentées dans la vidéo 3, de l’eau a été ajoutée à la surface de la chambre toutes les 6-8 heures pour lutter contre l’évaporation. - Une fois l’image acquise, visualisez-la et analysez-la à l’aide de plusieurs progiciels différents.
REMARQUE: Le logiciel recommandé comprend Imaris et SyGlass pour la visualisation et l’analyse. Le pipeline précis pour la reconstruction optimisée des astrocytes à l’aide du logiciel Imaris a été décrit précédemment9. En bref, les caractéristiques d’Imaris utilisées dans cette étude étaient des filaments pour reconstruire complètement les structures cellulaires et des taches pour extraire la position dans l’espace de tous les somata.
Résultats
Le nettoyage réussi des tranches épaisses de tissu cérébral entraîne une nouvelle gamme de questions qui peuvent être posées concernant les propriétés des grandes populations cellulaires par opposition aux propriétés des cellules individuelles ou des groupes de cellules voisines. Pour obtenir des résultats positifs, il faut respecter strictement le protocole CLARITY, car il existe un large éventail de paramètres qui doivent être pris en compte pour réduire la variance entre les échantillons (par exemple, pourcentage de clarté, informations de fluorescence, paramètres d’enflure).
La figure 1 décrit l’ensemble du processus de nettoyage, de la validation de l’expression des protéines fluorescentes à toutes les étapes de la méthode de nettoyage. La figure 2 décrit comment préparer une chambre pour le tissu clarifié, optimale pour l’imagerie sous un microscope à deux photons ou confocale. Les matériaux requis dans ce protocole sont extrêmement peu coûteux par rapport aux autres protocoles de préparation de la chambre.
La figure 3 présente le cube décrit dans la vidéo 1, où plus de 300 astrocytes sont montrés dans une section dégagée de la partie CA1 d’un hippocampe de souris. La figure 4 présente le cube décrit dans la vidéo 2, où les astrocytes et les somata neuronaux excitateurs sont montrés dans un tissu transparent épais. La figure 5 présente un hémisphère entier, comme décrit dans la vidéo 3. Les projections neuronales à l’échelle du cerveau sont affichées à partir du CA1 dorsal (vert, GFP) et du CA1 ventral (rouge, TdTomato).
La vidéo 1 présente une image épaisse d’astrocytes hippocampiques (>300) acquis avec un microscope à deux photons après une procédure CLARITY. La fluorescence a été fournie par transduction de vecteur viral spécifique aux astrocytes. La vidéo 2 présente la proximité spatiale entre les astrocytes et les noyaux des cellules pyramidales de l’hippocampe. La vidéo 3 trace des faisceaux axonaux sur tout un hémisphère; les axones se projettent à partir du cortex moteur primaire et sont tracés à partir de la moelle épinière. Un autre faisceau est tracé de l’hippocampe dorsal vers les corps Supra Mammillaires. Enfin, il trace un faisceau rouge d’axones depuis les corps mammillaires jusqu’à leur origine à l’hippocampe ventral. Toutes les cellules marquées sont exclusivement excitatrices.

Figure 1: Description détaillée du processus de compensation. (A) Validation de l’expression des fluorophores. Dans cet exemple, tous les astrocytes de la partie CA1 d’un hippocampe de souris expriment une protéine rouge (TdTomato, imagée en magenta), et tous les neurones excitateurs expriment une protéine verte dans leur noyau (H2B-GFP). Cette image a été acquise à l’aide d’un microscope à 2 photons. L’image a été prise à l’aide d’un objectif 16x à immersion dans l’eau (0,8 NA) avec un grossissement de 2,4 pour obtenir un champ de vision de 652 x 483 μm, à 15,5 images/s et une pile z avec des intervalles de 0,937 μm entre les plans. La spécificité et la pénétrance ont été vérifiées par immunohistochimie9. (B) Le transfert du gazN2 du réservoir dans le tube contenant le cerveau nécessite un tuyau avec une aiguille à son extrémité. (C) L’air à l’intérieur du tube est remplacé par N2 en créant deux trous, l’un (flèche supérieure) pour l’entrée de N2via l’aiguille reliée à la tuyauterie du réservoir d’essence et l’autre (flèche inférieure) pour l’écoulement. (D) Couvrir les trous avec de la pâte à modeler immédiatement après le dégazage empêche le N2 de sortir du tube. (E) Chauffage de la solution dégazée pendant 3,5 h dans un bain chaud. (F) Une polymérisation réussie entraîne un cerveau incorporé dans le SH gélifié. Des bulles de gaz peuvent être piégées dans le polymère. (G) Immédiatement après l’extraction du gel est le meilleur point pour que le cerveau soit coupé dans l’épaisseur souhaitée. (H) Les tubes perforés permettent à l’écoulement de la solution sur l’agitateur d’atteindre l’échantillon. (I) Les cerveaux à l’intérieur des tubes perforés sont maintenus verticalement par un support auto-fabriqué d’une taille faite pour s’adapter à un bécher de 2 L, debout sur un agitateur à plaque chauffante. (J) Exemple d’un cerveau qui n’est pas assez clair. L’échantillon doit être agité dans le CS2 pendant environ une semaine de plus. (K) Exemple d’un cerveau suffisamment clair. (L) Lors de l’insertion du cerveau clair dans la PBST, le tissu devient plus blanc qu’auparavant. Ce changement de couleur est dû au Triton et disparaîtra lorsqu’il sera déplacé de cette solution à la suivante. (M) Après >24 h dans le RIMS, le cerveau redeviendra complètement transparent. Abréviations: GFP = protéine fluorescente verte; NA = ouverture numérique; SH = solution d’hydrogel; CS2 = Solution de compensation 2; PBST = solution saline tamponnée au phosphate contenant 0,5 % de Triton X-100; RIMS = Solution de correspondance d’indice de réfraction. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation de la chambre. (A) La première couche de parois de colle chaude recouvre les bords d’une diapositive et laisse un espace suffisamment large pour contenir le cerveau sans toucher les parois. Un trou est laissé dans le coin supérieur gauche de la diapositive. (B) Ajout d’une couche après l’autre pour atteindre la hauteur du tissu. (C) Le couvercle droit (flèche blanche) scelle la chambre. (D) Chambre remplie de RIMS à travers le trou dans les parois de la chambre. (E) La chambre est remplie de RIMS ne laissant aucune bulle d’air. (F) Sceller le trou dans la chambre avec de la colle chaude pour éviter toute fuite. Vue latérale. (G) À ce stade, tout reste de colle chaude s’étendant sur les bords de la glissière doit être coupé de la chambre. (H) Chambre entièrement préparée, prête pour l’imagerie au microscope. Abréviation : RIMS = Refractive Index Matching Solution. Veuillez cliquer ici pour voir une version agrandie de cette figure.
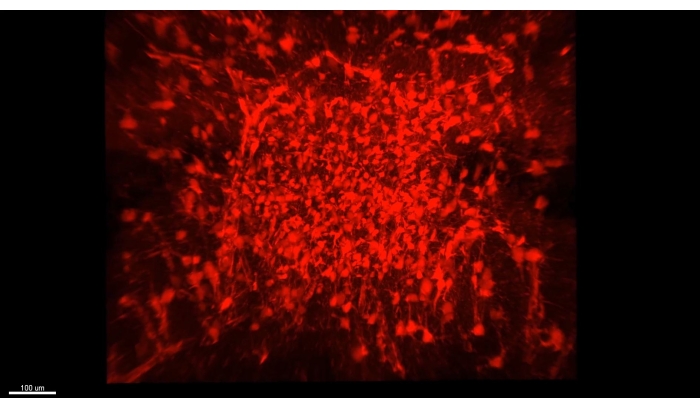
Figure 3 : Tous les astrocytes imagés (AAV1-GFAP::TdTomato, rouge) dans un hippocampe dégagé. Une seule image de la vidéo 1 capturant tous les astrocytes imagés (AAV1-GFAP::TdTomato, rouge) dans un hippocampe dégagé. Tous les détails des propriétés de l’image sont décrits sous Vidéo 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
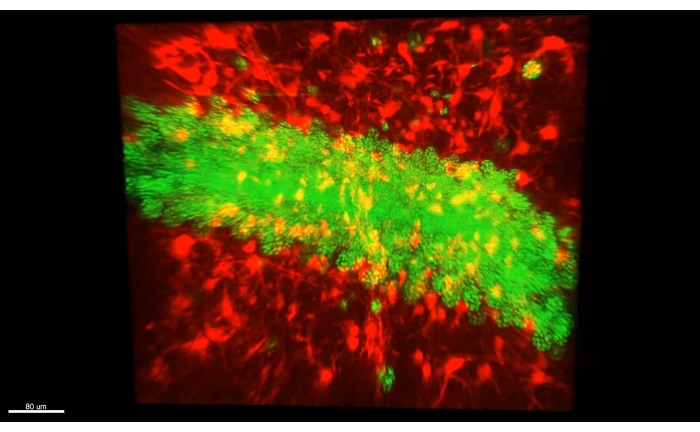
Figure 4 : Astrocytes (AAV1-GFAP::TdTomato, rouge) et noyaux de cellules pyramidales de l’hippocampe (AAV5-CaMKII::H2B-eGFP, vert) dans des tissus transparents épais. Une seule image de la vidéo 2 montrant à la fois des astrocytes (AAV1-GFAP::TdTomato, rouge) et des noyaux de cellules pyramidales de l’hippocampe (AAV5-CaMKII::H2B-eGFP, vert) dans un tissu transparent épais. Veuillez cliquer ici pour voir une version agrandie de cette figure.
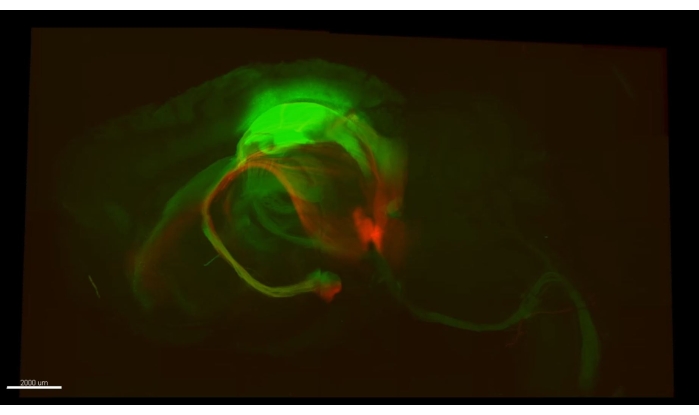
Figure 5 : Axones verts (AAV5-CaMKII::eGFP, vert) et axones rouges (AAV5-CaMKII::TdTomato). Une seule image de la vidéo 3 montrant les deux types d’axones dérivés de plusieurs endroits dans le cerveau d’une souris qui peuvent être tracés dans tout un hémisphère. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1 : Images d’une tranche d’astrocytes CA1 dorsal de >1 mm d’épaisseur (AAV1-GFAP::TdTomato, rouge). La vidéo a été acquise avec un microscope à deux photons à l’aide d’un objectif 16x (0,8 NA) avec un grossissement de 2,4 suivant une procédure CLARITY. Semblable à la figure 1A, l’intervalle z-pile a été défini sur 0,937 μm. La fluorescence a été fournie par transduction de vecteur viral spécifique aux astrocytes. Le nombre d’astrocytes dans ce cube est de >300, et la plupart des processus sont disponibles pour analyse dans la plupart des cellules. Abréviations : NA = ouverture numérique; AAV = virus adéno-associé; GFAP = protéine acide fibrillaire gliale. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2 : Noyaux d’astrocytes et de neurones excitateurs dans un cube 3D. Le cube contient toute la lame du dCA1 dans les conditions optiques mentionnées pour la figure 1A et la vidéo 1. Ce cube présente la proximité spatiale entre les astrocytes (AAV1-GFAP::TdTomato, rouge) et les noyaux des cellules pyramidales de l’hippocampe (AAV5-CaMKII::H2B-eGFP, vert). Abréviations : AAV = virus adéno-associé; GFAP = protéine acide fibrillaire gliale; CAMKII = protéine kinase II dépendante du calcium/calmoduline; eGFP = protéine fluorescente verte améliorée; H2B = histone 2B. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 3 : Traçage des faisceaux axonaux sur tout un hémisphère. Les axones verts (AAV5-CaMKII::eGFP, vert) se terminant au niveau de la moelle épinière remontent facilement au cortex moteur primaire (à plus de 7 mm l’un de l’autre). De l’hippocampe (face dorsale), un autre faisceau est tracé vers les corps supra mammillaires (la plus grande partie ventrale du cerveau), une trace de près de 3 mm de long. La deuxième moitié de la vidéo trace un faisceau rouge d’axones (AAV5-CaMKII::tdTomato) provenant de l’hippocampe ventral de leur emplacement cible aux corps mammillaires. L’image a été prise sous un microscope confocal laser à balayage Olympus FV1000 à l’aide d’un objectif 4x (0,16 NA), et plusieurs ROI ont été combinés à l’aide de la fonction MATL FluoView pour présenter l’ensemble de l’hémisphère. Abréviations : AAV = virus adéno-associé; CAMKII = protéine kinase II dépendante du calcium/calmoduline; eGFP = protéine fluorescente verte améliorée; NA = ouverture numérique; MATL = time-lapse à plusieurs zones. Veuillez cliquer ici pour télécharger cette vidéo.
| Solution d’hydrogel (1 L) | |
| Matériel | Quantité |
| VA-044 Initiateur | 2,5 g |
| PFA 4 % | 900 mL |
| Acrylamide (40 %) | 50 mL |
| Bisacrylamide (2 %) | 50 mL |
Tableau 1 : Préparation de la solution d’hydrogel (1 L). La solution d’hydrogel doit être préparée sur une surface glacée. L’ordre dans lequel les ingrédients sont mélangés n’est pas important. Notez que le pourcentage total d’acrylamide est de 2% contrairement aux protocoles similaires qui utilisent 1%17 ou 4%22.
| Solutions de compensation (1 L) | ||
| Matériel | Quantité | |
| CS1 | CS2 | |
| Acide borique (M.W. = 61,83 g/mol) | 12,366 g | 3,4 g |
| SDS | 80 g | 80 g |
| Base de tris (M.W. = 121,14 g/mol) | 0 | 12,1 g |
| Eau distillée (DW) | Remplir à 1 L | Remplir à 1 L |
| NaOH | pH 8,5 | |
| 1 L de solution saline tamponnée au phosphate avec 0,5 % de Triton X-100 | ||
| Matériel | Quantité | |
| PBS | 995 mL | |
| Triton X-100 | 5 mL | |
Tableau 2 : Préparation des solutions de nettoyage 1 et 2 (1 L) et 1 L de solution saline tamponnée au phosphate avec 0,5 % de Triton X-100. Les solutions de nettoyage peuvent être préparées à l’avance et maintenues à température ambiante pendant une longue période. Toute solution contenant de l’acide borique et des FDS doit être manipulée sous une hotte pour éviter l’inhalation ou le contact cutané avec la FDS ou l’acide borique. Le NaOH dans CS1 doit être ajouté en dernier pour régler le pH à 8,5. Chaque échantillon de cerveau doit être placé dans au moins 5 à 25 mL de CS1 et conservé pendant la nuit pour une diffusion suffisante. Abréviations : CS1 = solution de compensation 1 ; FDS = dodécylsulfate de sodium; M.W. = poids moléculaire.
| Nom du produit | Avantage principal | Inconvénient principal |
| RapiClear | L’échantillon reste transparent | Gonflement des tissus |
| RapiClear CS | L’échantillon revient à une taille normale | L’échantillon peut perdre en transparence |
Tableau 3 : Options RIMS présentant des avantages et des inconvénients. Rapiclear (RC, RI = 1,47) ou Rapiclear spécifique à CLARITY (CSRC, RI = 1,45). La principale différence entre ces deux solutions est que, tandis que le CSRC réduit le cerveau clair à sa taille d’origine, la solution RC ne le fait pas, laissant l’échantillon dégagé légèrement gonflé. Abréviation : RI = indice de réfraction.
Discussion
Les méthodes de nettoyage des tissus présentent un outil révolutionnaire dans la recherche sur le cerveau, invitant à des questions qui n’auraient pas pu être posées auparavant. En ciblant les propriétés d’un petit groupe de cellules, d’une seule cellule ou même d’une seule synapse, CLARITY permet désormais de cibler des populations cellulaires totales ou des caractéristiques de connectivité à longue portée en utilisant des fluorophores pertinents.
Le résultat de l’expression du fluorophore et de la combinaison de la procédure CLARITY n’est pas binaire; de nombreux facteurs peuvent interférer avec la procédure conduisant à des résultats sous-optimaux. Tout d’abord, l’expression du fluorophore doit être vérifiée à l’avance. Comme la procédure CLARITY entraîne une certaine perte d’information, une expression suffisante de la protéine fluorophore est cruciale pour la validité de l’image à la fin du processus CLARITY. Deuxièmement, la perfusion transcrânienne doit être manipulée avec soin, en veillant à ce que tout le sang sorte du cerveau, car l’autofluorescence du sang conduira à des données peu fiables en tranches épaisses. Troisièmement, tous les paramètres discutés dans le protocole doivent être traités à chaque étape du processus de nettoyage avec précision, par exemple, le résidu d’O2 dans le SH avant la polymérisation ou l’imprécision de la température à chaque étape empêchera la réaction chimique entre les matières actives de se produire.
Les protocoles précédents17,22 recommandent différentes concentrations d’acrylamide dans le SH. Le but premier de l’acrylamide est de mieux fixer les molécules avec des résidus d’amines (protéines et acides nucléiques). De légères altérations de la concentration ont un impact considérable sur l’ensemble du processus de nettoyage: si la fixation est trop compacte, les molécules lipidiques ne se déconnecteront pas du tissu et le processus de nettoyage sera inutilement prolongé ou entraînera des cerveaux opaques. Des concentrations plus faibles d’acrylamide, cependant, ne maintiendront pas adéquatement la structure du cerveau une fois dépourvue de lipides. Dans ce protocole, le pourcentage d’acrylamide est défini pour fournir l’équilibre délicat des tissus fixes mais clairs.
La majeure partie du processus de nettoyage a lieu dans CS2, et le niveau de clarté des tissus doit être testé quotidiennement. Le nettoyage PBST est une étape essentielle entre les solutions Clearing et les solutions d’appariement de l’indice de réfraction car il nettoie les molécules SDS résiduelles, qui peuvent interagir avec le RIMS. Il est également possible de conserver le tissu clair dans pbST (0,5%) indéfiniment si la préparation de la chambre n’est pas encore nécessaire.
En plaçant le cerveau dans le RIMS, il faut se familiariser avec les avantages et les limites des solutions. Par exemple, RapiClear provoquera une transparence totale même dans les tissus presque nettoyés, mais provoquera également un gonflement, qui ne doit pas être négligé lors de l’analyse des données. Les mesures précédentes9 suggèrent une expansion égale le long de tous les axes (c.-à-d. les axes dorsoventraux, antérieurs-postérieurs et latéraux-médiaux), ce qui permet de calculer l’indice de gonflement par rapport à de fines tranches de la même région du cerveau. L’utilisation de RapiClear spécifique à CLARITY élimine l’enflure; cependant, si des restes de FDS restent dans le tissu, ils s’agrégeront en masses non transparentes.
Un autre avantage de ce protocole modifié est son coût. Les protocoles précédents suggèrent différents types de colle pour créer une chambre qui peut contenir le cerveau dans RIMS. Dans ce protocole, nous utilisons simplement de la colle chaude. Il ne réagit pas avec les solutions, est disponible à l’achat partout, est facile à utiliser et est nettement moins cher que les colles suggérées précédemment.
Les données acquises à partir de l’imagerie d’échantillons cérébraux épais peuvent décrire des populations cellulaires entières, la connectivité entre les structures cérébrales ou le suivi d’un seul axone sur de grandes distances (vidéo 3). Bien que des questions concernant ces caractéristiques aient déjà été posées, la validité des données maintenant réalisables à l’aide de tranches de cerveau épaisses améliore considérablement les méthodes antérieures et sujettes aux erreurs de superposition d’images en tranches minces.
Le processus CLARITY permet un nettoyage réussi et uniforme des tranches épaisses, de plusieurs millimètres à l’imagerie cérébrale complète. Le nettoyage passif (c.-à-d. ne pas utiliser l’ETC) diminue le risque de dommages aux tissus et le temps pendant lequel les échantillons sont immergés dans des solutions de nettoyage afin qu’ils n’affectent pas la haute efficacité de la conservation des protéines.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce projet a reçu un financement du Conseil européen de la recherche (CER) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (convention de subvention n° 803589), de la Fondation israélienne pour la science (subvention ISF n° 1815/18) et des subventions Canada-Israël (CIHR-ISF, subvention n° 2591/18). Nous remercions Nechama Novick d’avoir commenté l’ensemble du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| AAV1-GFAP::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect astrocytes | |
| AAV5-CaMKII::eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| AAV5-CaMKII::H2B-eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neuronal nuclei | |
| AAV5-CaMKII::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| Acrylamide (40%) | Bio-rad | #161-0140 | |
| Bisacrylamide (2%) | Bio-rad | #161-0142 | |
| Boric acid | Sigma | #B7901 | Molecular weight - 61.83 g/mol |
| Confocal microscope, scanning, FV1000 | Olympus | 4x objective (UPlanSApo, 0.16 NA) | |
| Imaris software | Bitplane, UK | A software that allows 3D analysis of images | |
| NaOH | Sigma | #S5881 | |
| PBS | |||
| PFA 4% | EMS | #15710 | |
| RapiClear | SunJin lab | #RC147002 | |
| RapiClear CS | SunJin lab | #RCCS002 | |
| SDS | Sigma | #L3771 | |
| SyGlass software | A software that allows 3D analysis of images using virtual reality | ||
| Tris base 1 M | Bio-rad | #002009239100 | Molecular weight - 121.14 g/mol |
| Triton X-100 | ChemCruz | #sc-29112A | |
| Two photon microscope | Neurolabware | Ti:sapphire laser (Chameleon Discovery TPC, Coherent), GaAsP photo-multiplier tubes (Hamamatsu, H10770-40) , bandpass filter (Semrock), water immersion 16x objective (Nikon, 0.8 NA) | |
| VA-044 Initiator | Wako | #011-19365 |
Références
- Perea, G., Navarrete, M., Araque, A. Tripartite synapses: astrocytes process and control synaptic information. Trends in Neurosciences. 32 (8), 421-431 (2009).
- Ciappelloni, S., et al. Aquaporin-4 surface trafficking regulates astrocytic process motility and synaptic activity in health and autoimmune disease. Cell Reports. 27 (13), 3860-3872 (2019).
- Sylvain, N. J., et al. The effects of trifluoperazine on brain edema, aquaporin-4 expression and metabolic markers during the acute phase of stroke using photothrombotic mouse model. Biochimica et Biophysica Acta. Biomembranes. 1863 (5), 183573(2021).
- Kitchen, P., et al. Targeting aquaporin-4 subcellular localization to treat central nervous system edema. Cell. 181 (4), 784-799 (2020).
- Adamsky, A., et al. Astrocytic activation generates de novo neuronal potentiation and memory enhancement. Cell. 174 (1), 59-71 (2018).
- Adamsky, A., Goshen, I. Astrocytes in memory function: pioneering findings and future directions. Neuroscience. 370, 14-26 (2018).
- Nagai, J., et al. Behaviorally consequential astrocytic regulation of neural circuits. Neuron. 109 (4), 576-596 (2021).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Refaeli, R., et al. Features of hippocampal astrocytic domains and their spatial relation to excitatory and inhibitory neurons. Glia. 69 (10), 2378-2390 (2021).
- Eilam, R., Aharoni, R., Arnon, R., Malach, R. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human. eLife. 5, 15915(2016).
- Bushong, E. A., Marton, M. E., Ellisman, M. H. Maturation of astrocyte morphology and the establishment of astrocyte domains during postnatal hippocampal development. International Journal of Developmental Neuroscience. 22 (2), 73-86 (2004).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. Journal of Comparative Neurology. 462 (2), 241-251 (2003).
- Bushong, E. A., Martone, M. E., Jones, Y. Z., Ellisman, M. H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. The Journal of Neuroscience. 22 (1), 183-192 (2002).
- Chai, H., et al. Neural circuit-specialized astrocytes: transcriptomic, proteomic, morphological, and functional evidence. Neuron. 95 (3), 531-549 (2017).
- Taniguchi, H., et al. A resource of Cre driver lines for genetic targeting of GABAergic neurons in cerebral cortex. Neuron. 71 (6), 995-1013 (2011).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159(2005).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- DeNardo, L. A., et al. Temporal evolution of cortical ensembles promoting remote memory retrieval. Nature Neuroscience. 22 (3), 460-469 (2019).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon