Method Article
Untersuchung der räumlichen Interaktion zwischen Astrozyten und Neuronen in geräumten Gehirnen
In diesem Artikel
Zusammenfassung
Die Kombination von viraler Vektortransduktion und Gehirn-Clearing mit der CLARITY-Methode ermöglicht die gleichzeitige Untersuchung einer großen Anzahl von Neuronen und Astrozyten.
Zusammenfassung
Die Kombination von viraler Vektortransduktion und Gewebereinigung mit der CLARITY-Methode ermöglicht es, mehrere Arten von Gehirnzellen und deren Wechselwirkungen gleichzeitig zu untersuchen. Die virale Vektortransduktion ermöglicht die Markierung verschiedener Zelltypen in verschiedenen Fluoreszenzfarben innerhalb desselben Gewebes. Zellen können genetisch durch Aktivität oder Projektion identifiziert werden. Unter Verwendung eines modifizierten CLARITY-Protokolls ist die potenzielle Stichprobengröße von Astrozyten und Neuronen um 2-3 Größenordnungen gewachsen. Der Einsatz von CLARITY ermöglicht die Abbildung kompletter Astrozyten, die zu groß sind, um in ihrer Gesamtheit in Scheiben zu passen, und die Untersuchung der Somata mit all ihren Prozessen. Darüber hinaus bietet es die Möglichkeit, die räumliche Interaktion zwischen Astrozyten und verschiedenen neuronalen Zelltypen zu untersuchen, nämlich die Anzahl der pyramidenförmigen Neuronen in jeder astrozytischen Domäne oder die Nähe zwischen Astrozyten und spezifischen inhibitorischen Neuronenpopulationen. In diesem Beitrag wird ausführlich beschrieben, wie diese Methoden anzuwenden sind.
Einleitung
In den letzten Jahren hat das Wissen über die Funktion von Astrozyten und wie sie mit neuronalen Schaltkreisen interagieren, dramatisch zugenommen. Astrozyten können die Plastizität beeinflussen 1,2, die neuronale Erholung nach einer Verletzungunterstützen 3,4 und sogar eine de novo neuronale Potenzierung induzieren, wobei neuere Studien die Bedeutung von Astrozyten für den Gedächtniserwerb und die Belohnung zeigen, die bisher als rein neuronale Funktionen angesehen wurden 5,6,7 . Ein Merkmal von besonderem Interesse in der Astrozytenforschung ist die räumliche Anordnung der Zellen, die einzigartige räumliche Organisationen im Hippocampus und anderen Gehirnstrukturen aufrechterhalten 8,9,10. Im Gegensatz zu den neuronalen Dendriten, die sich zwischen den Zellsomata verflechten, bewohnen Hippocampus-Astrozyten visuell unterscheidbare Territorien mit leichten Überlappungen zwischen ihren Prozessen, wodurch unterschiedliche Domänenentstehen 8,11,12,13. Die Beweise, die die Teilnahme von Astrozyten an neuronalen Schaltkreisen unterstützen, unterstützen nicht das Fehlen einer detaillierten anatomischen Beschreibung solcher Populationen und der Neuronen in ihren Domänen14.
Virale Vektortransduktionsverfahren wurden zusammen mit transgenen Tieren (TG) als Werkzeugset zur Untersuchung von Gehirnstrukturen, -funktionen und Zellinteraktionenpopulär gemacht 15,16. Die Verwendung verschiedener Promotoren ermöglicht das Targeting spezifischer Zellen entsprechend ihren genetischen Eigenschaften, Aktivierungsstufen17,18 oder Projektionszielen. Verschiedene Viren können in verschiedenen Populationen verschiedenfarbige Fluorophore exprimieren. Ein Virus kann mit der endogenen Expression von Fluorophoren in TG kombiniert werden, oder TG-Tiere können ohne Viren verwendet werden. Diese Techniken werden häufig für die neuronale Markierung verwendet, und einige Labore haben begonnen, sie mit Modifikationen zu verwenden, die auf andere Zelltypen wie Astrozyten 5,9,19 spezialisiert sind.
Die CLARITY-Technik, die erstmals 2013 20,21 beschrieben wurde, ermöglicht die Untersuchung dicker Hirnschnitte, indem sie das gesamte Gehirn transparent macht und gleichzeitig die mikroskopischen Strukturen intakt lässt. Durch die Kombination der beiden Methoden - virale Vektortransduktion und Gewebereinigung - steht nun die Möglichkeit zur Verfügung, die räumlichen Wechselwirkungen zwischen verschiedenen Zelltyppopulationen zu untersuchen. Die meisten Astrozyten-Neuronen-Interaktionsstudien wurden an dünnen Gehirnschnitten durchgeführt, was zu Bildern unvollständiger Astrozyten aufgrund ihrer großen Domänen führte, wodurch die Anzahl der analysierten Zellen radikal eingeschränkt wurde. Die Verwendung der CLARITY-Technik ermöglicht die gleichzeitige Charakterisierung von Zellpopulationen in großflächigen Volumina mit Einzelzellauflösung. Die Abbildung fluoreszierend markierter Zellpopulationen in klaren Gehirnen liefert keine synaptische Auflösung, sondern ermöglicht eine gründliche Charakterisierung der räumlichen Wechselwirkungen zwischen Astrozyten und einer Vielzahl von neuronalen Zelltypen.
Aus diesem Grund nutzten wir diese hochmodernen Techniken, um die Eigenschaften von Astrozyten im gesamten dorsalen CA1 zu untersuchen und alle Lamina (Stratum Radiatum, Pyramidenschicht und Stratum Oriens) abzubilden. Wir haben Zehntausende von Astrozyten (mit einer Viruspenetranz von >96%5) gemessen und dabei die Informationen der gesamten astrozytischen Population um CA1 analysiert. Mit effizienter Penetranz der neuronalen Marker konnten wir die Wechselwirkungen zwischen der gesamten Population von CA1-Astrozyten und den vier Arten von neuronalen Zellen - Parvalbumin (PV), Somatostatin (SST), VIP-hemmenden Neuronen und exzitatorischen Pyramidenzellen9 - aufzeichnen.
Mehrere Experimente wurden mit einer Kombination aus Fluoreszenz von TG-Tieren und verschiedenfarbigen viralen Vektoren (alle inhibitorischen Zellen) durchgeführt, während andere (exzitatorisch) zwei virale Vektoren verwendeten, die verschiedene Fluorophore unter verschiedenen Promotoren exprimierten9. Dieses Papier stellt ein detailliertes Protokoll vor, einschließlich der Markierung der gewünschten Zellen im Gehirn, der Transparentmachung des Gehirns mit einem modifizierten CLARITY-Verfahren sowie der Bildgebung und Analyse kompletter Gehirnstrukturen mit verschiedenen Verfahren und Software.
Protokoll
Die Versuchsprotokolle wurden vom Animal Care and Use Committee der Hebrew University genehmigt und entsprachen den Richtlinien des National Institute of Health Guide for the Care and Use of Laboratory Animals.
1. Virale Vektortransduktion
HINWEIS: Virale Vektortransduktion wird verwendet, um Fluorophore im Gehirn zu exprimieren.
- Verwenden Sie einen Atlas (z. B. Allen Brain Atlas), um die relevante Koordination des Zielbereichs zu lokalisieren.
HINWEIS: 3D-Atlanten können online gefunden werden (z. B. http://connectivity.brain-map.org/3d-viewer). - Injizieren Sie mittels stereotaktischer Chirurgie die viralen Vektoren in die relevante Gehirnstruktur. Siehe9 für ein detailliertes Protokoll.
- Warten Sie 3-6 Wochen auf die Fluorophorexpression.
HINWEIS: Eine kurze Zeitspanne reicht aus, wenn nur Zellkörper markiert werden müssen. Wenn die axonalen Projektionen für die Fragestellung relevant sind, wird ein langer Zeitraum benötigt, da es länger dauert, bis sich die Fluorophore in Axonen exprimieren, die mehrere Millimeter lang sein können. - Validieren Sie die Spezifität und Penetranz der Fluorophorexpression (sowohl der viralen Expression als auch der TG-Tiere) im Voraus (Abbildung 1A). Bevor Sie mit dem CLARITY-Verfahren fortfahren, bestimmen Sie mindestens ein Gehirn für dünne Scheiben und stellen Sie sicher, dass die Fluorophorexpression sowohl stark als auch spezifisch für das Zielzellmerkmal ist.
2. KLARHEIT
HINWEIS: Diese Methode macht das Gehirn innerhalb von 2-6 Wochen transparent.
- Führen Sie eine transkranielle Perfusion an Tieren mit kalter phosphatgepufferter Kochsalzlösung (PBS) durch, gefolgt von 4% Paraformaldehyd (PFA) in PBS. Entfernen Sie das Gehirn und halten Sie es in PFA über Nacht bei 4 ° C in einem 50 ml Röhrchen oder einem ähnlichen Behälter.
HINWEIS: Bevor eine transkranielle Perfusion durchgeführt wird, muss das Tier tief betäubt werden. In den in diesem Protokoll vorgestellten Beispielen wurden alle Tiere mit Ketamin und Xylazin (90% bzw. 10%) betäubt. - Ersetzen Sie PFA durch Hydrogellösung (HS; siehe Tabelle 1) für 48 h bei 4 °C.
HINWEIS: Lassen Sie die Materialien in diesem Stadium nicht wärmer als die Kühltemperatur (4-8 ° C) werden, da sonst das Hydrogel polymerisiert. Das in diesem Protokoll verwendete HS enthält 2% Acrylamid, im Gegensatz zu früheren Protokollen, die 4% 22 oder 1% 17 vorschlagen. Der Nutzen von 2% wird im Diskussionsabschnitt beschrieben. Arbeiten Sie bei der Vorbereitung des HS auf einer eiskalten Oberfläche. Lagern Sie es bei -20 °C. - Entgasung
HINWEIS: Der Zweck dieser Phase besteht darin, den gesamten freien Sauerstoff aus dem Gewebe zu entfernen, da O2 den Polymerisationsprozess stört. Es kann jedes Nicht-O2-Gas verwendet werden (z. B.N2, CO2); N 2 wird empfohlen.- Übertragen Sie den N2 aus dem Tank über einen 5 mm (internen) flexiblen Schlauch, der an seinem Ende mit einer 19-G-Nadel verbunden ist (Abbildung 1B).
- Machen Sie zwei kleine Löcher (nadelbreit) in die Kappe des Rohres: eines, um das Gas einzuführen, und das andere, damit die Luft das Rohr verlassen kann (Abbildung 1C).
- Befestigen Sie das Rohr aus demN2-Gas am Rohr und ersetzen Sie die Gase für ca. 30 min bei Raumtemperatur (RT).
- Entfernen Sie das Rohr und schließen Sie die Löcher sofort mit Modelliermasse auf jedem Rohr ab (Abbildung 1D).
- Die entgasten versiegelten Rohre für 3,5 h in ein 37 °C warmes Bad geben, um das HS zu polymerisieren, das zu einem Gel wird. Achten Sie darauf, die Röhren nicht zu schütteln (Abbildung 1E).
- Extrahieren Sie das Gehirn aus der Tube und entfernen Sie das polymerisierte Gel vorsichtig mit Labortüchern aus der Umgebung. Stellen Sie sicher, dass kein Restgel an der Oberfläche des Gewebes haftet, da es in den folgenden Schritten mit der Lösung reagieren und den Gewebereinigungsprozess hemmen könnte (Abbildung 1F).
HINWEIS: Da das Gel PFA enthielt, sollte die Extraktion unter einem Abzug erfolgen. - Schneiden Sie das Gehirn auf, wenn die vorliegende Frage nur einen Teil davon benötigt. Teilen Sie es in zwei Hälften oder in sehr dicke Scheiben, die alle Bereiche von Interesse enthalten (Abbildung 1G).
- Legen Sie die Scheiben in der First Clearing Solution (CS1, siehe Tabelle 2) in einen neuen Behälter und schütteln Sie sie bei 70 U/min für 24 h bei 37 °C.
- Führen Sie die unten beschriebenen Schritte aus, um das Gehirn von CS1 auf die zweite Clearing-Lösung (CS2, siehe Tabelle 2) zu übertragen.
- Bereiten Sie im Voraus einen perforierten Schlauch für das Gehirn vor (Abbildung 1H).
- CS2 in einem Becherglas, das groß genug ist, um das Röhrchen aufzunehmen, auf 40-45 °C vorheizen. Tun Sie dies auf einer Kochplatte mit einem Rührer. Stellen Sie sicher, dass die Temperatur nicht 55 ° C erreicht, um das Ausbleichen der exprimierten Proteine zu verhindern.
- Legen Sie das mit CS2 gefüllte Becherglas und das perforierte Rohr auf eine Rührvorrichtung (ein 2-Liter-Becherglas in Abbildung 1I). Stellen Sie eine moderate Rührrate ein, die dazu führt, dass die Flüssigkeit fließt, ohne das Gewebe zu verzerren.
HINWEIS: Innerhalb von 2-6 Wochen wird das Gewebe transparent (der Prozess beginnt an der Peripherie und bewegt sich nach innen in Richtung der zentralen Gehirnstrukturen). Die Entscheidung, wann das Gewebe "klar genug" ist, liegt im persönlichen Urteil. Das Gehirn sollte ausreichend transparent sein, um unter dem Mikroskop ohne Interferenz abbilden zu können (Abbildung 1J nicht klar genug; Abbildung 1K klar genug). Das Überschreiten des Punktes, an dem das Gewebe klar genug ist, kann zu einem Verlust der Gewebesteifigkeit führen.
- Transfer von CS2 in PBST (0,5% Triton X-100 in PBS, siehe Tabelle 2) in einem neuen Behälter bei 37 °C mit leichtem Schütteln (70 U/min) für 24 h.
HINWEIS: Im PBST wird das Gewebe weißlich (Abbildung 1L). Die Klarheit kehrt zurück (und verbessert sich), wenn sie in die Refractive Index Matching Solution (RIMS, siehe Schritt 2.14) eingebettet ist. - Ersetzen Sie die PBST durch eine neue PBST. Unter den gleichen Bedingungen (37 °C mit leichtem Schütteln) für weitere 24 h aufbewahren.
- Ersetzen Sie PBST wieder durch neue PBST und behalten Sie sie 24 Stunden bei RT.
- Transfer zu PBS bei RT für 24 h.
- Ersetzen Sie die PBS und lassen Sie sie bei RT für weitere 24 Stunden.
- Entfernen Sie das Gehirn von PBS und übertragen Sie es über Nacht auf RIMS bei 37 ° C.
HINWEIS: Anfangs können Wellen im RIMS das Gehirn umgeben. Dieses Protokoll wurde unter Verwendung von zwei spezifischen kommerziellen RIMS entwickelt und validiert (siehe Tabelle 3). Das Protokoll sollte sich jedoch nicht unterscheiden, wenn andere RIMS (kommerziell oder selbst hergestellt) verwendet werden. - Halten Sie das Gewebe bei RT für weitere 24 h oder bis die Lösung das volle Gleichgewicht erreicht, d. h. wenn das Gewebe transparent wird und die Lösung keine sichtbaren Wellen mehr enthält (Abbildung 1M).
- Wenn das Gewebe transparent ist, fahren Sie mit der Kammervorbereitung fort. Wenn das Gewebe zu diesem Zeitpunkt weiß statt transparent wird (aufgrund von Aggregaten von verbleibenden SDS-Molekülen), reinigen Sie die Probe erneut, indem Sie die Schritte 2.9 und 2.10 wiederholen, und übertragen Sie das Gewebe für einige Tage in CS2 (Schritt 2.8), gefolgt von allen Schritten bis Schritt 2.15.
3. Kammervorbereitung
HINWEIS: Jede Probe benötigt einen Objektträger mit einer Bildgebungskammer, in die die Probe gelegt wird.
- Platzieren Sie die Probe in der Mitte des Objektträgers.
- Erstellen Sie mit einer Heißklebepistole Wände an den Rändern des Objektträgers, die fast so hoch sind wie das Gewebe. Achten Sie darauf, einen kleinen Spalt (ca. 5 mm) an einer der Ecken zu lassen (Abbildung 2A,B).
- Tragen Sie 1-2 Tropfen des RIMS auf die Probe auf, um die Oberseite feucht zu halten und zu verhindern, dass sich Blasen zwischen dem Deckglas und dem Gewebe bilden.
- Unmittelbar nach dem Auftragen der RIMS-Tropfen fügen Sie die letzte Schicht Heißkleber zu den Wänden hinzu (so dass sie die Höhe des Gehirns / der Scheibe erreichen) und gehen Sie sofort (während der Heißkleber noch flüssig ist) zu Schritt 3.5 fort.
- Verschließen Sie die Oberseite mit einem Deckglas und legen Sie es so gleichmäßig wie möglich auf die Oberseite der noch warmen Heißkleberschicht (Abbildung 2C).
- Füllen Sie die Kammer mit den RIMS durch den Spalt in den Heißklebewänden (Abbildung 2D,E).
- Schließen Sie die Lücke mit Heißkleber. Lassen Sie keine Luft im Inneren (Abbildung 2F).
- Wenn die Heißklebewände über die Grenzen des Objektträgers hinausragen, schneiden Sie die ausladenden Kanten ab (Abbildung 2G).
- Wenn das für die Bildgebung verwendete Objektiv eingetaucht ist, fügen Sie weitere 2-3 mm Kleber an die Wände über dem Deckglas hinzu, damit die Tauchlösung länger hält (Abbildung 2H).
4. Bildgebung (konfokal oder Zwei-Photonen)
- Prüfen Sie, ob der Tisch die Kammer halten kann, da die Dicke der Kammer mehrere Millimeter erreichen kann.
HINWEIS: Zum Beispiel ist das konfokale Mikroskop (siehe Materialtabelle), das in diesem Protokoll verwendet wird, mit mehreren Stufen ausgestattet (z. B. kreisförmig, rechteckig). Welche Stufe gewählt wird, um die Kammer zu halten, ist irrelevant, solange ihre Parameter zu den Kammergrößen passen. - Arbeiten Sie mit einem Objektiv mit einem ausreichenden Arbeitsabstand, d.h. einem minimalen Arbeitsabstand ≥3 mm, da die interessierende Hirnregion einige Millimeter tief sein kann und das Deckglas möglicherweise nicht vollständig gerade ist, da es manuell platziert wurde.
HINWEIS: Als Demonstration wurden die in Abbildung 1, Video 1 und Video 2 dargestellten Ergebnisse unter einem Zwei-Photonen-Mikroskop unter Verwendung eines 16-fachen Wasserimmerzobjektivs mit einem Arbeitsabstand von 3 mm und einer Vergrößerung von 2,4 erhalten, um ein Sichtfeld von 652 x 483 μm und einen Z-Stack mit 0,937 μm-Intervallen zwischen den Ebenen zu erhalten. - Führen Sie eine mehrbereichige Bildgebung durch, die einige Stunden oder sogar Tage dauern kann. Stellen Sie sicher, dass auf dem Computer ausreichend freier Speicherplatz vorhanden ist, da die Größe jedes Bildes bis zu zehn Gigabit erreichen kann.
HINWEIS: Die CLARITY-Bildgebung kann zu deutlich mehr Bildausschnitten in der Tiefe führen. Daher sollten die Intensitäten, die zum Erfassen des Ausdrucks verwendet werden, relativ niedrig sein, um eine Überexpression während der Bildsummierung zu verhindern. - Für Tauchobjektive überprüfen Sie die Flüssigkeit routinemäßig während der Bildgebung und ergänzen Sie sie bei Bedarf mit zusätzlicher Flüssigkeit.
HINWEIS: Während der Bildgebung der in Video 3 dargestellten Daten wurde der Oberfläche der Kammer alle 6-8 h Wasser hinzugefügt, um die Verdunstung zu bekämpfen. - Nachdem das Bild aufgenommen wurde, können Sie es mit verschiedenen Softwarepaketen anzeigen und analysieren.
HINWEIS: Die empfohlene Software umfasst Imaris und SyGlass für die Visualisierung und Analyse. Die genaue Pipeline zur optimierten Rekonstruktion von Astrozyten mit der Imaris-Software wurde bereits9 beschrieben. Kurz gesagt, die Imaris-Merkmale, die in dieser Studie verwendet wurden, waren Filamente, um Zellstrukturen vollständig zu rekonstruieren, und Spots, um die Position im Raum aller Somata zu extrahieren.
Ergebnisse
Die erfolgreiche Beseitigung dicker Hirngewebeschnitte führt zu einer neuen Reihe von Fragen, die in Bezug auf die Eigenschaften von großzelligen Populationen im Gegensatz zu den Eigenschaften einzelner Zellen oder benachbarter Zellgruppen gestellt werden können. Um erfolgreiche Ergebnisse zu erzielen, sollte man sich strikt an das CLARITY-Protokoll halten, da es eine Vielzahl von Parametern gibt, die berücksichtigt werden müssen, um die Varianz zwischen den Proben zu reduzieren (z. B. Prozentsatz der Klarheit, Fluoreszenzinformation, Geschwollenheitsparameter).
Abbildung 1 beschreibt den gesamten Clearing-Prozess von der Validierung der fluoreszierenden Proteinexpression bis hin zu allen Phasen der Clearing-Methode. Abbildung 2 beschreibt, wie eine Kammer für das geklärte Gewebe vorbereitet wird, optimal für die Bildgebung unter einem Zwei-Photonen- oder Konfokalmikroskop. Die in diesem Protokoll benötigten Materialien sind im Vergleich zu anderen Protokollen der Kammervorbereitung äußerst kostengünstig.
Abbildung 3 zeigt den in Video 1 beschriebenen Würfel, in dem über 300 Astrozyten in einem geräumten Abschnitt des CA1-Teils eines Maus-Hippocampus gezeigt werden. Abbildung 4 zeigt den in Video 2 beschriebenen Würfel, in dem sowohl Astrozyten als auch exzitatorische neuronale Somaten in dickem transparentem Gewebe gezeigt werden. Abbildung 5 zeigt eine ganze Hemisphäre, wie in Video 3 beschrieben. Gehirnweite neuronale Projektionen werden aus dem dorsalen CA1 (grün, GFP) und dem ventralen CA1 (rot, TdTomato) angezeigt.
Video 1 zeigt ein dickes Bild von Hippocampus-Astrozyten (>300), die mit einem Zwei-Photonen-Mikroskop nach einem CLARITY-Verfahren aufgenommen wurden. Die Fluoreszenz wurde durch virale Vektortransduktion speziell für Astrozyten bereitgestellt. Video 2 zeigt die räumliche Nähe zwischen Astrozyten und den Kernen der Hippocampus-Pyramidenzellen. Video 3 verfolgt axonale Bündel über eine ganze Hemisphäre; Axone projizieren aus dem primären motorischen Kortex und werden aus dem Rückenmark zurückverfolgt. Ein weiteres Bündel wird vom dorsalen Hippocampus in Richtung der supra mmillarischen Körper verfolgt. Schließlich verfolgt es ein rotes Bündel von Axonen von den Mammillarkörpern zu ihrem Ursprung im ventralen Hippocampus. Alle markierten Zellen sind ausschließlich exzitatorisch.

Abbildung 1: Detaillierte Beschreibung des Clearingprozesses. (A) Validierung der Fluorophorexpression. In diesem Beispiel exprimieren alle Astrozyten im CA1-Teil eines Hippocampus der Maus ein rotes Protein (TdTomato, abgebildet in Magenta), und alle erregenden Neuronen exprimieren ein grünes Protein in ihren Kernen (H2B-GFP). Dieses Bild wurde mit einem 2-Photonen-Mikroskop aufgenommen. Das Bild wurde mit einem 16-fachen Objektiv (0,8 NA) mit einer Vergrößerung von 2,4 aufgenommen, um ein Sichtfeld von 652 x 483 μm bei 15,5 Bildern/s und einem Z-Stack mit 0,937 μm-Intervallen zwischen den Ebenen zu erhalten. Die Spezifität und Penetranz wurden durch Immunhistochemienachgewiesen 9. (B) Die Übertragung desN2-Gases aus dem Tank in den Schlauch, der das Gehirn hält, erfordert ein Rohr mit einer Nadel an seinem Ende. (C) Die Luft im Rohr wird durch N2 ersetzt, indem zwei Löcher entstehen, eines (oberer Pfeil) für den Zufluss vonN2über die Nadel, die mit der Rohrleitung aus dem Gastank verbunden ist, und ein weiteres (unterer Pfeil) für den Abfluss. (D) Das Abdecken der Löcher mit Modelliermasse unmittelbar nach der Entgasung verhindert, dass dasN2 aus dem Rohr austritt. (E) Erhitzen der entgasten Lösung für 3,5 h in einem warmen Bad. (F) Eine erfolgreiche Polymerisation führt zu einem Gehirn, das in geliertes HS eingebettet ist. Gasblasen könnten im Polymer eingeschlossen sein. (G) Unmittelbar nach der Extraktion aus dem Gel ist der beste Punkt für das Gehirn, um in die gewünschte Dicke geschnitten zu werden. (H) Perforierte Röhrchen ermöglichen den Fluss der Lösung auf dem Rührer, um die Probe zu erreichen. (I) Gehirne in perforierten Schläuchen werden vertikal von einem selbstgebauten Halter in einer Größe gehalten, die für einen 2-Liter-Becher geeignet ist und auf einem Rührer mit Kochplatten steht. (J) Beispiel für ein Gehirn, das nicht klar genug ist. Die Probe sollte im CS2 für etwa eine weitere Woche gerührt werden. (K) Beispiel für ein ausreichend klares Gehirn. (L) Beim Einsetzen des klaren Gehirns in PBST wird das Gewebe weißer als zuvor. Dieser Farbwechsel ist auf den Triton zurückzuführen und verschwindet, wenn er von dieser Lösung zur nächsten verschoben wird. (M) Nach >24 h im RIMS wird das Gehirn wieder vollständig transparent. Abkürzungen: GFP = grün fluoreszierendes Protein; NA = numerische Apertur; HS = Hydrogellösung; CS2 = Clearing-Lösung 2; PBST = phosphatgepufferte Kochsalzlösung mit 0,5% Triton X-100; RIMS = Refractive Index Matching Solution. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Kammervorbereitung. (A) Die erste Schicht von Heißklebewänden bedeckt die Ränder eines Objektträgers und hinterlässt einen Raum, der breit genug ist, um das Gehirn aufzunehmen, ohne die Wände zu berühren. Ein Loch befindet sich in der oberen linken Ecke der Rutsche. (B) Hinzufügen von Schicht zu Schicht, um die Höhe des Gewebes zu erreichen. (C) Gerade Decke (weißer Pfeil) versiegelt die Kammer. (D) Kammer gefüllt mit RIMS durch das Loch in den Kammerwänden. (E) Die Kammer ist mit RIMS gefüllt und hinterlässt keine Luftblasen. (F) Abdichten des Lochs in der Kammer mit Heißkleber, um ein Auslaufen zu verhindern. Seitenansicht. (G) In diesem Stadium sollten alle Heißklebereste, die sich über die Ränder des Objektträgers erstrecken, von der Kammer abgeschnitten werden. (H) Vollständig vorbereitete Kammer, bereit für die Bildgebung unter dem Mikroskop. Abkürzung: RIMS = Refractive Index Matching Solution. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
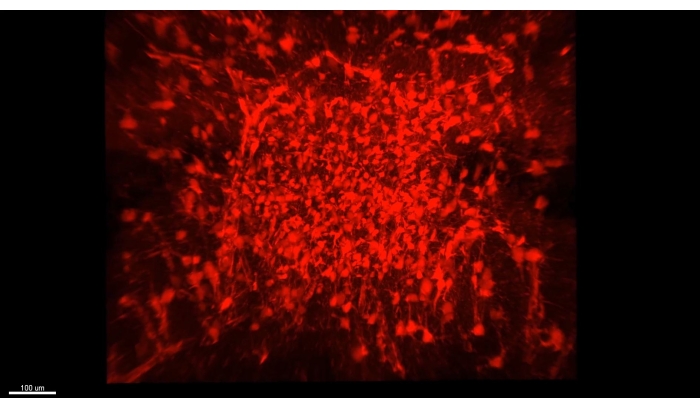
Abbildung 3: Alle abgebildeten Astrozyten (AAV1-GFAP::TdTomato, rot) in einem geräumten Hippocampus. Ein einzelnes Bild aus Video 1, das alle abgebildeten Astrozyten (AAV1-GFAP::TdTomato, rot) in einem geräumten Hippocampus erfasst. Alle Details zu den Bildeigenschaften sind unter Video 1 beschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
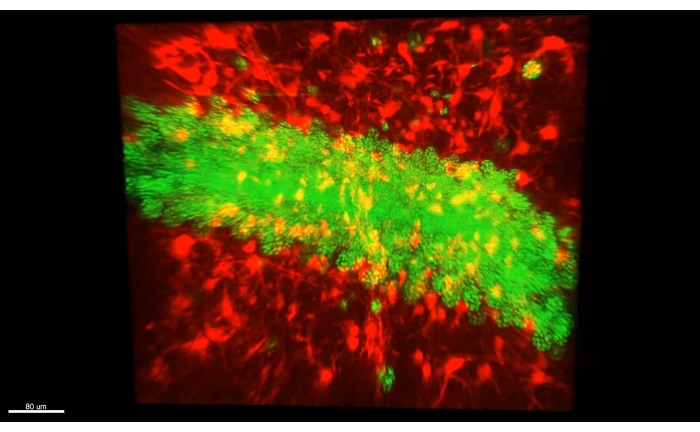
Abbildung 4: Astrozyten (AAV1-GFAP::TdTomato, rot) und Hippocampus-Pyramidenzellkerne (AAV5-CaMKII::H2B-eGFP, grün) in dickem transparentem Gewebe. Ein einzelnes Bild aus Video 2, das sowohl Astrozyten (AAV1-GFAP::TdTomato, rot) als auch Hippocampus-Pyramidenzellkerne (AAV5-CaMKII::H2B-eGFP, grün) in dickem transparentem Gewebe zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
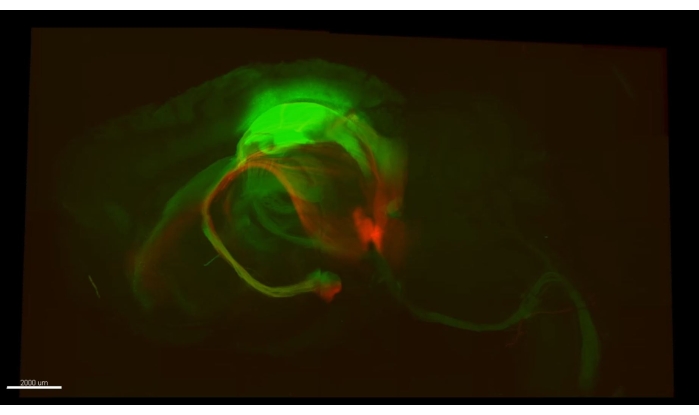
Abbildung 5: Grüne Axone (AAV5-CaMKII::eGFP, grün) und rote Axone (AAV5-CaMKII::TdTomato). Ein einzelnes Bild aus Video 3, das beide Arten von Axonen zeigt, die von mehreren Stellen in einem Mausgehirn stammen und in einer ganzen Hemisphäre verfolgt werden können. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Video 1: Filmmaterial von >1 mm dicken Scheibe hippokampaler dorsaler CA1-Astrozyten (AAV1-GFAP::TdTomato, rot). Das Video wurde mit einem Zwei-Photonen-Mikroskop unter Verwendung eines 16-fachen Objektivs (0,8 NA) mit einer Vergrößerung von 2,4 nach einem CLARITY-Verfahren aufgenommen. Ähnlich wie in Abbildung 1A wurde das Z-Stack-Intervall auf 0,937 μm festgelegt. Die Fluoreszenz wurde durch virale Vektortransduktion speziell für Astrozyten bereitgestellt. Die Anzahl der Astrozyten in diesem Würfel beträgt >300, und die meisten Prozesse stehen in den meisten Zellen zur Analyse zur Verfügung. Abkürzungen: NA = numerische Blende; AAV = Adeno-assoziiertes Virus; GFAP = gliales fibrilläres saures Protein. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Astrozyten und erregende Neuronenkerne in einem 3D-Würfel. Der Würfel enthält alle Lamina des dCA1 unter den für Abbildung 1A und Video 1 genannten optischen Bedingungen. Dieser Würfel zeigt die räumliche Nähe zwischen Astrozyten (AAV1-GFAP::TdTomato, rot) und den Kernen der Hippocampus-Pyramidenzellen (AAV5-CaMKII::H2B-eGFP, grün). Abkürzungen: AAV = Adeno-assoziiertes Virus; GFAP = gliales fibrilläres saures Protein; CAMKII = Calcium/Calmodulin-abhängige Proteinkinase II; eGFP = Enhanced Green Fluorescent Protein; H2B = Histone 2B. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 3: Axonale Bündel über eine ganze Hemisphäre verfolgen. Grüne Axone (AAV5-CaMKII::eGFP, grün), die am Rückenmark enden, lassen sich leicht bis zum primären motorischen Kortex (mehr als 7 mm voneinander entfernt) zurückverfolgen. Vom Hippocampus (dorsale Seite) wird ein weiteres Bündel in Richtung der Supra-Mammillarkörper (ventralste Seite des Gehirns) verfolgt, eine Spur von fast 3 mm Länge. Die zweite Hälfte des Videos zeichnet ein rotes Bündel von Axonen (AAV5-CaMKII::tdTomato) nach, die aus dem ventralen Hippocampus stammen, von ihrem Zielort an den Mammillarkörpern. Das Bild wurde unter einem konfokalen Rasterlasermikroskop FV1000 von Olympus mit einem 4-fachen Objektiv (0,16 NA) aufgenommen, und mehrere ROIs wurden mit der MATL FluoView-Funktion kombiniert, um die gesamte Hemisphäre darzustellen. Abkürzungen: AAV = Adeno-assoziiertes Virus; CAMKII = Calcium/Calmodulin-abhängige Proteinkinase II; eGFP = Enhanced Green Fluorescent Protein; NA = numerische Apertur; MATL = Zeitraffer mit mehreren Bereichen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
| Hydrogellösung (1 l) | |
| Material | Menge |
| VA-044 Initiator | 2,5 g |
| PFA 4% | 900 ml |
| Acrylamid (40%) | 50 ml |
| Bisacrylamid (2%) | 50 ml |
Tabelle 1: Herstellung von Hydrogellösung (1 L). Hydrogellösung muss auf einer eiskalten Oberfläche hergestellt werden. Die Reihenfolge, in der die Zutaten gemischt werden, ist nicht wichtig. Beachten Sie, dass der Gesamtprozentsatz von Acrylamid 2% beträgt, im Gegensatz zu ähnlichen Protokollen, die entweder 1% 17 oder 4% 22 verwenden.
| Clearing-Lösungen (1 l) | ||
| Material | Menge | |
| CS1 | CS2 | |
| Borsäure (M.W. = 61,83 g/mol) | 12,366 g | 3,4 g |
| SDS | 80 Gramm | 80 Gramm |
| Tris-Base (M.W. = 121,14 g/mol) | 0 | 12,1 g |
| Destilliertes Wasser (DW) | Füllung bis 1 L | Füllung bis 1 L |
| NaOH | pH-Wert 8,5 | |
| 1 l phosphatgepufferte Kochsalzlösung mit 0,5% Triton X-100 | ||
| Material | Menge | |
| PBS | 995 ml | |
| Triton X-100 | 5 ml | |
Tabelle 2: Herstellung von Clearinglösungen 1 und 2 (1 L) und 1 l phosphatgepufferter Kochsalzlösung mit 0,5% Triton X-100. Die Clearinglösungen können im Vorfeld vorbereitet und lange bei Raumtemperatur gehalten werden. Jede Lösung, die Borsäure und SDS enthält, sollte unter einem Abzug gehandhabt werden, um das Einatmen oder den Hautkontakt mit SDS oder Borsäure zu vermeiden. Das NaOH in CS1 sollte zuletzt hinzugefügt werden, um den pH-Wert auf 8,5 einzustellen. Jede Hirnprobe sollte in mindestens 5-25 ml CS1 gegeben und über Nacht für eine ausreichende Diffusion aufbewahrt werden. Abkürzungen: CS1 = Clearinglösung 1; SDS = Natriumdodecylsulfat; M.W. = Molekulargewicht.
| Produktname | Hauptvorteil | Hauptnachteil |
| RapiClear | Probe bleibt transparent | Gewebeschwellung |
| RapiClear CS | Die Probe schrumpft wieder auf die normale Größe | Probe kann an Transparenz verlieren |
Tabelle 3: RIMS-Optionen mit Vor- und Nachteilen. Rapiclear (RC, RI = 1,47) oder CLARITY-spezifisches Rapiclear (CSRC, RI = 1,45). Der Hauptunterschied zwischen diesen beiden Lösungen besteht darin, dass, während das CSRC das klare Gehirn wieder auf seine ursprüngliche Größe schrumpft, die RC-Lösung dies nicht tut und die gereinigte Probe leicht geschwollen bleibt. Abkürzung: RI = Brechungsindex.
Diskussion
Gewebe-Clearing-Methoden stellen ein revolutionäres Werkzeug in der Hirnforschung dar und laden zu Fragen ein, die bisher nicht hätten gestellt werden können. CLARITY zielt nicht mehr auf die Eigenschaften einer kleinen Gruppe von Zellen, einer einzelnen Zelle oder sogar einer einzelnen Synapse ab und ermöglicht nun das Targeting von Gesamtzellpopulationen oder langreichweitigen Konnektivitätsmerkmalen durch die Verwendung relevanter Fluorophore.
Das Ergebnis der Kombination aus Fluorophorexpression und CLARITY-Verfahren ist nicht binär; Viele Faktoren können das Verfahren beeinträchtigen und zu suboptimalen Ergebnissen führen. Zunächst muss die Fluorophorexpression im Vorfeld verifiziert werden. Da das CLARITY-Verfahren einen gewissen Informationsverlust verursacht, ist eine ausreichende Fluorophorproteinexpression entscheidend für die Gültigkeit des Bildes am Ende des CLARITY-Prozesses. Zweitens muss die transkranielle Perfusion sorgfältig gehandhabt werden, um sicherzustellen, dass das gesamte Blut das Gehirn verlässt, da die Autofluoreszenz des Blutes zu unzuverlässigen Daten in dicken Scheiben führt. Drittens müssen alle im Protokoll besprochenen Parameter in jedem Schritt des Clearingprozesses mit Präzision behandelt werden, z. B.O2-Rückstände im HS vor der Polymerisation oder Temperaturungenauigkeit in jeder Stufe verhindern, dass die chemische Reaktion zwischen den aktiven Materialien auftritt.
Bisherige Protokolle17,22 empfehlen unterschiedliche Konzentrationen von Acrylamid im HS. Der Hauptzweck von Acrylamid besteht darin, die Moleküle besser mit Aminresten (Proteine und Nukleinsäuren) zu fixieren. Leichte Veränderungen der Konzentration wirken sich stark auf den gesamten Clearing-Prozess aus: Wenn die Fixierung zu kompakt ist, werden sich die Lipidmoleküle nicht vom Gewebe lösen, und der Clearing-Prozess wird unnötig langwierig sein oder zu undurchsichtigen Gehirnen führen. Niedrigere Konzentrationen von Acrylamid werden die Gehirnstruktur jedoch nicht ausreichend aufrechterhalten, sobald sie frei von Lipiden ist. In diesem Protokoll wird der Acrylamidanteil so eingestellt, dass er das empfindliche Gleichgewicht von fixiertem, aber klarem Gewebe liefert.
Der größte Teil des Clearing-Prozesses findet in CS2 statt, und der Reinheitsgrad des Gewebes sollte täglich getestet werden. Die PBST-Bereinigung ist ein wesentlicher Schritt zwischen den Clearing-Lösungen und den Brechungsindex-Matching-Lösungen, da sie die verbleibenden SDS-Moleküle reinigt, die mit dem RIMS interagieren können. Es ist auch möglich, das klare Gewebe in PBST (0,5%) auf unbestimmte Zeit zu halten, wenn noch keine Kammervorbereitung erforderlich ist.
Wenn man das Gehirn im RIMS platziert, sollte man sich mit den Vorteilen und Grenzen der Lösungen vertraut machen. Zum Beispiel verursacht RapiClear vollständige Transparenz auch in fast gereinigtem Gewebe, verursacht aber auch eine gewisse Schwellung, die bei der Analyse der Daten nicht vernachlässigt werden sollte. Frühere Messungen9 deuten auf eine gleichmäßige Ausdehnung entlang aller Achsen (d.h. dorsoventrale, anterior-posteriore und lateral-mediale Achsen) hin, was es ermöglicht, den Quellindex im Vergleich zu dünnen Scheiben aus derselben Hirnregion zu berechnen. Die Verwendung von CLARITY-Specific RapiClear beseitigt die Schwellung; Wenn jedoch SDS-Reste im Gewebe verbleiben, aggregieren sie zu intransparenten Massen.
Ein weiterer Vorteil dieses modifizierten Protokolls sind seine Kosten. Frühere Protokolle schlagen verschiedene Klebstofftypen vor, um eine Kammer zu schaffen, die das Gehirn in RIMS halten kann. In diesem Protokoll verwenden wir einfach Heißkleber. Es reagiert nicht mit den Lösungen, ist überall erhältlich, einfach zu bedienen und deutlich günstiger als die bisher vorgeschlagenen Klebstoffe.
Daten, die aus der Bildgebung dicker Hirnproben gewonnen werden, können ganze Zellpopulationen, die Konnektivität zwischen Gehirnstrukturen oder die Verfolgung eines einzelnen Axons über große Entfernungen beschreiben (Video 3). Obwohl Fragen zu diesen Merkmalen bereits früher gestellt wurden, verbessert die Gültigkeit der Daten, die jetzt mit dicken Gehirnscheiben erreichbar sind, die früheren, fehleranfälligen Methoden der dünnen Bildüberlagerung erheblich.
Das CLARITY-Verfahren ermöglicht eine erfolgreiche und gleichmäßige Beseitigung dicker Scheiben - von mehreren Millimetern bis hin zur vollständigen Bildgebung des Gehirns. Das passive Clearing (d.h. die Nichtverwendung von ETC) verringert das Risiko einer Schädigung des Gewebes und die Zeit, für die Proben in Clearing-Lösungen eingetaucht werden, so dass die hohe Effizienz der Proteinkonservierung nicht beeinträchtigt wird.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Dieses Projekt wurde vom Europäischen Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (Grant Agreement No 803589), der Israel Science Foundation (ISF-Grant Nr. 1815/18) und der Canada-Israel Grants (CIHR-ISF, Grant No. 2591/18) gefördert. Wir danken Nechama Novick für den Kommentar zum gesamten Manuskript.
Materialien
| Name | Company | Catalog Number | Comments |
| AAV1-GFAP::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect astrocytes | |
| AAV5-CaMKII::eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| AAV5-CaMKII::H2B-eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neuronal nuclei | |
| AAV5-CaMKII::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| Acrylamide (40%) | Bio-rad | #161-0140 | |
| Bisacrylamide (2%) | Bio-rad | #161-0142 | |
| Boric acid | Sigma | #B7901 | Molecular weight - 61.83 g/mol |
| Confocal microscope, scanning, FV1000 | Olympus | 4x objective (UPlanSApo, 0.16 NA) | |
| Imaris software | Bitplane, UK | A software that allows 3D analysis of images | |
| NaOH | Sigma | #S5881 | |
| PBS | |||
| PFA 4% | EMS | #15710 | |
| RapiClear | SunJin lab | #RC147002 | |
| RapiClear CS | SunJin lab | #RCCS002 | |
| SDS | Sigma | #L3771 | |
| SyGlass software | A software that allows 3D analysis of images using virtual reality | ||
| Tris base 1 M | Bio-rad | #002009239100 | Molecular weight - 121.14 g/mol |
| Triton X-100 | ChemCruz | #sc-29112A | |
| Two photon microscope | Neurolabware | Ti:sapphire laser (Chameleon Discovery TPC, Coherent), GaAsP photo-multiplier tubes (Hamamatsu, H10770-40) , bandpass filter (Semrock), water immersion 16x objective (Nikon, 0.8 NA) | |
| VA-044 Initiator | Wako | #011-19365 |
Referenzen
- Perea, G., Navarrete, M., Araque, A. Tripartite synapses: astrocytes process and control synaptic information. Trends in Neurosciences. 32 (8), 421-431 (2009).
- Ciappelloni, S., et al. Aquaporin-4 surface trafficking regulates astrocytic process motility and synaptic activity in health and autoimmune disease. Cell Reports. 27 (13), 3860-3872 (2019).
- Sylvain, N. J., et al. The effects of trifluoperazine on brain edema, aquaporin-4 expression and metabolic markers during the acute phase of stroke using photothrombotic mouse model. Biochimica et Biophysica Acta. Biomembranes. 1863 (5), 183573(2021).
- Kitchen, P., et al. Targeting aquaporin-4 subcellular localization to treat central nervous system edema. Cell. 181 (4), 784-799 (2020).
- Adamsky, A., et al. Astrocytic activation generates de novo neuronal potentiation and memory enhancement. Cell. 174 (1), 59-71 (2018).
- Adamsky, A., Goshen, I. Astrocytes in memory function: pioneering findings and future directions. Neuroscience. 370, 14-26 (2018).
- Nagai, J., et al. Behaviorally consequential astrocytic regulation of neural circuits. Neuron. 109 (4), 576-596 (2021).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Refaeli, R., et al. Features of hippocampal astrocytic domains and their spatial relation to excitatory and inhibitory neurons. Glia. 69 (10), 2378-2390 (2021).
- Eilam, R., Aharoni, R., Arnon, R., Malach, R. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human. eLife. 5, 15915(2016).
- Bushong, E. A., Marton, M. E., Ellisman, M. H. Maturation of astrocyte morphology and the establishment of astrocyte domains during postnatal hippocampal development. International Journal of Developmental Neuroscience. 22 (2), 73-86 (2004).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. Journal of Comparative Neurology. 462 (2), 241-251 (2003).
- Bushong, E. A., Martone, M. E., Jones, Y. Z., Ellisman, M. H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. The Journal of Neuroscience. 22 (1), 183-192 (2002).
- Chai, H., et al. Neural circuit-specialized astrocytes: transcriptomic, proteomic, morphological, and functional evidence. Neuron. 95 (3), 531-549 (2017).
- Taniguchi, H., et al. A resource of Cre driver lines for genetic targeting of GABAergic neurons in cerebral cortex. Neuron. 71 (6), 995-1013 (2011).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159(2005).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- DeNardo, L. A., et al. Temporal evolution of cortical ensembles promoting remote memory retrieval. Nature Neuroscience. 22 (3), 460-469 (2019).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten