Method Article
研究清除大脑中星形胶质细胞和神经元之间的空间相互作用
摘要
使用CLARITY方法结合病毒载体转导和大脑清除,可以同时研究大量神经元和星形胶质细胞。
摘要
使用CLARITY方法将病毒载体转导和组织清除相结合,可以同时研究几种类型的脑细胞及其相互作用。病毒载体转导能够在同一组织内以不同的荧光颜色标记不同的细胞类型。细胞可以通过活动或投射进行遗传识别。使用改进的CLARITY方案,星形胶质细胞和神经元的潜在样本量增加了2-3个数量级。CLARITY的使用允许对完整的星形胶质细胞进行成像,这些星形胶质细胞太大而无法将其全部放入切片中,并检查体细胞及其所有过程。此外,它还提供了研究星形胶质细胞与不同神经元细胞类型之间的空间相互作用的机会,即每个星形细胞域中锥体神经元的数量或星形胶质细胞与特定抑制神经元群体之间的接近程度。本文详细介绍了如何应用这些方法。
引言
近年来,星形胶质细胞功能以及它们如何与神经元回路相互作用的知识急剧增加。星形胶质细胞可以影响可塑性1,2,帮助神经元损伤后恢复3,4,甚至诱导 从头 神经元增强,最近的研究表明星形胶质细胞在记忆获取和奖励中的重要性,以前被认为是纯粹的神经元功能5,6,7.星形胶质细胞研究中特别感兴趣的一个特征是细胞的空间排列,其在海马体和其他大脑结构中保持独特的空间组织8,9,10。与在细胞体瘤之间交织的神经元树突不同,海马星形胶质细胞栖息在视觉上可区分的区域,其过程之间略有重叠,形成不同的结构域8,11,12,13。支持星形胶质细胞参与神经元回路的证据并不支持缺乏对这些群体及其结构域中的神经元的详细解剖学描述14。
病毒载体转导程序以及转基因动物(TG)已被推广为研究大脑结构,功能和细胞相互作用的工具集15,16。利用不同的启动子允许根据其遗传特性,激活水平17,18或投射靶标靶向特定细胞。不同的病毒可以在不同的人群中表达不同颜色的荧光基团。病毒可以与TG中荧光团的内源性表达相结合,或者TG动物可以在不需要病毒的情况下使用。这些技术被广泛用于神经元标记,一些实验室已经开始使用它们,并专门用于靶向其他细胞类型(如星形胶质细胞5,9,19)进行修改。
CLARITY技术于2013年20,21年首次描述,通过使整个大脑透明,同时保持微观结构完整,能够研究厚厚的脑切片。通过结合两种方法 - 病毒载体转导和组织清除 - 现在可以选择检查不同细胞类型群体之间的空间相互作用。大多数星形胶质细胞 - 神经元相互作用研究是在薄脑切片上进行的,由于其大结构域导致不完全星形胶质细胞的图像,从而从根本上限制了分析细胞的数量。使用CLARITY技术可以同时对大规模体积的细胞群进行单细胞分辨率表征。对清晰大脑中荧光标记的细胞群进行成像并不能提供突触分辨率,但可以彻底表征星形胶质细胞与各种神经元细胞类型之间的空间相互作用。
出于这个原因,我们利用这些最先进的技术来研究整个背侧CA1星形胶质细胞的特性,对所有层层(层状镭骨,锥体层和地层Oriens)进行成像。我们测量了数以万计的星形胶质细胞(病毒外显率为>96%5),从而分析了CA1周围整个星形细胞群体的信息。通过神经元标志物的有效外显率,我们可以记录整个CA1星形胶质细胞群与四种类型的神经元细胞之间的相互作用 - 小白蛋白(PV),生长抑素(SST),VIP抑制神经元和兴奋性锥体细胞9。
使用来自TG动物的荧光和不同颜色的病毒载体(所有抑制性细胞)的组合进行了几次实验,而其他(兴奋性)利用两种病毒载体在不同启动子下表达不同的荧光团9。本文提出了一个详细的方案,包括标记大脑中所需细胞,使用修改后的CLARITY程序使大脑透明,以及使用各种程序和软件成像和分析完整的大脑结构。
研究方案
实验方案由希伯来大学动物护理和使用委员会批准,并符合国家卫生研究所实验室动物护理和使用指南的指导方针。
1. 病毒载体转导
注意:病毒载体转导用于表达大脑中的荧光团。
- 使用图集(例如,Allen Brain Atlas)来定位目标区域的相关协调。
注意:3D地图集可以在线找到(例如,http://connectivity.brain-map.org/3d-viewer)。 - 使用立体定向手术,将病毒载体注射到相关的大脑结构中。有关详细协议,请参见9 。
- 等待3-6周以进行荧光基团表达。
注意:如果只需要标记细胞体,则短时间就足够了。如果轴突投影与该问题相关,则需要很长一段时间,因为荧光团以轴突表达需要更长的时间,轴突可能长达几毫米。 - 事先验证荧光团表达(病毒表达和TG动物)的特异性和外显率(图1A)。在进行CLARITY程序之前,为薄片指定至少一个大脑,并确保荧光团表达既强又特定于靶细胞特征。
2. 清晰度
注意:这种方法在2-6周内使大脑透明。
- 使用冷磷酸盐缓冲盐水(PBS)对动物进行经颅灌注,然后在PBS中使用4%多聚甲醛(PFA)。取出大脑并将其保存在PFA中,在4°C的50mL管或类似容器中过夜。
注意:在进行经颅灌注之前,必须对动物进行深度麻醉。在该协议中提出的例子中,所有动物都使用氯胺酮和赛拉嗪(分别为90%和10%)麻醉。 - 用水凝胶溶液(HS;见 表1)在4°C下更换PFA 48小时。
注意:在此阶段,不要让材料变热于制冷温度(4-8°C),否则水凝胶会聚合。该协议中使用的HS含有2%丙烯酰胺,与以前的协议建议4%22 或1%17不同。2%的好处在讨论部分有详细说明。准备HS时,在冰冷的表面上工作。将其储存在-20°C。 - 脱气
注意:该阶段的目的是从组织中除去所有游离氧,因为O2 会干扰聚合过程。可以使用任何非O2 气体(例如,N2,CO2);建议使用 N2 。- 通过5 mm(内部)柔性管将N2从罐中转移出来,该软管在其末端连接到19 G针(图1B)。
- 在管的盖子上做两个小孔(针宽):一个用于引入气体,另一个用于允许空气离开管(图1C)。
- 将管道从N2 气体连接到管上,并在室温(RT)下更换气体约30分钟。
- 取下管道,并立即在每个管上用建模粘土密封孔(图1D)。
- 将脱气密封管转移到37°C浴中3.5小时以聚合HS,其将成为凝胶。注意不要摇晃管子(图1E)。
- 从管中取出大脑,并使用实验室湿巾轻轻地从周围取出聚合的凝胶。确保没有残留的凝胶附着在组织表面,因为它可能在以下步骤中与溶液反应,抑制组织清除过程(图1F)。
注意:由于凝胶含有PFA,因此提取应在通风橱下进行。 - 如果手头的问题只需要大脑的一部分,就把大脑切成薄片。将其分成两半或分成包含所有感兴趣区域的非常厚的切片(图1G)。
- 将切片置于第一个清除溶液(CS1,见 表2)中的新容器中,并在37°C下以70rpm摇动24小时。
- 按照下面描述的步骤将大脑从CS1转移到第二个清除溶液(CS2,见 表2)。
- 提前为大脑准备穿孔管(图1H)。
- 在足够大的烧杯中将CS2预热至40-45°C以容纳管子。在带有搅拌器的电炉上执行此操作。确保温度不超过55°C,以防止表达的蛋白质漂白。
- 将装有CS2的烧杯和穿孔管放在搅拌装置上( 图1I中的2L烧杯)。设置适度的搅拌速率,使液体流动而不会扭曲组织。
注意:在2-6周内,组织将变得透明(该过程从外围开始并向内移动到中央大脑结构)。关于组织何时"足够清晰"的决定取决于个人判断。大脑应足够透明,以便在显微镜下无干扰地成像(图1J 不够清晰; 图 1K 足够清晰)。超过组织足够清晰的点可能会导致组织僵硬的丧失。
- 从CS2转移到PBST(PBS中0.5%Triton X-100,见 表2)中,在37°C下以轻度振荡(70rpm)24小时。
注意:在PBST中,组织将变白(图1L)。嵌入折射率匹配解决方案(RIMS,请参阅步骤 2.14)中时,清晰度将恢复(并得到改善)。 - 将 PBST 替换为新的 PBST。在相同条件下(37°C温和摇晃)再保持24小时。
- 再次用新的 PBST 替换 PBST,并保持室温 24 小时。
- 在室温下转移到PBS 24小时。
- 更换PBS并在室温下再放置24小时。
- 从PBS中取出大脑,并在37°C下将其转移到RIMS过夜。
注意:最初,RIMS中的涟漪可能会包围大脑。该协议是使用两个特定的商用 RIMS 设计和验证的(参见 表 3)。但是,使用其他 RIMS(商用或自制)时,协议不应有所不同。 - 将组织在室温下保持24小时或直到溶液达到完全平衡,即当组织变得透明并且溶液不再包含任何可见的波纹时(图1M)。
- 如果组织是透明的,则继续进行腔室制备。如果此时组织变为白色而不是透明(由于残留的SDS分子聚集),则通过重复步骤2.9和2.10再次清洁样品,并将组织转移到CS2(步骤2.8)几天,然后进行所有步骤直到步骤2.15。
3. 腔室准备
注意:每个样品都需要一个带有成像室的载玻片,样品将被放置在其中。
- 将样品放在载玻片的中间。
- 使用热胶枪,在载玻片的边缘创建壁,几乎与组织一样高。确保在其中一个角处留出一个小间隙(约5毫米)(图2A,B)。
- 在样品上滴1-2滴RIMS,以保持上表面湿润,并防止盖玻片和组织之间形成气泡。
- 在应用RIMS滴剂后,立即将最后一层热胶水添加到壁上(使它们达到大脑/切片的高度),并立即进入步骤3.5(当热胶仍然是液体时)。
- 用盖玻片密封顶部,将其尽可能均匀地放在仍然温暖的热胶层的顶部(图2C)。
- 用RIMS通过热胶壁中留下的间隙填充腔室(图2D,E)。
- 用热胶合上缝合缝隙。不要在室内留空气(图2F)。
- 如果热胶壁延伸到幻灯片的边界之外,请切割延伸边缘(图2G)。
- 如果浸没用于成像的物镜,则在盖玻片上方的壁上再添加2-3mm胶水,以使浸入溶液持续更长时间(图2H)。
4. 成像(共聚焦或双光子)
- 检查载物台是否能容纳腔室,因为腔室的厚度可以达到几毫米。
注:例如,本方案中使用的共聚焦显微镜(参见 材料表)配备了几个阶段(例如,圆形,矩形)。无论选择哪个阶段来容纳腔室,只要其参数适合腔室尺寸,都是无关紧要的。 - 使用具有足够工作距离的物镜,即最小工作距离≥3 mm,因为感兴趣的大脑区域可能只有几毫米深,并且盖玻片可能不是完全笔直的,因为它是手动放置的。
注意:作为演示, 图1, 视频1和 视频2 中提供的结果是在双光子显微镜下获得的,使用水浸式16x物镜,工作距离为3 mm,放大倍率为2.4,以获得652 x 483μm的视场和平面之间间隔为0.937μm的z轴堆栈。 - 执行多区域成像,这可能需要几个小时甚至几天。确保计算机中有足够的可用存储空间,因为每个图像的大小可以达到数十千兆位。
注意:清晰度成像可能会导致图像深度明显增加。因此,用于捕获表达式的强度应相对较低,以防止在图像求和过程中过度表达。 - 对于浸入式物镜,在成像时定期检查液体,并在需要时补充额外的液体。
注意:在 对视频3中提供的数据进行成像期间,每6-8小时向腔室表面加水以对抗蒸发。 - 获取图像后,使用几个不同的软件包对其进行查看和分析。
注意:推荐的软件包括用于可视化和分析的 Imaris 和 SyGlass。使用Imaris软件优化星形胶质细胞重建的精确管道在前面已经描述过9。简而言之,本研究中使用的Imaris特征是用于完全重建细胞结构的细丝和用于提取所有体细胞空间中位置的斑点。
结果
成功清除厚脑组织切片会导致一系列新的问题,这些问题可以询问有关大细胞群的特性,而不是单个细胞或相邻细胞群的特性。为了获得成功的结果,应该严格遵守CLARITY协议,因为需要考虑广泛的参数来减少样品之间的差异(例如,透明度百分比,荧光信息,肿胀度参数)。
图1 描述了从荧光蛋白表达验证到清除方法所有阶段的整个清除过程。 图2 描述了如何为澄清的组织准备一个腔室,最适合在双光子或共聚焦显微镜下成像。与其他腔室制备方案相比,该协议中所需的材料非常便宜。
图3 显示了 视频1中描述的立方体,其中超过300个星形胶质细胞显示在小鼠海马体CA1部分的清除部分。 图4 显示了 视频2中描述的立方体,其中星形胶质细胞和兴奋性神经元体都显示在厚透明的组织中。 图5 显示了整个半球,如 视频3中所述。从背侧CA1(绿色,GFP)和腹侧CA1(红色,TdTomato)显示全脑神经元投射。
视频1 展示了在CLARITY手术后用双光子显微镜获得的海马星形胶质细胞(>300)的厚图像。荧光由星形胶质细胞特异性病毒载体转导提供。 视频2 展示了星形胶质细胞与海马锥体细胞核之间的空间接近。 视频3 在整个半球上跟踪轴突束;轴突从初级运动皮层投射出来,并从脊髓追溯。另一束从背侧海马体追踪到上颌骨。最后,它追踪了一束红色的轴突,从Mammillary身体到它们在腹侧海马体的起源。所有标记的细胞都是纯兴奋性的。

图1:清除过程的详细说明。(A)荧光基团表达的验证。在这个例子中,小鼠海马体CA1部分的所有星形胶质细胞表达红色蛋白质(TdTomato,以洋红色成像),并且所有兴奋性神经元在其细胞核中表达绿色蛋白质(H2B-GFP)。该图像是使用2光子显微镜获得的。使用放大倍率为2.4的水浸式物镜(0.8 NA)拍摄图像,以获得652 x 483 μm的视场,速度为15.5帧/秒,平面之间的z轴堆叠间隔为0.937 μm。通过免疫组织化学9验证了特异性和外显率。(B)将N2气体从罐中转移到容纳大脑的管中需要一根末端带有针头的管道。(C)通过创建两个孔来用N2替换管内的空气,一个(上箭头)用于通过连接到从储气罐管道的针头流入N2,另一个(底部箭头)用于流出。(D)脱气后立即用造型粘土覆盖孔,防止N2离开管子。(E)在温浴中加热脱气溶液3.5小时。(F)成功的聚合导致大脑嵌入凝胶状HS中。气泡可能被困在聚合物中。(G)从凝胶中提取后立即将大脑切成所需厚度的最佳点。(H)穿孔管允许溶液在搅拌器上的流动到达样品。(I)穿孔管内的大脑由一个自制的支架垂直固定,其尺寸适合2 L烧杯,站在电炉搅拌器上。(J)大脑不够清晰的例子。样品应在CS2中再搅拌约一周。(K)足够清晰的大脑的例子。(L)将透明大脑插入PBST时,组织变得比以前更白。这种颜色的变化是由于Triton引起的,当从此溶液移动到下一个溶液时将消失。(M)在RIMS中>24小时后,大脑将再次变得完全透明。缩写:GFP =绿色荧光蛋白;NA = 数值孔径;HS = 水凝胶溶液;CS2 = 清算解决方案 2;PBST =含有0.5%曲拉通X-100的磷酸盐缓冲盐水;RIMS = 折射率匹配解决方案。请点击此处查看此图的大图。

图2:腔室准备。 (A)第一层热胶壁覆盖了幻灯片的边缘,并留下了足够宽的空间,可以在不接触壁的情况下容纳大脑。幻灯片的左上角剩下一个孔。(B)加入一层又一层,达到组织的高度。(C)直盖玻片(白色箭头)密封腔室。(D) 腔室通过腔壁上的孔填充 RIMS。(E)腔室充满RIMS,不留气泡。(F)用热胶密封腔室中的孔,防止任何泄漏。侧视图。(G)在此阶段,任何延伸到载玻片边缘的热胶残留物都应从腔室中切断。(H)充分准备的腔室,准备在显微镜下成像。缩写:RIMS = 折射率匹配溶液。 请点击此处查看此图的大图。
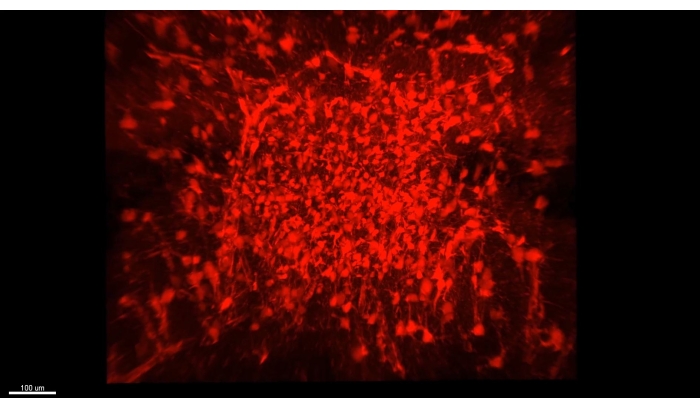
图3:清除的海马体中所有成像的星形胶质细胞(AAV1-GFAP::TdTomato,红色)。 视频1中的单个帧捕获清除的海马体中所有成像的星形胶质细胞(AAV1-GFAP::TdTomato,红色)。图像属性的所有详细信息都在视频 1 中进行了介绍。请点击此处查看此图的大图。
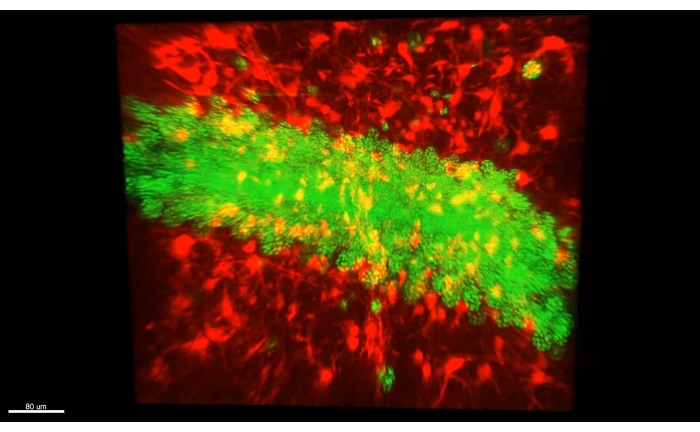
图4:厚透明组织中的星形胶质细胞(AAV1-GFAP::TdTomato,红色)和海马锥体细胞核(AAV5-CaMKII::H2B-eGFP,绿色)。视频2中的单个帧显示了厚透明组织中的星形胶质细胞(AAV1-GFAP::TdTomato,红色)和海马锥体细胞核(AAV5-CaMKII::H2B-eGFP,绿色)。请点击此处查看此图的大图。
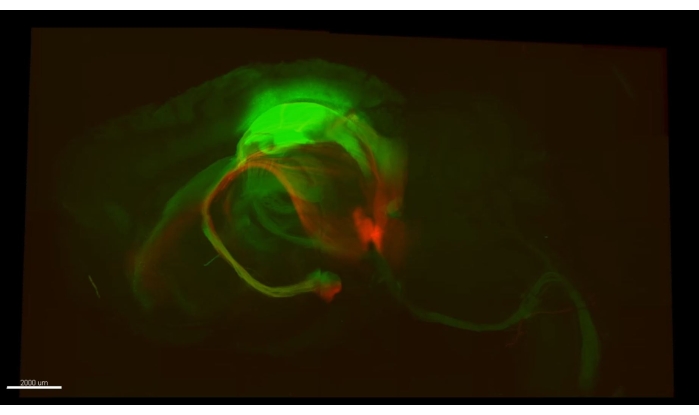
图5:绿色轴突(AAV5-CaMKII::eGFP,绿色)和红色轴突(AAV5-CaMKII::TdTomato)。视频3中的单个帧显示了两种类型的轴突,这些轴突来自小鼠大脑中的多个位置,可以在整个半球中进行追踪。请点击此处查看此图的大图。
视频 1:>1 毫米厚的海马背 CA1 星形胶质细胞切片(AAV1-GFAP::TdTomato,红色)的镜头。 该视频是使用16倍物镜(0.8 NA)的双光子显微镜获得的,放大倍率为2.4,经过CLARITY程序。与 图1A类似,z-堆栈间隔设置为0.937 μm。荧光由星形胶质细胞特异性病毒载体转导提供。该立方体中的星形胶质细胞数量为>300,大多数过程可用于大多数细胞的分析。缩写:NA = 数值孔径;AAV = 腺相关病毒;GFAP = 神经胶质原纤维酸性蛋白。 请点击此处下载此视频。
视频 2:3D 立方体中的星形胶质细胞和兴奋性神经元核。 该立方体包含 图1A 和视频1中提到的光学条件下dCA1的所有层 。该立方体显示了星形胶质细胞(AAV1-GFAP::TdTomato,红色)和海马锥体细胞核(AAV5-CaMKII::H2B-eGFP,绿色)之间的空间接近。缩写:AAV =腺相关病毒;GFAP = 神经胶质原纤维酸性蛋白;CAMKII = 钙/钙调蛋白依赖性蛋白激酶 II;eGFP = 增强的绿色荧光蛋白;H2B = 组蛋白 2B. 请点击此处下载此视频。
视频 3:追踪整个半球的轴突束。 在脊髓末端的绿色轴突(AAV5-CaMKII::eGFP,绿色)很容易追溯到初级运动皮层(相距超过7毫米)。从海马体(背侧),另一束可追溯到Mammillary上体(大脑的最腹侧),几乎3毫米长。视频的后半部分追踪了一束红色的轴突(AAV5-CaMKII::tdTomato),这些轴突起源于腹侧海马体,从它们在Mammillary体的目标位置返回。该图像是在奥林巴斯扫描激光共聚焦显微镜FV1000下使用4倍物镜(0.16 NA)拍摄的,并使用MATL FluoView特征组合多个ROI以显示整个半球。缩写:AAV =腺相关病毒;CAMKII = 钙/钙调蛋白依赖性蛋白激酶 II;eGFP = 增强的绿色荧光蛋白;NA = 数值孔径;MATL = 多区域延时摄影。 请点击此处下载此视频。
| 水凝胶溶液(1升) | |
| 材料 | 量 |
| VA-044 启动器 | 2.5克 |
| PFA 4% | 900 毫升 |
| 丙烯酰胺(40%) | 50 毫升 |
| 双丙烯酰胺(2%) | 50 毫升 |
表1:水凝胶溶液的制备(1L)。 水凝胶溶液必须在冰冷的表面上制备。成分混合的顺序并不重要。请注意,丙烯酰胺的总百分比为2%,这与使用1%17 或4%22的类似方案不同。
| 清算解决方案 (1 L) | ||
| 材料 | 量 | |
| CS1 | CS2 | |
| 硼酸(分子量 = 61.83 克/摩尔) | 12.366克 | 3.4克 |
| 安全数据表 | 80 克 | 80 克 |
| 三聚氰碱(M.W. = 121.14 克/摩尔) | 0 | 12.1克 |
| 蒸馏水 | 填充至 1 L | 填充至 1 L |
| 氢氧化钠 | 酸碱度 8.5 | |
| 1升磷酸盐缓冲盐水,含0.5%海卫一X-100 | ||
| 材料 | 量 | |
| 美国公共广播公司 | 995 毫升 | |
| 曲拉通X-100 | 5 毫升 | |
表2:用0.5%Triton X-100制备澄清溶液1和2(1L)和1L磷酸盐缓冲盐水。 清除溶液可以提前准备,并长期保持在室温下。任何含有硼酸和SDS的溶液都应在通风橱下处理,以避免吸入或皮肤接触SDS或硼酸。CS1中的NaOH应最后添加,以将pH值设置为8.5。每个脑部样本应置于至少 5-25 mL CS1 中,并保持过夜以充分扩散。缩写:CS1 = 清除解决方案 1;SDS = 十二烷基硫酸钠;M.W. = 分子量。
| 产品名称 | 主要优势 | 主要缺点 |
| RapiClear | 样品保持透明 | 组织肿胀 |
| RapiClear CS | 样品收缩回正常大小 | 样品可能会失去透明度 |
表 3:具有优缺点的 RIMS 选项。 Rapiclear (RC, RI = 1.47) 或 CLARITY 特异性 Rapiclear (CSRC, RI = 1.45)。这两种解决方案之间的主要区别在于,虽然中国证监会将清晰的大脑缩小到其原始大小,但RC解决方案却没有,从而使清除的样本略微肿胀。缩写:RI = 折射率。
讨论
组织清除方法是大脑研究中的革命性工具,引发了以前无法提出的问题。通过靶向一小群细胞,单个细胞甚至单个突触的特性,CLARITY现在可以通过使用相关的荧光团来靶向总细胞群或远距离连接特征。
荧光基团表达和CLARITY程序组合的结果不是二元的;许多因素可能会干扰导致次优结果的程序。首先,荧光基团的表达必须事先验证。由于CLARITY程序会导致一些信息丢失,因此在CLARITY过程结束时,足够的荧光团蛋白表达对于图像的有效性至关重要。其次,必须小心处理经颅灌注,确保所有血液都流出大脑,因为血液的自发荧光会导致厚片中数据不可靠。第三,方案中讨论的所有参数必须在清除过程的每个步骤中精确地处理,例如,聚合前HS中的O2 残基或每个阶段的温度不精确将阻止活性材料之间发生化学反应。
先前的方案17,22 推荐在HS中使用不同浓度的丙烯酰胺。丙烯酰胺的主要目的是用胺残基(蛋白质和核酸)更好地固定分子。浓度的轻微变化会极大地影响整个清除过程:如果固定太紧凑,脂质分子不会与组织断开,清除过程将不必要地延长或导致大脑不透明。然而,一旦没有脂质,较低浓度的丙烯酰胺将无法充分维持大脑结构。在该协议中,丙烯酰胺百分比被设置为提供固定但透明的组织的微妙平衡。
大部分清除过程发生在CS2中,应每天测试组织清晰度水平。PBST净化是清除溶液和折射率匹配溶液之间的重要步骤,因为它可以清除残留的SDS分子,这些分子可能与RIMS相互作用。如果尚不需要腔室制备,也可以无限期地将透明组织保持在PBST(0.5%)中。
当将大脑置于RIMS中时,人们应该熟悉解决方案的好处和局限性。例如,RapiClear即使在几乎清除的组织中也会引起完全透明,但也会引起一些肿胀,这在分析数据时不应忽视。先前的测量结果 9 表明沿所有轴(即背侧、前后轴和外侧内侧轴)的扩张相等,因此可以通过与来自同一大脑区域的薄片进行比较来计算肿胀指数。使用CLARITY特定的RapiClear消除肿胀;然而,如果任何SDS残留物留在组织中,它们将聚集成不透明的团块。
这种修改后的协议的另一个好处是它的成本。以前的协议建议使用不同的胶水类型来创建一个可以将大脑保持在RIMS中的腔室。在这个协议中,我们简单地使用热胶。它与解决方案没有反应,可以在任何地方购买,易于使用,并且比以前建议的胶水便宜得多。
从厚脑样本的成像中获得的数据可以描述整个细胞群,大脑结构之间的连接性,或远距离跟踪单个轴突(视频3)。尽管以前已经提出过有关这些特征的问题,但现在使用厚脑切片可以实现的数据的有效性大大改善了先前容易出错的薄切片图像叠加方法。
CLARITY过程可以成功均匀地清除厚切片 - 从几毫米到全脑成像。被动清除(即不使用ETC)降低了对组织造成伤害的风险,以及将样品浸入清除溶液中的时间,因此不会影响蛋白质保存的高效率。
披露声明
作者没有利益冲突需要披露。
致谢
该项目已获得欧洲研究理事会(ERC)根据欧盟地平线2020研究和创新计划(赠款协议No 803589),以色列科学基金会(ISF赠款No.1815/18)和加拿大 - 以色列赠款(CIHR-ISF,第2591/18号赠款)的资助。我们感谢Nechama Novick对整个手稿的评论。
材料
| Name | Company | Catalog Number | Comments |
| AAV1-GFAP::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect astrocytes | |
| AAV5-CaMKII::eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| AAV5-CaMKII::H2B-eGFP | ELSC Vector Core Facility (EVCF) | viral vector used to detect neuronal nuclei | |
| AAV5-CaMKII::TdTomato | ELSC Vector Core Facility (EVCF) | viral vector used to detect neurons | |
| Acrylamide (40%) | Bio-rad | #161-0140 | |
| Bisacrylamide (2%) | Bio-rad | #161-0142 | |
| Boric acid | Sigma | #B7901 | Molecular weight - 61.83 g/mol |
| Confocal microscope, scanning, FV1000 | Olympus | 4x objective (UPlanSApo, 0.16 NA) | |
| Imaris software | Bitplane, UK | A software that allows 3D analysis of images | |
| NaOH | Sigma | #S5881 | |
| PBS | |||
| PFA 4% | EMS | #15710 | |
| RapiClear | SunJin lab | #RC147002 | |
| RapiClear CS | SunJin lab | #RCCS002 | |
| SDS | Sigma | #L3771 | |
| SyGlass software | A software that allows 3D analysis of images using virtual reality | ||
| Tris base 1 M | Bio-rad | #002009239100 | Molecular weight - 121.14 g/mol |
| Triton X-100 | ChemCruz | #sc-29112A | |
| Two photon microscope | Neurolabware | Ti:sapphire laser (Chameleon Discovery TPC, Coherent), GaAsP photo-multiplier tubes (Hamamatsu, H10770-40) , bandpass filter (Semrock), water immersion 16x objective (Nikon, 0.8 NA) | |
| VA-044 Initiator | Wako | #011-19365 |
参考文献
- Perea, G., Navarrete, M., Araque, A. Tripartite synapses: astrocytes process and control synaptic information. Trends in Neurosciences. 32 (8), 421-431 (2009).
- Ciappelloni, S., et al. Aquaporin-4 surface trafficking regulates astrocytic process motility and synaptic activity in health and autoimmune disease. Cell Reports. 27 (13), 3860-3872 (2019).
- Sylvain, N. J., et al. The effects of trifluoperazine on brain edema, aquaporin-4 expression and metabolic markers during the acute phase of stroke using photothrombotic mouse model. Biochimica et Biophysica Acta. Biomembranes. 1863 (5), 183573(2021).
- Kitchen, P., et al. Targeting aquaporin-4 subcellular localization to treat central nervous system edema. Cell. 181 (4), 784-799 (2020).
- Adamsky, A., et al. Astrocytic activation generates de novo neuronal potentiation and memory enhancement. Cell. 174 (1), 59-71 (2018).
- Adamsky, A., Goshen, I. Astrocytes in memory function: pioneering findings and future directions. Neuroscience. 370, 14-26 (2018).
- Nagai, J., et al. Behaviorally consequential astrocytic regulation of neural circuits. Neuron. 109 (4), 576-596 (2021).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884(2019).
- Refaeli, R., et al. Features of hippocampal astrocytic domains and their spatial relation to excitatory and inhibitory neurons. Glia. 69 (10), 2378-2390 (2021).
- Eilam, R., Aharoni, R., Arnon, R., Malach, R. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human. eLife. 5, 15915(2016).
- Bushong, E. A., Marton, M. E., Ellisman, M. H. Maturation of astrocyte morphology and the establishment of astrocyte domains during postnatal hippocampal development. International Journal of Developmental Neuroscience. 22 (2), 73-86 (2004).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. Journal of Comparative Neurology. 462 (2), 241-251 (2003).
- Bushong, E. A., Martone, M. E., Jones, Y. Z., Ellisman, M. H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. The Journal of Neuroscience. 22 (1), 183-192 (2002).
- Chai, H., et al. Neural circuit-specialized astrocytes: transcriptomic, proteomic, morphological, and functional evidence. Neuron. 95 (3), 531-549 (2017).
- Taniguchi, H., et al. A resource of Cre driver lines for genetic targeting of GABAergic neurons in cerebral cortex. Neuron. 71 (6), 995-1013 (2011).
- Hippenmeyer, S., et al. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biology. 3 (5), 159(2005).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- DeNardo, L. A., et al. Temporal evolution of cortical ensembles promoting remote memory retrieval. Nature Neuroscience. 22 (3), 460-469 (2019).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Ye, L., et al. Wiring and molecular features of prefrontal ensembles representing distinct experiences. Cell. 165 (7), 1776-1788 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nature Methods. 10 (6), 508-513 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。