Method Article
Измерение свойств мембранного периодического скелета начального сегмента аксона с помощью 3D-структурированной микроскопии освещения (3D-SIM)
В этой статье
Резюме
Настоящий протокол описывает способ визуализации и измерения актиновых колец и других компонентов мембранного периодического скелета исходного сегмента аксона с использованием культивируемых нейронов гиппокампа крыс и 3D-структурированной микроскопии освещения (3D-SIM).
Аннотация
Начальный сегмент аксона (AIS) является местом, на котором инициируются потенциалы действия, и представляет собой транспортный фильтр и диффузионный барьер, которые способствуют поддержанию полярности нейронов путем сортировки сомато-дендритного груза. Мембранный периодический скелет (MPS), содержащий периодические актиновые кольца, обеспечивает каркас для закрепления различных белков AIS, включая структурные белки и различные ионные каналы. Хотя недавние протеомные подходы выявили значительное число новых компонентов АИС, детали структуры MPS и роли его отдельных компонентов отсутствуют. Расстояние между отдельными актиновыми кольцами в MPS (~ 190 нм) требует использования методов микроскопии сверхвысокого разрешения для разрешения структурных деталей MPS. Этот протокол описывает метод использования культивируемых нейронов гиппокампа крыс для изучения точной локализации белка AIS в MPS относительно субмембранозных актиновых колец с использованием 3D-структурированной микроскопии освещения (3D-SIM). Кроме того, описан аналитический подход к количественной оценке периодичности отдельных компонентов и их положения относительно актиновых колец.
Введение
Начальный сегмент аксона (АИС) представляет собой короткую, уникально специализированную область проксимального аксона нейронов позвоночных1. АИС содержит транспортный фильтр и диффузионный барьер, необходимые для поддержания полярности нейронов путем сортировки сомато-дендритного груза2,3,4,5,6,7. Кроме того, уникальная структура АИС позволяет размещать кластеры ионных каналов с напряжением, которые облегчают его функцию в качестве места инициации потенциала действия8. Высокостабильный структурный комплекс лежит в основе уникальных функций АИС. Исследования в течение последнего десятилетия выявили наличие мембранного периодического скелета (MPS), содержащего актиновые кольца, соединенные спектрином и обеспечивающие каркас для закрепления различных белков AIS9,10.
Расстояние между актиновыми кольцами в MPS (~190 нм)9,10 находится под пределом разрешения обычной световой микроскопии. Ранние попытки использовать электронную микроскопию для визуализации MPS не увенчались успехом, поскольку жесткие процедуры подготовки не смогли сохранить структуру MPS. Таким образом, методы микроскопии со сверхвысоким разрешением оказались бесценными в выяснении некоторых структурных деталей MPS11. Однако понимание структурного комплекса АИС, идентичности и функций его компонентов, его пространственно-временной регуляции до сих пор является неполным. Недавние протеомные исследования преуспели в создании значительного списка белков, которые локализуются в АИС вблизи структурных компонентов AIS12,13. Тем не менее, детали их функции и точное место в комплексе АИС отсутствуют. Таким образом, методы микроскопии со сверхвысоким разрешением служат важным инструментом для изучения точных положений этих белков относительно других компонентов MPS и исследования их функций. Несколько методов световой микроскопии могут достигать разрешений выше, чем дифракционный предел света, некоторые даже способны локализовать отдельные молекулы. Однако многие из этих методов обычно требуют специализированных флуорофоров или буферов визуализации, а получение изображений часто занимает много времени14.
3D-структурированная микроскопия освещения (3D-SIM), благодаря простоте использования и простым требованиям к пробоподготовке, не требует специальных реагентов для визуализации или подготовки образцов, хорошо работает с широким спектром флуорофоров и образцов, может быть легко реализована в нескольких цветах и способна к визуализации живых клеток15. Хотя наилучшее возможное разрешение SIM-карты (~ 120 нм) является низким по сравнению со многими другими методами сверхразрешения, его достаточно для многих приложений (например, для разрешения компонентов MPS в нейронах). Таким образом, крайне важно учитывать требования к конкретным приложениям, чтобы определить, является ли SIM-карта подходящим выбором или необходимо еще более высокое разрешение. Здесь описан протокол использования культивируемых нейронов гиппокампа и 3D-структурированной микроскопии освещения (3D-SIM) для изучения положения и организации предполагаемых белков АИС относительно актиновых колец в MPS, как реализовано в Abouelezz et al.16
протокол
Первичные нейроны гиппокампа, используемые в этих экспериментах, были собраны16 из эмбриональных эмбрионов крыс Wistar 17 любого пола в соответствии с этическими руководящими принципами Хельсинкского университета и финским законодательством.
1. Пробоподготовка
- На высококачественных стеклянных покровах позволяют нейронам гиппокампа крыс расти в условиях разреженной культуры (~ 5000-10000 клеток / см2) в течение 14 дней (14 дней in vitro).
ПРИМЕЧАНИЕ: Использование разреженных культур снижает вероятность перекрытия нейритов, что помогает количественно оценить MPS. - Фиксируйте нейроны с помощью 4% параформальдегида в течение 12 мин при комнатной температуре. Промойте крышку один раз в 0,2% BSA в PBS (BSA-PBS), затем инкубируйте в течение 10 мин в 1% растворе Triton-X в PBS при комнатной температуре. Мойте один раз в BSA-PBS.
- Разбавляют анти-анкириновые G антитела (1:200) в BSA-PBS. Добавьте раствор антител к крышке и инкубируйте в течение ночи при 4 °C. Необязательно добавляют куриные антитела против MAP2 (см. Таблицу материалов) в раствор антител для демаркации сомато-дендритного домена.
- Промывайте ячейки один раз в BSA-PBS, затем 0,1% Triton-X в PBS, затем сделайте окончательную промывку в BSA-PBS.
- Развести флуорофорные вторичные антимышечные антитела (1:200) (см. Таблицу материалов) в BSA-PBS, добавить в крышку и инкубировать в течение 1 ч при комнатной температуре. Промывайте клетки один раз в BSA-PBS, один раз в 0,1% Triton-X в PBS, затем один раз в PBS.
- Подготовьте 1 мкМ раствор меченого фаллоидина в PBS (см. Таблицу материалов) и добавьте его в клетки. Инкубировать в течение 2 ч при комнатной температуре. Промывайте клетки один раз в PBS, один раз в 0,1% Triton-X в PBS, затем один раз в PBS.
ПРИМЕЧАНИЕ: Здесь использовался фаллоидин с тегами AlexaFluor488, но другие теги также будут работать. - Для крепления крышки на стеклянную горку нанесите каплю монтажного материала на стеклянную горку, окуните крышку в деионизированную воду и смажьте мягким бумажным полотенцем (для удаления лишней воды).
- Поместите крышку на стеклянную горку. Инкубировать при комнатной температуре в течение 24 ч.
ПРИМЕЧАНИЕ: Никаких побочных эффектов на образец не наблюдалось при использовании жестко устанавливаемых монтажных сред (показатель преломления 1,47 после отверждения).
- Поместите крышку на стеклянную горку. Инкубировать при комнатной температуре в течение 24 ч.
2. Визуализация
- Если возможно, проконсультируйтесь с персоналом микроскопического центра перед визуализацией. Используйте калькулятор погружного масла (см. Таблицу материалов), чтобы выбрать иммерсионное масло, подходящее для образца.
- Как только образцы будут готовы, убедитесь, что крышки чисты и очищены от остатков или избыточных монтажных материалов. При необходимости используйте хлопчатобумажный наконечник, смоченный в воде или этаноле для очистки. Поместите образец в микроскоп с поддержкой 3D SIM-карты (см. Таблицу материалов) и найдите ячейку для изображения.
- Отрегулируйте мощность соответствующих лазерных линий и время экспозиции, чтобы максимизировать отношение сигнал/шум без значительного отбеливания образца.
ПРИМЕЧАНИЕ: Хорошее отношение сигнал/шум покажет четкий сетчатый вид, ориентированный на образец, и приведет к точным реконструкциям с высоким разрешением. Лазерные линии 488 нм и 640 нм использовались для визуализации F-актина и анкирина G соответственно. - Установите верхний и нижний пределы образца в z-измерении и приступайте к получению стека.
ПРИМЕЧАНИЕ: здесь использовался z-шаговый размер 125 нм. - Для успешной реконструкции SIM-карты убедитесь, что программное обеспечение для микроскопии (см. Таблицу материалов) имеет файл оптической передачи (OTF), подходящий для используемых красителей.
ПРИМЕЧАНИЕ: Они, как правило, создаются и поддерживаются специализированным персоналом. В отсутствие функционального OTF также доступны инструменты с открытым исходным кодом для выполнения реконструкций на основе оценок17. В этой работе использовались современные файлы OTF, контролируемые специализированным персоналом. - Запустите алгоритм реконструкции в стеке, чтобы получить реконструкцию со сверхразрешением. Проверьте реконструкции на наличие известных артефактов и при необходимости настройте параметры для их исправления.
ПРИМЕЧАНИЕ: Параметры алгоритма по умолчанию обычно дают точные результаты. Многие из этих артефактов включают в себя некоторые повторяющиеся узоры: полосатые линии вместе с несколькими направлениями на одной z-плоскости, «двоение» (повторяющиеся черты, появляющиеся в различных z-плоскостях) или шестиугольный «сотовый» узор, возникающий в некоторых областях. Эти артефакты часто могут быть исправлены с помощью лучшей пробоподготовки, лучшего отношения сигнал/шум, регулировки параметров алгоритма реконструкции или обеспечения того, чтобы показатель преломления выбранного погружного масла подходил для монтажной среды и образца. Для более подробного обсуждения артефактов SIM-карты и свободно доступного инструмента для проверки наличия артефактов см. Ball et al. 18 См. - Сравните реконструкцию SIM-карты с широкоугольным изображением, чтобы увидеть улучшения в разрешении.
- При выполнении многоцветной SIM-карты используйте алгоритм выравнивания для правильного выравнивания различных каналов после того, как будет готова удовлетворительная реконструкция.
ПРИМЕЧАНИЕ: Алгоритм выравнивания использует эталонный файл выравнивания, сгенерированный с помощью подготовки шариков микросферы в соответствии с инструкцией производителя микроскопа.
3. Анализ изображений
- Актиновые кольца в МПС имеют характерный периодический вид. Используя программное обеспечение для анализа изображений (см. Таблицу материалов), создайте проекционное изображение максимальной интенсивности, используя все фокальные плоскости, где видны актиновые кольца.
- На проекционном изображении максимальной интенсивности нарисуйте перпендикулярную линию через видимые соседние кольца и запишите интенсивность флуоресценции вместе с функцией программного обеспечения «Профиль графика».
- Чтобы рассчитать среднее межпиковое расстояние, запишите локальные максимумы в профиле линии и измерьте расстояние между отдельными соседними пиками интенсивности флуоресцентной жидкости.
ПРИМЕЧАНИЕ: Это может быть легко вычислено, например, с помощью функции 'findpeaks' в MATLAB или платформы GNU Octave (с открытым исходным кодом). - Чтобы оценить колокализацию различных белков с актиновыми кольцами в MPS, запустите процедуру анализа колокализации19,20,21 на SIM-реконструкциях актина и белка-кандидата. Вручную нарисуйте выбор, чтобы определить AIS как область интереса для плагина EzColocalization в программной платформе19 и запустите анализ для расчета коэффициента корреляции Пирсона (PCC) колокализации19,20,21. Значение PCC, близкое к 1, указывает на сильную колокализацию.
ПРИМЕЧАНИЕ: Этот протокол обобщен на рисунке 1.
Результаты
Используя культивируемые нейроны гиппокампа крыс и 3D-SIM, описан протокол для визуализации и измерения актиновых колец и других компонентов MPS в AIS. Реконструкции стеков изображений показали четкую периодичность актиновых колец (рисунок 2А). В наших руках среднее межпиковое расстояние актиновых колец в MPS, визуализированное с помощью фаллоидина с тегами Alexa 488, составило 190,36 ± 1,7 нм (среднее ± SEM). Это соответствует ранее сообщенному среднему расстоянию ~ 190 нм между актиновыми кольцами в MPS. Аналогичным образом, анти-анкириновое G антитело использовалось для визуализации анкирина G (рисунок 2B). Колокализация анкирина G и F-актина была протестирована в АИС с использованием процедуры анализа колокализации для расчета PCC колокализации19,20,21. PCC колокализации флуоресценции анкирина G и F-актина составил 0,36 ± 0,03 (среднее ± SEM, рисунок 2B). Поскольку анкириновые G и актиновые кольца связывают βIV-спектрин в разных доменах, они не показывают значительной колокализации. Эти данные были адаптированы из Abouelezz et al.16

Рисунок 1: Схематическое представление протокола подготовки образцов для 3D-SIM визуализации. Нейроны гиппокампа собирают из эмбрионов крыс, диссоциируют и позволяют расти на стеклянных покровах в культуре в течение 14 дней. Затем клетки фиксируются и окрашиваются с использованием помеченного фаллоидина и соответствующих антител, а затем устанавливаются на стеклянные слайды для визуализации 3D-SIM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
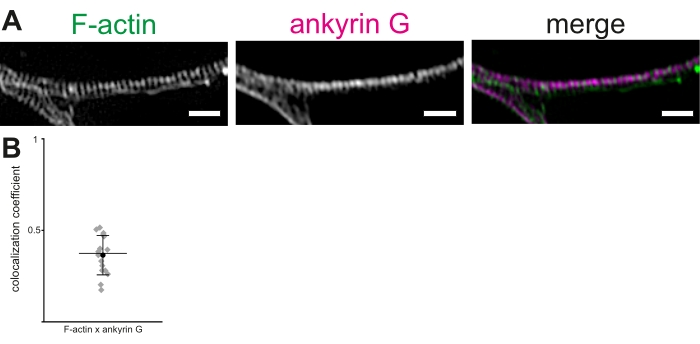
Рисунок 2: 3D-SIM реконструкция мембранного периодического скелета (MPS) в исходном сегменте аксона (AIS). (A) F-актин (зеленый) и анкирин G (пурпурный) показывают регулярное распределение в AIS, визуализированное 3D-SIM. Шкала bar = 1 мкм. (B) Коэффициенты корреляции Пирсона (PCC) колокализации анкирина G с F-актином в MPS в АИС. Среднее значение PCC анкирина G составляло 0,36 (черный круг). Серые алмазы представляют отдельные ячейки (n = 16), средняя линия представляет медиану, полосы ошибок представляют 25-й и 75-й процентили. Данные адаптированы из Abouelezz et al.16Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Протокол, описанный здесь, предоставляет метод визуализации и измерения белков MPS с использованием метода сверхвысокого разрешения. Поскольку актиновые кольца и другие компоненты MPS демонстрируют периодичность ~ 190 нм9,10, обычные дифракционные подходы к визуализации не могут раскрыть детали MPS. Несколько установок микроскопии могут разрешать дифракционные ограниченные структуры в сверхвысоком разрешении, а SIM-карта представляет собой надежный и несложный вариант. Важно отметить, что SIM-карта совместима с наиболее широко используемыми флуорофорами, обеспечивая значительную гибкость. Кроме того, SIM эффективна в визуализации потенциально тусклых структур в MPS, таких как актиновые кольца в нейронах, обработанных латрункулином22, а также живые нейроны15.
Важным аспектом успеха этого протокола является сохранение целостности MPS в первую очередь. Наиболее важные шаги для успешной визуализации SIM-карты происходят во время подготовки образца. Например, умеренная фиксация (4% PFA в течение 12 мин при комнатной температуре) и сильная пермеабилизация (1% Triton-X в течение 10 мин) обеспечивают наилучшие результаты. Важно иметь в виду, что суровые методы лечения, которые могут потребоваться для конкретных препаратов, могут оказать негативное влияние на структурную целостность MPS. Поэтому, возможно, лучше всего рассмотреть возможность изменения таких методов лечения, чтобы максимизировать сохранение MPS.
Другим важным фактором, который следует учитывать при подготовке образцов к визуализации, является максимизация плотности маркировки. В идеале каждая молекула должна быть помечена и обнаружена. Например, антиантириновое G-антитело, используемое в этом эксперименте, обычно используется для маркировки АИС. Он обеспечивает выдающуюся производительность в обычной флуоресцентной микроскопии, даже при использовании в разведении 1:1000 и инкубировании всего 1 ч при комнатной температуре. Однако для получения хорошей плотности маркировки для микроскопии сверхвысокого разрешения очень эффективно использовать 5-кратную концентрацию (1:200) и инкубировать антитело в течение ночи при 4 °C. Хотя конкретные требования к каждому антителу или методу маркировки будут варьироваться и должны быть определены экспериментально, возможно, полезно иметь это в виду.
Кроме того, важно отметить, что достижение высокого отношения сигнал/шум хорошо подходит для точной и успешной реконструкции SIM-карты. Хорошее эмпирическое правило заключается в том, что шаблон сетки должен быть виден на отдельных изображениях после включения модальности SIM-карты. Однако это не всегда возможно.
Наконец, важно отметить, что SIM является одним из самых слабых методов сверхразрешения в разрешении power14. Таким образом, хотя она, как правило, достаточна для выявления периодичности и общей организации белков MPS, она значительно менее способна предоставить подробную информацию об их взаимодействиях, чем стохастическая оптическая реконструкционная микроскопия (STORM)10. Кроме того, полезность метода, описанная здесь, ограничена изучением белков, для которых доступно специфическое, хорошо работающее антитело. Однако это может быть частично обойдено путем экзогенной экспрессии меченых белков15.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Д-р Пирта Хотулайнен отмечена за ее критические комментарии, неоценимые для подготовки этой рукописи. Доктор Риманте Минкявичене признана за ее помощь в подготовке нейронных культур, используемых для оригинальных экспериментов. Вся визуализация проводилась в отделении визуализации биомедицины. Эта работа была поддержана Академией Финляндии (D.M., SA 266351) и докторской программой Brain & Mind (A.A.)
Материалы
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 3524 | |
| 4% Paraformaldehyde | |||
| Alexa-488 Phalloidin | ThermoFisher | A12379 | |
| Alexa-647 anti-mouse | ThermoFisher | A31571 | |
| Anti-Ankyrin G antibody | UC Davis/NIH NeuroMab Facility, Clone 106/36 | 75-146 | |
| Anti-MAP2 antibody | Merck Millipore | AB5543 | |
| B-27 | Invitrogen | 17504044 | |
| Bovine Serum Albumin (BSA) | BioWest | P6154 | |
| Deltavision OMX SR | GE Healthcare Life Sciences | N/A | |
| Fiji software package | ImageJ | ||
| GNU Octave | GNU | ||
| High performance coverslips | Marienfeld | 117530 | |
| Immersion Oil Calculator | Cytiva Life Sciences | https://tinyurl.com/ImmersionOilCalculator | |
| L-Glutamine | VWR | ICNA1680149 | |
| MATLAB R2020a | Mathworks | ||
| Neurobasal media | Invitrogen | 21103049 | |
| OMX SR | Delta Vision OMX | ||
| Primocin | InvivoGen | ant-pm-1 | |
| ProLong Gold mounting media | Invitrogen | P10144 | |
| softWoRx Deconvolution | Cytiva Life Sciences | ||
| Superfrost Slides | Epredia | ISO 8037/1 | |
| TetraSpeck microspheres 0.1 µm | ThermoFisher | T7279 | |
| Triton-X | Sigma | X100 |
Ссылки
- Leterrier, C. The Axon initial segment, 50 years later: A nexus for neuronal organization and function. Current Topics in Membranes. 77, 185-233 (2016).
- Leterrier, C., Dargent, B. No pasaran! Role of the axon initial segment in the regulation of protein transport and the maintenance of axonal identity. Seminars in Cell & Developmental Biology. 27, 44-51 (2014).
- Brachet, A., et al. Ankyrin G restricts ion channel diffusion at the axonal initial segment before the establishment of the diffusion barrier. Journal of Cell Biology. 191 (2), 383-395 (2010).
- Nakada, C., et al. Accumulation of anchored proteins forms membrane diffusion barriers during neuronal polarization. Nature Cell Biology. 5 (7), 626-632 (2003).
- Song, A. H., et al. A selective filter for cytoplasmic transport at the axon initial segment. Cell. 136 (6), 1148-1160 (2009).
- Sun, X., et al. Selective filtering defect at the axon initial segment in Alzheimer's disease mouse models. Proceedings of the National Academy of Sciences of the United States of America. 111 (39), 14271-14276 (2014).
- Winckler, B., Forscher, P., Mellman, I. A diffusion barrier maintains distribution of membrane proteins in polarized neurons. Nature. 397 (6721), 698-701 (1999).
- Kole, M. H., et al. Action potential generation requires a high sodium channel density in the axon initial segment. Nature Neuroscience. 11 (2), 178-186 (2008).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339 (6118), 452-456 (2013).
- Leterrier, C., et al. Nanoscale architecture of the axon initial segment reveals an organized and robust scaffold. Cell Reports. 13 (12), 2781-2793 (2015).
- Leterrier, C. The axon initial segment: An updated viewpoint. The Journal of Neuroscience. 38 (9), 2135-2145 (2018).
- Hamdan, H., et al. Mapping axon initial segment structure and function by multiplexed proximity biotinylation. Nature Communications. 11 (1), 100(2020).
- Zhou, R., et al. Proteomic and functional analyses of the periodic membrane skeleton in neurons. bioRxiv. , (2020).
- Valli, J., et al. Seeing beyond the limit: A guide to choosing the right super-resolution microscopy technique. Journal of Biological Chemistry. 297 (1), 100791(2021).
- Wang, T., et al. Radial contractility of actomyosin rings facilitates axonal trafficking and structural stability. Journal of Cell Biology. 219 (5), 201902001(2020).
- Abouelezz, A., Stefen, H., Segerstråle, M., Micinski, D., Minkeviciene, R., Lahti, L., Hardeman, E., Gunning, P., Hoogenraad, C., Taira, T., Fath, T., Hotulainen, P. Tropomyosin Tpm3.1 is required to maintain the structure and function of the axon initial segment. iScience. 23 (5), 101053(2020).
- Muller, M., Monkemoller, V., Hennig, S., Hubner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7, 10980(2016).
- Ball, G., et al. SIMcheck: a toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5, 15915(2015).
- Stauffer, W., Sheng, H., Lim, H. N. EzColocalization: An ImageJ plugin for visualizing and measuring colocalization in cells and organisms. Scientific Reports. 8 (1), 15764(2018).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Lahti, L. Data analysis supplement to the research article Abouelezz, Stefen, Segerstråle, Micinski, Minkeviciene, Lahti, Hardeman, Gunning, Hoogenraad, Taira, Fath, & Hotulainen. Tropomyosin Tpm3.1 Is Required to Maintain the Structure and Function of the Axon Initial Segment. , (2021).
- Abouelezz, A., Micinski, D., Lipponen, A., Hotulainen, P. Sub-membranous actin rings in the axon initial segment are resistant to the action of latrunculin. Journal of Biological Chemistry. 400 (9), 1141-1146 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
ISSN 1940-087X
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.