Method Article
3D構造化照明顕微鏡(3D-SIM)を用いた軸索初期セグメントの膜周期骨格の特性の測定
要約
本プロトコールは、培養ラット海馬ニューロンおよび3D構造化照明顕微鏡(3D−SIM)を用いて軸索初期セグメントの膜周期骨格のアクチン環および他の成分を視覚化および測定する方法を記載する。
要約
軸索初期セグメント(AIS)は、活動電位が開始する部位であり、体性樹状貨物を選別することによってニューロン極性の維持に寄与する輸送フィルターおよび拡散障壁を構成する。周期的アクチン環を含む膜周期骨格(MPS)は、構造タンパク質および異なるイオンチャネルを含む様々なAISタンパク質を固定するための足場を提供する。最近のプロテオミクス的アプローチでは、かなりの数の新規AIS成分が同定されているが、MPSの構造とその個々の構成要素の役割の詳細は欠けている。MPS内の個々のアクチン環間の距離(〜190nm)は、MPSの構造的詳細を解明するために超解像顕微鏡技術の採用を必要とする。このプロトコルは、培養ラット海馬ニューロンを使用して、3D構造化照明顕微鏡(3D-SIM)を用いて膜下アクチン環に対するMPSにおけるAISタンパク質の正確な局在を調べるための方法を記載している。さらに、個々の成分の周期性およびアクチン環に対するそれらの位置を定量的に評価するための分析的アプローチも記載されている。
概要
軸索初期セグメント(AIS)は、脊椎動物ニューロンの近位軸索の短く、一意に専門化された領域である1。AISは、ソマト樹状貨物2,3,4,5,6,7を選別することにより、ニューロン極性の維持に不可欠な輸送フィルターと拡散バリアを備える。さらに、AISのユニークな構造により、活動電位開始部位としての機能を容易にする電位依存性イオンチャネルのクラスターを収容することができます8。非常に安定した構造複合体は、AISのユニークな機能の根底にあります。過去10年間の研究により、スペクトリンによって接続されたアクチン環を含む膜周期骨格(MPS)の存在が明らかになり、さまざまなAISタンパク質を固定するための足場が提供されました9,10。
MPS(〜190nm)9,10におけるアクチン環間の距離は、従来の光学顕微鏡の分解能限界以下である。電子顕微鏡を使用してMPSを視覚化しようとする初期の試みは、MPSの構造を保存するのに失敗したため、失敗した。したがって、超解像顕微鏡技術は、MPS11の構造の詳細のいくつかを解明する上で非常に貴重であることが証明されています。しかし、AIS構造複合体、その構成要素の同一性と機能、およびその時空間調節の理解はまだ不完全である。最近のプロテオミクス研究は、AISの構造成分に近いAISに局在するタンパク質のかなりのリストを作成することに成功しました12,13。それでも、AIS複合体におけるそれらの機能の詳細と正確な位置は欠けています。したがって、超解像顕微鏡技術は、他のMPS成分に対するこれらのタンパク質の正確な位置を調べ、それらの機能を調べるために不可欠なツールとして役立つ。いくつかの光学顕微鏡技術は、光の回折限界よりも高い分解能を達成することができ、いくつかは単一分子を局在化させることさえできる。しかし、これらの技術の多くは、通常、特殊な蛍光色素またはイメージングバッファーを必要とし、画像取得にはしばしば時間がかかります14。
3D構造化照明顕微鏡(3D-SIM)は、その使いやすさと簡単なサンプル調製要件により、イメージングやサンプル調製のための特別な試薬を必要とせず、幅広い蛍光色素やサンプルでうまく動作し、複数の色で容易に実装でき、生細胞イメージングが可能です15。SIMが提供する可能な限り最高の解像度(〜120nm)は、他の多くの超解像技術と比較して低いが、多くのアプリケーション(例えば、ニューロン内のMPSの成分を解像する)には十分である。したがって、SIMが適切な選択肢であるかどうか、またはさらに高い解像度が必要かどうかを判断するために、特定のアプリケーションの要件を考慮することが重要です。ここでは、Abouelezzらで実施されているように、培養海馬ニューロンおよび3D構造化照明顕微鏡(3D-SIM)を使用して、MPSにおけるアクチン環に対する推定AISタンパク質の位置および組織を調べるためのプロトコルが記載されている16。
プロトコル
これらの実験で使用した初代海馬ニューロンは、ヘルシンキ大学の倫理ガイドラインおよびフィンランドの法律に基づき、胚発生17日目から男女を問わずWistarラット胚を採取した16 。
1. サンプル調製
- 忠実度の高いガラスカバースリップで、ラット海馬ニューロンをまばらな培養条件(約5,000~10,000細胞/cm2)で14日間(14日間-インビトロ)成長させます。
注: まばらな培養物を使用すると、神経突起が重なる可能性が低くなり、MPS の定量化に役立ちます。 - 室温で12分間、4%パラホルムアルデヒドを使用してニューロンを固定する。カバースリップをPBS(BSA-PBS)中の0.2% BSA中で1回洗浄し、次いで室温でPBS中のTriton-Xの1%溶液中で10分間インキュベートする。BSA-PBSで1回洗ってください。
- 抗アンキリンG抗体(1:200)をBSA-PBSで希釈する。抗体溶液をカバースリップに加え、4°Cで一晩インキュベートした。 任意選択で、ニワトリ抗MAP2抗体( 材料表を参照)を抗体溶液に添加して、体性樹状ドメインを画定する。
- 細胞をBSA-PBSで1回洗浄し、続いてPBSで0.1%Triton-Xを洗浄し、次いでBSA-PBSで最終洗浄を行う。
- 蛍光色素タグ付き抗マウス二次抗体(1:200)( 材料表を参照)をBSA-PBSで希釈し、カバースリップに加え、室温で1時間インキュベートします。細胞をBSA-PBSで1回、PBSで0.1%Triton-Xに1回、次いでPBSで1回洗浄する。
- PBS中のタグ付きファロイジンの1μM溶液( 材料表を参照)を調製し、それを細胞に加える。室温で2時間インキュベートする。細胞をPBS中で1回、PBS中の0.1%Triton-X中に1回、次いでPBS中で1回洗浄する。
注:AlexaFluor488タグのファロイジンがここで使用されていましたが、他のタグも機能します。 - スライドガラスにカバースリップを取り付ける場合は、スライドガラスにマウントメディアを一滴塗り、脱イオン水に浸し、柔らかいペーパータオルで軽く叩きます(余分な水分を除去するため)。
- スライドガラスの上にカバースリップを置きます。室温で24時間インキュベートする。
注:ハードセット実装媒体(硬化後の屈折率1.47)を使用してもサンプルへの悪影響は観察されなかった。
- スライドガラスの上にカバースリップを置きます。室温で24時間インキュベートする。
2. イメージング
- 可能であれば、イメージングの前に顕微鏡施設の担当者に相談してください。浸漬油計算機( 材料表を参照)を使用して、サンプルに適した浸漬油を選択します。
- サンプルの準備ができたら、カバースリップが清潔で、残留物や余分なマウントメディアがないことを確認します。必要に応じて、綿の先端を水またはエタノールに浸して清掃してください。サンプルを3D SIM対応顕微鏡( 材料表を参照)に置き、画像化する細胞を見つけます。
- 関連するレーザーラインのパワーと露光時間を調整して、サンプルを大幅に漂白することなく信号対雑音比を最大化します。
注:良好な信号対雑音比は、サンプルに焦点を当てた明確なグリッド状の外観を示し、正確な高解像度再構成につながります。488nmおよび640nmのレーザーラインを用いて、それぞれF-アクチンおよびアンキリンGを視覚化した。 - サンプルの上限と下限を Z 次元で設定し、スタックの取得に進みます。
注: ここでは 125 nm の z ステップ サイズを使用しました。 - SIMの再構築を成功させるには、顕微鏡ソフトウェア( 材料表を参照)に、使用する色素に適した光転送ファイル(OTF)があることを確認してください。
注: これらは通常、専門の担当者によって作成および保守されます。機能的なOTFがない場合、オープンソースのツールも利用可能で、推定値に基づいて再構築を実行できます17。この作業では、最新のOTFファイルが専門の担当者によって管理されて使用されました。 - スタック上で再構成アルゴリズムを実行して、超解像再構成を取得します。再構成で既知のアーティファクトを確認し、必要に応じてパラメータを調整して修正します。
メモ: 通常、デフォルトのアルゴリズムパラメータは正確な結果をもたらします。これらのアーティファクトの多くは、1つのz平面上の複数の方向と一緒に縞模様の線、「ゴースト」(さまざまなz平面に現れる繰り返しの特徴)、またはいくつかの領域に現れる六角形の「ハニカム」パターンなど、いくつかの繰り返しパターンを含む。これらのアーチファクトは、多くの場合、より良いサンプル調製、より良い信号対雑音比、再構成アルゴリズムのパラメータの調整、または選択された浸漬油の屈折率がマウント媒体およびサンプルに適していることを保証することによって修正することができる。SIMアーティファクトのより詳細な説明と、アーティファクトの存在をチェックするための自由に利用可能なツールについては、Ballらを参照してください。18名 - SIM再構成を広視野画像と比較して、解像度の向上を観察します。
- マルチカラーSIMを実行する場合は、アライメントアルゴリズムを使用して、満足のいく再構築の準備ができたら、異なるチャンネルを正しくアライメントします。
メモ:アライメントアルゴリズムは、顕微鏡メーカーの指示に従って、ミクロスフェアビーズの準備を使用して生成されたアライメントリファレンスファイルを使用します。
3. 画像解析
- MPSのアクチン環は、独特の周期的な外観を有する。画像解析ソフトウェア( 材料表を参照)を使用して、アクチンリングが見えるすべての焦点面を使用して最大強度投影画像を作成します。
- 最大強度投影画像で、目に見える隣接するリングに垂直な線を描き、ソフトウェアの線「プロファイルのプロット」機能とともに蛍光強度を記録します。
- 平均ピーク間距離を計算するには、ラインプロファイルの極大値に注意し、隣接する個々の蛍光強度ピーク間の距離を測定します。
注: これは、たとえば、MATLAB の 'findpeaks' 関数や (オープンソースの) GNU Octave プラットフォームを使って簡単に計算できます。 - MPSにおけるアクチン環を有する異なるタンパク質の共局在を評価するために、アクチンおよび候補タンパク質のSIM再構成について共局在解析手順19,20,21を実行する。AISをソフトウェアプラットフォームのEzColocalizationプラグインの関心領域として定義する選択を手動で描画し19、分析を実行してピアソンの共局在化の相関係数(PCC)を計算します19,20,21。PCC 値が 1 に近い場合は、強い共局在化を示します。
メモ: このプロトコルを 図 1 にまとめます。
結果
培養ラット海馬ニューロンおよび3D−SIMを使用して、AISにおけるアクチンリングおよびMPSの他の成分を視覚化および測定するためのプロトコルが記載されている。画像スタックの再構成は、アクチン環の明確な周期性を示した(図2A)。我々の手では、Alexa 488タグ付きファロイジンを用いて可視化されたMPSにおけるアクチン環の平均ピーク間距離は、190.36±1.7nm(SEM±平均)であった。これは、MPSにおけるアクチン環間の〜190nmの以前に報告された平均距離と一致している。同様に、抗アンキリンG抗体を用いて、アンキリンGを可視化した(図2B)。アンキリンGおよびF-アクチンの共局在化を、共局在化のPCCを計算するために共局在化分析手順を用いてAISで試験した19、20、21。アンキリンGおよびFアクチン蛍光のPCCの共局在は0.36±0.03であった(SEM±平均、図2B)。アンキリンGとアクチン環は異なるドメインでβIVスペクトリンと結合するので、有意な共局在化を示さない。これらのデータはAbouelezzらから適応されたものである16。

図1:3D-SIMイメージングのためのサンプル調製のためのプロトコルの概略図。 海馬ニューロンをラット胚から採取し、解離させ、14日間培養してガラスカバーグラス上で増殖させた。次いで、細胞を固定し、タグ付きファロイジンおよび適切な抗体を用いて染色し、次いで3D−SIMイメージングのためにスライドガラス上にマウントする。 この図の拡大版を表示するには、ここをクリックしてください。
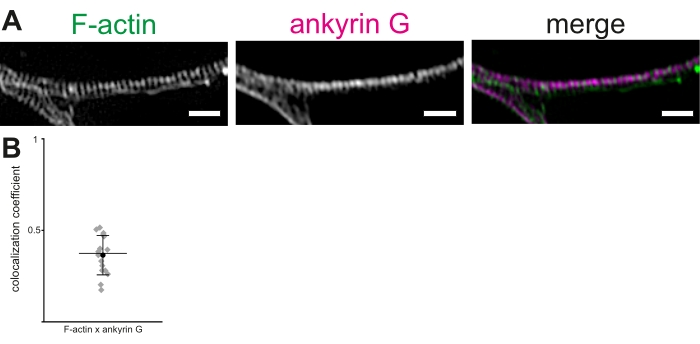
図2:軸索初期セグメント(AIS)における膜周期骨格(MPS)の3D-SIM再構成。 (A)F-アクチン(緑色)およびアンキリンG(マゼンタ)は、AISにおける規則的な分布を示し、3D-SIMによって視覚化された。(B)AISにおけるMPSにおけるアンキリンGとF-アクチンとの共局在のピアソンの相関係数(PCC)。アンキリンGの平均PCCは0.36(黒丸)であった。灰色のひし形は個々のセル(n = 16)を表し、中央線は中央値を表し、エラーバーは25番目 と75番目の 百分位数を表します。データはAbouelezzらから適応されています.16この図の拡大版を見るにはここをクリックしてください。
ディスカッション
ここで説明するプロトコルは、超解像技術を使用してMPSタンパク質を視覚化および測定する方法を提供します。アクチンリングおよび他のMPS成分は〜190nm9,10の周期性を示すので、従来の回折制限イメージングアプローチはMPSの詳細を明らかにすることができない。いくつかの顕微鏡セットアップは、回折が制限された構造を超解像で解決する可能性があり、SIMは堅牢で単純なオプションを表します。重要なことに、SIMは最も広く使用されている蛍光色素と互換性があり、大きな柔軟性を提供します。さらに、SIMは、ラトルンクリン処理ニューロン22のアクチン環や生きているニューロン15など、MPS内の潜在的に薄暗い構造を視覚化するのに効果的です。
このプロトコルを成功させるために不可欠な側面は、そもそも MPS の整合性を維持することです。SIMイメージングを成功させるための最も重要なステップは、サンプル調製中に発生します。例えば、適度な固定(室温で12分間の4%PFA)および強力な透過処理(1%Triton-Xを10分間)が最良の結果をもたらす。特定の製剤に必要とされる可能性のある過酷な治療は、MPSの構造的完全性に悪影響を及ぼす可能性があることに留意することが重要です。したがって、MPSの保存を最大化するためにそのような治療を修正することを検討することがおそらく最善である。
イメージング用のサンプルを調製する際に考慮すべきもう1つの重要な要素は、ラベリング密度を最大化することです。理想的には、すべての分子にタグが付けられ、検出されます。例えば、本実験で用いた抗アンキリンG抗体は、AISの標識に一般的に用いられている。従来の蛍光顕微鏡で優れた性能を発揮し、1:1000の希釈で使用し、室温でわずか1時間インキュベートした場合でも優れています。しかし、超解像顕微鏡で良好な標識密度を得るには、その濃度の5倍(1:200)を使用し、抗体を4°Cで一晩インキュベートすることが非常に効果的です。 各抗体または標識技術の具体的な要件はさまざまであり、実験的に決定する必要がありますが、これを念頭に置いておくと役立つ可能性があります。
さらに、高い信号対雑音比を達成することは、正確で成功したSIM再構成によく役立つことに注意することが不可欠です。良い経験則は、SIMモダリティがエンゲージされると、グリッドパターンが個々の画像に表示される必要があるということです。ただし、これは常に可能とは限りません。
最後に、SIMは解像力14で最も弱い超解像技術の1つであることに注意することが不可欠です。したがって、MPSタンパク質の周期性および全体的な組織を明らかにするには一般に十分であるが、確率的光学再構成顕微鏡(STORM)10よりもそれらの相互作用に関する詳細を提供する能力は著しく低い。さらに、ここで説明する技術の有用性は、特異的で高性能な抗体が利用可能なタンパク質の研究に限定されています。しかし、これは部分的にはタグ付きタンパク質の外因性発現によって回避することができます15。
開示事項
著者らは開示するものは何もありません。
謝辞
ピルタ・ホトゥライネン博士は、この原稿を準備する上で非常に貴重な批判的なコメントで認められています。リマンテ・ミンケビシエネ博士は、元の実験に使用されたニューロン培養物の準備における彼女の助けで認められています。全てのイメージングは、バイオメディカムイメージングユニットで行った。この研究は、アカデミー・オブ・フィンランド(D.M、SA 266351)と博士課程Brain & Mind(A.A.)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 3524 | |
| 4% Paraformaldehyde | |||
| Alexa-488 Phalloidin | ThermoFisher | A12379 | |
| Alexa-647 anti-mouse | ThermoFisher | A31571 | |
| Anti-Ankyrin G antibody | UC Davis/NIH NeuroMab Facility, Clone 106/36 | 75-146 | |
| Anti-MAP2 antibody | Merck Millipore | AB5543 | |
| B-27 | Invitrogen | 17504044 | |
| Bovine Serum Albumin (BSA) | BioWest | P6154 | |
| Deltavision OMX SR | GE Healthcare Life Sciences | N/A | |
| Fiji software package | ImageJ | ||
| GNU Octave | GNU | ||
| High performance coverslips | Marienfeld | 117530 | |
| Immersion Oil Calculator | Cytiva Life Sciences | https://tinyurl.com/ImmersionOilCalculator | |
| L-Glutamine | VWR | ICNA1680149 | |
| MATLAB R2020a | Mathworks | ||
| Neurobasal media | Invitrogen | 21103049 | |
| OMX SR | Delta Vision OMX | ||
| Primocin | InvivoGen | ant-pm-1 | |
| ProLong Gold mounting media | Invitrogen | P10144 | |
| softWoRx Deconvolution | Cytiva Life Sciences | ||
| Superfrost Slides | Epredia | ISO 8037/1 | |
| TetraSpeck microspheres 0.1 µm | ThermoFisher | T7279 | |
| Triton-X | Sigma | X100 |
参考文献
- Leterrier, C. The Axon initial segment, 50 years later: A nexus for neuronal organization and function. Current Topics in Membranes. 77, 185-233 (2016).
- Leterrier, C., Dargent, B. No pasaran! Role of the axon initial segment in the regulation of protein transport and the maintenance of axonal identity. Seminars in Cell & Developmental Biology. 27, 44-51 (2014).
- Brachet, A., et al. Ankyrin G restricts ion channel diffusion at the axonal initial segment before the establishment of the diffusion barrier. Journal of Cell Biology. 191 (2), 383-395 (2010).
- Nakada, C., et al. Accumulation of anchored proteins forms membrane diffusion barriers during neuronal polarization. Nature Cell Biology. 5 (7), 626-632 (2003).
- Song, A. H., et al. A selective filter for cytoplasmic transport at the axon initial segment. Cell. 136 (6), 1148-1160 (2009).
- Sun, X., et al. Selective filtering defect at the axon initial segment in Alzheimer's disease mouse models. Proceedings of the National Academy of Sciences of the United States of America. 111 (39), 14271-14276 (2014).
- Winckler, B., Forscher, P., Mellman, I. A diffusion barrier maintains distribution of membrane proteins in polarized neurons. Nature. 397 (6721), 698-701 (1999).
- Kole, M. H., et al. Action potential generation requires a high sodium channel density in the axon initial segment. Nature Neuroscience. 11 (2), 178-186 (2008).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339 (6118), 452-456 (2013).
- Leterrier, C., et al. Nanoscale architecture of the axon initial segment reveals an organized and robust scaffold. Cell Reports. 13 (12), 2781-2793 (2015).
- Leterrier, C. The axon initial segment: An updated viewpoint. The Journal of Neuroscience. 38 (9), 2135-2145 (2018).
- Hamdan, H., et al. Mapping axon initial segment structure and function by multiplexed proximity biotinylation. Nature Communications. 11 (1), 100 (2020).
- Zhou, R., et al. Proteomic and functional analyses of the periodic membrane skeleton in neurons. bioRxiv. , (2020).
- Valli, J., et al. Seeing beyond the limit: A guide to choosing the right super-resolution microscopy technique. Journal of Biological Chemistry. 297 (1), 100791 (2021).
- Wang, T., et al. Radial contractility of actomyosin rings facilitates axonal trafficking and structural stability. Journal of Cell Biology. 219 (5), 201902001 (2020).
- Abouelezz, A., Stefen, H., Segerstråle, M., Micinski, D., Minkeviciene, R., Lahti, L., Hardeman, E., Gunning, P., Hoogenraad, C., Taira, T., Fath, T., Hotulainen, P. Tropomyosin Tpm3.1 is required to maintain the structure and function of the axon initial segment. iScience. 23 (5), 101053 (2020).
- Muller, M., Monkemoller, V., Hennig, S., Hubner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7, 10980 (2016).
- Ball, G., et al. SIMcheck: a toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5, 15915 (2015).
- Stauffer, W., Sheng, H., Lim, H. N. EzColocalization: An ImageJ plugin for visualizing and measuring colocalization in cells and organisms. Scientific Reports. 8 (1), 15764 (2018).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Lahti, L. Data analysis supplement to the research article Abouelezz, Stefen, Segerstråle, Micinski, Minkeviciene, Lahti, Hardeman, Gunning, Hoogenraad, Taira, Fath, & Hotulainen. Tropomyosin Tpm3.1 Is Required to Maintain the Structure and Function of the Axon Initial Segment. , (2021).
- Abouelezz, A., Micinski, D., Lipponen, A., Hotulainen, P. Sub-membranous actin rings in the axon initial segment are resistant to the action of latrunculin. Journal of Biological Chemistry. 400 (9), 1141-1146 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved