Method Article
Medición de las propiedades del esqueleto periódico de membrana del segmento inicial del axón mediante microscopía de iluminación estructurada en 3D (3D-SIM)
En este artículo
Resumen
El presente protocolo describe un método para visualizar y medir anillos de actina y otros componentes del esqueleto periódico de membrana del segmento inicial del axón utilizando neuronas del hipocampo de rata cultivadas y microscopía de iluminación estructurada en 3D (3D-SIM).
Resumen
El segmento inicial del axón (AIS) es el sitio en el que se inician los potenciales de acción y constituye un filtro de transporte y una barrera de difusión que contribuyen al mantenimiento de la polaridad neuronal mediante la clasificación de la carga somato-dendrítica. Un esqueleto periódico de membrana (MPS) que comprende anillos periódicos de actina proporciona un andamio para anclar varias proteínas AIS, incluidas las proteínas estructurales y los diferentes canales iónicos. Aunque los enfoques proteómicos recientes han identificado un número considerable de nuevos componentes AIS, faltan detalles sobre la estructura del MPS y las funciones de sus componentes individuales. La distancia entre los anillos de actina individuales en el MPS (~ 190 nm) requiere el empleo de técnicas de microscopía de superresolución para resolver los detalles estructurales del MPS. Este protocolo describe un método para usar neuronas del hipocampo de rata cultivadas para examinar la localización precisa de una proteína AIS en el MPS en relación con los anillos de actina submembranosos utilizando microscopía de iluminación estructurada en 3D (3D-SIM). Además, también se describe un enfoque analítico para evaluar cuantitativamente la periodicidad de los componentes individuales y su posición en relación con los anillos de actina.
Introducción
El segmento inicial del axón (SIA) es una región corta y exclusivamente especializada del axón proximal de las neuronas de los vertebrados1. El AIS comprende un filtro de transporte y una barrera de difusión esenciales para mantener la polaridad neuronal mediante la clasificación de la carga somato-dendrítica2,3,4,5,6,7. Además, la estructura única del AIS le permite acomodar grupos de canales iónicos dependientes de voltaje que facilitan su función como el sitio de iniciación potencial de acción8. Un complejo estructural altamente estable subyace a las funciones únicas del AIS. La investigación realizada en la última década ha revelado la presencia de un esqueleto periódico de membrana (MPS) que contiene anillos de actina conectados por espectrina y que proporciona un andamio para anclar varias proteínas AIS9,10.
La distancia entre los anillos de actina en el MPS (~190 nm)9,10 está por debajo del límite de resolución de la microscopía de luz convencional. Los primeros intentos de usar microscopía electrónica para visualizar el MPS no tuvieron éxito, ya que los duros procedimientos de preparación involucrados no pudieron preservar la estructura del MPS. Por lo tanto, las técnicas de microscopía de superresolución han demostrado ser invaluables para dilucidar algunos de los detalles estructurales del MPS11. Sin embargo, la comprensión del complejo estructural AIS, la identidad y las funciones de sus componentes y su regulación espaciotemporal aún están incompletas. Estudios proteómicos recientes lograron crear una lista considerable de proteínas que se localizan en el AIS cerca de los componentes estructurales del AIS12,13. Aún así, faltan detalles de su función y lugar preciso en el complejo AIS. Por lo tanto, las técnicas de microscopía de superresolución sirven como una herramienta esencial para examinar las posiciones precisas de estas proteínas en relación con otros componentes de MPS e investigar sus funciones. Varias técnicas de microscopía de luz pueden alcanzar resoluciones superiores al límite de difracción de la luz, algunas incluso capaces de localizar moléculas individuales. Sin embargo, muchas de estas técnicas suelen requerir fluoróforos especializados o tampones de imagen, y la adquisición de imágenes suele requerir mucho tiempo14.
La microscopía de iluminación estructurada 3D (3D-SIM), debido a su facilidad de uso y a los requisitos simples de preparación de muestras, no requiere reactivos especiales para la obtención de imágenes o muestras, funciona bien con una amplia gama de fluoróforos y muestras, se puede implementar fácilmente en múltiples colores y es capaz de obtener imágenes de células vivas15. Si bien la mejor resolución posible que ofrece SIM (~ 120 nm) es baja en comparación con muchas otras técnicas de superresolución, es suficiente para muchas aplicaciones (por ejemplo, para resolver los componentes del MPS en las neuronas). Por lo tanto, es crucial considerar el requisito de aplicaciones específicas para determinar si SIM es una opción adecuada o si es necesaria una resolución aún mayor. Aquí, se describe un protocolo para el uso de neuronas del hipocampo cultivadas y microscopía de iluminación estructurada en 3D (3D-SIM) para examinar la posición y organización de las supuestas proteínas AIS en relación con los anillos de actina en el MPS, como se implementó en Abouelezz et al.16
Protocolo
Las neuronas primarias del hipocampo utilizadas en estos experimentos fueron cosechadas16 de embriones embrionarios de rata Wistar de ambos sexos según las directrices éticas de la Universidad de Helsinki y la ley finlandesa.
1. Preparación de la muestra
- En los recubiertos de vidrio de alta fidelidad, permita que las neuronas del hipocampo de rata crezcan en condiciones de cultivo escasas (~ 5,000-10,000 células / cm2) durante 14 días (14 días in vitro).
NOTA: El uso de cultivos dispersos reduce las posibilidades de superposición de neuritas, lo que ayuda a cuantificar el MPS. - Arregle las neuronas usando paraformaldehído al 4% durante 12 minutos a temperatura ambiente. Lave el cubrehojas una vez en BSA al 0,2% en PBS (BSA-PBS), luego incube durante 10 min en una solución al 1% de Triton-X en PBS a temperatura ambiente. Lavar una vez en BSA-PBS.
- Diluir los anticuerpos anti-anquirina G (1:200) en BSA-PBS. Añadir solución de anticuerpos a la cubierta e incubar durante la noche a 4 °C. Opcionalmente, agregue anticuerpos anti-MAP2 de pollo (ver Tabla de Materiales) a la solución de anticuerpos para demarcar el dominio somato-dendrítico.
- Lave las células una vez en BSA-PBS, seguido de Triton-X al 0.1% en PBS, luego haga un lavado final en BSA-PBS.
- Diluir los anticuerpos secundarios anti-ratón marcados con fluoróforo (1:200) (ver Tabla de Materiales) en BSA-PBS, añadir al cobertor e incubar durante 1 h a temperatura ambiente. Lave las células una vez en BSA-PBS, una vez en Triton-X al 0,1% en PBS, luego una vez en PBS.
- Preparar una solución de 1 μM de faloidina etiquetada en PBS (ver Tabla de Materiales) y añadirla a las celdas. Incubar durante 2 h a temperatura ambiente. Lave las células una vez en PBS, una vez en Triton-X al 0,1% en PBS, luego una vez en PBS.
NOTA: La faloidina etiquetada con AlexaFluor488 se usó aquí, pero otras etiquetas también funcionarán. - Para montar el trozo de cubierta en un portaobjetos de vidrio, aplique una gota de medios de montaje en un portaobjetos de vidrio, sumerja el la cubierta en agua desionizada y aplique con una toalla de papel suave (para eliminar el exceso de agua).
- Coloque el trozo de cubierta en el portaobjetos de vidrio. Incubar a temperatura ambiente durante 24 h.
NOTA: No se observaron efectos adversos en la muestra utilizando medios de montaje duros (índice de refracción 1,47 después del curado).
- Coloque el trozo de cubierta en el portaobjetos de vidrio. Incubar a temperatura ambiente durante 24 h.
2. Imágenes
- Si es posible, consulte con el personal de la instalación de microscopía antes de tomar imágenes. Utilice una calculadora de aceite de inmersión (consulte la Tabla de materiales) para seleccionar el aceite de inmersión adecuado para la muestra.
- Una vez que las muestras estén listas, asegúrese de que las cubiertas estén limpias y libres de cualquier residuo o exceso de medios de montaje. Si es necesario, use una punta de algodón sumergida en agua o etanol para limpiar. Coloque la muestra en un microscopio 3D compatible con SIM (consulte la Tabla de materiales) y busque una celda para obtener una imagen.
- Ajuste la potencia de las líneas láser relevantes y los tiempos de exposición para maximizar la relación señal-ruido sin blanquear significativamente la muestra.
NOTA: Una buena relación señal-ruido mostrará una apariencia clara en forma de cuadrícula centrada en la muestra y conducirá a reconstrucciones precisas de alta resolución. Se utilizaron líneas láser de 488 nm y 640 nm para visualizar la F-actina y la anquirina G, respectivamente. - Establezca los límites superior e inferior de la muestra en la dimensión z y proceda a adquirir una pila.
NOTA: Aquí se utilizó el tamaño z-step de 125 nm. - Para una reconstrucción exitosa de la SIM, asegúrese de que el software de microscopía (consulte la Tabla de materiales) tenga un archivo de transferencia óptica (OTF) adecuado para los tintes utilizados.
NOTA: Por lo general, estos son creados y mantenidos por personal especializado. En ausencia de un SOC funcional, también se dispone de herramientas de código abierto para realizar reconstrucciones basadas en estimaciones17. En este trabajo se utilizaron archivos OTF actualizados controlados por personal especializado. - Ejecute el algoritmo de reconstrucción en la pila para obtener una reconstrucción superresoluta. Verifique las reconstrucciones de los artefactos conocidos y, si es necesario, ajuste los parámetros para corregirlos.
NOTA: Los parámetros predeterminados del algoritmo suelen dar resultados precisos. Muchos de estos artefactos involucran algunos patrones repetitivos: líneas rayadas junto con múltiples direcciones en un plano z, 'ghosting' (características repetidas que aparecen en varios planos z) o un patrón hexagonal de 'panal' que emerge en algunas áreas. Estos artefactos a menudo se pueden arreglar con una mejor preparación de la muestra, una mejor relación señal-ruido, ajustando los parámetros del algoritmo de reconstrucción o asegurando que el índice de refracción del aceite de inmersión elegido sea adecuado para el medio de montaje y la muestra. Para una discusión más detallada de los artefactos SIM y una herramienta disponible gratuitamente para verificar la presencia de artefactos, consulte Ball et al. 18 - Compare la reconstrucción de la SIM con una imagen de campo amplio para observar mejoras en la resolución.
- Al realizar una SIM multicolor, utilice el algoritmo de alineación para alinear los diferentes canales correctamente una vez que esté lista una reconstrucción satisfactoria.
NOTA: El algoritmo de alineación utiliza un archivo de referencia de alineación generado utilizando una preparación de cuentas de microesfera según las instrucciones del fabricante del microscopio.
3. Análisis de imágenes
- Los anillos de actina en el MPS tienen una apariencia periódica distintiva. Utilizando un software de análisis de imágenes (ver Tabla de Materiales), cree una imagen de proyección de máxima intensidad utilizando todos los planos focales donde los anillos de actina son visibles.
- En la imagen de proyección de máxima intensidad, dibuje una línea perpendicular a través de anillos adyacentes visibles y registre la intensidad de fluorescencia junto con la función 'Perfil de trazado' de línea del software.
- Para calcular la distancia media entre picos, anote los máximos locales en el perfil de línea y mida la distancia entre los picos de intensidad fluorescente adyacentes individuales.
NOTA: Esto se puede calcular fácilmente, por ejemplo, utilizando la función 'findpeaks' en MATLAB o la plataforma GNU Octave (de código abierto). - Para evaluar la colocalización de diferentes proteínas con anillos de actina en el MPS, ejecute un procedimiento de análisis de colocalización19,20,21 sobre reconstrucciones SIM de actina y la proteína candidata. Dibuje manualmente una selección para definir el AIS como una región de interés para el plugin EzColocalization en la plataforma de software19 y ejecute el análisis para calcular el coeficiente de correlación de Pearson (PCC) de co-localización19,20,21. Un valor de PCC cercano a 1 indica una fuerte colocalización.
NOTA: Este protocolo se resume en la Figura 1.
Resultados
Utilizando neuronas del hipocampo de rata cultivadas y 3D-SIM, se describe un protocolo para visualizar y medir los anillos de actina y otros componentes del MPS en el AIS. Las reconstrucciones de las pilas de imágenes mostraron una clara periodicidad de los anillos de actina (Figura 2A). En nuestras manos, la distancia media entre picos de los anillos de actina en el MPS, visualizada utilizando la faloidina etiquetada con Alexa 488, fue de 190,36 ± 1,7 nm (media ± SEM). Esto está en línea con la distancia promedio reportada anteriormente de ~ 190 nm entre los anillos de actina en el MPS. Del mismo modo, se utilizó un anticuerpo anti-anquirina G para visualizar la anquirina G (Figura 2B). La colocalización de anquirina G y F-actina se probó en el AIS mediante un procedimiento de análisis de colocalización para calcular el PCC de la colocalización19,20,21. El PCC de colocalización de anquirina G y F-actina fluorescencia fue de 0,36 ± 0,03 (media ± SEM, Figura 2B). Como los anillos de anquirina G y actina se unen a la βIV-espectrina en diferentes dominios, no muestran una colocalización significativa. Estos datos fueron adaptados de Abouelezz et al.16

Figura 1: Representación esquemática del protocolo para la preparación de muestras para imágenes 3D-SIM. Las neuronas del hipocampo se cosechan de embriones de rata, se disocian y se dejan crecer en hojas de vidrio en cultivo durante 14 días. Las células se fijan y tiñen con faloidina marcada y anticuerpos apropiados, luego se montan en portaobjetos de vidrio para obtener imágenes 3D-SIM. Haga clic aquí para ver una versión más grande de esta figura.
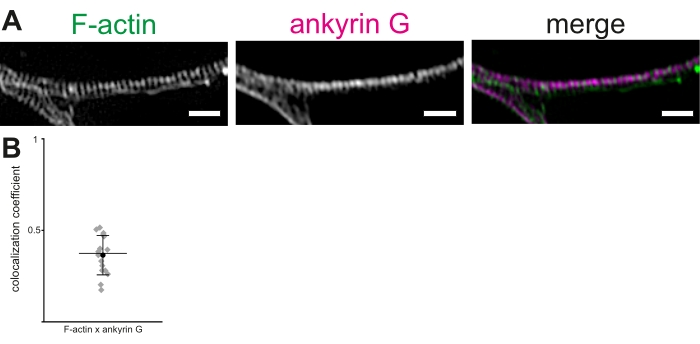
Figura 2: Reconstrucción 3D-SIM del esqueleto periódico de membrana (MPS) en el segmento inicial del axón (AIS). (A) F-actina (verde) y anquirina G (magenta) muestran una distribución regular en el AIS, visualizada por 3D-SIM. Barra de escala = 1 μm. (B) Coeficientes de correlación de Pearson (PCC) de colocalización de anquirina G con F-actina en el MPS en el AIS. El PCC medio de la anquirina G fue de 0,36 (círculo negro). Los diamantes grises representan celdas individuales (n = 16), la línea media representa la mediana, las barras de error representan los percentiles 25 y 75. Los datos están adaptados de Abouelezz et al.16Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito aquí proporciona un método para visualizar y medir las proteínas MPS utilizando la técnica de superresolución. Como los anillos de actina y otros componentes de MPS muestran una periodicidad de ~ 190 nm9,10, los enfoques de imágenes convencionales de difracción limitada no pueden revelar los detalles del MPS. Varias configuraciones de microscopía pueden resolver estructuras limitadas por difracción en superresolución, y SIM representa una opción robusta y sin complicaciones. Es importante destacar que SIM es compatible con los fluoróforos más utilizados, proporcionando una flexibilidad significativa. Además, la SIM es eficaz para visualizar estructuras potencialmente tenues en el MPS, como anillos de actina en neuronas tratadas con latrunculina22, así como neuronas vivas15.
Un aspecto esencial para el éxito de este protocolo es preservar la integridad del MPS en primer lugar. Los pasos más críticos para el éxito de las imágenes SIM ocurren durante la preparación de la muestra. Por ejemplo, la fijación moderada (4% de PFA durante 12 min a temperatura ambiente) y la permeabilización fuerte (1% de Triton-X durante 10 min) proporcionan los mejores resultados. Es crucial tener en cuenta que los tratamientos severos que pueden ser necesarios para preparaciones específicas pueden tener un efecto negativo en la integridad estructural del MPS. Por lo tanto, tal vez sea mejor considerar la modificación de dichos tratamientos para maximizar la preservación del MPS.
El otro factor crucial a considerar al preparar muestras para imágenes es maximizar la densidad de etiquetado. Idealmente, cada molécula sería etiquetada y detectada. Por ejemplo, el anticuerpo anti-anquirina G utilizado en este experimento se usa comúnmente para etiquetar el AIS. Proporciona un rendimiento excepcional en microscopía de fluorescencia convencional, incluso cuando se usa a una dilución de 1:1000 e incuba durante solo 1 h a temperatura ambiente. Sin embargo, para obtener una buena densidad de etiquetado para la microscopía de superresolución, es altamente efectivo usar 5 veces esa concentración (1:200) e incubar el anticuerpo durante la noche a 4 ° C. Si bien los requisitos específicos para cada anticuerpo o técnica de etiquetado variarán y deberán determinarse experimentalmente, tal vez sea útil tener esto en cuenta.
Además, es esencial tener en cuenta que lograr una alta relación señal-ruido se presta bien a reconstrucciones de SIM precisas y exitosas. Una buena regla general es que el patrón de cuadrícula debe ser visible en las imágenes individuales una vez que se activa la modalidad SIM. Sin embargo, esto no siempre es posible.
Finalmente, es esencial tener en cuenta que SIM se encuentra entre las técnicas de superresolución más débiles para resolver la potencia14. Por lo tanto, si bien generalmente es suficiente para revelar la periodicidad y la organización general de las proteínas MPS, es significativamente menos capaz de proporcionar detalles sobre sus interacciones que la microscopía de reconstrucción óptica estocástica (STORM)10. Además, la utilidad de la técnica descrita aquí se limita al estudio de proteínas para las que se dispone de un anticuerpo específico y de buen rendimiento. Sin embargo, esto puede evitarse en parte mediante la expresión exógena de proteínas marcadas15.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Pirta Hotulainen es reconocida por sus comentarios críticos, invaluables para preparar este manuscrito. La Dra. Rimante Minkeviciene es reconocida por su ayuda en la preparación de los cultivos neuronales utilizados para los experimentos originales. Todas las imágenes se realizaron en la Unidad de Imágenes de Biomedicum. Este trabajo fue apoyado por la Academia de Finlandia (D.M., SA 266351) y el Programa de Doctorado Brain & Mind (A.A.)
Materiales
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 3524 | |
| 4% Paraformaldehyde | |||
| Alexa-488 Phalloidin | ThermoFisher | A12379 | |
| Alexa-647 anti-mouse | ThermoFisher | A31571 | |
| Anti-Ankyrin G antibody | UC Davis/NIH NeuroMab Facility, Clone 106/36 | 75-146 | |
| Anti-MAP2 antibody | Merck Millipore | AB5543 | |
| B-27 | Invitrogen | 17504044 | |
| Bovine Serum Albumin (BSA) | BioWest | P6154 | |
| Deltavision OMX SR | GE Healthcare Life Sciences | N/A | |
| Fiji software package | ImageJ | ||
| GNU Octave | GNU | ||
| High performance coverslips | Marienfeld | 117530 | |
| Immersion Oil Calculator | Cytiva Life Sciences | https://tinyurl.com/ImmersionOilCalculator | |
| L-Glutamine | VWR | ICNA1680149 | |
| MATLAB R2020a | Mathworks | ||
| Neurobasal media | Invitrogen | 21103049 | |
| OMX SR | Delta Vision OMX | ||
| Primocin | InvivoGen | ant-pm-1 | |
| ProLong Gold mounting media | Invitrogen | P10144 | |
| softWoRx Deconvolution | Cytiva Life Sciences | ||
| Superfrost Slides | Epredia | ISO 8037/1 | |
| TetraSpeck microspheres 0.1 µm | ThermoFisher | T7279 | |
| Triton-X | Sigma | X100 |
Referencias
- Leterrier, C. The Axon initial segment, 50 years later: A nexus for neuronal organization and function. Current Topics in Membranes. 77, 185-233 (2016).
- Leterrier, C., Dargent, B. No pasaran! Role of the axon initial segment in the regulation of protein transport and the maintenance of axonal identity. Seminars in Cell & Developmental Biology. 27, 44-51 (2014).
- Brachet, A., et al. Ankyrin G restricts ion channel diffusion at the axonal initial segment before the establishment of the diffusion barrier. Journal of Cell Biology. 191 (2), 383-395 (2010).
- Nakada, C., et al. Accumulation of anchored proteins forms membrane diffusion barriers during neuronal polarization. Nature Cell Biology. 5 (7), 626-632 (2003).
- Song, A. H., et al. A selective filter for cytoplasmic transport at the axon initial segment. Cell. 136 (6), 1148-1160 (2009).
- Sun, X., et al. Selective filtering defect at the axon initial segment in Alzheimer's disease mouse models. Proceedings of the National Academy of Sciences of the United States of America. 111 (39), 14271-14276 (2014).
- Winckler, B., Forscher, P., Mellman, I. A diffusion barrier maintains distribution of membrane proteins in polarized neurons. Nature. 397 (6721), 698-701 (1999).
- Kole, M. H., et al. Action potential generation requires a high sodium channel density in the axon initial segment. Nature Neuroscience. 11 (2), 178-186 (2008).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339 (6118), 452-456 (2013).
- Leterrier, C., et al. Nanoscale architecture of the axon initial segment reveals an organized and robust scaffold. Cell Reports. 13 (12), 2781-2793 (2015).
- Leterrier, C. The axon initial segment: An updated viewpoint. The Journal of Neuroscience. 38 (9), 2135-2145 (2018).
- Hamdan, H., et al. Mapping axon initial segment structure and function by multiplexed proximity biotinylation. Nature Communications. 11 (1), 100 (2020).
- Zhou, R., et al. Proteomic and functional analyses of the periodic membrane skeleton in neurons. bioRxiv. , (2020).
- Valli, J., et al. Seeing beyond the limit: A guide to choosing the right super-resolution microscopy technique. Journal of Biological Chemistry. 297 (1), 100791 (2021).
- Wang, T., et al. Radial contractility of actomyosin rings facilitates axonal trafficking and structural stability. Journal of Cell Biology. 219 (5), 201902001 (2020).
- Abouelezz, A., Stefen, H., Segerstråle, M., Micinski, D., Minkeviciene, R., Lahti, L., Hardeman, E., Gunning, P., Hoogenraad, C., Taira, T., Fath, T., Hotulainen, P. Tropomyosin Tpm3.1 is required to maintain the structure and function of the axon initial segment. iScience. 23 (5), 101053 (2020).
- Muller, M., Monkemoller, V., Hennig, S., Hubner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7, 10980 (2016).
- Ball, G., et al. SIMcheck: a toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5, 15915 (2015).
- Stauffer, W., Sheng, H., Lim, H. N. EzColocalization: An ImageJ plugin for visualizing and measuring colocalization in cells and organisms. Scientific Reports. 8 (1), 15764 (2018).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Lahti, L. Data analysis supplement to the research article Abouelezz, Stefen, Segerstråle, Micinski, Minkeviciene, Lahti, Hardeman, Gunning, Hoogenraad, Taira, Fath, & Hotulainen. Tropomyosin Tpm3.1 Is Required to Maintain the Structure and Function of the Axon Initial Segment. , (2021).
- Abouelezz, A., Micinski, D., Lipponen, A., Hotulainen, P. Sub-membranous actin rings in the axon initial segment are resistant to the action of latrunculin. Journal of Biological Chemistry. 400 (9), 1141-1146 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados