Method Article
תכונות מדידה של השלד התקופתי של הממברנה של המקטע ההתחלתי של אקסון באמצעות מיקרוסקופיית תאורה מובנית בתלת-ממד (3D-SIM)
In This Article
Summary
הפרוטוקול הנוכחי מתאר שיטה לדמיין ולמדוד טבעות אקטין ורכיבים אחרים של השלד התקופתי של הממברנה של המקטע הראשוני של האקסון באמצעות נוירונים היפוקמפליים חולדה מתורבתת ומיקרוסקופיית תאורה מובנית 3D (3D-SIM).
Abstract
המגזר הראשוני של האקסון (AIS) הוא האתר שבו פוטנציאל פעולה ליזום ומהווה מסנן תחבורה ומחסום דיפוזיה התורמים לשמירה על הקוטביות העצבית על ידי מיון מטען סומטו-דנדריטי. שלד תקופתי ממברנה (MPS) הכולל טבעות אקטין תקופתיות מספק פיגום לעיגון חלבוני AIS שונים, כולל חלבונים מבניים ותעלות יונים שונות. למרות גישות פרוטאומיות האחרונות זיהו מספר ניכר של רכיבי AIS חדשניים, פרטים על המבנה של MPS ואת התפקידים של מרכיביו בודדים חסרים. המרחק בין טבעות אקטין בודדות ב- MPS (~ 190 ננומטר) מחייב העסקה של טכניקות מיקרוסקופיות ברזולוציית-על כדי לפתור את הפרטים המבניים של ה- MPS. פרוטוקול זה מתאר שיטה לשימוש בתאי עצב היפוקמפוס חולדה מתורבתת כדי לבחון את הלוקליזציה המדויקת של חלבון AIS ב- MPS ביחס לטבעות אקטין תת-ממברניות באמצעות מיקרוסקופיית תאורה מובנית בתלת-ממד (3D-SIM). בנוסף, מתוארת גם גישה אנליטית להערכה כמותית של תקופתיות של רכיבים בודדים ואת מיקומם ביחס לטבעות אקטין.
Introduction
פלח האקסון ההתחלתי (AIS) הוא אזור קצר וייחודי של האקסון הפרוקסימלי של נוירונים בעלי חוליות1. ה- AIS כולל מסנן תחבורה ומחסום דיפוזיה החיוני לשמירה על הקוטביות העצבית על ידי מיון מטען סומטו-דנדריטי2,3,4,5,5,6,7. בנוסף, המבנה הייחודי של AIS מאפשר לו להכיל אשכולות של תעלות יונים מגודרות מתח המאפשרים את תפקידו כאתר של ייזום פוטנציאלי פעולה8. קומפלקס מבני יציב מאוד עומד בבסיס הפונקציות הייחודיות של ה- AIS. מחקרים בעשור האחרון חשפו את נוכחותו של שלד תקופתי ממברנה (MPS) המכיל טבעות אקטין המחוברות על ידי ספקרין ומספק פיגומים לעיגון חלבוני AIS שונים9,10.
המרחק בין טבעות אקטין ב- MPS (~ 190 ננומטר)9,10 הוא תחת מגבלת הרזולוציה של מיקרוסקופיית אור קונבנציונלית. ניסיונות מוקדמים להשתמש במיקרוסקופיה אלקטרונית כדי לדמיין את ה- MPS לא הצליחו, שכן הליכי ההכנה הקשים המעורבים לא הצליחו לשמר את המבנה של MPS. לכן, טכניקות מיקרוסקופיות ברזולוציית-על הוכיחו את עצמן לא יסולא בפז בהבהרת חלק מהפרטים המבניים של MPS11. עם זאת, ההבנה של קומפלקס מבני AIS, הזהות והפונקציות של מרכיביו, ואת הרגולציה המרחבית שלה עדיין אינם שלמים. מחקרים פרוטאומיים אחרונים הצליחו ליצור רשימה גדולה של חלבונים המתאימים ל- AIS קרוב לרכיבים מבניים של AIS12,13. ובכל זאת, פרטים על תפקידם ומיקומם המדויק במתחם AIS חסרים. לפיכך, טכניקות מיקרוסקופיות ברזולוציית-על משמשות ככלי חיוני לבחינת המיקומים המדויקים של חלבונים אלה ביחס לרכיבי MPS אחרים ולחקור את תפקידיהם. מספר טכניקות מיקרוסקופיה אור יכול להשיג רזולוציות גבוהות יותר מאשר מגבלת עקיפה של אור, חלקם אפילו מסוגל לוקליזציה של מולקולות בודדות. עם זאת, רבות מטכניקות אלה דורשות בדרך כלל פלואורופורים מיוחדים או מאגרי הדמיה, ורכישת תמונה היא לעתים קרובות אינטנסיבית בזמן14.
מיקרוסקופיית תאורה מובנית תלת-ממדית (3D-SIM), בשל קלות השימוש שלה ודרישות פשוטות להכנת מדגם, אינה דורשת ריאגנטים מיוחדים להדמיה או הכנה מדגמית, פועלת היטב עם מגוון רחב של פלואורופורים ודגימות, ניתן ליישם אותה בקלות בצבעים מרובים, ומסוגלת להדמיית תאים חיים15. בעוד שהרזולוציה הטובה ביותר האפשרית SIM מציעה (~ 120 ננומטר) נמוכה בהשוואה לטכניקות רבות אחרות של רזולוציית-על, היא מספיקה עבור יישומים רבים (לדוגמה, לפתרון הרכיבים של MPS בתאי עצב). לכן, חשוב לשקול את הדרישה ליישומים ספציפיים כדי לקבוע אם SIM הוא בחירה מתאימה או אם יש צורך ברזולוציה גבוהה עוד יותר. כאן, פרוטוקול מתואר לשימוש בנוירונים היפוקמפוסים מתורבתים ומיקרוסקופיית תאורה מובנית 3D (3D-SIM) כדי לבחון את המיקום והארגון של חלבוני AIS putative ביחס לטבעות actin ב- MPS, כפי שיושם ב Abouelezz et al.16
Protocol
נוירונים ההיפוקמפוס העיקריים המשמשים בניסויים אלה נקצרו16 מהיום העוברי 17 עוברי חולדה Wistar משני המינים תחת ההנחיות האתיות של אוניברסיטת הלסינקי והחוק הפיני.
1. הכנה לדוגמה
- על כיסויי זכוכית באיכות גבוהה, לאפשר נוירונים היפוקמפוס חולדה לגדול בתנאי תרבות דלילה (~ 5,000-10,000 תאים / cm2) במשך 14 ימים (14 ימים במבחנה).
הערה: שימוש בתרבויות דלילות מקטין את הסיכוי לנוריטים חופפים, דבר המסייע לכמת את ה- MPS. - תקן נוירונים באמצעות 4% paraformaldehyde במשך 12 דקות בטמפרטורת החדר. לשטוף את כיסוי פעם אחת ב 0.2% BSA ב PBS (BSA-PBS), ולאחר מכן לדגור במשך 10 דקות בתמיסה של 1% של טריטון-X ב PBS בטמפרטורת החדר. לשטוף פעם אחת בBSA-PBS.
- לדלל נוגדנים נגד אנקירין G (1:200) ב- BSA-PBS. הוסיפו את תמיסת הנוגדנים לכיסוי ודגרו למשך הלילה ב-4 מעלות צלזיוס. לחלופין, הוסיפו נוגדני עוף נגד MAP2 (ראו טבלת חומרים) לתמיסת הנוגדנים כדי לסמן את התחום הסומטו-דנדריטי.
- לשטוף תאים פעם אחת ב- BSA-PBS, ואחריו 0.1% טריטון-X ב- PBS, ולאחר מכן לעשות שטיפה סופית ב- BSA-PBS.
- לדלל נוגדנים משניים נגד עכברים מתויגים פלואורופור (1:200) (ראה טבלת חומרים) ב- BSA-PBS, להוסיף את כיסוי, ודגור במשך 1 שעה בטמפרטורת החדר. לשטוף את התאים פעם אחת ב- BSA-PBS, פעם ב 0.1% טריטון-X ב- PBS, ולאחר מכן פעם אחת ב- PBS.
- הכן פתרון 1 μM של phalloidin מתויג ב- PBS (ראה טבלת חומרים) ולהוסיף אותו לתאים. דגירה ל-2 שעות בטמפרטורת החדר. לשטוף תאים פעם אחת ב-PBS, פעם ב-0.1% טריטון-X ב-PBS, ואז פעם אחת ב-PBS.
הערה: AlexaFluor488 מתויג phalloidin שימש כאן, אבל תגים אחרים יעבדו גם. - להרכבה על כיסוי הכיסוי על מגלשת זכוכית, יש למרוח טיפה של מדיית הרכבה על מגלשת זכוכית, לטבול את כיסוי הכיסוי במים deionized, וטפטוף באמצעות מגבת נייר רכה (כדי להסיר עודפי מים).
- מניחים את כיסוי הכיסוי על מגלשת הזכוכית. דגירה בטמפרטורת החדר למשך 24 שעות.
הערה: לא נצפו תופעות לוואי על המדגם באמצעות מדיה הרכבה קשה (אינדקס שבירה 1.47 לאחר ריפוי).
- מניחים את כיסוי הכיסוי על מגלשת הזכוכית. דגירה בטמפרטורת החדר למשך 24 שעות.
2. הדמיה
- במידת האפשר, יש להתייעץ עם אנשי מתקן המיקרוסקופיה לפני ההדמיה. השתמש במחשבון שמן טבילה (ראה טבלת חומרים) כדי לבחור את שמן הטבילה המתאים לדגימה.
- לאחר שהדגימות מוכנות, ודא שהכיסויים נקיים ונקיים מכל שאריות או מדיית הרכבה עודפת. במידת הצורך, יש להשתמש בקצה כותנה טבול במים או באתנול לניקוי. מקם את הדגימה במיקרוסקופ תלת-ממדי התומך ב-SIM (ראה טבלת חומרים) ומצא תא לתמונה.
- התאם את העוצמה של קווי הלייזר הרלוונטיים ואת זמני החשיפה כדי למקסם את יחס האות לרעש מבלי להלבין באופן משמעותי את המדגם.
הערה: יחס אות לרעש טוב יציג מראה ברור דמוי רשת המתמקד במדגם ויוביל לשחזורים מדויקים ברזולוציה גבוהה. 488 ננומטר ו 640 ננומטר קווי לייזר שימשו לדמיין F-actin ו ankyrin G, בהתאמה. - הגדר את הגבולות העליונים והתחתונים של המדגם בממד z והמשך לרכוש מחסנית.
הערה: גודל z-שלב של 125 ננומטר שימש כאן. - לשחזור SIM מוצלח, ודא שלתוכנת המיקרוסקופיה (ראה טבלת חומרים) יש קובץ העברה אופטית (OTF) המתאים לצבעים המשומשים.
הערה: אלה נוצרים ומתוחזקים בדרך כלל על ידי אנשי צוות מיוחדים. בהיעדר OTF פונקציונלי, כלי קוד פתוח זמינים גם לביצוע שחזורים בהתבסס על הערכות17. בעבודה זו, קבצי OTF עדכניים שימשו הנשלטים על ידי אנשי צוות מיוחדים. - הפעל את אלגוריתם השחזור על הערימה כדי לקבל שחזור סופר נפתר. בדוק את השחזורים עבור חפצים ידועים, ואם יש צורך, להתאים את הפרמטרים כדי לתקן אותם.
הערה: פרמטרי האלגוריתם המוגדרים כברירת מחדל מספקים בדרך כלל תוצאות מדויקות. רבים מהממצאים הללו כוללים כמה דפוסים חוזרים: קווים מפוספסים יחד עם כיוונים מרובים במישור z אחד, 'ghosting' (תכונות חוזרות ונשנות המופיעות במישורי z שונים), או דפוס 'חלת דבש' משושה המתהווה באזורים מסוימים. לעתים קרובות ניתן לתקן חפצים אלה עם הכנה מדגם טובה יותר, יחס אות לרעש טוב יותר, התאמת הפרמטרים של אלגוריתם השחזור, או הבטחת אינדקס השבירה של שמן הטבילה שנבחר מתאים למדיום ההרכבה ולדגימה. לדיון מפורט יותר בממצאי SIM וכלי זמין באופן חופשי כדי לבדוק את נוכחותם של חפצים, ראה Ball et al. 18 - השווה את שחזור ה-SIM לתמונת שדה רחבה כדי לבחון שיפורים ברזולוציה.
- בעת ביצוע SIM מרובה צבעים, השתמש באלגוריתם היישור כדי ליישר את הערוצים השונים כראוי לאחר ששחזור משביע רצון מוכן.
הערה: אלגוריתם היישור משתמש בקובץ הפניה ליישור שנוצר באמצעות הכנת חרוזים מיקרוספירה בהתאם להוראת יצרן המיקרוסקופ.
3. ניתוח תמונה
- לטבעות אקטין ב- MPS יש מראה תקופתי ייחודי. באמצעות תוכנת ניתוח תמונות (ראה טבלת חומרים), צור תמונת הקרנה בעוצמה מרבית באמצעות כל מישורי המוקד שבהם טבעות אקטין גלויות.
- בתמונת ההקרנה בעוצמה המרבית, צייר קו מאונך על-פני טבעות סמוכות גלויות לעין ורשום את עוצמת הפלואורסצנטיות יחד עם הפונקציה 'Plot Profile' של השורה של התוכנה.
- כדי לחשב את המרחק הבין-שיאי הממוצע, שים לב למקסימום המקומי בפרופיל הקו ומדוד את המרחק בין פסגות עוצמה פלואורסצנטיות סמוכות בודדות.
הערה: ניתן לחשב זאת בקלות, לדוגמה, באמצעות הפונקציה 'findpeaks' ב- MATLAB או בפלטפורמת גנו אוקטבה (קוד פתוח). - כדי להעריך את colocalization של חלבונים שונים עם טבעות אקטין ב- MPS, להפעיל הליך ניתוח colocalization19,20,21 על שחזורי SIM של אקטין ואת חלבון המועמד. צייר באופן ידני בחירה כדי להגדיר את AIS כאזור עניין עבור תוסף EzColocalization בפלטפורמת התוכנה19 ולהפעיל את הניתוח כדי לחשב את מקדם המתאם של פירסון (PCC) של לוקליזציה משותפת19,20,21. ערך PCC קרוב ל- 1 מציין colocalization חזק.
הערה: פרוטוקול זה מסוכם באיור 1.
תוצאות
באמצעות נוירונים היפוקמפוס חולדה מתורבתת 3D-SIM, פרוטוקול מתואר לדמיין ולמדוד טבעות אקטין ורכיבים אחרים של MPS ב- AIS. שחזורים של ערימות תמונות הראו מחזוריות ברורה של טבעות אקטין (איור 2A). בידיים שלנו, המרחק הבין-שיא הממוצע של טבעות אקטין ב- MPS, שדמיינו באמצעות אלקסה 488-מתויג phalloidin, היה 190.36 ± 1.7 ננומטר (ממוצע ± SEM). זה עולה בקנה אחד עם המרחק הממוצע שדווח בעבר של ~ 190 ננומטר בין טבעות אקטין ב- MPS. באופן דומה, נוגדן G אנטי-אנקרין שימש לדמיין אנקרין G (איור 2B). colocalization של ankyrin G ו- F-actin נבדק ב- AIS באמצעות הליך ניתוח colocalization כדי לחשב את ה- PCC של לוקליזציה משותפת19,20,21. ה- PCC של colocalization של פלורסצנטיות אנקירין G ו- F-actin היה 0.36 ± 0.03 (ממוצע ± SEM, איור 2B). כמו אנקירין G וטבעות actin לקשור βIV-ספקטרין בתחומים שונים, הם אינם מראים colocalization משמעותי. נתונים אלה הותאמו מאבולז ואח' 16

איור 1: ייצוג סכמטי של הפרוטוקול להכנה מדגמית להדמיית 3D-SIM. נוירונים בהיפוקמפוס נקצרים מעוברי חולדה, מנותקים, ומותר להם לגדול על כיסויי זכוכית בתרבות במשך 14 יום. לאחר מכן התאים קבועים ומוכתמים באמצעות פאלואידין מתויג ונוגדנים מתאימים, ולאחר מכן מותקנים על שקופיות זכוכית להדמיית 3D-SIM. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
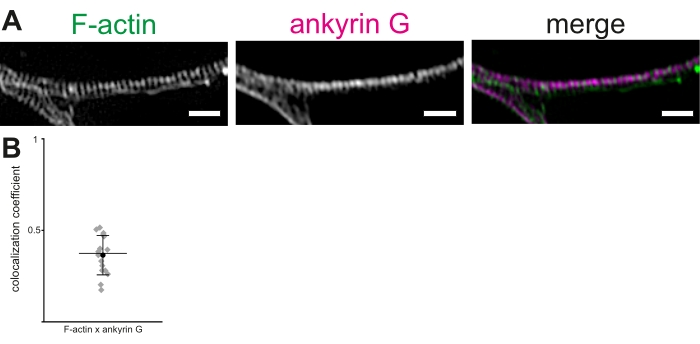
איור 2: שחזור תלת-ממדי-SIM של השלד התקופתי של הממברנה (MPS) במקטע הראשוני של האקסון (AIS). (A) F-actin (ירוק) ו-ankyrin G (מגנטה) מציגים התפלגות קבועה ב- AIS, המודמית על-ידי 3D-SIM. סרגל קנה מידה = 1 מיקרומטר. (B) מקדמי המתאם של פירסון (PCC) של colocalization של ankyrin G עם F-actin ב- MPS ב- AIS. PCC הממוצע של ankyrin G היה 0.36 (עיגול שחור). יהלומים אפורים מייצגים תאים בודדים (n = 16), קו האמצע מייצג את החציון, קווי שגיאה מייצגים את האחוזונים ה-25 וה-75. הנתונים מותאמים מ Abouelezz et al.16פלאש לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המתואר כאן מספק שיטה להדמיה ומדידה של חלבוני MPS באמצעות טכניקת פתרון העל. כאשר טבעות actin ורכיבי MPS אחרים מציגים תקופתיות של ~ 190 nm9,10, גישות הדמיה קונבנציונליות מוגבלות עקיפה אינן יכולות לחשוף את פרטי ה- MPS. מספר הגדרות מיקרוסקופיה עשויות לפתור מבנים מוגבלים בעקיפה ברזולוציית-על, ו-SIM מייצג אפשרות חזקה ולא מסובכת. חשוב לציין, SIM תואם לפלורופורים הנפוצים ביותר, ומספק גמישות משמעותית. יתר על כן, SIM יעיל בהדמיית מבנים עמומים פוטנציאליים ב- MPS, כגון טבעות actin בתאי עצב שטופלו בלטרונקולין22, כמו גם נוירונים חיים15.
היבט חיוני להצלחת פרוטוקול זה הוא שמירה על שלמות ה- MPS מלכתחילה. השלבים הקריטיים ביותר להדמיית SIM מוצלחת מתרחשים במהלך הכנת מדגם. לדוגמה, קיבוע מתון (4% PFA במשך 12 דקות בטמפרטורת החדר) וחדירות חזקה (1% טריטון-X למשך 10 דקות) מספקים את התוצאות הטובות ביותר. חשוב לזכור כי טיפולים קשים שעשויים להידרש להכנות ספציפיות עשויים להיות בעלי השפעה שלילית על השלמות המבנית של MPS. לכן, אולי עדיף לשקול שינוי טיפולים כאלה כדי למקסם את השימור של MPS.
הגורם המכריע השני שיש לקחת בחשבון בעת הכנת דגימות להדמיה הוא למקסם את צפיפות התוויות. באופן אידיאלי, כל מולקולה תהיה מתויגת ומזוהה. לדוגמה, נוגדן אנטי-אנקירין G המשמש בניסוי זה משמש בדרך כלל כדי לתייג את AIS. הוא מספק ביצועים יוצאי דופן במיקרוסקופיה פלואורסצנטית קונבנציונלית, גם כאשר נעשה שימוש בדילול של 1:1000 ודגר רק 1 שעה בטמפרטורת החדר. עם זאת, כדי להשיג צפיפות תיוג טובה עבור מיקרוסקופיה ברזולוציה סופר, זה יעיל מאוד להשתמש 5-פי 5 ריכוז (1:200) ולדגור את הנוגדן לילה ב 4 °C (60 °F). בעוד הדרישות הספציפיות עבור כל נוגדן או טכניקת תיוג ישתנו ויש לקבוע באופן ניסיוני, זה אולי מועיל כדי לזכור את זה.
בנוסף, חשוב לציין כי השגת יחס אות לרעש גבוה משאילה את עצמה היטב לשחזורי SIM מדויקים ומוצלחים. כלל אצבע טוב הוא שתבנית הרשת צריכה להיות גלויה בתמונות הבודדות לאחר הפעלת שיטת ה- SIM. עם זאת, זה לא תמיד אפשרי.
לבסוף, חשוב לציין כי SIM הוא בין טכניקות פתרון העל החלשות ביותר בפתרון כוח14. לכן, בעוד זה בדרך כלל מספיק לחשיפת תקופתיות וארגון כולל של חלבוני MPS, זה באופן משמעותי פחות מסוגל לספק פרטים על האינטראקציות שלהם מאשר מיקרוסקופיה שחזור אופטי סטוכסטי (STORM)10. יתר על כן, התועלת של הטכניקה המתוארת כאן מוגבלת לחקר חלבונים שעבורם קיים נוגדן ספציפי בעל ביצועים טובים. עם זאת, זה יכול להיות עקף חלקית באמצעות ביטוי אקסוגני של חלבונים מתויגים15.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ד"ר פירטה חוטואלינן מוכרת על הערותיה הביקורתיות, שלא יסולא בפז על הכנת כתב היד הזה. ד"ר רימנטה מינקביצ'ין מוכרת על עזרתה בהכנת התרבויות העצביות ששימשו לניסויים המקוריים. כל ההדמיה בוצעה ביחידת ההדמיה הביו-רפואית. עבודה זו נתמכה על ידי האקדמיה של פינלנד (D.M., SA 266351) ותוכנית הדוקטורט מוח ונפש (A.A.)
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 3524 | |
| 4% Paraformaldehyde | |||
| Alexa-488 Phalloidin | ThermoFisher | A12379 | |
| Alexa-647 anti-mouse | ThermoFisher | A31571 | |
| Anti-Ankyrin G antibody | UC Davis/NIH NeuroMab Facility, Clone 106/36 | 75-146 | |
| Anti-MAP2 antibody | Merck Millipore | AB5543 | |
| B-27 | Invitrogen | 17504044 | |
| Bovine Serum Albumin (BSA) | BioWest | P6154 | |
| Deltavision OMX SR | GE Healthcare Life Sciences | N/A | |
| Fiji software package | ImageJ | ||
| GNU Octave | GNU | ||
| High performance coverslips | Marienfeld | 117530 | |
| Immersion Oil Calculator | Cytiva Life Sciences | https://tinyurl.com/ImmersionOilCalculator | |
| L-Glutamine | VWR | ICNA1680149 | |
| MATLAB R2020a | Mathworks | ||
| Neurobasal media | Invitrogen | 21103049 | |
| OMX SR | Delta Vision OMX | ||
| Primocin | InvivoGen | ant-pm-1 | |
| ProLong Gold mounting media | Invitrogen | P10144 | |
| softWoRx Deconvolution | Cytiva Life Sciences | ||
| Superfrost Slides | Epredia | ISO 8037/1 | |
| TetraSpeck microspheres 0.1 µm | ThermoFisher | T7279 | |
| Triton-X | Sigma | X100 |
References
- Leterrier, C. The Axon initial segment, 50 years later: A nexus for neuronal organization and function. Current Topics in Membranes. 77, 185-233 (2016).
- Leterrier, C., Dargent, B. No pasaran! Role of the axon initial segment in the regulation of protein transport and the maintenance of axonal identity. Seminars in Cell & Developmental Biology. 27, 44-51 (2014).
- Brachet, A., et al. Ankyrin G restricts ion channel diffusion at the axonal initial segment before the establishment of the diffusion barrier. Journal of Cell Biology. 191 (2), 383-395 (2010).
- Nakada, C., et al. Accumulation of anchored proteins forms membrane diffusion barriers during neuronal polarization. Nature Cell Biology. 5 (7), 626-632 (2003).
- Song, A. H., et al. A selective filter for cytoplasmic transport at the axon initial segment. Cell. 136 (6), 1148-1160 (2009).
- Sun, X., et al. Selective filtering defect at the axon initial segment in Alzheimer's disease mouse models. Proceedings of the National Academy of Sciences of the United States of America. 111 (39), 14271-14276 (2014).
- Winckler, B., Forscher, P., Mellman, I. A diffusion barrier maintains distribution of membrane proteins in polarized neurons. Nature. 397 (6721), 698-701 (1999).
- Kole, M. H., et al. Action potential generation requires a high sodium channel density in the axon initial segment. Nature Neuroscience. 11 (2), 178-186 (2008).
- Xu, K., Zhong, G., Zhuang, X. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. Science. 339 (6118), 452-456 (2013).
- Leterrier, C., et al. Nanoscale architecture of the axon initial segment reveals an organized and robust scaffold. Cell Reports. 13 (12), 2781-2793 (2015).
- Leterrier, C. The axon initial segment: An updated viewpoint. The Journal of Neuroscience. 38 (9), 2135-2145 (2018).
- Hamdan, H., et al. Mapping axon initial segment structure and function by multiplexed proximity biotinylation. Nature Communications. 11 (1), 100 (2020).
- Zhou, R., et al. Proteomic and functional analyses of the periodic membrane skeleton in neurons. bioRxiv. , (2020).
- Valli, J., et al. Seeing beyond the limit: A guide to choosing the right super-resolution microscopy technique. Journal of Biological Chemistry. 297 (1), 100791 (2021).
- Wang, T., et al. Radial contractility of actomyosin rings facilitates axonal trafficking and structural stability. Journal of Cell Biology. 219 (5), 201902001 (2020).
- Abouelezz, A., Stefen, H., Segerstråle, M., Micinski, D., Minkeviciene, R., Lahti, L., Hardeman, E., Gunning, P., Hoogenraad, C., Taira, T., Fath, T., Hotulainen, P. Tropomyosin Tpm3.1 is required to maintain the structure and function of the axon initial segment. iScience. 23 (5), 101053 (2020).
- Muller, M., Monkemoller, V., Hennig, S., Hubner, W., Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nature Communications. 7, 10980 (2016).
- Ball, G., et al. SIMcheck: a toolbox for successful super-resolution structured illumination microscopy. Scientific Reports. 5, 15915 (2015).
- Stauffer, W., Sheng, H., Lim, H. N. EzColocalization: An ImageJ plugin for visualizing and measuring colocalization in cells and organisms. Scientific Reports. 8 (1), 15764 (2018).
- Dunn, K. W., Kamocka, M. M., McDonald, J. H. A practical guide to evaluating colocalization in biological microscopy. American Journal of Physiology-Cell Physiology. 300 (4), 723-742 (2011).
- Lahti, L. Data analysis supplement to the research article Abouelezz, Stefen, Segerstråle, Micinski, Minkeviciene, Lahti, Hardeman, Gunning, Hoogenraad, Taira, Fath, & Hotulainen. Tropomyosin Tpm3.1 Is Required to Maintain the Structure and Function of the Axon Initial Segment. , (2021).
- Abouelezz, A., Micinski, D., Lipponen, A., Hotulainen, P. Sub-membranous actin rings in the axon initial segment are resistant to the action of latrunculin. Journal of Biological Chemistry. 400 (9), 1141-1146 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved