Method Article
Робастная дифференциация ИПСК человека в чистую популяцию адипоцитов для изучения адипоцит-ассоциированных заболеваний
В этой статье
Резюме
Протокол позволяет генерировать чистую популяцию адипоцитов из индуцированных плюрипотентных стволовых клеток (ИПСК). Ретиноевая кислота используется для дифференцировки ИПСК в мезенхимальные стволовые клетки (МСК), которые используются для производства адипоцитов. Затем для получения чистых адипоцитов используется подход сортировки, основанный на окрашивании Нила в красный цвет.
Аннотация
Последние достижения в технологии индуцированных плюрипотентных стволовых клеток (iPSC) позволили генерировать различные типы клеток, включая адипоциты. Однако современные методы дифференцировки имеют низкую эффективность и не дают однородной популяции адипоцитов. Здесь мы обходим эту проблему, используя полностью транс-ретиноевый метод для получения мезенхимальных стволовых клеток (МСК) с высоким выходом. Регулируя пути, регулирующие пролиферацию, выживание и адгезию клеток, наша стратегия дифференцировки позволяет эффективно генерировать эмбриональные тела (БЭ), которые дифференцируются в чистую популяцию мультипотентных МСК. Большое количество МСК, генерируемых этим методом, является идеальным источником для генерации адипоцитов. Однако гетерогенность образца в результате дифференцировки адипоцитов остается проблемой. Поэтому мы использовали метод очистки липидсодержащих зрелых адипоцитов на основе нильского краса с помощью FACS. Эта стратегия сортировки позволила нам установить надежный способ моделирования метаболических нарушений, связанных с адипоцитами, с использованием пула адипоцитов с уменьшенной гетерогенностью образца и улучшенной функциональностью клеток.
Введение
Мезенхимальные стволовые клетки (МСК) действуют как эффективный транзиторный ресурс для производства клеток мезодермального происхождения, таких как адипоциты, остеоциты и хондроциты, которые в дальнейшем могут быть использованы для моделирования соответствующих генетических нарушений. Однако предыдущие подходы основывались на получении этих МСК из тканей взрослого человека 1, что создавало проблему получения их в больших количествах от доноров и ограничение их функциональной жизнеспособности в неоптимальных условиях культивирования in vitro 1,2. Эти препятствия породили большой спрос на протокол для генерации МСК in vitro. Индуцированные плюрипотентные стволовые клетки человека (ИПСК) могут быть использованы в качестве ценного источника МСК, проявляя характеристикиМСК 3,4,5. МСК, полученные из ИПСК, могут использоваться в качестве терапевтического варианта при нескольких заболеваниях. Кроме того, способность МСК, полученных из ИПСК, генерировать адипоциты, делает их ценной моделью человека in vitro для изучения адипогенеза человека, ожирения и заболеваний, связанных с адипоцитами.
Современные протоколы дифференцировки адипоцитов можно разделить на две группы, одна из которых включает дифференцировку адипоцитов с использованием химических или белковых коктейлей, дающих результирующий выход 30%-60%6,7,8,9, а другая включает генетические манипуляции для надежной индукции ключевых факторов транскрипции, регулирующих развитие адипоцитов, чтобы дать выход 80%-90%10, 11. Однако генетические манипуляции не повторяют естественный процесс дифференцировки адипоцитов и часто маскируют тонкие парадигмы, возникающие во время адипогенеза, что делает его неэффективным для целей моделирования заболеваний12,13. Таким образом, мы представляем способ сортировки химически полученных зрелых адипоцитов от незрелых путем флуоресцентной маркировки липидсодержащих адипоцитов с использованием нильского красного.
Здесь мы представляем протокол, включающий транзиторную инкубацию эмбриоидных тел (БЭ), полученных из ИПСК, с полностью транс-ретиноевой кислотой для получения большого количества быстро пролиферирующих МСК, которые в дальнейшем могут быть использованы для получения адипоцитов14. Мы также представляем способ сортировки химически полученных зрелых адипоцитов из пула гетерогенной дифференцировки путем флуоресцентной маркировки их липидных капель с использованием липофильного красителя; Нил красный. Это позволило бы создать чистую популяцию зрелых адипоцитов с расширенной функциональностью для точного моделирования метаболических нарушений, связанных с адипоцитами.
протокол
Исследование было одобрено соответствующим институциональным комитетом по этике исследований и выполнено в соответствии с этическими стандартами, изложенными в Хельсинкской декларации 1964 года и ее более поздних поправках или сопоставимых этических стандартах. Протокол был одобрен Институциональным наблюдательным советом (IRB) HMC (No 16260/16) и QBRI (No 2016-003). Эта работа также оптимизирована для hESCs, таких как H1 и H9. Образцы крови были получены от здоровых людей с полного информированного согласия. ИПСК генерируются из мононуклеарных клеток периферической крови (PBMC) здоровых людей.
1. Культивирование и поддержание ИПСК
- Подготовьте пластины с матричным покрытием базальной мембраны, восстановив матрицу покрытия в нокаут-DMEM в соотношении 1:80 и храните при температуре 4 °C.
- Приготовьте питательные среды ИПСК, добавив 50 мл 10-кратной добавки стволовых клеток к 500 мл базальной среды стволовых клеток вместе с 5 мл 100-кратного пенициллина-стрептомицина (P / S) и храните при 4 ° C в течение короткого времени или при -20 ° C для длительного использования.
- Выстелите планшеты матрицей с покрытием - 1 мл для 6-луночного планшета, 500 мкл для 12-луночного планшета, 250 мкл для 24-луночного планшета - и инкубируйте планшет при 37 ° C в течение 1-2 часов.
- Удалите аликвоту питательных сред ИПСК и предварительно подогрейте при комнатной температуре перед использованием.
- Разморозьте флакон с ИПСК (ЭСК или ИПСК) на водяной бане при температуре 37 °C и переложите в коническую пробирку объемом 15 мл, содержащую 2-3 мл питательных сред.
- Центрифугируйте пробирку при 120 x g в течение 4 мин при комнатной температуре (RT-23 °C).
- Удалите надосадочную жидкость и добавьте 2 мл свежей питательной среды с добавлением 10 мкМ ингибитора ROCK (Y-27632). Поместите ячейки в одну лунку 6-луночной пластины с матричным покрытием и поместите пластину при температуре 37 ° C.
- Через 24 часа удалите носитель и замените его свежим питательным материалом.
- Меняйте носитель каждый день, пока ячейки не достигнут 80-90% слияния.
- Достигнув слияния, пройдите ячейки, выполнив шаги, описанные ниже.
- Удалите среду и промойте клетки фосфатно-буферным физиологическим раствором Дульбекко (DPBS).
- Добавить реагент для диссоциации ИПСК (см. Таблицу материалов) - 500 мкл для лунки 6-луночного планшета, 250 мкл для лунки 24-луночного планшета - и выдерживать в течение 1 мин при 37 °С.
- Удалите диссоциационный реагент и высушите клетки в течение 1 мин при 37 °C.
- Соберите клетки, используя питательную среду - 1 мл для лунки 6-луночного планшета и 250 мкл для лунки 24-луночного планшета - в коническую пробирку объемом 15 мл и центрифугу при 120 x g в течение 4 мин.
- Ресуспендируют клетки в питательных средах - 2 мл для лунки с 6-луночным планшетом и 500 мкл для лунки с 24-луночным планшетом, дополненным ингибитором ROCK 10 мкМ, и помещают их на свежие пластины с матричным покрытием при 40% слиянии.
2. Дифференциация ИПСК в МСК
- Приготовьте среду для дифференцировки МСК, добавив 15% фетальной бычьей сыворотки (FBS) и 1% P/S к ДМЭМ + пируват с низким содержанием глюкозы и храните при 4 °C.
- При достижении 80% слияния используйте ИПСК для формирования эмбриоидных тел (БЭ), следуя шагам, описанным ниже.
- Промойте клетки DPBS и инкубируйте их с диссоциативной средой / ЭДТА-500 мкл для лунки 6-луночной пластины, 250 мкл для лунки 24-луночной пластины.
- Инкубировать при 37 °C в течение 1 мин, аспирировать диссоциирующий реагент и выдерживать клетки при 37 °C еще 1 мин. Чтобы начать дифференцировку МСК, требуется ~10-12 х 106 клеток.
- Соберите клетки в коническую пробирку объемом 15 мл, используя питательные среды. Убедитесь, что вы очень осторожны при сборе, чтобы предотвратить образование одиночных клеток и позволить образованию БЭ. Центрифугируют клетки при 120 x g в течение 4 мин.
- Ресуспендируют клетки в 3 мл среды дифференцировки МСК, содержащей 10 мкМ ингибитора ROCK.
- Смешайте и распределите 0,5 мл на лунку в 24-луночной пластине со сверхнизкой насадкой.
ПРИМЕЧАНИЕ: Использование пластины со сверхнизким креплением будет стимулировать агрегацию клеток в ЭБ, а не их прикрепление к поверхности. - Поместите тарелку в инкубатор при температуре 37 °C.
- Через 24 часа индуцируйте полученные БЭ лечением с высоким содержанием ретиноевой кислоты (РА), выполнив шаги, описанные ниже.
- Добавьте 10 мкМ РА к 3 мл дифференцировочной среды МСК. Соберите ЭБ в пробирку объемом 15 мл и дайте им отстояться в течение 15 минут.
- Удалите надосадочную жидкость из ЭБ и добавьте среду для дифференцировки МСК с добавлением 10 мкМ RA.
- Осторожно ресуспендируйте и распределите 0,5 мл / лунку в той же 24-луночной пластине со сверхнизким креплением.
- Поместите тарелку в инкубатор при температуре 37 °C. Не беспокойте ЭБ в течение следующих 48 ч.
- Через 48 ч соберите ЭБ в пробирку объемом 15 мл и дайте им отстояться в течение 15 мин.
- Удалите надосадочную жидкость из ЭБ и добавьте среду для дифференцировки МСК с добавлением 0,1 мкМ РА.
- Осторожно ресуспендируйте и распределите 0,5 мл / лунку в той же 24-луночной пластине со сверхнизким креплением.
- Поместите тарелку в инкубатор при температуре 37 °C. Не беспокойте ЭБ в течение следующих 48 ч.
- Удалите RA, добавленный в ячейки, выполнив действия, описанные ниже.
- Через 48 ч после последнего лечения ревматоидного артрита соберите ЭБ и дайте им успокоиться в течение 15 минут.
- Удалите надосадочную жидкость и добавьте среду с низким содержанием глюкозы DMEM без цитокинов.
- Осторожно ресуспендируйте и распределите 0,5 мл / лунку в 24-луночной пластине со сверхнизким креплением. Поместите тарелку в инкубатор при температуре 37 °C.
- Нанесите ЭБ, полученные из ИПСК, выполнив шаги, описанные ниже.
- Через 48 ч после предыдущего этапа (этап 2.4) соберите ЭБ в пробирку объемом 15 мл и дайте им осесть в течение 15 минут.
- Удалить надосадочную жидкость и ресуспендировать в 2 мл свежей среды для дифференцировки МСК.
- Перенос в две скважины 6-луночной пластины с матричным покрытием из фундаментальной мембраны.
- Меняйте носитель через день в течение дополнительных 5 дней.
- Через 5 дней удалите отработанную среду и замените ее свежей средой для дифференцировки МСК, содержащей 2,5 нг/мл основного фактора роста фибробластов (bFGF).
- Пройдите EB с покрытием, когда они достигнут слияния 80%-90%, выполнив шаги, описанные ниже.
- Промойте клетки DPBS, добавьте трипсин-ЭДТА-500 мкл для лунки 6-луночной пластины и инкубируйте клетки при 37 ° C в течение 3 мин.
- Соберите клетки, используя средства для дифференцировки MSC, в коническую пробирку объемом 15 мл и отжимайте при 750 x g в течение 4 минут.
- Ресуспендируют в средах дифференцировки МСК с 2,5 нг/мл bFGF и накладывают клетки на пластины с матричным покрытием базальной мембраны в соотношении 1:3.
- Повторите прохождение, когда ячейки достигнут слияния 70%-80%. Ожидается, что он наберет 3-6 миллионов клеток за 2-3 прохода.
3. Проточный цитометрический анализ МСК, полученных из ИПСК
ПРИМЕЧАНИЕ: После прохождения 2-3 пассажей следует получить доступ к клеткам для эффективности дифференцировки МСК. Дифференцировка будет считаться успешной, если клетки экспрессируют маркеры дифференцировки МСК - CD44, CD73, CD90 и CD105 с эффективностью более 90% и не экспрессируют высокие уровни гемопоэтических маркеров - CD14, CD19, CD34 и CD45. Об эффективности этих маркеров можно узнать, выполнив следующие действия.
- Пройдите через ячейки, используя шаги, описанные выше (шаг 2.6), и получите 1 x 105 ячеек в одной лунке 96-луночной пластины с v-образным дном.
- Центрифугируйте пластину при 375 x g в течение 4 мин при 4 °C.
- Ресуспендировать 1 x 105 клеток в 100 мкл холодного DPBS с 1 мкл конъюгированного антитела (Ab) (см. Таблицу материалов) и инкубировать при 4 °C в течение 30-40 мин, предотвращая воздействие света.
- Ресуспендируют еще 1 x 105 клеток в 100 мкл холодного DPBS с соответствующим контролем изотипа конъюгированного Ab в концентрации 1:100 ) и инкубируют при 4 °C в течение 30-40 мин, предотвращая воздействие света.
- После инкубации центрифугируют пластину при 375 x g в течение 4 мин при 4 °C. Выбросьте надосадочную жидкость, встряхнув тарелку над раковиной.
- Ресуспендируют клетки в 100 мкл холодного DPBS.
- Центрифугируют клетки при 375 x g в течение 4 мин при 4 °C. Откажитесь от надосадочной жидкости.
- Ресуспендируют клетки в 200 мкл холодного DPBS и собирают в темные холодные микроцентрифужные пробирки объемом 1,5 мл и держат их на льду до тех пор, пока они не будут проанализированы с помощью флуоресцентно-активированной сортировки клеток (FACS).
- Для анализа FACS распределите ячейки, используя боковое рассеяние (SSC-A) и прямое рассеяние (FSC-A), чтобы исключить мусор. Кроме того, распределите закрытые клетки, используя высоту прямого рассеяния (FSC-H) по сравнению с областью прямого рассеяния (FSC-A), чтобы отличить синглеты от дублетов из популяции живых клеток.
ПРИМЕЧАНИЕ: Клетки были закрыты относительно сдвига контроля изотипа для каждого маркера, и для анализа использовалось не менее 10 000 закрытых событий из каждого окрашенного образца.
4. Дифференцировка МСК в адипоциты
- Подготовьте базальную среду для дифференцировки адипоцитов, добавив 10% нокаутирующей сыворотки (KOSR), 1% глютамина, 1% P/S, 4,5 нг/мкл глюкозы к минимальному количеству незаменимых сред (MEM)-альфа и храните при температуре 4 °C.
- Разрешите MSC достичь слияния выше 90%. Продолжайте культивировать их еще 48 часов, чтобы они могли пройти период остановки роста.
- Приготовьте полную среду для дифференцировки адипоцитов, добавив 100 мкг/мл 3-изобутил-1-метилксантина (IBMX), 1 мкМ дексаметазона, 0,2 ЕД/мл инсулина, 100 мкМ индометацина и 10 мкМ росиглитазона к базальной среде.
- Удалите дифференцировочную среду MSC и промойте клетки с помощью DPBS.
- Добавьте полную среду для дифференцировки адипоцитов - 2 мл для лунки с 6-луночным планшетом и 1 мл для лунки с 12-луночной пластиной - и инкубируйте клетки при 37 ° C. Меняйте полную дифференциацию среды через день в течение 14 дней.
5. Оценка эффективности дифференцировки адипоцитов
- На 14-й день дифференцировки проверяют эффективность дифференцировки, окрашивая клетки на маркеры созревания адипоцитов, FABP4 и адипонектин.
- Извлеките носитель и промойте ячейки с помощью DPBS.
- Закрепите клетки с помощью 4% параформальдегида (PFA) - 200 мкл в лунке 24-луночной пластины - и инкубируйте при комнатной температуре в течение 15 минут.
- Выбросьте PFA и промойте с помощью солевого раствора с трис-буфером с 0,5% твином (TBST) и поместите его в шейкер при комнатной температуре на 15 минут. Повторите процесс дважды.
- Пропитайте фиксированные клетки фосфатно-буферным физиологическим раствором с 0,5% Triton X-100 (PBST) и поместите его на шейкер при комнатной температуре на 15-20 минут.
- Откажитесь от PBST и добавьте блокирующий буфер (5%-6% бычьего сывороточного альбумина (BSA) в PBST) - 500 мкл для лунки 6-луночного планшета и 250 мкл для лунки 12-луночного планшета - и инкубируйте при комнатной температуре на шейкере в течение 40-60 минут.
- Разбавляют первичные антитела против FABP4, адипонектина в 2%-3% BSA, в концентрации 1:500 (см. Таблицу материалов). Добавляйте эти антитела вместе только в том случае, если они выращены на разных животных, и поместите тарелку на шейкер при температуре 4 ° C на ночь.
- Удалите первичные антитела и трижды промойте клетки TBST (по 15 минут каждый) и поместите его на шейкер при комнатной температуре.
- Подготовьте вторичные антитела Alexa Fluor в PBST (1:500). Инкубируйте клетки в комбинациях вторичных антител (в соответствии с видами, у которых выращивается первичное антитело) в течение 60 минут при комнатной температуре и накройте пластину алюминиевой фольгой, чтобы защитить ее от света.
- Выбросьте вторичные антитела, трижды промойте TBST и поставьте тарелку на шейкер.
- Для окрашивания ядер добавляют 1 мкг/мл Hoechst 33342-200 мкл для лунки 24-луночной пластины, разведенной в PBS, и выдерживают в течение 5 мин при комнатной температуре.
- Откажитесь от раствора Хёхста и добавьте PBS-500 мкл для лунки 24-луночной пластины в ячейки. Держите пластины закрытыми от света до тех пор, пока они не будут визуализированы с помощью инвертированного флуоресцентного микроскопа.
6. Сортировка адипоцитов с помощью нильского красного
- Приготовьте рабочий раствор нильского красного, добавив 1 мг/мл раствора нильского красного в ДМСО и храните при -20 °C. Непосредственно перед использованием разморозьте нильский красный бульон и восстановите в DPBS до достижения концентрации рабочего раствора 300 нМ.
- На 14-й день дифференцировки адипоцитов или после него удалите среду из клеток и промойте с помощью DPBS.
- Добавьте рабочий раствор нильского красного -1 мл в лунку 6-луночного планшета и выдерживайте при 37 °C в течение 15 мин.
- Удалите раствор нильского красного и добавьте трипсин-ЭДТА -500 мкл в лунку 6-луночного планшета и инкубируйте при 37 ° C в течение 4 мин.
- Соберите клетки с помощью DMEM, содержащего 5% FBS, в коническую пробирку объемом 15 мл. Центрифуга при 750 x g в течение 4 мин.
- Удалить надосадочную жидкость и ресуспендировать в DPBS-1 мл для 1 х 106 клеток. Центрифуга при 750 x g в течение 4 мин.
- Удалить надосадочную жидкость и ресуспендировать в DPBS-1 мл для 1 х 106 клеток. Используйте сортировщик FACS для выделения нильских красных положительных клеток с использованием канала FL1.
- Повторно культивируйте отсортированные клетки в среде дифференцировки адипоцитов или соберите отсортированные клетки для выделения РНК и белка.
- Извлеките РНК из отсортированных клеток и проведите относительный количественный анализ маркеров дифференцировки адипоцитов, включая FABP4, PPARG и C/EBPA. Нильские красные положительные клетки демонстрируют значительное повышение экспрессии генов, по крайней мере, в два раза по сравнению с несортированными клетками.
Результаты
Схема и морфология клеток во время мезенхимальной дифференцировки: Дифференцировка ИПСК в МСК включает в себя различные стадии развития, охватывающие образование БЭ, дифференцировку МСК и экспансию МСК (рис. 1). На этих стадиях развития клетки приобретают различную морфологию из-за различных стимулирующих химических веществ, которым они подвергаются. После начала дифференцировки клетки покрываются суспензией и, как ожидается, будут круглыми, с определенными границами клеток, но при этом будут иметь малый или средний размер в диаметре (рис. 2). Выбор культивирующих клеток в суспензии во время начальной фазы дифференцировки позволяет ей очень напоминать процесс естественного эмбрионального развития, что делает эту фазу очень важной для успешной дифференцировки. Фаза формирования ЭБ и обработки РА сопровождается нанесением ЭБ на пластины с матричным покрытием базальной мембраны. Жизнеспособность ЭБ после нанесения покрытия может быть достигнута путем наблюдения за их поведением быстрой пролиферации, приводящим к появлению большего количества МСК (рис. 2). Это быстрое пролиферативное поведение, демонстрируемое МСК, сохраняется даже после того, как они переносятся на свежие пластины с матричным покрытием вместе с сохранением своеобразной, удлиненной морфологии (рис. 2).
Количественная оценка поверхностных маркеров МСК: Эффективность дифференциации МСК достигается путем количественного определения поверхностных маркеров, специфичных для дифференциации МСК. Хорошая дифференцировка, дающая надежные МСК, должна показывать более чем 90% эффективность мезенхимальных поверхностных маркеров CD73, CD44 и CD90 (рис. 3A). Кроме того, клетки также оцениваются на отсутствие поверхностных маркеров, изображающих гемопоэтический фенотип, CD14, CD34 и CD19, и, следовательно, ожидается, что эффективность экспрессии для них составит менее 1% (рис. 3B).
Дифференцировка МСК в адипоциты: Дифференцировка МСК в адипоциты может быть достигнута путем окрашивания на FABP4 и адипонектин. FABP4 представляет собой цитоплазматический белок и рассматривается как маркер терминально дифференцированных адипоцитов. Его высокая экспрессия среди адипоцитов с цитоплазматическим распределением является ключевым признаком их зрелости развития (рис. 4А). В дополнение к FABP4 адипонектин рассматривается как один из важных маркеров зрелости адипоцитов. Его высокая экспрессия указывает на то, что адипоциты достаточно функциональны для накопления липидов и адипогенеза в ответ на передачу сигналов глюкозы. Будучи секреторным белком, адипонектин проявляет глобулярную морфологию, причем каждая белковая глобула легко различима в цитоплазме (рис. 4B).
Окрашивание и сортировка зрелых адипоцитов с использованием нильского красного: При дифференцировке зрелые адипоциты можно отличить от их незрелых аналогов путем окрашивания в нильский красный. Нильский красный связывается с липидосодержащими адипоцитами, что характерно исключительно для зрелых адипоцитов (рис. 5А). Это, наряду с флуоресцентным подшипником, характерным для нильского красного, делает его эффективным инструментом для сортировки зрелых адипоцитов с использованием флуоресцентной активированной проточной цитометрии (рис. 5B). Эффективная сортировка должна приводить к увеличению маркеров созревания — PPARG, C/EBPA и FABP4 — как минимум в два раза, что определяется с помощью количественной ПЦР в реальном времени (qRT-PCR) (рис.5C).

Рисунок 1: Принципиальная схема, показывающая дифференцировку ИПСК на МСК и адипоциты. ИПСК дифференцируются в МСК с использованием метода эмбриоидного тела (БЭ). ЭБ подвергаются кратковременному воздействию 10 мкМ полностью транс-ретиноевой кислоты (РА). Сгенерированные МСК дифференцируются в 40%-77% адипоцитов на основе линии iPSC. Нильские красные положительные клетки сортируются с помощью FACS для получения очищенной популяции зрелых адипоцитов, которые могут быть использованы для изучения расстройств, связанных с адипоцитами (моделирование заболеваний), идентификации новых лекарств и, в конечном итоге, для персонализированной терапии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
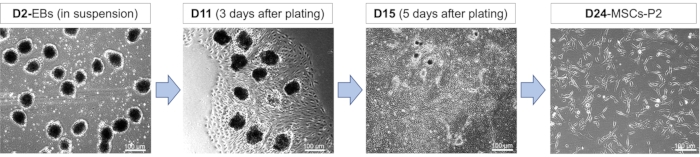
Рисунок 2: Дифференциация ИПСК в МСК. Репрезентативные морфологические изображения, показывающие различные стадии дифференцировки МСК на 2-й (D2), 11-й (D11), 15-й (D15) и 24-й (D24) день. Эмбриоидные тельца (БЭ), полученные в присутствии 10 мкМ РА в течение 24 ч, покрывали на 8-й день дифференцировки с последующей диссоциацией и пассажем через 12-17 дней дифференцировки. МСК проходили несколько раз. Сокращения: П2 = отрывок 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Экспрессия маркеров МСК и гемопоэтических маркеров в МСК, полученных из ИПСК. Репрезентативные гистограммы проточной цитометрии, показывающие экспрессию маркеров МСК, CD73, CD44 и CD90, (A) и гемопоэтических маркеров, CD34, CD19 и CD14 (B) в МСК, полученных из ЭБ, полученных из iPSC, обработанных 10 мкМ РА. Ось X на графике представляет интенсивность флуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
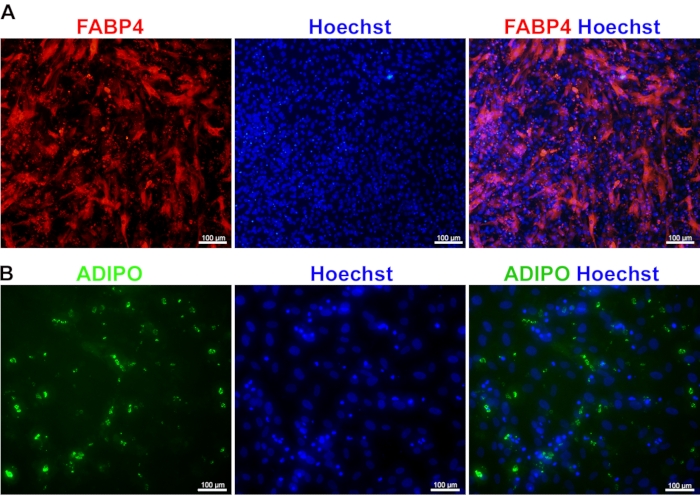
Рисунок 4: Дифференцировка МСК, полученных из iPSC, в адипоциты. Изображения иммуноокрашивания, показывающие экспрессию FABP4 (A) и адипонектина (ADIPO) (B) в зрелых адипоцитах, полученных из ИПСК. Ядра были окрашены Хёхстом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Сортировка адипоцитов, полученных из iPSC, с использованием нильского красного. (A) Изображения, показывающие светлое поле (BF) и окрашенные в нильский красный цвет зрелые адипоциты. (B) Количественное определение нильского красного (PE-положительных клеток) в зрелых адипоцитах с использованием FACS. (C) ПЦР-анализ в реальном времени, показывающий экспрессию C/EBPA, FABP4 и PPARG в отсортированных и несортированных зрелых адипоцитах. Данные представлены в виде средних ± SD; *p < 0,05, **p < 0,01, ***p < 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол имеет первостепенное значение из-за его способности обеспечивать высокую производительность и эффективность МСК. Это массовое производство МСК стало возможным благодаря переходной инкубации ЭБ, полученных из ИПСК, с 10 мкМ RA14,15. Транзиторная обработка 10 мкМ РА увеличила выход МСК в 11,2-1542 раза в14,15, причем этот протокол применим как к ИПСК, так и к ЧПСК. При такой дозе и продолжительности лечения РА улучшает пролиферативную способность и выживаемость БЭ-образующих клеток за счет прямой или косвенной регуляции экспрессии нескольких генов, участвующих в пролиферации клеток, апоптозе и клеточных адгезиях клетка-клетка и ECM-клетка, которые имеют решающее значение для выживания и пролиферации ИПСК14,16. Гены включают, помимо прочего, факторы транскрипции (такие как EGFR4, SOX4), факторы роста и рецепторы факторов роста (такие как IGF2, FGFR4) и молекулы адгезии (такие как FN1 и CAM). Однако, в отличие от низких доз (0,1-10 мкМ), при высоких дозах (≥20 мкМ) РА отрицательно регулирует пролиферацию и выживание БЭ-образующих клеток, что приводит к уменьшению количества и размера БЭ, полученных из ПСХ, и, следовательно, к снижению выхода МСК14. РА рассматривается как ингибитор пролиферации в нескольких нормальных дифференцированных и раковых клетках17,18,19. При БЭ передача сигналов ретиноидов зависит от контекста (времени, концентрации, вида и клеточной линии); дифференциально влияет на самообновление, выживание и дифференцировку БЭ-образующих клеток, регулируя различные гены и сигнальные пути20,21. Таким образом, использование РА в оптимальное время и в оптимальной концентрации РА-10 мкМ на 3-й день индукции БЭ с последующим снижением дозы до 0,1 мкМ на 5-й день в течение 2 дней, как описано в настоящем протоколе, имеет решающее значение для индуцирования выживания и пролиферации БЭ-образующих клеток.
В дополнение к регулированию роста и выживаемости, РА подвергает обработанные БЭ задержке дифференцировки по сравнению с клетками, не обработанными RA14. Фактически, БЭ, обработанные РА, сохраняют свою компактную форму после нанесения покрытия и не дифференцируются в МСК-подобные клетки, в отличие от БЭ, не обработанных РА. Это согласуется с предыдущими исследованиями, в которых сообщалось, что кратковременное воздействие лечения РА ингибирует дифференцировку клеток за счет подавления передачи сигналов WNT21. Кроме того, эти обработанные РА клетки с задержкой дифференцировки также показали повышенную экспрессию кадгерина и белков внеклеточного матрикса14, которые, как известно, играют важную роль в поддержании плюрипотентного состояния ИПСК16. Чтобы освободить блок дифференцировки, опосредованный РА, БЭ должны быть диссоциированы, что приводит к нарушению клеточных спаек и обеспечивает долгосрочную дифференцировку МСК после нанесения покрытия. Интересно, что лечение ревматоидного артрита действительно удерживало блок дифференцировки над клетками, но оно не поддерживало клетки в плюрипотентном состоянии. Фактически, EB-образующие клетки, подвергающиеся кратковременному воздействию 10 мкМ RA, демонстрируют значительно сниженную экспрессию ключевых маркеров плюрипотентности - OCT4, SOX2 и NANOG14.
Было показано, что МСК, полученные при краткосрочном лечении РА БЭ, сохраняют свою типичную фибробластоподобную морфологию с обильной экспрессией поверхностных маркеров МСК и их мультипотентностью после криоконсервации, что делает эти массовые МСК пригодными для хранения для долгосрочных исследованийэкспансии 14. Подвергая их адипогенным, хондрогенным и остеогенным условиям дифференцировки, эти МСК могут легко дифференцироваться в три типа мезодермальных клеток, что делает их легко достижимым источником для моделирования заболеваний, связанных с тканями14. Таким образом, стабильное и разностороннее поведение in vitro МСК, генерируемых протоколом дифференцировки, опосредованным РА, придает им первостепенное значение в исследовательских и прикладных условиях.
В то время как хондрогенный и остеогенный дифференцировочные потенциалы МСК, полученных из БЭ, обработанных РА, по-видимому, аналогичны таковым у МСК, полученных из необработанных БЭ, было обнаружено, что первый проявляет повышенный потенциал дифференцировки в адипогенную линию при воздействии условий адипогенной дифференцировки14. Об этом свидетельствует 2-3-кратное увеличение внутриклеточного накопления липидов (окрашивание Oil Red O) и FABP4-положительных клеток адипоцитарного маркера в пуле дифференцировки клеток, полученных после культивирования МСК, полученных из БЭ, обработанных РА, с адипогенными дифференцировочными средами, по сравнению с МСК, полученными из БЭ, не обработанных РА. Это может быть следствием регуляции РА нескольких сигнальных путей, управляющих развитием адипоцитов, таких как пути взаимодействия Hippo, WNT и ECM-клеток, как показали данные секвенирования РНК из обработанных и необработанных РА EB 14,22,23,24,25. Эта повышенная способность МСК, полученных из РА, подвергаться адипогенной дифференцировке ценна, поскольку доступные в настоящее время протоколы либо приводят к низкому выходу адипоцитов, либо используют генетические манипуляции, что делает сгенерированные адипоциты бесценными для получения адипоцитов, рекапитулированных естественным процессом. Адипоциты делятся на три типа: белые, коричневые и бежевые. Белые адипоциты классифицируются по наличию одной липидной капли и играют роль в накоплении энергии. Принимая во внимание, что коричневые адипоциты участвуют в расходе энергии за счет окисления субстрата из-за очень высокой численности митохондрий, характеризующихся экспрессией UCP1. Принимая во внимание, что коричневые адипоциты, которые локализованы в белой жировой ткани, известны как бежевые или коричневые адипоциты. Эти МСК могут дать обильный выход белых адипоцитов с учетом предварительного воздействия ЭБ на РА. В предыдущих публикациях говорилось о селективной индукции ИПСК в клетки, экспрессирующие низкий уровень UCP1, т.е. белые адипоциты, а не о воздействии RA26 на клетки с высоким уровнем UCP1. В предыдущих публикациях сообщалось, что ревматоидный артрит, продуцируемый из клеток нервного гребня эмбрионов мышей и рыбок данио, играет важную роль в образовании белых адипоцитов27,28.
Несмотря на то, что протокол на основе РА позволил генерировать МСК, которые обеспечивают повышенный выход адипоцитов, достигая 48,5%-77,4% (против 22,5%-57,6% без лечения РА), недостижение >90% по-прежнему проблематично при моделировании многовариантных генетических нарушений на основе адипоцитов in vitro. На самом деле, недостижение чистой популяции адипоцитов может привести к амбивалентным результатам, полученным из многовариантных моделей заболевания, поскольку будет трудно различить, связаны ли наблюдаемые различия в развитии с различными генетическими составами или из-за непоследовательной эффективности дифференцировки. Чтобы обойти эту проблему, было важно отсортировать дифференцированные клетки, чтобы получить пул чистых зрелых адипоцитов, чтобы любые различия в фенотипах можно было отнести только к врожденным генетическим различиям. Несколько исследований выявили поверхностные маркеры на адипоцитах, которые потенциально могут быть использованы для сортировки. Например, работа, проведенная Рональдом Каном, позволила идентифицировать переносчик аминокислот ASC-1 в качестве нового поверхностного маркера на белых адипоцитах29. Кроме того, исследования по извлечению зрелых адипоцитов из сальниковой и подкожной областей показали, что зрелые адипоциты экспрессируют CD34, CD36 и CD59 на своих поверхностях30, где, как сообщается, CD36 функционирует как переносчик жирных кислот на поверхности зрелых адипоцитов31. Однако в этих исследованиях использовались гетерогенные популяции клеток, полученных из жировой ткани, без указания экспрессии этих маркеров только для зрелых популяций адипоцитов. Кроме того, эти маркеры могут также экспрессироваться другими типами клеток и не являются специфическими для адипоцитов. Например, ASC-1 присутствует как на астроцитах, так и на нейронах32, CD34 является маркером гемопоэтических стволовых клеток33CD36 присутствует на тромбоцитах, мононуклеарных фагоцитах, гепатоцитах, миоцитах и некоторых эпителиях33, а CD59 экспрессируется на эндотелиальных и лимфоидных клетках34,35. Поэтому в качестве альтернативного решения в качестве возможного кандидата для сортировки адипоцитов использовался нильский красный, селективное флуоресцентное окрашивание внутриклеточных липидов. Адипоциты хранят значительную часть липидов, которые могут быть высвобождены и использованы для производства энергии, построения мембран или в качестве сигнальных молекул, регулирующих метаболизм36. Краситель нильский красный ранее использовался в проточной цитометрии и микроскопии для окрашивания адипоцитов, полученных из мышиных и человеческих МСК37. В предыдущих исследованиях сообщалось об использовании нильского красного для адипоцитов, полученных из ESC, и усилении маркеров адипоцитов после сортировки38. Адипоциты, полученные из МСК, полученные по настоящему протоколу на основе РА, оценивали на предмет их способности окрашиваться нильским красным цветом, что указывает на их зрелость, и сортировали для их очистки. Эти отсортированные по красному цвету клетки Нила показали двух-трехкратное увеличение экспрессии маркеров созревания адипоцитов, в том числе PPARG, C/EBPAи FABP4 по сравнению с несортированными клетками, что еще больше увеличивает выход адипоцитов, полученных из ИПСК. Хотя эти маркеры экспрессируются до накопления липидов, их экспрессия помечает клетку для терминальной дифференцировки в липидосодержащие адипоциты. Проверка эффективности сортировки по этим маркерам позволяет выявить пул, в котором экспрессируются все ячейки FABP4, CEBPaи PPARg, указывающий на пул, который был предопределен для образования зрелых адипоцитов. Клетки сортируются на основе их способности окрашивать в нильский красный. Эффективность очистки увеличилась в два-три раза за счет большого количества адипоцитов в несортированной фракции. Размер липидсодержащих адипоцитов в значительной степени изменяется во время дифференцировки, когда сортируется пул клеток с одинаковым распределением по размерам. Несортированная фракция включает липидосодержащие адипоциты, но они не являются полностью зрелыми и регулируются различными размерными пропорциями.
Ранее сообщалось о гетерогенности МСК, выделенных из организма человека39. Эта гетерогенность зависит от нескольких факторов, таких как происхождение МСК, доноры и условия39. Это может привести к различиям в их эффективности при лечении различных заболеваний. Это исследование предполагает, что короткая обработка РА ВПСК, полученная в условиях культивирования, совместимых с надлежащей производственной практикой (GMP), даст однородную популяцию МСК. Это указывает на то, что текущий протокол является перспективным подходом для создания большого количества МСК клинического уровня, которые могут быть использованы для терапии на основе МСК.
Комбинация протокола дифференцировки МСК на основе РА, приводящего к дифференцировке адипоцитов, и протокола сортировки нильских красных позволила получить адипоциты, полученные из ИПСК, с усиленной экспрессией функциональных маркеров и повышенным выходом и чистотой. Таким образом, этот комбинированный протокол позволит генерировать в достаточном количестве и чистоте зрелые адипоциты от генетически различных индивидуумов и потенциально раскрывать новые генетические варианты, лежащие в основе метаболических нарушений, связанных с адипоцитами.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Эта работа была профинансирована за счет гранта Катарского национального исследовательского фонда (QNRF) (грант No NPRP10-1221-160041). Марьям Агади получила стипендию GSRA от Катарского национального исследовательского фонда (QNRF).
Материалы
| Name | Company | Catalog Number | Comments |
| Adiponectin | Abcam | ab22554 | Adipocyte maturation marker |
| anti-CD105 | BD Pharmingen | 560839 | MSC differentiation marker |
| anti-CD14 | BD Pharmingen | 561712 | MSC differentiation marker |
| anti-CD19 | BD Pharmingen | 555415 | MSC differentiation marker |
| anti-CD34 | BD Pharmingen | 555824 | MSC differentiation marker |
| anti-CD44 | abcam | ab93758 | MSC differentiation marker |
| anti-CD45 | BD Pharmingen | 560975 | MSC differentiation marker |
| anti-CD73 | BD Pharmingen | 550256 | MSC differentiation marker |
| anti-CD90 | BD Pharmingen | 555596 | MSC differentiation marker |
| bFGF | R&D | 233-FP | MSC culture media supplement |
| C/EBPA | Abcam | ab40761 | Adipocyte maturation marker |
| Dexamethasone | Torics | 1126 | Adipocyte differentiation media supplement |
| FABP4 | Abcam | ab93945 | Adipocyte maturation marker |
| Fetal bovine serum | ThermoFisher | 10082147 | MSC culture media supplement |
| Glutamax | ThermoFisher | 35050-061 | MSC culture media supplement |
| IBMX | Sigma Aldrich | I5879 | Adipocyte differentiation media supplement |
| Indomethacin | Sigma Aldrich | I7378 | Adipocyte differentiation media supplement |
| Insulin | Sigma Aldrich | 91077C | Adipocyte differentiation media supplement |
| Knockout DMEM | ThermoFisher | 12660012 | Basal media for preparing matrigel |
| Low glucose DMEM | ThermoFisher | 11885084 | MSC culturing media |
| Matrigel | Corning | 354230 | Coating matrix |
| MEM-alpha | ThermoFisher | 12561056 | Adipocyte differentiation media |
| Nilered | Sigma Aldrich | 19123 | Sorting marker for adipocyte |
| Penicillin | ThermoFisher | 15140122 | MSC/Adipocyte media supplement |
| Phosphate-buffered saline | ThermoFisher | 14190144 | wash buffer |
| Pierce™ 20X TBS Buffer | Thermo Fisher | 28358 | wash buffer |
| PPARG | Cell Signaling Technology | 2443 | Adipocyte maturation marker |
| ReLeSR | Stem Cell Technologies | 5872 | Dissociation reagent |
| Retinoic acid | Sigma Aldrich | R2625 | MSC differentiation media supplement |
| Rock inhibitor | Tocris | 1254/10 | hPSC culture media supplement |
| Roziglitazone | Sigma Aldrich | R2408 | Adipocyte differentiation media supplement |
| StemFlex | ThermoFisher | A334901 | hPSC culture media |
| Triton | Thermo Fisher | 28314 | Permebealization reagent |
| Trypsin | ThermoFisher | 25200072 | Dissociation reagent |
| Tween 20 | Sigma Aldrich | P7942 | Wash buffer |
Ссылки
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling: CCS. 9, 12(2011).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PLoS One. 4 (6), 5846(2009).
- Brown, P. T., Squire, M. W., Li, W. J. Characterization and evaluation of mesenchymal stem cells derived from human embryonic stem cells and bone marrow. Cell and Tissue Research. 358 (1), 149-164 (2014).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Experimental Hematology. 36 (3), 350-359 (2008).
- Barberi, T., Willis, L. M., Socci, N. D., Studer, L. Derivation of multipotent mesenchymal precursors from human embryonic stem cells. PLoS Medicine. 2 (6), 161(2005).
- Xiong, C., et al. Derivation of adipocytes from human embryonic stem cells. Stem Cells and Development. 14 (6), 671-675 (2005).
- Cuaranta-Monroy, I., et al. Highly efficient differentiation of embryonic stem cells into adipocytes by ascorbic acid. Stem Cell Research. 13 (1), 88-97 (2014).
- van Harmelen, V., et al. Differential lipolytic regulation in human embryonic stem cell-derived adipocytes. Obesity (Silver Spring). 15 (4), 846-852 (2007).
- Noguchi, M., et al. In vitro characterization and engraftment of adipocytes derived from human induced pluripotent stem cells and embryonic stem cells. Stem Cells and Development. 22 (21), 2895-2905 (2013).
- Ahfeldt, T., et al. Programming human pluripotent stem cells into white and brown adipocytes. Nature Cell Biology. 14 (2), 209-219 (2012).
- Lee, Y. K., Cowan, C. A. Differentiation of white and brown adipocytes from human pluripotent stem cells. Methods in Enzymology. 538, 35-47 (2014).
- Abdelalim, E. M. Modeling different types of diabetes using human pluripotent stem cells. Cellular and Molecular Life Sciences: CMLS. 78 (6), 2459-2483 (2021).
- Abdelalim, E. M., Bonnefond, A., Bennaceur-Griscelli, A., Froguel, P. Pluripotent stem cells as a potential tool for disease modelling and cell therapy in diabetes. Stem Cell Reviews and Reports. 10 (3), 327-337 (2014).
- Karam, M., Younis, I., Elareer, N. R., Nasser, S., Abdelalim, E. M. Scalable Generation of mesenchymal stem cells and adipocytes from human pluripotent stem cells. Cells. 9 (3), (2020).
- Karam, M., Abdelalim, E. M. Robust and highly efficient protocol for differentiation of human pluripotent stem cells into mesenchymal stem cells. Methods in Molecular Biology. , Clifton, N.J. (2020).
- Li, L., Bennett, S. A., Wang, L. Role of E-cadherin and other cell adhesion molecules in survival and differentiation of human pluripotent stem cells. Cell Adhesion & Migration. 6 (1), 59-70 (2012).
- Lai, L., Bohnsack, B. L., Niederreither, K., Hirschi, K. K. Retinoic acid regulates endothelial cell proliferation during vasculogenesis. Development. 130 (26), 6465-6474 (2003).
- Chanchevalap, S., Nandan, M. O., Merlin, D., Yang, V. W. All-trans retinoic acid inhibits proliferation of intestinal epithelial cells by inhibiting expression of the gene encoding Kruppel-like factor 5. FEBS Letters. 578 (1-2), 99-105 (2004).
- di Masi, A., et al. Retinoic acid receptors: from molecular mechanisms to cancer therapy. Molecular Aspects of Medicine. 41, 1(2015).
- Simandi, Z., Balint, B. L., Poliska, S., Ruhl, R., Nagy, L. Activation of retinoic acid receptor signaling coordinates lineage commitment of spontaneously differentiating mouse embryonic stem cells in embryoid bodies. FEBS Letters. 584 (14), 3123-3130 (2010).
- De Angelis, M. T., Parrotta, E. I., Santamaria, G., Cuda, G. Short-term retinoic acid treatment sustains pluripotency and suppresses differentiation of human induced pluripotent stem cells. Cell Death & Disease. 9 (1), 6(2018).
- Li, L., Dong, L., Wang, Y., Zhang, X., Yan, J. Lats1/2-mediated alteration of hippo signaling pathway regulates the fate of bone marrow-derived mesenchymal stem cells. BioMed Research International. 2018, 4387932(2018).
- Moldes, M., et al. Peroxisome-proliferator-activated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis. The Biochemical Journal. 376, Pt 3 607-613 (2003).
- Ross, S. E., et al. Inhibition of adipogenesis by Wnt signaling. Science. 289 (5481), 950-953 (2000).
- Wang, Y. K., Chen, C. S. Cell adhesion and mechanical stimulation in the regulation of mesenchymal stem cell differentiation. Journal of Cellular and Molecular Medicine. 17 (7), 823-832 (2013).
- Mohsen-Kanson, T., et al. Differentiation of human induced pluripotent stem cells into brown and white adipocytes: role of Pax3. Stem Cells. 32 (6), 1459-1467 (2014).
- Billon, N., et al. The generation of adipocytes by the neural crest. Development. 134 (12), 2283-2292 (2007).
- Li, N., Kelsh, R. N., Croucher, P., Roehl, H. H. Regulation of neural crest cell fate by the retinoic acid and Pparg signalling pathways. Development. 137 (3), 389-394 (2010).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Festy, F., et al. Surface protein expression between human adipose tissue-derived stromal cells and mature adipocytes. Histochemistry and Cell Biology. 124 (2), 113-121 (2005).
- Cai, L., Wang, Z., Ji, A., Meyer, J. M., vander Westhuyzen, D. R. Scavenger receptor CD36 expression contributes to adipose tissue inflammation and cell death in diet-induced obesity. PLoS One. 7 (5), 36785(2012).
- Mesuret, G., et al. A neuronal role of the Alanine-Serine-Cysteine-1 transporter (SLC7A10, Asc-1) for glycine inhibitory transmission and respiratory pattern. Scientific Reports. 8 (1), 8536(2018).
- Silverstein, R. L., Febbraio, M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior. Science Signaling. 2 (72), (2009).
- Brooimans, R. A., van Wieringen, P. A., van Es, L. A., Daha, M. R. Relative roles of decay-accelerating factor, membrane cofactor protein, and CD59 in the protection of human endothelial cells against complement-mediated lysis. European Journal of Immunology. 22 (12), 3135-3140 (1992).
- Davies, A., et al. CD59, an LY-6-like protein expressed in human lymphoid cells, regulates the action of the complement membrane attack complex on homologous cells. The Journal of Experimental Medicine. 170 (3), 637-654 (1989).
- Lapid, K., Graff, J. M. Form(ul)ation of adipocytes by lipids. Adipocyte. 6 (3), 176-186 (2017).
- Aldridge, A., et al. Assay validation for the assessment of adipogenesis of multipotential stromal cells--a direct comparison of four different methods. Cytotherapy. 15 (1), 89-101 (2013).
- Schaedlich, K., Knelangen, J. M., Navarrete Santos, A., Fischer, B., Navarrete Santos, A. A simple method to sort ESC-derived adipocytes. Cytometry A. 77 (10), 990-995 (2010).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences: CMLS. 78 (2), 447-467 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены