Method Article
将人 iPSC 稳健分化为纯脂肪细胞群以研究脂肪细胞相关疾病
摘要
该方案允许从诱导多能干细胞(iPSC)产生纯脂肪细胞群。维甲酸用于将iPSCs分化为间充质干细胞(MSC),用于产生脂肪细胞。然后,采用基于尼罗河红染色的分选方法获得纯脂肪细胞。
摘要
诱导多能干细胞(iPSC)技术的最新进展允许产生不同的细胞类型,包括脂肪细胞。然而,目前的分化方法效率低,不能产生均匀的脂肪细胞群。在这里,我们通过使用基于全反式视黄体的方法以高产量生产间充质干细胞(MSCs)来规避这个问题。通过调节控制细胞增殖、存活和粘附的途径,我们的分化策略允许有效生成分化成纯多能MSC群体的胚胎体(EB)。该方法产生的大量MSC为产生脂肪细胞提供了理想的来源。然而,脂肪细胞分化导致的样品异质性仍然是一个挑战。因此,我们使用基于尼罗河红的方法使用FACS纯化含脂成熟脂肪细胞。这种分选策略使我们能够建立一种可靠的方法来使用具有降低样品异质性和增强细胞功能的脂肪细胞池来模拟脂肪细胞相关的代谢紊乱。
引言
间充质干细胞(MSCs)是产生中胚层起源细胞(如脂肪细胞,骨细胞和软骨细胞)的有效短暂资源,可以进一步用于模拟其各自的遗传疾病。然而,以前的方法依赖于从成人组织1获得这些MSC,这带来了从供体获得大量MSC的挑战,并且限制了它们在次优体外培养条件下保持功能存活1,2。这些障碍产生了对体外产生MSCs的方案的巨大需求。人诱导多能干细胞(iPSCs)可用作MSC的宝贵来源,表现出MSC特征3,4,5。iPSCs衍生的间充质干细胞可用作多种疾病的治疗选择。此外,iPSCs衍生的MSCs产生脂肪细胞的能力使其成为研究人类脂肪生成,肥胖和脂肪细胞相关疾病的有价值的体外人类模型。
目前脂肪细胞的分化方案可分为两组,一组涉及使用化学或基于蛋白质的混合物分化脂肪细胞,结果产量为30%-60%6,7,8,9,而另一组涉及遗传操作以稳健地诱导控制脂肪细胞发育的关键转录因子,以产生80%-90%10的产量,11.然而,基因操作并不能概括脂肪细胞分化的自然过程,并且经常掩盖脂肪生成过程中到达的微妙范式,使其对疾病建模目的无效12,13。因此,我们提出了一种通过使用尼罗河红荧光标记含脂脂肪细胞来将化学衍生的成熟脂肪细胞与未成熟脂肪细胞进行分类的方法。
在这里,我们提出了一种协议,涉及将iPSC衍生的拟胚体(EB)与全反式 维甲酸瞬时孵育以产生大量快速增殖的MSC,这可以进一步用于产生脂肪细胞14。我们还提出了一种通过使用亲脂性染料荧光标记其脂滴来从异质分化池中分选化学衍生的成熟脂肪细胞的方法;尼罗河红。这将允许产生具有增强功能的成熟脂肪细胞的纯群体,以准确模拟脂肪细胞相关的代谢紊乱。
研究方案
该研究已获得适当的机构研究伦理委员会的批准,并按照1964年《赫尔辛基宣言》及其后来的修正案或类似的伦理标准中规定的伦理标准进行。该协议已获得HMC(编号16260/16)和QBRI(编号:2016-003)的机构审查委员会(IRB)的批准。这项工作还针对H1和H9等hESC进行了优化。血液样本是在完全知情同意的情况下从健康个体获得的。iPSCs由健康个体的外周血单核细胞(PBMC)产生。
1. 培养和维持 iPSC
- 通过在敲除DMEM中以1:80的比例重建涂层基质来制备基底膜基质涂层板,并储存在4°C。
- 通过将 50 mL 的 10 x 干细胞补充剂培养基与 5 mL 的 100 x 青霉素-链霉素 (P/S) 一起制备 iPSC 培养基,并在 4 °C 下短期储存或长期储存在 -20 °C。
- 将板与包衣基质-1 mL 用于 6 孔板,500 μL 用于 12 孔板,250 μL 用于 24 孔板 - 并将板在 37 °C 下孵育 1-2 小时。
- 取出等分试样的iPSCs培养基,并在使用前在室温下预热。
- 在37°C水浴中解冻一瓶iPSC(ESC或iPSC),并转移到含有2-3mL培养基的15 mL锥形管中。
- 在室温(RT-23°C)下以120× g 离心管4分钟。
- 除去上清液,加入 2 mL 补充有 10 μM ROCK 抑制剂 (Y-27632) 的新鲜培养基。将细胞接种在基质包被的6孔板的一个孔中,并将板置于37°C。
- 24小时后,取出培养基并用新鲜培养基替换。
- 每天更换培养基,直到细胞达到80%-90%的汇合度。
- 达到汇合后,按照下面概述的步骤传代细胞。
- 取出培养基并用Dulbecco的磷酸盐缓冲盐水(DPBS)洗涤细胞。
- 加入iPSC解离试剂(参见 材料表)-500μL用于6孔板的孔,250μL用于24孔板的孔 - 并在37°C下孵育1分钟。
- 取出解离试剂并将细胞在37°C下干燥孵育1分钟。
- 使用培养基-1 mL 收集细胞,用于 6 孔板的孔,250 μL 用于 24 孔板的孔 - 在 15 mL 锥形管中,并以 120 x g 离心 4 分钟。
- 将细胞重悬于培养基-2 mL 中,用于 6 孔板的孔,500 μL 重悬于补充有 10 μM ROCK 抑制剂的 24 孔板的孔中,并以 40% 汇合度将它们接种在新鲜的基质包被的板上。
2. iPSC分化为间充质干细胞
- 通过将15%胎牛血清(FBS)和1%P / S添加到低葡萄糖DMEM +丙酮酸中来制备MSC分化培养基,并储存在4°C。
- 达到 80% 汇合后,按照以下步骤使用 iPSC 形成拟胚体 (EB)。
- 用DPBS洗涤细胞,并用解离培养基/ EDTA-500μL孵育它们,用于6孔板的孔,250μL用于24孔板的孔。
- 在37°C孵育1分钟,吸出解离试剂并将细胞保持在37°C再保持1分钟。要开始MSC分化,需要~10-12 x 106 个细胞。
- 使用培养基将细胞收集在 15 mL 锥形管中。确保在收集时非常温和,以防止细胞变单一并允许EB形成。将细胞以120 x g 离心4分钟。
- 将细胞重悬于含有 10 μM ROCK 抑制剂的 3 mL MSC 分化培养基中。
- 在 24 孔超低附着板中混合并分配 0.5 mL/孔。
注意:使用超低附着板会鼓励细胞聚集到EB中,而不是它们附着在表面上。 - 将板置于37°C的培养箱中。
- 24小时后,按照以下步骤用高维甲酸(RA)处理诱导获得的EB。
- 将 10 μM RA 加入 3 mL MSC 分化培养基中。在 15 mL 管中收集 EB,并让它们稳定 15 分钟。
- 从EB中取出上清液,加入补充有10μM RA的MSC分化培养基。
- 轻轻重悬,并将 0.5 mL/孔分布在同一 24 孔超低附着板中。
- 将板置于37°C的培养箱中。 在接下来的48小时内不要打扰EB。
- 48小时后,在15mL管中收集EB,并让它们稳定15分钟。
- 从EB中取出上清液,加入补充有0.1μM RA的MSC分化培养基。
- 轻轻重悬,并将 0.5 mL/孔分布在同一 24 孔超低附着板中。
- 将板置于37°C的培养箱中。 在接下来的48小时内不要打扰EB。
- 按照下面概述的步骤删除添加到单元格中的 RA。
- 最后一次RA处理48小时后,收集EB并让它们稳定15分钟。
- 除去上清液并加入不含细胞因子的DMEM低葡萄糖培养基。
- 轻轻重悬并将 0.5 mL/孔分布在 24 孔超低附着板中。将板置于37°C的培养箱中。
- 按照下面概述的步骤对 iPSC 衍生的 EB 进行铺板。
- 从上一步(步骤2.4)开始48小时后,将EB收集在15mL管中并让它们稳定15分钟。
- 除去上清液并重悬于 2 mL 新鲜 MSC 分化培养基中。
- 转移到基底膜基质涂层的6孔板的两个孔中。
- 每隔一天更换一次介质,再增加 5 天。
- 5 天后,取出用过的培养基,并用含有 2.5 ng/mL 碱性成纤维细胞生长因子 (bFGF) 的新鲜 MSC 分化培养基代替。
- 当电镀EB达到80%-90%汇合度时,按照下面概述的步骤通过它们。
- 用DPBS洗涤细胞,加入胰蛋白酶-EDTA-500μL以获得6孔板的孔,并将细胞在37°C孵育3分钟。
- 使用 MSC 分化培养基在 15 mL 锥形管中收集细胞,并以 750 x g 离心 4 分钟。
- 用 2.5 ng/mL 的 bFGF 重悬于 MSC 分化培养基中,并以 1:3 的比例将细胞接种在基底膜基质包被的平板上。
- 当细胞达到70%-80%汇合时重复传代。预计通过2-3次传代将获得3-6百万个细胞。
3. iPSCs来源的MSCs的流式细胞术分析
注意:在经历2-3代后,应访问细胞以提高MSC分化的效率。如果细胞以超过 90% 的效率表达 MSC 分化标志物 - CD44、CD73、CD90 和 CD105,并且不表达高水平的造血标志物 - CD14、CD19、CD34 和 CD45,则分化将被认为是成功的。可以按照以下步骤访问这些标记的效率。
- 使用上述步骤(步骤2.6)传代细胞,并在V底96孔板的一个孔中获得1 x 105 个细胞。
- 在4°C下以375× g 离心板4分钟。
- 将 1 x 105 个细胞重悬于 100 μL 冷 DPBS 中,并用 1 μL 偶联抗体 (Ab)(参见 材料表),并在 4 °C 下孵育 30-40 分钟以防止暴露在光线下。
- 将另外1 x 105 个细胞重悬于100μL冷DPBS中,浓度为1:100的共轭Ab的相应同种型对照,并在4°C下孵育30-40分钟以防止暴露在光线下。
- 孵育后,将板在4°C下以375× g 离心4分钟。 通过在水槽上摇动板来丢弃上清液。
- 将细胞重悬于 100 μL 冷 DPBS 中。
- 将细胞在4°C下以375× g 离心4分钟。 弃去上清液。
- 将细胞重悬于 200 μL 冷 DPBS 中,并收集在深色、冷的 1.5 mL 微量离心管中,并将其保存在冰上,直到通过荧光激活细胞分选 (FACS) 进行分析。
- 对于 FACS 分析,使用侧向散射 (SSC-A) 与前向散射 (FSC-A) 分布细胞以排除碎片。此外,使用前向散射高度(FSC-H)与前向散射面积(FSC-A)分布门控细胞,以区分活细胞群中的单峰和双峰。
注意:细胞相对于每个标记物的同种型对照位移进行门控,并且使用来自每个染色样品的至少10,000个门控事件进行分析。
4. 间充质干细胞分化为脂肪细胞
- 通过将10%敲除血清替代(KOSR),1%谷氨酰胺,1%P / S,4.5ng / μL葡萄糖添加到最小必需培养基(MEM)-α中来制备脂肪细胞分化基础培养基,并储存在4°C。
- 允许 MSC 达到 90% 以上的汇合度。继续培养它们48小时,使它们经历一段时间的生长停滞。
- 通过向基础培养基中加入 100 μg/mL 的 3-异丁基-1-甲基黄嘌呤 (IBMX)、1 μM 地塞米松、0.2 U/mL 胰岛素、100 μM 吲哚美辛和 10 μM 罗格列酮,制备完整的脂肪细胞分化培养基。
- 去除MSC分化培养基并使用DPBS洗涤细胞。
- 加入完整的脂肪细胞分化培养基-2mL用于6孔板的孔,1mL用于12孔板的孔-并将细胞在37°C孵育。 每隔一天更换一次完整的分化培养基,持续 14 天。
5.脂肪细胞分化效率的评价
- 在分化的第14天,通过染色细胞中的脂肪细胞成熟标志物,FABP4和脂联素来检查分化效率。
- 取出培养基并用DPBS洗涤细胞。
- 使用 4% 多聚甲醛 (PFA) - 200 μL 将细胞固定到 24 孔板的孔中 - 并在室温下孵育 15 分钟。
- 丢弃PFA,使用含有0.5%吐温(TBST)的三缓冲盐水洗涤,并将其置于室温下的摇床上15分钟。重复该过程两次。
- 用含有0.5%Triton X-100(PBST)的磷酸盐缓冲盐水透化固定细胞,并将其置于室温振荡器上15-20分钟。
- 弃去PBST并加入封闭缓冲液(PBST中的5%-6%牛血清白蛋白(BSA))-500μL用于6孔板的孔和250μL用于12孔板的孔 - 并在室温下在振荡器上孵育40-60分钟。
- 在2%-3%BSA中稀释针对FABP4,脂联素的一抗,浓度为1:500(参见 材料表)。仅当在不同的动物中饲养时,才将这些抗体加在一起,并将板放在4°C的摇床上过夜。
- 去除一抗并用TBST洗涤细胞三次(每次15分钟),并将其置于室温下的摇床上。
- 在PBST中制备Alexa Fluor二抗(1:500)。将二抗组合中的细胞(根据一抗产生的物种)在室温下孵育60分钟,并用铝箔覆盖板以保护其免受光照。
- 丢弃二抗,用TBST洗涤三次,然后将板放在摇床上。
- 要染色细胞核,加入 1 μg/mL 的 Hoechst 33342-200 μL 以获得在 PBS 中稀释的 24 孔板的孔,并在室温下孵育 5 分钟。
- 弃去赫斯特溶液,向细胞中加入PBS-500 μL,以获得24孔板的孔。保持平板免受光照,直到使用倒置荧光显微镜观察。
6. 使用尼罗河红分选脂肪细胞
- 通过在DMSO中加入1mg / mL尼罗河红储备溶液来制备尼罗河红工作溶液,并储存在-20°C。 在使用前,解冻尼罗河红原液并在DPBS中复溶,以达到300 nM工作溶液浓度。
- 在脂肪细胞分化的第14天或之后,从细胞中丢弃培养基并使用DPBS洗涤。
- 在6孔板的孔中加入尼罗红工作溶液-1mL,并在37°C下孵育15分钟。
- 取出尼罗红溶液,在6孔板的孔中加入胰蛋白酶-EDTA -500μL,并在37°C孵育4分钟。
- 使用含有 5% FBS 的 DMEM 在 15 mL 锥形管中收集细胞。以750 x g 离心4分钟。
- 取出上清液并在DPBS-1 mL中重悬1 x 106 细胞。以750 x g 离心4分钟。
- 取出上清液并在DPBS-1 mL中重悬1 x 106 细胞。使用 FACS 分选仪使用 FL1 通道分离尼罗河红阳性细胞。
- 在脂肪细胞分化培养基中重新培养分选的细胞或收集分选的细胞以进行RNA和蛋白质分离。
- 从分选的细胞中提取RNA,并对脂肪细胞分化标志物(包括 FABP4,PPARG和 C / EBPA)进行相对定量分析。与未分选的细胞相比,尼罗河红阳性细胞的基因表达显着上调至少两倍。
结果
间充质分化过程中细胞的示意图和形态:iPSC 分化为 MSC 涉及跨越 EB 形成、MSC 分化和 MSC 扩增的不同发育阶段(图 1)。在这些发育阶段,细胞由于受到不同的刺激化学物质而获得各种形态。在开始分化时,细胞被铺在悬浮液中,并且预期是圆形的,具有明确的细胞边界,同时直径为小到中等尺寸(图2)。在分化的初始阶段选择悬浮培养细胞使其与自然胚胎发育的过程非常相似,因此该阶段对于成功分化至关重要。EB形成和RA处理阶段之后,在基底膜基质涂层板上电镀EB。EB在电镀时的活力可以通过观察其快速增殖行为来获得,从而产生更多的MSC(图2)。即使将MSCs传到新鲜的基质包被板上,MSCs表现出的这种快速增殖行为仍保留下来,同时保留了特殊的细长形态(图2)。
MSC 表面标志物的定量评估:通过定量 MSC 分化的表面标志物来获得 MSC 的分化效率。产生可靠MSC的良好分化应显示出间充质表面标志物CD73,CD44和CD90的效率大于90%(图3A)。除此之外,还评估细胞是否缺乏描述造血表型CD14,CD34和CD19的表面标志物,因此预计它们的表达效率低于1%(图3B)。
间充质干细胞分化为脂肪细胞:间充质干细胞分化为脂肪细胞可通过FABP4和脂联素染色获得。FABP4是一种细胞质蛋白,被认为是终末分化脂肪细胞的标志物。它在脂肪细胞中的高表达,具有细胞质分布,是其发育成熟的关键标志(图4A)。除FABP4外,脂联素被认为是脂肪细胞成熟的重要标志物之一。其高表达表明脂肪细胞的功能足以响应葡萄糖信号传导进行脂质储存和脂肪生成。作为一种分泌蛋白,脂联素表现出球状形态,每个蛋白球在细胞质内都很容易区分(图4B)。
使用尼罗河红对成熟脂肪细胞进行染色和分选:分化后,可以通过对尼罗河红进行染色将成熟脂肪细胞与未成熟脂肪细胞区分开来。尼罗红与含脂脂肪细胞结合,这是成熟脂肪细胞独有的特征(图5A)。这与尼罗河红的荧光承载特性一起使其成为使用荧光活化流式细胞术分选成熟脂肪细胞的有效工具(图5B)。有效分选应使成熟标记物(PPARG、C/EBPA和FABP4)至少提高两倍,由定量实时PCR(qRT-PCR)确定(图5C)。

图 1:显示 iPSC 分化为间充质干细胞和脂肪细胞的示意图。 iPSC 使用拟胚体 (EB) 技术分化为间充质干细胞。EB经受10μM全反式维甲酸(RA)的短时间暴露。生成的MSC基于iPSC系分化为40%-77%的脂肪细胞。使用FACS对尼罗河红阳性细胞进行分类,以获得纯化的成熟脂肪细胞群,可用于研究脂肪细胞相关疾病(疾病建模),鉴定新药,并最终用于个性化治疗。请点击此处查看此图的大图。
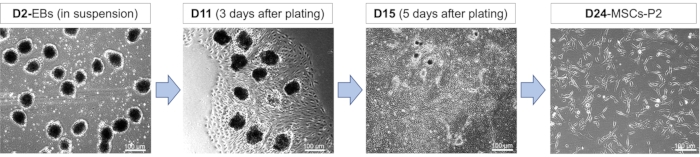
图 2:iPSC 分化为 MSC。 代表性形态学图像显示第 2 天 (D2)、11 天 (D11)、15 天 (D15) 和 24 天 (D24) 分化的不同阶段。在10μMRA存在下产生的拟胚体(EBs)在分化第8天接种24小时,然后在分化12-17天后解离和传代。MSC被多次通过。缩写:P2 = 段落 2。 请点击此处查看此图的大图。

图 3:iPSC 衍生的 MSC 中 MSC 标志物和造血标志物的表达。 代表性流式细胞术直方图显示MSC标志物CD73,CD44和CD90(A)以及造血标志物CD34,CD19和CD14(B)在用10μMRA处理的iPSC衍生EB产生的MSC中的表达。图中的X轴表示荧光强度。 请点击此处查看此图的大图。
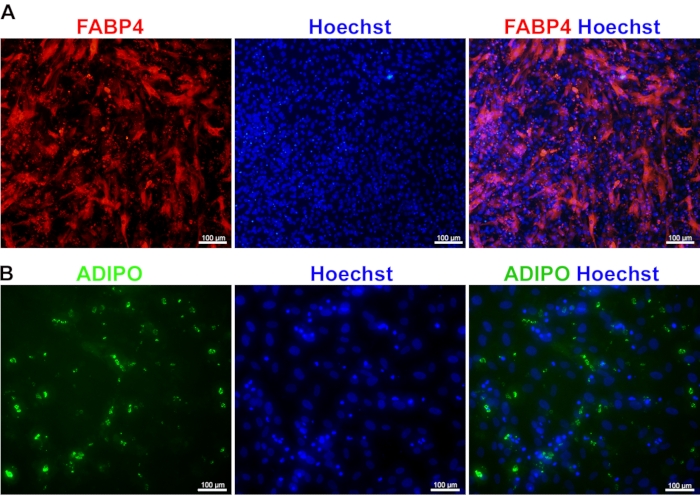
图 4:iPSC 衍生的 MSC 分化为脂肪细胞。 免疫染色图像显示源自 iPSC 的成熟脂肪细胞中 FABP4 (A) 和脂联素 (ADIPO) (B) 的表达。细胞核被赫斯特染色。 请点击此处查看此图的大图。

图 5:使用尼罗河红分选 iPSC 衍生的脂肪细胞。 (A) 显示明场 (BF) 和尼罗河红色染色成熟脂肪细胞的图像。(B)使用FACS定量成熟脂肪细胞中的尼罗红(PE阳性细胞)。(C)实时PCR分析显示C / EBPA,FABP4和PPARG在分选与未分类的成熟脂肪细胞中的表达。数据表示为平均值±SD;*p < 0.05, **p < 0.01, ****p < 0.001。请点击此处查看此图的大图。
讨论
该协议至关重要,因为它能够提供高产量和高效率的MSC。这种大规模生产MSCs是通过将iPSCs衍生的EB与10μM的RA14,15瞬时孵育来实现的。用 10 μM RA 瞬时处理将 MSC 产量提高了 11.2 至 1542 倍14,15,该方案适用于 iPSC 和 hPSC。在此剂量和治疗持续时间下,RA通过直接或间接调节参与细胞增殖,凋亡以及细胞间和ECM细胞粘附的几种基因的表达来提高EB形成细胞的增殖和存活能力,这对于iPSCs的存活和增殖至关重要14,16.这些基因包括但不限于转录因子(如EGFR4,SOX4),生长因子和生长因子受体(如IGF2,FGFR4)以及粘附分子(如FN1和CAM)。然而,与低剂量(0.1-10μM)相比,在高剂量(≥20μM)下,RA负调节EB形成细胞的增殖和存活,导致PSC衍生的EB数量和大小减少,从而降低MSC14的产量。RA被认为是几种正常分化和癌细胞中的增殖抑制剂17,18,19。在EB中,类视黄醇信号传导与上下文(时间、浓度、物种和细胞系)有关;通过调节不同的基因和信号通路差异影响EB形成细胞的自我更新,存活和分化20,21。因此,在EB诱导的第3天以最佳时间和RA-10μM浓度使用RA,然后在第5天将剂量减少至0.1μM,持续2天,如本协议中所述 - 对于诱导EB形成细胞存活和增殖至关重要。
除了调节生长和存活外,与未用RA14处理的细胞相比,RA确实使处理过的EB受到分化延迟。事实上,与未经RA处理的EB相比,RA处理的EB在电镀后保持其紧凑的形状,并且无法分化成MSC样细胞。这与先前的研究报告一致,即短期暴露于RA治疗通过抑制WNT信号传导来抑制细胞分化21。此外,这些RA处理的分化延迟细胞还显示出钙粘蛋白和细胞外基质蛋白14的增强表达,已知它们在维持iPSC16的多能状态中起重要作用。为了释放RA介导的分化块,应解离EB,这会导致细胞粘附中断,并允许在接种时长期分化MSC。有趣的是,RA处理确实在细胞上保持分化阻断,但它并没有将细胞维持在多能状态。事实上,短期暴露于 10 μM RA 的 EB 形成细胞显示出关键多能性标志物 - OCT4、SOX2 和 NANOG14 的表达显着降低。
通过短期RA处理EB产生的MSC已被证明可以保持其典型的成纤维细胞样形态,具有丰富的MSC表面标志物表达及其冷冻保存后的多能性,从而使这些大规模生产的MSCs可储存用于长期扩增研究14。当将它们置于脂肪,软骨和成骨分化条件下时,这些MSCs可以很容易地分化成三种中胚层细胞类型,从而使它们成为模拟组织相关疾病的容易获得的来源14。因此,由RA介导的分化方案产生的MSCs的稳定和通用的 体外 行为使它们在研究和基于应用的环境中至关重要。
虽然从RA处理的EB获得的MSC的软骨和成骨分化潜力似乎与从未经处理的EB获得的MSCs相似,但发现前者在接受脂肪分化条件时显示出增强的分化成脂肪谱系的潜力14。与来自未经RA处理的EB的MSC相比,用RA处理的EB培养后的MSCs后获得的细胞分化池中的细胞内脂质积累(油红O染色)和脂肪细胞标志物FABP4阳性细胞增加了2至3倍。这可能是RA调节控制脂肪细胞发育的几种信号通路的结果,如Hippo,WNT和ECM-细胞相互作用途径,如RA处理和未处理EB的RNA测序数据所揭示的那样14,22,23,24,25。RA衍生的MSCs进行脂肪分化的增强能力是有价值的,因为目前可用的方案要么导致脂肪细胞产量低下,要么利用遗传操作使生成的脂肪细胞对于获得自然过程的重述脂肪细胞非常有价值。脂肪细胞分为三种类型——白色、棕色和米色。白色脂肪细胞通过单个脂滴的存在进行分类,并在能量储存中发挥作用。然而,棕色脂肪细胞通过底物氧化参与能量消耗,因为以UCP1表达为特征的线粒体丰度非常高。而发现位于白色脂肪组织中的棕色脂肪细胞被称为米色或棕色样脂肪细胞。鉴于EB预先暴露于RA,这些MSC有可能提供丰富的白色脂肪细胞产量。以前的出版物已经指出,将iPSC选择性诱导到表达低UCP1的细胞中,即白色脂肪细胞,而不是将具有高UCP1水平的细胞暴露于RA26。以前的出版物报道,小鼠和斑马鱼胚胎中神经嵴细胞产生的RA在白色脂肪细胞形成中起重要作用27,28。
尽管基于RA的方案允许产生MSC,其脂肪细胞产量增加达到48.5%-77.4%(而没有RA治疗时为22.5%-57.6%),但在模拟基于多变异脂肪细胞的遗传疾病时,未达到>90%仍然是有问题的 in vitro.事实上,没有达到纯脂肪细胞群体可能会使来自多变异疾病模型的结果变得矛盾,因为很难区分观察到的发育差异是由于不同的基因组成还是由于不一致的分化效率。为了规避这个问题,重要的是对分化的细胞进行分类以获得纯成熟脂肪细胞库,这样表型的任何差异只能归因于固有的遗传差异。一些研究已经确定了脂肪细胞上可能用于分选的表面标志物。例如,Ronald Kahn进行的工作允许将氨基酸转运蛋白ASC-1鉴定为白色脂肪细胞上的新型表面标记物29.此外,从网膜和皮下区域提取成熟脂肪细胞的研究报告了成熟脂肪细胞在其表面表达 CD34、CD36 和 CD5930,据报道CD36在成熟脂肪细胞表面作为脂肪酸转运蛋白起作用31.然而,这些研究利用了来自脂肪组织的异质细胞群,而没有将这些标志物的表达指定为仅成熟的脂肪细胞群。此外,这些标志物也可以由其他细胞类型表达,并且对脂肪细胞不具有特异性。例如,ASC-1同时存在于星形胶质细胞和神经元上32,CD34是造血干细胞的标志物33,CD36 存在于血小板、单核吞噬细胞、肝细胞、肌细胞和一些上皮细胞上33,CD59在内皮细胞和淋巴细胞上表达34,35.因此,作为替代溶液,尼罗红(细胞内脂质的选择性荧光染色剂)被用作分选脂肪细胞的可能候选者。脂肪细胞储存了大量的脂质,这些脂质可以释放并用于产生能量、构建膜或作为调节新陈代谢的信号分子36.尼罗河红染料以前已用于流式细胞术和显微镜检查,以染色来自小鼠和人间充质干细胞的脂肪细胞37.以前的研究报告了尼罗河红用于ESC衍生的脂肪细胞和分选后脂肪细胞标志物的增强38.评估由当前基于RA的方案获得的MSC产生的脂肪细胞被尼罗河红染色的能力,表明其成熟度,并对其进行分类以纯化它们。这些尼罗河红分选细胞的脂肪细胞成熟标志物的表达增加了两到三倍,包括 PPARG, C/EBPA和 FABP4 与未分选的细胞相比,从而进一步提高了iPSCs衍生脂肪细胞的产量。虽然这些标志物在脂质积累之前表达,但它们的表达标记细胞以终末分化为含脂质的脂肪细胞。通过这些标记检查分选效率使我们能够识别出所有细胞都表达的池 FABP4, CEBPa和 PPARg,表示一个池,它注定要形成成熟的脂肪细胞。根据细胞对尼罗河红的染色潜力对细胞进行分选。由于未分选馏分中的脂肪细胞数量较多,纯化效率提高了两到三倍。含脂脂肪细胞的大小在分化过程中变化很大,其中具有相同大小分布的细胞池被分选。未分类的组分包括含脂脂肪细胞,但它们尚未完全成熟,并且由不同的大小比例控制.
先前已报道从人体中分离出的间充质性干细胞的异质性39。这种异质性取决于几个因素,例如MSC来源,供体和条件39。这可能会导致它们治疗不同疾病的效率发生变化。这项研究表明,在符合良好生产规范(GMP)的培养条件下对hPSCs进行短期RA处理将使MSCs群体均匀。这表明目前的方案是一种有前途的方法,可以产生大量可用于基于MSC的治疗的临床级MSC。
基于RA的MSC分化方案与尼罗河红分选方案相结合,使我们能够获得iPSCs衍生的脂肪细胞,增强功能标志物的表达并提高产量和纯度。因此,这种组合方案将允许从遗传上不同的个体中产生足够数量和纯度的成熟脂肪细胞,并可能发现脂肪细胞相关代谢紊乱背后的新遗传变异。
披露声明
提交人声明他们没有竞争利益。
致谢
这项工作由卡塔尔国家研究基金(QNRF)资助(资助号NPRP10-1221-160041)。Maryam Aghadi得到了卡塔尔国家研究基金(QNRF)的GSRA奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Adiponectin | Abcam | ab22554 | Adipocyte maturation marker |
| anti-CD105 | BD Pharmingen | 560839 | MSC differentiation marker |
| anti-CD14 | BD Pharmingen | 561712 | MSC differentiation marker |
| anti-CD19 | BD Pharmingen | 555415 | MSC differentiation marker |
| anti-CD34 | BD Pharmingen | 555824 | MSC differentiation marker |
| anti-CD44 | abcam | ab93758 | MSC differentiation marker |
| anti-CD45 | BD Pharmingen | 560975 | MSC differentiation marker |
| anti-CD73 | BD Pharmingen | 550256 | MSC differentiation marker |
| anti-CD90 | BD Pharmingen | 555596 | MSC differentiation marker |
| bFGF | R&D | 233-FP | MSC culture media supplement |
| C/EBPA | Abcam | ab40761 | Adipocyte maturation marker |
| Dexamethasone | Torics | 1126 | Adipocyte differentiation media supplement |
| FABP4 | Abcam | ab93945 | Adipocyte maturation marker |
| Fetal bovine serum | ThermoFisher | 10082147 | MSC culture media supplement |
| Glutamax | ThermoFisher | 35050-061 | MSC culture media supplement |
| IBMX | Sigma Aldrich | I5879 | Adipocyte differentiation media supplement |
| Indomethacin | Sigma Aldrich | I7378 | Adipocyte differentiation media supplement |
| Insulin | Sigma Aldrich | 91077C | Adipocyte differentiation media supplement |
| Knockout DMEM | ThermoFisher | 12660012 | Basal media for preparing matrigel |
| Low glucose DMEM | ThermoFisher | 11885084 | MSC culturing media |
| Matrigel | Corning | 354230 | Coating matrix |
| MEM-alpha | ThermoFisher | 12561056 | Adipocyte differentiation media |
| Nilered | Sigma Aldrich | 19123 | Sorting marker for adipocyte |
| Penicillin | ThermoFisher | 15140122 | MSC/Adipocyte media supplement |
| Phosphate-buffered saline | ThermoFisher | 14190144 | wash buffer |
| Pierce™ 20X TBS Buffer | Thermo Fisher | 28358 | wash buffer |
| PPARG | Cell Signaling Technology | 2443 | Adipocyte maturation marker |
| ReLeSR | Stem Cell Technologies | 5872 | Dissociation reagent |
| Retinoic acid | Sigma Aldrich | R2625 | MSC differentiation media supplement |
| Rock inhibitor | Tocris | 1254/10 | hPSC culture media supplement |
| Roziglitazone | Sigma Aldrich | R2408 | Adipocyte differentiation media supplement |
| StemFlex | ThermoFisher | A334901 | hPSC culture media |
| Triton | Thermo Fisher | 28314 | Permebealization reagent |
| Trypsin | ThermoFisher | 25200072 | Dissociation reagent |
| Tween 20 | Sigma Aldrich | P7942 | Wash buffer |
参考文献
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling: CCS. 9, 12(2011).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PLoS One. 4 (6), 5846(2009).
- Brown, P. T., Squire, M. W., Li, W. J. Characterization and evaluation of mesenchymal stem cells derived from human embryonic stem cells and bone marrow. Cell and Tissue Research. 358 (1), 149-164 (2014).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Experimental Hematology. 36 (3), 350-359 (2008).
- Barberi, T., Willis, L. M., Socci, N. D., Studer, L. Derivation of multipotent mesenchymal precursors from human embryonic stem cells. PLoS Medicine. 2 (6), 161(2005).
- Xiong, C., et al. Derivation of adipocytes from human embryonic stem cells. Stem Cells and Development. 14 (6), 671-675 (2005).
- Cuaranta-Monroy, I., et al. Highly efficient differentiation of embryonic stem cells into adipocytes by ascorbic acid. Stem Cell Research. 13 (1), 88-97 (2014).
- van Harmelen, V., et al. Differential lipolytic regulation in human embryonic stem cell-derived adipocytes. Obesity (Silver Spring). 15 (4), 846-852 (2007).
- Noguchi, M., et al. In vitro characterization and engraftment of adipocytes derived from human induced pluripotent stem cells and embryonic stem cells. Stem Cells and Development. 22 (21), 2895-2905 (2013).
- Ahfeldt, T., et al. Programming human pluripotent stem cells into white and brown adipocytes. Nature Cell Biology. 14 (2), 209-219 (2012).
- Lee, Y. K., Cowan, C. A. Differentiation of white and brown adipocytes from human pluripotent stem cells. Methods in Enzymology. 538, 35-47 (2014).
- Abdelalim, E. M. Modeling different types of diabetes using human pluripotent stem cells. Cellular and Molecular Life Sciences: CMLS. 78 (6), 2459-2483 (2021).
- Abdelalim, E. M., Bonnefond, A., Bennaceur-Griscelli, A., Froguel, P. Pluripotent stem cells as a potential tool for disease modelling and cell therapy in diabetes. Stem Cell Reviews and Reports. 10 (3), 327-337 (2014).
- Karam, M., Younis, I., Elareer, N. R., Nasser, S., Abdelalim, E. M. Scalable Generation of mesenchymal stem cells and adipocytes from human pluripotent stem cells. Cells. 9 (3), (2020).
- Karam, M., Abdelalim, E. M. Robust and highly efficient protocol for differentiation of human pluripotent stem cells into mesenchymal stem cells. Methods in Molecular Biology. , Clifton, N.J. (2020).
- Li, L., Bennett, S. A., Wang, L. Role of E-cadherin and other cell adhesion molecules in survival and differentiation of human pluripotent stem cells. Cell Adhesion & Migration. 6 (1), 59-70 (2012).
- Lai, L., Bohnsack, B. L., Niederreither, K., Hirschi, K. K. Retinoic acid regulates endothelial cell proliferation during vasculogenesis. Development. 130 (26), 6465-6474 (2003).
- Chanchevalap, S., Nandan, M. O., Merlin, D., Yang, V. W. All-trans retinoic acid inhibits proliferation of intestinal epithelial cells by inhibiting expression of the gene encoding Kruppel-like factor 5. FEBS Letters. 578 (1-2), 99-105 (2004).
- di Masi, A., et al. Retinoic acid receptors: from molecular mechanisms to cancer therapy. Molecular Aspects of Medicine. 41, 1(2015).
- Simandi, Z., Balint, B. L., Poliska, S., Ruhl, R., Nagy, L. Activation of retinoic acid receptor signaling coordinates lineage commitment of spontaneously differentiating mouse embryonic stem cells in embryoid bodies. FEBS Letters. 584 (14), 3123-3130 (2010).
- De Angelis, M. T., Parrotta, E. I., Santamaria, G., Cuda, G. Short-term retinoic acid treatment sustains pluripotency and suppresses differentiation of human induced pluripotent stem cells. Cell Death & Disease. 9 (1), 6(2018).
- Li, L., Dong, L., Wang, Y., Zhang, X., Yan, J. Lats1/2-mediated alteration of hippo signaling pathway regulates the fate of bone marrow-derived mesenchymal stem cells. BioMed Research International. 2018, 4387932(2018).
- Moldes, M., et al. Peroxisome-proliferator-activated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis. The Biochemical Journal. 376, Pt 3 607-613 (2003).
- Ross, S. E., et al. Inhibition of adipogenesis by Wnt signaling. Science. 289 (5481), 950-953 (2000).
- Wang, Y. K., Chen, C. S. Cell adhesion and mechanical stimulation in the regulation of mesenchymal stem cell differentiation. Journal of Cellular and Molecular Medicine. 17 (7), 823-832 (2013).
- Mohsen-Kanson, T., et al. Differentiation of human induced pluripotent stem cells into brown and white adipocytes: role of Pax3. Stem Cells. 32 (6), 1459-1467 (2014).
- Billon, N., et al. The generation of adipocytes by the neural crest. Development. 134 (12), 2283-2292 (2007).
- Li, N., Kelsh, R. N., Croucher, P., Roehl, H. H. Regulation of neural crest cell fate by the retinoic acid and Pparg signalling pathways. Development. 137 (3), 389-394 (2010).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Festy, F., et al. Surface protein expression between human adipose tissue-derived stromal cells and mature adipocytes. Histochemistry and Cell Biology. 124 (2), 113-121 (2005).
- Cai, L., Wang, Z., Ji, A., Meyer, J. M., vander Westhuyzen, D. R. Scavenger receptor CD36 expression contributes to adipose tissue inflammation and cell death in diet-induced obesity. PLoS One. 7 (5), 36785(2012).
- Mesuret, G., et al. A neuronal role of the Alanine-Serine-Cysteine-1 transporter (SLC7A10, Asc-1) for glycine inhibitory transmission and respiratory pattern. Scientific Reports. 8 (1), 8536(2018).
- Silverstein, R. L., Febbraio, M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior. Science Signaling. 2 (72), (2009).
- Brooimans, R. A., van Wieringen, P. A., van Es, L. A., Daha, M. R. Relative roles of decay-accelerating factor, membrane cofactor protein, and CD59 in the protection of human endothelial cells against complement-mediated lysis. European Journal of Immunology. 22 (12), 3135-3140 (1992).
- Davies, A., et al. CD59, an LY-6-like protein expressed in human lymphoid cells, regulates the action of the complement membrane attack complex on homologous cells. The Journal of Experimental Medicine. 170 (3), 637-654 (1989).
- Lapid, K., Graff, J. M. Form(ul)ation of adipocytes by lipids. Adipocyte. 6 (3), 176-186 (2017).
- Aldridge, A., et al. Assay validation for the assessment of adipogenesis of multipotential stromal cells--a direct comparison of four different methods. Cytotherapy. 15 (1), 89-101 (2013).
- Schaedlich, K., Knelangen, J. M., Navarrete Santos, A., Fischer, B., Navarrete Santos, A. A simple method to sort ESC-derived adipocytes. Cytometry A. 77 (10), 990-995 (2010).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences: CMLS. 78 (2), 447-467 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。