Method Article
تمايز قوي ل iPSCs البشرية إلى مجموعة نقية من الخلايا الشحمية لدراسة الاضطرابات المرتبطة بالخلايا الشحمية
In This Article
Summary
يسمح البروتوكول بتوليد مجموعة من الخلايا الشحمية النقية من الخلايا الجذعية المستحثة متعددة القدرات (iPSCs). يستخدم حمض الريتينويك للتمييز بين الخلايا الجذعية المستحثة متعددة القدرات إلى خلايا جذعية وسيطة (MSCs) تستخدم لإنتاج الخلايا الشحمية. بعد ذلك ، يتم استخدام نهج الفرز على أساس تلطيخ النيل الأحمر للحصول على الخلايا الشحمية النقية.
Abstract
سمحت التطورات الحديثة في تقنية الخلايا الجذعية المستحثة متعددة القدرات (iPSC) بتوليد أنواع مختلفة من الخلايا ، بما في ذلك الخلايا الشحمية. ومع ذلك ، فإن طرق التمايز الحالية لها كفاءة منخفضة ولا تنتج مجموعة متجانسة من الخلايا الشحمية. هنا ، نتحايل على هذه المشكلة باستخدام طريقة قائمة على الريتينويك بالكامل لإنتاج الخلايا الجذعية الوسيطة (MSCs) ذات العائد العالي. من خلال تنظيم المسارات التي تحكم تكاثر الخلايا وبقائها والالتصاق ، تسمح استراتيجية التمايز الخاصة بنا بالتوليد الفعال للأجسام الجنينية (EBs) التي تتمايز إلى مجموعة نقية من MSCs متعددة القدرات. يوفر العدد الكبير من MSCs الناتجة عن هذه الطريقة مصدرا مثاليا لتوليد الخلايا الشحمية. ومع ذلك ، لا يزال عدم تجانس العينة الناتج عن تمايز الخلايا الشحمية يمثل تحديا. لذلك ، استخدمنا طريقة تعتمد على أحمر النيل لتنقية الخلايا الشحمية الناضجة الحاملة للدهون باستخدام FACS. سمحت لنا استراتيجية الفرز هذه بإنشاء طريقة موثوقة لنمذجة الاضطرابات الأيضية المرتبطة بالخلايا الشحمية باستخدام مجموعة من الخلايا الشحمية مع تقليل عدم تجانس العينة وتحسين وظائف الخلية.
Introduction
تعمل الخلايا الجذعية الوسيطة (MSCs) كمورد انتقالي فعال لإنتاج خلايا من أصل الأديم المتوسط مثل الخلايا الشحمية والخلايا العظمية والخلايا الغضروفية ، والتي يمكن استخدامها بشكل أكبر لنمذجة الاضطرابات الوراثية الخاصة بكل منها. ومع ذلك ، اعتمدت الأساليب السابقة على الحصول على هذه MSCs من الأنسجة البالغة 1 ، مما فرض التحدي المتمثل في الحصول عليها بأعداد كبيرة من المتبرعين ، والحد من إبقائها قابلة للحياة وظيفيا في ظروف الزراعة المختبرية دون المستوى الأمثل 1,2. أنتجت هذه العقبات طلبا كبيرا على وجود بروتوكول لتوليد MSCs في المختبر. يمكن استخدام الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (iPSCs) كمصدر قيم ل MSCs ، حيث تظهر خصائص MSC3،4،5. يمكن استخدام MSCs المشتقة من iPSCs كخيار علاجي في العديد من الأمراض. أيضا ، فإن قدرة MSCs المشتقة من iPSCs على توليد الخلايا الشحمية ، تجعلها نموذجا بشريا قيما في المختبر لدراسة تكوين الدهون البشرية والسمنة والاضطرابات المرتبطة بالخلايا الشحمية.
يمكن تصنيف بروتوكولات التمايز الحالية للخلايا الشحمية إلى مجموعتين ، إحداهما تتضمن تمايز الخلايا الشحمية باستخدام الكوكتيلات الكيميائية أو البروتينية التي تعطي عائدا ناتجا بنسبة 30٪ -60٪ 6،7،8،9 ، بينما تتضمن الأخرى التلاعب الجيني لتحريض قوي لعوامل النسخ الرئيسية التي تحكم تطور الخلايا الشحمية لإعطاء عائد 80٪ -90٪ 10 ، 11. ومع ذلك ، فإن التلاعب الجيني لا يلخص العملية الطبيعية لتمايز الخلايا الشحمية ، وغالبا ما يخفي النماذج الدقيقة التي تصل أثناء تكوين الدهون ، مما يجعلها غير فعالة لأغراض نمذجة المرض12،13. لذلك ، نقدم طريقة لفرز الخلايا الشحمية الناضجة المشتقة كيميائيا من الخلايا الشحمية غير الناضجة عن طريق وضع علامات على الخلايا الشحمية الحاملة للدهون باستخدام أحمر النيل.
نقدم هنا بروتوكولا يتضمن الحضانة العابرة للأجسام الجنينية المشتقة من iPSCs (EBs) مع حمض الريتينويك المتحولة بالكامل لإنتاج عدد كبير من MSCs سريعة التكاثر ، والتي يمكن استخدامها بشكل أكبر لتوليد الخلايا الشحمية14. نقدم أيضا طريقة لفرز الخلايا الشحمية الناضجة المشتقة كيميائيا من مجموعة التمايز غير المتجانسة عن طريق وضع علامات على قطرات الدهون الخاصة بها باستخدام صبغة محبة للدهون. أحمر النيل. وهذا من شأنه أن يسمح بتوليد مجموعة نقية من الخلايا الشحمية الناضجة مع وظائف محسنة لنمذجة الاضطرابات الأيضية المرتبطة بالخلايا الشحمية بدقة.
Protocol
تمت الموافقة على الدراسة من قبل لجنة أخلاقيات البحث المؤسسي المناسبة وتم إجراؤها وفقا للمعايير الأخلاقية على النحو المنصوص عليه في إعلان هلسنكي لعام 1964 وتعديلاته اللاحقة أو المعايير الأخلاقية المماثلة. وتمت الموافقة على البروتوكول من قبل مجلس المراجعة المؤسسية التابع لمؤسسة حمد الطبية (رقم 16260/16) ومعهد قطر لبحوث الطب الحيوي (رقم 2016-003). تم تحسين هذا العمل أيضا ل hESCs مثل H1 و H9. تم الحصول على عينات الدم من الأفراد الأصحاء بموافقة مستنيرة كاملة. يتم إنشاء iPSCs من خلايا الدم أحادية النواة المحيطية (PBMCs) للأفراد الأصحاء.
1. زراعة وصيانة iPSCs
- قم بإعداد الألواح المطلية بمصفوفة الغشاء القاعدي عن طريق إعادة تشكيل مصفوفة الطلاء بالضربة القاضية-DMEM بنسبة 1:80 وتخزينها عند 4 درجات مئوية.
- قم بإعداد وسائط استزراع iPSCs عن طريق إضافة 50 مل من وسائط مكملات الخلايا الجذعية 10x إلى 500 مل من الوسائط القاعدية للخلايا الجذعية ، جنبا إلى جنب مع 5 مل من 100x البنسلين والستربتومايسين (P / S) وتخزينها في 4 درجات مئوية على المدى القصير أو عند -20 درجة مئوية للاستخدام على المدى الطويل.
- قم بتبطين الألواح بمصفوفة طلاء -1 مل للوحة 6 آبار ، و 500 ميكرولتر للوحة 12 بئرا ، و 250 ميكرولتر للوحة 24 بئرا - واحتضان اللوحة عند 37 درجة مئوية لمدة 1-2 ساعة.
- قم بإزالة حصة من وسائط الاستزراع iPSCs وقم بتسخينها مسبقا في درجة حرارة الغرفة قبل الاستخدام.
- قم بإذابة قارورة من iPSCs (ESCs أو iPSCs) في حمام مائي 37 درجة مئوية وانقلها إلى أنبوب مخروطي سعة 15 مل يحتوي على 2-3 مل من وسائط الاستزراع.
- جهاز طرد مركزي الأنبوب عند 120 × جم لمدة 4 دقائق في درجة حرارة الغرفة (RT-23 درجة مئوية).
- قم بإزالة المادة الطافية وأضف 2 مل من وسائط الاستزراع الطازجة المكملة بمثبط 10 ميكرومتر ROCK (Y-27632). قم بطلاء الخلايا في بئر واحدة من صفيحة 6 آبار مطلية بالمصفوفة وضع اللوحة عند 37 درجة مئوية.
- بعد 24 ساعة ، قم بإزالة الوسائط واستبدالها بوسائط ثقافية جديدة.
- قم بتغيير الوسائط كل يوم حتى تصل الخلايا إلى التقاء 80٪ -90٪.
- عند الوصول إلى نقطة التقاء ، تمر الخلايا باتباع الخطوات الموضحة أدناه.
- قم بإزالة الوسائط وغسل الخلايا بمحلول ملحي مخزن بالفوسفات من Dulbecco (DPBS).
- أضف كاشف تفكك iPSCs (انظر جدول المواد) -500 ميكرولتر لبئر صفيحة 6 آبار ، 250 ميكرولتر لبئر صفيحة 24 بئر - واحتضان لمدة 1 دقيقة عند 37 درجة مئوية.
- قم بإزالة كاشف التفكك واحتضان الخلايا الجافة لمدة 1 دقيقة عند 37 درجة مئوية.
- اجمع الخلايا باستخدام وسائط الاستزراع - 1 مل لبئر صفيحة 6 آبار و 250 ميكرولتر لبئر صفيحة 24 بئرا - في أنبوب مخروطي 15 مل وأجهزة طرد مركزي عند 120 × جم لمدة 4 دقائق.
- إعادة تعليق الخلايا في وسط الاستزراع -2 مل لبئر صفيحة 6 آبار و 500 ميكرولتر لبئر من 24 بئرا مكملة بمثبط ROCK 10 ميكرومتر ووضعها على ألواح مغلفة بمصفوفة جديدة عند التقاء 40٪.
2. تمايز iPSC إلى MSCs
- قم بإعداد وسائط تمايز MSC عن طريق إضافة 15٪ مصل بقري جنيني (FBS) و 1٪ P / S إلى DMEM منخفض الجلوكوز + بيروفات وتخزينها عند 4 درجات مئوية.
- عند الوصول إلى التقاء 80٪ ، استخدم iPSCs لتشكيل الجسم الجنيني (EB) باتباع الخطوات الموضحة أدناه.
- اغسل الخلايا باستخدام DPBS واحتضانها بوسط التفكك / EDTA-500 ميكرولتر لبئر من صفيحة 6 آبار ، 250 ميكرولتر لبئر صفيحة 24 بئر.
- احتضان في 37 درجة مئوية لمدة 1 دقيقة ، نضح كاشف التفكك والحفاظ على الخلايا في 37 درجة مئوية لمدة 1 دقيقة إضافية. لبدء تمايز MSC ، ~ 10-12 × 106 خلايا مطلوبة.
- اجمع الخلايا في أنبوب مخروطي سعة 15 مل باستخدام وسائط الثقافة. تأكد من أن تكون لطيفا جدا أثناء التجميع لمنع الخلايا من التفرد والسماح بتكوين EB. أجهزة الطرد المركزي الخلايا في 120 × ز لمدة 4 دقائق.
- أعد تعليق الخلايا في 3 مل من وسائط تمايز MSC التي تحتوي على مثبط 10 ميكرومتر ROCK.
- امزج ووزع 0.5 مل / بئر في لوحة تثبيت منخفضة للغاية من 24 بئرا.
ملاحظة: قد يشجع استخدام لوحة التثبيت المنخفضة للغاية على تجميع الخلايا في EBs بدلا من ارتباطها على السطح. - ضع اللوحة في الحاضنة عند 37 درجة مئوية.
- بعد 24 ساعة ، حث EBs التي تم الحصول عليها مع علاج حمض الريتينويك العالي (RA) باتباع الخطوات الموضحة أدناه.
- أضف 10 ميكرومتر RA إلى 3 مل من وسائط التمايز MSC. اجمع EBs في أنبوب سعة 15 مل واتركها تستقر لمدة 15 دقيقة.
- قم بإزالة المادة الطافية من EBs وأضف وسائط تمايز MSC مكملة ب 10 ميكرومتر RA.
- أعد التعليق برفق وقم بتوزيع 0.5 مل / بئر في نفس لوحة التثبيت منخفضة للغاية ذات 24 بئرا.
- ضع اللوحة في الحاضنة عند 37 درجة مئوية. لا تزعج EBs لمدة 48 ساعة القادمة.
- بعد 48 ساعة ، اجمع EBs في أنبوب سعة 15 مل واتركها تستقر لمدة 15 دقيقة.
- قم بإزالة المادة الطافية من EBs وأضف وسائط تمايز MSC مكملة ب 0.1 ميكرومتر RA.
- أعد التعليق برفق وقم بتوزيع 0.5 مل / بئر في نفس لوحة التثبيت منخفضة للغاية ذات 24 بئرا.
- ضع اللوحة في الحاضنة عند 37 درجة مئوية. لا تزعج EBs لمدة 48 ساعة القادمة.
- قم بإزالة RA المضافة إلى الخلايا باتباع الخطوات الموضحة أدناه.
- بعد 48 ساعة من آخر علاج التهاب المفاصل الروماتويدي ، اجمع EBs واسمح لهم بالاستقرار لمدة 15 دقيقة.
- قم بإزالة المادة الطافية وإضافة وسائط منخفضة الجلوكوز DMEM بدون السيتوكينات.
- أعد التعليق برفق ووزع 0.5 مل / بئر في لوحة تثبيت منخفضة للغاية تبلغ 24 بئرا. ضع اللوحة في الحاضنة عند 37 درجة مئوية.
- قم بتمييز EBs المشتقة من iPSCs باتباع الخطوات الموضحة أدناه.
- بعد 48 ساعة من الخطوة السابقة (الخطوة 2.4) ، اجمع EBs في أنبوب سعة 15 مل واتركها تستقر لمدة 15 دقيقة.
- قم بإزالة المادة الطافية وإعادة تعليقها في 2 مل من وسائط تمايز MSC الجديدة.
- نقل إلى بئرين من صفيحة 6 آبار مغلفة بمصفوفة الغشاء القاعدي.
- قم بتغيير الوسائط كل يومين لمدة 5 أيام إضافية.
- بعد 5 أيام ، قم بإزالة الوسائط المستهلكة واستبدلها بوسائط تمايز MSC جديدة تحتوي على 2.5 نانوغرام / مل من عامل نمو الخلايا الليفية الأساسي (bFGF).
- قم بتمرير EBs المطلية عندما تصل إلى التقاء 80٪ -90٪ ، باتباع الخطوات الموضحة أدناه.
- اغسل الخلايا باستخدام DPBS ، وأضف trypsin-EDTA-500 μL لبئر من 6 آبار - واحتضان الخلايا عند 37 درجة مئوية لمدة 3 دقائق.
- اجمع الخلايا باستخدام وسائط تمايز MSC في أنبوب مخروطي سعة 15 مل وقم بتدويرها عند 750 × جم لمدة 4 دقائق.
- أعد التعليق في وسائط التمايز MSC ب 2.5 نانوغرام / مل من bFGF وقم بطلاء الخلايا على ألواح مغلفة بمصفوفة الغشاء القاعدي بنسبة 1: 3.
- كرر المقطع عندما تصل الخلايا إلى التقاء 70٪ -80٪. ومن المتوقع أن يكسب 3-6 ملايين خلية من خلال 2-3 ممرات.
3. تحليل التدفق الخلوي ل MSCs المشتقة من iPSCs
ملاحظة: عند الخضوع ل 2-3 مقاطع ، يجب الوصول إلى الخلايا لكفاءة تمايز MSC. سيتم اعتبار التمايز ناجحا إذا كانت الخلايا تعبر عن علامات التمايز MSC-CD44 و CD73 و CD90 و CD105 بكفاءة تزيد عن 90٪ ، ولا تعبر عن مستويات عالية من علامات المكونة للدم-CD14 و CD19 و CD34 و CD45. يمكن الوصول إلى كفاءة هذه العلامات باتباع الخطوات أدناه.
- قم بتمرير الخلايا باستخدام الخطوات الموضحة أعلاه (الخطوة 2.6) واحصل على 1 × 105 خلايا في بئر واحدة من صفيحة 96 بئرا ذات قاع V.
- جهاز طرد مركزي اللوحة عند 375 × جم لمدة 4 دقائق عند 4 درجات مئوية.
- أعد تعليق 1 × 105 خلايا في 100 ميكرولتر من DPBS البارد مع 1 ميكرولتر من الجسم المضاد المترافق (Ab) (انظر جدول المواد) واحتضانها عند 4 درجات مئوية لمدة 30-40 دقيقة لمنع التعرض للضوء.
- إعادة تعليق 1 × 105 خلايا أخرى في 100 ميكرولتر من DPBS البارد مع التحكم في النمط المتماثل المعني ل Ab المترافق بتركيز 1: 100 ) واحتضانه عند 4 درجات مئوية لمدة 30-40 دقيقة لمنع التعرض للضوء.
- بعد الحضانة ، قم بطرد مركزي اللوحة عند 375 × جم لمدة 4 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية عن طريق هز اللوحة فوق الحوض.
- أعد تعليق الخلايا في 100 ميكرولتر من DPBS البارد.
- أجهزة الطرد المركزي الخلايا عند 375 × جم لمدة 4 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية.
- أعد تعليق الخلايا في 200 ميكرولتر من DPBS البارد وجمعها في أنابيب طرد مركزي دقيقة مظلمة وباردة سعة 1.5 مل واحتفظ بها على الجليد حتى يتم تحليلها بواسطة فرز الخلايا المنشط بالفلور (FACS).
- لتحليل FACS ، قم بتوزيع الخلايا باستخدام التشتت الجانبي (SSC-A) مقابل التشتت الأمامي (FSC-A) لاستبعاد الحطام. علاوة على ذلك ، قم بتوزيع الخلايا المسورة باستخدام الارتفاع المتناثر الأمامي (FSC-H) مقابل المنطقة المبعثرة الأمامية (FSC-A) لتمييز المفرد من الثنائيات من مجموعة الخلايا الحية.
ملاحظة: تم إغلاق الخلايا بالنسبة إلى تحول التحكم في النمط المتماثل لكل علامة ، وتم استخدام ما لا يقل عن 10000 حدث مسور من كل عينة ملطخة للتحليل.
4. تمايز MSCs إلى خلايا دهنية
- تحضير الوسائط القاعدية لتمايز الخلايا الشحمية عن طريق إضافة 10٪ استبدال مصل بالضربة القاضية (KOSR) ، 1٪ جلوتامين ، 1٪ P / S ، 4.5 نانوغرام / ميكرولتر من الجلوكوز إلى الحد الأدنى من الوسائط الأساسية (MEM) - ألفا وتخزينها عند 4 درجات مئوية.
- اسمح ل MSCs بالوصول إلى التقاء أعلى من 90٪. استمر في زراعتها لمدة 48 ساعة أخرى للسماح لها بالخضوع لفترة من توقف النمو.
- تحضير وسائط تمايز الخلايا الشحمية الكاملة عن طريق إضافة 100 ميكروغرام / مل من 3-إيزوبوتيل-1-ميثيل زانثين (IBMX) ، 1 ميكرومتر من ديكساميثازون ، 0.2 وحدة / مل من الأنسولين ، 100 ميكرومتر من الإندوميتاسين ، و 10 ميكرومتر من روزيجليتازون إلى الوسائط القاعدية.
- قم بإزالة وسائط التمايز MSC واغسل الخلايا باستخدام DPBS.
- أضف وسائط تمايز الخلايا الشحمية الكاملة - 2 مل لبئر صفيحة 6 آبار و 1 مل لبئر صفيحة 12 بئرا - واحتضان الخلايا عند 37 درجة مئوية. قم بتغيير وسائط التمايز الكاملة كل يوم لمدة 14 يوما.
5. تقييم كفاءة التمايز للخلايا الشحمية
- في اليوم 14 من التمايز ، تحقق من كفاءة التمايز عن طريق تلطيخ الخلايا لعلامات نضج الخلايا الشحمية ، FABP4 ، والأديبونكتين.
- قم بإزالة الوسائط وغسل الخلايا باستخدام DPBS.
- ثبت الخلايا باستخدام 4٪ بارافورمالدهايد (PFA) - 200 ميكرولتر في بئر من صفيحة 24 بئرا - واحتضانها في درجة حرارة الغرفة لمدة 15 دقيقة.
- تخلص من PFA واغسله باستخدام محلول ملحي مخزن بنسبة 0.5٪ توين (TBST) وضعه على شاكر في درجة حرارة الغرفة لمدة 15 دقيقة. كرر العملية مرتين.
- قم بنفاذ الخلايا الثابتة بمحلول ملحي مخزن بالفوسفات بنسبة 0.5٪ Triton X-100 (PBST) وضعه على شاكر في درجة حرارة الغرفة لمدة 15-20 دقيقة.
- تخلص من PBST وأضف المخزن المؤقت المانع (5٪ -6٪ ألبومين مصل البقر (BSA) في PBST) -500 ميكرولتر لبئر من صفيحة 6 آبار و 250 ميكرولتر لبئر من صفيحة 12 بئرا - واحتضانها في درجة حرارة الغرفة على شاكر لمدة 40-60 دقيقة.
- تمييع الأجسام المضادة الأولية ضد FABP4 ، أديبونيكتين في 2٪ -3٪ BSA ، بتركيز 1: 500 (انظر جدول المواد). أضف هذه الأجسام المضادة معا فقط إذا تم تربيتها في مختلفة وضع الطبق على الخفق عند 4 درجات مئوية طوال الليل.
- قم بإزالة الأجسام المضادة الأولية واغسل الخلايا ثلاث مرات باستخدام TBST (15 دقيقة لكل منها) وضعها على شاكر في درجة حرارة الغرفة.
- تحضير الأجسام المضادة الثانوية Alexa Fluor في PBST (1: 500). احتضان الخلايا في مجموعات الأجسام المضادة الثانوية (حسب الأنواع التي يتم فيها رفع الجسم المضاد الأساسي) لمدة 60 دقيقة في درجة حرارة الغرفة وقم بتغطية اللوحة بورق الألمنيوم لحمايتها من الضوء.
- تخلص من الأجسام المضادة الثانوية ، واغسلها باستخدام TBST ثلاث مرات ، وضع الطبق على شاكر.
- لتلطيخ النوى ، أضف 1 ميكروغرام / مل من Hoechst 33342-200 μL لبئر من 24 بئرا مخففة في PBS واحتضانها لمدة 5 دقائق في درجة حرارة الغرفة.
- تخلص من محلول Hoechst وأضف PBS-500 μL لبئر من 24 بئرا إلى الخلايا. حافظ على الألواح مغطاة من الضوء حتى يتم تصورها باستخدام مجهر مضان مقلوب.
6. فرز الخلايا الشحمية باستخدام النيل الأحمر
- قم بإعداد محلول العمل الأحمر النيلي بإضافة 1 مجم / مل من محلول مخزون النيل الأحمر في DMSO وتخزينه عند -20 درجة مئوية. قبل الاستخدام مباشرة ، قم بإذابة مخزون النيل الأحمر وإعادة تكوينه في DPBS لتحقيق تركيز محلول عمل 300 نانومتر.
- في أو بعد اليوم 14 من تمايز الخلايا الشحمية ، تخلص من الوسائط من الخلايا واغسلها باستخدام DPBS.
- يضاف محلول العمل الأحمر النيلي -1 مل في بئر من 6 آبار - ويحتضن على حرارة 37 درجة مئوية لمدة 15 دقيقة.
- يرفع محلول النيل الأحمر ويضاف التربسين-EDTA -500 ميكرولتر في بئر من 6 آبار - ويحتضن على حرارة 37 درجة مئوية لمدة 4 دقائق.
- اجمع الخلايا باستخدام DMEM التي تحتوي على 5٪ FBS في أنبوب مخروطي سعة 15 مل. أجهزة الطرد المركزي في 750 × ز لمدة 4 دقائق.
- قم بإزالة المادة الطافية وإعادة تعليقها في DPBS-1 مل لخلايا 1 × 106 . أجهزة الطرد المركزي في 750 × ز لمدة 4 دقائق.
- قم بإزالة المادة الطافية وإعادة تعليقها في DPBS-1 مل لخلايا 1 × 106 . استخدم فارز FACS لعزل الخلايا الموجبة لأحمر النيل باستخدام قناة FL1.
- إعادة زراعة الخلايا التي تم فرزها في وسائط تمايز الخلايا الشحمية أو جمع الخلايا التي تم فرزها لعزل الحمض النووي الريبي والبروتين.
- استخراج الحمض النووي الريبي من الخلايا التي تم فرزها وإجراء تحليل كمي نسبي لعلامات تمايز الخلايا الشحمية ، بما في ذلك FABP4 و PPARG و C / EBPA. تظهر الخلايا الموجبة لأحمر النيل تنظيما كبيرا في التعبير الجيني بمقدار طيتين على الأقل مقارنة بالخلايا غير المصنفة.
النتائج
تخطيط ومورفولوجيا الخلايا أثناء تمايز اللحمة المتوسطة: يتضمن تمايز iPSCs إلى MSCs مراحل مختلفة من التطور تمتد عبر تكوين EB وتمايز MSC وتوسيع MSC (الشكل 1). خلال هذه المراحل من التطور ، تكتسب الخلايا مورفولوجيا مختلفة بسبب المواد الكيميائية المحفزة المختلفة التي تتعرض لها. عند بدء التمايز ، تكون الخلايا مطلية بالتعليق ومن المتوقع أن تكون مستديرة ، مع حدود خلية محددة ، بينما تكون صغيرة إلى متوسطة الحجم في القطر (الشكل 2). إن اختيار الخلايا المزروعة المعلقة خلال المرحلة الأولية من التمايز يسمح لها بأن تشبه إلى حد كبير عملية التطور الجنيني الطبيعي ، مما يجعل هذه المرحلة حاسمة للغاية لتحقيق التمايز الناجح. يتبع مرحلة تكوين EB ومعالجة RA طلاء EBs على الألواح المطلية بمصفوفة الغشاء القاعدي. يمكن الوصول إلى صلاحية EBs عند الطلاء من خلال مراقبة سلوك انتشارها السريع الذي يؤدي إلى ظهور المزيد من MSCs (الشكل 2). يتم الاحتفاظ بسلوك الانتشار السريع هذا الذي تظهره MSCs حتى بعد تمريرها إلى ألواح مغلفة بمصفوفة جديدة جنبا إلى جنب مع الاحتفاظ بالتشكل الغريب الممدود (الشكل 2).
التقييم الكمي لعلامات سطح MSC: يتم الوصول إلى كفاءة التمايز ل MSCs عن طريق القياس الكمي للعلامات السطحية الخاصة بتمايز MSC. يجب أن يظهر التمايز الجيد الذي ينتج MSCs موثوقة كفاءة أكبر من 90٪ لعلامات سطح اللحمة المتوسطة CD73 و CD44 و CD90 (الشكل 3 أ). بالإضافة إلى ذلك ، يتم تقييم الخلايا أيضا لعدم وجود علامات سطحية تصور النمط الظاهري المكونة للدم ، CD14 و CD34 و CD19 ، وبالتالي من المتوقع أن تظهر كفاءة تعبير أقل من 1٪ لها (الشكل 3 ب).
تمايز MSCs إلى خلايا دهنية: يمكن الوصول إلى تمايز MSCs إلى خلايا دهنية عن طريق تلطيخ FABP4 و adiponectin. FABP4 هو بروتين سيتوبلازمي ، ويعتبر علامة للخلايا الشحمية المتمايزة نهائيا. يعد تعبيره العالي بين الخلايا الشحمية ، مع التوزيع السيتوبلازمي ، علامة رئيسية على نضجها التنموي (الشكل 4 أ). بالإضافة إلى FABP4 ، يعتبر الأديبونيكتين أحد العلامات المهمة لنضج الخلايا الشحمية. يشير تعبيره العالي إلى أن الخلايا الشحمية وظيفية بما يكفي للخضوع لتخزين الدهون وتكوين الدهون استجابة لإشارات الجلوكوز. كونه بروتينا إفرازيا ، يعرض الأديبونيكتين مورفولوجيا كروية مع كل كرية بروتينية يمكن تمييزها بسهولة داخل السيتوبلازم (الشكل 4 ب).
تلطيخ وفرز الخلايا الشحمية الناضجة باستخدام أحمر النيل: عند التمايز ، يمكن تمييز الخلايا الشحمية الناضجة عن نظيراتها غير الناضجة عن طريق تلطيخ أحمر النيل. يرتبط أحمر النيل بالخلايا الشحمية الحاملة للدهون ، وهي خاصية حصرية للخلايا الشحمية الناضجة (الشكل 5 أ). هذا إلى جانب خاصية تحمل الفلورسنت لأحمر النيل يجعلها أداة فعالة لفرز الخلايا الشحمية الناضجة باستخدام قياس التدفق الخلوي المنشط الفلوري (الشكل 5 ب). يجب أن يؤدي الفرز الفعال إلى تحسين علامات النضج - PPARG و C / EBPA و FABP4 - بمقدار ضعفين على الأقل ، يتم تحديدهما بواسطة تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي (qRT-PCR) (الشكل5C).

الشكل 1: شكل تخطيطي يوضح تمايز الخلايا الجذعية المستحثة متعددة القدرات إلى الخلايا الجذعية الجذعية العضلية والخلايا الشحمية. يتم تمييز iPSCs إلى MSCs باستخدام تقنية الجسم الجنيني (EB). تتعرض EBs لتعرض قصير يبلغ 10 ميكرومتر من حمض الريتينويك المتحول. يتم تمييز MSCs المتولدة إلى 40٪ -77٪ خلايا دهنية بناء على خط iPSC. يتم فرز الخلايا الإيجابية الحمراء النيلية باستخدام FACS للحصول على مجموعة منقاة من الخلايا الشحمية الناضجة التي يمكن استخدامها لدراسة الاضطرابات المرتبطة بالخلايا الشحمية (نمذجة المرض) ، وتحديد الأدوية الجديدة ، وفي النهاية للعلاج الشخصي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
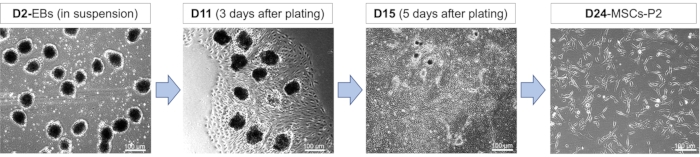
الشكل 2: تمايز iPSCs إلى MSCs. صور مورفولوجية تمثيلية تظهر مراحل مختلفة من تمايز MSC في الأيام 2 (D2) و 11 (D11) و 15 (D15) و 24 (D24). تم طلاء الأجسام الجنينية (EBs) المتولدة في وجود 10 ميكرومتر من التهاب المفاصل الروماتويدي لمدة 24 ساعة في اليوم 8 من التمايز ، يليها التفكك والمرور بعد 12-17 يوما من التمايز. تم تمرير MSCs عدة مرات. الاختصارات: P2 = المقطع 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التعبير عن علامات MSC وعلامات المكونة للدم في MSCs المشتقة من iPSC. الرسوم البيانية لقياس التدفق الخلوي التمثيلي تظهر التعبير عن علامات MSC ، CD73 و CD44 و CD90 ، (A) وعلامات المكونة للدم ، CD34 و CD19 و CD14 (B) في MSCs الناتجة عن EBs المشتقة من iPSC المعالجة ب 10 ميكرومتر من RA. يمثل المحور X في التمثيل البياني شدة الفلورسنت. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
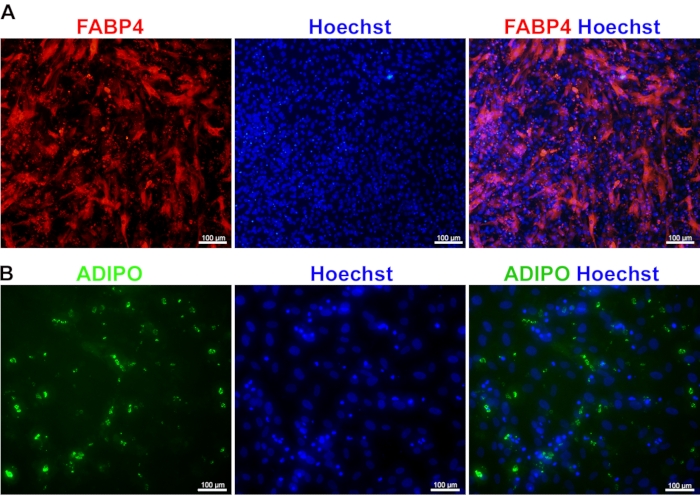
الشكل 4: تمايز الخلايا الجذعية العضلية المشتقة من iPSC إلى خلايا دهنية. صور مناعية تظهر تعبير FABP4 (A) و adiponectin (ADIPO) (B) في الخلايا الشحمية الناضجة المشتقة من iPSCs. كانت النوى ملطخة ب Hoechst. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: فرز الخلايا الشحمية المشتقة من iPSC باستخدام أحمر النيل. (أ) صور توضح الخلايا الشحمية الناضجة ذات المجال الساطع (BF) والخلايا الشحمية الناضجة الملطخة باللون الأحمر النيلي. (ب) القياس الكمي لأحمر النيل (الخلايا الموجبة ل PE) في الخلايا الشحمية الناضجة باستخدام FACS. (ج) تحليل تفاعل البوليميراز المتسلسل في الوقت الفعلي الذي يظهر تعبير C / EBPA و FABP4 و PPARG في الخلايا الشحمية الناضجة المصنفة مقابل الخلايا الشحمية غير المصنفة. يتم تمثيل البيانات كمتوسط ± SD. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يحمل هذا البروتوكول أهمية قصوى نظرا لقدرته على توفير MSCs بإنتاجية وكفاءة عالية. أصبح هذا الإنتاج الضخم ل MSCs ممكنا من خلال الحضانة العابرة ل EBs المشتقة من iPSCs مع 10 ميكرومتر من RA14,15. عززت المعالجة العابرة ب 10 ميكرومتر من التهاب المفاصل الروماتويدي عائد MSC بمقدار 11.2 إلى 1542 ضعفا14,15 ، مع تطبيق هذا البروتوكول على كل من iPSCs و hPSCs. في هذه الجرعة ومدة العلاج ، يحسن التهاب المفاصل الروماتويدي القدرات التكاثرية والبقاء للخلايا المكونة ل EB عن طريق التنظيم المباشر أو غير المباشر للتعبير عن العديد من الجينات المشاركة في تكاثر الخلايا ، وموت الخلايا المبرمج ، والتصاقات الخلايا الخلوية وخلايا ECM ، والتي تعتبر ضرورية لبقاء وانتشار iPSCs14,16. تشمل الجينات ، على سبيل المثال لا الحصر ، عوامل النسخ (مثل EGFR4 و SOX4) وعوامل النمو ومستقبلات عامل النمو (مثل IGF2 و FGFR4) وجزيئات الالتصاق (مثل FN1 و CAMs). ومع ذلك ، على عكس الجرعات المنخفضة (0.1-10 ميكرومتر) ، عند الجرعات العالية (≥20 ميكرومتر) ، ينظم التهاب المفاصل الروماتويدي سلبا تكاثر وبقاء الخلايا المكونة ل EB مما يؤدي إلى تقليل عدد وحجم EB المشتق من PSC وبالتالي انخفاض محصول MSCs14. يعتبر التهاب المفاصل الروماتويدي مثبطا للانتشار في العديد من الخلايا الطبيعية المتمايزة والسرطانية17،18،19. في EBs ، تعتمد إشارات الريتينويد على السياق (الوقت والتركيز والأنواع وخط الخلية). التأثير التفاضلي على التجديد الذاتي والبقاء والتمايز للخلايا المكونة ل EB من خلال تنظيم الجينات المتميزة ومسارات الإشارات20,21. لذلك ، فإن استخدام RA في الوقت الأمثل وتركيز RA-10 μM في اليوم 3 من تحريض EB متبوعا بتخفيض الجرعة إلى 0.1 ميكرومتر في اليوم 5 لمدة يومين كما هو موضح في البروتوكول الحالي - أمر بالغ الأهمية للحث على بقاء الخلايا المكونة ل EB وتكاثرها.
بالإضافة إلى تنظيم النمو والبقاء على قيد الحياة ، فإن التهاب المفاصل الروماتويدي يخضع EBs المعالجة لتأخير التمايز مقارنة بالخلايا غير المعالجة ب RA14. في الواقع ، تحافظ EBs المعالجة بالتهاب المفاصل الروماتويدي على شكلها المضغوط بعد الطلاء وتفشل في التمايز إلى خلايا تشبه MSC ، على عكس EBs غير المعالجة ب RA. وهذا يتفق مع الدراسات السابقة التي تفيد بأن التعرض على المدى القصير لعلاج التهاب المفاصل الروماتويدي يمنع تمايز الخلايا من خلال قمع إشارات WNT21. علاوة على ذلك ، أظهرت هذه الخلايا المتأخرة في التمايز المعالجة بالتهاب المفاصل الروماتويدي أيضا تعبيرا معززا عن الكاديرين وبروتينات المصفوفة خارج الخلية14 ، والتي من المعروف أنها تلعب دورا مهما في الحفاظ على الحالة متعددة القدرات ل iPSCs16. لتحرير كتلة التمايز بوساطة RA، يجب فصل EBs، مما يؤدي إلى تعطيل التصاقات الخلايا ويسمح بتمايز MSC على المدى الطويل عند الطلاء. ومن المثير للاهتمام ، أن علاج التهاب المفاصل الروماتويدي كان يحمل كتلة تمايز على الخلايا ، لكنه لم يحافظ على الخلايا في حالة متعددة القدرات. في الواقع ، تظهر الخلايا المكونة ل EB التي تتعرض للتعرض قصير المدى ل 10 μM RA تعبيرا منخفضا بشكل كبير عن علامات تعدد القدرات الرئيسية - OCT4 و SOX2 و NANOG14.
لقد ثبت أن MSCs الناتجة عن معالجة RA قصيرة المدى ل EBs تحافظ على مورفولوجيتها النموذجية الشبيهة بالخلايا الليفية مع تعبير وفير عن علامات سطح MSC وتعدد قدراتها بعد الحفظ بالتبريد ، مما يجعل هذه MSCs المنتجة بكميات كبيرة قابلة للتخزين لدراسات التوسع طويلة الأجل14. عند تعريضها لظروف تمايز دهنية المنشأ ، غضروفية ، وعظمية المنشأ ، يمكن لهذه MSCs أن تتمايز بسهولة إلى أنواع خلايا الأديم المتوسط الثلاثة مما يجعلها مصدرا يسهل الوصول إليه لنمذجة الأمراض المرتبطة بالأنسجة14. وبالتالي ، فإن السلوك المستقر والمتعدد الاستخدامات في المختبر ل MSCs الناتجة عن بروتوكول التمايز بوساطة RA-mediad يوفر لهم أهمية قصوى في الإعدادات القائمة على البحث والتطبيق.
في حين أن إمكانات التمايز الغضروفية والعظمية المنشأ ل MSCs التي تم الحصول عليها من EBs المعالجة ب RAs تبدو مشابهة لتلك الخاصة ب MSCs التي تم الحصول عليها من EBs غير المعالجة ، فقد وجد أن الأول يعرض إمكانات معززة للتمايز إلى سلالة دهنية المنشأ عند تعرضه لظروف التمايز الدهني14. وقد تجلى ذلك من خلال زيادة 2 إلى 3 أضعاف في تراكم الدهون داخل الخلايا (تلطيخ الزيت الأحمر O) والخلايا الإيجابية لعلامة الخلايا الشحمية FABP4 في مجموعة تمايز الخلايا التي تم الحصول عليها بعد زراعة MSCs المشتقة من EBs المعالجة ب RAs مع وسائط التمايز الشحمية ، مقارنة ب MSCs المشتقة من EBs غير المعالجة RA. قد يكون هذا نتيجة لتنظيم ، من قبل RA، للعديد من مسارات الإشارات التي تحكم تطور الخلايا الشحمية مثل مسارات تفاعل خلايا فرس النهر و WNT و ECM ، كما كشفت بيانات تسلسل الحمض النووي الريبي من EBs المعالجة وغير المعالجةب RAs 14،22،23،24،25. هذه القدرة المعززة ل MSCs المشتقة من التهاب المفاصل الروماتويدي للخضوع للتمايز الدهني هي قيمة ، حيث أن البروتوكولات المتاحة حاليا إما تؤدي إلى ضعف إنتاجية الخلايا الشحمية أو الاستفادة من التلاعب الجيني مما يجعل الخلايا الشحمية المتولدة لا تقدر بثمن لاشتقاق الخلايا الشحمية الملخصة للعملية الطبيعية. تصنف الخلايا الشحمية إلى ثلاثة أنواع - الأبيض والبني والبيج. تصنف الخلايا الشحمية البيضاء من خلال وجود قطرة دهنية واحدة وتلعب دورا في تخزين الطاقة. في حين أن الخلايا الشحمية البنية تشارك في إنفاق الطاقة عن طريق أكسدة الركيزة بسبب الوفرة العالية جدا للميتوكوندريا التي تتميز بالتعبير عن UCP1. في حين أن الخلايا الشحمية البنية الموجودة في الأنسجة الدهنية البيضاء تعرف باسم الخلايا الشحمية البيج أو البني. هذه MSC لديها القدرة على إعطاء غلة وفيرة من الخلايا الشحمية البيضاء بالنظر إلى التعرض المسبق ل EBs لالتهاب المفاصل الروماتويدي. ذكرت المنشورات السابقة الحث الانتقائي ل iPSC في الخلايا التي تعبر عن انخفاض UCP1 ، أي الخلايا الشحمية البيضاء ، بدلا من تعريض الخلايا ذات مستويات UCP1 العالية إلى RA26. ذكرت المنشورات السابقة أن التهاب المفاصل الروماتويدي المنتج من خلايا القمة العصبية في أجنة الفئران وأسماك الزرد يلعب دورا مهما في تكوين الخلايا الشحمية البيضاء27,28.
على الرغم من أن البروتوكول القائم على التهاب المفاصل الروماتويدي سمح بتوليد MSCs التي توفر زيادة في غلة الخلايا الشحمية تصل إلى 48.5٪ -77.4٪ (مقابل 22.5٪ -57.6٪ بدون علاج التهاب المفاصل الروماتويدي) ، إلا أن عدم تحقيق >90٪ لا يزال يمثل مشكلة عند نمذجة الاضطرابات الوراثية القائمة على الخلايا الشحمية متعددة المتغيرات in vitro. في الواقع ، فإن عدم الوصول إلى مجموعة الخلايا الشحمية النقية يمكن أن يجعل النتائج القادمة من نماذج الأمراض متعددة المتغيرات متناقضة ، حيث سيكون من الصعب التمييز بين ما إذا كانت الاختلافات التنموية الملحوظة ناتجة عن التركيب الجيني المختلف أو بسبب كفاءات التمايز غير المتسقة. من أجل التحايل على هذه المشكلة ، كان من المهم فرز الخلايا المتمايزة للحصول على مجموعة من الخلايا الشحمية الناضجة النقية ، بحيث لا يمكن أن تعزى أي اختلافات في الأنماط الظاهرية إلا إلى الاختلافات الجينية المتأصلة. حددت العديد من الدراسات علامات سطحية على الخلايا الشحمية التي يمكن استخدامها للفرز. على سبيل المثال ، سمح العمل الذي قام به رونالد كان بتحديد ناقل الأحماض الأمينية ASC-1 كعلامة سطحية جديدة على الخلايا الشحمية البيضاء29. بالإضافة إلى ذلك ، أبلغت الدراسات التي تستخرج الخلايا الشحمية الناضجة من المناطق الفموية وتحت الجلد عن خلايا دهنية ناضجة للتعبير عن CD34 و CD36 و CD59 على أسطحها30، حيث تم الإبلاغ عن أن CD36 يعمل كناقل للأحماض الدهنية على سطح الخلايا الشحمية الناضجة31. ومع ذلك ، فقد استخدمت هذه الدراسات مجموعات غير متجانسة من الخلايا المشتقة من الأنسجة الدهنية دون تحديد تعبير هذه العلامات لمجموعات الخلايا الشحمية الناضجة فقط. علاوة على ذلك ، يمكن التعبير عن هذه العلامات أيضا بواسطة أنواع الخلايا الأخرى وليست خاصة بالخلايا الشحمية. على سبيل المثال ، ASC-1 موجود في كل من الخلايا النجمية والخلايا العصبية32، CD34 هو علامة على الخلايا الجذعية المكونة للدم33، CD36 موجود على الصفائح الدموية، والخلايا البلعمية أحادية النواة، والخلايا الكبدية، والخلايا العضلية، وبعض الظهارات33، ويتم التعبير عن CD59 على الخلايا البطانية واللمفاوية34,35. لذلك ، كحل بديل ، تم استخدام أحمر النيل ، صبغة الفلورسنت الانتقائية للدهون داخل الخلايا ، كمرشح محتمل لفرز الخلايا الشحمية. تخزن الخلايا الشحمية جزءا كبيرا من الدهون التي يمكن إطلاقها واستخدامها لإنتاج الطاقة أو بناء الأغشية أو كجزيئات إشارة تنظم عملية التمثيل الغذائي36. تم استخدام صبغة النيل الحمراء سابقا في قياس التدفق الخلوي والفحص المجهري لتلطيخ الخلايا الشحمية المشتقة من الفئران و MSCs البشرية37. أفادت الدراسات السابقة باستخدام أحمر النيل للخلايا الشحمية المشتقة من ESC وتعزيز علامات الخلايا الشحمية بعد الفرز38. تم تقييم الخلايا الشحمية الناتجة عن MSCs التي تم الحصول عليها بواسطة البروتوكول الحالي القائم على التهاب المفاصل الروماتويدي لقدرتها على تلطيخها باللون الأحمر النيلي ، مما يشير إلى نضجها ، وفرزها لتنقيتها. أظهرت هذه الخلايا المصنفة باللون الأحمر النيلي زيادة بمقدار ضعفين إلى ثلاثة أضعاف في التعبير عن علامات نضج الخلايا الشحمية ، بما في ذلك PPARG, C/EBPAو FABP4 مقارنة بالخلايا غير المصنفة ، وبالتالي زيادة إنتاج الخلايا الشحمية المشتقة من iPSCs. على الرغم من أن هذه العلامات يتم التعبير عنها قبل تراكم الدهون ، إلا أن تعبيرها يشير إلى خلية للتمايز النهائي إلى الخلايا الشحمية الحاملة لليبيدات. يسمح لنا التحقق من كفاءة الفرز بواسطة هذه العلامات بتحديد تجمع حيث تكون جميع الخلايا صريحة FABP4, CEBPaو PPARg، مما يشير إلى تجمع ، والذي كان مخصصا مسبقا لتشكيل الخلايا الشحمية الناضجة. يتم فرز الخلايا بناء على قدرتها على تلطيخ النيل الأحمر. زادت كفاءة التنقية بمقدار ضعفين إلى ثلاثة أضعاف بسبب ارتفاع عدد الخلايا الشحمية في الجزء غير المصنف. يختلف حجم الخلايا الشحمية الحاملة للدهون إلى حد كبير أثناء التمايز ، حيث يتم فرز مجموعة من الخلايا ذات توزيع الحجم المتطابق. يشمل الجزء غير المصنف الخلايا الشحمية الحاملة للدهون ، لكنها ليست ناضجة تماما وتحكمها نسب حجم مختلفة.
تم الإبلاغ سابقا عن عدم تجانس MSCs المعزولة من جسم الإنسان39. يعتمد عدم التجانس هذا على عدة عوامل ، مثل أصل MSC والمتبرعين والظروف39. هذا قد يؤدي إلى اختلافات في كفاءتها في علاج الأمراض المختلفة. تشير هذه الدراسة إلى أن المعالجة القصيرة ل RA ل hPSCs المنتجة في ظل ظروف الاستزراع المتوافقة مع ممارسات التصنيع الجيدة (GMP) من شأنها أن تعطي مجموعة متجانسة من MSCs. يشير هذا إلى أن البروتوكول الحالي هو نهج واعد لتوليد عدد كبير من MSCs من الدرجة السريرية التي يمكن استخدامها للعلاج القائم على MSC.
سمح لنا الجمع بين بروتوكول تمايز MSC القائم على التهاب المفاصل الروماتويدي الذي يؤدي إلى تمايز الخلايا الشحمية وبروتوكول الفرز الأحمر النيلي بالحصول على الخلايا الشحمية المشتقة من iPSCs مع التعبير المعزز عن العلامات الوظيفية وزيادة الغلة والنقاء. وبالتالي ، فإن هذا البروتوكول المشترك سيسمح بتوليد ، بكمية ونقاء كافيين ، من الخلايا الشحمية الناضجة من أفراد متميزين وراثيا والكشف المحتمل عن المتغيرات الجينية الجديدة وراء الاضطرابات الأيضية المرتبطة بالخلايا الشحمية.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم تمويل هذا العمل من خلال منحة من الصندوق القطري لرعاية البحث العلمي (رقم المنحة NPRP10-1221-160041). حصلت مريم أغادي على منحة دراسية من GSRA من الصندوق القطري لرعاية البحث العلمي (QNRF).
Materials
| Name | Company | Catalog Number | Comments |
| Adiponectin | Abcam | ab22554 | Adipocyte maturation marker |
| anti-CD105 | BD Pharmingen | 560839 | MSC differentiation marker |
| anti-CD14 | BD Pharmingen | 561712 | MSC differentiation marker |
| anti-CD19 | BD Pharmingen | 555415 | MSC differentiation marker |
| anti-CD34 | BD Pharmingen | 555824 | MSC differentiation marker |
| anti-CD44 | abcam | ab93758 | MSC differentiation marker |
| anti-CD45 | BD Pharmingen | 560975 | MSC differentiation marker |
| anti-CD73 | BD Pharmingen | 550256 | MSC differentiation marker |
| anti-CD90 | BD Pharmingen | 555596 | MSC differentiation marker |
| bFGF | R&D | 233-FP | MSC culture media supplement |
| C/EBPA | Abcam | ab40761 | Adipocyte maturation marker |
| Dexamethasone | Torics | 1126 | Adipocyte differentiation media supplement |
| FABP4 | Abcam | ab93945 | Adipocyte maturation marker |
| Fetal bovine serum | ThermoFisher | 10082147 | MSC culture media supplement |
| Glutamax | ThermoFisher | 35050-061 | MSC culture media supplement |
| IBMX | Sigma Aldrich | I5879 | Adipocyte differentiation media supplement |
| Indomethacin | Sigma Aldrich | I7378 | Adipocyte differentiation media supplement |
| Insulin | Sigma Aldrich | 91077C | Adipocyte differentiation media supplement |
| Knockout DMEM | ThermoFisher | 12660012 | Basal media for preparing matrigel |
| Low glucose DMEM | ThermoFisher | 11885084 | MSC culturing media |
| Matrigel | Corning | 354230 | Coating matrix |
| MEM-alpha | ThermoFisher | 12561056 | Adipocyte differentiation media |
| Nilered | Sigma Aldrich | 19123 | Sorting marker for adipocyte |
| Penicillin | ThermoFisher | 15140122 | MSC/Adipocyte media supplement |
| Phosphate-buffered saline | ThermoFisher | 14190144 | wash buffer |
| Pierce™ 20X TBS Buffer | Thermo Fisher | 28358 | wash buffer |
| PPARG | Cell Signaling Technology | 2443 | Adipocyte maturation marker |
| ReLeSR | Stem Cell Technologies | 5872 | Dissociation reagent |
| Retinoic acid | Sigma Aldrich | R2625 | MSC differentiation media supplement |
| Rock inhibitor | Tocris | 1254/10 | hPSC culture media supplement |
| Roziglitazone | Sigma Aldrich | R2408 | Adipocyte differentiation media supplement |
| StemFlex | ThermoFisher | A334901 | hPSC culture media |
| Triton | Thermo Fisher | 28314 | Permebealization reagent |
| Trypsin | ThermoFisher | 25200072 | Dissociation reagent |
| Tween 20 | Sigma Aldrich | P7942 | Wash buffer |
References
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling: CCS. 9, 12(2011).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PLoS One. 4 (6), 5846(2009).
- Brown, P. T., Squire, M. W., Li, W. J. Characterization and evaluation of mesenchymal stem cells derived from human embryonic stem cells and bone marrow. Cell and Tissue Research. 358 (1), 149-164 (2014).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Experimental Hematology. 36 (3), 350-359 (2008).
- Barberi, T., Willis, L. M., Socci, N. D., Studer, L. Derivation of multipotent mesenchymal precursors from human embryonic stem cells. PLoS Medicine. 2 (6), 161(2005).
- Xiong, C., et al. Derivation of adipocytes from human embryonic stem cells. Stem Cells and Development. 14 (6), 671-675 (2005).
- Cuaranta-Monroy, I., et al. Highly efficient differentiation of embryonic stem cells into adipocytes by ascorbic acid. Stem Cell Research. 13 (1), 88-97 (2014).
- van Harmelen, V., et al. Differential lipolytic regulation in human embryonic stem cell-derived adipocytes. Obesity (Silver Spring). 15 (4), 846-852 (2007).
- Noguchi, M., et al. In vitro characterization and engraftment of adipocytes derived from human induced pluripotent stem cells and embryonic stem cells. Stem Cells and Development. 22 (21), 2895-2905 (2013).
- Ahfeldt, T., et al. Programming human pluripotent stem cells into white and brown adipocytes. Nature Cell Biology. 14 (2), 209-219 (2012).
- Lee, Y. K., Cowan, C. A. Differentiation of white and brown adipocytes from human pluripotent stem cells. Methods in Enzymology. 538, 35-47 (2014).
- Abdelalim, E. M. Modeling different types of diabetes using human pluripotent stem cells. Cellular and Molecular Life Sciences: CMLS. 78 (6), 2459-2483 (2021).
- Abdelalim, E. M., Bonnefond, A., Bennaceur-Griscelli, A., Froguel, P. Pluripotent stem cells as a potential tool for disease modelling and cell therapy in diabetes. Stem Cell Reviews and Reports. 10 (3), 327-337 (2014).
- Karam, M., Younis, I., Elareer, N. R., Nasser, S., Abdelalim, E. M. Scalable Generation of mesenchymal stem cells and adipocytes from human pluripotent stem cells. Cells. 9 (3), (2020).
- Karam, M., Abdelalim, E. M. Robust and highly efficient protocol for differentiation of human pluripotent stem cells into mesenchymal stem cells. Methods in Molecular Biology. , Clifton, N.J. (2020).
- Li, L., Bennett, S. A., Wang, L. Role of E-cadherin and other cell adhesion molecules in survival and differentiation of human pluripotent stem cells. Cell Adhesion & Migration. 6 (1), 59-70 (2012).
- Lai, L., Bohnsack, B. L., Niederreither, K., Hirschi, K. K. Retinoic acid regulates endothelial cell proliferation during vasculogenesis. Development. 130 (26), 6465-6474 (2003).
- Chanchevalap, S., Nandan, M. O., Merlin, D., Yang, V. W. All-trans retinoic acid inhibits proliferation of intestinal epithelial cells by inhibiting expression of the gene encoding Kruppel-like factor 5. FEBS Letters. 578 (1-2), 99-105 (2004).
- di Masi, A., et al. Retinoic acid receptors: from molecular mechanisms to cancer therapy. Molecular Aspects of Medicine. 41, 1(2015).
- Simandi, Z., Balint, B. L., Poliska, S., Ruhl, R., Nagy, L. Activation of retinoic acid receptor signaling coordinates lineage commitment of spontaneously differentiating mouse embryonic stem cells in embryoid bodies. FEBS Letters. 584 (14), 3123-3130 (2010).
- De Angelis, M. T., Parrotta, E. I., Santamaria, G., Cuda, G. Short-term retinoic acid treatment sustains pluripotency and suppresses differentiation of human induced pluripotent stem cells. Cell Death & Disease. 9 (1), 6(2018).
- Li, L., Dong, L., Wang, Y., Zhang, X., Yan, J. Lats1/2-mediated alteration of hippo signaling pathway regulates the fate of bone marrow-derived mesenchymal stem cells. BioMed Research International. 2018, 4387932(2018).
- Moldes, M., et al. Peroxisome-proliferator-activated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis. The Biochemical Journal. 376, Pt 3 607-613 (2003).
- Ross, S. E., et al. Inhibition of adipogenesis by Wnt signaling. Science. 289 (5481), 950-953 (2000).
- Wang, Y. K., Chen, C. S. Cell adhesion and mechanical stimulation in the regulation of mesenchymal stem cell differentiation. Journal of Cellular and Molecular Medicine. 17 (7), 823-832 (2013).
- Mohsen-Kanson, T., et al. Differentiation of human induced pluripotent stem cells into brown and white adipocytes: role of Pax3. Stem Cells. 32 (6), 1459-1467 (2014).
- Billon, N., et al. The generation of adipocytes by the neural crest. Development. 134 (12), 2283-2292 (2007).
- Li, N., Kelsh, R. N., Croucher, P., Roehl, H. H. Regulation of neural crest cell fate by the retinoic acid and Pparg signalling pathways. Development. 137 (3), 389-394 (2010).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Festy, F., et al. Surface protein expression between human adipose tissue-derived stromal cells and mature adipocytes. Histochemistry and Cell Biology. 124 (2), 113-121 (2005).
- Cai, L., Wang, Z., Ji, A., Meyer, J. M., vander Westhuyzen, D. R. Scavenger receptor CD36 expression contributes to adipose tissue inflammation and cell death in diet-induced obesity. PLoS One. 7 (5), 36785(2012).
- Mesuret, G., et al. A neuronal role of the Alanine-Serine-Cysteine-1 transporter (SLC7A10, Asc-1) for glycine inhibitory transmission and respiratory pattern. Scientific Reports. 8 (1), 8536(2018).
- Silverstein, R. L., Febbraio, M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior. Science Signaling. 2 (72), (2009).
- Brooimans, R. A., van Wieringen, P. A., van Es, L. A., Daha, M. R. Relative roles of decay-accelerating factor, membrane cofactor protein, and CD59 in the protection of human endothelial cells against complement-mediated lysis. European Journal of Immunology. 22 (12), 3135-3140 (1992).
- Davies, A., et al. CD59, an LY-6-like protein expressed in human lymphoid cells, regulates the action of the complement membrane attack complex on homologous cells. The Journal of Experimental Medicine. 170 (3), 637-654 (1989).
- Lapid, K., Graff, J. M. Form(ul)ation of adipocytes by lipids. Adipocyte. 6 (3), 176-186 (2017).
- Aldridge, A., et al. Assay validation for the assessment of adipogenesis of multipotential stromal cells--a direct comparison of four different methods. Cytotherapy. 15 (1), 89-101 (2013).
- Schaedlich, K., Knelangen, J. M., Navarrete Santos, A., Fischer, B., Navarrete Santos, A. A simple method to sort ESC-derived adipocytes. Cytometry A. 77 (10), 990-995 (2010).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences: CMLS. 78 (2), 447-467 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved