Method Article
脂肪細胞関連疾患を研究するためのヒトiPS細胞を純粋な脂肪細胞集団に確実に分化させる(英語)
要約
このプロトコルにより、人工多能性幹細胞(iPSC)から純粋な脂肪細胞集団を作製することができます。レチノイン酸は、iPS細胞を脂肪細胞の産生に使用される間葉系幹細胞(MSC)に分化させるために使用されます。次に、ナイルレッド染色に基づくソーティングアプローチを使用して、純粋な脂肪細胞を取得します。
要約
人工多能性幹細胞(iPSC)技術の最近の進歩により、脂肪細胞を含むさまざまな種類の細胞の生成が可能になりました。しかしながら、現在の分化方法は効率が低く、脂肪細胞の均質な集団を産生しない。ここでは、オールトランスレチノインベースの方法を使用して間葉系幹細胞(MSC)を高収率で製造することにより、この問題を回避します。細胞の増殖、生存、接着を支配する経路を調節することにより、私たちの分化戦略は、多能性MSCの純粋な集団に分化する胚体(EB)の効率的な生成を可能にします。この方法によって生成される多数のMSCは、脂肪細胞を生成するための理想的な供給源を提供します。しかしながら、脂肪細胞の分化に起因するサンプルの不均一性は依然として課題である。そこで、FACSを用いた脂質含有成熟脂肪細胞の精製にはナイルレッドベースの法を用いた。このソーティング戦略により、サンプルの不均一性を低減し、細胞機能を強化した脂肪細胞のプールを使用して、脂肪細胞関連の代謝障害をモデル化する信頼性の高い方法を確立することができました。
概要
間葉系幹細胞(MSC)は、脂肪細胞、骨細胞、軟骨細胞などの中胚葉起源の細胞を産生するための効果的な一時的なリソースとして機能し、それぞれの遺伝性疾患のモデリングにさらに使用できます。しかし、以前のアプローチでは、これらのMSCを成体組織から得ることに依存しており1、ドナーから大量に入手するという課題と、最適ではないin vitro培養条件で機能的に生存し続けるという限界がありました1,2。これらの障害は、in vitroでMSCを生成するためのプロトコルを有するという大きな要求を生み出している。ヒト人工多能性幹細胞(iPSC)は、MSCの特徴を示すMSCの貴重な供給源として使用することができます3,4,5。iPS細胞由来の間葉系幹細胞は、いくつかの疾患の治療選択肢として使用できます。また、iPS細胞由来のMSCは脂肪細胞を生成する能力があるため、ヒトの脂肪生成、肥満、および脂肪細胞関連疾患を研究するための貴重なin vitroヒトモデルになります。
脂肪細胞の現在の分化プロトコルは2つのグループに分類でき、1つは化学的またはタンパク質ベースのカクテルを使用した脂肪細胞の分化を含み、結果として得られる収量は30%-60%6,7,8,9であり、もう1つは脂肪細胞の発生を支配する主要な転写因子の堅牢な誘導のための遺伝子操作を含み、80%-90%の収量をもたらします10。11.しかし、遺伝子操作は脂肪細胞分化の自然な過程を再現せず、脂肪生成中に到着する微妙なパラダイムを隠すことが多く、疾患モデリングの目的には効果がありません12,13。そこで、ナイルレッドを用いて脂質を含む脂肪細胞に蛍光タグを付けることで、化学的に由来した成熟脂肪細胞と未成熟脂肪細胞を選別する方法を提示します。
ここでは、iPS細胞由来の胚様体(EB)をオールトランス レチノイン酸と一過性インキュベートして、脂肪細胞の生成にさらに使用できる多数の急速に増殖するMSCを生成するプロトコルを紹介します14。また、親油性色素を使用して脂肪滴に蛍光タグを付けることにより、化学的に誘導された成熟脂肪細胞を不均一な分化プールから選別する方法も紹介します。ナイルレッド。これにより、脂肪細胞関連代謝障害を正確にモデル化するための機能が強化された成熟脂肪細胞の純粋な集団の生成が可能になります。
プロトコル
この研究は、適切な機関研究倫理委員会によって承認され、1964年のヘルシンキ宣言およびその後の改正または同等の倫理基準に定められた倫理基準に従って実施されています。このプロトコルは、HMC(番号16260/16)およびQBRI(番号2016-003)の治験審査委員会(IRB)によって承認されました。この作業は、H1やH9などのhESCにも最適化されています。血液サンプルは、完全なインフォームドコンセントで健康な個人から取得されました。iPS細胞は、健常人の末梢血単核球(PBMC)から作製されます。
1. iPS細胞の培養と維持
- ノックアウトDMEMでコーティングマトリックスを1:80の割合で再構成して基底膜マトリックスコーティングプレートを調製し、4°Cで保存します。
- 500 mLの幹細胞基礎培地に50 mLの10x幹細胞サプリメント培地と5 mLの100xペニシリン-ストレプトマイシン(P / S)を加えてiPS細胞培養培地を調製し、短期の場合は4°C、長期使用の場合は-20°Cで保存します。
- プレートをコーティングマトリックス(6ウェルプレートの場合は1 mL、12ウェルプレートの場合は500 μL、24ウェルプレートの場合は250 μL)で裏打ちし、プレートを37°Cで1〜2時間インキュベートします。
- iPS細胞培養培地のアリコートを取り出し、室温で予熱してから使用してください。
- iPSC(ESCまたはiPSC)のバイアルを37°Cの水浴で解凍し、2〜3 mLの培養培地を含む15 mLのコニカルチューブに移します。
- チューブを120 x g で室温(RT-23°C)で4分間遠心分離します。
- 上清を除去し、10 μM ROCK阻害剤(Y-27632)を添加した新鮮な培地2 mLを加えます。細胞をマトリックスコーティングされた6ウェルプレートの1ウェルにプレートし、プレートを37°Cで配置します。
- 24時間後、培地を取り出し、新鮮な培地と交換します。
- 細胞が80%〜90%のコンフルエントに達するまで、毎日培地を交換してください。
- コンフルエントに達したら、以下に概説する手順に従って細胞を継代する。
- 培地を取り出し、ダルベッコリン酸緩衝生理食塩水(DPBS)で細胞を洗浄します。
- iPS細胞解離試薬( 材料表参照)-6ウェルプレートのウェルに500 μL、24ウェルプレートのウェルに250 μLを加え、37°Cで1分間インキュベートします。
- 解離試薬を除去し、細胞を37°Cで1分間インキュベートします。
- 培養培地(6ウェルプレートのウェルには1 mL、24ウェルプレートのウェルには250 μL)を使用して細胞を回収し、15 mLコニカルチューブに入れ、120 x g で4分間遠心分離します。
- 細胞を培養培地(6ウェルプレートのウェルには2 mL)、10 μM ROCK阻害剤を添加した24ウェルプレートのウェルには500 μLを再懸濁し、40%コンフルエントで新しいマトリックスコーティングプレートにプレートします。
2. iPS細胞から間葉系幹細胞への分化
- 低グルコースDMEM+ピルビン酸に15%ウシ胎児血清(FBS)および1%P/Sを添加してMSC分化培地を調製し、4°Cで保存します。
- コンフルエント性が80%に達したら、以下に概説する手順に従って、iPS細胞を使用して胚様体(EB)形成を行います。
- 細胞をDPBSで洗浄し、解離培地/EDTA-500 μL(6ウェルプレートのウェル)と250 μL(24ウェルプレートのウェル)でインキュベートします。
- 37°Cで1分間インキュベートし、解離試薬を吸引し、細胞を37°Cでさらに1分間保持します。MSC分化を開始するには、~10-12 x 106 細胞が必要です。
- 培地を使用して15 mLのコニカルチューブに細胞を回収します。細胞が単一になるのを防ぎ、EB形成を可能にするために、収集中は非常に穏やかであることを確認してください。細胞を120 x g で4分間遠心分離します。
- 10 μM ROCK阻害剤を含む3 mLのMSC分化培地に細胞を再懸濁します。
- 0.5 mL/ウェルを24ウェル超低アタッチメントプレートで混合して分配します。
注:超低アタッチメントプレートを使用すると、表面への付着ではなく、EBへの細胞凝集が促進されます。 - プレートを37°Cのインキュベーターに入れます。
- 24時間後、以下に概説する手順に従って、高レチノイン酸(RA)治療で達成されたEBを誘導します。
- 10 μM RA を 3 mL の MSC 分化培地に添加します。EBを15 mLチューブに集め、15分間落ち着かせます。
- EBから上清を除去し、10 μM RAを添加したMSC分化培地を追加します。
- 穏やかに再懸濁し、同じ24ウェル超低アタッチメントプレートに0.5 mL/ウェルを分配します。
- プレートを37°Cのインキュベーターに入れます。 次の48時間はEBを邪魔しないでください。
- 48時間後、EBを15 mLチューブに集め、15分間落ち着かせます。
- EBから上清を除去し、0.1 μM RAを添加したMSC分化培地を追加します。
- 穏やかに再懸濁し、同じ24ウェル超低アタッチメントプレートに0.5 mL/ウェルを分配します。
- プレートを37°Cのインキュベーターに入れます。 次の48時間はEBを邪魔しないでください。
- 以下に概説する手順に従って、セルに追加されたRAを削除します。
- 最後のRA治療の48時間後、EBを収集し、15分間落ち着かせます。
- 上清を除去し、サイトカインを含まないDMEM低グルコース培地を添加する。
- 穏やかに再懸濁し、0.5 mL/ウェルを24ウェル超低アタッチメントプレートに分配します。プレートを37°Cのインキュベーターに入れます。
- iPS細胞由来EBを以下に概説する手順に従ってプレートします。
- 前のステップ(ステップ2.4)から48時間後、EBを15 mLチューブに集め、15分間落ち着かせます。
- 上清を除去し、2 mLの新鮮なMSC分化培地に再懸濁します。
- 基底膜マトリックスコート6ウェルプレートの2つのウェルに移す。
- さらに5日間、一日おきにメディアを交換してください。
- 5日後、使用済み培地を取り除き、2.5 ng/mLの塩基性線維芽細胞増殖因子(bFGF)を含む新鮮なMSC分化培地と交換します。
- 以下に概説する手順に従って、メッキされたEBが80%〜90%のコンフルエントに達したら通過させます。
- 細胞をDPBSで洗浄し、トリプシン-EDTA-500 μLを6ウェルプレートのウェルに添加し、細胞を37°Cで3分間インキュベートします。
- 15 mL コニカルチューブ内の MSC 分化培地を使用して細胞を回収し、750 x g で 4 分間回転させます。
- 2.5 ng/mLのbFGFを含むMSC分化培地に再懸濁し、基底膜マトリックスコーティングプレート上に細胞を1:3の比率でプレートします。
- 細胞が70%〜80%のコンフルエントに達したら継代を繰り返します。2〜3回の継代で3〜600万個の細胞を獲得すると予想されています。
3. iPS細胞由来間葉系幹細胞のフローサイトメトリー解析
注:2〜3回の継代を受けたら、MSC分化の効率のために細胞にアクセスする必要があります。細胞がMSC分化マーカー-CD44、CD73、CD90、およびCD105を90%を超える効率で発現し、高レベルの造血マーカー-CD14、CD19、CD34、およびCD45を発現しない場合、分化は成功したと見なされます。これらのマーカーの効率には、以下の手順に従ってアクセスできます。
- 上記で概説したステップ(ステップ2.6)を使用して細胞を継代し、V底96ウェルプレートの1ウェルで1 x 105 細胞を達成します。
- プレートを375 x g で4°Cで4分間遠心分離します。
- 1 x 105 細胞を1 μLの結合抗体(Ab)を含む100 μLの冷DPBSに再懸濁し( 材料の表を参照)、光への暴露を防ぐために4°Cで30〜40分間インキュベートします。
- 別の1 x 105 細胞を100 μLの冷DPBSに再懸濁し、抱合型Abのそれぞれのアイソタイプコントロールを1:100の濃度で再懸濁し、4°Cで30〜40分間インキュベートして、光への曝露を防ぎます。
- インキュベーション後、プレートを375 x g で4°Cで4分間遠心分離します。 シンクの上でプレートを振って上清を捨てます。
- 細胞を100 μLの冷たいDPBSに再懸濁します。
- 細胞を375 x g で4°Cで4分間遠心分離します。 上清を捨てる。
- 細胞を200 μLの冷DPBSに再懸濁し、暗くて冷たい1.5 mLマイクロ遠心チューブに集め、蛍光活性化セルソーティング(FACS)で分析されるまで氷上に保ちます。
- FACS解析では、側方散乱(SSC-A)と前方散乱(FSC-A)を使用して細胞を分散させ、破片を排除します。さらに、前方散乱高さ(FSC-H)と前方散乱領域(FSC-A)を使用してゲート細胞を分配し、生細胞集団からダブレットから一重項を区別します。
注:細胞は、すべてのマーカーのアイソタイプコントロールのシフトに対してゲートされ、すべての染色サンプルから少なくとも10,000のゲートイベントが分析に使用されました。
4. 間葉系幹細胞の脂肪細胞への分化
- 最小必須培地(MEM)-αに10%ノックアウト血清置換(KOSR)、1%グルタミン、1%P/S、4.5 ng/μLのグルコースを添加して脂肪細胞分化基礎培地を調製し、4°Cで保存します。
- MSCが90%以上のコンフルエンシーに達するのを待ちます。成長停止期間を経るために、さらに48時間培養を続けます。
- 100 μg/mLの3-イソブチル-1-メチルキサンチン(IBMX)、1 μMのデキサメタゾン、0.2 U/mLのインスリン、100 μMのインドメタシン、および10 μMのロシグリタゾンを基礎培地に添加することにより、完全な脂肪細胞分化培地を調製します。
- MSC分化培地を除去し、DPBSを用いて細胞を洗浄します。
- 6ウェルプレートのウェルには完全脂肪細胞分化培地(2 mL)、12ウェルプレートのウェルには1 mLを加え、細胞を37°Cでインキュベートします。 14日間、一日おきに完全な分化培地を交換してください。
5. 脂肪細胞の分化効率の評価
- 分化14日目に、脂肪細胞成熟マーカー、FABP4、およびアディポネクチンについて細胞を染色することにより、分化効率を確認します。
- 培地を取り出し、細胞をDPBSで洗浄します。
- 4%パラホルムアルデヒド(PFA)(200 μL)を使用して細胞を24ウェルプレートのウェルに固定し、室温で15分間インキュベートします。
- PFAを廃棄し、0.5%トゥイーン(TBST)を含むトリス緩衝生理食塩水を使用して洗浄し、室温で15分間シェーカーに置きます。このプロセスを2回繰り返します。
- 固定した細胞を0.5%Triton X-100(PBST)を含むリン酸緩衝生理食塩水で透過処理し、室温で15〜20分間シェーカー上に置きます。
- PBSTを廃棄し、ブロッキングバッファー(PBST中の5%-6%ウシ血清アルブミン(BSA))-6ウェルプレートのウェルには500 μL、12ウェルプレートのウェルには250 μLを加え、シェーカー上で室温で40〜60分間インキュベートします。
- FABP4に対する一次抗体、アディポネクチンを2%〜3%BSAで1:500の濃度で希釈します( 材料表を参照)。異なる動物で飼育した場合にのみこれらの抗体を一緒に追加し、プレートを4°Cのシェーカーに一晩置きます。
- 一次抗体を除去し、細胞をTBSTで3回洗浄し(各15分)、室温でシェーカー上に置きます。
- アレクサ蛍光二次抗体をPBSTで調製します(1:500)。二次抗体の組み合わせ(一次抗体が産生される種に応じて)で細胞を室温で60分間インキュベートし、プレートをアルミホイルで覆って光から保護します。
- 二次抗体を廃棄し、TBSTで3回洗浄し、プレートをシェーカーに置きます。
- 核を染色するには、PBSで希釈した24ウェルプレートのウェルに1 μg/mLのHoechst 33342-200 μLを加え、室温で5分間インキュベートします。
- ヘキスト溶液を廃棄し、24ウェルプレートのウェルにPBS-500 μLを細胞に加えます。倒立蛍光顕微鏡で可視化するまで、プレートを光から覆ってください。
6. ナイルレッドを用いた脂肪細胞の選別
- DMSOに1 mg/mLのナイルレッドストック溶液を加えてナイルレッド作業溶液を調製し、-20°Cで保存します。 使用直前に、ナイルレッドストックを解凍し、DPBSで再構成して、300 nMの作業溶液濃度を達成します。
- 脂肪細胞分化の14日目以降に、細胞から培地を廃棄し、DPBSを用いて洗浄する。
- ナイルレッドの作業溶液-1 mLを6ウェルプレートのウェルに加え、37°Cで15分間インキュベートします。
- ナイルレッド溶液を除去し、トリプシン-EDTA -500 μLを6ウェルプレートのウェルに加え、37°Cで4分間インキュベートします。
- 15 mL コニカルチューブ内の 5% FBS を含む DMEM を使用して細胞を回収します。750 x g で4分間遠心分離します。
- 上清を除去し、DPBS-1 mL に 1 x 106 細胞分間再懸濁します。750 x g で4分間遠心分離します。
- 上清を除去し、DPBS-1 mL に 1 x 106 細胞分間再懸濁します。FACSソーターを使用して、FL1チャネルを使用してナイル赤陽性細胞を単離します。
- 選別した細胞を脂肪細胞分化培地で再培養するか、選別した細胞を集めてRNAやタンパク質を単離します。
- 選別した細胞からRNAを抽出し、FABP4、PPARG、C/EBPAなどの脂肪細胞分化マーカーの相対定量解析を行います。ナイル赤陽性細胞は、選別されていない細胞と比較して、少なくとも2倍の遺伝子発現の有意なアップレギュレーションを示す。
結果
間葉系分化における細胞の概略と形態:iPS細胞から間葉系幹細胞への分化には、EB形成、MSC分化、MSC増殖にまたがるさまざまな発生段階があります(図1)。発生のこれらの段階で、細胞は、それらが受ける異なる刺激化学物質のために様々な形態を獲得する。分化を開始すると、細胞は懸濁液に播種され、直径が小から中のサイズでありながら、明確な細胞境界を持つ円形であることが期待されます(図2)。分化の初期段階で浮遊状態で細胞を培養することを選択することで、自然な胚発生のプロセスによく似たものになり、この段階は分化を成功させるために非常に重要です。EB形成とRA処理の段階に続いて、基底膜マトリックスコーティングプレートにEBをメッキします。めっき時のEBの生存率は、より多くのMSCを生じる急速な増殖挙動を観察することでアクセスできます(図2)。間葉系幹細胞が示すこの急速な増殖挙動は、特異で細長い形態を保持しながら、新しいマトリックスコーティングされたプレートに通過させた後でも保持されます(図2)。
MSC表面マーカーの定量的評価:MSCの分化効率は、MSC分化に特異的な表面マーカーの定量によってアクセスされます。信頼性の高いMSCを産生する良好な分化は、間葉系表面マーカーCD73、CD44、およびCD90の90%以上の効率を示すはずです(図3A)。それに加えて、細胞は造血表現型、CD14、CD34、およびCD19を示す表面マーカーがないことについても評価されるため、細胞に対する発現効率は1%未満であることが期待されます(図3B)。
MSCの脂肪細胞への分化:MSCの脂肪細胞への分化は、FABP4およびアディポネクチンの染色によってアクセスできます。FABP4は細胞質タンパク質であり、最終分化型脂肪細胞のマーカーとされています。細胞質分布を有する脂肪細胞におけるその高い発現は、それらの発生成熟の重要な兆候です(図4A)。FABP4に加えて、アディポネクチンは脂肪細胞成熟の重要なマーカーの1つと見なされています。その高い発現は、脂肪細胞がグルコースシグナル伝達に応答して脂質貯蔵および脂肪生成を受けるのに十分機能的であることを示している。分泌タンパク質であるアディポネクチンは、細胞質内ですべてのタンパク質球を容易に区別できる球状形態を示します(図4B)。
ナイルレッドを用いた成熟脂肪細胞の染色と選別:分化時に、成熟脂肪細胞はナイルレッドを染色することによって未熟な脂肪細胞と区別することができます。ナイルレッドは、成熟脂肪細胞特有の特徴である脂質含有脂肪細胞に結合します(図5A)。これは、ナイルレッドの蛍光担持特性とともに、蛍光活性化フローサイトメトリーを使用して成熟脂肪細胞を選別するための効果的なツールになります(図5B)。効果的なソーティングは、定量的リアルタイムPCR(qRT-PCR)によって決定された成熟マーカー(PPARG、C/EBPA、およびFABP4)を少なくとも2倍増強するはずです(図5C)。

図1:iPS細胞と間葉系幹細胞と脂肪細胞への分化を示す模式図。 iPS細胞は、胚様体(EB)技術を用いて間葉系幹細胞に分化します。EBを10μMの全トランスレチノイン酸(RA)の短時間露光にかけます。生成されたMSCは、iPS細胞株に基づいて40%〜77%の脂肪細胞に分化します。ナイルレッド陽性細胞は、FACSを使用して選別され、脂肪細胞関連疾患の研究(疾患モデリング)、新薬の特定、そして最終的には個別化治療に使用できる成熟脂肪細胞の精製集団が得られます。この図の拡大版を表示するには、ここをクリックしてください。
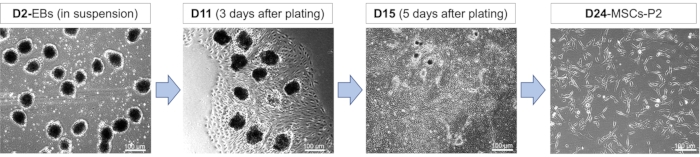
図2:iPS細胞から間葉系幹細胞への分化 2日目(D2)、11日目(D11)、15日目(D15)、および24日目(D24)におけるMSC分化の異なる段階を示す代表的な形態学的画像。10 μMのRA存在下で24時間生成された胚様体(EB)を分化8日目に播種し、その後、分化の12〜17日後に解離および継代した。MSCは数回継がれました。略語:P2 =パッセージ2。 この図の拡大版を表示するには、ここをクリックしてください。

図3:iPS細胞由来MSCにおけるMSCマーカーおよび造血マーカーの発現。 10 μMのRAで処理したiPS細胞由来EBから生成されたMSCにおけるMSCマーカー、CD73、CD44、およびCD90(A)および造血マーカー、CD34、CD19、およびCD14(B)の発現を示す代表的なフローサイトメトリーヒストグラム。グラフ中のX軸は蛍光強度を表す。 この図の拡大版を表示するには、ここをクリックしてください。
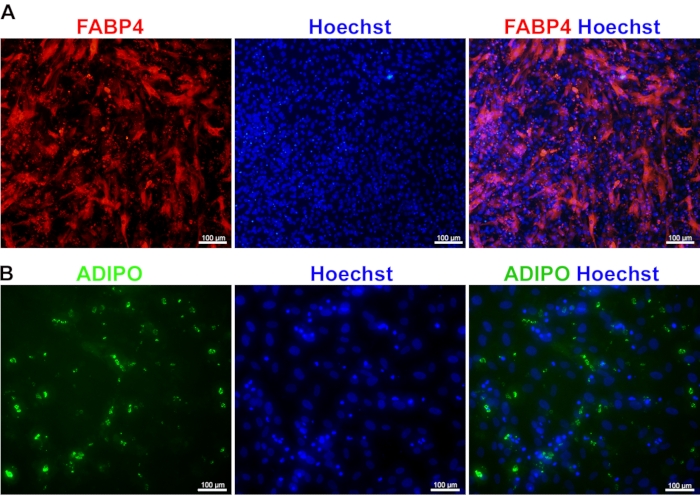
図4:iPS細胞由来間葉系幹細胞の脂肪細胞への分化 iPS細胞由来の成熟脂肪細胞におけるFABP4(A)およびアディポネクチン(ADIPO)(B)の発現を示す免疫染色像。核をヘキストで染色した。 この図の拡大版を表示するには、ここをクリックしてください。

図5:ナイルレッドを用いたiPS細胞由来脂肪細胞のソーティング。 (A)明視野(BF)およびナイルレッド染色された成熟脂肪細胞を示す画像。(B)FACSを用いた成熟脂肪細胞中のナイルレッド(PE陽性細胞)の定量。(C)選別された成熟脂肪細胞と選別されていない成熟脂肪細胞におけるC / EBPA、FABP4、およびPPARGの発現を示すリアルタイムPCR分析。データは平均±SDとして表されます。*p < 0.05, **p < 0.01, **p < 0.001.この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、MSCを高い収率と効率で提供できるため、最も重要です。このMSCの大量生産は、iPS細胞由来EBと10 μMのRA14,15との一過性インキュベーションによって可能になりました。10 μMのRAによる一過性治療は、MSC収量を11.2〜1542倍に増加させ14,15、このプロトコルはiPS細胞とhPSCの両方に適用できます。この用量および治療期間において、RAは、iPS細胞の生存および増殖に重要な細胞増殖、アポトーシス、ならびに細胞間およびECM細胞接着に関与するいくつかの遺伝子の発現を直接的または間接的に調節することにより、EB形成細胞の増殖および生存能力を改善する14,16.遺伝子には、転写因子(EGFR4、SOX4など)、成長因子および成長因子受容体(IGF2、FGFR4など)、および接着分子(FN1およびCAMなど)が含まれますが、これらに限定されません。しかし、低用量(0.1-10 μM)とは対照的に、高用量(≥20 μM)では、RAはEB形成細胞の増殖と生存を負に調節し、PSC由来のEB数とサイズを減少させ、それによってMSCの収量を低下させます14。RAは、いくつかの正常な分化細胞および癌細胞における増殖阻害剤とみなされる17、18、19。EBでは、レチノイドシグナル伝達はコンテキスト(時間、濃度、種、および細胞株)に依存します。異なる遺伝子とシグナル伝達経路を調節することにより、EB形成細胞の自己複製、生存、および分化に異なる影響を及ぼします20,21。したがって、EB誘導の3日目にRA-10 μMの最適な時間と濃度でRAを使用し、続いて本プロトコルに記載されているように5日目に2日間0.1 μMに用量を減らすことは、EB形成細胞の生存と増殖を誘導するために重要です。
増殖および生存を調節することに加えて、RAは、RA14で処理されていない細胞と比較して、処理されたEBを分化遅延にさらします。実際、RA処理EBは、RA未処理EBとは対照的に、プレーティング後もコンパクトな形状を維持し、MSC様細胞に分化しません。これは、RA治療への短期間の曝露がWNTシグナル伝達の抑制を通じて細胞分化を阻害することを報告している以前の研究と一致している21。さらに、これらのRA処理分化遅延細胞は、iPS細胞16の多能性状態の維持に重要な役割を果たすことが知られているカドヘリンおよび細胞外マトリックスタンパク質14の発現増強も示した。RA媒介分化ブロックを放出するには、EBを解離させる必要があり、その結果、細胞接着が破壊され、プレーティング時に長期間のMSC分化が可能になります。興味深いことに、RA処理は細胞に対する分化ブロックを保持しましたが、細胞を多能性状態に維持しませんでした。実際、10 μM RAへの短期間の曝露を受けたEB形成細胞は、主要な多能性マーカーであるOCT4、SOX2、およびNANOG14の発現が有意に低下しています。
EBの短期RA処理によって生成されたMSCは、MSC表面マーカーの豊富な発現と凍結保存後の多能性により、典型的な線維芽細胞様形態を維持することが示されているため、これらの大量生産されたMSCは長期拡張研究のために保存可能です14。これらのMSCを脂肪原性、軟骨形成性、および骨形成性の分化条件にさらすと、これらのMSCは3つの中胚葉細胞型に容易に分化できるため、組織関連疾患をモデル化するための容易に達成可能なソースになります14。したがって、RAを介した分化プロトコルによって生成されたMSCの安定した 汎用性の高いin vitro 挙動は、研究およびアプリケーションベースの設定において最も重要になります。
RA処理EBから得られた間葉系幹細胞の軟骨形成および骨形成分化能は、未処理EBから得られた間葉系幹細胞の軟骨形成および骨形成分化能は類似しているように見えるが、前者は脂肪分化条件に供すると脂肪原性系統への分化能が高まることがわかった14。このことは、RA処理EB由来の間葉系幹細胞を脂肪分化培地で培養した後に得られた細胞の分化プールにおける細胞内脂質蓄積(オイルレッドO染色)および脂肪細胞マーカーFABP4陽性細胞が、RA未処理EB由来の間葉系幹細胞と比較して2〜3倍増加したことからも明らかである。これは、RA処理および未処理のEBからのRNAシーケンシングデータによって明らかにされたように、カバ、WNT、およびECM細胞相互作用経路などの脂肪細胞発生を支配するいくつかのシグナル伝達経路のRAによる調節の結果である可能性があります14,22,23,24,25。現在利用可能なプロトコルは、脂肪細胞収量の低下につながるか、遺伝子操作を利用して生成された脂肪細胞を天然プロセス複製脂肪細胞を誘導するために非常に貴重であるため、RA由来のMSCが脂肪分化を受けるこの強化された能力は価値があります。脂肪細胞は、ホワイト、ブラウン、ベージュの3種類に分類されます。白色脂肪細胞は、単一の脂肪滴の存在によって分類され、エネルギー貯蔵において役割を果たす。一方、褐色脂肪細胞は、UCP1の発現を特徴とするミトコンドリアの存在量が非常に高いため、基質酸化によるエネルギー消費に関与しています。一方、白色脂肪組織に局在する褐色脂肪細胞は、ベージュまたは茶色のような脂肪細胞として知られています。これらのMSCは、EBのRAへの事前曝露が与えられた場合、白色脂肪細胞の豊富な収量を与える可能性があります。以前の出版物では、UCP1レベルが高い細胞をRA26に曝露するのではなく、低UCP1を発現する細胞、すなわち白色脂肪細胞へのiPS細胞の選択的誘導が述べられていた。以前の出版物では、マウスおよびゼブラフィッシュ胚の神経堤細胞から産生されるRAが白色脂肪細胞形成に重要な役割を果たすことが報告されています27,28。
RAベースのプロトコルでは、脂肪細胞の収量が48.5%〜77.4%に達するMSCの生成が可能になりましたが(RA治療なしの22.5%〜57.6%)、>90%を達成しないことは、多変量脂肪細胞ベースの遺伝性疾患をモデル化する場合に依然として問題があります in vitro.実際、純粋な脂肪細胞集団に到達しないと、観察された発生上の違いが異なる遺伝子構成によるものなのか、一貫性のない分化効率によるものなのかを区別するのが難しいため、多変異疾患モデルから得られる結果が曖昧になる可能性があります。この問題を回避するためには、分化した細胞を選別して純粋な成熟脂肪細胞のプールを得ることが重要であり、表現型の違いは固有の遺伝的差異にのみ起因する可能性がある。いくつかの研究では、ソーティングに使用できる可能性のある脂肪細胞の表面マーカーが特定されています。例えば、Ronald Kahnによって行われた研究は、白色脂肪細胞上の新規表面マーカーとしてのアミノ酸トランスポーターASC-1の同定を可能にした29.さらに、大網および皮下領域から成熟脂肪細胞を抽出する研究では、成熟脂肪細胞が表面にCD34、CD36、およびCD59を発現することが報告されています30CD36は成熟脂肪細胞の表面で脂肪酸トランスポーターとして機能することが報告されています31.しかしながら、これらの研究は、成熟脂肪細胞集団のみにこれらのマーカーの発現を特定することなく、脂肪組織に由来する細胞の不均一な集団を利用している。さらに、これらのマーカーは、他の細胞型によっても発現することができ、脂肪細胞に特異的ではない。例えば、ASC-1は星状細胞とニューロンの両方に存在します32、CD34は造血幹細胞のマーカーである33、CD36は血小板、単核食細胞、肝細胞、筋細胞、およびいくつかの上皮に存在します33、およびCD59は内皮およびリンパ系細胞に発現している34,35.したがって、代替溶液として、細胞内脂質の選択的蛍光染色であるナイルレッドを、脂肪細胞を選別するための可能な候補として使用しました。脂肪細胞は、放出され、エネルギーの生成、膜の構築、または代謝を調節するシグナル伝達分子として使用できる脂質のかなりの量を貯蔵しています36.ナイルレッド色素は、マウスおよびヒトMSC由来の脂肪細胞を染色するために、フローサイトメトリーおよび顕微鏡検査で以前に使用されてきました37.以前の研究では、ESC由来の脂肪細胞に対するナイルレッドの使用と、ソーティング後の脂肪細胞マーカーの強化が報告されています38.本RAベースのプロトコルによって得られた間葉系幹細胞から生成された脂肪細胞は、成熟度を示すナイルレッドに染色される能力について評価され、精製するために選別されました。これらのナイルレッドソート細胞は、脂肪細胞成熟マーカーの発現において2〜3倍の増加を示した PPARG, C/EBPAそして FABP4 未選別細胞と比較して、iPS細胞由来脂肪細胞の収量をさらに増加させる。これらのマーカーは脂質蓄積前に発現されるが、それらの発現は脂質担持脂肪細胞への最終分化のために細胞にタグを付ける。これらのマーカーで選別効率を確認することで、すべての細胞が発現しているプールを特定することができます FABP4, CEBPaそして PPARg成熟脂肪細胞形成のために予め運命づけられたプールを示す。細胞は、ナイルレッドへの染色の可能性に基づいて選別されます。精製効率は、未選別画分中の脂肪細胞の数が多いため、2〜3倍に増加しました。脂質を含む脂肪細胞のサイズは、同じサイズ分布を有する細胞のプールが選別される分化中に大きく変化する。未選別画分には脂質含有脂肪細胞が含まれますが、完全に成熟しておらず、異なるサイズの比率によって支配されています.
人体から単離された間葉系幹細胞の不均一性は以前に報告されています39。この異質性は、MSCの起源、ドナー、および条件39などのいくつかの要因に依存する。これは、さまざまな病気の治療における効率にばらつきをもたらす可能性があります。この研究は、適正製造基準(GMP)に適合した培養条件下で生産されたhPS細胞を短時間RA処理すると、MSCの集団が均質になることを示唆しています。これは、現在のプロトコルが、MSCベースの治療に使用できる多数の臨床グレードのMSCを生成するための有望なアプローチであることを示しています。
脂肪細胞分化につながるRAベースのMSC分化プロトコルとナイルレッドソーティングプロトコルの組み合わせにより、機能マーカーの発現が増強され、収量と純度が向上したiPS細胞由来脂肪細胞を得ることができました。したがって、この組み合わせたプロトコルにより、十分な量と純度で、遺伝的に異なる個体から成熟脂肪細胞を生成し、脂肪細胞関連の代謝障害の背後にある新しい遺伝的変異を明らかにすることができます。
開示事項
著者は、競合する利益がないことを宣言します。
謝辞
この作業は、カタール国立研究基金(QNRF)からの助成金によって資金提供されました(助成金番号NPRP10-1221-160041)。マリアム・アガディは、カタール国立研究基金(QNRF)からのGSRA奨学金の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Adiponectin | Abcam | ab22554 | Adipocyte maturation marker |
| anti-CD105 | BD Pharmingen | 560839 | MSC differentiation marker |
| anti-CD14 | BD Pharmingen | 561712 | MSC differentiation marker |
| anti-CD19 | BD Pharmingen | 555415 | MSC differentiation marker |
| anti-CD34 | BD Pharmingen | 555824 | MSC differentiation marker |
| anti-CD44 | abcam | ab93758 | MSC differentiation marker |
| anti-CD45 | BD Pharmingen | 560975 | MSC differentiation marker |
| anti-CD73 | BD Pharmingen | 550256 | MSC differentiation marker |
| anti-CD90 | BD Pharmingen | 555596 | MSC differentiation marker |
| bFGF | R&D | 233-FP | MSC culture media supplement |
| C/EBPA | Abcam | ab40761 | Adipocyte maturation marker |
| Dexamethasone | Torics | 1126 | Adipocyte differentiation media supplement |
| FABP4 | Abcam | ab93945 | Adipocyte maturation marker |
| Fetal bovine serum | ThermoFisher | 10082147 | MSC culture media supplement |
| Glutamax | ThermoFisher | 35050-061 | MSC culture media supplement |
| IBMX | Sigma Aldrich | I5879 | Adipocyte differentiation media supplement |
| Indomethacin | Sigma Aldrich | I7378 | Adipocyte differentiation media supplement |
| Insulin | Sigma Aldrich | 91077C | Adipocyte differentiation media supplement |
| Knockout DMEM | ThermoFisher | 12660012 | Basal media for preparing matrigel |
| Low glucose DMEM | ThermoFisher | 11885084 | MSC culturing media |
| Matrigel | Corning | 354230 | Coating matrix |
| MEM-alpha | ThermoFisher | 12561056 | Adipocyte differentiation media |
| Nilered | Sigma Aldrich | 19123 | Sorting marker for adipocyte |
| Penicillin | ThermoFisher | 15140122 | MSC/Adipocyte media supplement |
| Phosphate-buffered saline | ThermoFisher | 14190144 | wash buffer |
| Pierce™ 20X TBS Buffer | Thermo Fisher | 28358 | wash buffer |
| PPARG | Cell Signaling Technology | 2443 | Adipocyte maturation marker |
| ReLeSR | Stem Cell Technologies | 5872 | Dissociation reagent |
| Retinoic acid | Sigma Aldrich | R2625 | MSC differentiation media supplement |
| Rock inhibitor | Tocris | 1254/10 | hPSC culture media supplement |
| Roziglitazone | Sigma Aldrich | R2408 | Adipocyte differentiation media supplement |
| StemFlex | ThermoFisher | A334901 | hPSC culture media |
| Triton | Thermo Fisher | 28314 | Permebealization reagent |
| Trypsin | ThermoFisher | 25200072 | Dissociation reagent |
| Tween 20 | Sigma Aldrich | P7942 | Wash buffer |
参考文献
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling: CCS. 9, 12(2011).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PLoS One. 4 (6), 5846(2009).
- Brown, P. T., Squire, M. W., Li, W. J. Characterization and evaluation of mesenchymal stem cells derived from human embryonic stem cells and bone marrow. Cell and Tissue Research. 358 (1), 149-164 (2014).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Experimental Hematology. 36 (3), 350-359 (2008).
- Barberi, T., Willis, L. M., Socci, N. D., Studer, L. Derivation of multipotent mesenchymal precursors from human embryonic stem cells. PLoS Medicine. 2 (6), 161(2005).
- Xiong, C., et al. Derivation of adipocytes from human embryonic stem cells. Stem Cells and Development. 14 (6), 671-675 (2005).
- Cuaranta-Monroy, I., et al. Highly efficient differentiation of embryonic stem cells into adipocytes by ascorbic acid. Stem Cell Research. 13 (1), 88-97 (2014).
- van Harmelen, V., et al. Differential lipolytic regulation in human embryonic stem cell-derived adipocytes. Obesity (Silver Spring). 15 (4), 846-852 (2007).
- Noguchi, M., et al. In vitro characterization and engraftment of adipocytes derived from human induced pluripotent stem cells and embryonic stem cells. Stem Cells and Development. 22 (21), 2895-2905 (2013).
- Ahfeldt, T., et al. Programming human pluripotent stem cells into white and brown adipocytes. Nature Cell Biology. 14 (2), 209-219 (2012).
- Lee, Y. K., Cowan, C. A. Differentiation of white and brown adipocytes from human pluripotent stem cells. Methods in Enzymology. 538, 35-47 (2014).
- Abdelalim, E. M. Modeling different types of diabetes using human pluripotent stem cells. Cellular and Molecular Life Sciences: CMLS. 78 (6), 2459-2483 (2021).
- Abdelalim, E. M., Bonnefond, A., Bennaceur-Griscelli, A., Froguel, P. Pluripotent stem cells as a potential tool for disease modelling and cell therapy in diabetes. Stem Cell Reviews and Reports. 10 (3), 327-337 (2014).
- Karam, M., Younis, I., Elareer, N. R., Nasser, S., Abdelalim, E. M. Scalable Generation of mesenchymal stem cells and adipocytes from human pluripotent stem cells. Cells. 9 (3), (2020).
- Karam, M., Abdelalim, E. M. Robust and highly efficient protocol for differentiation of human pluripotent stem cells into mesenchymal stem cells. Methods in Molecular Biology. , Clifton, N.J. (2020).
- Li, L., Bennett, S. A., Wang, L. Role of E-cadherin and other cell adhesion molecules in survival and differentiation of human pluripotent stem cells. Cell Adhesion & Migration. 6 (1), 59-70 (2012).
- Lai, L., Bohnsack, B. L., Niederreither, K., Hirschi, K. K. Retinoic acid regulates endothelial cell proliferation during vasculogenesis. Development. 130 (26), 6465-6474 (2003).
- Chanchevalap, S., Nandan, M. O., Merlin, D., Yang, V. W. All-trans retinoic acid inhibits proliferation of intestinal epithelial cells by inhibiting expression of the gene encoding Kruppel-like factor 5. FEBS Letters. 578 (1-2), 99-105 (2004).
- di Masi, A., et al. Retinoic acid receptors: from molecular mechanisms to cancer therapy. Molecular Aspects of Medicine. 41, 1(2015).
- Simandi, Z., Balint, B. L., Poliska, S., Ruhl, R., Nagy, L. Activation of retinoic acid receptor signaling coordinates lineage commitment of spontaneously differentiating mouse embryonic stem cells in embryoid bodies. FEBS Letters. 584 (14), 3123-3130 (2010).
- De Angelis, M. T., Parrotta, E. I., Santamaria, G., Cuda, G. Short-term retinoic acid treatment sustains pluripotency and suppresses differentiation of human induced pluripotent stem cells. Cell Death & Disease. 9 (1), 6(2018).
- Li, L., Dong, L., Wang, Y., Zhang, X., Yan, J. Lats1/2-mediated alteration of hippo signaling pathway regulates the fate of bone marrow-derived mesenchymal stem cells. BioMed Research International. 2018, 4387932(2018).
- Moldes, M., et al. Peroxisome-proliferator-activated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis. The Biochemical Journal. 376, Pt 3 607-613 (2003).
- Ross, S. E., et al. Inhibition of adipogenesis by Wnt signaling. Science. 289 (5481), 950-953 (2000).
- Wang, Y. K., Chen, C. S. Cell adhesion and mechanical stimulation in the regulation of mesenchymal stem cell differentiation. Journal of Cellular and Molecular Medicine. 17 (7), 823-832 (2013).
- Mohsen-Kanson, T., et al. Differentiation of human induced pluripotent stem cells into brown and white adipocytes: role of Pax3. Stem Cells. 32 (6), 1459-1467 (2014).
- Billon, N., et al. The generation of adipocytes by the neural crest. Development. 134 (12), 2283-2292 (2007).
- Li, N., Kelsh, R. N., Croucher, P., Roehl, H. H. Regulation of neural crest cell fate by the retinoic acid and Pparg signalling pathways. Development. 137 (3), 389-394 (2010).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Festy, F., et al. Surface protein expression between human adipose tissue-derived stromal cells and mature adipocytes. Histochemistry and Cell Biology. 124 (2), 113-121 (2005).
- Cai, L., Wang, Z., Ji, A., Meyer, J. M., vander Westhuyzen, D. R. Scavenger receptor CD36 expression contributes to adipose tissue inflammation and cell death in diet-induced obesity. PLoS One. 7 (5), 36785(2012).
- Mesuret, G., et al. A neuronal role of the Alanine-Serine-Cysteine-1 transporter (SLC7A10, Asc-1) for glycine inhibitory transmission and respiratory pattern. Scientific Reports. 8 (1), 8536(2018).
- Silverstein, R. L., Febbraio, M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior. Science Signaling. 2 (72), (2009).
- Brooimans, R. A., van Wieringen, P. A., van Es, L. A., Daha, M. R. Relative roles of decay-accelerating factor, membrane cofactor protein, and CD59 in the protection of human endothelial cells against complement-mediated lysis. European Journal of Immunology. 22 (12), 3135-3140 (1992).
- Davies, A., et al. CD59, an LY-6-like protein expressed in human lymphoid cells, regulates the action of the complement membrane attack complex on homologous cells. The Journal of Experimental Medicine. 170 (3), 637-654 (1989).
- Lapid, K., Graff, J. M. Form(ul)ation of adipocytes by lipids. Adipocyte. 6 (3), 176-186 (2017).
- Aldridge, A., et al. Assay validation for the assessment of adipogenesis of multipotential stromal cells--a direct comparison of four different methods. Cytotherapy. 15 (1), 89-101 (2013).
- Schaedlich, K., Knelangen, J. M., Navarrete Santos, A., Fischer, B., Navarrete Santos, A. A simple method to sort ESC-derived adipocytes. Cytometry A. 77 (10), 990-995 (2010).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences: CMLS. 78 (2), 447-467 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved