Method Article
התמיינות איתנה של תאי גזע פלוריפוטנטיים מושרים אנושיים לאוכלוסייה טהורה של אדיפוציטים כדי לחקור הפרעות הקשורות לאדיפוציטים
In This Article
Summary
הפרוטוקול מאפשר יצירת אוכלוסיית אדיפוציט טהורה מתאי גזע פלוריפוטנטיים מושרים (iPSCs). חומצה רטינואית משמשת להתמיינות iPSCs לתאי גזע מזנכימליים (MSCs) המשמשים לייצור אדיפוציטים. לאחר מכן, גישת מיון המבוססת על צביעה אדומה של הנילוס משמשת להשגת אדיפוציטים טהורים.
Abstract
ההתקדמות האחרונה בטכנולוגיית תאי גזע פלוריפוטנטיים מושרים (iPSC) אפשרה יצירה של סוגי תאים שונים, כולל אדיפוציטים. עם זאת, שיטות ההבחנה הנוכחיות הן בעלות יעילות נמוכה ואינן מייצרות אוכלוסייה הומוגנית של אדיפוציטים. כאן, אנו עוקפים בעיה זו באמצעות שיטה מבוססת all-trans רטינואית לייצור תאי גזע מזנכימליים (MSC) בתפוקה גבוהה. על ידי ויסות מסלולים השולטים בהתפשטות, הישרדות והיצמדות תאים, אסטרטגיית ההתמיינות שלנו מאפשרת יצירה יעילה של גופים עובריים (EBs) המתמיינים לאוכלוסייה טהורה של MSCs רב-עוצמה. המספר הגבוה של MSCs שנוצרו על ידי שיטה זו מספק מקור אידיאלי ליצירת אדיפוציטים. עם זאת, הטרוגניות הדגימה הנובעת מהתמיינות אדיפוציטים נותרה אתגר. לכן, השתמשנו בשיטה מבוססת אדום הנילוס לטיהור אדיפוציטים בוגרים נושאי שומנים באמצעות FACS. אסטרטגיית מיון זו אפשרה לנו לבסס דרך אמינה למדל הפרעות מטבוליות הקשורות לאדיפוציט באמצעות מאגר של אדיפוציטים עם הטרוגניות דגימה מופחתת ופונקציונליות תאים משופרת.
Introduction
תאי גזע מזנכימליים (MSCs) פועלים כמשאב חולף יעיל לייצור תאים ממוצא מזודרמלי כמו אדיפוציטים, אוסטיאוציטים וכונדרוציטים, אשר יכולים לשמש עוד יותר למידול ההפרעות הגנטיות שלהם. עם זאת, גישות קודמות הסתמכו על השגת MSCs אלה מרקמות בוגרות 1, אשר הטילו את האתגר של השגתם במספרים גבוהים מהתורמים, ואת המגבלה של שמירה על יכולת התפקוד שלהם בתנאי תרבית חוץ גופית תת-אופטימליים 1,2. מכשולים אלה יצרו דרישה גדולה של פרוטוקול ליצירת MSCs במבחנה. תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSCs) יכולים לשמש כמקור רב ערך של MSCs, המציגים מאפייני MSC 3,4,5. MSCs הנגזרים מ- iPSCs יכולים לשמש כאופציה טיפולית במספר מחלות. כמו כן, היכולת של MSCs שמקורם ב- iPSCs לייצר אדיפוציטים, הופכת אותם למודל אנושי בעל ערך במבחנה לחקר אדיפוגנזה אנושית, השמנת יתר והפרעות הקשורות לאדיפוציטים.
ניתן לסווג את פרוטוקולי ההתמיינות הנוכחיים של אדיפוציטים לשתי קבוצות, כאשר האחת כוללת התמיינות של אדיפוציטים באמצעות קוקטיילים כימיים או מבוססי חלבון המניבה תשואה של 30%-60%6,7,8,9, ואילו השנייה כוללת מניפולציה גנטית לאינדוקציה חזקה של גורמי שעתוק מרכזיים השולטים בהתפתחות האדיפוציטים כדי לתת תשואה של 80%-90%10, 11. עם זאת, מניפולציה גנטית אינה משחזרת את התהליך הטבעי של התמיינות אדיפוציטים, ולעתים קרובות מסווה את הפרדיגמות העדינות המגיעות במהלך אדיפוגנזה, מה שהופך אותה ללא יעילה למטרות מידול מחלות12,13. לכן, אנו מציגים דרך למיין אדיפוציטים בוגרים שמקורם כימי מאדיפוציטים לא בוגרים על ידי תיוג פלואורסצנטי של אדיפוציטים נושאי שומנים באמצעות אדום הנילוס.
כאן אנו מציגים פרוטוקול הכולל דגירה חולפת של גופים עובריים שמקורם ב- iPSCs (EBs) עם חומצה רטינואית all-trans כדי לייצר מספר גבוה של MSCs המתרבים במהירות, אשר יכולים לשמש עוד יותר לייצור אדיפוציטים14. אנו גם מציגים דרך למיין אדיפוציטים בוגרים שמקורם כימי ממאגר ההתמיינות ההטרוגנית על ידי תיוג פלואורסצנטי של טיפות השומנים שלהם באמצעות צבע ליפופילי; אדום הנילוס. זה יאפשר יצירת אוכלוסייה טהורה של אדיפוציטים בוגרים עם פונקציונליות משופרת כדי למדל במדויק הפרעות מטבוליות הקשורות לאדיפוציטים.
Protocol
המחקר אושר על ידי ועדת האתיקה המוסדית המתאימה ובוצע בהתאם לסטנדרטים האתיים כפי שנקבעו בהצהרת הלסינקי משנת 1964 ותיקוניה המאוחרים יותר או סטנדרטים אתיים דומים. הפרוטוקול אושר על ידי מועצת הביקורת המוסדית (IRB) של HMC (מס '16260/16) ו- QBRI (מס '2016-003). עבודה זו ממוטבת גם עבור תאי גזע עובריים (HESC) כגון H1 ו-H9. דגימות דם נלקחו מאנשים בריאים בהסכמה מדעת מלאה. תאי גזע פלוריפוטנטיים מושרים נוצרים מתאי דם חד-גרעיניים היקפיים (PBMCs) של אנשים בריאים.
1. טיפוח ותחזוקה של תאי גזע פלוריפוטנטיים מושרים
- הכינו לוחות מטריצת ממברנת מרתף על ידי בנייה מחדש של מטריצת ציפוי בנוקאאוט-DMEM ביחס של 1:80 ואחסנו ב -4 מעלות צלזיוס.
- הכן מדיה תרבית iPSCs על ידי הוספת 50 מ"ל של 10x מדיה תוספת תאי גזע ל 500 מ"ל של מדיה בסיסית של תאי גזע, יחד עם 5 מ"ל של 100x פניצילין-סטרפטומיצין (P / S) ולאחסן ב 4 ° C לטווח קצר או ב -20 ° C לשימוש לטווח ארוך.
- רפדו את הלוחות במטריצת ציפוי - 1 מ"ל לצלחת 6 בארות, 500 מיקרוליטר לצלחת 12 בארות, 250 מיקרוליטר לצלחת 24 בארות - ודגרו על הצלחת ב 37 מעלות צלזיוס למשך 1-2 שעות.
- יש להסיר אליציטוט של מצעי תרבית iPSCs ולחמם מראש בטמפרטורת החדר לפני השימוש.
- הפשירו בקבוקון של iPSCs (ESCs או iPSCs) באמבט מים של 37 מעלות צלזיוס והעבירו לצינור חרוטי של 15 מ"ל המכיל 2-3 מ"ל של מדיה תרבותית.
- צנטריפוגה את הצינור ב 120 x גרם במשך 4 דקות בטמפרטורת החדר (RT-23 ° C).
- הסר את supernatant ולהוסיף 2 מ"ל של מדיה תרבותית טרייה בתוספת מעכב ROCK 10 μM (Y-27632). לוחים את התאים בבאר אחת של צלחת 6 בארות מצופת מטריצה ומניחים את הצלחת בטמפרטורה של 37°C.
- לאחר 24 שעות, הסר את המדיה והחלף אותה במדיה תרבותית רעננה.
- שנה את המדיה כל יום עד שהתאים מגיעים למפגש של 80%-90%.
- עם ההגעה למפגש, עברו תאים על ידי ביצוע השלבים המתוארים להלן.
- הסר את המדיה ושטוף את התאים עם מלח חוצץ פוספט של Dulbecco (DPBS).
- הוסף מגיב דיסוציאציה iPSCs (ראה טבלת חומרים)-500 μL עבור באר של צלחת 6 בארות, 250 μL עבור באר של צלחת 24 בארות - ודגור במשך דקה אחת ב 37 ° C.
- הסר את מגיב הדיסוציאציה ודגר על התאים יבשים במשך דקה אחת ב 37 מעלות צלזיוס.
- לאסוף את התאים באמצעות מדיה תרבית - 1 מ"ל עבור באר של צלחת 6 בארות ו 250 μL עבור באר של צלחת 24 באר - בתוך צינור חרוטי 15 מ"ל וצנטריפוגה ב 120 x גרם במשך 4 דקות.
- תאי השהיה מחדש בתרבית מדיה-2 מ"ל עבור באר של צלחת 6 בארות ו-500 מיקרוליטר עבור באר של צלחת 24 בארות בתוספת מעכב ROCK של 10 מיקרומטר וצלחת אותם על לוחות מצופים מטריצה טרייה במפגש של 40%.
2. הבחנה של iPSC לתוך MSCs
- הכן אמצעי התמיינות MSC על ידי הוספת 15% סרום בקר עוברי (FBS) ו- 1% P/S ל- DMEM + פירובט עם גלוקוז נמוך ואחסן ב- 4 ° C.
- עם ההגעה למפגש של 80%, יש להשתמש בתאי גזע פלוריפוטנטיים מושרים ליצירת גוף עוברי (EB) בהתאם לשלבים המפורטים להלן.
- לשטוף את התאים עם DPBS ולדגור אותם עם מדיום דיסוציאציה / EDTA-500 μL עבור באר של צלחת 6 בארות, 250 μL עבור באר של צלחת 24 באר.
- לדגור ב 37 ° C במשך 1 דקות, לשאוף את מגיב דיסוציאציה ולשמור את התאים ב 37 ° C למשך 1 דקות נוספות. כדי להתחיל התמיינות MSC, ~ 10-12 x 106 תאים נדרשים.
- לאסוף את התאים בצינור חרוטי 15 מ"ל באמצעות מדיה תרבית. הקפידו להיות עדינים מאוד בזמן האיסוף כדי למנוע מהתאים להיות בודדים ולאפשר היווצרות EB. צנטריפוגה את התאים ב 120 x גרם במשך 4 דקות.
- השהה מחדש את התאים ב- 3 מ"ל של מדיית התמיינות MSC המכילה מעכב ROCK של 10 מיקרומטר.
- מערבבים ומפיצים 0.5 מ"ל/באר בצלחת חיבור אולטרה-נמוכה של 24 בארות.
הערה: שימוש בלוח חיבור נמוך במיוחד יעודד צבירת תאים לתוך EBs במקום החיבור שלהם על פני השטח. - מניחים את הצלחת באינקובטור ב 37 מעלות צלזיוס.
- לאחר 24 שעות, לגרום EBs שהושגו עם טיפול חומצה רטינואית גבוהה (RA) על ידי ביצוע השלבים המפורטים להלן.
- הוסף 10 μM RA ל- 3 מ"ל של מדיית בידול MSC. אספו EBs בצינור של 15 מ"ל ואפשרו להם להתיישב למשך 15 דקות.
- הסר את supernatant מ EBs ולהוסיף מדיה בידול MSC בתוספת 10 μM RA.
- יש להשהות בעדינות ולפזר 0.5 מ"ל/באר באותה פלטת חיבור נמוכה במיוחד עם 24 בארות.
- מניחים את הצלחת באינקובטור ב 37 מעלות צלזיוס. אל תפריעו ל-EBs במשך 48 השעות הבאות.
- לאחר 48 שעות, לאסוף EBs בצינור 15 מ"ל ולאפשר להם להתיישב במשך 15 דקות.
- הסר את supernatant מ EBs ולהוסיף מדיה בידול MSC בתוספת 0.1 μM RA.
- יש להשהות בעדינות ולפזר 0.5 מ"ל/באר באותה פלטת חיבור נמוכה במיוחד עם 24 בארות.
- מניחים את הצלחת באינקובטור ב 37 מעלות צלזיוס. אל תפריעו ל-EBs במשך 48 השעות הבאות.
- הסר את RA שנוסף לתאים על-ידי ביצוע השלבים המתוארים להלן.
- לאחר 48 שעות של טיפול RA האחרון, לאסוף את EBs ולאפשר להם להתיישב במשך 15 דקות.
- הסר את supernatant ולהוסיף DMEM גלוקוז נמוך מדיה ללא ציטוקינים.
- יש להשהות בעדינות ולפזר 0.5 מ"ל/באר בצלחת חיבור נמוכה במיוחד בעלת 24 בארות. מניחים את הצלחת באינקובטור ב 37 מעלות צלזיוס.
- צלחות את ה- EBs הנגזרים מ- iPSCs על-ידי ביצוע השלבים המפורטים להלן.
- לאחר 48 שעות מהשלב הקודם (שלב 2.4), לאסוף את EBs בצינור 15 מ"ל ולאפשר להם להתיישב במשך 15 דקות.
- הסר supernatant והשהה מחדש ב- 2 מ"ל של מדיית בידול MSC טרייה.
- מעבירים לשתי בארות של פלטת 6 בארות מצופה ממברנת מרתף.
- שנה את המדיה כל יומיים למשך 5 ימים נוספים.
- לאחר 5 ימים, הסר את המדיה המשומשת והחלף אותה במדיית התמיינות MSC טרייה המכילה 2.5 ננוגרם/מ"ל של גורם גדילה פיברובלסט בסיסי (bFGF).
- עברו את ה-EBs המצופים כאשר הם מגיעים למפגש של 80%-90%, על ידי ביצוע השלבים המפורטים להלן.
- לשטוף את התאים עם DPBS, להוסיף טריפסין-EDTA-500 μL עבור באר של צלחת 6 באר - ולדגור את התאים ב 37 ° C במשך 3 דקות.
- אסוף את התאים באמצעות מדיית התמיינות MSC בצינור חרוטי של 15 מ"ל וסובב ב 750 x גרם במשך 4 דקות.
- השהיה מחדש במדיית התמיינות MSC עם 2.5 ng/mL של bFGF ולוחית את התאים על לוחות ממברנת מרתף מצופים מטריצה ביחס של 1:3.
- חזור על המעבר כאשר התאים מגיעים למפגש של 70%-80%. הוא צפוי לצבור 3-6 מיליון תאים על ידי 2-3 מעברים.
3. ניתוח ציטומטריית זרימה של MSCs שמקורם ב- iPSCs
הערה: לאחר שעוברים 2-3 מעברים, יש לגשת לתאים ליעילות התמיינות MSC. התמיינות תיחשב מוצלחת אם התאים מבטאים סמני התמיינות MSC - CD44, CD73, CD90 ו- CD105 ביעילות של יותר מ -90%, ואינם מבטאים רמות גבוהות של סמנים המטופויטיים - CD14, CD19, CD34 ו- CD45. ניתן לגשת ליעילות של סמנים אלה על ידי ביצוע השלבים הבאים.
- עברו את התאים באמצעות השלבים המתוארים לעיל (שלב 2.6) והשיגו 1 x 105 תאים בבאר אחת של לוח V תחתון 96 בארות.
- צנטריפוגה את הצלחת ב 375 x גרם במשך 4 דקות ב 4 ° C.
- יש להשהות מחדש 1 x 105 תאים ב-100 מיקרוליטר של DPBS קר עם 1 μL של נוגדן מצומד (Ab) (ראה טבלת חומרים) ולדגור ב-4°C למשך 30-40 דקות תוך מניעת חשיפה לאור.
- להשהות עוד 1 x 105 תאים ב 100 μL של DPBS קר עם בקרת איזוטיפ בהתאמה של Ab מצומד בריכוז של 1:100 ) ולדגור ב 4 ° C במשך 30-40 דקות מניעת חשיפה לאור.
- לאחר הדגירה, צנטריפוגה את הצלחת ב 375 x גרם במשך 4 דקות ב 4 ° C. השליכו את הסופרנאטנט על ידי ניעור הצלחת מעל הכיור.
- להשעות מחדש את התאים ב 100 μL של DPBS קר.
- צנטריפוגה את התאים ב 375 x גרם במשך 4 דקות ב 4 ° C. השליכו את הסופרנטנט.
- להשהות מחדש את התאים ב 200 μL של DPBS קר ולאסוף צינורות מיקרוצנטריפוגות חשוכים וקרים 1.5 מ"ל ולשמור אותם על קרח עד לניתוח על ידי מיון תאים מופעל פלואורסצנטי (FACS).
- עבור ניתוח FACS, התפזר את התאים באמצעות פיזור צדדי (SSC-A) לעומת פיזור קדימה (FSC-A) כדי לא לכלול את הפסולת. יתר על כן, פזרו את התאים המגודרים באמצעות גובה מפוזר קדימה (FSC-H) לעומת שטח מפוזר קדימה (FSC-A) כדי להבחין בין סינגלים לכפילים מאוכלוסיית התאים החיים.
הערה: התאים היו מגודרים ביחס לשינוי בקרת האיזוטיפ עבור כל סמן, ומינימום של 10,000 אירועים מגודרים מכל דגימה מוכתמת שימשו לניתוח.
4. הבחנה של MSCs לתוך אדיפוציטים
- הכינו את חומרי העזר הבסיסיים להתמיינות אדיפוציט על ידי הוספת 10% תחליף סרום נוקאאוט (KOSR), 1% גלוטמין, 1% P/S, 4.5 ננוגרם/מיקרוליטר גלוקוז למדיה חיונית מינימלית (MEM)-אלפא ואחסנו בטמפרטורה של 4°C.
- אפשר ל-MSCs להגיע למפגש של מעל 90%. המשיכו לגדל אותם במשך 48 שעות נוספות כדי לאפשר להם לעבור תקופה של עצירת גדילה.
- הכן אמצעי התמיינות אדיפוציט מלא על ידי הוספת 100 מיקרוגרם/מ"ל של 3-איזובוטיל-1-מתיל-קסנטין (IBMX), 1 מיקרומטר של דקסמתזון, 0.2 U/מ"ל אינסולין, 100 מיקרומטר של אינדומתצין ו-10 מיקרומטר של רוזיגליטזון למדיה הבסיסית.
- הסר מדיית התמיינות של MSC ושטוף את התאים באמצעות DPBS.
- הוסף אמצעי התמיינות אדיפוציט מלא - 2 מ"ל לבאר של צלחת 6 בארות ו -1 מ"ל לבאר של צלחת 12 בארות - ודגר על התאים ב -37 מעלות צלזיוס. שנה את מדיית הבידול המלאה כל יומיים למשך 14 יום.
5. הערכת יעילות ההבחנה של אדיפוציטים
- ביום ה-14 להתמיינות, בדקו את יעילות ההתמיינות על ידי צביעת תאים לסמני הבשלת אדיפוציטים, FABP4 ואדיפונקטין.
- הסר את המדיה ושטוף את התאים עם DPBS.
- תקן את התאים באמצעות 4% paraformaldehyde (PFA) - 200 μL לבאר של צלחת 24 באר - ודגור בטמפרטורת החדר במשך 15 דקות.
- יש להשליך את ה-PFA ולשטוף באמצעות מלח חוצץ בתריס עם 0.5% טווין (TBST) ולהניח אותו על שייקר בטמפרטורת החדר למשך 15 דקות. חזור על התהליך פעמיים.
- חדרו את התאים הקבועים במי מלח חוצצי פוספט עם 0.5% Triton X-100 (PBST) והניחו אותו על שייקר בטמפרטורת החדר למשך 15-20 דקות.
- יש להשליך את ה-PBST ולהוסיף את המאגר החוסם (אלבומין בסרום בקר 5%-6% (BSA) ב-PBST) - 500 מיקרוליטר לבאר של צלחת בעלת 6 בארות ו-250 מיקרוליטר לבאר של צלחת בת 12 בארות - ולדגור בטמפרטורת החדר על השייקר למשך 40-60 דקות.
- לדלל את הנוגדנים הראשוניים נגד FABP4, אדיפונקטין ב 2%-3% BSA, בריכוז של 1:500 (ראה טבלת חומרים). הוסיפו את הנוגדנים הללו יחד רק אם גדלו בבעלי חיים שונים והניחו את הצלחת על השייקר בטמפרטורה של 4 מעלות צלזיוס, למשך הלילה.
- הסירו את הנוגדנים הראשוניים ושטפו את התאים שלוש פעמים עם TBST (15 דקות כל אחד) והניחו אותם על שייקר בטמפרטורת החדר.
- הכן נוגדנים משניים של Alexa Fluor ב- PBST (1:500). דוגרים על התאים בשילובי הנוגדנים המשניים (לפי המינים שבהם מגדלים את הנוגדן הראשוני) במשך 60 דקות בטמפרטורת החדר ומכסים את הצלחת ברדיד אלומיניום כדי להגן עליה מפני אור.
- השליכו את הנוגדנים המשניים, שטפו עם TBST שלוש פעמים והניחו את הצלחת על השייקר.
- כדי להכתים את הגרעינים, יש להוסיף 1 מיקרוגרם/מ"ל של Hoechst 33342-200 μL לבאר של צלחת 24 בארות מדוללת ב-PBS ולדגור במשך 5 דקות בטמפרטורת החדר.
- השליכו את תמיסת Hoechst והוסיפו PBS-500 μL לבאר של צלחת 24 בארות לתאים. שמור על הלוחות מכוסים מאור עד להדמיה באמצעות מיקרוסקופ פלואורסצנטי הפוך.
6. מיון אדיפוציטים באמצעות אדום הנילוס
- הכן פתרון עבודה אדום נילוס על ידי הוספת 1 מ"ג / מ"ל תמיסת מלאי אדום הנילוס ב DMSO ולאחסן ב -20 ° C. ממש לפני השימוש, יש להפשיר את הזן האדום של הנילוס וליצור אותו מחדש ב-DPBS כדי להגיע לריכוז תמיסת עבודה של 300 ננומטר.
- ביום ה-14 של התמיינות האדיפוציט או אחריו, יש להשליך את המדיה מהתאים ולשטוף באמצעות DPBS.
- מוסיפים את תמיסת העבודה האדומה של הנילוס -1 מ"ל בבאר של צלחת 6 בארות - ודגרים ב 37 מעלות צלזיוס למשך 15 דקות.
- מוציאים את התמיסה האדומה מהנילוס ומוסיפים טריפסין-EDTA -500 μL לבאר של צלחת בעלת 6 בארות ודגרים בטמפרטורה של 37°C למשך 4 דקות.
- אסוף את התאים באמצעות DMEM המכיל 5% FBS בצינור חרוטי של 15 מ"ל. צנטריפוגה ב 750 x גרם במשך 4 דקות.
- הסר את supernatant ו resuspend ב DPBS-1 מ"ל עבור 1 x 106 תאים. צנטריפוגה ב 750 x גרם במשך 4 דקות.
- הסר את supernatant ו resuspend ב DPBS-1 מ"ל עבור 1 x 106 תאים. השתמש בממיין FACS כדי לבודד את התאים האדומים האדומים של הנילוס באמצעות ערוץ FL1.
- תרבית מחדש את התאים הממוינים באמצעי התמיינות אדיפוציטים או לאסוף את התאים הממוינים לבידוד RNA וחלבונים.
- לחלץ RNA מהתאים הממוינים ולבצע ניתוח כמותי יחסי של סמני התמיינות אדיפוציטים, כולל FABP4, PPARG ו - C/EBPA. התאים האדומים-חיוביים של הנילוס מראים עלייה משמעותית בביטוי הגנים של לפחות שני קפלים בהשוואה לתאים לא ממוינים.
תוצאות
סכמות ומורפולוגיה של תאים במהלך התמיינות מזנכימלית: התמיינות של תאי גזע פלוריפוטנטיים מושרים לתאי MSC כרוכה בשלבי התפתחות שונים המשתרעים על פני היווצרות EB, התמיינות MSC והתרחבות MSC (איור 1). במהלך שלבי התפתחות אלה, תאים רוכשים מורפולוגיה שונה בשל כימיקלים מעוררים שונים שהם חשופים להם. עם תחילת ההתמיינות, התאים מצופים בתרחיף וצפויים להיות עגולים, עם גבולות תא מוגדרים, בעוד שקוטרם קטן עד בינוני (איור 2). בחירת תאי הרבייה בתרחיף בשלב הראשוני של ההתמיינות מאפשרת לו להידמות מאוד לתהליך ההתפתחות העוברית הטבעית, מה שהופך שלב זה לחיוני ביותר להתמיינות מוצלחת. השלב של היווצרות EB וטיפול RA מלווה בציפוי EBs על לוחות מטריצת ממברנות מרתף. ניתן לגשת לכדאיות של EBs לאחר ציפוי על-ידי התבוננות בהתנהגות ההתפשטות המהירה שלהם, מה שמוליד יותר MSCs (איור 2). התנהגות ההתרבות המהירה הזו שמפגינים MSCs נשמרת אפילו לאחר העברתם ללוחות מצופים מטריצה טרייה יחד עם שמירה על מורפולוגיה מוארכת ומשונה (איור 2).
הערכה כמותית של סמני פני השטח של MSC: יעילות הדיפרנציאציה של MSC נגישה על ידי כימות של סמני שטח ספציפיים להתמיינות MSC. התמיינות טובה המייצרת MSCs אמינים צריכה להראות יעילות של יותר מ-90% של סמני משטח מזנכימליים CD73, CD44 ו-CD90 (איור 3A). בנוסף לכך, תאים מוערכים גם בהיעדר סמנים על פני השטח המתארים פנוטיפ המטופוייטי, CD14, CD34 ו-CD19, ולכן צפוי להראות פחות מ-1% יעילות ביטוי עבורם (איור 3B).
התמיינות של MSCs לאדיפוציטים: ניתן לגשת להתמיינות של MSCs לאדיפוציטים על ידי צביעה עבור FABP4 ואדיפונקטין. FABP4 הוא חלבון ציטופלזמי, והוא נחשב סמן לאדיפוציטים ממוינים סופניים. הביטוי הגבוה שלו בקרב אדיפוציטים, עם התפלגות ציטופלזמית, הוא סימן מפתח לבשלות ההתפתחותית שלהם (איור 4A). בנוסף ל- FABP4, אדיפונקטין נחשב לאחד הסמנים החשובים לבשלות אדיפוציטים. הביטוי הגבוה שלו מצביע על כך שהאדיפוציטים מתפקדים מספיק כדי לעבור אחסון שומנים ואדיפוגנזה בתגובה לאיתות גלוקוז. בהיותו חלבון מפריש, אדיפונקטין מציג מורפולוגיה כדורית כאשר כל כדורית חלבון ניתנת להבחנה בקלות בתוך הציטופלסמה (איור 4B).
צביעה ומיון של אדיפוציטים בוגרים באמצעות אדום הנילוס: עם ההבחנה, ניתן להבחין בין אדיפוציטים בוגרים לבין עמיתיהם הלא בוגרים על ידי צביעה לאדום הנילוס. אדום הנילוס נקשר לאדיפוציטים נושאי שומנים, מאפיין בלעדי לאדיפוציטים בוגרים (איור 5A). זה, יחד עם הנושא הפלואורסצנטי האופייני לאדום הנילוס, הופך אותו לכלי יעיל למיון אדיפוציטים בוגרים באמצעות ציטומטריית זרימה מופעלת פלואורסצנטית (איור 5B). מיון יעיל אמור להביא לשיפור סמני ההתבגרות - PPARG, C/EBPA ו- FABP4 - בשני קפלים לפחות, הנקבעים על-ידי PCR כמותי בזמן אמת (qRT-PCR) (איור5C).

איור 1: דיאגרמה סכמטית שמראה את ההתמיינות של iPSCs ל-MSCs ולאדיפוציטים. iPSCs מתמיינים ל-MSCs באמצעות טכניקת הגוף העוברי (EB). ה- EBs חשופים לחשיפה קצרה של 10 מיקרומטר של חומצה רטינואית all-trans (RA). MSCs שנוצרו מתמיינים ל 40%-77% אדיפוציטים בהתבסס על קו iPSC. התאים החיוביים האדומים של הנילוס ממוינים באמצעות FACS כדי להשיג אוכלוסייה מטוהרת של אדיפוציטים בוגרים שניתן להשתמש בהם לחקר הפרעות הקשורות לאדיפוציטים (מידול מחלות), זיהוי תרופות חדשות, ובסופו של דבר לטיפול מותאם אישית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
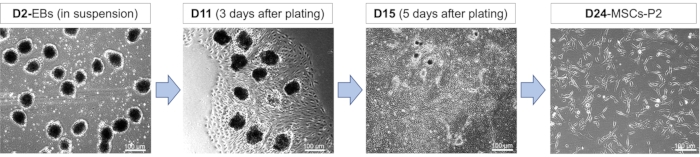
איור 2: התמיינות של תאי גזע פלוריפוטנטיים מושרים לתאי MSC. תמונות מורפולוגיות מייצגות המציגות שלבים שונים של התמיינות MSC בימים 2 (D2), 11 (D11), 15 (D15) ו-24 (D24). גופים עובריים (EBs) שנוצרו בנוכחות 10 מיקרומטר של RA במשך 24 שעות היו מצופים ביום 8 של התמיינות, ואחריו דיסוציאציה ומעבר לאחר 12-17 ימים של התמיינות. ה-MSCs עברו מספר פעמים. קיצורים: P2 = קטע 2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: ביטוי של סמני MSC וסמנים המטופויטיים ב-MSC שמקורו ב-iPSC. היסטוגרמות ציטומטריה של זרימה מייצגת המציגות את הביטוי של סמני MSC, CD73, CD44 ו- CD90, (A) והסמנים ההמטופויטיים, CD34, CD19 ו- CD14 (B) ב- MSCs המופקים מ- EBs שמקורם ב- iPSC שטופלו ב- 10 מיקרומטר של RA. ציר ה-X בגרף מייצג את העוצמה הפלואורסצנטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
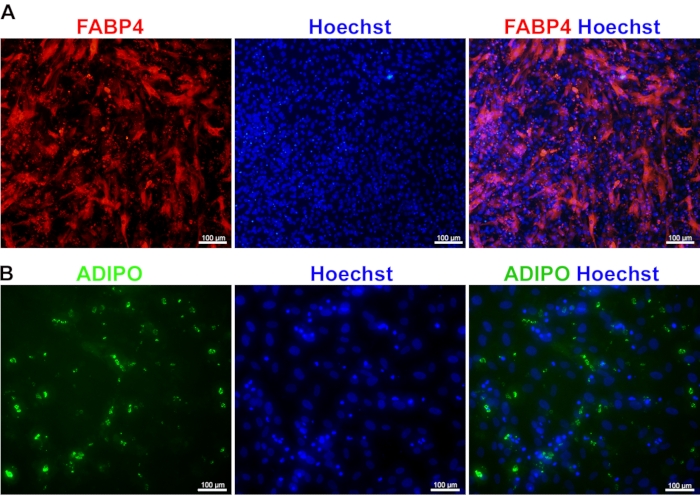
איור 4: התמיינות של MSCs שמקורם ב-iPSC לאדיפוציטים. תמונות של צביעת מערכת החיסון המציגות את הביטוי של FABP4 (A) ואדיפונקטין (ADIPO) (B) באדיפוציטים בוגרים שמקורם בתאי גזע פלוריפוטנטיים מושרים (iPSC). הגרעינים היו מוכתמים בהוכסט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: מיון של אדיפוציטים שמקורם ב-iPSC באמצעות אדום הנילוס. (A) תמונות המציגות שדה בהיר (BF) ואדיפוציטים בוגרים מוכתמים באדום הנילוס. (B) כימות של אדום הנילוס (תאים חיוביים ל-PE) באדיפוציטים בוגרים באמצעות FACS. (C) ניתוח PCR בזמן אמת המראה את הביטוי של C/EBPA, FABP4 ו-PPARG באדיפוציטים בוגרים ממוינים לעומת לא ממוינים. הנתונים מיוצגים כממוצע ± SD; *p < 0.05, **p < 0.01, ***p < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה הוא בעל חשיבות עליונה בשל יכולתו לספק MSCs בתפוקה גבוהה וביעילות. ייצור בקנה מידה המוני זה של MSCs התאפשר על ידי דגירה ארעית של EBs הנגזרים מ- iPSCs עם 10 מיקרומטר של RA14,15. טיפול חולף עם 10 מיקרומטר של RA שיפר את תפוקת MSC פי 11.2 עד 1542 פי14,15, כאשר פרוטוקול זה ישים הן על iPSCs והן על hPSCs. במינון ובמשך הטיפול הזה, RA משפר את יכולות ההתרבות וההישרדות של תאים יוצרי EB על ידי ויסות ישיר או עקיף של ביטוי של מספר גנים המעורבים בהתרבות תאים, אפופטוזיס והידבקויות תאי תאים ותאי ECM, שהם קריטיים להישרדות ולשגשוג של iPSCs14,16. הגנים כוללים, אך אינם מוגבלים לגורמי שעתוק (כגון EGFR4, SOX4), גורמי גדילה וקולטני גורמי גדילה (כגון IGF2, FGFR4), ומולקולות הידבקות (כגון FN1 ו- CAM). עם זאת, בניגוד למינונים נמוכים (0.1-10 מיקרומטר), במינונים גבוהים (≥20 מיקרומטר), RA מווסת באופן שלילי את ההתרבות וההישרדות של תאים יוצרי EB וכתוצאה מכך מספר וגודל EB הנגזרים מ-PSC ובכך תפוקה מופחתת של MSCs14. RA נחשב כמעכב התפשטות במספר תאים ממוינים וסרטניים נורמליים17,18,19. ב- EBs, איתות רטינואידי תלוי הקשר (זמן, ריכוז, מינים וקו תאים); השפעה דיפרנציאלית על התחדשות עצמית, הישרדות והתמיינות של תאים יוצרי EB על ידי ויסות גנים נפרדים ומסלולי איתות20,21. לכן, השימוש ב- RA בזמן ובריכוז אופטימליים של RA-10 מיקרומטר ביום השלישי של השראת EB ואחריו הפחתת מינון ל -0.1 מיקרומטר ביום 5 למשך יומיים כמתואר בפרוטוקול הנוכחי - הוא חיוני להשראת הישרדות ושגשוג תאים יוצרי EB.
בנוסף להסדרת גדילה והישרדות, RA אכן מכפיף את ה- EBs המטופלים לעיכוב התמיינות בהשוואה לתאים שאינם מטופלים ב- RA14. למעשה, EBs שטופלו ב-RA שומרים על צורתם הקומפקטית לאחר הציפוי ואינם מצליחים להתמיין לתאים דמויי MSC, בניגוד ל-EBs שאינם מטופלים ב-RA. זה עולה בקנה אחד עם מחקרים קודמים שדיווחו כי חשיפה לטווח קצר לטיפול RA מעכבת התמיינות תאים באמצעות דיכוי של איתות WNT21. יתר על כן, תאים מעוכבי התמיינות אלה שטופלו ב- RA הראו גם ביטוי משופר של קדהרין וחלבוני מטריצה חוץ-תאיים14, אשר ידועים כממלאים תפקיד חשוב בשמירה על המצב הפלוריפוטנטי של iPSCs16. כדי לשחרר את בלוק ההתמיינות בתיווך RA, EBs צריכים להיות מנותקים, מה שגורם לשיבוש הידבקויות התאים ומאפשר התמיינות MSC לטווח ארוך עם הציפוי. באופן מעניין, טיפול RA אכן החזיק בלוק התמיינות על פני תאים, אך הוא לא שמר על התאים במצב פלוריפוטנטי. למעשה, התאים יוצרי EB שעברו חשיפה קצרת טווח ל- 10 μM RA מראים ביטוי מופחת באופן משמעותי של סמני פלוריפוטנציה מרכזיים - OCT4, SOX2 ו- NANOG14.
MSCs שנוצרו על ידי טיפול קצר טווח RA של EBs הוכחו לשמור על המורפולוגיה דמוית הפיברובלסט האופיינית שלהם עם ביטוי שופע של סמני פני השטח של MSC ואת הרב-עוצמה שלהם לאחר שימור בהקפאה, ובכך להפוך MSCs אלה המיוצרים בייצור המוני לאחסון עבור מחקרי הרחבה לטווח ארוך14. כאשר הם נחשפים לתנאי התמיינות אדיפוגניים, כונדרוגנים ואוסטאוגניים, MSCs אלה יכולים להתמיין בקלות לשלושת סוגי התאים המזודרמליים ובכך להפוך אותם למקור קל להשגה למידול מחלות הקשורות לרקמות14. לפיכך, ההתנהגות היציבה והמגוונת במבחנה של MSCs הנוצרת על ידי פרוטוקול הבידול בתיווך RA מעניקה להם חשיבות עליונה במחקר ובהגדרות מבוססות יישומים.
בעוד שפוטנציאלי ההתמיינות הכונדרוגנים והאוסטאוגניים של MSCs המתקבלים מ- EBs שטופלו ב- RA נראים דומים לאלה של MSCs שהתקבלו מ- EBs לא מטופלים, הראשון נמצא כמציג פוטנציאל מוגבר להתמיין לשושלת אדיפוגנית כאשר הוא נתון לתנאי התמיינות אדיפוגניים14. עדות לכך הייתה עלייה של פי 2 עד פי 3 בהצטברות שומנים תוך-תאיים (צביעת שמן אדום O) ובתאים חיוביים לסמן אדיפוציט FABP4 במאגר ההתמיינות של תאים שהתקבלו לאחר תרבית MSCs שמקורם ב- EBs שטופלו ב- RA עם אמצעי התמיינות אדיפוגניים, בהשוואה ל- MSCs שמקורם ב- EBs שלא טופלו ב- RA. זו יכולה להיות תוצאה של ויסות, על ידי RA, של מספר מסלולי איתות השולטים בהתפתחות אדיפוציטים כגון היפו, WNT ומסלולי אינטראקציה בין תאי ECM, כפי שנחשף על ידי נתוני ריצוף RNA מ- EBs 14,22,23,24,25 שטופלו ב- RA ולא טופלו. יכולת משופרת זו של MSCs שמקורם ב- RA לעבור התמיינות אדיפוגנית היא בעלת ערך, מכיוון שהפרוטוקולים הזמינים כיום מובילים לתפוקת אדיפוציט ירודה או עושים שימוש במניפולציה גנטית מה שהופך את האדיפוציטים שנוצרו ליקרי ערך להפקת אדיפוציטים משוחזרים בתהליך טבעי. אדיפוציטים מסווגים לשלושה סוגים - לבן, חום ובז '. אדיפוציטים לבנים מסווגים על ידי נוכחות של טיפת שומנים אחת וממלאים תפקיד באחסון אנרגיה. והואיל ואדיפוציטים חומים מעורבים בהוצאת אנרגיה על ידי חמצון המצע בשל השפע הגבוה מאוד של מיטוכונדריה המאופיין בביטוי של UCP1. ואילו האדיפוציטים החומים הנמצאים ממוקמים ברקמת השומן הלבנה ידועים כאדיפוציטים בצבע בז' או חום. MSC אלה יש פוטנציאל לתת תשואה שופעת של אדיפוציטים לבנים בהתחשב טרום חשיפה של EBs RA. פרסומים קודמים הצהירו על השראות סלקטיביות של iPSC לתאים המבטאים UCP1 נמוך, כלומר אדיפוציטים לבנים, במקום לחשוף תאים עם רמות UCP1 גבוהות ל- RA26. פרסומים קודמים דיווחו כי RA המופק מתאי פסגה עצבית בעוברי עכברים ודגי זברה ממלא תפקיד חשוב בהיווצרות אדיפוציט לבן27,28.
למרות שהפרוטוקול מבוסס RA איפשר ייצור של MSCs המספקים תפוקה מוגברת של אדיפוציטים המגיעה ל -48.5%-77.4% (לעומת 22.5%-57.6% ללא טיפול RA), אי השגת >90% עדיין בעייתית בעת מידול הפרעות גנטיות מבוססות אדיפוציט רב וריאנטים in vitro. למעשה, אי הגעה לאוכלוסיית אדיפוציטים טהורה עלולה להפוך את התוצאות המגיעות ממודלים של מחלות רב-וריאנטיות לאמביוולנטיות, שכן יהיה קשה להבחין אם ההבדלים ההתפתחותיים שנצפו נובעים מההרכב הגנטי השונה או מיעילות התמיינות לא עקבית. כדי לעקוף בעיה זו, היה חשוב למיין את התאים המתמיינים כדי לקבל מאגר של אדיפוציטים בוגרים טהורים, כך שכל הבדל בפנוטיפים ניתן יהיה לייחס רק להבדלים גנטיים אינהרנטיים. מספר מחקרים זיהו סמני שטח על אדיפוציטים שעשויים לשמש למיון. לדוגמה, עבודה שבוצעה על ידי רונלד קאהן אפשרה לזהות את טרנספורטר חומצות האמינו ASC-1 כסמן פני שטח חדש על אדיפוציטים לבנים29. בנוסף, מחקרים שחילצו אדיפוציטים בוגרים מאזורים אומנטליים ותת עוריים דיווחו על אדיפוציטים בוגרים המבטאים CD34, CD36 ו- CD59 על פני השטח שלהם30שם דווח כי CD36 מתפקד כמוביל חומצות שומן על פני השטח של אדיפוציטים בוגרים.,31. עם זאת, מחקרים אלה עשו שימוש באוכלוסיות הטרוגניות של תאים שמקורם ברקמת השומן מבלי לציין את הביטוי של סמנים אלה לאוכלוסיות אדיפוציט בוגרות בלבד. יתר על כן, סמנים אלה יכולים לבוא לידי ביטוי גם על ידי סוגי תאים אחרים ואינם ספציפיים לאדיפוציטים. לדוגמה, ASC-1 קיים גם על אסטרוציטים וגם על תאי עצב32CD34 הוא סמן של תאי גזע המטופויטיים.,33CD36 קיים על טסיות דם, פגוציטים חד-גרעיניים, הפטוציטים, מיוציטים וכמה אפיתליות.,33ו- CD59 מבוטא על תאי אנדותל ולימפה.,34,35. לכן, כפתרון חלופי, אדום הנילוס, הכתם הפלואורסצנטי הסלקטיבי לשומנים תוך תאיים, שימש כמועמד אפשרי למיון אדיפוציטים. אדיפוציטים מאחסנים כמות משמעותית של שומנים שניתן לשחרר ולהשתמש בהם לייצור אנרגיה, לבניית ממברנות או כמולקולות איתות המווסתות את חילוף החומרים36. צבע אדום הנילוס שימש בעבר בציטומטריית זרימה ובמיקרוסקופ כדי להכתים אדיפוציטים שמקורם במורין ובתאי MSC אנושיים37. מחקרים קודמים דיווחו על שימוש באדום הנילוס עבור אדיפוציטים שמקורם ב-ESC ושיפור סמני האדיפוציט לאחר מיון38. האדיפוציטים שנוצרו מ- MSCs שהתקבלו על ידי הפרוטוקול הנוכחי מבוסס RA הוערכו ביכולתם להיות מוכתמים באדום הנילוס, המציין את בשלותם, ומוינו כדי לטהר אותם. תאים אלה ממוינים באדום הנילוס הציגו עלייה של פי שניים עד שלושה בביטוי סמני ההבשלה של האדיפוציטים, כולל PPARG, C/EBPAו FABP4 בהשוואה לתאים לא ממוינים, ובכך להגדיל עוד יותר את התפוקה של אדיפוציטים שמקורם ב- iPSCs. למרות שסמנים אלה באים לידי ביטוי לפני הצטברות שומנים, הביטוי שלהם מתייג תא להתמיינות טרמינלית לאדיפוציטים נושאי שומנים. בדיקת יעילות המיון על ידי סמנים אלה מאפשרת לנו לזהות מאגר שבו כל התאים באים לידי ביטוי FABP4, CEBPaו PPARgהמציין בריכה, שיועדה מראש להיווצרות אדיפוציט בוגר., התאים ממוינים על פי פוטנציאל הצביעה שלהם לאדום הנילוס. יעילות הטיהור גדלה פי שניים עד שלושה בשל המספר הגבוה של אדיפוציטים בחלק הלא ממוין. גודלם של אדיפוציטים נושאי שומנים משתנה במידה רבה במהלך ההתמיינות, שבה מאגר של תאים עם התפלגות גודל זהה ממוינים. שבר לא ממוין כולל אדיפוציטים נושאי שומנים, אך הם אינם בשלים לחלוטין ונשלטים על ידי פרופורציות גודל שונות.
ההטרוגניות של MSCs מבודדים מגוף האדם דווחה בעבר39. הטרוגניות זו תלויה במספר גורמים, כגון מוצא MSC, תורמים ותנאים39. זה עלול להוביל לשינויים ביעילותם בטיפול במחלות שונות. מחקר זה מציע כי טיפול קצר ב- RA של hPSCs המיוצרים בתנאי תרבות תואמי תנאי ייצור נאותים (GMP) ייתן אוכלוסייה הומוגנית של MSCs. זה מצביע על כך שהפרוטוקול הנוכחי הוא גישה מבטיחה ליצירת מספר רב של MSCs ברמה קלינית שניתן להשתמש בהם לטיפול מבוסס MSC.
השילוב של פרוטוקול התמיינות MSC מבוסס RA המוביל להתמיינות אדיפוציט ופרוטוקול מיון אדום הנילוס איפשר לנו להשיג אדיפוציטים שמקורם ב- iPSCs עם ביטוי משופר של סמנים פונקציונליים ותשואה וטוהר משופרים. לפיכך, פרוטוקול משולב זה יאפשר ליצור, בכמות וטוהר מספיקים, של אדיפוציטים בוגרים מפרטים נבדלים גנטית ואת הפוטנציאל לחשוף וריאנטים גנטיים חדשים מאחורי הפרעות מטבוליות הקשורות לאדיפוציטים.
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
עבודה זו מומנה על ידי מענק מקרן המחקר הלאומית של קטאר (QNRF) (מענק מס' NPRP10-1221-160041). מרים אגאדי נתמכה על ידי מלגת GSRA מקרן המחקר הלאומית של קטאר (QNRF).
Materials
| Name | Company | Catalog Number | Comments |
| Adiponectin | Abcam | ab22554 | Adipocyte maturation marker |
| anti-CD105 | BD Pharmingen | 560839 | MSC differentiation marker |
| anti-CD14 | BD Pharmingen | 561712 | MSC differentiation marker |
| anti-CD19 | BD Pharmingen | 555415 | MSC differentiation marker |
| anti-CD34 | BD Pharmingen | 555824 | MSC differentiation marker |
| anti-CD44 | abcam | ab93758 | MSC differentiation marker |
| anti-CD45 | BD Pharmingen | 560975 | MSC differentiation marker |
| anti-CD73 | BD Pharmingen | 550256 | MSC differentiation marker |
| anti-CD90 | BD Pharmingen | 555596 | MSC differentiation marker |
| bFGF | R&D | 233-FP | MSC culture media supplement |
| C/EBPA | Abcam | ab40761 | Adipocyte maturation marker |
| Dexamethasone | Torics | 1126 | Adipocyte differentiation media supplement |
| FABP4 | Abcam | ab93945 | Adipocyte maturation marker |
| Fetal bovine serum | ThermoFisher | 10082147 | MSC culture media supplement |
| Glutamax | ThermoFisher | 35050-061 | MSC culture media supplement |
| IBMX | Sigma Aldrich | I5879 | Adipocyte differentiation media supplement |
| Indomethacin | Sigma Aldrich | I7378 | Adipocyte differentiation media supplement |
| Insulin | Sigma Aldrich | 91077C | Adipocyte differentiation media supplement |
| Knockout DMEM | ThermoFisher | 12660012 | Basal media for preparing matrigel |
| Low glucose DMEM | ThermoFisher | 11885084 | MSC culturing media |
| Matrigel | Corning | 354230 | Coating matrix |
| MEM-alpha | ThermoFisher | 12561056 | Adipocyte differentiation media |
| Nilered | Sigma Aldrich | 19123 | Sorting marker for adipocyte |
| Penicillin | ThermoFisher | 15140122 | MSC/Adipocyte media supplement |
| Phosphate-buffered saline | ThermoFisher | 14190144 | wash buffer |
| Pierce™ 20X TBS Buffer | Thermo Fisher | 28358 | wash buffer |
| PPARG | Cell Signaling Technology | 2443 | Adipocyte maturation marker |
| ReLeSR | Stem Cell Technologies | 5872 | Dissociation reagent |
| Retinoic acid | Sigma Aldrich | R2625 | MSC differentiation media supplement |
| Rock inhibitor | Tocris | 1254/10 | hPSC culture media supplement |
| Roziglitazone | Sigma Aldrich | R2408 | Adipocyte differentiation media supplement |
| StemFlex | ThermoFisher | A334901 | hPSC culture media |
| Triton | Thermo Fisher | 28314 | Permebealization reagent |
| Trypsin | ThermoFisher | 25200072 | Dissociation reagent |
| Tween 20 | Sigma Aldrich | P7942 | Wash buffer |
References
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Communication and Signaling: CCS. 9, 12(2011).
- Wagner, W., et al. Aging and replicative senescence have related effects on human stem and progenitor cells. PLoS One. 4 (6), 5846(2009).
- Brown, P. T., Squire, M. W., Li, W. J. Characterization and evaluation of mesenchymal stem cells derived from human embryonic stem cells and bone marrow. Cell and Tissue Research. 358 (1), 149-164 (2014).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Experimental Hematology. 36 (3), 350-359 (2008).
- Barberi, T., Willis, L. M., Socci, N. D., Studer, L. Derivation of multipotent mesenchymal precursors from human embryonic stem cells. PLoS Medicine. 2 (6), 161(2005).
- Xiong, C., et al. Derivation of adipocytes from human embryonic stem cells. Stem Cells and Development. 14 (6), 671-675 (2005).
- Cuaranta-Monroy, I., et al. Highly efficient differentiation of embryonic stem cells into adipocytes by ascorbic acid. Stem Cell Research. 13 (1), 88-97 (2014).
- van Harmelen, V., et al. Differential lipolytic regulation in human embryonic stem cell-derived adipocytes. Obesity (Silver Spring). 15 (4), 846-852 (2007).
- Noguchi, M., et al. In vitro characterization and engraftment of adipocytes derived from human induced pluripotent stem cells and embryonic stem cells. Stem Cells and Development. 22 (21), 2895-2905 (2013).
- Ahfeldt, T., et al. Programming human pluripotent stem cells into white and brown adipocytes. Nature Cell Biology. 14 (2), 209-219 (2012).
- Lee, Y. K., Cowan, C. A. Differentiation of white and brown adipocytes from human pluripotent stem cells. Methods in Enzymology. 538, 35-47 (2014).
- Abdelalim, E. M. Modeling different types of diabetes using human pluripotent stem cells. Cellular and Molecular Life Sciences: CMLS. 78 (6), 2459-2483 (2021).
- Abdelalim, E. M., Bonnefond, A., Bennaceur-Griscelli, A., Froguel, P. Pluripotent stem cells as a potential tool for disease modelling and cell therapy in diabetes. Stem Cell Reviews and Reports. 10 (3), 327-337 (2014).
- Karam, M., Younis, I., Elareer, N. R., Nasser, S., Abdelalim, E. M. Scalable Generation of mesenchymal stem cells and adipocytes from human pluripotent stem cells. Cells. 9 (3), (2020).
- Karam, M., Abdelalim, E. M. Robust and highly efficient protocol for differentiation of human pluripotent stem cells into mesenchymal stem cells. Methods in Molecular Biology. , Clifton, N.J. (2020).
- Li, L., Bennett, S. A., Wang, L. Role of E-cadherin and other cell adhesion molecules in survival and differentiation of human pluripotent stem cells. Cell Adhesion & Migration. 6 (1), 59-70 (2012).
- Lai, L., Bohnsack, B. L., Niederreither, K., Hirschi, K. K. Retinoic acid regulates endothelial cell proliferation during vasculogenesis. Development. 130 (26), 6465-6474 (2003).
- Chanchevalap, S., Nandan, M. O., Merlin, D., Yang, V. W. All-trans retinoic acid inhibits proliferation of intestinal epithelial cells by inhibiting expression of the gene encoding Kruppel-like factor 5. FEBS Letters. 578 (1-2), 99-105 (2004).
- di Masi, A., et al. Retinoic acid receptors: from molecular mechanisms to cancer therapy. Molecular Aspects of Medicine. 41, 1(2015).
- Simandi, Z., Balint, B. L., Poliska, S., Ruhl, R., Nagy, L. Activation of retinoic acid receptor signaling coordinates lineage commitment of spontaneously differentiating mouse embryonic stem cells in embryoid bodies. FEBS Letters. 584 (14), 3123-3130 (2010).
- De Angelis, M. T., Parrotta, E. I., Santamaria, G., Cuda, G. Short-term retinoic acid treatment sustains pluripotency and suppresses differentiation of human induced pluripotent stem cells. Cell Death & Disease. 9 (1), 6(2018).
- Li, L., Dong, L., Wang, Y., Zhang, X., Yan, J. Lats1/2-mediated alteration of hippo signaling pathway regulates the fate of bone marrow-derived mesenchymal stem cells. BioMed Research International. 2018, 4387932(2018).
- Moldes, M., et al. Peroxisome-proliferator-activated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis. The Biochemical Journal. 376, Pt 3 607-613 (2003).
- Ross, S. E., et al. Inhibition of adipogenesis by Wnt signaling. Science. 289 (5481), 950-953 (2000).
- Wang, Y. K., Chen, C. S. Cell adhesion and mechanical stimulation in the regulation of mesenchymal stem cell differentiation. Journal of Cellular and Molecular Medicine. 17 (7), 823-832 (2013).
- Mohsen-Kanson, T., et al. Differentiation of human induced pluripotent stem cells into brown and white adipocytes: role of Pax3. Stem Cells. 32 (6), 1459-1467 (2014).
- Billon, N., et al. The generation of adipocytes by the neural crest. Development. 134 (12), 2283-2292 (2007).
- Li, N., Kelsh, R. N., Croucher, P., Roehl, H. H. Regulation of neural crest cell fate by the retinoic acid and Pparg signalling pathways. Development. 137 (3), 389-394 (2010).
- Ussar, S., et al. ASC-1, PAT2, and P2RX5 are cell surface markers for white, beige, and brown adipocytes. Science Translational Medicine. 6 (247), (2014).
- Festy, F., et al. Surface protein expression between human adipose tissue-derived stromal cells and mature adipocytes. Histochemistry and Cell Biology. 124 (2), 113-121 (2005).
- Cai, L., Wang, Z., Ji, A., Meyer, J. M., vander Westhuyzen, D. R. Scavenger receptor CD36 expression contributes to adipose tissue inflammation and cell death in diet-induced obesity. PLoS One. 7 (5), 36785(2012).
- Mesuret, G., et al. A neuronal role of the Alanine-Serine-Cysteine-1 transporter (SLC7A10, Asc-1) for glycine inhibitory transmission and respiratory pattern. Scientific Reports. 8 (1), 8536(2018).
- Silverstein, R. L., Febbraio, M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior. Science Signaling. 2 (72), (2009).
- Brooimans, R. A., van Wieringen, P. A., van Es, L. A., Daha, M. R. Relative roles of decay-accelerating factor, membrane cofactor protein, and CD59 in the protection of human endothelial cells against complement-mediated lysis. European Journal of Immunology. 22 (12), 3135-3140 (1992).
- Davies, A., et al. CD59, an LY-6-like protein expressed in human lymphoid cells, regulates the action of the complement membrane attack complex on homologous cells. The Journal of Experimental Medicine. 170 (3), 637-654 (1989).
- Lapid, K., Graff, J. M. Form(ul)ation of adipocytes by lipids. Adipocyte. 6 (3), 176-186 (2017).
- Aldridge, A., et al. Assay validation for the assessment of adipogenesis of multipotential stromal cells--a direct comparison of four different methods. Cytotherapy. 15 (1), 89-101 (2013).
- Schaedlich, K., Knelangen, J. M., Navarrete Santos, A., Fischer, B., Navarrete Santos, A. A simple method to sort ESC-derived adipocytes. Cytometry A. 77 (10), 990-995 (2010).
- Costa, L. A., et al. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cellular and Molecular Life Sciences: CMLS. 78 (2), 447-467 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved