Method Article
Микрофлюидный акустофорез для сквозного разделения грамотрицательных бактерий с использованием аффинных шариков Аптамера
В этой статье
Резюме
В данной работе описывается изготовление и эксплуатация микрофлюидных акустофоретических чипов с использованием метода микрофлюидного акустофореза и модифицированных аптамерами микрошариков, которые могут быть использованы для быстрого и эффективного выделения грамотрицательных бактерий из среды.
Аннотация
В этой статье описывается изготовление и эксплуатация микрофлюидных акустофоретических чипов с использованием метода микрофлюидного акустофореза и модифицированных аптамерами микрошариков, которые могут быть использованы для быстрого и эффективного выделения грамотрицательных бактерий из среды. Этот метод повышает эффективность разделения с помощью смеси длинных квадратных микроканалов. В этой системе образец и буфер вводятся во входной порт через контроллер потока. Для центрирования шариков и разделения образцов питание переменного тока подается на пьезоэлектрический преобразователь через функциональный генератор с усилителем мощности для создания силы акустического излучения в микроканале. Существует раздвоенный канал как на входе, так и на выходе, что обеспечивает одновременное разделение, очистку и концентрацию. Устройство имеет скорость восстановления >98% и чистоту от 97,8% до 10-кратной концентрации дозы. Это исследование продемонстрировало скорость восстановления и чистоту выше, чем существующие методы разделения бактерий, предполагая, что устройство может эффективно разделять бактерии.
Введение
Разрабатываются микрофлюидные платформы для выделения бактерий из медицинских и экологических образцов, в дополнение к методам, основанным на диэлектрическом переносе, магнитофорезе, извлечении шариков, фильтрации, центробежной микрофлюидике и инерциальных эффектах, а также поверхностных акустическихволнах 1,2. Обнаружение патогенных бактерий продолжают с помощью полимеразной цепной реакции (ПЦР), но обычно она трудоемкая, сложная и трудоемкая 3,4. Системы микрофлюидного акустофореза являются альтернативой для решения этой проблемы за счет разумной пропускной способности и бесконтактной изоляции клеток 5,6,7. Акустофорез — это технология, которая отделяет или концентрирует шарики, используя явление движения материала через звуковую волну. Когда звуковые волны попадают в микроканал, они сортируются по размеру, плотности и т. д. шариков, а клетки могут быть разделены в соответствии с биохимическими и электрическими свойствами суспензионной среды 7,8. Соответственно, активно проводилось много акустофоретических исследований 9,10,11, а в последнее время было введено 3D-численное моделирование акустофоретического движения, индуцированного граничным акустическим потоком в микрофлюидике акустических волн стоячей поверхности12.
Исследования в различных областях изучают, как заменить антитела 2,3. Аптамер является целевым материалом, обладающим высокой селективностью и специфичностью, и многие исследования проводятся 2,9,10,13. Аптамеры имеют преимущества небольшого размера, отличной биологической стабильности, низкой стоимости и высокой воспроизводимости по сравнению с антителами и изучаются в диагностических и терапевтических приложениях 2,3,14.
Здесь в этой статье описывается протокол технологии микрофлюидного акустофореза, который может быть использован для быстрого и эффективного отделения грамотрицательных (GN) бактерий из среды с использованием модифицированных аптамерами микрошариков. Эта система генерирует двумерную (2D) акустическую стоячую волну через одиночное пьезоэлектрическое срабатывание путем одновременной стимуляции двух ортогональных резонансов в длинном прямоугольном микроканале для выравнивания и фокусировки прикрепленных к аптамеру микрошариков в узле и точках антиузла для эффективности разделения 2,11,15,16 . Существует раздвоенный канал как на входе, так и на выходе, что обеспечивает одновременное разделение, очистку и концентрацию.
Этот протокол может быть полезен в области ранней диагностики бактериальных инфекционных заболеваний, а также быстрого, селективного и чувствительного ответа на патогенные бактериальные инфекции посредством мониторинга воды в режиме реального времени.
протокол
1. Микрофлюидный дизайн чипа акустофореза
ПРИМЕЧАНИЕ: На фиг.1 показана схема разделения и сбора микрошариков-мишеней из микроканалов методом акустофореза. Микрофлюидный чип акустофореза разработан с помощью программы САПР.
- Разработайте микрофлюидный чип акустофореза, который использует смесь модифицированных аптамером бусин и полистирольных шариков со стрептавидиновым покрытием (PS), соответствующих размеру бактерий, для изучения производительности разделения устройства.
- Спроектируйте микрофлюидный чип акустофореза, который собирает ШАРИКИ PS на целевом выходе и отбрасывает остальное через выходное отверстие после введения смеси образца PS во входное отверстие образца (см. Рисунок 2 и Таблицу 1).
ПРИМЕЧАНИЕ: Для этой цели акустофлюидный чип состоит из двух входов для впрыска образцов и буфера, основного канала с прикрепленным пьезоэлектрическим преобразователем (PZT), позволяющего выровнять микрошарики по центру, и двух выходов, через которые собираются образцы и выбрасываются отходы (рисунок 3A). - Спроектируйте микрофлюидный чип акустофореза, в котором микрошарики, буфер, бактерии и аптамеры проходят через основной канал, причем микрогранулы выровнены по центру с помощью акустофореза в чипе, индуцированного PZT (рисунок 3B, C)
2. Изготовление микрофлюидного акустофореза
ПРИМЕЧАНИЕ: Соберите четыре слоя в следующем порядке: боросиликатный стекло-кремниевый слой, кремниевый слой, боросиликатный стеклянный слой и слой PZT, как показано на рисунке 3A, B.
- Подготовьте боросиликатное стекло (самый верхний слой) с отверстиями диаметром 2 мм с помощью пескоструйнойобработки 17 на входе и выходе для соединения трубок из полиэфирэфиркетона (PEEK). Боросиликатное стекло имеет размеры 20 × 80 × 0,5 мм3.
- Готовят слой кремниевого канала толщиной 200 мкм с микроканалом с площадью поперечного сечения 0,2 × 0,2мм2, сформированный с помощью фоторезиста и кремниевого рисунка, полученного методом глубокого реакционноспособного ионного травления (RIE)18. Просверлите отверстия диаметром 1 мм для входных каналов образца и буфера, а также каналов сбора и выпуска отходов во время реакционно-ионного травления.
ПРИМЕЧАНИЕ: Здесь ионное травление использует процесс RIE для формирования микроканалов. Фоторезист был нанесен в форме канала на кремниевую пластину для слоя кремниевого канала. Кремниевую пластину с PR-покрытием травили плазмой, генерируемой путем нанесения 13,56 МГц на фтор18. - Подготовьте стружку со слоями выше и ниже слоя кремния (20 × 80 × 0,5 мм3), приготовленными на стадии 2,2 (20 × 80 × 0,5 мм3), прикрепленной к боросиликатному стеклу на стадии 2.1 и третьему боросиликатному стеклянному слою с использованием анодирования при 1000 В и 400 °C19.
- Прикрепите PZT (20 × 40мм2) к боросиликатному стеклянному слою вдоль микрофлюидного канала с помощью цианоакрилатного клея (10 мкл или менее).
ПРИМЕЧАНИЕ: Нанесите клей в виде очень тонкого слоя в канал с помощью ватного тампона, чтобы свести к минимуму любое изменение высоты. На рисунке 3C показано изображение устройства.
3. Бактериальные штаммы и культуры
ПРИМЕЧАНИЕ: Обратитесь к таблице 2 для отбора и инкубации GN и грамположительных (GP) бактерий для экспериментов. Для метода культуры обратитесь к шагам 3.1-3.4. Все бактерии следует инкубировать в аэробных условиях до получения абсорбции 0,4 при600 нм (OD 600).
- Для бактерий GN, таких как Escherichia coli DH5α, Escherichia coli KCTC2571, Sphingomonas insulae и Pseudomonas pictorum и бактерий GP, таких как Staphylococcus epidermidis и Staphylococcus pasteuri, инкубируют в среде Luria-Bertani при 37 °C и 220 об/мин в течение 16 ч.
- Для энтеробактеров (GN) и Bacillus megaterium (GP; KCTC 1021), инкубируют в питательной среде бульона при 37 °C и 220 об/мин в течение 16 ч.
- Для Enterococcus thailandicus (GP) инкубируют в среде de Man, Rogosa и Sharpe (MRS) при 37 °C и 220 об/мин в течение 16 ч.
- Для Listeria grayi (GP) инкубируют в инфузионной среде сердца мозга при 37 °C и 220 об/мин в течение 16 ч.
- Центрифугу (9056 х г) культивируемые бактерии в течение 1 мин при комнатной температуре (RT), затем дважды промыть 1x фосфат-буферным солевым (PBS) буфером.
- Подготовьте выбранные бактерии GN и GP к анализу путем повторного использования в буфере PBS.
4. Микрошарики и иммобилизация аптамера на микрошарики
- Перед использованием повторно суспендируйте смесь микрогранул со стрептавидиновым покрытием (10 мкм) (Таблица материалов) (перемешайте с помощью вихрей в течение 20 с).
- Готовят аптамер путем денатурации при 95 °C в течение 3 мин, а затем повторного складывания при 0 °C в течение 2 мин.
- Переложить 250 мкл суспендированной смесью микрогранул, покрытой стрептавидином, в пробирку объемом 1,5 мл и промыть буфером Tris-HCl (50 мМ Tris, рН 7,4, 1 мМ MgCl2, 5 мМ KCL, 100 мМ NaCl) на RT. Затем добавьте в трубку 100 мкл биотинилированного ДНК-аптамера.
- Инкубировать смесь на RT в течение 30 мин при вращении (25 об/мин).
- После центрифугирования (9056 х г) дважды промыть трубку 200 мкл буфера Tris-HCl на RT.
- Добавьте 10 мкл BSA (100 мг/мл) в промытую пробирку и инкубируйте в течение 30 мин на RT с вращением (25 об/мин).
- Наконец, дважды промыть модифицированные аптамером микрогранулы центрифугированием (9056 х г) в буфере Tris-HCl при RT.
5. Настройка и эксплуатация акустофореза
- Соедините трубки PEEK с двумя входными отверстиями для впрыска двух образцов и буфера и двумя выходами для сбора и сброса отходов (рисунок 4).
- Вручную заполните канал микрофлюидного акустофореза безпузырьковой деминерализованной водой с помощью шприца объемом 10 мл.
- Подготовьте прецизионный регулятор давления с двумя или более выходными каналами для управления потоком жидкости. Затем наполовину заполните флаконы образцом и буфером с двумя отверстиями в их колпачках, соответственно, и подключите к входу чипа.
ПРИМЕЧАНИЕ: Прецизионный контроллер давления с двумя или более выходными каналами может быть заменен несколькими прецизионными регуляторами давления. На входе буфера буфер, способный генерировать ламинарный поток, который предотвращает перемещение образца в центр во время впрыска образца, вводится через контроллер потока. - После подготовки устройства вводят образец и буфер, применяя давление 2 кПа на вход образца и 4 кПа на буферное входное отверстие с помощью прецизионного устройства контроля давления.
ПРИМЕЧАНИЕ: В это время для плавного ламинарного потока давление впрыска буфера должно быть выше, чем давление впрыска образца. Поток управляется контроллером потока, закрепленным на аспираторе, подключенном к входному каналу. - Сосредоточьтесь на шарике, чтобы переместить его в центр микрофлюидного канала с помощью PZT во время проверки через микроскоп.
ПРИМЕЧАНИЕ: Чем больше шарик, тем больше влияние на форму сигнала, поэтому его легче выровнять с точкой узла. Функциональный генератор с усилителем подает мощность на PZT для генерации синусоиды в микроканале. Поскольку верхняя и нижняя части микроканала сделаны из стекла, генерируемая синусоида отражается и создает точку узла7. - Генерируйте резонансную частоту 3,66 МГц с помощью генератора одноканальной функции и усиливайте типичный сигнал на 16 дБ (примерно в девять раз) с помощью усилителя мощности (рисунок 4).
ПРИМЕЧАНИЕ: Резонансная частота привода должна соответствовать размеру канала; поскольку канал квадратный, PZT работает на точной частоте, чтобы создать один узел. - Наблюдайте за процессами разделения и обогащения на акустофлюидном чипе с помощью флуоресцентного микроскопа и высокоскоростной камеры, работающей со скоростью 1 200 кадров в секунду.
- Количественная оценка и анализ присутствия или отсутствия бактерий GN и бактерий GP путем проверки изображений, сделанных с помощью камеры флуоресцентного микроскопа связанных с бактериями шариков и бактерий, выделяемых через образцы сбора и выхода отходов.
ПРИМЕЧАНИЕ: Микрошарики с буфером, бактериями и аптамерами проходят через основной канал, а микрогранулы выравниваются по центру с помощью внутричипового акустофореза, индуцированного PZT. Наконец, микрошарики, которые имеют связанные бактерии GN, собираются на выходе сбора, а несобранные бактерии сбрасываются через выход отходов.
Результаты
На рисунке 5 показано изображение потока шарика в зависимости от напряжения PZT (OFF, 0,1 В, 0,5 В, 5 В). В случае акустофоретического чипа, представленного в этом исследовании, было подтверждено, что по мере увеличения напряжения PZT центральная концентрация шариков размером 10 мкм увеличивалась. Большинство бусин размером 10 мкм были сосредоточены в центре при напряжении PZT 5 В. Благодаря этому результату резонансная частота 3,66 МГц была сгенерирована в генераторе одноканальной функции, а общий сигнал был усилен на 16 дБ (примерно в 9 раз) с помощью усилителя мощности.
В таблице 3 показано, что смесь микрогранул размером 1 мкм (размер ячейки) и 10 мкм (шарик с аптамером) была введена в чип акустической жидкости, используемый в этом исследовании, и производительность разделения чипа в соответствии со скоростью потока на выходе (400, 450 и 475 мкл / мин) является результатом оценки. Коэффициент извлечения представляет собой отношение количества бусин, собранных на выходе, к общему количеству введенных бусин для бусин размером 10 мкм, которые составляли 98% ± 2,2%, 98% ± 2,5% и 90% ± 9,8% соответственно. Чистота - это отношение количества бусин размером 10 мкм к общему количеству собранных бусин, которые составили 97,1% ± 3,6%, 97,6% ± 2,4% и 99,4% ± 0,6% соответственно. Это говорит о том, что устройство обладает высокой эффективностью разделения для бусин размером 10 мкм.
На рисунке 6 показаны изображения и график связанных с бактериями чисел на бусину. Данные, относящиеся к работе чипа акустофореза в отношении образцов мишени и отходов, были собраны на выходе и входе соответственно. Все образцы подвергали отбору проб объемом 10 мкл в коллекторных пробирках, а количество бактерий, связывающихся с микрогранулами, наблюдалось под флуоресцентным микроскопом. Многие бактерии GN (например, E. кишечная палочка DH5α) связаны со всеми бусинами, в то время как несколько бактерий GP (например, Listeria grayi) связаны с некоторыми бусинами. Количество бактерий GN и GP, связанных с каждой модифицированной аптамером микрогранулой (из 25 бусин), измерялось с помощью микроскопа с высокоскоростной камерой. Все пять бактерий GN были связаны с шариками (4,96 ± 0,77 каждая), в то время как значительно меньше бактерий GP были связаны с тестируемыми веществами (0,08 ± 0,08 каждая). Сила сигнала значительно различалась между бактериями GN и GP. Эти данные подтверждают, что это устройство было успешным в выделении бактерий GN.
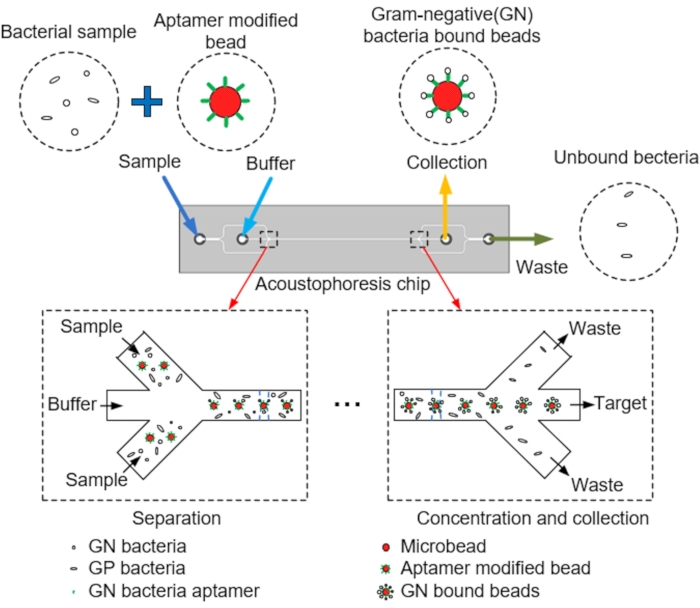
Рисунок 1: Схема микроканалов, центральное выравнивание микрошариков с помощью акустофореза и коллекция мишеней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: CAD-изображение микрофлюидного акустофореза чипа для разделения бактерий GN с использованием аффинных шариков аптамера. (A) Слой кремниевого канала. (B) Верхний слой стекла. (Размеры от 1 до 4 см. в таблице 1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Структура микроустройства акустофореза. (А) Участок пола, (Б) план поперечного сечения и (В) фотография устройства. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
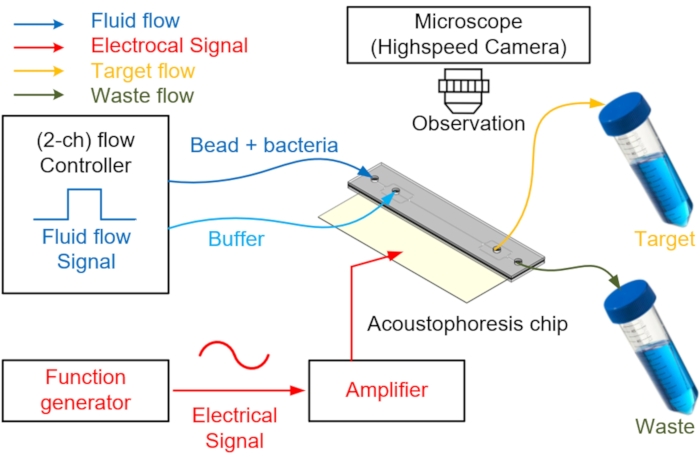
Рисунок 4: Схема акустофлюидной системы, используемой для разделения и сбора клеток. Образец или буферный раствор вводится во входной порт через контроллер потока. Для центрирования шариков и разделения образцов питание переменного тока подается на PZT через функциональный генератор с усилителем мощности для генерации силы акустического излучения в микроканале. Отделенный целевой образец собирается через коллекторную трубку, а оставшаяся отработанная жидкость извлекается через другое выходное отверстие. Для визуализации разделения используется высокоскоростной модуль камеры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Изображение потока шариков в зависимости от напряжения PZT. (A) PZT OFF, (B) PZT 0,1 В, (C) PZT 0,5 В, (D) PZT 5 В. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
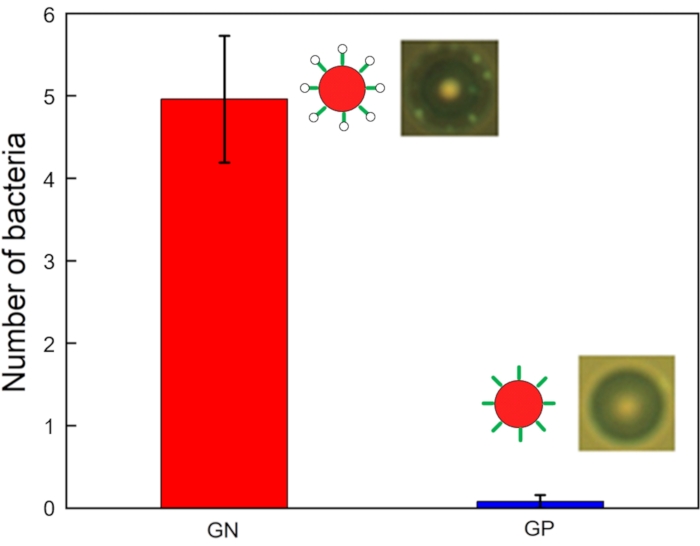
Рисунок 6: Количество бактерий GN (E. coli DH5α) и GP (Listeria grayi), связанных с аптамер-модифицированными микрошариками (n = 25, погрешность = стандартная ошибка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Число | Устройство | Ширина (Ш) или Диаметр (Г) (мкм) |
| 1 | Входной и выходной порт (кремний) | 1000 (Д) |
| 2 | Микрофлюидный канал | 200 () |
| 3 | Входной и выходной канал | 400 (Вт) |
| 4 | Входное и выходное отверстие (стекло) | 1500 (Д) |
Таблица 1: Размеры пневматической микрофлюидной платформы (от 1 до 4 на рисунке 2).
| Бактерии GN | Бактерии GP |
| Кишечная палочка (DH5α) | Бацилла мегатерий (KCTC 1021) |
| Энтеробактер клоака | Стафилококк эпидермидис |
| Sphingomonas insulae | Листерия грейи |
| Кишечная палочка KCTC 2571 | Энтерококк таиландский |
| Синегнойная палочка pictorum | Стафилококк пастеури |
Таблица 2: Изученные бактерии GN и GP.
| Расход на выходе (мкл/мин) | Коэффициент извлечения (%) | Чистота (%) |
| 400 (5-кратное объемное коннетнирование) | 98 ± 2,2 | 97,1 ± 3,6 |
| 450 (10-кратное объемное коннетнирование) | 98 ± 2,5 | 97.6 ± 2.4 |
| 475 (20-кратное объемное коннетнирование) | 90 ± 9,8 | 99.4 ± 0.6 |
Таблица 3: Коэффициент извлечения и чистота сепарации.
Обсуждение
Мы разработали микрофлюидное устройство звуковой левитации для захвата и передачи бактерий GN из образцов культуры на высокой скорости на основе метода непрерывного хода в соответствии с их размером и типом, а также модифицированных аптамерами микрошариков. Длинный квадратный микроканал обеспечивает более простую конструкцию и большую экономическую эффективность для 2D-акустофореза, чем сообщалось ранее 20,21,22,23,24,25,26. Устройство имеет скорость восстановления >98% до 10-кратной концентрации дозы. Это исследование показывает более высокую скорость восстановления и чистоту, чем существующие методы без маркировки 20,21,22,23,24 и методы аффинного шарика25,26 для разделения бактерий. Это говорит о том, что устройство может эффективно разделять бактерии. Однако, поскольку 10-мкм шарики могут течь в боковые каналы, скорость восстановления снижается до 90% при концентрации дозы 20x из-за сильной силы вывода, возникающей из закрытого выходного отверстия, блокирующего акустическое излучение в тесте производительности. В то время как скорость восстановления на чипе может достигать 98%, несколько факторов снижают скорость восстановления, такие как осаждение шариков в ингаляторе или засорение трубки, соединяющей ингалятор с чипом.
Есть несколько ключевых моментов, необходимых для того, чтобы сделать этот акустофоретический чип и заставить его работать. Клей, используемый для крепления PZT, должен использоваться как можно меньше для точности гофрирования, а PZT и микроканал должны быть параллельными. Ошибки на этом этапе приводят к передаче неправильных форм сигналов через PZT на чип, что проявляется в виде смещения бусин. Также будьте осторожны при эксплуатации, так как несколько факторов могут ухудшить скорость восстановления, такие как осаждение шариков из шприца или засорение соединительной трубки стружкой из шприца.
Это устройство может быть не только использовано для обнаружения живых бактерий или биомаркеров бактериального происхождения в области ранней диагностики бактериальных инфекционных заболеваний, но также может быть распространено на мониторинг загрязнения воды, что поможет выявить биотерроризм и патогенные бактериальные инфекции.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана грантом Национального исследовательского фонда Кореи (NRF), финансируемым корейским правительством (Министерство науки и ИКТ). (Нет. НРФ-2021R1A2C1011380)
Материалы
| Name | Company | Catalog Number | Comments |
| 1 µm polystyrene microbeads | Bang Laboratories | PS04001 | Cell size beads |
| 10 µm Streptavidin-coated microbeads | Bang Laboratories | CP01007 | Aptamer affinity beads |
| 4-inch Silicon Wafer/SU-8 mold | 4science | 29-03573-01 | Components of chip |
| Aptamer | Integrated DNA Technologies | GN3-6' | RNA for bacteria conjugation |
| Borosilicate glass | Schott | BOROFLOAT 33 | Components of chip |
| Centrifuge | Daihan | CF-10 | Wasing particles |
| Cyanoacrylate glue | 3M | AD100 | Attach PZT to microchip |
| Escherichia coli DH5α | KCTC | KCTC2571 | Target bacteria |
| Functional generator | GW Instek | AFG-2225 | Generate frequency |
| High-speed camera | Photron | FASTCAM Mini | Observation of separation |
| Hot plate | As one | HI-1000 | Heating plate for curing of liquid PDMS |
| KOVAX-SYRINGE 10 mL Syringe | Koreavaccine | 22G-10ML | Fill the microfluidic acoustophoresis channel with bubble-free demineralized water. |
| Liquid polydimethylsiloxane, PDMS | Dow Corning Inc. | Sylgard 184 | Components of chip |
| LB Broth Miller | BD Difco | 244620 | Cell culture (Luria-Bertani medium) |
| Microscope | Olympus Corp. | IX-81 | Observation of separation |
| PBS buffer | Capricorn scientific | PBS-1A | Wasing bacteria |
| PEEK Tubes | Saint-Gobain Ppl Corp. | AAD04103 | Inject or collect particles |
| Piezoelectric transducer | Fuji Ceramics | C-213 | Generate specific wave in channel |
| Power amplifier | Amplifier Research | 75A250A | Amplify frequency |
| Pressure controller/μflucon | AMED | AMED-μflucon | Control of air pressure/flow controller |
| Tris-HCl buffer | invitrogen | 15567027 | Wasing particles |
| Tube rotator | SeouLin Bioscience | SLRM-3 | Modifiying aptamer and bead |
Ссылки
- Wu, M., et al. Acoustofluidic separation of cells and particles. Microsystem & Nanoengineering. 5 (1), 1-18 (2019).
- Lee, S. W., et al. Aptamer affinity-bead mediated capture and displacement of Gram-negative bacteria using acoustophoresis. Micromachines. 10 (11), 770(2019).
- Hirvonen, J. J., et al. One-step sample preparation of positive blood cultures for the direct detection of methicillin-sensitive and -resistant Staphylococcus aureus and methicillin-resistant coagulase-negative staphylococci within one hour using the automated GenomEra CDXTM PCR system. European Journal of Clinical Microbiology & Infectious Diseases. 31 (10), 2835-2842 (2012).
- Swaminathan, B., Feng, P. Rapid detection of food-borne pathogenic bacteria. Annual Review of Microbiology. 48 (1), 401-426 (1994).
- Ding, X., et al. On-chip manipulation of single microparticles, cells, and organisms using surface acoustic waves. Proceeding of the National Academy of Sciences of the United States of America. 109 (28), 11105-11109 (2012).
- Karthick, S., et al. Acoustic impedance-based size independent isolation of circulating tumor cells from blood using acoustophoresis. Lab on a Chip. 18 (24), 2802(2018).
- Lenshof, A., et al. Acoustofluidics 8: Applications of acoustophoresis in continuous flow microsystems. Lab on a Chip. 12 (7), 1210-1223 (2012).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS journal. 275 (22), 5657-5666 (2008).
- Klussmann, S. The aptamer handbook: Functional oligonucleotides and their applications. , John Wiley & Sons. Hoboken, New Jersey. (2006).
- Ellington, A., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346 (6287), 818-822 (1990).
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249 (4968), 505-510 (1990).
- Namnabat, M. S., et al. 3D numerical simulation of acoustophoretic motion induced by boundary-driven acoustic streaming in standing surface acoustic wave microfluidics. Scientific Reports. 11 (1), 11326(2021).
- Nimjee, S. M., et al. Aptamer as therapeutics. Annual Review of Pharmacology and Toxicology. 57, 61-79 (2017).
- Zhang, Y., et al. Recent advances in aptamer discovery and application. Molecules. 24 (5), 941(2019).
- Park, J. W., et al. Acousto-microfluidics for screening of ssDNA aptamer. Scientific Reports. 6 (1), 1-9 (2016).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS Journal. 275 (22), 5657-5666 (2008).
- Van Toan, N., et al. An investigation of processes for glass micromachining. Micromachines. 7 (3), 51(2016).
- Jansen, H., et al. A survey on the reactive ion etching of silicon in microtechnology. Journal of Micromechanics and Microengineering. 6 (1), 14(1996).
- Hanneborg, A., et al. Silicon-to-silicon anodic bonding with a borosilicate glass layer. Journal of Micromechanics and Microengineering. 1 (3), 139(1991).
- Mach, A. J., Di Carlo, D. Continuous scalable blood filtration device using inertial microfluidics. Biotechnology and bioengineering. 107 (2), 302-311 (2010).
- Wang, S., et al. Simple filter microchip for rapid separation of plasma and viruses from whole blood. International Journal of Nanomedicine. 7, 5019-5028 (2012).
- Ai, Y., et al. Separation of Escherichia coli bacteria from peripheral blood mononuclear cells using standing surface acoustic waves. Analytical Chemistry. 85 (19), 9126-9134 (2013).
- Ohlsson, P., et al. Acoustic impedance matched buffers enable separation of bacteria from blood cells at high cell concentrations. Scientific Reports. 8 (1), 1-11 (2018).
- Park, S., et al. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Kim, U., Soh, H. T. Simultaneous sorting of multiple bacterial targets using integrated Dielectrophoretic-Magnetic Activated Cell Sorter. Lab on a Chip. 9 (16), 2313-2318 (2009).
- Cai, G., et al. A fluidic device for immunomagnetic separation of foodborne bacteria using self-assembled magnetic nanoparticle chains. Micromachines. 9 (12), 624(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены