Method Article
Acoustophorèse microfluidique pour la séparation en continu de bactéries à Gram négatif à l’aide de billes d’affinité aptamères
Dans cet article
Résumé
Cet article décrit la fabrication et le fonctionnement de puces acoustophorétiques microfluidiques à l’aide de la technique de l’acoustophorèse microfluidique et de microbilles modifiées par aptamères qui peuvent être utilisées pour isoler rapidement et efficacement les bactéries à Gram négatif d’un milieu.
Résumé
Cet article décrit la fabrication et le fonctionnement de puces acoustophorétiques microfluidiques à l’aide d’une technique d’acoustophorèse microfluidique et de microbilles modifiées par aptamère qui peuvent être utilisées pour l’isolement rapide et efficace des bactéries à Gram négatif à partir d’un milieu. Cette méthode améliore l’efficacité de séparation en utilisant un mélange de longs microcanaux carrés. Dans ce système, l’échantillon et le tampon sont injectés dans l’orifice d’entrée via un régulateur de débit. Pour le centrage du cordon et la séparation des échantillons, l’alimentation CA est appliquée au transducteur piézoélectrique via un générateur de fonctions avec un amplificateur de puissance pour générer une force de rayonnement acoustique dans le microcanal. Il y a un canal bifurqué à l’entrée et à la sortie, permettant la séparation, la purification et la concentration simultanées. L’appareil a un taux de récupération de >98% et une pureté de 97,8% jusqu’à une concentration de dose 10x. Cette étude a démontré un taux de récupération et une pureté supérieurs aux méthodes existantes de séparation des bactéries, ce qui suggère que le dispositif peut séparer efficacement les bactéries.
Introduction
Des plates-formes microfluidiques sont en cours de développement pour isoler les bactéries à partir d’échantillons médicaux et environnementaux, en plus des méthodes basées sur le transfert diélectrique, la magnétophorèse, l’extraction des billes, le filtrage, la microfluidique centrifuge et les effets inertiels, et les ondes acoustiques de surface 1,2. La détection des bactéries pathogènes se poursuit à l’aide de la réaction en chaîne de la polymérase (PCR), mais elle est généralement laborieuse, complexe et prend beaucoupde temps 3,4. Les systèmes d’acoustophorèse microfluidique sont une solution de rechange pour résoudre ce problème grâce à un débit raisonnable et à une isolation cellulaire sans contact 5,6,7. L’acoustophorèse est une technologie qui sépare ou concentre les perles en utilisant le phénomène du mouvement de la matière à travers une onde sonore. Lorsque les ondes sonores pénètrent dans le microcanal, elles sont triées en fonction de la taille, de la densité, etc., des billes, et les cellules peuvent être séparées en fonction des propriétés biochimiques et électriques du milieu en suspension 7,8. En conséquence, de nombreuses études acoustophorétiques ont été activement poursuivies 9,10,11, et récemment, des simulations numériques 3D du mouvement acoustophorétique induit par l’écoulement acoustique entraîné par les limites dans la microfluidique à ondes acoustiques de surface debout ont été introduites 12.
Des études dans divers domaines examinent comment remplacer les anticorps 2,3. L’aptamère est un matériau cible ayant une sélectivité et une spécificité élevées, et de nombreuses études sont en cours 2,9,10,13. Les aptamères présentent des avantages de petite taille, d’excellente stabilité biologique, de faible coût et de reproductibilité élevée par rapport aux anticorps et sont étudiés dans des applications diagnostiques et thérapeutiques 2,3,14.
Ici, cet article décrit un protocole technologique d’acoustophorèse microfluidique qui peut être utilisé pour la séparation rapide et efficace des bactéries à Gram négatif (GN) d’un milieu à l’aide de microbilles modifiées par aptamère. Ce système génère une onde stationnaire acoustique bidimensionnelle (2D) par actionnement piézoélectrique unique en stimulant simultanément deux résonances orthogonales dans un long microcanal rectangulaire pour aligner et concentrer les microbilles attachées aux aptamères au niveau du nœud et des points anti-nœuds pour l’efficacité de séparation 2,11,15,16 . Il y a un canal bifurqué à l’entrée et à la sortie, permettant la séparation, la purification et la concentration simultanées.
Ce protocole peut être utile dans le domaine du diagnostic précoce des maladies infectieuses bactériennes, ainsi que d’une réponse rapide, sélective et sensible aux infections bactériennes pathogènes grâce à la surveillance de l’eau en temps réel.
Protocole
1. Conception de puce d’acoustophorèse microfluidique
REMARQUE : La figure 1 montre un schéma de la séparation et de la collecte des microbilles cibles des microcanaux par acoustophorèse. La puce d’acoustophorèse microfluidique est conçue avec un programme de CAO.
- Concevoir une puce d’acoustophorèse microfluidique qui utilise un mélange de billes modifiées par aptamère et de billes de polystyrène (PS) enrobées de streptavidine correspondant à la taille des bactéries pour étudier la performance de séparation du dispositif.
- Concevoir une puce d’acoustophorèse microfluidique qui recueille les billes de PS à la sortie cible et élimine le reste par la sortie après avoir injecté un mélange d’échantillons de PS dans l’entrée de l’échantillon (voir la figure 2 et le tableau 1).
REMARQUE : À cette fin, la puce acoustofluidique est conçue composée de deux entrées pour l’injection d’échantillons et de tampon, d’un canal principal avec un transducteur piézoélectrique (PZT) attaché pour permettre l’alignement central des microbilles et de deux sorties par lesquelles les échantillons sont collectés et les déchets rejetés (Figure 3A). - Concevoir une puce d’acoustophorèse microfluidique dans laquelle les microbilles, le tampon, les bactéries et les aptamères traversent le canal principal, les microbilles étant alignées au centre par l’acoustophorèse dans la puce induite par le PZT (Figure 3B,C)
2. Fabrication de puces d’acoustophorèse microfluidique
REMARQUE : Assemblez quatre couches dans l’ordre suivant : une couche de verre-silicium borosilicate, une couche de silicium, une couche de verre borosilicaté et une couche PZT, comme illustré à la figure 3A, B.
- Préparer le verre borosilicaté (la couche supérieure) avec des trous de 2 mm de diamètre par jet de sable17 à l’entrée et à la sortie pour connecter les tubes en polyétheréthercétone (PEEK). Le verre borosilicaté mesure 20 × 80 × 0,5 mm3.
- Préparer une couche de canal de silicium de 200 μm d’épaisseur avec un microcanal d’une section transversale de 0,2 × 0,2 mm2 formé à l’aide d’une résine photosensible et d’un motif de silicium obtenu par gravure ionique réactive profonde (RIE)18. Percer des trous de 1 mm de diamètre pour les canaux d’entrée d’échantillon et de tampon ainsi que les canaux de collecte et de sortie des déchets pendant la gravure ionique réactive.
REMARQUE: Ici, la gravure ionique utilise le processus RIE pour former des microcanaux. Une résine photosensible a été appliquée sous la forme d’un canal sur une plaquette de silicium pour la couche de canal de silicium. La plaquette de silicium revêtue de PR a été gravée avec du plasma généré par l’application de 13,56 Mhz au fluor18. - Préparer une puce avec les couches supérieures et inférieures à la couche de silicium (20 × 80 × 0,5 mm3) préparée à l’étape 2.2 (20 × 80 × 0,5mm3) collée au verre borosilicaté à l’étape 2.1 et une troisième couche de verre borosilicaté par anodisation à 1 000 V et 400 °C19.
- Fixer un PZT (20 × 40 mm2) à la couche de verre borosilicaté le long du canal microfluidique à l’aide d’un adhésif cyanoacrylate (10 μL ou moins).
REMARQUE: Appliquez l’adhésif en couche très fine dans le canal à l’aide d’un coton-tige pour minimiser tout changement de hauteur. La figure 3C est une image de l’appareil.
3. Souches bactériennes et culture
REMARQUE : Reportez-vous au tableau 2 pour sélectionner et incuber les bactéries GN et Gram positif (GP) pour les expériences. Pour la méthode de culture, reportez-vous aux étapes 3.1-3.4. Toutes les bactéries doivent être incubées dans des conditions aérobies jusqu’à ce qu’une absorbance de 0,4 à 600 nm (OD600) soit obtenue.
- Pour les bactéries GN telles que Escherichia coli DH5α, Escherichia coli KCTC2571, Sphingomonas insulae et Pseudomonas pictorum et les bactéries GP telles que Staphylococcus epidermidis et Staphylococcus pasteuri, incuber dans le milieu Luria-Bertani à 37 °C et 220 rpm pendant 16 h.
- Pour Enterobacter (GN) et Bacillus megaterium (GP; KCTC 1021), incuber dans un milieu de bouillon nutritif à 37 °C et 220 rpm pendant 16 h.
- Pour Enterococcus thailandicus (GP), incuber dans de Man, Rogosa et Sharpe (MRS) milieu à 37 °C et 220 rpm pendant 16 h.
- Pour Listeria grayi (GP), incuber dans un milieu de perfusion cardiaque cérébral à 37 °C et 220 rpm pendant 16 h.
- Centrifuger (9056 x g) les bactéries cultivées pendant 1 min à température ambiante (RT), puis laver deux fois avec 1x tampon de solution saline tamponnée au phosphate (PBS).
- Préparer les bactéries GN et GP sélectionnées pour l’analyse en les remettant en suspension dans un tampon PBS.
4. Microbilles et immobilisation de l’aptamère sur les microbilles
- Remettez en suspension le mélange de microbilles enrobées de streptavidine (10 μm) (Table des matières) avant utilisation (mélanger par vortex pendant 20 s).
- Préparer l’aptamère en le dénaturant à 95 °C pendant 3 min, puis en le repliant à 0 °C pendant 2 min.
- Transvaser 250 μL du mélange de microbilles recouvertes de streptavidine en suspension dans un tube de 1,5 mL et laver avec un tampon Tris-HCl (50 mM Tris, pH 7,4, 1 mM MgCl2, 5 mM KCL, 100 mM NaCl) à TA. Ajoutez ensuite 100 μL d’aptamère d’ADN biotinylé dans le tube.
- Incuber le mélange à TA pendant 30 min en tournant (25 tr/min).
- Après centrifugation (9056 x g), laver le tube deux fois avec 200 μL de tampon Tris-HCl à TA.
- Ajouter 10 μL de BSA (100 mg/mL) dans le tube à échantillon lavé et incuber pendant 30 min à TA avec rotation (25 rpm).
- Enfin, laver deux fois les microbilles modifiées par aptamère par centrifugation (9056 x g) dans un tampon Tris-HCl à TA.
5. Configuration et fonctionnement de l’acoustophorèse
- Connectez les tubes en PEEK aux deux entrées pour injecter deux échantillons et un tampon et aux deux sorties pour la collecte et le rejet des déchets (Figure 4).
- Remplir manuellement le canal d’acoustophorèse microfluidique avec de l’eau déminéralisée sans bulles à l’aide d’une seringue de 10 mL.
- Préparez un régulateur de pression de précision avec deux canaux de sortie ou plus pour contrôler le débit du fluide. Ensuite, remplissez à moitié les flacons avec l’échantillon et le tampon avec deux trous dans leurs bouchons, respectivement, et connectez-les à l’entrée de la puce.
REMARQUE: Un régulateur de pression de précision avec deux canaux de sortie ou plus peut être remplacé par plusieurs régulateurs de pression de précision. À l’entrée du tampon, un tampon capable de générer un flux laminaire qui empêche l’échantillon de se déplacer vers le centre pendant l’injection de l’échantillon est injecté à travers un régulateur de débit. - Après avoir préparé l’appareil, injecter l’échantillon et le tampon en appliquant une pression de 2 kPa à l’entrée de l’échantillon et de 4 kPa à l’entrée du tampon à l’aide du dispositif de contrôle de pression de précision.
REMARQUE : À ce stade, pour un écoulement laminaire régulier, la pression d’injection du tampon doit être supérieure à la pression d’injection de l’échantillon. Le débit est contrôlé par un régulateur de débit fixé à l’aspirateur relié au canal d’entrée. - Concentrez-vous sur une perle pour la déplacer au centre du canal microfluidique à l’aide du PZT tout en vérifiant au microscope.
REMARQUE: Plus le cordon est grand, plus l’effet sur la forme d’onde est important, il est donc plus facile de s’aligner avec le point du nœud. Le générateur de fonctions avec amplificateur applique de la puissance au PZT pour générer une onde sinusoïdale dans le microcanal. Puisque les parties supérieure et inférieure du microcanal sont en verre, l’onde sinusoïdale générée est réfléchie et crée un point de nœud7. - Générer une fréquence de résonance de 3,66 MHz à l’aide d’un générateur de fonctions monocanal et amplifier un signal typique de 16 dB (environ neuf fois) à l’aide d’un amplificateur de puissance (Figure 4).
REMARQUE: La fréquence de résonance de l’actionneur doit correspondre à la taille du canal; parce que le canal est carré, le PZT fonctionne à une fréquence précise pour créer un seul nœud. - Observez les processus de séparation et d’enrichissement sur la puce acoustofluidique avec un microscope à fluorescence et une caméra haute vitesse fonctionnant à 1 200 ips.
- Quantifier et analyser la présence ou l’absence de bactéries GN et de bactéries GP en vérifiant les images prises avec la caméra du microscope à fluorescence des billes liées aux bactéries et des bactéries rejetées par les échantillons de collecte et de sortie de déchets.
REMARQUE : Les microbilles avec tampon, bactéries et aptamères passent par le canal principal, et les microbilles sont alignées au centre par l’acoustophorèse dans la puce induite par le PZT. Enfin, les microbilles qui ont lié les bactéries GN sont collectées à la sortie de collecte, et les bactéries non collectées sont rejetées par la sortie de déchets.
Résultats
La figure 5 montre l’image de l’écoulement du cordon en fonction de la tension PZT (OFF, 0,1 V, 0,5 V, 5 V). Dans le cas de la puce acoustophorétique introduite dans cette étude, il a été confirmé qu’à mesure que la tension du PZT augmentait, la concentration centrale des billes de 10 μm augmentait. La plupart des billes de 10 μm étaient concentrées au centre à 5 V de la tension PZT. Grâce à ce résultat, une fréquence de résonance de 3,66 MHz a été générée dans un générateur de fonction à canal unique, et un signal général a été amplifié de 16 dB (environ 9 fois) à l’aide d’un amplificateur de puissance.
Le tableau 3 montre que le mélange de microbilles de 1 μm (taille de la cellule) et de 10 μm (bille attachée à l’aptamère) a été injecté dans la puce de fluide acoustique utilisée dans cette étude, et la performance de séparation des copeaux selon le débit de sortie (400, 450 et 475 μL/min) est le résultat de l’évaluation. Le taux de récupération est le rapport entre le nombre de billes collectées à la sortie et le nombre total de billes injectées pour les billes de 10 μm, qui étaient de 98 % ± 2,2 %, 98 % ± 2,5 % et 90 % ± 9,8 %, respectivement. La pureté est le rapport entre le nombre de billes de 10 μm et le nombre total de billes collectées, qui étaient de 97,1 % ± 3,6 %, 97,6 % ± 2,4 % et 99,4 % ± 0,6 %, respectivement. Cela montre que l’appareil a une efficacité de séparation élevée pour les billes d’une taille de 10 μm.
La figure 6 montre des images et un graphique du nombre de bactéries liées par bille. Les données relatives au fonctionnement des puces d’acoustophorèse concernant les échantillons cibles et de déchets ont été recueillies à la sortie et à l’entrée, respectivement. Tous les échantillons ont été soumis à un échantillonnage de 10 μL dans des tubes de collecte, et le nombre de bactéries se liant aux microbilles a été observé au microscope à fluorescence. De nombreuses bactéries GN (p. ex. E. Coli DH5α) sont liées à toutes les perles, tandis que quelques bactéries GP (par exemple, Listeria grayi) sont liées à certaines perles. Le nombre de bactéries GN et GP liées à chaque microbille modifiée par aptamère (de 25 billes) a été mesuré à l’aide d’un microscope avec une caméra à grande vitesse. Les cinq bactéries GN étaient liées aux billes (4,96 ± 0,77 chacune), tandis que beaucoup moins de bactéries GP étaient liées aux substances testées (0,08 ± 0,08 chacune). L’intensité du signal différait significativement entre les bactéries GN et GP. Ces données confirment que ce dispositif a réussi à isoler les bactéries GN.
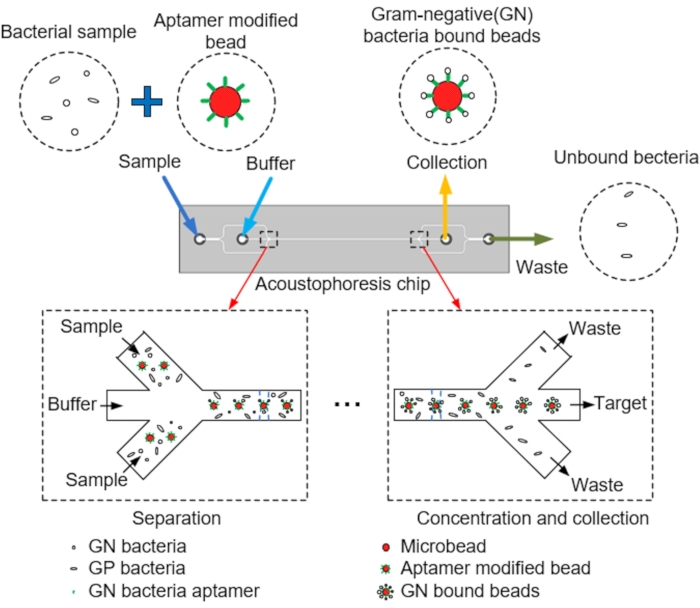
Figure 1 : Schéma des microcanaux, alignement central des microbilles par acoustophorèse et collecte des cibles. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Image CAO de la puce d’acoustophorèse microfluidique pour la séparation des bactéries GN à l’aide de billes d’affinité aptamères. (A) Couche de canal de silicium. (B) Couche supérieure de verre. (Pour les dimensions de 1 à 4, voir tableau 1). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Structure du microdispositif d’acoustophorèse. (A) tracé du sol, (B) plan de coupe transversale, et (C) photographie de l’appareil. Veuillez cliquer ici pour voir une version agrandie de cette figure.
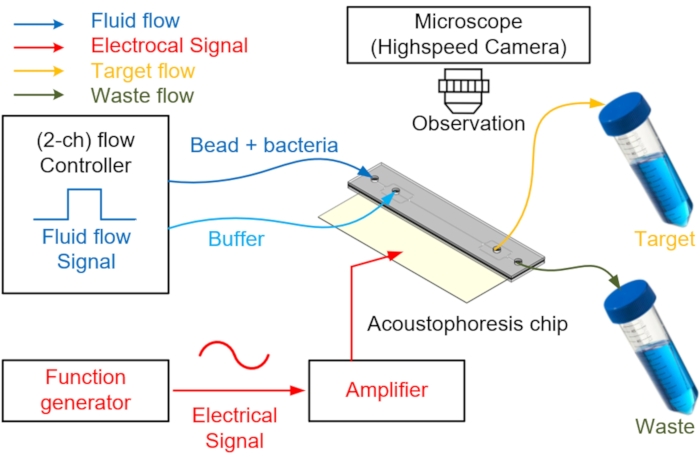
Figure 4 : Schéma du système acoustofluidique utilisé pour séparer et collecter les cellules. L’échantillon ou la solution tampon est injecté dans l’orifice d’entrée par le régulateur de débit. Pour le centrage des billes et la séparation des échantillons, l’alimentation CA est appliquée au PZT via un générateur de fonctions avec un amplificateur de puissance pour générer une force de rayonnement acoustique dans le microcanal. L’échantillon cible séparé est recueilli à travers un tube de collecte, et le fluide résiduel est récupéré par une autre sortie. Un module de caméra haute vitesse est utilisé pour visualiser la séparation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Image du flux de billes en fonction de la tension PZT. (A) PZT DÉSACTIVÉ, (B) PZT 0,1 V, (C) PZT 0,5 V, (D) PZT 5 V. Veuillez cliquer ici pour voir une version agrandie de cette figure.
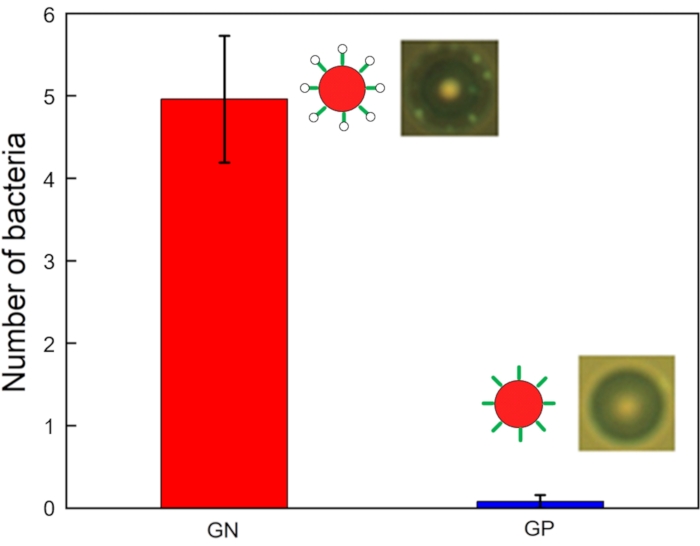
Figure 6 : Nombre de bactéries GN (E. coli DH5α) et GP (Listeria grayi) liées aux microbilles modifiées par les aptamères (n = 25, barre d’erreur = erreur-type). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nombre | Appareil | Largeur (W) ou diamètre (D) (μm) |
| 1 | Port d’entrée et de sortie (silicium) | 1000 (D) |
| 2 | Canal microfluidique | 200 (W) |
| 3 | Canal d’entrée et de sortie | 400 (W) |
| 4 | Orifice d’entrée et de sortie (verre) | 1500 (D) |
Tableau 1 : Dimensions de la plate-forme microfluidique pneumatique (1 à 4 sur la figure 2).
| Bactéries GN | Bactéries GP |
| Escherichia coli (DH5α) | Bacillus megaterium (KCTC 1021) |
| Enterobacter cloacae | Staphylococcus epidermidis |
| Sphingomonas insulae | Listeria grayi |
| Escherichia coli KCTC 2571 | Enterococcus thailandicus |
| Pseudomonas pictorum | Staphylococcus pasteuri |
Tableau 2 : Les bactéries GN et GP étudiées.
| Débit à la sortie de l’eau (μL/min) | Taux de récupération (%) | Pureté (%) |
| 400 (concentration volumétrique 5x) | 98 ± 2,2 | 97,1 ± 3,6 |
| 450 (concentration volumétrique 10x) | 98 ± 2,5 | 97,6 ± 2,4 |
| 475 (concentration volumétrique 20x) | 90 ± 9,8 | 99,4 ± 0,6 |
Tableau 3 : Taux de récupération et pureté de séparation.
Discussion
Nous avons développé un dispositif microfluidique à lévitation sonique pour capturer et transférer les bactéries GN à partir d’échantillons de culture à grande vitesse basé sur une méthode de fonctionnement continu en fonction de leur taille et de leur type, et des microbilles modifiées par aptamère. Le microcanal long et carré permet une conception plus simple et une plus grande rentabilité pour l’acoustophorèse2D que précédemment rapporté 20,21,22,23,24,25,26. L’appareil a un taux de récupération de >98% jusqu’à une concentration de dose 10x. Cette étude montre un taux de récupération et une pureté plus élevés que les méthodes existantes sans marquage 20,21,22,23,24 et les méthodes de billes d’affinité 25,26 pour séparer les bactéries. Cela suggère que l’appareil peut séparer efficacement les bactéries. Cependant, comme les billes de 10 μm peuvent s’écouler dans les canaux latéraux, le taux de récupération est réduit à 90% à une concentration de dose de 20x en raison de la forte force de retrait résultant de la sortie fermée bloquant le rayonnement acoustique lors d’un essai de performance. Alors que le taux de récupération sur la puce peut atteindre 98%, plusieurs facteurs réduisent le taux de récupération, tels que la précipitation des billes dans l’inhalateur ou le colmatage du tube reliant l’inhalateur à la puce.
Il y a quelques points clés nécessaires pour faire cette puce acoustophorétique et la faire fonctionner. L’adhésif utilisé pour fixer le PZT doit être utilisé le moins possible pour la précision de l’ondulation et le PZT et le microcanal doivent être parallèles. Les erreurs dans cette étape entraînent la transmission de formes d’onde incorrectes à travers le PZT à la puce, ce qui se manifeste par un désalignement des billes. Soyez également prudent lors de l’opération, car plusieurs facteurs peuvent aggraver le taux de récupération, tels que la sédimentation des billes de la seringue ou le blocage du tube de connexion avec les copeaux de la seringue.
Ce dispositif peut non seulement être utilisé pour détecter des bactéries vivantes ou des biomarqueurs dérivés de bactéries dans le domaine du diagnostic précoce des maladies infectieuses bactériennes, mais peut également être étendu à la surveillance de la contamination de l’eau, ce qui aidera à identifier le bioterrorisme et les infections bactériennes pathogènes.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par la subvention de la Fondation nationale de la recherche de Corée (NRF) financée par le gouvernement coréen (ministère des Sciences et des TIC). (Non. NRF-2021R1A2C1011380)
matériels
| Name | Company | Catalog Number | Comments |
| 1 µm polystyrene microbeads | Bang Laboratories | PS04001 | Cell size beads |
| 10 µm Streptavidin-coated microbeads | Bang Laboratories | CP01007 | Aptamer affinity beads |
| 4-inch Silicon Wafer/SU-8 mold | 4science | 29-03573-01 | Components of chip |
| Aptamer | Integrated DNA Technologies | GN3-6' | RNA for bacteria conjugation |
| Borosilicate glass | Schott | BOROFLOAT 33 | Components of chip |
| Centrifuge | Daihan | CF-10 | Wasing particles |
| Cyanoacrylate glue | 3M | AD100 | Attach PZT to microchip |
| Escherichia coli DH5α | KCTC | KCTC2571 | Target bacteria |
| Functional generator | GW Instek | AFG-2225 | Generate frequency |
| High-speed camera | Photron | FASTCAM Mini | Observation of separation |
| Hot plate | As one | HI-1000 | Heating plate for curing of liquid PDMS |
| KOVAX-SYRINGE 10 mL Syringe | Koreavaccine | 22G-10ML | Fill the microfluidic acoustophoresis channel with bubble-free demineralized water. |
| Liquid polydimethylsiloxane, PDMS | Dow Corning Inc. | Sylgard 184 | Components of chip |
| LB Broth Miller | BD Difco | 244620 | Cell culture (Luria-Bertani medium) |
| Microscope | Olympus Corp. | IX-81 | Observation of separation |
| PBS buffer | Capricorn scientific | PBS-1A | Wasing bacteria |
| PEEK Tubes | Saint-Gobain Ppl Corp. | AAD04103 | Inject or collect particles |
| Piezoelectric transducer | Fuji Ceramics | C-213 | Generate specific wave in channel |
| Power amplifier | Amplifier Research | 75A250A | Amplify frequency |
| Pressure controller/μflucon | AMED | AMED-μflucon | Control of air pressure/flow controller |
| Tris-HCl buffer | invitrogen | 15567027 | Wasing particles |
| Tube rotator | SeouLin Bioscience | SLRM-3 | Modifiying aptamer and bead |
Références
- Wu, M., et al. Acoustofluidic separation of cells and particles. Microsystem & Nanoengineering. 5 (1), 1-18 (2019).
- Lee, S. W., et al. Aptamer affinity-bead mediated capture and displacement of Gram-negative bacteria using acoustophoresis. Micromachines. 10 (11), 770(2019).
- Hirvonen, J. J., et al. One-step sample preparation of positive blood cultures for the direct detection of methicillin-sensitive and -resistant Staphylococcus aureus and methicillin-resistant coagulase-negative staphylococci within one hour using the automated GenomEra CDXTM PCR system. European Journal of Clinical Microbiology & Infectious Diseases. 31 (10), 2835-2842 (2012).
- Swaminathan, B., Feng, P. Rapid detection of food-borne pathogenic bacteria. Annual Review of Microbiology. 48 (1), 401-426 (1994).
- Ding, X., et al. On-chip manipulation of single microparticles, cells, and organisms using surface acoustic waves. Proceeding of the National Academy of Sciences of the United States of America. 109 (28), 11105-11109 (2012).
- Karthick, S., et al. Acoustic impedance-based size independent isolation of circulating tumor cells from blood using acoustophoresis. Lab on a Chip. 18 (24), 2802(2018).
- Lenshof, A., et al. Acoustofluidics 8: Applications of acoustophoresis in continuous flow microsystems. Lab on a Chip. 12 (7), 1210-1223 (2012).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS journal. 275 (22), 5657-5666 (2008).
- Klussmann, S. The aptamer handbook: Functional oligonucleotides and their applications. , John Wiley & Sons. Hoboken, New Jersey. (2006).
- Ellington, A., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346 (6287), 818-822 (1990).
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249 (4968), 505-510 (1990).
- Namnabat, M. S., et al. 3D numerical simulation of acoustophoretic motion induced by boundary-driven acoustic streaming in standing surface acoustic wave microfluidics. Scientific Reports. 11 (1), 11326(2021).
- Nimjee, S. M., et al. Aptamer as therapeutics. Annual Review of Pharmacology and Toxicology. 57, 61-79 (2017).
- Zhang, Y., et al. Recent advances in aptamer discovery and application. Molecules. 24 (5), 941(2019).
- Park, J. W., et al. Acousto-microfluidics for screening of ssDNA aptamer. Scientific Reports. 6 (1), 1-9 (2016).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS Journal. 275 (22), 5657-5666 (2008).
- Van Toan, N., et al. An investigation of processes for glass micromachining. Micromachines. 7 (3), 51(2016).
- Jansen, H., et al. A survey on the reactive ion etching of silicon in microtechnology. Journal of Micromechanics and Microengineering. 6 (1), 14(1996).
- Hanneborg, A., et al. Silicon-to-silicon anodic bonding with a borosilicate glass layer. Journal of Micromechanics and Microengineering. 1 (3), 139(1991).
- Mach, A. J., Di Carlo, D. Continuous scalable blood filtration device using inertial microfluidics. Biotechnology and bioengineering. 107 (2), 302-311 (2010).
- Wang, S., et al. Simple filter microchip for rapid separation of plasma and viruses from whole blood. International Journal of Nanomedicine. 7, 5019-5028 (2012).
- Ai, Y., et al. Separation of Escherichia coli bacteria from peripheral blood mononuclear cells using standing surface acoustic waves. Analytical Chemistry. 85 (19), 9126-9134 (2013).
- Ohlsson, P., et al. Acoustic impedance matched buffers enable separation of bacteria from blood cells at high cell concentrations. Scientific Reports. 8 (1), 1-11 (2018).
- Park, S., et al. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Kim, U., Soh, H. T. Simultaneous sorting of multiple bacterial targets using integrated Dielectrophoretic-Magnetic Activated Cell Sorter. Lab on a Chip. 9 (16), 2313-2318 (2009).
- Cai, G., et al. A fluidic device for immunomagnetic separation of foodborne bacteria using self-assembled magnetic nanoparticle chains. Micromachines. 9 (12), 624(2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon