Method Article
Acoustopforese microfluidica para flowthrough separação de bactérias gram-negativas usando Contas de Afinidade De Aptamer
Neste Artigo
Resumo
Este artigo descreve a fabricação e o funcionamento de chips acoustopforéticos microfluidos usando a técnica de austopforese microfluidica e microesferas modificadas por aptamer que podem ser usadas para o isolamento rápido e eficiente de bactérias Gram-negativas a partir de um meio.
Resumo
Este artigo descreve a fabricação e o funcionamento de chips acoustopforéticos microfluidos usando uma técnica de austopforese microfluídica e microesferas modificadas por aptamer que podem ser usadas para o isolamento rápido e eficiente de bactérias Gram-negativas de um meio. Este método aumenta a eficiência de separação usando uma mistura de microcanais longos e quadrados. Neste sistema, a amostra e o buffer são injetados na porta de entrada através de um controlador de fluxo. Para centralizar as contas e separar amostras, a energia CA é aplicada no transdutor piezoelétrico através de um gerador de função com um amplificador de energia para gerar força de radiação acústica no microcanal. Há um canal bifurcado tanto na entrada quanto na saída, permitindo separação simultânea, purificação e concentração. O dispositivo tem uma taxa de recuperação de >98% e pureza de 97,8% até uma concentração de 10x de dose. Este estudo demonstrou uma taxa de recuperação e pureza superior aos métodos existentes para separar bactérias, sugerindo que o dispositivo pode separar as bactérias de forma eficiente.
Introdução
Plataformas microfluídicas estão sendo desenvolvidas para isolar bactérias de amostras médicas e ambientais, além de métodos baseados na transferência dielétrica, magnetoforese, extração de contas, filtragem, microfluidos centrífugas e efeitos inerciais, e ondas acústicas superficiais 1,2. A detecção de bactérias patogênicas continua usando reação em cadeia de polimerase (PCR), mas geralmente é trabalhosa, complexa e demorada 3,4. Os sistemas de austopforese microfluidica são uma alternativa para lidar com isso através de rendimento razoável e isolamento celular sem contato 5,6,7. Acoustophoresis é uma tecnologia que separa ou concentra contas usando o fenômeno do movimento material através de uma onda sonora. Quando as ondas sonoras entram no microcanal, elas são classificadas de acordo com o tamanho, densidade, etc., das contas, e as células podem ser separadas de acordo com as propriedades bioquímicas e elétricas do meio de suspensão 7,8. Assim, muitos estudos aoustopforéticos foram ativamente perseguidos 9,10,11, e recentemente, simulações numéricas 3D de movimento acoustopforético induzido pelo streaming acústico orientado por limites em microfluidos de onda acústica de superfície em pé foram introduzidas12.
Estudos em diversas áreas estão examinando como substituir anticorpos 2,3. Aptamer é um material-alvo com alta seletividade e especificidade, e muitos estudos estão sendo realizados 2,9,10,13. Os aptamers têm vantagens de pequeno porte, excelente estabilidade biológica, baixo custo e alta reprodutibilidade em relação aos anticorpos e estão sendo estudados em aplicações diagnósticas e terapêuticas 2,3,14.
Aqui, este artigo descreve um protocolo de tecnologia de acoustopforese microfluídica que pode ser usado para a rápida e eficiente separação de bactérias Gram-negativas (GN) de um meio usando microesferas modificadas por aptamer. Este sistema gera uma onda de pé acústica bidimensional (2D) através da atuação piezoelétrica única, estimulando simultaneamente duas ressonâncias ortogonais dentro de um microcanal retangular longo para alinhar e focar microesferas ligadas a aptamer nos pontos de nó e anti-nó para eficiência de separação 2,11,15,16 . Há um canal bifurcado tanto na entrada quanto na saída, permitindo separação simultânea, purificação e concentração.
Este protocolo pode ser útil no campo do diagnóstico precoce de doenças infecciosas bacterianas, bem como uma resposta rápida, seletiva e sensível a infecções bacterianas patogênicas através do monitoramento da água em tempo real.
Protocolo
1. Design de chip de acoustopforese microfluídica
NOTA: A Figura 1 mostra um esquema da separação e coleta de microesferas-alvo de microcanais por acoustopforese. O chip de austopforese microfluídica é projetado com um programa CAD.
- Projete um chip de acoustopforese microfluida que usa uma mistura de contas modificadas por aptámero e contas de poliestireno revestidos de streptavidin (PS) correspondentes ao tamanho das bactérias para estudar o desempenho de separação do dispositivo.
- Projete um chip de austopforese microfluida que colete contas de PS na tomada alvo e descarte o resto através da tomada depois de injetar uma mistura de amostra de PS na entrada da amostra (ver Figura 2 e Tabela 1).
NOTA: Para isso, o chip acoustofluidic é projetado composto por duas entradas para injetar amostras e tampão, um canal principal com um transdutor piezoelétrico anexado (PZT) para permitir que as microesferas sejam alinhadas centralmente, e duas saídas através das quais os espécimes são coletados e os resíduos são descarregados (Figura 3A) - Projete um chip de acoustopforese microfluida no qual microesferas, tampão, bactérias e aptamers passam pelo canal principal, com as microesferas alinhadas centralmente através de acoustophoresis in-chip induzida pelo PZT (Figura 3B,C)
2. Fabricação de chip de acoustopforese microfluídica
NOTA: Monte quatro camadas na seguinte ordem: uma camada de vidro-silício borossilicato, uma camada de silício, uma camada de vidro borossilicato e uma camada PZT, como mostrado na Figura 3A,B.
- Prepare vidro borossilicato (a camada superior) com furos de 2 mm de diâmetro pelo jateamentode areia 17 na entrada e saída para conectar tubos de polietercetíton (PEEK). O vidro borossilicato mede 20 × 80 × 0,5 mm3.
- Prepare uma camada de canal de silício de 200 μm de espessura com um microcanal com uma área transversal de 0,2 × 0,2 mm2 formadas por um fotoresist e um padrão de silício obtido através de gravura de íons reativos profundos (RIE)18. Perfurar furos de 1 mm de diâmetro para os canais de entrada de amostra e tampão e os canais de coleta e saída de resíduos durante a gravação de íons reativos.
NOTA: Aqui, a gravura de íons usa o processo RIE para formar microcanais. Um fotoresist foi aplicado na forma de um canal em um wafer de silício para a camada do canal de silício. O wafer de silício revestido de RP foi gravado com plasma gerado pela aplicação de 13,56 Mhz ao flúor18. - Prepare um chip com as camadas acima e abaixo da camada de silício (20 × 80 × 0,5 mm 3) preparado na etapa 2.2 (20 × 80 ×3 0,5 mm3) ligado ao vidro borossilicato na etapa 2.1 e uma terceira camada de vidro borossilicato usando anodização a 1.000 V e 400 °C19.
- Conecte um PZT (20 × 40 mm2) à camada de vidro borossilicato ao longo do canal microfluido usando um adesivo de cianoacrilato (10 μL ou menos).
NOTA: Aplique o adesivo como uma camada muito fina no canal usando um cotonete para minimizar qualquer mudança de altura. Figura 3C é uma imagem do dispositivo.
3. Cepas bacterianas e cultura
NOTA: Consulte a Tabela 2 para selecionar e incubar bactérias GN e Gram-positive (GP) para experimentos. Para o método de cultura, consulte as etapas 3.1-3.4. Todas as bactérias devem ser incubadas em condições aeróbicas até que seja obtida uma absorvância de 0,4 a 600 nm (OD600).
- Para bactérias GN como Escherichia coli DH5α, Escherichia coli KCTC2571, Sphingomonas insulae, e pseudomonas pictorum e bactérias GP como Staphylococcus epidermidis e Staphylococcus pasteuri, incubam em luria-bertani médio a 37 °C e 220 rpm por 16 h.
- Para Enterobacter (GN) e Bacillus megaterium (GP; KCTC 1021), incubar em caldo de nutrientes médio a 37 °C e 220 rpm por 16 h.
- Para Enterococcus thailandicus (GP), incubar em de Man, Rogosa e Sharpe (MRS) médio a 37 °C e 220 rpm por 16 h.
- Para Listeria grayi (GP), incubar em meio de infusão cerebral ao coração a 37 °C e 220 rpm por 16 h.
- Centrífuga (9056 x g) as bactérias cultivadas por 1 min a temperatura ambiente (RT), depois lava duas vezes com 1x tampão salino tampão tampão de fosfato (PBS).
- Prepare as bactérias GN e GP selecionadas para análise, reutilizando-se no buffer PBS.
4. Microesferas e imobilização de aptamer em microesferas
- Resuspend a mistura de microesferas revestidas de streptavidin (10 μm) (Tabela de Materiais) antes do uso (misture via vórtice para 20 s).
- Prepare o aptamer desnaturando a 95 °C por 3 min e, em seguida, redobrando a 0 °C por 2 min.
- Transfira 250 μL da mistura de microesferas revestidas de streptavidin resuspended para um tubo de 1,5 mL e lave com tampão Tris-HCl (50 mM Tris, pH 7.4, 1 mM MgCl2, 5 mM KCL, 100 mM NaCl) na RT. Em seguida, adicione 100 μL de aptamer de DNA biotinitado ao tubo.
- Incubar a mistura em RT por 30 minutos enquanto gira (25 rpm).
- Após a centrifugação (9056 x g), lave o tubo duas vezes com 200 μL de tampão Tris-HCl em RT.
- Adicione 10 μL de BSA (100 mg/mL) ao tubo de amostra lavado e incubar por 30 minutos em RT com rotação (25 rpm).
- Finalmente, lave as microesferas modificadas por aptamer duas vezes por centrifugação (9056 x g) no buffer Tris-HCl em RT.
5. Configuração e operação acoustophoresis
- Conecte os tubos PEEK às duas entradas para injetar duas amostras e tampão e as duas tomadas para coleta e descarga de resíduos (Figura 4).
- Encha manualmente o canal de acoustopforese microfluídica com água desmineralizada sem bolhas usando uma seringa de 10 mL.
- Prepare um controlador de pressão de precisão com dois ou mais canais de saída para controlar o fluxo de fluidos. Em seguida, encha os frascos com amostra e tampão com dois orifícios em suas tampas, respectivamente, e conecte-se à entrada do chip.
NOTA: Um controlador de pressão de precisão com dois ou mais canais de saída pode ser substituído por múltiplos controladores de pressão de precisão. Na entrada do buffer, um buffer capaz de gerar um fluxo laminar que impede que a amostra se mova para o centro durante a injeção de amostra é injetado através de um controlador de fluxo. - Após o preparo do dispositivo, injete a amostra e o buffer aplicando uma pressão de 2 kPa na entrada da amostra e 4 kPa na entrada do buffer usando o dispositivo de controle de pressão de precisão.
NOTA: Neste momento, para um fluxo suave de laminar, a pressão de injeção do tampão deve ser maior do que a pressão de injeção da amostra. O fluxo é controlado por um controlador de fluxo fixado ao aspirador conectado ao canal de entrada. - Concentre-se em uma conta para movê-la para o centro do canal microfluido usando o PZT enquanto verifica através do microscópio.
NOTA: Quanto maior a conta, maior o efeito na forma de onda, por isso é mais fácil alinhar com o ponto de nó. Gerador de função com amplificador aplica energia ao PZT para gerar onda senoidal no microcanal. Como as porções superior e inferior do microcanal são feitas de vidro, a onda seno gerada é refletida e cria um nó ponto7. - Gere uma frequência de ressonância de 3,66 MHz usando um gerador de função de um único canal e amplie um sinal típico por 16 dB (cerca de nove vezes) usando um amplificador de energia (Figura 4).
NOTA: A frequência de ressonância do atuador deve corresponder ao tamanho do canal; como o canal é quadrado, o PZT opera em uma frequência precisa para criar um único nó. - Observe os processos de separação e enriquecimento no chip acoustofluido com um microscópio de fluorescência e uma câmera de alta velocidade operando a 1.200 fps.
- Quantifique e analise a presença ou ausência de bactérias GN e bactérias GP verificando as imagens tiradas com a câmera do microscópio de fluorescência das contas ligadas a bactérias e bactérias descarregadas através das amostras de coleta e saída de resíduos.
NOTA: Microesferas com tampão, bactérias e aptamers passam pelo canal principal, e as microesferas são alinhadas centralmente através de acoustophoresis in-chip induzida pelo PZT. Finalmente, microesferas que ligaram bactérias GN são coletadas na tomada de coleta, e as bactérias não coletadas são descarregadas através da tomada de resíduos.
Resultados
A Figura 5 mostra a imagem do fluxo de contas em função da tensão PZT (OFF, 0,1 V, 0,5 V, 5 V). No caso do chip acoustopforético introduzido neste estudo, foi confirmado que, à medida que a tensão do PZT aumentava, a concentração central das contas de 10 μm aumentava. A maioria das contas de 10 μm de tamanho estavam concentradas no centro a 5 V da tensão PZT. Através deste resultado, uma frequência ressonante de 3,66 MHz foi gerada em um gerador de função de um único canal, e um sinal geral foi amplificado por 16 dB (cerca de 9 vezes) usando um amplificador de energia.
A tabela 3 mostra que a mistura de microesferas de 1 μm (tamanho celular) e 10 μm (aptamer anexado) foram injetadas no chip de fluido acústico utilizado neste estudo, e o desempenho de separação do chip de acordo com a taxa de fluxo de saída (400, 450 e 475 μL/min) é o resultado da avaliação. A taxa de recuperação é a razão do número de contas coletadas na tomada para o número total de contas injetadas para contas de 10 μm de tamanho, que foram de 98% ± 2,2%, 98% ± 2,5% e 90% ± 9,8%, respectivamente. Pureza é a razão do número de contas de tamanho de 10 μm para o número total de contas coletadas, que foram de 97,1% ± 3,6%, 97,6% ± 2,4% e 99,4% ± 0,6%, respectivamente. Isso mostra que o dispositivo tem uma alta eficiência de separação para contas com um tamanho de 10-μm.
A Figura 6 mostra imagens e um gráfico de números ligados a bactérias por conta. Foram coletados dados relativos à operação de chip de acoustopforese referentes ao alvo e amostras de resíduos na tomada e entrada, respectivamente. Todas as amostras foram submetidas a amostragem de 10-μL em tubos de coleta, e o número de bactérias ligadas a micróbios foi observado sob um microscópio de fluorescência. Muitas bactérias GN (por exemplo, E. Coli DH5α) estão ligadas a todas as contas, enquanto algumas bactérias GP (por exemplo, Listeria grayi) estão ligadas a algumas contas. Os números de bactérias GN e GP ligadas a cada micróbio modificado por aptamer (de 25 contas) foram medidos usando um microscópio com uma câmera de alta velocidade. Todas as cinco bactérias GN foram obrigadas a contas (4,96 ± 0,77 cada), enquanto significativamente menos bactérias GP foram ligadas às substâncias (0,08 ± 0,08 cada) testadas. A força do sinal difere significativamente entre as bactérias GN e GP. Esses dados confirmam que este dispositivo foi bem sucedido em isolar bactérias GN.
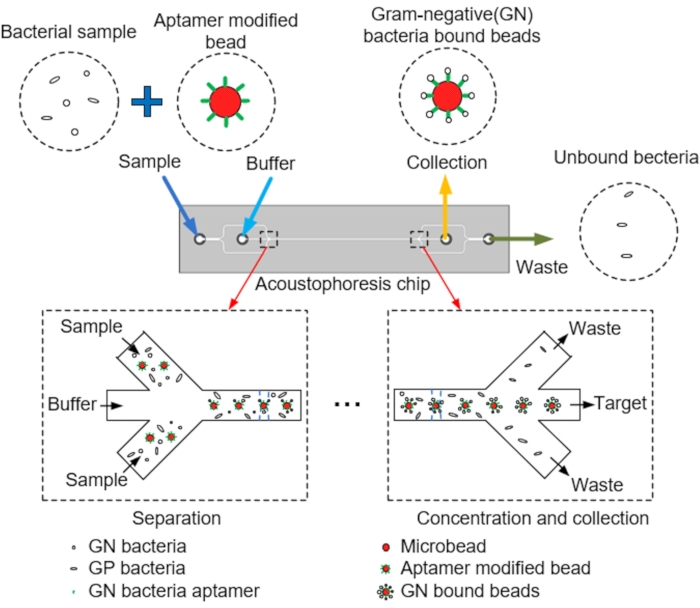
Figura 1: Esquema dos microcanais, alinhamento central das microesferas via acoustopforese e coleta dos alvos. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagem CAD do chip de acoustophorese microfluídica para separação de bactérias GN usando contas de afinidade de aptamer. (A) camada de canal de silício. (B) Camada de vidro superior. (Para as dimensões de 1 a 4, consulte a Tabela 1). Clique aqui para ver uma versão maior desta figura.

Figura 3: Estrutura do microdispositivo acoustopforesis. (A) Plano transversal (B) e (C) fotografia do dispositivo. Clique aqui para ver uma versão maior desta figura.
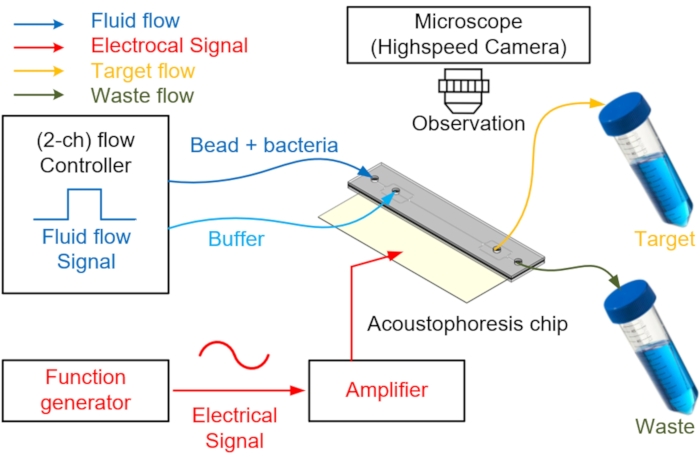
Figura 4: Esquema do sistema acoustofluido utilizado para separar e coletar células. A solução amostral ou tampão é injetada na porta de entrada através do controlador de fluxo. Para centralizar as contas e separar amostras, a energia CA é aplicada ao PZT através de um gerador de função com um amplificador de energia para gerar uma força de radiação acústica no microcanal. A amostra alvo separada é coletada através de um tubo de coleta, e o fluido de resíduo restante é recuperado através de outra tomada. Um módulo de câmera de alta velocidade é usado para visualizar a separação. Clique aqui para ver uma versão maior desta figura.

Figura 5: A imagem das contas flui em função da tensão PZT. (A) PZT OFF, (B) PZT 0.1 V, (C) PZT 0,5 V, (D) PZT 5 V. Clique aqui para ver uma versão maior desta figura.
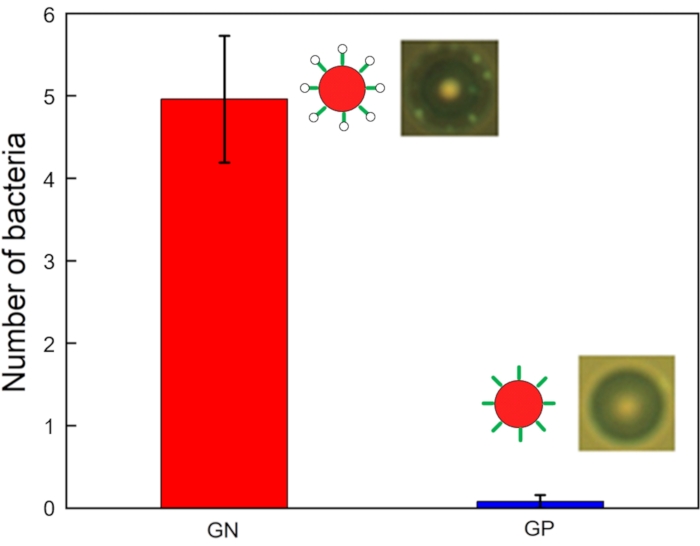
Figura 6: Números de GN (E. coli DH5α) e GP (Listeria grayi) bactérias ligadas a microesferas modificadas por aptamer (n = 25, barra de erro = erro padrão). Clique aqui para ver uma versão maior desta figura.
| Número | Dispositivo | Largura (W) ou Diâmetro (D) (μm) |
| 1 | Porta de entrada e saída (silício) | 1000 (D) |
| 2 | Canal microfluido | 200 (W) |
| 3 | Canal de entrada e saída | 400 (W) |
| 4 | Porta de entrada e saída (vidro) | 1500 (D) |
Tabela 1: Dimensões da plataforma microfluidica pneumática (1 a 4 na Figura 2).
| Bactérias GN | Bactérias GP |
| Escherichia coli (DH5α) | Bacillus megaterium (KCTC 1021) |
| Enterobacter cloacae | Staphylococcus epidermidis |
| Sphingomonas insulae | Listeria grayi |
| Escherichia coli KCTC 2571 | Enterococcus tailândia |
| Pictorum pseudomonas | Staphylococcus pasteuri |
Tabela 2: As bactérias GN e GP estudadas.
| Vazão na saída wate (μL/min) | Taxa de recuperação (%) | Pureza (%) |
| 400 (5x concetnration volumoso) | 98 ± 2.2 | 97,1 ± 3,6 |
| 450 (10x de concetnração volumosa) | 98 ± 2,5 | 97,6 ± 2.4 |
| 475 (20x de concetnrção volumosa) | 90 ± 9.8 | 99.4 ± 0.6 |
Tabela 3: Taxa de recuperação e pureza da separação.
Discussão
Desenvolvemos um dispositivo microfluido de levitação sônica para capturar e transferir bactérias GN de amostras de cultura em alta velocidade com base em um método de execução contínuo de acordo com seu tamanho e tipo, e microesferas modificadas por aptamer. O microcanal longo e quadrado permite um design mais simples e maior custo-benefício para a 2D acoustophoresis do que o relatado anteriormente 20,21,22,23,24,25,26. O dispositivo tem uma taxa de recuperação de >98% até uma concentração de 10x de dose. Este estudo mostra uma taxa de recuperação e pureza maiores do que os métodos existentes sem rótulos 20,21,22,23,24 e métodos de contas de afinidade 25,26 para separar bactérias. Isso sugere que o dispositivo pode separar as bactérias de forma eficiente. No entanto, como as contas de 10 μm podem fluir para os canais laterais, a taxa de recuperação é reduzida para 90% em uma concentração de dose de 20x devido à forte força de retirada decorrente da saída fechada bloqueando a radiação acústica em um teste de desempenho. Embora a taxa de recuperação do chip possa chegar a 98%, vários fatores reduzem a taxa de recuperação, como a precipitação de contas no inalador ou entupimento do tubo que liga o inalador ao chip.
Existem alguns pontos-chave necessários para fazer este chip acoustopforático e fazê-lo funcionar. O adesivo utilizado para fixar o PZT deve ser usado o mínimo possível para a precisão da corrugação e o PZT e o microcanal devem ser paralelos. Erros nesta etapa resultam na transmissão de formas de onda incorretas através do PZT para o chip, que se manifesta como desalinhamento de contas. Além disso, tenha cuidado ao operar, pois vários fatores podem piorar a taxa de recuperação, como a sedimentação de contas da seringa ou o bloqueio do tubo de conexão com lascas da seringa.
Este dispositivo não só pode ser usado para detectar bactérias vivas ou biomarcadores derivados de bactérias no campo do diagnóstico precoce de doenças infecciosas bacterianas, mas também pode ser estendido ao monitoramento da contaminação da água, o que ajudará a identificar bioterrorismo e infecções bacterianas patogênicas.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Pesquisa da Coreia (NRF) financiada pelo governo coreano (Ministério da Ciência e TIC). (Não. NRF-2021R1A2C1011380)
Materiais
| Name | Company | Catalog Number | Comments |
| 1 µm polystyrene microbeads | Bang Laboratories | PS04001 | Cell size beads |
| 10 µm Streptavidin-coated microbeads | Bang Laboratories | CP01007 | Aptamer affinity beads |
| 4-inch Silicon Wafer/SU-8 mold | 4science | 29-03573-01 | Components of chip |
| Aptamer | Integrated DNA Technologies | GN3-6' | RNA for bacteria conjugation |
| Borosilicate glass | Schott | BOROFLOAT 33 | Components of chip |
| Centrifuge | Daihan | CF-10 | Wasing particles |
| Cyanoacrylate glue | 3M | AD100 | Attach PZT to microchip |
| Escherichia coli DH5α | KCTC | KCTC2571 | Target bacteria |
| Functional generator | GW Instek | AFG-2225 | Generate frequency |
| High-speed camera | Photron | FASTCAM Mini | Observation of separation |
| Hot plate | As one | HI-1000 | Heating plate for curing of liquid PDMS |
| KOVAX-SYRINGE 10 mL Syringe | Koreavaccine | 22G-10ML | Fill the microfluidic acoustophoresis channel with bubble-free demineralized water. |
| Liquid polydimethylsiloxane, PDMS | Dow Corning Inc. | Sylgard 184 | Components of chip |
| LB Broth Miller | BD Difco | 244620 | Cell culture (Luria-Bertani medium) |
| Microscope | Olympus Corp. | IX-81 | Observation of separation |
| PBS buffer | Capricorn scientific | PBS-1A | Wasing bacteria |
| PEEK Tubes | Saint-Gobain Ppl Corp. | AAD04103 | Inject or collect particles |
| Piezoelectric transducer | Fuji Ceramics | C-213 | Generate specific wave in channel |
| Power amplifier | Amplifier Research | 75A250A | Amplify frequency |
| Pressure controller/μflucon | AMED | AMED-μflucon | Control of air pressure/flow controller |
| Tris-HCl buffer | invitrogen | 15567027 | Wasing particles |
| Tube rotator | SeouLin Bioscience | SLRM-3 | Modifiying aptamer and bead |
Referências
- Wu, M., et al. Acoustofluidic separation of cells and particles. Microsystem & Nanoengineering. 5 (1), 1-18 (2019).
- Lee, S. W., et al. Aptamer affinity-bead mediated capture and displacement of Gram-negative bacteria using acoustophoresis. Micromachines. 10 (11), 770(2019).
- Hirvonen, J. J., et al. One-step sample preparation of positive blood cultures for the direct detection of methicillin-sensitive and -resistant Staphylococcus aureus and methicillin-resistant coagulase-negative staphylococci within one hour using the automated GenomEra CDXTM PCR system. European Journal of Clinical Microbiology & Infectious Diseases. 31 (10), 2835-2842 (2012).
- Swaminathan, B., Feng, P. Rapid detection of food-borne pathogenic bacteria. Annual Review of Microbiology. 48 (1), 401-426 (1994).
- Ding, X., et al. On-chip manipulation of single microparticles, cells, and organisms using surface acoustic waves. Proceeding of the National Academy of Sciences of the United States of America. 109 (28), 11105-11109 (2012).
- Karthick, S., et al. Acoustic impedance-based size independent isolation of circulating tumor cells from blood using acoustophoresis. Lab on a Chip. 18 (24), 2802(2018).
- Lenshof, A., et al. Acoustofluidics 8: Applications of acoustophoresis in continuous flow microsystems. Lab on a Chip. 12 (7), 1210-1223 (2012).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS journal. 275 (22), 5657-5666 (2008).
- Klussmann, S. The aptamer handbook: Functional oligonucleotides and their applications. , John Wiley & Sons. Hoboken, New Jersey. (2006).
- Ellington, A., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346 (6287), 818-822 (1990).
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249 (4968), 505-510 (1990).
- Namnabat, M. S., et al. 3D numerical simulation of acoustophoretic motion induced by boundary-driven acoustic streaming in standing surface acoustic wave microfluidics. Scientific Reports. 11 (1), 11326(2021).
- Nimjee, S. M., et al. Aptamer as therapeutics. Annual Review of Pharmacology and Toxicology. 57, 61-79 (2017).
- Zhang, Y., et al. Recent advances in aptamer discovery and application. Molecules. 24 (5), 941(2019).
- Park, J. W., et al. Acousto-microfluidics for screening of ssDNA aptamer. Scientific Reports. 6 (1), 1-9 (2016).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS Journal. 275 (22), 5657-5666 (2008).
- Van Toan, N., et al. An investigation of processes for glass micromachining. Micromachines. 7 (3), 51(2016).
- Jansen, H., et al. A survey on the reactive ion etching of silicon in microtechnology. Journal of Micromechanics and Microengineering. 6 (1), 14(1996).
- Hanneborg, A., et al. Silicon-to-silicon anodic bonding with a borosilicate glass layer. Journal of Micromechanics and Microengineering. 1 (3), 139(1991).
- Mach, A. J., Di Carlo, D. Continuous scalable blood filtration device using inertial microfluidics. Biotechnology and bioengineering. 107 (2), 302-311 (2010).
- Wang, S., et al. Simple filter microchip for rapid separation of plasma and viruses from whole blood. International Journal of Nanomedicine. 7, 5019-5028 (2012).
- Ai, Y., et al. Separation of Escherichia coli bacteria from peripheral blood mononuclear cells using standing surface acoustic waves. Analytical Chemistry. 85 (19), 9126-9134 (2013).
- Ohlsson, P., et al. Acoustic impedance matched buffers enable separation of bacteria from blood cells at high cell concentrations. Scientific Reports. 8 (1), 1-11 (2018).
- Park, S., et al. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Kim, U., Soh, H. T. Simultaneous sorting of multiple bacterial targets using integrated Dielectrophoretic-Magnetic Activated Cell Sorter. Lab on a Chip. 9 (16), 2313-2318 (2009).
- Cai, G., et al. A fluidic device for immunomagnetic separation of foodborne bacteria using self-assembled magnetic nanoparticle chains. Micromachines. 9 (12), 624(2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados