Method Article
Auustofori microfluidica per la separazione flowthrough di batteri Gram-negativi utilizzando perline di affinità aptamero
In questo articolo
Riepilogo
Questo articolo descrive la fabbricazione e il funzionamento di chip acustoforetici microfluidici utilizzando la tecnica dell'acoustophoresis microfluidica e microsfere modificate con aptamero che possono essere utilizzate per un isolamento rapido ed efficiente di batteri Gram-negativi da un mezzo.
Abstract
Questo articolo descrive la fabbricazione e il funzionamento di chip acustoforetici microfluidici utilizzando una tecnica di acoustophoresis microfluidica e microsfere modificate con aptamero che possono essere utilizzate per l'isolamento rapido ed efficiente di batteri Gram-negativi da un mezzo. Questo metodo migliora l'efficienza di separazione utilizzando un mix di microcanali lunghi e quadrati. In questo sistema, il campione e il buffer vengono iniettati nella porta di ingresso attraverso un regolatore di flusso. Per il centraggio delle sfere e la separazione del campione, l'alimentazione CA viene applicata al trasduttore piezoelettrico tramite un generatore di funzioni con un amplificatore di potenza per generare forza di radiazione acustica nel microcanale. C'è un canale biforcato sia all'ingresso che all'uscita, consentendo la separazione, la purificazione e la concentrazione simultanee. Il dispositivo ha un tasso di recupero del >98% e una purezza del 97,8% fino a una concentrazione di dose 10x. Questo studio ha dimostrato un tasso di recupero e una purezza superiori ai metodi esistenti per separare i batteri, suggerendo che il dispositivo può separare i batteri in modo efficiente.
Introduzione
Sono in fase di sviluppo piattaforme microfluidiche per isolare batteri da campioni medici e ambientali, oltre a metodi basati su trasferimento dielettrico, magnetoforesi, estrazione di perline, filtraggio, microfluidica centrifuga ed effetti inerziali e onde acustiche superficiali 1,2. La rilevazione di batteri patogeni viene continuata utilizzando la reazione a catena della polimerasi (PCR), ma di solito è laboriosa, complessa e richiede tempo 3,4. I sistemi di acoustophoresis microfluidica sono un'alternativa per affrontare questo problema attraverso una produttività ragionevole e l'isolamento cellulare senza contatto 5,6,7. L'acoustophoresis è una tecnologia che separa o concentra le perle utilizzando il fenomeno del movimento del materiale attraverso un'onda sonora. Quando le onde sonore entrano nel microcanale, vengono ordinate in base alle dimensioni, alla densità, ecc. delle perle e le cellule possono essere separate in base alle proprietà biochimiche ed elettriche del mezzo di sospensione 7,8. Di conseguenza, molti studi acustoforetici sono stati attivamente perseguiti 9,10,11, e recentemente sono state introdotte simulazioni numeriche 3D del moto acustoforetico indotto dal flusso acustico guidato dal confine nella microfluidica delle onde acustiche della superficie stazionaria12.
Studi in vari campi stanno esaminando come sostituire gli anticorpi 2,3. L'aptamero è un materiale bersaglio con elevata selettività e specificità e molti studi sono in corso 2,9,10,13. Gli aptameri hanno vantaggi di piccole dimensioni, eccellente stabilità biologica, basso costo e alta riproducibilità rispetto agli anticorpi e sono in fase di studio in applicazioni diagnostiche e terapeutiche 2,3,14.
Qui, questo articolo descrive un protocollo tecnologico di acoustophoresis microfluidica che può essere utilizzato per la separazione rapida ed efficiente dei batteri Gram-negativi (GN) da un mezzo utilizzando microsfere modificate con aptamero. Questo sistema genera un'onda stazionaria acustica bidimensionale (2D) attraverso una singola attuazione piezoelettrica stimolando simultaneamente due risonanze ortogonali all'interno di un lungo microcanale rettangolare per allineare e focalizzare le microsfere attaccate all'aptamero nei punti del nodo e dell'antinodo per l'efficienza di separazione 2,11,15,16 . C'è un canale biforcato sia all'ingresso che all'uscita, consentendo la separazione, la purificazione e la concentrazione simultanee.
Questo protocollo può essere utile nel campo della diagnosi precoce delle malattie infettive batteriche, nonché una risposta rapida, selettiva e sensibile alle infezioni batteriche patogene attraverso il monitoraggio dell'acqua in tempo reale.
Protocollo
1. Progettazione di chip di acoustophoresis microfluidica
NOTA: La Figura 1 mostra uno schema della separazione e della raccolta delle microsfere target dai microcanali mediante acustoforesi. Il chip di acoustophoresis microfluidica è progettato con un programma CAD.
- Progettare un chip di acoustophoresis microfluidica che utilizza una miscela di perle modificate con aptamero e perle di polistirene (PS) rivestite di streptavidina corrispondenti alle dimensioni dei batteri per studiare le prestazioni di separazione del dispositivo.
- Progettare un chip di acoustophoresis microfluidica che raccolga le sfere di PS all'uscita di destinazione e scarti il resto attraverso l'uscita dopo aver iniettato una miscela di campioni PS nell'ingresso del campione (vedere Figura 2 e Tabella 1).
NOTA: A questo scopo, il chip acustofluidico è costituito da due ingressi per l'iniezione di campioni e tampone, un canale principale con un trasduttore piezoelettrico collegato (PZT) per consentire l'allineamento centrale delle microsfere e due uscite attraverso le quali vengono raccolti i campioni e scaricati i rifiuti (Figura 3A) - Progettare un chip di acoustophoresis microfluidica in cui microsfere, tampone, batteri e aptameri passano attraverso il canale principale, con le microsfere allineate centralmente tramite acoustophoresis indotta dal PZT (Figura 3B,C)
2. Fabbricazione di chip di acoustophoresis microfluidica
NOTA: assemblare quattro strati nell'ordine seguente: uno strato di vetro-silicio borosilicato, uno strato di silicio, uno strato di vetro borosilicato e uno strato PZT, come mostrato nella Figura 3A,B.
- Preparare il vetro borosilicato (lo strato più alto) con fori di 2 mm di diametro mediante sabbiatura17 all'ingresso e all'uscita per il collegamento di tubi in polietereterchetone (PEEK). Il vetro borosilicato misura 20 × 80 × 0,5 mm3.
- Preparare uno strato di canale del silicio spesso 200 μm con un microcanale con un'area di sezione trasversale di 0,2 × 0,2 mm2 formato utilizzando un fotoresist e un modello di silicio ottenuto mediante incisione ionica reattiva profonda (RIE)18. Praticare fori di 1 mm di diametro per i canali di ingresso del campione e del tampone e i canali di raccolta e di uscita dei rifiuti durante l'incisione ionica reattiva.
NOTA: Qui, l'incisione ionica utilizza il processo RIE per formare microcanali. Un fotoresist è stato applicato a forma di canale su un wafer di silicio per lo strato di canale di silicio. Il wafer di silicio rivestito PR è stato inciso con plasma generato applicando 13,56 Mhz al fluoro18. - Preparare un chip con gli strati sopra e sotto lo strato di silicio (20 × 80 × 0,5 mm 3) preparato nella fase 2.2 (20 × 80 × 0,5 mm3) incollato al vetro borosilicato nella fase 2.1 e un terzo strato di vetro borosilicato utilizzando l'anodizzazione a 1.000 V e 400 °C19.
- Attaccare un PZT (20 × 40 mm2) allo strato di vetro borosilicato lungo il canale microfluidico utilizzando un adesivo cianoacrilato (10 μL o meno).
NOTA: Applicare l'adesivo come uno strato molto sottile nel canale utilizzando un batuffolo di cotone per ridurre al minimo qualsiasi variazione di altezza. La Figura 3C è un'immagine del dispositivo.
3. Ceppi batterici e coltura
NOTA: Fare riferimento alla Tabella 2 per selezionare e incubare i batteri GN e Gram-positivi (GP) per gli esperimenti. Per il metodo della lingua, fare riferimento ai passaggi 3.1-3.4. Tutti i batteri devono essere incubati in condizioni aerobiche fino ad ottenere un'assorbanza di 0,4 a 600 nm (OD600).
- Per batteri GN come Escherichia coli DH5α, Escherichia coli KCTC2571, Sphingomonas insulae e Pseudomonas pictorum e batteri GP come Staphylococcus epidermidis e Staphylococcus pasteuri, incubare in terreno Luria-Bertani a 37 °C e 220 rpm per 16 ore.
- Per Enterobacter (GN) e Bacillus megaterium (GP; KCTC 1021), incubare in terreno di brodo nutritivo a 37 °C e 220 giri/min per 16 ore.
- Per Enterococcus thailandicus (GP), incubare in terreno de Man, Rogosa e Sharpe (MRS) a 37 °C e 220 giri/min per 16 ore.
- Per Listeria grayi (GP), incubare in terreno di infusione cardiaca cerebrale a 37 °C e 220 giri/min per 16 ore.
- Centrifugare (9056 x g) i batteri coltivati per 1 minuto a temperatura ambiente (RT), quindi lavare due volte con 1x tampone salino fosfato (PBS).
- Preparare i batteri GN e GP selezionati per l'analisi risospendendo nel tampone PBS.
4. Microsfere e immobilizzazione dell'aptamero su microsfere
- Risospendere la miscela di microsfere rivestite di streptavidina (10 μm) (Tabella dei materiali) prima dell'uso (mescolare tramite vortice per 20 s).
- Preparare l'aptamero denaturando a 95 °C per 3 minuti e poi ripiegando a 0 °C per 2 min.
- Trasferire 250 μL della miscela di microsfere ricoperte di streptavidina ricoperta in un tubo da 1,5 mL e lavare con tampone Tris-HCl (50 mM Tris, pH 7,4, 1 mM MgCl2, 5 mM KCL, 100 mM NaCl) a RT. Quindi aggiungere 100 μL di aptamero di DNA biotinilato alla provetta.
- Incubare la miscela a RT per 30 minuti durante la rotazione (25 rpm).
- Dopo centrifugazione (9056 x g), lavare il tubo due volte con 200 μL di tampone Tris-HCl a RT.
- Aggiungere 10 μL di BSA (100 mg/ml) alla provetta lavata e incubare per 30 minuti a RT con rotazione (25 giri/min).
- Infine, lavare due volte le microsfere modificate con aptamero mediante centrifugazione (9056 x g) in tampone Tris-HCl a RT.
5. Configurazione e funzionamento dell'acoustophoresis
- Collegare i tubi in PEEK ai due ingressi per iniettare due campioni e tampone e le due uscite per la raccolta e lo scarico dei rifiuti (Figura 4).
- Riempire manualmente il canale di acoustophoresis microfluidica con acqua demineralizzata priva di bolle utilizzando una siringa da 10 ml.
- Preparare un regolatore di pressione di precisione con due o più canali di uscita per controllare il flusso del fluido. Quindi, riempire a metà le fiale con campione e tampone con due fori nei loro cappucci, rispettivamente, e collegare all'ingresso del chip.
NOTA: Un regolatore di pressione di precisione con due o più canali di uscita può essere sostituito con più regolatori di pressione di precisione. All'ingresso del tampone, un tampone in grado di generare un flusso laminare che impedisce al campione di spostarsi verso il centro durante l'iniezione del campione viene iniettato attraverso un regolatore di flusso. - Dopo aver preparato il dispositivo, iniettare il campione e il tampone applicando una pressione di 2 kPa all'ingresso del campione e di 4 kPa all'ingresso del tampone utilizzando il dispositivo di controllo della pressione di precisione.
NOTA: In questo momento, per un flusso laminare regolare, la pressione di iniezione del tampone deve essere superiore alla pressione di iniezione del campione. Il flusso è controllato da un regolatore di flusso fissato all'aspiratore collegato al canale di ingresso. - Concentrarsi su una perlina per spostarla al centro del canale microfluidico utilizzando il PZT mentre si controlla attraverso il microscopio.
NOTA: più grande è il tallone, maggiore è l'effetto sulla forma d'onda, quindi è più facile allinearsi con il punto del nodo. Il generatore di funzioni con amplificatore applica potenza a PZT per generare onde sinusoidali nel microcanale. Poiché le porzioni superiore e inferiore del microcanale sono fatte di vetro, l'onda sinusoidale generata viene riflessa e crea un punto nodo7. - Generare una frequenza di risonanza di 3,66 MHz utilizzando un generatore di funzioni a canale singolo e amplificare un segnale tipico di 16 dB (circa nove volte) utilizzando un amplificatore di potenza (Figura 4).
NOTA: La frequenza di risonanza dell'attuatore deve corrispondere alla dimensione del canale; poiché il canale è quadrato, il PZT opera a una frequenza accurata per creare un singolo nodo. - Osservare i processi di separazione e arricchimento sul chip acustofluidico con un microscopio a fluorescenza e una telecamera ad alta velocità funzionante a 1.200 fps.
- Quantificare e analizzare la presenza o l'assenza di batteri GN e batteri GP controllando le immagini scattate con la fotocamera del microscopio a fluorescenza delle perle legate ai batteri e dei batteri scaricati attraverso i campioni di raccolta e di uscita dei rifiuti.
NOTA: Le microsfere con tampone, batteri e aptameri passano attraverso il canale principale e le microsfere sono allineate centralmente tramite l'acoustophoresis indotta dal PZT. Infine, le microsfere che hanno legato i batteri GN vengono raccolte all'uscita di raccolta e i batteri non raccolti vengono scaricati attraverso l'uscita dei rifiuti.
Risultati
La figura 5 mostra l'immagine del flusso del tallone in funzione della tensione PZT (OFF, 0,1 V, 0,5 V, 5 V). Nel caso del chip acustoforetico introdotto in questo studio, è stato confermato che all'aumentare della tensione del PZT, la concentrazione centrale delle perle di dimensioni 10 μm è aumentata. La maggior parte delle perle di dimensioni 10 μm erano concentrate al centro a 5 V della tensione PZT. Attraverso questo risultato, è stata generata una frequenza di risonanza di 3,66 MHz in un generatore di funzioni a canale singolo e un segnale generale è stato amplificato di 16 dB (circa 9 volte) utilizzando un amplificatore di potenza.
La Tabella 3 mostra che la miscela di microsfere di 1 μm (dimensione della cella) e 10 μm (tallone attaccato all'aptamero) è stata iniettata nel chip del fluido acustico utilizzato in questo studio e le prestazioni di separazione del truciolo in base alla portata di uscita (400, 450 e 475 μL / min) sono il risultato della valutazione. Il tasso di recupero è il rapporto tra il numero di perle raccolte all'uscita e il numero totale di perle iniettate per perle di dimensioni 10 μm, che erano rispettivamente del 98% ± 2,2%, 98% ± 2,5% e 90% ± 9,8%. La purezza è il rapporto tra il numero di perle di dimensioni 10-μm e il numero totale di perle raccolte, che erano rispettivamente 97,1% ± 3,6%, 97,6% ± 2,4% e 99,4% ± 0,6%. Ciò dimostra che il dispositivo ha un'elevata efficienza di separazione per perline con una dimensione di 10 μm.
La Figura 6 mostra immagini e un grafico dei numeri legati ai batteri per perla. I dati relativi al funzionamento del chip di acoustophoresis riguardanti i campioni target e di rifiuti sono stati raccolti rispettivamente all'uscita e all'ingresso. Tutti i campioni sono stati sottoposti a campionamento di 10 μL in provette di raccolta e il numero di batteri che si legano alle microsfere è stato osservato al microscopio a fluorescenza. Molti batteri GN (ad esempio, E. Coli DH5α) sono legati a tutte le perle, mentre alcuni batteri GP (ad esempio, Listeria grayi) sono legati ad alcune perle. Il numero di batteri GN e GP legati a ciascuna microsfere modificate con aptamero (di 25 perle) è stato misurato utilizzando un microscopio con una fotocamera ad alta velocità. Tutti e cinque i batteri GN erano legati alle perline (4,96 ± 0,77 ciascuno), mentre significativamente meno batteri GP erano legati alle sostanze (0,08 ± 0,08 ciascuna) testate. La potenza del segnale differiva significativamente tra i batteri GN e GP. Questi dati confermano che questo dispositivo è riuscito a isolare i batteri GN.
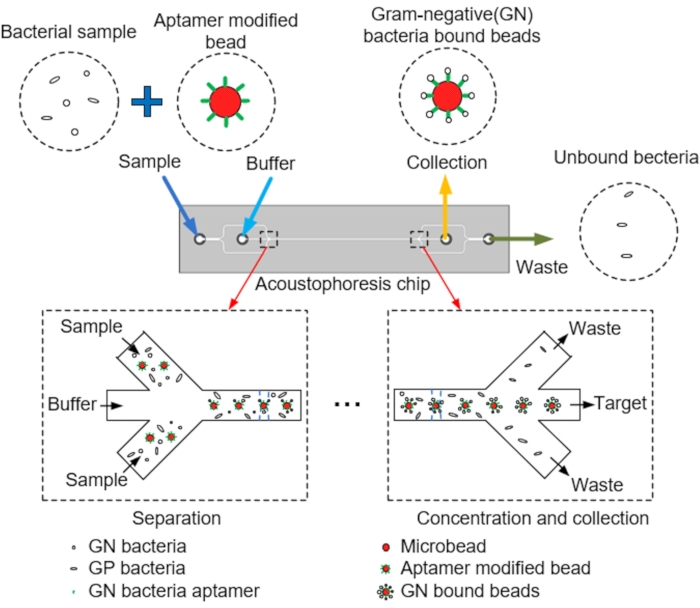
Figura 1: Schema dei microcanali, allineamento centrale delle microsfere tramite acustoforesi e raccolta dei target. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Immagine CAD del chip di acoustophoresis microfluidica per la separazione dei batteri GN utilizzando sfere di affinità aptamero . (A) Strato di canale del silicio. (B) Strato superiore di vetro. (Per le dimensioni da 1 a 4, vedere tabella 1). Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Struttura del microdispositivo di acoustophoresis . (A) Trama del pavimento, (B) pianta della sezione trasversale e (C) fotografia del dispositivo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
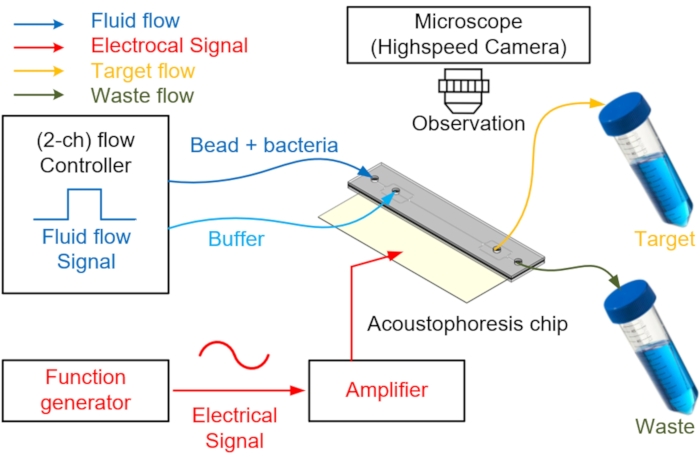
Figura 4: Schema del sistema acustofluidico utilizzato per separare e raccogliere le cellule. La soluzione campione o tampone viene iniettata nella porta di ingresso attraverso il regolatore di flusso. Per il centraggio delle sfere e la separazione del campione, l'alimentazione CA viene applicata al PZT tramite un generatore di funzioni con un amplificatore di potenza per generare una forza di radiazione acustica nel microcanale. Il campione target separato viene raccolto attraverso una provetta di raccolta e il fluido di scarto rimanente viene recuperato attraverso un'altra uscita. Un modulo telecamera ad alta velocità viene utilizzato per visualizzare la separazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Immagine del flusso delle perle in funzione della tensione PZT. (A) PZT OFF, (B) PZT 0,1 V, (C) PZT 0,5 V, (D) PZT 5 V. Fare clic qui per visualizzare una versione ingrandita di questa figura.
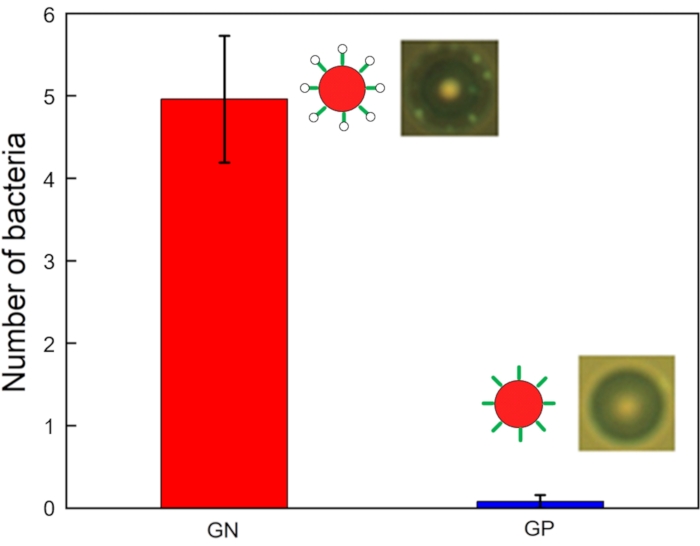
Figura 6: Numero di batteri GN (E. coli DH5α) e GP (Listeria grayi) legati a microsfere modificate con aptamero (n = 25 , barra di errore = errore standard). Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Numero | Dispositivo | Larghezza (W) o Diametro (D) (μm) |
| 1 | Porta di ingresso e uscita (silicio) | 1000 (D) |
| 2 | Canale microfluidico | 200 (V) |
| 3 | Canale di ingresso e uscita | 400 (V) |
| 4 | Porta di ingresso e uscita (vetro) | 1500 (D) |
Tabella 1: Dimensioni della piattaforma microfluidica pneumatica (da 1 a 4 nella figura 2).
| Batteri GN | Batteri GP |
| Escherichia coli (DH5α) | Bacillus megaterium (KCTC 1021) |
| Enterobacter cloacae | Staphylococcus epidermidis |
| Sphingomonas insulae | Listeria grayi |
| Escherichia coli KCTC 2571 | Enterococcus thailandicus |
| Pseudomonas pictorum | Staphylococcus pasteuri |
Tabella 2: I batteri GN e GP studiati.
| Portata all'uscita dell'olio (μL/min) | Tasso di recupero (%) | Purezza (%) |
| 400 (concetnration volumetrica 5x) | 98 ± 2.2 | 97,1 ± 3,6 |
| 450 (concetnration volumetrica 10x) | 98 ± 2,5 | 97,6 ± 2,4 |
| 475 (concetnration volumetrica 20x) | 90 ± 9,8 | 99,4 ± 0,6 |
Tabella 3: Tasso di recupero e purezza della separazione.
Discussione
Abbiamo sviluppato un dispositivo microfluidico a levitazione sonica per catturare e trasferire i batteri GN da campioni di coltura ad alta velocità basato su un metodo di funzionamento continuo in base alle loro dimensioni e tipo e microsfere modificate con aptamero. Il microcanale lungo e quadrato consente una progettazione più semplice e una maggiore efficienza in termini di costi per l'acoustophoresis 2D rispetto a 20,21,22,23,24,25,26 precedentemente riportati. Il dispositivo ha un tasso di recupero del >98% fino a una concentrazione di dose 10x. Questo studio mostra un tasso di recupero e una purezza più elevati rispetto ai metodi esistenti senza etichetta 20,21,22,23,24 e ai metodi di affinità 25,26 per separare i batteri. Ciò suggerisce che il dispositivo può separare i batteri in modo efficiente. Tuttavia, poiché le sfere da 10 μm possono fluire nei canali laterali, il tasso di recupero viene ridotto al 90% a una concentrazione di dose 20x a causa della forte forza di ritiro derivante dall'uscita chiusa che blocca la radiazione acustica in un test delle prestazioni. Mentre il tasso di recupero sul chip può raggiungere il 98%, diversi fattori riducono il tasso di recupero, come la precipitazione di perline nell'inalatore o l'intasamento del tubo che collega l'inalatore al chip.
Ci sono alcuni punti chiave necessari per rendere questo chip acustoforetico e farlo funzionare. L'adesivo utilizzato per fissare il PZT deve essere usato il meno possibile per la precisione dell'ondulazione e il PZT e il microcanale devono essere paralleli. Gli errori in questa fase provocano la trasmissione di forme d'onda errate attraverso il PZT al chip, che si manifesta come disallineamento delle perline. Inoltre, prestare attenzione durante il funzionamento, poiché diversi fattori possono peggiorare il tasso di recupero, come la sedimentazione delle perle dalla siringa o il blocco del tubo di collegamento con i trucioli della siringa.
Questo dispositivo non solo può essere utilizzato per rilevare batteri vivi o biomarcatori di origine batterica nel campo della diagnosi precoce delle malattie infettive batteriche, ma può anche essere esteso al monitoraggio della contaminazione dell'acqua, che aiuterà a identificare il bioterrorismo e le infezioni batteriche patogene.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla sovvenzione della National Research Foundation of Korea (NRF) finanziata dal governo coreano (Ministero della Scienza e delle TIC). (No. NRF-2021R1A2C1011380)
Materiali
| Name | Company | Catalog Number | Comments |
| 1 µm polystyrene microbeads | Bang Laboratories | PS04001 | Cell size beads |
| 10 µm Streptavidin-coated microbeads | Bang Laboratories | CP01007 | Aptamer affinity beads |
| 4-inch Silicon Wafer/SU-8 mold | 4science | 29-03573-01 | Components of chip |
| Aptamer | Integrated DNA Technologies | GN3-6' | RNA for bacteria conjugation |
| Borosilicate glass | Schott | BOROFLOAT 33 | Components of chip |
| Centrifuge | Daihan | CF-10 | Wasing particles |
| Cyanoacrylate glue | 3M | AD100 | Attach PZT to microchip |
| Escherichia coli DH5α | KCTC | KCTC2571 | Target bacteria |
| Functional generator | GW Instek | AFG-2225 | Generate frequency |
| High-speed camera | Photron | FASTCAM Mini | Observation of separation |
| Hot plate | As one | HI-1000 | Heating plate for curing of liquid PDMS |
| KOVAX-SYRINGE 10 mL Syringe | Koreavaccine | 22G-10ML | Fill the microfluidic acoustophoresis channel with bubble-free demineralized water. |
| Liquid polydimethylsiloxane, PDMS | Dow Corning Inc. | Sylgard 184 | Components of chip |
| LB Broth Miller | BD Difco | 244620 | Cell culture (Luria-Bertani medium) |
| Microscope | Olympus Corp. | IX-81 | Observation of separation |
| PBS buffer | Capricorn scientific | PBS-1A | Wasing bacteria |
| PEEK Tubes | Saint-Gobain Ppl Corp. | AAD04103 | Inject or collect particles |
| Piezoelectric transducer | Fuji Ceramics | C-213 | Generate specific wave in channel |
| Power amplifier | Amplifier Research | 75A250A | Amplify frequency |
| Pressure controller/μflucon | AMED | AMED-μflucon | Control of air pressure/flow controller |
| Tris-HCl buffer | invitrogen | 15567027 | Wasing particles |
| Tube rotator | SeouLin Bioscience | SLRM-3 | Modifiying aptamer and bead |
Riferimenti
- Wu, M., et al. Acoustofluidic separation of cells and particles. Microsystem & Nanoengineering. 5 (1), 1-18 (2019).
- Lee, S. W., et al. Aptamer affinity-bead mediated capture and displacement of Gram-negative bacteria using acoustophoresis. Micromachines. 10 (11), 770(2019).
- Hirvonen, J. J., et al. One-step sample preparation of positive blood cultures for the direct detection of methicillin-sensitive and -resistant Staphylococcus aureus and methicillin-resistant coagulase-negative staphylococci within one hour using the automated GenomEra CDXTM PCR system. European Journal of Clinical Microbiology & Infectious Diseases. 31 (10), 2835-2842 (2012).
- Swaminathan, B., Feng, P. Rapid detection of food-borne pathogenic bacteria. Annual Review of Microbiology. 48 (1), 401-426 (1994).
- Ding, X., et al. On-chip manipulation of single microparticles, cells, and organisms using surface acoustic waves. Proceeding of the National Academy of Sciences of the United States of America. 109 (28), 11105-11109 (2012).
- Karthick, S., et al. Acoustic impedance-based size independent isolation of circulating tumor cells from blood using acoustophoresis. Lab on a Chip. 18 (24), 2802(2018).
- Lenshof, A., et al. Acoustofluidics 8: Applications of acoustophoresis in continuous flow microsystems. Lab on a Chip. 12 (7), 1210-1223 (2012).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS journal. 275 (22), 5657-5666 (2008).
- Klussmann, S. The aptamer handbook: Functional oligonucleotides and their applications. , John Wiley & Sons. Hoboken, New Jersey. (2006).
- Ellington, A., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346 (6287), 818-822 (1990).
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249 (4968), 505-510 (1990).
- Namnabat, M. S., et al. 3D numerical simulation of acoustophoretic motion induced by boundary-driven acoustic streaming in standing surface acoustic wave microfluidics. Scientific Reports. 11 (1), 11326(2021).
- Nimjee, S. M., et al. Aptamer as therapeutics. Annual Review of Pharmacology and Toxicology. 57, 61-79 (2017).
- Zhang, Y., et al. Recent advances in aptamer discovery and application. Molecules. 24 (5), 941(2019).
- Park, J. W., et al. Acousto-microfluidics for screening of ssDNA aptamer. Scientific Reports. 6 (1), 1-9 (2016).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS Journal. 275 (22), 5657-5666 (2008).
- Van Toan, N., et al. An investigation of processes for glass micromachining. Micromachines. 7 (3), 51(2016).
- Jansen, H., et al. A survey on the reactive ion etching of silicon in microtechnology. Journal of Micromechanics and Microengineering. 6 (1), 14(1996).
- Hanneborg, A., et al. Silicon-to-silicon anodic bonding with a borosilicate glass layer. Journal of Micromechanics and Microengineering. 1 (3), 139(1991).
- Mach, A. J., Di Carlo, D. Continuous scalable blood filtration device using inertial microfluidics. Biotechnology and bioengineering. 107 (2), 302-311 (2010).
- Wang, S., et al. Simple filter microchip for rapid separation of plasma and viruses from whole blood. International Journal of Nanomedicine. 7, 5019-5028 (2012).
- Ai, Y., et al. Separation of Escherichia coli bacteria from peripheral blood mononuclear cells using standing surface acoustic waves. Analytical Chemistry. 85 (19), 9126-9134 (2013).
- Ohlsson, P., et al. Acoustic impedance matched buffers enable separation of bacteria from blood cells at high cell concentrations. Scientific Reports. 8 (1), 1-11 (2018).
- Park, S., et al. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Kim, U., Soh, H. T. Simultaneous sorting of multiple bacterial targets using integrated Dielectrophoretic-Magnetic Activated Cell Sorter. Lab on a Chip. 9 (16), 2313-2318 (2009).
- Cai, G., et al. A fluidic device for immunomagnetic separation of foodborne bacteria using self-assembled magnetic nanoparticle chains. Micromachines. 9 (12), 624(2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon