Method Article
الرحلان الصوتي الموائع الدقيقة للفصل المتدفق للبكتيريا سالبة الجرام باستخدام حبات تقارب أبتامر
In This Article
Summary
تصف هذه الورقة تصنيع وتشغيل رقائق التحلل الصوتي الموائع الدقيقة باستخدام تقنية الرحلان الأكوستوفوريزي الموائع الدقيقة والميكروبيدات المعدلة بواسطة aptamer والتي يمكن استخدامها للعزل السريع والفعال للبكتيريا سالبة الجرام من الوسط.
Abstract
توضح هذه المقالة تصنيع وتشغيل رقائق الرحلان الأكوستوفورتيك الموائع الدقيقة باستخدام تقنية الرحلان الأجوستوفوريزي الموائع الدقيقة والميكروبيدات المعدلة بواسطة aptamer والتي يمكن استخدامها للعزل السريع والفعال للبكتيريا سالبة الجرام من الوسط. تعزز هذه الطريقة كفاءة الفصل باستخدام مزيج من القنوات الدقيقة الطويلة والمربعة. في هذا النظام، يتم حقن العينة والمخزن المؤقت في منفذ المدخل من خلال وحدة تحكم في التدفق. بالنسبة لتمركز الخرز وفصل العينات، يتم تطبيق طاقة التيار المتردد على محول الطاقة الكهرضغطية عبر مولد وظيفي مع مضخم طاقة لتوليد قوة إشعاع صوتي في القناة الدقيقة. هناك قناة متشعبة في كل من المدخل والمخرج ، مما يتيح الفصل والتنقية والتركيز في وقت واحد. يحتوي الجهاز على معدل استرداد يبلغ >98٪ ونقاء 97.8٪ حتى تركيز جرعة 10x. أظهرت هذه الدراسة معدل استرداد ونقاء أعلى من الطرق الحالية لفصل البكتيريا ، مما يشير إلى أن الجهاز يمكنه فصل البكتيريا بكفاءة.
Introduction
ويجري تطوير منصات الموائع الدقيقة لعزل البكتيريا عن العينات الطبية والبيئية، بالإضافة إلى الطرق القائمة على النقل العازل للكهرباء، والرحلان المغناطيسي، واستخراج الخرز، والترشيح، والموائع الدقيقة بالطرد المركزي والتأثيرات بالقصور الذاتي، والموجات الصوتية السطحية 1,2. يستمر الكشف عن البكتيريا المسببة للأمراض باستخدام تفاعل البوليميراز المتسلسل (PCR) ، ولكنه عادة ما يكون شاقا ومعقدا ومستهلكا للوقت 3,4. تعد أنظمة الرحلان الأيكولومبي الموائع الدقيقة بديلا لمعالجة ذلك من خلال الإنتاجية المعقولة وعزل الخلايا غير الملامسة5،6،7. الرحلان الصوتي هو تقنية تفصل أو تركز الخرز باستخدام ظاهرة حركة المواد من خلال موجة صوتية. عندما تدخل الموجات الصوتية إلى القناة الدقيقة ، يتم فرزها وفقا لحجم الخرز وكثافته وما إلى ذلك ، ويمكن فصل الخلايا وفقا للخصائص الكيميائية الحيوية والكهربائية لوسط التعليق 7,8. وفقا لذلك ، تم متابعة العديد من الدراسات الصوتية بنشاط9،10،11 ، ومؤخرا ، تم إدخال المحاكاة العددية ثلاثية الأبعاد للحركة الصوتية الناجمة عن التدفق الصوتي المدفوع بالحدود في الموائع الدقيقة للموجة الصوتية السطحية الدائمة12.
تدرس الدراسات في مختلف المجالات كيفية استبدال الأجسام المضادة 2,3. Aptamer هي مادة مستهدفة ذات انتقائية وخصوصية عالية ، ويتم إجراء العديد من الدراسات2،9،10،13. تتميز Aptamers بصغر حجمها ، والاستقرار البيولوجي الممتاز ، والتكلفة المنخفضة ، وقابلية التكاثر العالية مقارنة بالأجسام المضادة ويتم دراستها في التطبيقات التشخيصية والعلاجية2،3،14.
هنا ، تصف هذه المقالة بروتوكول تقنية الرحلان الأكوستوفوريزي الموائع الدقيقة التي يمكن استخدامها للفصل السريع والفعال للبكتيريا سالبة الجرام (GN) عن وسط باستخدام الميكروبيدات المعدلة بواسطة aptamer. يولد هذا النظام موجة صوتية دائمة ثنائية الأبعاد (2D) من خلال تشغيل كهرضغطي واحد عن طريق تحفيز رنين متعامدين في وقت واحد داخل قناة دقيقة مستطيلة طويلة لمحاذاة وتركيز الميكروبيدات المرتبطة ب aptamer في العقدة ونقاط مضادة للعقدة لكفاءة الفصل 2,11,15,16 . هناك قناة متشعبة في كل من المدخل والمخرج ، مما يتيح الفصل والتنقية والتركيز في وقت واحد.
يمكن أن يكون هذا البروتوكول مفيدا في مجال التشخيص المبكر للأمراض المعدية البكتيرية ، بالإضافة إلى استجابة سريعة وانتقائية وحساسة للعدوى البكتيرية المسببة للأمراض من خلال مراقبة المياه في الوقت الفعلي.
Protocol
1. تصميم رقاقة الرحلان الفموائع الدقيقة
ملاحظة: يوضح الشكل 1 مخططا لفصل وجمع الميكروبيدات المستهدفة من القنوات الدقيقة بواسطة الرحلان الأوكوستوبيريس. تم تصميم رقاقة الرحلان الأيكولومبي الموائع الدقيقة باستخدام برنامج CAD.
- تصميم رقاقة الرحلان الأكوستوفوريسيس الموائع الدقيقة التي تستخدم مزيجا من الخرز المعدل من أبتامر وحبات البوليسترين المطلية بالستربتافيدين (PS) المقابلة لحجم البكتيريا لدراسة أداء الفصل للجهاز.
- صمم رقاقة الرحلان الأيكولومبي الموائع الدقيقة التي تجمع حبات PS عند المخرج المستهدف وتتخلص من الباقي من خلال المخرج بعد حقن خليط عينة PS في مدخل العينة (انظر الشكل 2 والجدول 1).
ملاحظة: لهذا الغرض، تم تصميم رقاقة المfluidic الصوتية التي تتكون من مدخلين لحقن العينات والمخزن المؤقت، وقناة رئيسية مع محول كهرضغطي متصل (PZT) للسماح بمحاذاة الميكروبيدات مركزيا، ومنفذين يتم من خلالهما جمع العينات وتصريف النفايات (الشكل 3A) - تصميم رقاقة الرحلان الأجوستوفوريزي الموائع الدقيقة التي تمر فيها الميكروبيدات والعازلة والبكتيريا والأبتامير عبر القناة الرئيسية ، مع محاذاة الميكروبيدات مركزيا عبر الرحلان الأكوتوتوبوريسي داخل الرقاقة الناجم عن PZT (الشكل 3B ، C)
2. تصنيع رقاقة الرحلان الأكوستوفوريزي ميكروفلويديك
ملاحظة: قم بتجميع أربع طبقات بالترتيب التالي: طبقة من زجاج البورسليكات والسيليكون، وطبقة من السيليكون، وطبقة من زجاج البورسليكات، وطبقة PZT، كما هو موضح في الشكل 3A، B.
- قم بإعداد زجاج البورسليكات (الطبقة العليا) مع ثقوب قطرها 2 مم بواسطة الرمل17 عند المدخل والمخرج لتوصيل أنابيب البولي إيثركيتون (PEEK). زجاج البورسليكات يقيس 20 × 80 × 0.5 مم3.
- قم بإعداد طبقة قناة سيليكون بسماكة 200 ميكرومتر مع قناة صغيرة بمساحة مقطع عرضي تبلغ 0.2 × 0.2 مم2 تم تشكيلها باستخدام مقاومة للضوء ونمط سيليكون تم الحصول عليه عن طريق نقش الأيونات التفاعلية العميقة (RIE)18. حفر ثقوب قطرها 1 مم لقنوات مدخل العينة والمخزن المؤقت وقنوات الجمع ومخرج النفايات أثناء الحفر الأيوني التفاعلي.
ملاحظة: هنا ، يستخدم الحفر الأيوني عملية RIE لتشكيل قنوات صغيرة. تم تطبيق مقاومة للضوء على شكل قناة على رقاقة سيليكون لطبقة قناة السيليكون. تم حفر رقاقة السيليكون المغلفة بالعلاقات العامة بالبلازما الناتجة عن تطبيق 13.56 ميجاهرتز على الفلور18. - قم بإعداد شريحة تحتوي على طبقات أعلى وأسفل طبقة السيليكون (20 × 80 × 0.5 مم 3) محضرة في الخطوة 2.2 (20 × 80 × 0.5 مم3) مرتبطة بزجاج البورسليكات في الخطوة 2.1 وطبقة زجاجية ثالثة من البورسليكات باستخدام الأنودة عند 1000 فولت و 400 درجة مئوية19.
- قم بتوصيل PZT (20 × 40 مم2) بطبقة زجاج البورسليكات على طول قناة الموائع الدقيقة باستخدام مادة لاصقة cyanoacrylate (10 ميكرولتر أو أقل).
ملاحظة: ضع المادة اللاصقة كطبقة رقيقة جدا في القناة باستخدام قطعة قطن لتقليل أي تغيير في الارتفاع. الشكل 3C هو صورة للجهاز.
3. السلالات البكتيرية والثقافة
ملاحظة: ارجع إلى الجدول 2 لاختيار واحتضان بكتيريا GN والبكتيريا إيجابية الجرام (GP) للتجارب. للحصول على طريقة الثقافة، راجع الخطوات 3.1-3.4. يجب احتضان جميع البكتيريا تحت الظروف الهوائية حتى يتم الحصول على امتصاص 0.4 عند 600 نانومتر (OD600).
- بالنسبة لبكتيريا GN مثل الإشريكية القولونية DH5α والإشريكية القولونية KCTC2571 وسولات Sphingomonas وبكتيريا Pseudomonas pictorum و GP مثل المكورات العنقودية الجلدية والمكورات العنقودية المعكرونة ، تحضن في وسط لوريا بيرتاني عند 37 درجة مئوية و 220 دورة في الدقيقة لمدة 16 ساعة.
- للبكتيريا المعوية (GN) وعصية ميغاتيريوم (GP; KCTC 1021) ، تحضن في وسط مرق المغذيات عند 37 درجة مئوية و 220 دورة في الدقيقة لمدة 16 ساعة.
- بالنسبة للمكورات المعوية التايلاندية (GP) ، احتضن في وسط دي مان وروجوسا وشارب (MRS) عند 37 درجة مئوية و 220 دورة في الدقيقة لمدة 16 ساعة.
- بالنسبة لليستريا غراي (GP) ، احتضن في وسط ضخ قلب الدماغ عند 37 درجة مئوية و 220 دورة في الدقيقة لمدة 16 ساعة.
- جهاز طرد مركزي (9056 × جم) البكتيريا المستزرعة لمدة 1 دقيقة في درجة حرارة الغرفة (RT) ، ثم يغسل مرتين باستخدام 1x المخزن الملحي المخزن بالفوسفات (PBS).
- قم بإعداد بكتيريا GN و GP المحددة للتحليل عن طريق التعليق في المخزن المؤقت PBS.
4. الميكروبيدات وتجميد أبتامر على الميكروبيدات
- أعد تعليق خليط الميكروبيدات المغلفة بالستربتافيدين (10 ميكرومتر) (جدول المواد) قبل الاستخدام (اخلطه عبر دوامة لمدة 20 ثانية).
- تحضير aptamer عن طريق تمسخ في 95 درجة مئوية لمدة 3 دقائق ثم إعادة طيها عند 0 درجة مئوية لمدة 2 دقيقة.
- انقل 250 ميكرولتر من خليط الميكروبيدات المطلية بالستربتافيدين المعاد تعليقه إلى أنبوب 1.5 مل واغسله باستخدام المخزن المؤقت Tris-HCl (50 mM Tris، الرقم الهيدروجيني 7.4، 1 mM MgCl2، 5 mM KCL، 100 mM NaCl) في RT. ثم أضف 100 ميكرولتر من أبتمير الحمض النووي البيوتينيل إلى الأنبوب.
- احتضن الخليط في RT لمدة 30 دقيقة أثناء الدوران (25 دورة في الدقيقة).
- بعد الطرد المركزي (9056 × جم) ، اغسل الأنبوب مرتين باستخدام 200 ميكرولتر من المخزن المؤقت Tris-HCl في RT.
- أضف 10 ميكرولتر من BSA (100 ملغم / مل) إلى أنبوب العينة المغسول واحتضنه لمدة 30 دقيقة في RT مع الدوران (25 دورة في الدقيقة).
- أخيرا ، اغسل الميكروبيدات المعدلة بواسطة aptamer مرتين عن طريق الطرد المركزي (9056 × g) في المخزن المؤقت Tris-HCl في RT.
5. إعداد وتشغيل الرحلان الصوتي
- قم بتوصيل أنابيب PEEK بالمدخلين لحقن عينتين ومخزن مؤقت ومنفذين لجمع النفايات وتفريغها (الشكل 4).
- املأ يدويا قناة الرحلان الأكوستوفوريسيس الموائع الدقيقة بالماء الخالي من الفقاعات باستخدام حقنة 10 مل.
- قم بإعداد وحدة تحكم في الضغط الدقيق مع قناتي إخراج أو أكثر للتحكم في تدفق السوائل. بعد ذلك ، قم بملء نصف القوارير بالعينة والمخزن المؤقت مع ثقبين في قبعاتها ، على التوالي ، والاتصال بمدخل الشريحة.
ملاحظة: يمكن استبدال وحدة التحكم في الضغط الدقيق المزودة بقناتي إخراج أو أكثر بوحدات تحكم متعددة في الضغط الدقيق. عند مدخل المخزن المؤقت، يتم حقن مخزن مؤقت قادر على توليد تدفق صفائحي يمنع العينة من الانتقال إلى المركز أثناء حقن العينة من خلال وحدة تحكم في التدفق. - بعد تحضير الجهاز ، قم بحقن العينة والمخزن المؤقت عن طريق تطبيق ضغط قدره 2 كيلو باسكال على مدخل العينة و 4 كيلو باسكال على مدخل المخزن المؤقت باستخدام جهاز التحكم الدقيق في الضغط.
ملاحظة: في هذا الوقت ، من أجل التدفق الرقائقي السلس ، يجب أن يكون ضغط الحقن للمخزن المؤقت أعلى من ضغط الحقن للعينة. يتم التحكم في التدفق بواسطة وحدة تحكم في التدفق مثبتة على الشافطة المتصلة بقناة المدخل. - ركز على حبة لنقلها إلى مركز قناة الموائع الدقيقة باستخدام PZT أثناء التحقق من خلال المجهر.
ملاحظة: كلما كانت الخرزة أكبر ، زاد التأثير على الشكل الموجي ، لذلك من الأسهل المحاذاة مع نقطة العقدة. مولد وظيفة مع مكبر للصوت يطبق الطاقة على PZT لتوليد موجة جيبية في القناة الصغيرة. نظرا لأن الأجزاء العلوية والسفلية من القناة الدقيقة مصنوعة من الزجاج ، فإن الموجة الجيبية المتولدة تنعكس وتخلق نقطة عقدة7. - توليد تردد رنين يبلغ 3.66 ميغاهيرتز باستخدام مولد دالة أحادي القناة وتضخيم إشارة نموذجية بمقدار 16 ديسيبل (حوالي تسعة أضعاف) باستخدام مضخم طاقة (الشكل 4).
ملاحظة: يجب أن يتطابق تردد الرنين للمشغل مع حجم القناة. نظرا لأن القناة مربعة ، تعمل PZT بتردد دقيق لإنشاء عقدة واحدة. - راقب عمليات الفصل والتخصيب على رقاقة الموائع الصوتية باستخدام مجهر فلوري وكاميرا عالية السرعة تعمل بمعدل 1200 إطار في الثانية.
- تحديد وتحليل وجود أو عدم وجود بكتيريا GN وبكتيريا GP عن طريق التحقق من الصور التي تم التقاطها باستخدام كاميرا المجهر الفلوري للخرز المرتبط بالبكتيريا والبكتيريا التي يتم تفريغها من خلال عينات الجمع ومخرج النفايات.
ملاحظة: تمر الميكروبيدات ذات العازلة والبكتيريا و aptamers عبر القناة الرئيسية ، ويتم محاذاة الميكروبيدات مركزيا عبر الرحلان الأكوتوفوريسيس داخل الشريحة الناجم عن PZT. وأخيرا، يتم جمع الميكروبيدات التي ربطت بكتيريا GN في منفذ التجميع، ويتم تصريف البكتيريا غير المجمعة من خلال منفذ النفايات.
النتائج
يوضح الشكل 5 صورة تدفق الخرز كدالة لجهد PZT (إيقاف التشغيل ، 0.1 فولت ، 0.5 فولت ، 5 فولت). في حالة الشريحة الصوتية التي تم إدخالها في هذه الدراسة ، تم التأكيد على أنه مع زيادة جهد PZT ، زاد التركيز المركزي للخرز بحجم 10 ميكرومتر. تركزت معظم الخرز بحجم 10 ميكرومتر في الوسط عند 5 فولت من جهد PZT. ومن خلال هذه النتيجة، تم توليد تردد رنين يبلغ 3.66 ميغاهيرتز في مولد دالة أحادي القناة، وتم تضخيم إشارة عامة بمقدار 16 ديسيبل (حوالي 9 مرات) باستخدام مضخم طاقة.
ويبين الجدول 3 أن خليط الميكروبيدات البالغ 1 ميكرومتر (حجم الخلية) و 10 ميكرومتر (حبة أبتامر المرفقة) قد تم حقنه في رقاقة السائل الصوتي المستخدمة في هذه الدراسة، وكان أداء فصل الرقاقة وفقا لمعدل تدفق المخرج (400 و 450 و 475 ميكرولتر/دقيقة) نتيجة للتقييم. معدل الاسترداد هو نسبة عدد الخرز الذي تم جمعه في المخرج إلى إجمالي عدد الخرز المحقون لخرز بحجم 10 ميكرومتر ، والتي كانت 98٪ ± 2.2٪ ، و 98٪ ± 2.5٪ ، و 90٪ ± 9.8٪ على التوالي. النقاء هو نسبة عدد الخرز بحجم 10 ميكرومتر إلى إجمالي عدد الخرز الذي تم جمعه ، والذي كان 97.1٪ ± 3.6٪ ، 97.6٪ ± 2.4٪ ، و 99.4٪ ± 0.6٪ على التوالي. هذا يدل على أن الجهاز لديه كفاءة فصل عالية للخرز بحجم 10-μm.
يوضح الشكل 6 صورا ورسما بيانيا للأعداد المرتبطة بالبكتيريا لكل خرزة. تم جمع البيانات المتعلقة بتشغيل رقاقة الرحلان الأكوستوفوريسيس فيما يتعلق بعينات الهدف والنفايات في المخرج والمدخل ، على التوالي. وتعرضت جميع العينات لأخذ عينات بسعة 10 ميكرولتر في أنابيب التجميع، ولوحظ عدد البكتيريا المرتبطة بالميكروبيدات تحت المجهر الفلوري. العديد من بكتيريا GN (على سبيل المثال ، E. القولونيه DH5α) مرتبطة بجميع الخرز ، في حين أن بعض بكتيريا GP (على سبيل المثال ، Listeria grayi) مرتبطة ببعض الخرز. تم قياس أعداد بكتيريا GN و GP المرتبطة بكل ميكروبة معدلة بواسطة aptamer (من 25 خرزة) باستخدام مجهر مزود بكاميرا عالية السرعة. كانت جميع بكتيريا GN الخمسة مرتبطة بالخرز (4.96 ± 0.77 لكل منهما) ، في حين أن عددا أقل بكثير من بكتيريا GP كانت مرتبطة بالمواد التي تم اختبارها (0.08 ± 0.08 لكل منها). اختلفت قوة الإشارة اختلافا كبيرا بين بكتيريا GN و GP. تؤكد هذه البيانات أن هذا الجهاز كان ناجحا في عزل بكتيريا GN.
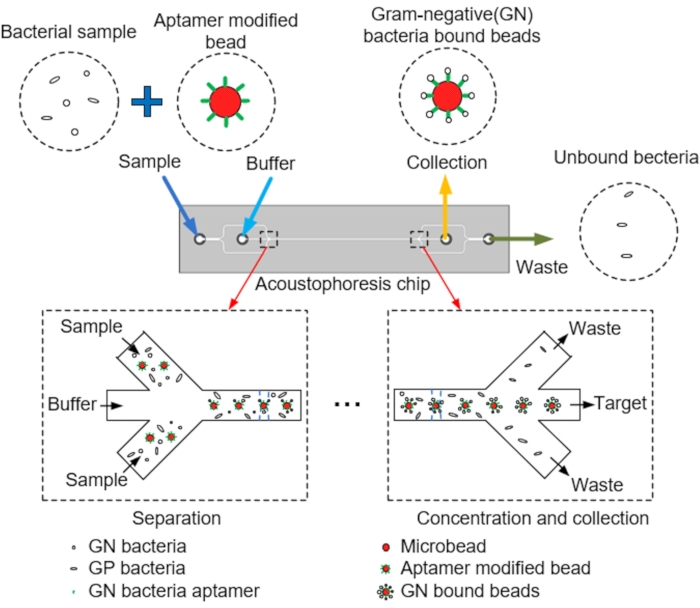
الشكل 1: مخطط القنوات الدقيقة، والمحاذاة المركزية للميكروبيدات عبر الرحلان الصوتي، وجمع الأهداف.

الشكل 2: صورة CAD لرقاقة الرحلان الأكوستوفوريزي الموائع الدقيقة لفصل بكتيريا GN باستخدام حبات تقارب aptamer . (A) طبقة قناة السيليكون. (ب) الطبقة الزجاجية العليا. (للاطلاع على أبعاد من 1 إلى 4، انظر الجدول 1). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: هيكل الجهاز المجهري للهروب الحيوي . (أ) مخطط الأرضية ، (ب) مخطط المقطع العرضي ، و (ج) صورة فوتوغرافية للجهاز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
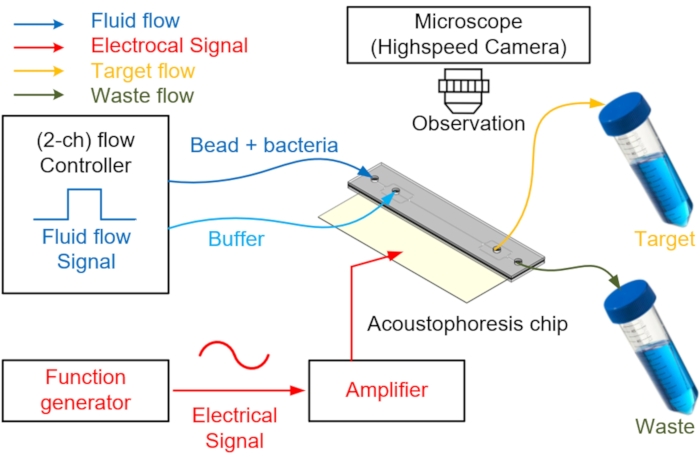
الشكل 4: مخطط لنظام الموائع الصوتية المستخدم لفصل الخلايا وجمعها. يتم حقن العينة أو محلول المخزن المؤقت في منفذ المدخل من خلال وحدة التحكم في التدفق. لتمركز الخرز وفصل العينات، يتم تطبيق طاقة التيار المتردد على PZT عبر مولد وظيفي مع مضخم طاقة لتوليد قوة إشعاع صوتي في القناة الدقيقة. يتم جمع العينة المستهدفة المنفصلة من خلال أنبوب تجميع ، ويتم استرداد سائل النفايات المتبقي من خلال منفذ آخر. يتم استخدام وحدة كاميرا عالية السرعة لتصور الفصل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صورة تدفق الخرز كدالة لجهد PZT. (A) PZT OFF ، (B) PZT 0.1 V ، (C) PZT 0.5 V ، (D) PZT 5 V. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
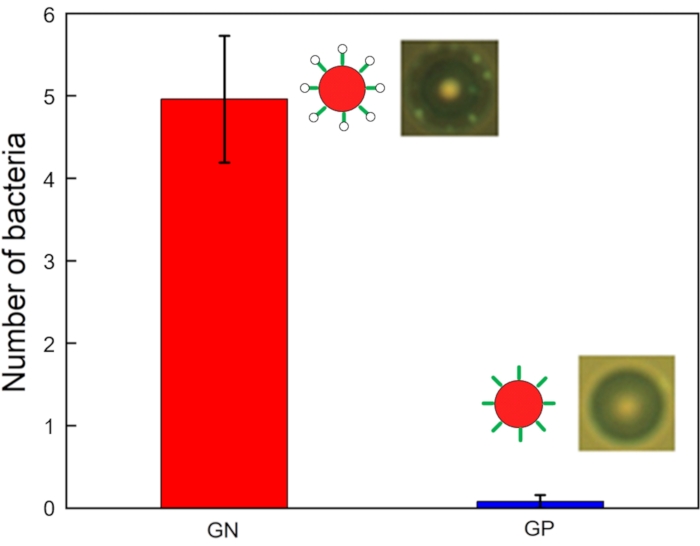
الشكل 6: أعداد بكتيريا GN (E. coli DH5α) و GP (Listeria grayi) المرتبطة بالميكروبيدات المعدلة بواسطة aptamer (n = 25 ، شريط الخطأ = الخطأ القياسي). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رقم | جهاز | العرض (W) أو القطر (D) (μm) |
| 1 | منفذ مدخل ومخرج (سيليكون) | 1000 (د) |
| 2 | قناة الموائع الدقيقة | 200 (واط) |
| 3 | قناة المدخل والمخرج | 400 (واط) |
| 4 | منفذ مدخل ومخرج (زجاج) | 1500 (د) |
الجدول 1: أبعاد منصة الموائع الدقيقة الهوائية (1 إلى 4 في الشكل 2).
| بكتيريا GN | بكتيريا GP |
| الإشريكية القولونية (DH5α) | عصية ميغاتيريوم (KCTC 1021) |
| Enterobacter cloacae | المكورات العنقودية البشرة |
| سفينجوموناس انسولي | ليستيريا جراي |
| الإشريكية القولونية KCTC 2571 | المكورات المعوية التايلاندية |
| الزائفة بيكتوروم | المكورات العنقودية باستوري |
الجدول 2: دراسة بكتيريا GN و GP.
| معدل التدفق عند مخرج wate (ميكرولتر / دقيقة) | معدل الاسترداد (٪) | النقاء (٪) |
| 400 (5x concetnration الحجمي) | 98 ± 2.2 | 97.1 ± 3.6 |
| 450 (10x concetnration الحجمي) | 98 ± 2.5 | 97.6 ± 2.4 |
| 475 (20x concetnration الحجمي) | 90 ± 9.8 | 99.4 ± 0.6 |
الجدول 3: معدل الاسترداد ونقاء الفصل.
Discussion
قمنا بتطوير جهاز الموائع الدقيقة للرفع الصوتي لالتقاط ونقل بكتيريا GN من عينات المستنبتة بسرعة عالية استنادا إلى طريقة تشغيل مستمرة وفقا لحجمها ونوعها ، والميكروبيدات المعدلة بواسطة aptamer. تتيح القناة الدقيقة المربعة الطويلة تصميما أبسط وكفاءة أكبر من حيث التكلفة للهروب الحرقفي ثنائي الأبعاد مما تم الإبلاغ عنه سابقا20،21،22،23،24،25،26. يحتوي الجهاز على معدل استرداد يبلغ >98٪ يصل إلى تركيز جرعة 10x. تظهر هذه الدراسة معدل استرداد ونقاء أعلى من الطرق الحالية الخالية من الملصقات20،21،22،23،24 وطرق تقارب الخرز 25،26 لفصل البكتيريا. هذا يشير إلى أن الجهاز يمكنه فصل البكتيريا بكفاءة. ومع ذلك ، نظرا لأن الخرز 10-μm يمكن أن يتدفق إلى القنوات الجانبية ، يتم تقليل معدل الاسترداد إلى 90٪ عند تركيز جرعة 20x بسبب قوة السحب القوية الناشئة عن المخرج المغلق الذي يمنع الإشعاع الصوتي في اختبار الأداء. في حين أن معدل الاسترداد على الشريحة يمكن أن يصل إلى 98٪ ، فإن هناك عدة عوامل تقلل من معدل الاسترداد ، مثل هطول الخرز في جهاز الاستنشاق أو انسداد الأنبوب الذي يربط جهاز الاستنشاق بالشريحة.
هناك بعض النقاط الرئيسية اللازمة لجعل هذه الشريحة الصوتية وجعلها تعمل. يجب استخدام المادة اللاصقة المستخدمة لإرفاق PZT بأقل قدر ممكن من الدقة للتموج ويجب أن تكون PZT والقناة الدقيقة متوازية. تؤدي الأخطاء في هذه الخطوة إلى نقل أشكال موجية غير صحيحة من خلال PZT إلى الشريحة ، والتي تظهر على شكل اختلال في محاذاة الخرز. أيضا ، كن حذرا عند التشغيل ، حيث يمكن أن تؤدي عدة عوامل إلى تفاقم معدل الاسترداد ، مثل ترسيب الخرز من المحقنة أو انسداد أنبوب التوصيل برقائق من المحقنة.
لا يمكن استخدام هذا الجهاز للكشف عن البكتيريا الحية أو المؤشرات الحيوية المشتقة من البكتيريا في مجال التشخيص المبكر للأمراض المعدية البكتيرية فحسب ، بل يمكن أيضا توسيعه ليشمل مراقبة تلوث المياه ، مما سيساعد على تحديد الإرهاب البيولوجي والالتهابات البكتيرية المسببة للأمراض.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من خلال منحة المؤسسة الوطنية للبحوث في كوريا (NRF) التي تمولها الحكومة الكورية (وزارة العلوم وتكنولوجيا المعلومات والاتصالات). (لا. NRF-2021R1A2C1011380)
Materials
| Name | Company | Catalog Number | Comments |
| 1 µm polystyrene microbeads | Bang Laboratories | PS04001 | Cell size beads |
| 10 µm Streptavidin-coated microbeads | Bang Laboratories | CP01007 | Aptamer affinity beads |
| 4-inch Silicon Wafer/SU-8 mold | 4science | 29-03573-01 | Components of chip |
| Aptamer | Integrated DNA Technologies | GN3-6' | RNA for bacteria conjugation |
| Borosilicate glass | Schott | BOROFLOAT 33 | Components of chip |
| Centrifuge | Daihan | CF-10 | Wasing particles |
| Cyanoacrylate glue | 3M | AD100 | Attach PZT to microchip |
| Escherichia coli DH5α | KCTC | KCTC2571 | Target bacteria |
| Functional generator | GW Instek | AFG-2225 | Generate frequency |
| High-speed camera | Photron | FASTCAM Mini | Observation of separation |
| Hot plate | As one | HI-1000 | Heating plate for curing of liquid PDMS |
| KOVAX-SYRINGE 10 mL Syringe | Koreavaccine | 22G-10ML | Fill the microfluidic acoustophoresis channel with bubble-free demineralized water. |
| Liquid polydimethylsiloxane, PDMS | Dow Corning Inc. | Sylgard 184 | Components of chip |
| LB Broth Miller | BD Difco | 244620 | Cell culture (Luria-Bertani medium) |
| Microscope | Olympus Corp. | IX-81 | Observation of separation |
| PBS buffer | Capricorn scientific | PBS-1A | Wasing bacteria |
| PEEK Tubes | Saint-Gobain Ppl Corp. | AAD04103 | Inject or collect particles |
| Piezoelectric transducer | Fuji Ceramics | C-213 | Generate specific wave in channel |
| Power amplifier | Amplifier Research | 75A250A | Amplify frequency |
| Pressure controller/μflucon | AMED | AMED-μflucon | Control of air pressure/flow controller |
| Tris-HCl buffer | invitrogen | 15567027 | Wasing particles |
| Tube rotator | SeouLin Bioscience | SLRM-3 | Modifiying aptamer and bead |
References
- Wu, M., et al. Acoustofluidic separation of cells and particles. Microsystem & Nanoengineering. 5 (1), 1-18 (2019).
- Lee, S. W., et al. Aptamer affinity-bead mediated capture and displacement of Gram-negative bacteria using acoustophoresis. Micromachines. 10 (11), 770(2019).
- Hirvonen, J. J., et al. One-step sample preparation of positive blood cultures for the direct detection of methicillin-sensitive and -resistant Staphylococcus aureus and methicillin-resistant coagulase-negative staphylococci within one hour using the automated GenomEra CDXTM PCR system. European Journal of Clinical Microbiology & Infectious Diseases. 31 (10), 2835-2842 (2012).
- Swaminathan, B., Feng, P. Rapid detection of food-borne pathogenic bacteria. Annual Review of Microbiology. 48 (1), 401-426 (1994).
- Ding, X., et al. On-chip manipulation of single microparticles, cells, and organisms using surface acoustic waves. Proceeding of the National Academy of Sciences of the United States of America. 109 (28), 11105-11109 (2012).
- Karthick, S., et al. Acoustic impedance-based size independent isolation of circulating tumor cells from blood using acoustophoresis. Lab on a Chip. 18 (24), 2802(2018).
- Lenshof, A., et al. Acoustofluidics 8: Applications of acoustophoresis in continuous flow microsystems. Lab on a Chip. 12 (7), 1210-1223 (2012).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS journal. 275 (22), 5657-5666 (2008).
- Klussmann, S. The aptamer handbook: Functional oligonucleotides and their applications. , John Wiley & Sons. Hoboken, New Jersey. (2006).
- Ellington, A., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346 (6287), 818-822 (1990).
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249 (4968), 505-510 (1990).
- Namnabat, M. S., et al. 3D numerical simulation of acoustophoretic motion induced by boundary-driven acoustic streaming in standing surface acoustic wave microfluidics. Scientific Reports. 11 (1), 11326(2021).
- Nimjee, S. M., et al. Aptamer as therapeutics. Annual Review of Pharmacology and Toxicology. 57, 61-79 (2017).
- Zhang, Y., et al. Recent advances in aptamer discovery and application. Molecules. 24 (5), 941(2019).
- Park, J. W., et al. Acousto-microfluidics for screening of ssDNA aptamer. Scientific Reports. 6 (1), 1-9 (2016).
- Persson, J., et al. Acoustic microfluidic chip technology to facilitate automation of phage display selection. The FEBS Journal. 275 (22), 5657-5666 (2008).
- Van Toan, N., et al. An investigation of processes for glass micromachining. Micromachines. 7 (3), 51(2016).
- Jansen, H., et al. A survey on the reactive ion etching of silicon in microtechnology. Journal of Micromechanics and Microengineering. 6 (1), 14(1996).
- Hanneborg, A., et al. Silicon-to-silicon anodic bonding with a borosilicate glass layer. Journal of Micromechanics and Microengineering. 1 (3), 139(1991).
- Mach, A. J., Di Carlo, D. Continuous scalable blood filtration device using inertial microfluidics. Biotechnology and bioengineering. 107 (2), 302-311 (2010).
- Wang, S., et al. Simple filter microchip for rapid separation of plasma and viruses from whole blood. International Journal of Nanomedicine. 7, 5019-5028 (2012).
- Ai, Y., et al. Separation of Escherichia coli bacteria from peripheral blood mononuclear cells using standing surface acoustic waves. Analytical Chemistry. 85 (19), 9126-9134 (2013).
- Ohlsson, P., et al. Acoustic impedance matched buffers enable separation of bacteria from blood cells at high cell concentrations. Scientific Reports. 8 (1), 1-11 (2018).
- Park, S., et al. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Kim, U., Soh, H. T. Simultaneous sorting of multiple bacterial targets using integrated Dielectrophoretic-Magnetic Activated Cell Sorter. Lab on a Chip. 9 (16), 2313-2318 (2009).
- Cai, G., et al. A fluidic device for immunomagnetic separation of foodborne bacteria using self-assembled magnetic nanoparticle chains. Micromachines. 9 (12), 624(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved