Method Article
Подготовка и выращивание топорических насекомых с тканевыми культивируемыми саженцами для исследований взаимодействия микробиоты кишечника хозяина и жука-листоеда
В этой статье
Резюме
Чтобы получить топорное насекомое, его поверхность яйца стерилизуют, а вылупившуюся личинку впоследствии выращивают с помощью акшеновых листьев. Этот метод обеспечивает эффективный способ приготовления аксенических насекомых без введения антибиотиков или разработки искусственной диеты, которая также может быть применена к другим листоядным насекомым.
Аннотация
Кишечник насекомых колонизирован различными бактериями, которые могут глубоко влиять на физиологические черты хозяина. Введение определенного бактериального штамма в аксеническое насекомое является мощным методом проверки микробной функции кишечника и выяснения механизмов, лежащих в основе взаимодействия кишечного микроба и хозяина. Введение антибиотиков или стерилизация поверхностей яиц являются двумя широко используемыми методами удаления кишечных бактерий от насекомых. Однако, в дополнение к потенциальному неблагоприятному воздействию антибиотиков на насекомых, предыдущие исследования показали, что кормление антибиотиками не может устранить кишечные бактерии. Таким образом, искусственные диеты без микробов, как правило, используются для поддержания топорических насекомых, что является утомительным и трудоемким процессом, который не может полностью напоминать питательные компоненты в натуральной пище. Здесь описан эффективный и простой протокол для подготовки и поддержания аксеновых личинок жука-листоеда (Plagiodera versicolora). В частности, поверхности яиц жуков были стерилизованы, после чего листья тополя без микробов использовались для выращивания личинок топоруса. Аксеновый статус насекомых был дополнительно подтвержден с помощью культурозависимых и зависящих от культуры анализов. В совокупности, сочетая дезинфекцию яиц и выращивание без микробов, был разработан эффективный и удобный метод получения аксениса P. versicolora, обеспечивающий легко переносимый инструмент для других листоядных насекомых.
Введение
Подобно млекопитающим, пищеварительный тракт насекомых является полостью для переваривания и всасывания пищи. Большинство насекомых содержат разнообразные комменсальные бактерии, которые процветают в их кишечнике и живут на питании, поставляемом хозяевами1. Комменсальное сообщество кишечника оказывает глубокое влияние на многочисленные физиологические процессы у насекомых, включая переваривание пищи и детоксикацию 2,3,4, питание и развитие 5,6,7, защиту от патогенов и паразитов 8,9,10,11, химическую связь 12,13 и поведение14 ,15. Интересно, что некоторая микробиота кишечника может быть факультативно патогенной или манипулироваться путем вторжения патогенов для усугубления инфекции, что указывает на то, что кишечные бактерии могут быть вредными в некоторых случаях 16,17,18. Кишечные бактерии также могут служить микробным ресурсом для биотехнических применений и борьбы с вредителями. Например, переваривающие лигноцеллюлозу бактерии из фитофаговых и ксилофаговых насекомых использовались для переваривания растительных клеток для разработки биотоплива19. Рассеивание инженерных кишечных симбионтов, экспрессирующих биологически активные молекулы, является новой и многообещающей тактикой для борьбы с вредителями сельского и лесного хозяйства и комарами, передающими инфекционные заболевания 19,20,21, которые также могут быть использованы для улучшения приспособленности полезных насекомых 22. Таким образом, иллюстрация того, как кишечная бактерия ведет себя in vivo, считается приоритетом для полного использования ее функции и дальнейшего использования ее для различных применений.
Животные могут содержать от 1 до >1000 симбиотических микробных видов в кишечнике1. В результате трудно точно проверить, как отдельные бактериальные таксоны или их сборка работают внутри животного, и управляет ли хозяин или его микробные партнеры определенной функцией. Поэтому для исследования бактериальной функции и взаимодействия с насекомыми23 необходима подготовка аксеневых личинок к получению гнотобиотических насекомых путем моно- или многовидовой колонизации. В настоящее время введение антибиотических коктейлей и стерилизация поверхности яиц насекомых являются распространенными методами удаления кишечных бактерий 14,24,25,26. Однако антибиотические диеты не могут полностью устранить кишечные бактерии и оказывают негативное влияние на физиологию насекомых-хозяев27,28. Следовательно, использование обработанных антибиотиками насекомых может скрыть истинные способности некоторых кишечных бактерий. К счастью, поверхностная стерилизация яиц может свести на нет эту проблему23,29, которая не оказывает никакого или незначительного воздействия на экспериментальных насекомых. Кроме того, искусственные диеты не могут полностью напоминать натуральную пищу от насекомых, а разработка искусственной диеты является дорогостоящим и трудоемким процессом30,31.
Жук-листоед ивы, Plagiodera versicolora (Laicharting) (Coleoptera: Chrysomelidae), является широко распространенным листоядным вредителем, который в основном питается слюнными деревьями, такими как ива (Salix) и тополь (Populus L.) 32,33. Здесь жук-листоед ивы использовался в качестве представителя листоядного насекомого для разработки протокола подготовки и выращивания насекомого без микробов. Мы использовали культуру растительной ткани для получения листьев тополя без микробов для выращивания личинок P. versicolora axenic из стерилизованных яиц. Аксеновый статус личинок P. versicolora был проверен с помощью культурозависимых и зависящих от культуры анализов. Этот протокол может поддерживать акшенических насекомых, которые лучше имитируют дикие условия, чем выращивание насекомых с искусственной диетой. Что еще более важно, этот метод удобен при очень низкой стоимости, что повышает целесообразность получения аксеневых насекомых для будущих исследований взаимодействия микробиоты насекомых и кишечника, особенно для немодальных насекомых без хорошо разработанных искусственных диет.
протокол
1. Выращивание насекомых
- Поддерживают популяцию P. versicolora в камере роста при температуре 27 °C и 70 ± относительной влажности 5% при фотопериоде 16 ч света/8 ч темноты. Поместите их в перфорированные пластиковые коробки с мокрой впитывающей бумагой и кормите их свежими ветками тополя. Распыляйте чистую воду на впитывающую бумагу для поддержания влаги и смены ветвей каждые два дня.
- Изолируют взрослых для яйцекладки после окукливания. Кормите их нежными листьями, чтобы получить больше яиц.
- Соберите вновь отложенные яйца (в течение 24 ч). Поместите яйца на влажную впитывающую бумагу на 60 ч, чтобы подготовить личинки аксении.
ПРИМЕЧАНИЕ: Недавно отложенные яйца вылупятся через ~ 72 ч. Лучшее время для стерилизации поверхностей яиц – за день до вылупления; в противном случае количество успешно вылупившихся яиц уменьшится.
2. Культивирование тополя без зародышей
- Готовят мурашиге и скуг (МС) среды и 1 мг/мл α-нафталиновой уксусной кислоты (NAA) (см. Таблицу материалов).
- В капсуле биобезопасности добавьте 50 мкл 1 мг/мл раствора NAA к 500 мл среды MS, встряхните, чтобы хорошо перемешать, и насыпьте ~ 50 мл на контейнер для культуры ткани и дождитесь затвердевания.
- Приготовьте скальпели, спиртовую лампу и щипцы; стерилизуйте скальпели и щипцы в пламя спиртовой лампы в вытяжке биобезопасности.
- Срезайте 3-4 см стеблевые сегменты с верхушечными почками или боковыми почками из рассады тополя на ~1 месяц роста (рассада без зародышей, культивируемая тканью) и вставляйте их в культуральную среду, по одному или двум стеблевым сегментам на контейнер.
- Инкубируют эти сегменты стебля в камере роста при 25 °C и 50 ± интенсивностью света 10 кд с фотопериодом 16 ч света / 8 ч темной в течение примерно 30 дней. Используйте листья без зародышей, чтобы накормить личинок топоруса.
3. Стерилизация поверхности яйца и выращивание топорных личинок
- Автоклавные чашки Петри, кисти, фильтровальная бумага, дистиллированная вода и чашка Петри, содержащая агаровую среду LB (Luria-Bertani).
- Поместите листья с прилипшими яйцами в чашку Петри, аккуратно извлеките яйца из листьев с помощью щипцов и перенесите их в другую чашку Петри.
ПРИМЕЧАНИЕ: Этот шаг следует выполнять очень осторожно, потому что яйца прилипают к листьям. - Вымойте эти яйца 75% этанолом в течение 8 мин, и повторите промывку четыре раза стерильной водой.
- Переложите яйца на агаровую среду LB, чтобы сохранить влагу для вылупления.
ПРИМЕЧАНИЕ: Использование агаровой среды LB может помочь проверить, не содержит ли продезинфицированное яйцо микробов. - Поместите чашку Петри в камеру роста и подождите, пока яйца вылупятся в течение 24 часов.
- В вытяжке биобезопасности выложите три куска влажной фильтровальной бумаги в чашку Петри, поместите на бумагу листья тополя без микробов, соберите личинки и поместите их на листья, запечатайте чашку Петри парапленкой и высиживают их в камере роста при 27 ° C и 70 ± 5% относительной влажности с фотопериодом 16 ч света / 8 ч темноты.
ПРИМЕЧАНИЕ: Выращенные в тканях листья нежные и могут быстро терять воду. Таким образом, использование влажной фильтровальной бумаги необходимо при переносе листьев на чашку Петри. - Меняйте листья каждые два дня.
- Для традиционно выращенных групп перенесите яйца из листьев в чашку Петри, содержащую влажную фильтровальную бумагу, и кормите этих личинок листьями тополя без микробов.
4. Верификация личинок аксеновых с помощью культурозависимых анализов
- Случайным образом выберите трех1-х,2-х и3-х звездных личинок из свободных от микробов и традиционно выращенных групп.
- Рассекните личинок3-й звезды стерильными ножницами и щипцами под стереомикроскопом и соберите их кишки в микроцентрифужные трубки. Собирайте неповрежденных личинок1-й и2-й звезды в трубки.
ПРИМЕЧАНИЕ: Соберите целые личинки1-й и2-й звезды, так как они слишком малы, чтобы рассекать, и сохраните их кишки нетронутыми. - Добавьте 100 мкл фосфатно-буферного физиологического раствора и три стальных шарика в пробирки по 1,5 мл и измельчите ткани в гомогенаты с помощью гомогенизатора, взбивающего шарики.
- Добавьте 100 мкл гомогената в агаровую среду LB и пластину с помощью стерильного стеклянного разбрасывающего стержня.
- Поместите пластины при 37 °C в течение 24 ч и наблюдайте за бактериальными колониями.
5. Верификация аксенических индивидов с помощью культурозависимых анализов
- Извлеките общую ДНК тканей (полученную в разделе 4) с помощью набора для экстракции ДНК.
- Измерьте концентрацию ДНК с помощью спектрофотометра при 260 нм.
- Амплифицируйте бактериальный ген 16S рРНК с помощью универсальных праймеров 16S рРНК с ПЦР. Настройте реакционную систему с 18 мкл 1,1x ПЦР-мастер-микса (см. Таблицу материалов), 0,5 мкл праймера 27F (5'-ACGGATACCTTGTTACGAC-3'), 0,5 мкл праймера 1495R (5'-ACGGATACCTTGTTACGAC-3') и 100 нг шаблонной ДНК. Установите условия ПЦР при 95 °C в течение 3 мин; 28 циклов при 95 °C в течение 30 с, 55 °C в течение 1 мин и 72 °C в течение 1 мин; затем 72 °C в течение 10 мин. Хранить продукты ПЦР при температуре 4 °C до дальнейшего анализа.
- Смешайте продукты ПЦР с красителем нуклеиновых кислот и проанализируйте их с помощью электрофореза на 1% агарозном геле в 1x буфере TAE. Используйте 10 мкл ДНК-маркера в качестве эталона.
- Понаблюдайте за гелем с помощью УФ-трансиллюминатора и найдите целевой фрагмент около 1 500 bp.
Результаты
Этапы жизни P. versicolora показаны на рисунке 1. Взрослый самец меньше взрослой самки (рисунок 1А). В поле жук группирует свои яйца на листе; здесь четыре яйца были отделены от листа (рисунок 1B). Сегменты стебля тополя и саженцы, используемые для выращивания топорных насекомых, показаны на рисунке 2. Кишечник3-й звездной личинки показан на рисунке 3, а сегменты кишечника отмечены белыми скобками.
Хотя никаких бактериальных колоний не наблюдалось ни в одной группе, свободной от микробов, они наблюдались во всех традиционно выращенных группах (рисунок 4), что указывает на то, что личинки из стерилизованных яиц, которые питались тканевыми листьями тополя, не содержат бактерий. Полосы ПЦР ~1 500 bp появились во всех традиционно выращенных группах. Напротив, в группах, свободных от микробов, не наблюдалось ни одной полосы или отрицательного контроля (рисунок 5), что означает, что в личинках аксении не существовало кишечных бактерий. Не было никаких различий во времени развития личинок, выживаемости или внешнем виде между свободными от микробов и традиционно выращенными личинками P. versicolora . Однако масса тела свободных от микробов личинок была несколько выше, чем у условно выращенных личинок на5-й день, хотя массы станут похожими до окукливания16. Эти результаты подтвердили целесообразность этого протокола для подготовки и заднего топора личинок.

Рисунок 1: Этапы жизни ивового листоеда, Plagiodera versicolora. (А) Взрослые самки и самцы; (B) яйца; (C)1-я звездная личинка; (D)2-я звездная личинка; (E)3-я звездная личинка; и F) куколки. Шкала стержней = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Сегменты стебля тополя и саженцы. (А) Стеблевые сегменты с верхушечными почками; (B) сегменты стебля отрастали корнями через 10 дней; (C) месячный саженец. Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Кишечник личинки третьей звезды. Передняя кишка, средняя кишка и задняя кишка помечены скобками. Шкала = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Подтверждение эффективности элиминации кишечных бактерий путем культивирования гомогенатов кишечника или целых насекомых на пластинах агара LB. Никаких бактерий не наблюдалось в листьях тополя, которых кормили без микробов, тогда как бактерии наблюдались в традиционно выращенных группах. Для анализа использовались1-я,2-я и 3-я личинки. Три личинки были случайным образом выбраны в каждой группе. Сокращения: GF = личинки без зародышей; CR = условно выращенные личинки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
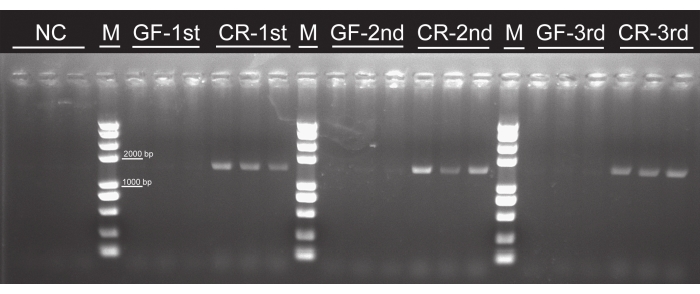
Рисунок 5: Подтверждение эффективности элиминации кишечных бактерий методом ПЦР-анализа с использованием универсальных праймеров гена 16S рРНК. Целевая полоса гена 16S рРНК составляет ~ 1 500 bp. Для анализа использовались1-е,2-е и3-е звездчатые личинки. В группах GF целевой полосы не наблюдалось. Сокращения: NC = отрицательный контроль; GF = без микробов; CR = условно выращенный. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Получение свободных от микробов личинок и получение гнотобиотических личинок путем реинтродукции специфических бактериальных штаммов являются мощными методами выяснения механизмов, лежащих в основе взаимодействия хозяина и микроба. Недавно вылупившиеся личинки получают микробиоту кишечника двумя основными способами: вертикальная передача от матери к потомству или горизонтальное приобретение от братьев и сестер и окружающей среды34. Первое может быть выполнено путем родительской передачи потомству через загрязнение поверхности яйца35. Таким образом, вполне реально получить аксеновые личинки путем стерилизации поверхностей яиц насекомых 27,28,29. Введение коктейля из нескольких антибиотиков является еще одним способом развития аксеновых насекомых, но имеет несколько недостатков28. Напротив, стерилизация поверхности яиц с последующей аксенической диетой лучше для развития аксеновых насекомых 23,28,29.
Яйца большинства жуков-листоедов видны, легко усваиваются и легко дезинфицируются. Это основная причина, по которой для дезинфекции использовался простой реагент (75% этанола) и более короткое время (8 мин) по сравнению с аналогичными исследованиями (например, 40 мин дезинфекции яиц для вонючего жука Plautia stali с 75% этанолом и формальдегидом для получения топорных насекомых; 6 мин стерилизации поверхности яйца дрозофилы с 1% активным хлором и 75% этанолом; и 10 мин стерилизации поверхности яйца красного пальмового долгоносика Rhynchophorus ferrugineus с 10% гипохлоритом натрия решение)23,29,36. Для видов насекомых с крошечными яйцами необходимо оптимизировать использование дезинфекторов и продолжительность стерилизации, поскольку обработка может значительно повлиять на результаты.
В некоторых случаях искусственные диеты без микробов используются для выращивания топорических насекомых после стерилизации поверхности яиц29,37. Однако разработка подходящей искусственной диеты для насекомых является утомительным и трудоемким процессом. Питательные вещества в рационе активно влияют на физиологию насекомых (например, время развития, иммунитет) и микробиоту кишечника 6,35. Таким образом, квалифицированная искусственная диета для насекомого должна содержать питательный состав, схожий с натуральной пищей, чего трудно достичь, особенно для фитофаговых насекомых. В этом протоколе мы кормили насекомых растениями-хозяевами, что преодолевает недостатки искусственной диеты. Важно отметить, что, как и в случае с растением тополя, используемым здесь, также нетрудно получить культивируемые тканью саженцы из многих экономически важных культур, таких как табак, картофель, помидоры, пшеница и рис, путем поверхностной стерилизации семян или дезинфекции стеблевой секции38. Следует отметить, что эндофиты в растениях могут существовать в культивируемых тканями саженцах39 и могут быть устранены с помощью технологии40 культивирования меристемы побега. В заключение, этот протокол предоставляет новый метод для поддержания насекомых без микробов, который является удобным инструментом для облегчения исследований взаимодействия насекомых и кишечных бактерий.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа финансировалась Национальным фондом естественных наук Китая (31971663) и Программой спонсорства молодых элитных ученых CAST (2020QNRC001).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filters | Millipore | SLGP033RB | |
| 1 mg/mL NAA stock solution | a. Prepare 0.1 M NaOH solution (dissolve 0.8 g NaOH in 200 mL of distilled water). b. Add 0.2 g NAA in a 250 mL beaker, add little 0.1 M NaOH solution until NAA dissolved, and adjust the final volume to 200 mL with distilled water. c. Filter the solution to remove bacteria with a 0.22 µm syringe filter and a 50 mL sterile syringe, subpackage the solution in 1.5 mL centrifuge tubes and restore at -20 °C. | ||
| 1.5 mL microcentrifuge tubes | Sangon Biotech | F600620 | |
| 10x PBS stock solution | Biosharp Life Sciences | BL302A | |
| 2 M KOH solution | Dissolve 22.44 g KOH (molecular weight: 56.1) in 200 mL of distilled water and autoclave it for 20 min at 121 °C. | ||
| 250 mL and 2,000 mL beakers | Shubo | sb16455 | |
| 50 mL sterile syringes | Jinta | JT0125789 | |
| 500 mL measuring cylinder | Shubo | sb1601 | |
| 50x TAE stock solution | a. Dissolve 242 g Tris and 18.612 g EDTA in 700 mL of distilled water. b. Adjust pH to 7.8 with about 57.1 mL of acetic acid. c. Adjust the final volume to 1,000 mL. d. The stock solution was diluted to 1x TAE buffer when used. | ||
| 75% ethanol | Xingheda trade | ||
| α-naphthalene acetic acid (NAA) | Solarbio Life Sciences | 86-87-3 | |
| Absorbing paper | 22.3 cm x 15.3 cm x 9 cm | ||
| Acetic acid | Sinopharm Chemical Reagent Co. Ltd | ||
| Agar | Coolaber | 9002-18-0 | |
| Agarose | Biowest | 111860 | |
| Autoclave | Panasonic | MLS-3781L-PC | |
| Bead-beating homogenizer | Jing Xin | XM-GTL64 | |
| DNA extraction kit | MP Biomedicals | 116560200 | |
| EDTA | Saiguo Biotech | 1340 | |
| Filter paper | Jiaojie | 70 mm diameter | |
| Gel electrophoresis unit | Bio-rad | 164-5052 | |
| Gel Signal Green nucleic acid dye | TsingKe | TSJ003 | |
| Germ-free poplar seedlings | Shan Xin poplar from Ludong University in Shandong Province | ||
| Golden Star Super PCR Master Mix (1.1×) | TsingKe | TSE101 | |
| Growth chamber | Ruihua | HP400GS-C | |
| LB agar medium | a. Dissolve 5 g tryptone, 5 g NaCl, 2.5 g yeast extract in 300 mL of distilled water. b. Adjust the final volume to 500 mL, transfer the solution to a 1,000 mL conical flask, and add 7.5 g agar. c. Autoclave the medium for 20 min at 121 °C. | ||
| Mini centrifuge | DRAGONLAB | D1008 | |
| MS basic medium | Coolaber | PM1121-50L | M0245 |
| MS solid medium for germ-free poplar seedling culture | a. Dissolve 4.43 g MS basic medium powder and 30 g sucrose in 800 mL of distilled water. b. Adjust the pH to about 5.8 with 2 M KOH by a pH meter. c. Adjust the final volume to 1,000 mL, separate into two parts, transfer into two 1,000 mL conical flasks, and add 2.6 g agar per 500 mL. d. Autoclave for 20 min at 121 °C. | ||
| NanoDrop 1000 spectrophotometer | Thermo Fisher Scientific | ||
| Paintbrush | 1 cm width, used to collect the eggs | ||
| Parafilm | Bemis | PM-996 | |
| PCR Thermal Cyclers | Eppendorf | 6331000076 | |
| Petri dishes | Supin | 90 mm diameter | |
| pH meter | METTLER TOLEDO | FE20 | |
| Pipettes 0.2-2 µL | Gilson | ECS000699 | |
| Pipettes 100-1,000 µL | Eppendorf | 3120000267 | |
| Pipettes 20-200 µL | Eppendorf | 3120000259 | |
| Pipettes 2-20 µL | Eppendorf | 3120000232 | |
| Plant tissue culture container | Chembase | ZP21 | 240 mL |
| Plastic box | 2.35 L | ||
| Potassium hydroxide (KOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Primers for amplifying the bacterial 16S rRNA gene | Sangon Biotech | 27-F: 5’-ACGGATACCTTGTTACGAC-3’, 1492R: 5’-ACGGATACCTTGTTACGAC-3’ | |
| Sodium chloride (NaCl) | Sinopharm Chemical Reagent Co. Ltd | ||
| Sodium hydroxide (NaOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Steel balls | 0.25 mm | used to grind tissues | |
| Stereomicroscope | OLYMPUS | SZ61 | |
| Sucrose | Sinopharm Chemical Reagent Co. Ltd | ||
| Trans2K plus II DNA marker | Transgene Biotech | BM121-01 | |
| Tris base | Biosharp Life Sciences | 1115 | |
| Tryptone | Thermo Fisher Scientific | LP0037 | |
| UV transilluminator | Monad Biotech | QuickGel 6100 | |
| Vortexer | Scilogex | MX-S | |
| Willow branches | Sha Lake Park, Wuhan, China | ||
| Willow leaf beetle | Huazhong Agricultural University, Wuhan, China | ||
| Yeast extract | Thermo Fisher Scientific | LP0021 |
Ссылки
- Moran, N. A., Ochman, H., Hammer, T. J. Evolutionary and ecological consequences of gut microbial communities. Annual Review of Ecology, Evolution, and Systematics. 50 (1), 451-475 (2019).
- Warnecke, F., et al. Metagenomic and functional analysis of hindgut microbiota of a wood-feeding higher termite. Nature. 450 (7169), 560-565 (2007).
- Tokuda, G., et al. Fiber-associated spirochetes are major agents of hemicellulose degradation in the hindgut of wood-feeding higher termites. Proceedings of the National Academy of Sciences of the United States of America. 115 (51), 11996-12004 (2018).
- Wang, G. H., et al. Changes in microbiome confer multigenerational host resistance after sub-toxic pesticide exposure. Cell Host & Microbe. 27 (2), 213-224 (2020).
- Shin, S. C., et al. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science. 334 (6056), 670-674 (2011).
- Storelli, G., et al. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing. Cell Metabolism. 14 (3), 403-414 (2011).
- Salem, H., et al. Vitamin supplementation by gut symbionts ensures metabolic homeostasis in an insect host. Proceedings. Biological Sciences. 281 (1796), 20141838 (2014).
- Koch, H., Schmid-Hempel, P. Socially transmitted gut microbiota protect bumble bees against an intestinal parasite. Proceedings of the National Academy of Sciences of the United States of America. 108 (48), 19288-19292 (2011).
- Cirimotich, C. M., et al. Natural microbe-mediated refractoriness to Plasmodium infection in Anopheles gambiae. Science. 332 (6031), 855-858 (2011).
- Kaltenpoth, M., Gottler, W., Herzner, G., Strohm, E. Symbiotic bacteria protect wasp larvae from fungal infestation. Current Biology. 15 (5), 475-479 (2005).
- Yuan, C., Xing, L., Wang, M., Hu, Z., Zou, Z. Microbiota modulates gut immunity and promotes baculovirus infection in Helicoverpa armigera. Insect Science. , (2021).
- Dillon, R. J., Vennard, C. T., Charnley, A. K. Pheromones - Exploitation of gut bacteria in the locust. Nature. 403 (6772), 851 (2000).
- Xu, L. T., Lou, Q. Z., Cheng, C. H., Lu, M., Sun, J. H. Gut-associated bacteria of Dendroctonus valens and their involvement in verbenone production. Microbial Ecology. 70 (4), 1012-1023 (2015).
- Schretter, C. E., et al. A gut microbial factor modulates locomotor behaviour in Drosophila. Nature. 563 (7731), 402-406 (2018).
- Jia, Y., et al. Gut microbiome modulates Drosophila aggression through octopamine signaling. Nature Communications. 12 (1), 2698 (2021).
- Ma, M., et al. Metabolic and immunological effects of gut microbiota in leaf beetles at the local and systemic levels. Integrative Zoology. 16 (3), 313-323 (2021).
- Xu, L., et al. Synergistic action of the gut microbiota in environmental RNA interference in a leaf beetle. Microbiome. 9 (1), 98 (2021).
- Xu, L., et al. Gut microbiota in an invasive bark beetle infected by a pathogenic fungus accelerates beetle mortality. Journal of Pest Science. 92, 343-351 (2019).
- Berasategui, A., Shukla, S., Salem, H., Kaltenpoth, M. Potential applications of insect symbionts in biotechnology. Applied Microbiology and Biotechnology. 100 (4), 1567-1577 (2016).
- Tikhe, C. V., Martin, T. M., Howells, A., Delatte, J., Husseneder, C. Assessment of genetically engineered Trabulsiella odontotermitis as a 'Trojan Horse' for paratransgenesis in termites. BMC Microbiology. 16 (1), 202 (2016).
- Wang, S., et al. Fighting malaria with engineered symbiotic bacteria from vector mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12734-12739 (2012).
- Leonard, S. P., et al. Engineered symbionts activate honey bee immunity and limit pathogens. Science. 367 (6477), 573-576 (2020).
- Kietz, C., Pollari, V., Meinander, A. Generating germ-free Drosophila to study gut-microbe interactions: protocol to rear Drosophila under axenic conditions. Current Protocols in Toxicology. 77 (1), 52 (2018).
- Brummel, T., Ching, A., Seroude, L., Simon, A. F., Benzer, S. Drosophila lifespan enhancement by exogenous bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12974-12979 (2004).
- Correa, M. A., Matusovsky, B., Brackney, D. E., Steven, B. Generation of axenic Aedes aegypti demonstrate live bacteria are not required for mosquito development. Nature Communications. 9 (1), 4464 (2018).
- Romoli, O., Schonbeck, J. C., Hapfelmeier, S., Gendrin, M. Production of germ-free mosquitoes via transient colonisation allows stage-specific investigation of host-microbiota interactions. Nature Communications. 12 (1), 942 (2021).
- Berasategui, A., et al. Gut microbiota of the pine weevil degrades conifer diterpenes and increases insect fitness. Molecular Ecology. 26 (15), 4099-4110 (2017).
- Lin, X. L., Kang, Z. W., Pan, Q. J., Liu, T. X. Evaluation of five antibiotics on larval gut bacterial diversity of Plutella xylostella (Lepidoptera: Plutellidae). Insect Science. 22 (5), 619-628 (2015).
- Muhammad, A., Habineza, P., Hou, Y., Shi, Z. Preparation of red palm weevil Rhynchophorus Ferrugineus (Olivier) (Coleoptera: Dryophthoridae) germ-free larvae for host-gut microbes interaction studies. Bio-protocol. 9 (24), 3456 (2019).
- Gelman, D. B., Bell, R. A., Liska, L. J., Hu, J. S. Artificial diets for rearing the Colorado potato beetle, Leptinotarsa decemlineata. Journal of Insect Science. 1, 7 (2001).
- Bengtson, D. A. A comprehensive program for the evaluation of artificial diets. Journal of the World Aquaculture Society. 24 (2), 285-293 (2007).
- Utsumi, S., Ando, Y., Ohgushi, T. Evolution of feeding preference in a leaf beetle: the importance of phenotypic plasticity of a host plant. Ecology Letters. 12 (9), 920-929 (2009).
- Ishihara, M., Ohgushi, T. Reproductive inactivity and prolonged developmental time induced by seasonal decline in host plant quality in the willow leaf beetle Plagiodera versicolora (Coleoptera: Chrysomelidae). Environmental Entomology. 35 (2), 524-530 (2006).
- Bright, M., Bulgheresi, S. A complex journey: transmission of microbial symbionts. Nature Reviews: Microbiology. 8 (3), 218-230 (2010).
- Hassan, B., Siddiqui, J. A., Xu, Y. Vertically transmitted gut bacteria and nutrition influence the immunity and fitness of Bactrocera dorsalis larvae. Frontiers in Microbiology. 11, 596352 (2020).
- Hosokawa, T., et al. Obligate bacterial mutualists evolving from environmental bacteria in natural insect populations. Nature Microbiology. 1, 15011 (2016).
- Habineza, P., et al. The promoting effect of gut microbiota on growth and development of red palm weevil, Rhynchophorus ferrugineus (Olivier) (Coleoptera: Dryophthoridae) by modulating its nutritional metabolism. Frontiers in Microbiology. 10, 1212 (2019).
- Meilan, R., Ma, C. Poplar (Populus spp.). Methods in Molecular Biology. 344, 143-151 (2006).
- Wani, Z. A., Ashraf, N., Mohiuddin, T., Riyaz-Ul-Hassan, S. Plant-endophyte symbiosis, an ecological perspective. Applied Microbiology and Biotechnology. 99 (7), 2955-2965 (2015).
- Grout, B. W. Meristem-tip culture. Methods in Molecular Biology. 6, 81-91 (1990).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены