Method Article
Preparando e criando insetos axeônicos com mudas cultivadas de tecido para estudos de interação microbiota hospedeiro-intestinal do besouro-folha
Neste Artigo
Resumo
Para obter um inseto axenic, sua superfície de ovo é esterilizada, e a larva eclodida é posteriormente criada usando folhas axenic. Este método fornece uma maneira eficiente de preparação de insetos machados sem administrar antibióticos ou desenvolver uma dieta artificial, que também pode ser aplicada a outros insetos comedores de folhas.
Resumo
As entranhas dos insetos são colonizadas por diversas bactérias que podem impactar profundamente os traços fisiológicos do hospedeiro. Introduzir uma cepa bacteriana particular em um inseto axenic é um método poderoso para verificar a função microbiana intestinal e elucidar os mecanismos subjacentes às interações entre micróbios intestinais. Administrar antibióticos ou esterilizar superfícies de óvulos são dois métodos comumente usados para remover bactérias intestinais de insetos. No entanto, além dos potenciais efeitos adversos dos antibióticos em insetos, estudos anteriores indicaram que a alimentação de antibióticos não poderia eliminar bactérias intestinais. Assim, dietas artificiais sem germes são geralmente empregadas para manter insetos axenic, que é um processo tedioso e intensivo em mão-de-obra que não pode se assemelhar totalmente a componentes nutricionais em alimentos naturais. Descrito aqui é um protocolo eficiente e simples para preparar e manter larvas axenic de um besouro de folhas (Plagiodera versicolora). Especificamente, superfícies dos ovos de besouro foram esterilizadas, seguindo as quais folhas de álamo sem germes foram usadas para retrotecanças. O status axenic dos insetos foi confirmado ainda através de ensaios dependentes da cultura e independentes da cultura. Coletivamente, combinando desinfecção de ovos e cultivo livre de germes, um método eficiente e conveniente foi desenvolvido para obter a P. versicolora axenic, fornecendo uma ferramenta facilmente transferível para outros insetos comedores de folhas.
Introdução
Semelhante aos mamíferos, o trato digestivo de insetos é uma cavidade para digestão e absorção de alimentos. A maioria dos insetos abriga diversas bactérias commensais que prosperam em suas entranhas e vivem de nutrição fornecida pelos hospedeiros1. A comunidade commensal intestinal tem um impacto profundo em múltiplos processos fisiológicos em insetos, incluindo digestão e desintoxicaçãode alimentos 2,3,4, nutrição e desenvolvimento 5,6,7, defesa contra patógenos e parasitas 8,9,10,11, comunicação química 12,13 e comportamentos14 15. Curiosamente, algumas microbiota intestinal podem ser facultativamente patogênicas ou manipuladas por patógenos invasores para agravar a infecção, indicando que bactérias intestinais podem ser prejudiciais em alguns casos 16,17,18. As bactérias intestinais também podem servir como um recurso microbiano para aplicações biotécnicas e manejo de pragas. Por exemplo, bactérias digeridoras de lignocelulose de insetos fitofagosos e xilofagos foram usadas para digerir células vegetais para o desenvolvimento de biocombustíveis19. A dispersão de simbionts intestinais projetados expressando moléculas bioativas é uma tática nova e promissora para gerenciar a agricultura e pragas florestais e mosquitos que transmitem doenças infecciosas 19,20,21, que também podem ser usadas para melhorar a aptidão de insetos benéficos 22. Ilustrar como uma bactéria intestinal se comporta in vivo é, portanto, considerada uma prioridade para alavancar plenamente sua função e explorá-la ainda mais para várias aplicações.
Os animais podem abrigar de 1 a >1000 espécies microbianas simbióticas no intestino1. Como resultado, é difícil verificar com precisão como a taxa bacteriana individual ou sua montagem se comportam dentro de um animal, e se o hospedeiro ou seus parceiros microbianos conduzem uma função específica. Portanto, o preparo de larvas machadonicas para obter insetos gnóbitos por colonização mono ou multiespécies é necessário para investigar a função bacteriana e a interação com insetos23. Atualmente, administrar coquetéis antibióticos e esterilizar a superfície dos ovos de insetos são métodos comuns para remover bactérias intestinais 14,24,25,26. No entanto, as dietas antibióticas não podem eliminar completamente as bactérias intestinais e têm um efeito negativo na fisiologiado inseto hospedeiro 27,28. Consequentemente, o uso de insetos tratados com antibióticos pode obscurecer as verdadeiras habilidades de algumas bactérias intestinais. Felizmente, a esterilização superficial de ovos pode negar esse problema23,29, que não tem efeitos ou insignificantes sobre insetos experimentais. Além disso, dietas artificiais não podem se assemelhar totalmente a alimentos naturais para insetos, e desenvolver uma dieta artificial é um processo caro e que consome mão-de-obra30,31.
O besouro-folha de salgueiro, Plagiodera versicolora (Laicharting) (Coleoptera: Chrysomelidae), é uma praga comedora de folhas generalizada que se alimenta principalmente de árvores salicacesas, como salgueiros (Salix) e álamo (Populus L.) 32,33. Aqui, o besouro-folha de salgueiro foi usado como um inseto representativo que come folhas para desenvolver um protocolo para preparar e criar um inseto livre de germes. Exploramos a cultura do tecido vegetal para obter folhas de álamo sem germes para criar larvas machados P. versicolora de ovos esterilizados. O status axenic das larvas de P. versicolora foi verificado através de ensaios dependentes da cultura e independentes da cultura. Este protocolo pode manter insetos axenic que melhor imitam a condição selvagem do que a criação de insetos com uma dieta artificial. Mais importante, este método é conveniente a um custo muito baixo, o que aumenta a viabilidade de obter insetos axenic para futuros estudos de interação inseto-intestino, especialmente para insetos não-modelos sem dietas artificiais bem desenvolvidas.
Protocolo
1. Criação de insetos
- Manter a população de P. versicolora em uma câmara de crescimento na condição de 27 °C e 70 ± umidade relativa de 5% com um fotoperíodo de 16 h de luz/8 h escuro. Coloque-os em caixas de plástico perfuradas com papel absorvente molhado de azulejos e alimente-os galhos de álamo frescos. Pulverize a água limpa no papel absorvente para manter a umidade e troque os galhos a cada dois dias.
- Isole adultos para oviposição após a pupação. Alimente-os com folhas macias para obter mais ovos.
- Coletar ovos recém-colocados (dentro de 24 h). Coloque os ovos em papel absorvente úmido por 60 h para preparar larvas axenic.
NOTA: Os ovos recém-colocados chocarão depois de ~72 h. A melhor hora para esterilizar superfícies de ovos é um dia antes da eclosão; caso contrário, o número de ovos eclodidos com sucesso diminuirá.
2. Cultivo de álamo sem germes
- Prepare as soluções de estoque de ácido acético Murashige e Skoog (MS) e 1 mg/mL α-naphthalene as soluções de estoque (NAA) (ver a Tabela de Materiais).
- Em uma capa de biossegurança, adicione 50 μL de solução de estoque NAA de 1 mg/mL a 500 mL de ms médio, agite para misturar bem e despeje ~50 mL por recipiente de cultura tecidual e espere pela solidificação.
- Preparar bisturis, lâmpada de álcool e fórceps; esterilizar os bisturis e fórceps na chama da lâmpada alcoólica no capô da biossegurança.
- Corte segmentos de haste de 3-4 cm com botões apical ou botões laterais de mudas de álamo a ~1 mês de crescimento (mudas cultivadas com tecido livre de germes), e insira-as no meio de cultura, um ou dois segmentos de haste por recipiente.
- Incubar esses segmentos de haste em uma câmara de crescimento a 25 °C e 50 ± intensidade de luz de 10 cd com um fotoperódo de 16 h de luz/8h escuro por aproximadamente 30 dias. Use as folhas sem germes para alimentar as larvas axenic.
3. Esterilização da superfície do ovo e criação de larvas axenic
- Placas de Petri autoclave, pincéis, papel filtro, água destilada, e uma placa de Petri contendo LB (Luria-Bertani) meio de ágar.
- Coloque as folhas com ovos aderentes em uma placa de Petri, retire cuidadosamente os ovos das folhas usando fórceps e transfira-os para outra placa de Petri.
NOTA: Esta etapa deve ser realizada com muito cuidado, pois os ovos são aderentes às folhas. - Lave esses ovos com 75% de etanol por 8 minutos e repita a lavagem quatro vezes com água estéril.
- Transfira os ovos para o meio ágar LB para preservar a umidade para eclodir.
NOTA: O uso do meio de ágar LB pode ajudar a verificar se o óvulo desinfetado está livre de germes. - Coloque a placa de Petri em uma câmara de crescimento e espere os ovos chocarem dentro de 24 horas.
- Em um capô biossegurança, ladrilho três pedaços de papel filtro molhado em uma placa de Petri, coloque folhas de álamo sem germes no papel, colete as larvas e coloque-as nas folhas, sele a placa de Petri com parafilm, e incuba-as em uma câmara de crescimento a 27 °C e 70 ± umidade relativa com um fotoperperiod de 16 h luz/8 h escuro.
NOTA: As folhas cultivadas por tecido são delicadas e podem perder água rapidamente. Assim, o uso de papel filtro úmido é necessário ao transferir as folhas para a placa de Petri. - Troque as folhas a cada dois dias.
- Para os grupos criados convencionalmente, transfira os ovos das folhas para uma placa de Petri contendo papel filtro úmido e alimente essas larvas com folhas de álamo sem germes.
4. Verificação de larvas axenic com ensaios dependentes da cultura
- Selecione aleatoriamente três larvas1, 2 e 3ª instar dos grupos criados sem germes e convencionalmente criados.
- Disseque as larvas3ª instar com tesouras estéreis e fórceps sob um estereótipo e colete suas entranhas em tubos de microcentrifuuge. Recolher larvas intactas1 e 2ª em tubos.
NOTA: Colete larvas inteiras de 1e 2º instar, pois são muito pequenas para dissecar, e mantenha suas entranhas intactas. - Adicione 100 μL de soro fisiológico tamponado com fosfato e três bolas de aço a tubos de 1,5 mL e triture os tecidos em homogeneizadores usando um homogeneizador de contas.
- Adicione 100 μL do homogeneado ao meio de ágar LB e placa usando uma haste de difusão de vidro estéril.
- Coloque as placas a 37 °C por 24 h e observe as colônias bacterianas.
5. Verificação de indivíduos axeônicos com ensaios independentes da cultura
- Extrair o DNA total dos tecidos (obtidos na seção 4) utilizando um kit de extração de DNA.
- Meça a concentração de DNA usando um espectrofotômetro a 260 nm.
- Amplie o gene rna 16S bacteriano usando primers universais de rRNA 16S com PCR. Configure o sistema de reação com 18 μL de 1,1x PCR master mix (ver a Tabela de Materiais), 0,5 μL de primer 27F (5'-ACGGATACCTTGTTACGAC-3'), 0,5 μL de primer 1495R (5'-ACGGATACCTTGTTACGAC-3') e 100 ng modelo de DNA. Definir as condições do PCR em 95 °C para 3 min; 28 ciclos de 95 °C para 30 s, 55 °C para 1 min e 72 °C por 1 min; seguido por 72 °C para 10 min. Armazene os produtos PCR a 4 °C até uma análise mais aprofundada.
- Misture os produtos PCR com corante ácido nucleico e analise-os usando eletroforese em um gel de 1% de agarose no tampão 1x TAE. Use 10 μL de um marcador de DNA como referência.
- Observe o gel com um transilluminador UV e procure o fragmento alvo em torno de 1.500 bp.
Resultados
As fases de vida de P. versicolora são mostradas na Figura 1. O macho adulto é menor que o feminino adulto (Figura 1A). No campo, o besouro agrupa seus ovos em uma folha; aqui, quatro ovos foram retirados de uma folha (Figura 1B). Os segmentos de haste de álamo e as mudas utilizadas para a criação de insetos axeônicos são mostrados na Figura 2. O intestino de uma larva instar 3é mostrado na Figura 3, e segmentos intestinais são marcados com suportes brancos.
Embora nenhuma colônia bacteriana tenha sido observada em qualquer grupo livre de germes, elas foram observadas em todos os grupos criados convencionalmente (Figura 4), indicando que larvas de ovos esterilizados que foram alimentados com folhas de álamo cultivadas por tecido não contêm bactérias. As bandas pcr de ~1.500 bp apareceram em todos os grupos criados convencionalmente. Em contraste, nenhuma banda foi observada nos grupos livres de germes ou no controle negativo (Figura 5), implicando que não existiam bactérias intestinais em larvas axenicas. Não houve diferenças no tempo de desenvolvimento larval, taxa de sobrevivência ou aparência entre larvas P. versicolora convencionalmente criadas . No entanto, a massa corporal de larvas livres de germes era ligeiramente maior do que a das larvas criadas convencionalmente no5º dia, embora as massas se tornem semelhantes antes da pupação16. Esses resultados confirmaram a viabilidade deste protocolo para preparar e retrovisor as larvas axenic.

Figura 1: Estágios de vida do besouro-folha de salgueiro, Plagiodera versicolora. (A) Adultos femininos e masculinos; (B) ovos; (C) 1st instar larva; (D)2ª larva instar; (E)3ª larva instar; e (F) pupa. Barras de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Segmentos de hastes de álamo e mudas. (A) Segmentos de haste com botões apical; (B) segmentos-tronco cresceram raízes após 10 dias; (C) uma muda de um mês de idade. Barras de escala = 1 cm. Clique aqui para ver uma versão maior desta figura.

Figura 3: O intestino de uma larva de terceira estrela. Foregut, midgut e hindgut são rotulados com suportes. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Confirmação da eficácia da eliminação de bactérias intestinais por meio da cultura de homogeneizadores de intestino ou insetos inteiros em placas de ágar LB. Nenhuma bactéria foi observada em larvas alimentadas com folhas de álamo sem germes, enquanto as bactérias foram observadas em grupos criados convencionalmente. Foram utilizadas1ª,2ª e3ª larvas instar para o ensaio. Três larvas foram selecionadas aleatoriamente em cada grupo. Abreviaturas: GF = larvas livres de germes; CR = larvas criadas convencionalmente. Clique aqui para ver uma versão maior desta figura.
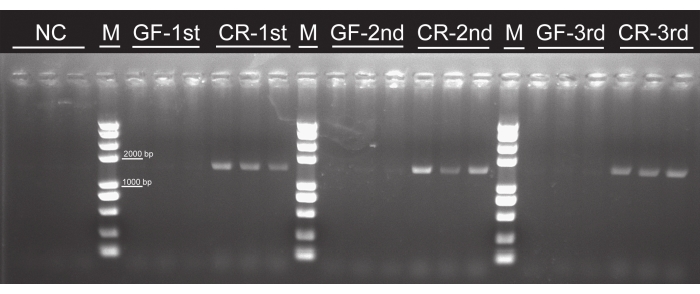
Figura 5: Confirmação da eficácia da eliminação de bactérias intestinais pelo ensaio PCR usando primers genéticos universais de 16S rRNA. A faixa-alvo do gene 16S rRNA é ~1.500 bp. 1st,2nd, e 3rd instar larvas foram usadas para o ensaio. Nenhuma faixa alvo foi observada nos grupos GF. Abreviaturas: NC = controle negativo; GF = livre de germes; CR = criado convencionalmente. Clique aqui para ver uma versão maior desta figura.
Discussão
A preparação de larvas livres de germes e a obtenção de larvas gnotobióticas, reintroduzindo cepas bacterianas específicas, são métodos poderosos para elucidar os mecanismos subjacentes às interações hospedeiro-micróbio. Larvas recém-eclodidas obtêm microbiota intestinal de duas formas principais: transmissão vertical da mãe para a prole ou aquisição horizontal de irmãos e ambiente34. O primeiro pode ser cumprido pela transferência dos pais para a prole através da contaminação da superfície do ovo35. Assim, é altamente viável obter larvas axenicas esterilizando superfícies de ovos deinsetos 27,28,29. A administração de um coquetel de vários antibióticos é outra forma de desenvolver insetos axenic, mas tem várias desvantagens28. Em contraste, a esterilização da superfície do ovo seguida de uma dieta axenic é melhor para o desenvolvimento de insetos axenic 23,28,29.
Os ovos da maioria dos besouros que consomem folhas são visíveis, facilmente adquiridos e simples de desinfetar. Esta é a principal razão pela qual um reagente simples (75% de etanol) e menor tempo (8 min) foram usados para desinfecção em comparação com estudos semelhantes (por exemplo, 40 min de desinfecção de ovo para fedorbug Plautia stali com 75% de etanol e formaldeído para obter insetos axenic; 6 min de esterilização da superfície do ovo de Drosophila com 1% de cloro ativo e 75% de etanol; e 10 min de esterilização da superfície do ovo de palmeira vermelha weevil Rhynchophorus ferrugineus com hipoclorato de sódio 10% de sódio solução)23,29,36. Para espécies de insetos com ovos minúsculos, o uso de desinfetantes e a duração da esterilização precisam ser otimizados, pois o tratamento pode impactar significativamente os resultados.
Em alguns casos, dietas artificiais sem germes são empregadas para a criação de insetos axenic após a esterilizaçãoda superfície do ovo 29,37. No entanto, desenvolver uma dieta artificial adequada para insetos é um processo tedioso e que consome mão-de-obra. Os nutrientes na dieta influenciam extensivamente a fisiologia dos insetos (por exemplo, tempo de desenvolvimento, imunidade) e microbiota intestinal 6,35. Assim, uma dieta artificial qualificada para um inseto deve conter uma composição nutricional semelhante ao alimento natural, o que é difícil de alcançar, especialmente para insetos fitofágicos. Neste protocolo, alimentamos insetos com plantas hospedeiras axeônicas, o que supera as deficiências de uma dieta artificial. É importante ressaltar que, como acontece com a planta de álamo aqui utilizada, também não é difícil obter mudas cultivadas por tecidos de muitas culturas economicamente importantes, como tabaco, batata, tomate, trigo e arroz por esterilização superficial de sementes ou desinfecção de seção de caule38. Note-se que os endófitos nas plantas podem existir em mudas cultivadas em tecido39 e podem ser eliminados através da tecnologia de cultura de meristem40. Em conclusão, este protocolo fornece um novo método para manter insetos livres de germes, que é uma ferramenta útil para facilitar estudos de interação entre insetos e intestinos.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi financiado pela National Natural Science Foundation of China (31971663) e pelo Young Elite Scientists Sponsorship Program by CAST (2020QNRC001).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filters | Millipore | SLGP033RB | |
| 1 mg/mL NAA stock solution | a. Prepare 0.1 M NaOH solution (dissolve 0.8 g NaOH in 200 mL of distilled water). b. Add 0.2 g NAA in a 250 mL beaker, add little 0.1 M NaOH solution until NAA dissolved, and adjust the final volume to 200 mL with distilled water. c. Filter the solution to remove bacteria with a 0.22 µm syringe filter and a 50 mL sterile syringe, subpackage the solution in 1.5 mL centrifuge tubes and restore at -20 °C. | ||
| 1.5 mL microcentrifuge tubes | Sangon Biotech | F600620 | |
| 10x PBS stock solution | Biosharp Life Sciences | BL302A | |
| 2 M KOH solution | Dissolve 22.44 g KOH (molecular weight: 56.1) in 200 mL of distilled water and autoclave it for 20 min at 121 °C. | ||
| 250 mL and 2,000 mL beakers | Shubo | sb16455 | |
| 50 mL sterile syringes | Jinta | JT0125789 | |
| 500 mL measuring cylinder | Shubo | sb1601 | |
| 50x TAE stock solution | a. Dissolve 242 g Tris and 18.612 g EDTA in 700 mL of distilled water. b. Adjust pH to 7.8 with about 57.1 mL of acetic acid. c. Adjust the final volume to 1,000 mL. d. The stock solution was diluted to 1x TAE buffer when used. | ||
| 75% ethanol | Xingheda trade | ||
| α-naphthalene acetic acid (NAA) | Solarbio Life Sciences | 86-87-3 | |
| Absorbing paper | 22.3 cm x 15.3 cm x 9 cm | ||
| Acetic acid | Sinopharm Chemical Reagent Co. Ltd | ||
| Agar | Coolaber | 9002-18-0 | |
| Agarose | Biowest | 111860 | |
| Autoclave | Panasonic | MLS-3781L-PC | |
| Bead-beating homogenizer | Jing Xin | XM-GTL64 | |
| DNA extraction kit | MP Biomedicals | 116560200 | |
| EDTA | Saiguo Biotech | 1340 | |
| Filter paper | Jiaojie | 70 mm diameter | |
| Gel electrophoresis unit | Bio-rad | 164-5052 | |
| Gel Signal Green nucleic acid dye | TsingKe | TSJ003 | |
| Germ-free poplar seedlings | Shan Xin poplar from Ludong University in Shandong Province | ||
| Golden Star Super PCR Master Mix (1.1×) | TsingKe | TSE101 | |
| Growth chamber | Ruihua | HP400GS-C | |
| LB agar medium | a. Dissolve 5 g tryptone, 5 g NaCl, 2.5 g yeast extract in 300 mL of distilled water. b. Adjust the final volume to 500 mL, transfer the solution to a 1,000 mL conical flask, and add 7.5 g agar. c. Autoclave the medium for 20 min at 121 °C. | ||
| Mini centrifuge | DRAGONLAB | D1008 | |
| MS basic medium | Coolaber | PM1121-50L | M0245 |
| MS solid medium for germ-free poplar seedling culture | a. Dissolve 4.43 g MS basic medium powder and 30 g sucrose in 800 mL of distilled water. b. Adjust the pH to about 5.8 with 2 M KOH by a pH meter. c. Adjust the final volume to 1,000 mL, separate into two parts, transfer into two 1,000 mL conical flasks, and add 2.6 g agar per 500 mL. d. Autoclave for 20 min at 121 °C. | ||
| NanoDrop 1000 spectrophotometer | Thermo Fisher Scientific | ||
| Paintbrush | 1 cm width, used to collect the eggs | ||
| Parafilm | Bemis | PM-996 | |
| PCR Thermal Cyclers | Eppendorf | 6331000076 | |
| Petri dishes | Supin | 90 mm diameter | |
| pH meter | METTLER TOLEDO | FE20 | |
| Pipettes 0.2-2 µL | Gilson | ECS000699 | |
| Pipettes 100-1,000 µL | Eppendorf | 3120000267 | |
| Pipettes 20-200 µL | Eppendorf | 3120000259 | |
| Pipettes 2-20 µL | Eppendorf | 3120000232 | |
| Plant tissue culture container | Chembase | ZP21 | 240 mL |
| Plastic box | 2.35 L | ||
| Potassium hydroxide (KOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Primers for amplifying the bacterial 16S rRNA gene | Sangon Biotech | 27-F: 5’-ACGGATACCTTGTTACGAC-3’, 1492R: 5’-ACGGATACCTTGTTACGAC-3’ | |
| Sodium chloride (NaCl) | Sinopharm Chemical Reagent Co. Ltd | ||
| Sodium hydroxide (NaOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Steel balls | 0.25 mm | used to grind tissues | |
| Stereomicroscope | OLYMPUS | SZ61 | |
| Sucrose | Sinopharm Chemical Reagent Co. Ltd | ||
| Trans2K plus II DNA marker | Transgene Biotech | BM121-01 | |
| Tris base | Biosharp Life Sciences | 1115 | |
| Tryptone | Thermo Fisher Scientific | LP0037 | |
| UV transilluminator | Monad Biotech | QuickGel 6100 | |
| Vortexer | Scilogex | MX-S | |
| Willow branches | Sha Lake Park, Wuhan, China | ||
| Willow leaf beetle | Huazhong Agricultural University, Wuhan, China | ||
| Yeast extract | Thermo Fisher Scientific | LP0021 |
Referências
- Moran, N. A., Ochman, H., Hammer, T. J. Evolutionary and ecological consequences of gut microbial communities. Annual Review of Ecology, Evolution, and Systematics. 50 (1), 451-475 (2019).
- Warnecke, F., et al. Metagenomic and functional analysis of hindgut microbiota of a wood-feeding higher termite. Nature. 450 (7169), 560-565 (2007).
- Tokuda, G., et al. Fiber-associated spirochetes are major agents of hemicellulose degradation in the hindgut of wood-feeding higher termites. Proceedings of the National Academy of Sciences of the United States of America. 115 (51), 11996-12004 (2018).
- Wang, G. H., et al. Changes in microbiome confer multigenerational host resistance after sub-toxic pesticide exposure. Cell Host & Microbe. 27 (2), 213-224 (2020).
- Shin, S. C., et al. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science. 334 (6056), 670-674 (2011).
- Storelli, G., et al. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing. Cell Metabolism. 14 (3), 403-414 (2011).
- Salem, H., et al. Vitamin supplementation by gut symbionts ensures metabolic homeostasis in an insect host. Proceedings. Biological Sciences. 281 (1796), 20141838 (2014).
- Koch, H., Schmid-Hempel, P. Socially transmitted gut microbiota protect bumble bees against an intestinal parasite. Proceedings of the National Academy of Sciences of the United States of America. 108 (48), 19288-19292 (2011).
- Cirimotich, C. M., et al. Natural microbe-mediated refractoriness to Plasmodium infection in Anopheles gambiae. Science. 332 (6031), 855-858 (2011).
- Kaltenpoth, M., Gottler, W., Herzner, G., Strohm, E. Symbiotic bacteria protect wasp larvae from fungal infestation. Current Biology. 15 (5), 475-479 (2005).
- Yuan, C., Xing, L., Wang, M., Hu, Z., Zou, Z. Microbiota modulates gut immunity and promotes baculovirus infection in Helicoverpa armigera. Insect Science. , (2021).
- Dillon, R. J., Vennard, C. T., Charnley, A. K. Pheromones - Exploitation of gut bacteria in the locust. Nature. 403 (6772), 851 (2000).
- Xu, L. T., Lou, Q. Z., Cheng, C. H., Lu, M., Sun, J. H. Gut-associated bacteria of Dendroctonus valens and their involvement in verbenone production. Microbial Ecology. 70 (4), 1012-1023 (2015).
- Schretter, C. E., et al. A gut microbial factor modulates locomotor behaviour in Drosophila. Nature. 563 (7731), 402-406 (2018).
- Jia, Y., et al. Gut microbiome modulates Drosophila aggression through octopamine signaling. Nature Communications. 12 (1), 2698 (2021).
- Ma, M., et al. Metabolic and immunological effects of gut microbiota in leaf beetles at the local and systemic levels. Integrative Zoology. 16 (3), 313-323 (2021).
- Xu, L., et al. Synergistic action of the gut microbiota in environmental RNA interference in a leaf beetle. Microbiome. 9 (1), 98 (2021).
- Xu, L., et al. Gut microbiota in an invasive bark beetle infected by a pathogenic fungus accelerates beetle mortality. Journal of Pest Science. 92, 343-351 (2019).
- Berasategui, A., Shukla, S., Salem, H., Kaltenpoth, M. Potential applications of insect symbionts in biotechnology. Applied Microbiology and Biotechnology. 100 (4), 1567-1577 (2016).
- Tikhe, C. V., Martin, T. M., Howells, A., Delatte, J., Husseneder, C. Assessment of genetically engineered Trabulsiella odontotermitis as a 'Trojan Horse' for paratransgenesis in termites. BMC Microbiology. 16 (1), 202 (2016).
- Wang, S., et al. Fighting malaria with engineered symbiotic bacteria from vector mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12734-12739 (2012).
- Leonard, S. P., et al. Engineered symbionts activate honey bee immunity and limit pathogens. Science. 367 (6477), 573-576 (2020).
- Kietz, C., Pollari, V., Meinander, A. Generating germ-free Drosophila to study gut-microbe interactions: protocol to rear Drosophila under axenic conditions. Current Protocols in Toxicology. 77 (1), 52 (2018).
- Brummel, T., Ching, A., Seroude, L., Simon, A. F., Benzer, S. Drosophila lifespan enhancement by exogenous bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12974-12979 (2004).
- Correa, M. A., Matusovsky, B., Brackney, D. E., Steven, B. Generation of axenic Aedes aegypti demonstrate live bacteria are not required for mosquito development. Nature Communications. 9 (1), 4464 (2018).
- Romoli, O., Schonbeck, J. C., Hapfelmeier, S., Gendrin, M. Production of germ-free mosquitoes via transient colonisation allows stage-specific investigation of host-microbiota interactions. Nature Communications. 12 (1), 942 (2021).
- Berasategui, A., et al. Gut microbiota of the pine weevil degrades conifer diterpenes and increases insect fitness. Molecular Ecology. 26 (15), 4099-4110 (2017).
- Lin, X. L., Kang, Z. W., Pan, Q. J., Liu, T. X. Evaluation of five antibiotics on larval gut bacterial diversity of Plutella xylostella (Lepidoptera: Plutellidae). Insect Science. 22 (5), 619-628 (2015).
- Muhammad, A., Habineza, P., Hou, Y., Shi, Z. Preparation of red palm weevil Rhynchophorus Ferrugineus (Olivier) (Coleoptera: Dryophthoridae) germ-free larvae for host-gut microbes interaction studies. Bio-protocol. 9 (24), 3456 (2019).
- Gelman, D. B., Bell, R. A., Liska, L. J., Hu, J. S. Artificial diets for rearing the Colorado potato beetle, Leptinotarsa decemlineata. Journal of Insect Science. 1, 7 (2001).
- Bengtson, D. A. A comprehensive program for the evaluation of artificial diets. Journal of the World Aquaculture Society. 24 (2), 285-293 (2007).
- Utsumi, S., Ando, Y., Ohgushi, T. Evolution of feeding preference in a leaf beetle: the importance of phenotypic plasticity of a host plant. Ecology Letters. 12 (9), 920-929 (2009).
- Ishihara, M., Ohgushi, T. Reproductive inactivity and prolonged developmental time induced by seasonal decline in host plant quality in the willow leaf beetle Plagiodera versicolora (Coleoptera: Chrysomelidae). Environmental Entomology. 35 (2), 524-530 (2006).
- Bright, M., Bulgheresi, S. A complex journey: transmission of microbial symbionts. Nature Reviews: Microbiology. 8 (3), 218-230 (2010).
- Hassan, B., Siddiqui, J. A., Xu, Y. Vertically transmitted gut bacteria and nutrition influence the immunity and fitness of Bactrocera dorsalis larvae. Frontiers in Microbiology. 11, 596352 (2020).
- Hosokawa, T., et al. Obligate bacterial mutualists evolving from environmental bacteria in natural insect populations. Nature Microbiology. 1, 15011 (2016).
- Habineza, P., et al. The promoting effect of gut microbiota on growth and development of red palm weevil, Rhynchophorus ferrugineus (Olivier) (Coleoptera: Dryophthoridae) by modulating its nutritional metabolism. Frontiers in Microbiology. 10, 1212 (2019).
- Meilan, R., Ma, C. Poplar (Populus spp.). Methods in Molecular Biology. 344, 143-151 (2006).
- Wani, Z. A., Ashraf, N., Mohiuddin, T., Riyaz-Ul-Hassan, S. Plant-endophyte symbiosis, an ecological perspective. Applied Microbiology and Biotechnology. 99 (7), 2955-2965 (2015).
- Grout, B. W. Meristem-tip culture. Methods in Molecular Biology. 6, 81-91 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados