Method Article
Préparation et élevage d’insectes axeniques avec des semis de culture tissulaire pour les études d’interaction entre le microbiote hôte et intestinal du coléoptère
Dans cet article
Résumé
Pour obtenir un insecte axenique, sa surface d’œuf est stérilisée et la larve éclose est ensuite élevée à l’aide de feuilles axeniques. Cette méthode fournit un moyen efficace pour la préparation d’insectes axeniques sans administrer d’antibiotiques ou développer un régime artificiel, qui peut également être appliqué à d’autres insectes mangeurs de feuilles.
Résumé
Les intestins des insectes sont colonisés par diverses bactéries qui peuvent avoir un impact profond sur les traits physiologiques de l’hôte. L’introduction d’une souche bactérienne particulière dans un insecte axenique est une méthode puissante pour vérifier la fonction microbienne intestinale et élucider les mécanismes sous-jacents aux interactions intestin microbe-hôte. L’administration d’antibiotiques ou la stérilisation des surfaces des œufs sont deux méthodes couramment utilisées pour éliminer les bactéries intestinales des insectes. Cependant, en plus des effets indésirables potentiels des antibiotiques sur les insectes, des études antérieures ont indiqué que l’alimentation en antibiotiques ne pouvait pas éliminer les bactéries intestinales. Ainsi, les régimes artificiels sans germes sont généralement utilisés pour maintenir les insectes axeniques, ce qui est un processus fastidieux et laborieux qui ne peut pas ressembler pleinement aux composants nutritionnels des aliments naturels. Décrit ici est un protocole efficace et simple pour préparer et maintenir les larves axeniques d’un coléoptère (Plagiodera versicolora). Plus précisément, les surfaces des œufs de coléoptères ont été stérilisées, après quoi des feuilles de peuplier exemptes de germes ont été utilisées pour élever des larves d’axenique. Le statut axenique des insectes a ensuite été confirmé par des essais dépendants de la culture et indépendants de la culture. Collectivement, en combinant la désinfection des œufs et la culture sans germes, une méthode efficace et pratique a été développée pour obtenir P. versicolora axenique, fournissant un outil facilement transférable pour d’autres insectes mangeurs de feuilles.
Introduction
Semblable aux mammifères, le tube digestif des insectes est une cavité pour la digestion et l’absorption des aliments. La plupart des insectes abritent diverses bactéries commensales qui se développent dans leurs intestins et vivent de la nutrition fournie par les hôtes1. La communauté commensale intestinale a un impact profond sur de multiples processus physiologiques chez les insectes, y compris la digestion et la désintoxication des aliments 2,3,4, la nutrition et le développement 5,6,7, la défense contre les agents pathogènes et les parasites 8,9,10,11, la communication chimique12,13 et les comportements14 ,15. Curieusement, certains microbiotes intestinaux peuvent être facultativement pathogènes ou être manipulés par des agents pathogènes envahisseurs pour aggraver l’infection, ce qui indique que les bactéries intestinales peuvent être nocives dans certains cas 16,17,18. Les bactéries intestinales peuvent également servir de ressource microbienne pour les applications biotechniques et la lutte antiparasitaire. Par exemple, des bactéries digérant la lignocellulose provenant d’insectes phytophages et xylophages ont été utilisées pour digérer les cellules végétales afin de développer des biocarburants19. La dispersion de symbiotes intestinaux modifiés exprimant des molécules bioactives est une tactique nouvelle et prometteuse pour lutter contre les ravageurs agricoles et forestiers et les moustiques transmettant des maladies infectieuses 19,20,21, qui peut également être utilisée pour améliorer l’aptitude des insectes utiles 22. Illustrer comment une bactérie intestinale se comporte in vivo est donc considéré comme une priorité pour tirer pleinement parti de sa fonction et l’exploiter davantage pour diverses applications.
Les animaux peuvent abriter de 1 à > 1000 espèces microbiennes symbiotiques dans l’intestin1. En conséquence, il est difficile de vérifier avec précision comment les taxons bactériens individuels ou leur assemblage se comportent à l’intérieur d’un animal, et si l’hôte ou ses partenaires microbiens déterminent une fonction spécifique. Par conséquent, la préparation de larves axeniques pour obtenir des insectes gnotobiotiques par colonisation mono- ou multi-espèces est nécessaire pour étudier la fonction bactérienne et l’interaction avec les insectes23. À l’heure actuelle, l’administration de cocktails antibiotiques et la stérilisation de la surface des œufs d’insectes sont des méthodes courantes pour éliminer les bactéries intestinales 14,24,25,26. Cependant, les régimes antibiotiques ne peuvent pas éliminer complètement les bactéries intestinales et ont un effet négatif sur la physiologie de l’insecte hôte27,28. Par conséquent, l’utilisation d’insectes traités aux antibiotiques peut obscurcir les véritables capacités de certaines bactéries intestinales. Heureusement, la stérilisation de surface des œufs peut annuler ce problème23,29, qui n’a pas ou peu d’effets sur les insectes expérimentaux. En outre, les régimes artificiels ne peuvent pas ressembler pleinement aux aliments naturels pour insectes, et le développement d’un régime artificiel est un processus coûteux et laborieux30,31.
Le coléoptère du saule, Plagiodera versicolora (Laicharting) (Coleoptera: Chrysomelidae), est un ravageur répandu qui mange les feuilles et se nourrit principalement d’arbres saplicacés, tels que les saules (Salix) et le peuplier (Populus L.) 32,33. Ici, le dendroctone du saule a été utilisé comme insecte mangeur de feuilles représentatif pour développer un protocole de préparation et d’élevage d’un insecte sans germes. Nous avons exploité la culture de tissus végétaux pour obtenir des feuilles de peuplier exemptes de germes pour élever des larves de P. versicolora axenic à partir d’œufs stérilisés. Le statut axenique des larves de P. versicolora a été vérifié par des tests dépendants de la culture et indépendants de la culture. Ce protocole peut maintenir des insectes axeniques qui imitent mieux la condition sauvage que l’élevage d’insectes avec un régime artificiel. Plus important encore, cette méthode est pratique à un coût très faible, ce qui augmente la faisabilité de l’obtention d’insectes axeniques pour de futures études d’interaction insecte-intestin, en particulier pour les insectes non modèles sans régime artificiel bien développé.
Protocole
1. Élevage d’insectes
- Maintenir la population de P. versicolora dans une chambre de croissance à l’état de 27 °C et 70 ± 5 % d’humidité relative avec une photopériode de 16 h de lumière/8 h d’obscurité. Placez-les dans des boîtes en plastique perforées avec du papier absorbant humide carrelé et nourrissez-les de branches de peuplier frais. Vaporisez de l’eau propre sur du papier absorbant pour maintenir l’humidité et changez les branches tous les deux jours.
- Isoler les adultes pour la ponte après la nymphose. Nourrissez-les de feuilles tendres pour obtenir plus d’œufs.
- Recueillir les œufs nouvellement pondus (dans les 24 heures). Placez les œufs sur du papier absorbant humide pendant 60 h pour préparer les larves d’axenique.
REMARQUE: Les œufs nouvellement pondus éclosent après environ 72 h. Le meilleur moment pour stériliser les surfaces des œufs est la veille de l’éclosion; sinon, le nombre d’œufs éclos avec succès diminuera.
2. Culture de peupliers sans germes
- Préparer des solutions mères de Murashige et de Skoog (MS) et de 1 mg/mL d’acide acétique α-naphtalène (NAA) (voir la Table des matériaux).
- Dans une hotte de biosécurité, ajouter 50 μL de solution mère NAA de 1 mg/mL à 500 mL de milieu MS, agiter pour bien mélanger et verser environ 50 mL par récipient de culture tissulaire et attendre la solidification.
- Préparez des scalpels, une lampe à alcool et une pince; stériliser les scalpels et les pinces dans la flamme de la lampe à alcool dans la hotte de biosécurité.
- Couper des segments de tige de 3 à 4 cm avec des bourgeons apicaux ou des bourgeons latéraux de plants de peuplier à environ 1 mois de croissance (semis de culture tissulaire sans germes) et les insérer dans le milieu de culture, un ou deux segments de tige par récipient.
- Incuber ces segments de tige dans une chambre de croissance à 25 °C et 50 ± intensité lumineuse de 10 cd avec une photopériode de 16 h de lumière/8 h d’obscurité pendant environ 30 jours. Utilisez les feuilles exemptes de germes pour nourrir les larves axeniques.
3. Stérilisation à la surface des œufs et élevage des larves axeniques
- Boîtes de Petri autoclaves, pinceaux, papier filtre, eau distillée et une boîte de Petri contenant du support de gélose LB (Luria-Bertani).
- Placez les feuilles avec des œufs adhérents dans une boîte de Pétri, retirez soigneusement les œufs des feuilles à l’aide d’une pince et transférez-les dans une autre boîte de Pétri.
REMARQUE: Cette étape doit être effectuée très soigneusement car les œufs adhèrent aux feuilles. - Lavez ces œufs avec de l’éthanol à 75% pendant 8 min et répétez le lavage quatre fois avec de l’eau stérile.
- Transférer les œufs sur un milieu de gélose LB pour préserver l’humidité pour l’éclosion.
REMARQUE: L’utilisation d’un milieu de gélose LB peut aider à vérifier si l’œuf désinfecté est exempt de germes. - Placez la boîte de Pétri dans une chambre de croissance et attendez que les œufs éclosent dans les 24 heures.
- Dans une hotte de biosécurité, carreler trois morceaux de papier filtre humide dans une boîte de Pétri, placer des feuilles de peuplier sans germes sur le papier, recueillir les larves et les placer sur les feuilles, sceller la boîte de Pétri avec un parafilm et les incuber dans une chambre de croissance à 27 °C et 70 ± 5% d’humidité relative avec une photopériode de 16 h de lumière / 8 h d’obscurité.
REMARQUE: Les feuilles cultivées en tissu sont délicates et peuvent perdre de l’eau rapidement. Ainsi, l’utilisation de papier filtre humide est nécessaire lors du transfert des feuilles dans la boîte de Pétri. - Changez les feuilles tous les deux jours.
- Pour les groupes élevés de manière conventionnelle, transférez les œufs des feuilles dans une boîte de Pétri contenant du papier filtre humide et nourrissez ces larves avec des feuilles de peuplier exemptes de germes.
4. Vérification des larves d’axenique avec des tests dépendants de la culture
- Sélectionnez au hasard trois larvesde 1 ème, 2e et 3e stade parmi les groupes exempts de germes et élevés de manière conventionnelle.
- Disséquez les larves du3ème stade avec des ciseaux et des pinces stériles sous un stéréomicroscope et collectez leurs intestins dans des tubes de microcentrifugation. Recueillir intactesles larves du 1er et du 2 e stade dansdes tubes.
REMARQUE: Recueillir les larves entières du1er et du 2e stade car elles sont trop petites pour être disséquées et garder leurs intestins intacts. - Ajouter 100 μL de solution saline tamponnée au phosphate et trois billes d’acier dans des tubes de 1,5 mL et broyer les tissus en homogénats à l’aide d’un homogénéisateur battant les billes.
- Ajouter 100 μL de l’homogénat au milieu de la gélose LB et plaquer à l’aide d’une tige d’étalement en verre stérile.
- Placez les plaques à 37 °C pendant 24 h et observez les colonies bactériennes.
5. Vérification des individus axeniques avec des tests indépendants de la culture
- Extraire l’ADN total des tissus (obtenu à la section 4) à l’aide d’un kit d’extraction d’ADN.
- Mesurer la concentration d’ADN à l’aide d’un spectrophotomètre à 260 nm.
- Amplifier le gène de l’ARNr 16S bactérien à l’aide d’amorces universelles d’ARNr 16S avec PCR. Configurez le système de réaction avec 18 μL de 1,1x mélange maître PCR (voir la table des matériaux), 0,5 μL d’amorce 27F (5'-ACGGATACCTTGTTACGAC-3'), 0,5 μL d’amorce 1495R (5'-ACGGATACCTTGTTACGAC-3') et 100 ng d’ADN modèle. Réglez les conditions de PCR à 95 °C pendant 3 min; 28 cycles de 95 °C pendant 30 s, 55 °C pendant 1 min et 72 °C pendant 1 min; suivi de 72 °C pendant 10 min. Conserver les produits PCR à 4 °C jusqu’à une analyse plus approfondie.
- Mélangez les produits PCR avec un colorant d’acide nucléique et analysez-les par électrophorèse sur un gel d’agarose à 1% dans 1x tampon TAE. Utilisez 10 μL d’un marqueur d’ADN comme référence.
- Observez le gel avec un transilluminateur UV et recherchez le fragment cible autour de 1 500 bp.
Résultats
Les étapes de la vie de P. versicolora sont illustrées à la figure 1. Le mâle adulte est plus petit que la femelle adulte (figure 1A). Dans le champ, le coléoptère regroupe ses œufs sur une feuille; ici, quatre œufs ont été détachés d’une feuille (figure 1B). Les segments de tiges de peuplier et les semis utilisés pour l’élevage d’insectes hacheniques sont illustrés à la figure 2. L’intestin d’une larve du3e stade est représenté à la figure 3 et les segments de l’intestin sont marqués de crochets blancs.
Bien qu’aucune colonie bactérienne n’ait été observée dans aucun groupe exempt de germes, elle a été observée dans tous les groupes élevés de façon conventionnelle (figure 4), ce qui indique que les larves d’œufs stérilisés nourris avec des feuilles de peuplier cultivées en tissu ne contiennent aucune bactérie. Les bandes PCR d’environ 1 500 pb sont apparues dans tous les groupes élevés de manière conventionnelle. En revanche, aucune bande n’a été observée dans les groupes exempts de germes ou le témoin négatif (figure 5), ce qui implique qu’aucune bactérie intestinale n’existait chez les larves d’axenique. Il n’y avait aucune différence dans le temps de développement larvaire, le taux de survie ou l’apparence entre les larves de P. versicolora exemptes de germes et élevées de manière conventionnelle. Cependant, la masse corporelle des larves exemptes de germes était légèrement supérieure à celle des larves élevées de manière conventionnelle le 5e jour, bien que les masses deviennent similaires avant la nymphose16. Ces résultats ont confirmé la faisabilité de ce protocole pour préparer et élever les larves axeniques.

Figure 1 : Stades de vie du dendroctone du saule, Plagiodera versicolora. (A) Adultes femelles et mâles; B) les œufs; (C) 1ère larve d’instar; D) 2e larve du stade; (E) 3e larve d’instar; et (F) pupe. Barres d’échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Segments et semis de tiges de peuplier. (A) Segments de tige avec bourgeons apicaux; (B) les segments de tige ont poussé des racines après 10 jours; C) un semis d’un mois. Barres d’échelle = 1 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : L’intestin d’une larve du troisième stade. L’intestin antérieur, l’intestin moyen et l’intestin postérieur sont étiquetés avec des crochets. Barre d’échelle = 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Confirmation de l’efficacité de l’élimination des bactéries intestinales par la culture d’homogénats d’insectes intestinaux ou entiers sur des plaques de gélose LB. Aucune bactérie n’a été observée chez les larves nourries avec des feuilles de peuplier exemptes de germes, alors que des bactéries ont été observées dans des groupes élevés de manière conventionnelle. Leslarves des 1er, 2e et3e stades ont été utilisées pour le dosage. Trois larves ont été sélectionnées au hasard dans chaque groupe. Abréviations : GF = larves exemptes de germes; CR = larves élevées de façon conventionnelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
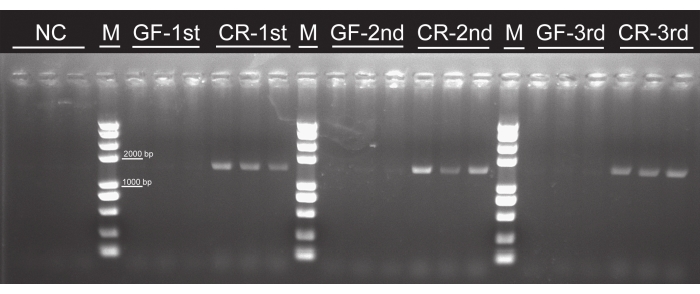
Figure 5 : Confirmation de l’efficacité de l’élimination des bactéries intestinales par pcR à l’aide d’amorces universelles du gène de l’ARNr 16S. La bande cible du gène de l’ARNr 16S est d’environ 1 500 pb. 1ère, 2ème et3ème larves d’instar ont été utilisées pour le test. Aucune bande cible n’a été observée dans les groupes GF. Abréviations : NC = contrôle négatif; GF = sans germes; CR = élevé de façon conventionnelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La préparation de larves exemptes de germes et l’obtention de larves gnotobiotiques en réintroduisant des souches bactériennes spécifiques sont des méthodes puissantes pour élucider les mécanismes sous-jacents aux interactions hôte-microbe. Les larves nouvellement écloses obtiennent le microbiote intestinal de deux manières principales: la transmission verticale de la mère à la progéniture ou l’acquisition horizontale par les frères et sœurs et l’environnement34. Le premier peut être rempli par transfert parental à la progéniture par contamination de la surface de l’œuf35. Ainsi, il est hautement possible d’obtenir des larves axeniques en stérilisant les surfaces des œufs d’insectes 27,28,29. L’administration d’un cocktail de plusieurs antibiotiques est un autre moyen de développer des insectes axeniques mais présente plusieurs inconvénients28. En revanche, la stérilisation de la surface des œufs suivie d’un régime axenique est meilleure pour le développement d’insectes axeniques 23,28,29.
Les œufs de la plupart des coléoptères consommateurs de feuilles sont visibles, faciles à acquérir et simples à désinfecter. C’est la principale raison pour laquelle un réactif simple (éthanol à 75 %) et un temps plus court (8 min) ont été utilisés pour la désinfection par rapport à des études similaires (par exemple, 40 min de désinfection des œufs pour plautia stali avec 75 % d’éthanol et de formaldéhyde pour obtenir des insectes axeniques; 6 min de stérilisation de la surface de l’œuf de Drosophila avec 1% de chlore actif et 75% d’éthanol; et 10 min de stérilisation à la surface de l’œuf du charançon rouge Rhynchophorus ferrugineus avec 10% d’hypochlorite de sodium solution)23,29,36. Pour les espèces d’insectes avec de minuscules œufs, l’utilisation de désinfecteurs et la durée de stérilisation doivent être optimisées car le traitement peut avoir un impact significatif sur les résultats.
Dans certains cas, des régimes artificiels sans germes sont utilisés pour l’élevage d’insectes axeniques après la stérilisation à la surface desœufs 29,37. Cependant, le développement d’un régime artificiel approprié pour les insectes est un processus fastidieux et laborieux. Les nutriments contenus dans l’alimentation influencent largement la physiologie des insectes (par exemple, le temps de développement, l’immunité) et le microbiote intestinal 6,35. Ainsi, un régime artificiel qualifié pour un insecte devrait contenir une composition nutritionnelle similaire à celle de l’aliment naturel, ce qui est difficile à réaliser, en particulier pour les insectes phytophages. Dans ce protocole, nous avons nourri les insectes avec des plantes hôtes axeniques, ce qui surmonte les lacunes d’un régime artificiel. Il est important de noter que, comme pour le peuplier utilisé ici, il n’est pas difficile non plus d’obtenir des semis cultivés en tissu à partir de nombreuses cultures économiquement importantes telles que le tabac, la pomme de terre, la tomate, le blé et le riz par stérilisation à la surface des graines ou désinfection de la section de la tige38. Il convient de noter que les endophytes chez les plantes peuvent exister dans les semis cultivés en tissu39 et peuvent être éliminés grâce à la technologie de culture du méristème à pointe de pousse40. En conclusion, ce protocole fournit une nouvelle méthode pour maintenir les insectes exempts de germes, qui est un outil pratique pour faciliter les études d’interaction insecte-bactéries intestinales.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été financé par la National Natural Science Foundation of China (31971663) et le Young Elite Scientists Sponsorship Program de CAST (2020QNRC001).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filters | Millipore | SLGP033RB | |
| 1 mg/mL NAA stock solution | a. Prepare 0.1 M NaOH solution (dissolve 0.8 g NaOH in 200 mL of distilled water). b. Add 0.2 g NAA in a 250 mL beaker, add little 0.1 M NaOH solution until NAA dissolved, and adjust the final volume to 200 mL with distilled water. c. Filter the solution to remove bacteria with a 0.22 µm syringe filter and a 50 mL sterile syringe, subpackage the solution in 1.5 mL centrifuge tubes and restore at -20 °C. | ||
| 1.5 mL microcentrifuge tubes | Sangon Biotech | F600620 | |
| 10x PBS stock solution | Biosharp Life Sciences | BL302A | |
| 2 M KOH solution | Dissolve 22.44 g KOH (molecular weight: 56.1) in 200 mL of distilled water and autoclave it for 20 min at 121 °C. | ||
| 250 mL and 2,000 mL beakers | Shubo | sb16455 | |
| 50 mL sterile syringes | Jinta | JT0125789 | |
| 500 mL measuring cylinder | Shubo | sb1601 | |
| 50x TAE stock solution | a. Dissolve 242 g Tris and 18.612 g EDTA in 700 mL of distilled water. b. Adjust pH to 7.8 with about 57.1 mL of acetic acid. c. Adjust the final volume to 1,000 mL. d. The stock solution was diluted to 1x TAE buffer when used. | ||
| 75% ethanol | Xingheda trade | ||
| α-naphthalene acetic acid (NAA) | Solarbio Life Sciences | 86-87-3 | |
| Absorbing paper | 22.3 cm x 15.3 cm x 9 cm | ||
| Acetic acid | Sinopharm Chemical Reagent Co. Ltd | ||
| Agar | Coolaber | 9002-18-0 | |
| Agarose | Biowest | 111860 | |
| Autoclave | Panasonic | MLS-3781L-PC | |
| Bead-beating homogenizer | Jing Xin | XM-GTL64 | |
| DNA extraction kit | MP Biomedicals | 116560200 | |
| EDTA | Saiguo Biotech | 1340 | |
| Filter paper | Jiaojie | 70 mm diameter | |
| Gel electrophoresis unit | Bio-rad | 164-5052 | |
| Gel Signal Green nucleic acid dye | TsingKe | TSJ003 | |
| Germ-free poplar seedlings | Shan Xin poplar from Ludong University in Shandong Province | ||
| Golden Star Super PCR Master Mix (1.1×) | TsingKe | TSE101 | |
| Growth chamber | Ruihua | HP400GS-C | |
| LB agar medium | a. Dissolve 5 g tryptone, 5 g NaCl, 2.5 g yeast extract in 300 mL of distilled water. b. Adjust the final volume to 500 mL, transfer the solution to a 1,000 mL conical flask, and add 7.5 g agar. c. Autoclave the medium for 20 min at 121 °C. | ||
| Mini centrifuge | DRAGONLAB | D1008 | |
| MS basic medium | Coolaber | PM1121-50L | M0245 |
| MS solid medium for germ-free poplar seedling culture | a. Dissolve 4.43 g MS basic medium powder and 30 g sucrose in 800 mL of distilled water. b. Adjust the pH to about 5.8 with 2 M KOH by a pH meter. c. Adjust the final volume to 1,000 mL, separate into two parts, transfer into two 1,000 mL conical flasks, and add 2.6 g agar per 500 mL. d. Autoclave for 20 min at 121 °C. | ||
| NanoDrop 1000 spectrophotometer | Thermo Fisher Scientific | ||
| Paintbrush | 1 cm width, used to collect the eggs | ||
| Parafilm | Bemis | PM-996 | |
| PCR Thermal Cyclers | Eppendorf | 6331000076 | |
| Petri dishes | Supin | 90 mm diameter | |
| pH meter | METTLER TOLEDO | FE20 | |
| Pipettes 0.2-2 µL | Gilson | ECS000699 | |
| Pipettes 100-1,000 µL | Eppendorf | 3120000267 | |
| Pipettes 20-200 µL | Eppendorf | 3120000259 | |
| Pipettes 2-20 µL | Eppendorf | 3120000232 | |
| Plant tissue culture container | Chembase | ZP21 | 240 mL |
| Plastic box | 2.35 L | ||
| Potassium hydroxide (KOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Primers for amplifying the bacterial 16S rRNA gene | Sangon Biotech | 27-F: 5’-ACGGATACCTTGTTACGAC-3’, 1492R: 5’-ACGGATACCTTGTTACGAC-3’ | |
| Sodium chloride (NaCl) | Sinopharm Chemical Reagent Co. Ltd | ||
| Sodium hydroxide (NaOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Steel balls | 0.25 mm | used to grind tissues | |
| Stereomicroscope | OLYMPUS | SZ61 | |
| Sucrose | Sinopharm Chemical Reagent Co. Ltd | ||
| Trans2K plus II DNA marker | Transgene Biotech | BM121-01 | |
| Tris base | Biosharp Life Sciences | 1115 | |
| Tryptone | Thermo Fisher Scientific | LP0037 | |
| UV transilluminator | Monad Biotech | QuickGel 6100 | |
| Vortexer | Scilogex | MX-S | |
| Willow branches | Sha Lake Park, Wuhan, China | ||
| Willow leaf beetle | Huazhong Agricultural University, Wuhan, China | ||
| Yeast extract | Thermo Fisher Scientific | LP0021 |
Références
- Moran, N. A., Ochman, H., Hammer, T. J. Evolutionary and ecological consequences of gut microbial communities. Annual Review of Ecology, Evolution, and Systematics. 50 (1), 451-475 (2019).
- Warnecke, F., et al. Metagenomic and functional analysis of hindgut microbiota of a wood-feeding higher termite. Nature. 450 (7169), 560-565 (2007).
- Tokuda, G., et al. Fiber-associated spirochetes are major agents of hemicellulose degradation in the hindgut of wood-feeding higher termites. Proceedings of the National Academy of Sciences of the United States of America. 115 (51), 11996-12004 (2018).
- Wang, G. H., et al. Changes in microbiome confer multigenerational host resistance after sub-toxic pesticide exposure. Cell Host & Microbe. 27 (2), 213-224 (2020).
- Shin, S. C., et al. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science. 334 (6056), 670-674 (2011).
- Storelli, G., et al. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing. Cell Metabolism. 14 (3), 403-414 (2011).
- Salem, H., et al. Vitamin supplementation by gut symbionts ensures metabolic homeostasis in an insect host. Proceedings. Biological Sciences. 281 (1796), 20141838 (2014).
- Koch, H., Schmid-Hempel, P. Socially transmitted gut microbiota protect bumble bees against an intestinal parasite. Proceedings of the National Academy of Sciences of the United States of America. 108 (48), 19288-19292 (2011).
- Cirimotich, C. M., et al. Natural microbe-mediated refractoriness to Plasmodium infection in Anopheles gambiae. Science. 332 (6031), 855-858 (2011).
- Kaltenpoth, M., Gottler, W., Herzner, G., Strohm, E. Symbiotic bacteria protect wasp larvae from fungal infestation. Current Biology. 15 (5), 475-479 (2005).
- Yuan, C., Xing, L., Wang, M., Hu, Z., Zou, Z. Microbiota modulates gut immunity and promotes baculovirus infection in Helicoverpa armigera. Insect Science. , (2021).
- Dillon, R. J., Vennard, C. T., Charnley, A. K. Pheromones - Exploitation of gut bacteria in the locust. Nature. 403 (6772), 851 (2000).
- Xu, L. T., Lou, Q. Z., Cheng, C. H., Lu, M., Sun, J. H. Gut-associated bacteria of Dendroctonus valens and their involvement in verbenone production. Microbial Ecology. 70 (4), 1012-1023 (2015).
- Schretter, C. E., et al. A gut microbial factor modulates locomotor behaviour in Drosophila. Nature. 563 (7731), 402-406 (2018).
- Jia, Y., et al. Gut microbiome modulates Drosophila aggression through octopamine signaling. Nature Communications. 12 (1), 2698 (2021).
- Ma, M., et al. Metabolic and immunological effects of gut microbiota in leaf beetles at the local and systemic levels. Integrative Zoology. 16 (3), 313-323 (2021).
- Xu, L., et al. Synergistic action of the gut microbiota in environmental RNA interference in a leaf beetle. Microbiome. 9 (1), 98 (2021).
- Xu, L., et al. Gut microbiota in an invasive bark beetle infected by a pathogenic fungus accelerates beetle mortality. Journal of Pest Science. 92, 343-351 (2019).
- Berasategui, A., Shukla, S., Salem, H., Kaltenpoth, M. Potential applications of insect symbionts in biotechnology. Applied Microbiology and Biotechnology. 100 (4), 1567-1577 (2016).
- Tikhe, C. V., Martin, T. M., Howells, A., Delatte, J., Husseneder, C. Assessment of genetically engineered Trabulsiella odontotermitis as a 'Trojan Horse' for paratransgenesis in termites. BMC Microbiology. 16 (1), 202 (2016).
- Wang, S., et al. Fighting malaria with engineered symbiotic bacteria from vector mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12734-12739 (2012).
- Leonard, S. P., et al. Engineered symbionts activate honey bee immunity and limit pathogens. Science. 367 (6477), 573-576 (2020).
- Kietz, C., Pollari, V., Meinander, A. Generating germ-free Drosophila to study gut-microbe interactions: protocol to rear Drosophila under axenic conditions. Current Protocols in Toxicology. 77 (1), 52 (2018).
- Brummel, T., Ching, A., Seroude, L., Simon, A. F., Benzer, S. Drosophila lifespan enhancement by exogenous bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12974-12979 (2004).
- Correa, M. A., Matusovsky, B., Brackney, D. E., Steven, B. Generation of axenic Aedes aegypti demonstrate live bacteria are not required for mosquito development. Nature Communications. 9 (1), 4464 (2018).
- Romoli, O., Schonbeck, J. C., Hapfelmeier, S., Gendrin, M. Production of germ-free mosquitoes via transient colonisation allows stage-specific investigation of host-microbiota interactions. Nature Communications. 12 (1), 942 (2021).
- Berasategui, A., et al. Gut microbiota of the pine weevil degrades conifer diterpenes and increases insect fitness. Molecular Ecology. 26 (15), 4099-4110 (2017).
- Lin, X. L., Kang, Z. W., Pan, Q. J., Liu, T. X. Evaluation of five antibiotics on larval gut bacterial diversity of Plutella xylostella (Lepidoptera: Plutellidae). Insect Science. 22 (5), 619-628 (2015).
- Muhammad, A., Habineza, P., Hou, Y., Shi, Z. Preparation of red palm weevil Rhynchophorus Ferrugineus (Olivier) (Coleoptera: Dryophthoridae) germ-free larvae for host-gut microbes interaction studies. Bio-protocol. 9 (24), 3456 (2019).
- Gelman, D. B., Bell, R. A., Liska, L. J., Hu, J. S. Artificial diets for rearing the Colorado potato beetle, Leptinotarsa decemlineata. Journal of Insect Science. 1, 7 (2001).
- Bengtson, D. A. A comprehensive program for the evaluation of artificial diets. Journal of the World Aquaculture Society. 24 (2), 285-293 (2007).
- Utsumi, S., Ando, Y., Ohgushi, T. Evolution of feeding preference in a leaf beetle: the importance of phenotypic plasticity of a host plant. Ecology Letters. 12 (9), 920-929 (2009).
- Ishihara, M., Ohgushi, T. Reproductive inactivity and prolonged developmental time induced by seasonal decline in host plant quality in the willow leaf beetle Plagiodera versicolora (Coleoptera: Chrysomelidae). Environmental Entomology. 35 (2), 524-530 (2006).
- Bright, M., Bulgheresi, S. A complex journey: transmission of microbial symbionts. Nature Reviews: Microbiology. 8 (3), 218-230 (2010).
- Hassan, B., Siddiqui, J. A., Xu, Y. Vertically transmitted gut bacteria and nutrition influence the immunity and fitness of Bactrocera dorsalis larvae. Frontiers in Microbiology. 11, 596352 (2020).
- Hosokawa, T., et al. Obligate bacterial mutualists evolving from environmental bacteria in natural insect populations. Nature Microbiology. 1, 15011 (2016).
- Habineza, P., et al. The promoting effect of gut microbiota on growth and development of red palm weevil, Rhynchophorus ferrugineus (Olivier) (Coleoptera: Dryophthoridae) by modulating its nutritional metabolism. Frontiers in Microbiology. 10, 1212 (2019).
- Meilan, R., Ma, C. Poplar (Populus spp.). Methods in Molecular Biology. 344, 143-151 (2006).
- Wani, Z. A., Ashraf, N., Mohiuddin, T., Riyaz-Ul-Hassan, S. Plant-endophyte symbiosis, an ecological perspective. Applied Microbiology and Biotechnology. 99 (7), 2955-2965 (2015).
- Grout, B. W. Meristem-tip culture. Methods in Molecular Biology. 6, 81-91 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon