Method Article
Preparazione e allevamento di insetti axenici con piantine coltivate su tessuto per studi di interazione microbiota ospite-intestino dello scarabeo fogliare
In questo articolo
Riepilogo
Per ottenere un insetto ascianico, la sua superficie dell'uovo viene sterilizzata e la larva tratteggiata viene successivamente allevata usando foglie astronche. Questo metodo fornisce un modo efficiente per la preparazione degli insetti axenici senza somministrare antibiotici o sviluppare una dieta artificiale, che può essere applicata anche ad altri insetti mangiatori di foglie.
Abstract
Le viscere degli insetti sono colonizzate da diversi batteri che possono avere un impatto profondo sui tratti fisiologici dell'ospite. L'introduzione di un particolare ceppo batterico in un insetto astronico è un metodo potente per verificare la funzione microbica intestinale e chiarire i meccanismi alla base delle interazioni tra microbi intestinali e ospiti. La somministrazione di antibiotici o la sterilizzazione delle superfici delle uova sono due metodi comunemente usati per rimuovere i batteri intestinali dagli insetti. Tuttavia, oltre ai potenziali effetti avversi degli antibiotici sugli insetti, studi precedenti hanno indicato che l'alimentazione di antibiotici non poteva eliminare i batteri intestinali. Pertanto, le diete artificiali prive di germi sono generalmente impiegate per mantenere gli insetti ascinici, che è un processo noioso e laborioso che non può assomigliare completamente ai componenti nutrizionali nel cibo naturale. Qui è descritto un protocollo efficiente e semplice per preparare e mantenere le larve axeniche di uno scarabeo fogliare (Plagiodera versicolora). In particolare, le superfici delle uova di coleottero sono state sterilizzate, in seguito alle quali sono state utilizzate foglie di pioppo prive di germi per allevare larve astronche. Lo stato astronico degli insetti è stato ulteriormente confermato attraverso saggi dipendenti dalla cultura e indipendenti dalla coltura. Collettivamente, combinando la disinfezione delle uova e la coltivazione priva di germi, è stato sviluppato un metodo efficiente e conveniente per ottenere L. versicolora axenico, fornendo uno strumento facilmente trasferibile per altri insetti mangiatori di foglie.
Introduzione
Simile ai mammiferi, il tratto digestivo degli insetti è una cavità per la digestione e l'assorbimento del cibo. La maggior parte degli insetti ospita diversi batteri commensali che prosperano nelle loro viscere e vivono di nutrizione fornita dagli ospiti1. La comunità commensale intestinale ha un profondo impatto su molteplici processi fisiologici negli insetti, tra cui digestione e disintossicazione degli alimenti 2,3,4, nutrizione e sviluppo 5,6,7, difesa contro agenti patogeni e parassiti 8,9,10,11, comunicazione chimica12,13 e comportamenti 14 ,15. Curiosamente, alcuni microbiota intestinali possono essere facoltativamente patogeni o essere manipolati da agenti patogeni invasori per aggravare l'infezione, indicando che i batteri intestinali possono essere dannosi in alcuni casi 16,17,18. I batteri intestinali possono anche servire come risorsa microbica per applicazioni biotecniche e gestione dei parassiti. Ad esempio, i batteri che digeriscono la lignocellulosa da insetti fitofagi e xilofagi sono stati utilizzati per digerire le cellule vegetali per lo sviluppo di biocarburanti19. La dispersione di simbionti intestinali ingegnerizzati che esprimono molecole bioattive è una tattica nuova e promettente per gestire l'agricoltura e i parassiti forestali e le zanzare che trasmettono malattie infettive 19,20,21, che può anche essere utilizzata per migliorare la forma fisica degli insetti benefici 22. Illustrare come si comporta un batterio intestinale in vivo è quindi considerato una priorità per sfruttarne appieno la funzione e sfruttarlo ulteriormente per varie applicazioni.
Gli animali possono ospitare da 1 a >1000 specie microbiche simbiotiche nell'intestino1. Di conseguenza, è difficile verificare con precisione come i singoli taxa batterici o il loro assemblaggio si comportano all'interno di un animale e se l'ospite o i suoi partner microbici guidano una funzione specifica. Pertanto, preparare le larve astrone per ottenere insetti gnotobiotici mediante colonizzazione mono- o multi-specie è necessario per studiare la funzione batterica e l'interazione con gli insetti23. Allo stato attuale, la somministrazione di cocktail antibiotici e la sterilizzazione della superficie delle uova di insetti sono metodi comuni per rimuovere i batteri intestinali 14,24,25,26. Tuttavia, le diete antibiotiche non possono eliminare completamente i batteri intestinali e hanno un effetto negativo sulla fisiologia degli insetti ospiti27,28. Di conseguenza, l'uso di insetti trattati con antibiotici può oscurare le vere capacità di alcuni batteri intestinali. Fortunatamente, la sterilizzazione superficiale delle uova può negare questo problema 23,29, che non ha effetti o trascurabili sugli insetti sperimentali. Inoltre, le diete artificiali non possono assomigliare completamente al cibo naturale degli insetti e lo sviluppo di una dieta artificiale è un processo costoso e laborioso30,31.
Il coleottero delle foglie di salice, Plagiodera versicolora (Laicharting) (Coleoptera: Chrysomelidae), è un diffuso parassita che si nutre principalmente di alberi salicacei, come salici (Salix) e pioppo (Populus L.) 32,33. Qui, lo scarabeo delle foglie di salice è stato usato come insetto rappresentativo mangiatore di foglie per sviluppare un protocollo per preparare e allevare un insetto privo di germi. Abbiamo sfruttato la coltura di tessuti vegetali per ottenere foglie di pioppo prive di germi per allevare larve axeniche di P. versicolora da uova sterilizzate. Lo stato astronico delle larve di P. versicolora è stato verificato tramite saggi dipendenti dalla cultura e indipendenti dalla cultura. Questo protocollo può mantenere gli insetti ascinici che imitano meglio la condizione selvaggia rispetto all'allevamento di insetti con una dieta artificiale. Ancora più importante, questo metodo è conveniente a un costo molto basso, il che aumenta la fattibilità di ottenere insetti axenici per futuri studi di interazione microbiota insetto-intestino, specialmente per insetti non modello senza diete artificiali ben sviluppate.
Protocollo
1. Allevamento di insetti
- Mantenere la popolazione di P. versicolora in una camera di crescita a 27 °C e 70 ± 5% di umidità relativa con un fotoperiodo di 16 ore di luce/8 ore di buio. Mettili in scatole di plastica perforate con carta assorbente bagnata piastrellata e dai loro da mangiare rami di pioppo freschi. Spruzzare acqua pulita sulla carta assorbente per mantenere l'umidità e cambiare i rami ogni due giorni.
- Isolare gli adulti per l'ovodeposizione dopo la pupa. Dai loro da mangiare foglie tenere per ottenere più uova.
- Raccogli le uova appena deposte (entro 24 ore). Posizionare le uova su carta assorbente umida per 60 ore per preparare le larve axeniche.
NOTA: le uova appena deposte si schiuderanno dopo ~ 72 h. Il momento migliore per sterilizzare le superfici delle uova è il giorno prima della schiusa; altrimenti, il numero di uova schiuse con successo diminuirà.
2. Coltivazione di pioppi senza germi
- Preparare le soluzioni stock di Acido acetico (NAA) medio Murashige e Skoog (MS) e 1 mg/mL di acido acetico α-naftalene (NAA) (vedere la tabella dei materiali).
- In una cappa di biosicurezza, aggiungere 50 μL di soluzione madre NAA da 1 mg/mL a 500 mL di MS medium, agitare per mescolare bene e versare ~ 50 mL per contenitore di coltura tissutale e attendere la solidificazione.
- Preparare bisturi, lampada alcolica e pinza; sterilizzare i bisturi e le pinze nella fiamma della lampada ad alcool nella cappa di biosicurezza.
- Tagliare segmenti di stelo di 3-4 cm con gemme apicali o gemme laterali da piantine di pioppo a ~ 1 mese di crescita (piantine coltivate con tessuto privo di germi) e inserirli nel terreno di coltura, uno o due segmenti di gambo per contenitore.
- Incubare questi segmenti di stelo in una camera di crescita a 25 °C e 50 ± intensità luminosa di 10 cd con un fotoperiodo di 16 ore di luce/8 ore di buio per circa 30 giorni. Usa le foglie prive di germi per nutrire le larve asferiche.
3. Sterilizzazione superficiale delle uova e allevamento di larve axeniche
- Piastre di Petri in autoclave, pennelli, carta da filtro, acqua distillata e una capsula di Petri contenente LB (Luria-Bertani) agar medium.
- Metti le foglie con uova aderenti in una capsula di Petri, rimuovi con cura le uova dalle foglie usando una pinza e trasferiscile in un'altra capsula di Petri.
NOTA: Questo passaggio deve essere eseguito con molta attenzione perché le uova sono aderenti alle foglie. - Lavare queste uova con etanolo al 75% per 8 minuti e ripetere il lavaggio quattro volte con acqua sterile.
- Trasferire le uova sul mezzo LB agar per preservare l'umidità per la schiusa.
NOTA: L'uso di lb agar medium può aiutare a verificare se l'uovo disinfettato è privo di germi. - Posizionare la capsula di Petri in una camera di crescita e attendere che le uova si schiudano entro 24 ore.
- In una cappa di biosicurezza, piastrellare tre pezzi di carta da filtro bagnata in una capsula di Petri, posizionare foglie di pioppo prive di germi sulla carta, raccogliere le larve e posizionarle sulle foglie, sigillare la capsula di Petri con parafilm e incubarle in una camera di crescita a 27 ° C e 70 ± 5% di umidità relativa con un fotoperiodo di 16 ore di luce / 8 ore di buio.
NOTA: Le foglie coltivate con tessuti sono delicate e possono perdere acqua rapidamente. Pertanto, l'uso di carta da filtro umida è necessario quando si trasferiscono le foglie nella capsula di Petri. - Cambia le foglie ogni due giorni.
- Per i gruppi allevati convenzionalmente, trasferire le uova dalle foglie a una capsula di Petri contenente carta da filtro umida e nutrire queste larve con foglie di pioppo prive di germi.
4. Verifica delle larve astoniche con saggi dipendenti dalla coltura
- Seleziona casualmente tre larve 1°, 2° e 3° instar dai gruppi privi di germi e allevati convenzionalmente.
- Seziona le 3larve di instar con forbici sterili e pinze sotto uno stereomicroscopio e raccogli le loro viscere in tubi microcentrifuga. Raccogli intatte le larve di 1° e 2° instar in tubi.
NOTA: Raccogli intere larve 1° e 2° instar in quanto sono troppo piccole per essere sezionate e mantieni intatte le loro viscere. - Aggiungere 100 μL di soluzione salina tamponata con fosfato e tre sfere di acciaio in tubi da 1,5 mL e macinare i tessuti in omogeneizzati usando un omogeneizzatore che batte le perline.
- Aggiungere 100 μL di omogeneizzato al mezzo e alla piastra LB agar utilizzando un'asta sterile per la diffusione del vetro.
- Posizionare le piastre a 37 °C per 24 ore e osservare le colonie batteriche.
5. Verifica di individui axenici con saggi indipendenti dalla cultura
- Estrarre il DNA totale dei tessuti (ottenuto nella sezione 4) utilizzando un kit di estrazione del DNA.
- Misurare la concentrazione di DNA utilizzando uno spettrofotometro a 260 nm.
- Amplificare il gene rRNA batterico 16S utilizzando primer rRNA 16S universali con PCR. Impostare il sistema di reazione con 18 μL di miscela master PCR 1,1x (vedere la tabella dei materiali), 0,5 μL di primer 27F (5'-ACGGATACCTTGTTACGAC-3'), 0,5 μL di primer 1495R (5'-ACGGATACCTTGTTACGAC-3') e 100 ng di DNA modello. Impostare le condizioni PCR a 95 °C per 3 min; 28 cicli di 95 °C per 30 s, 55 °C per 1 min e 72 °C per 1 min; seguito da 72 °C per 10 min. Conservare i prodotti PCR a 4 °C fino a ulteriori analisi.
- Mescolare i prodotti PCR con colorante acido nucleico e analizzarli utilizzando l'elettroforesi su un gel di agarosio all'1% in 1x tampone TAE. Utilizzare 10 μL di un marcatore del DNA come riferimento.
- Osservare il gel con un transilluminatore UV e cercare il frammento target intorno a 1.500 bp.
Risultati
Le fasi di vita di P. versicolora sono mostrate nella Figura 1. Il maschio adulto è più piccolo della femmina adulta (Figura 1A). Nel campo, lo scarafaggio raggruppa le sue uova su una foglia; qui, quattro uova sono state staccate da una foglia (Figura 1B). I segmenti e le piantine di stelo di pioppo utilizzati per l'allevamento di insetti axenici sono mostrati nella Figura 2. L'intestino di una3a larva instar è mostrato nella Figura 3 e i segmenti intestinali sono contrassegnati con parentesi bianche.
Sebbene non siano state osservate colonie batteriche in nessun gruppo privo di germi, sono state osservate in tutti i gruppi allevati convenzionalmente (Figura 4), indicando che le larve di uova sterilizzate che sono state alimentate con foglie di pioppo coltivate con tessuti non contengono batteri. Le bande PCR ~ 1.500 bp sono apparse in tutti i gruppi allevati convenzionalmente. Al contrario, non è stata osservata alcuna banda nei gruppi privi di germi o nel controllo negativo (Figura 5), il che implica che non esistevano batteri intestinali nelle larve astroniche. Non c'erano differenze nel tempo di sviluppo larvale, nel tasso di sopravvivenza o nell'aspetto tra larve di P. versicolora prive di germi e allevate convenzionalmente. Tuttavia, la massa corporea delle larve prive di germi era leggermente superiore a quella delle larve allevate convenzionalmente il 5° giorno, anche se le masse diventeranno simili prima della pupa16. Questi risultati hanno confermato la fattibilità di questo protocollo per preparare e allevare larve axeniche.

Figura 1: Fasi di vita dello scarabeo foglia di salice, Plagiodera versicolora. (A) Adulti femmine e maschi; B) uova; (C)1a larva instar; D)2a larva instar; (E)3a larva instar; e (F) pupa. Barre della scala = 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Segmenti e piantine di stelo di pioppo. (A) Segmenti di stelo con gemme apicali; (B) i segmenti dello stelo hanno fatto crescere le radici dopo 10 giorni; C) una piantina di un mese. Barre della scala = 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: L'intestino di una larva di terza stella. Foregut, midgut e hindgut sono etichettati con parentesi. Barra della scala = 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Conferma dell'efficacia dell'eliminazione dei batteri intestinali coltivando omogenati intestinali o interi insetti su piastre di agar LB. Non sono stati osservati batteri nelle larve alimentate con foglie di pioppo prive di germi, mentre i batteri sono stati osservati in gruppi allevati convenzionalmente. Per il test sono state utilizzate larve di1a,2a e 3a instar. Tre larve sono state selezionate casualmente in ciascun gruppo. Abbreviazioni: GF = larve prive di germi; CR = larve allevate convenzionalmente. Fare clic qui per visualizzare una versione più grande di questa figura.
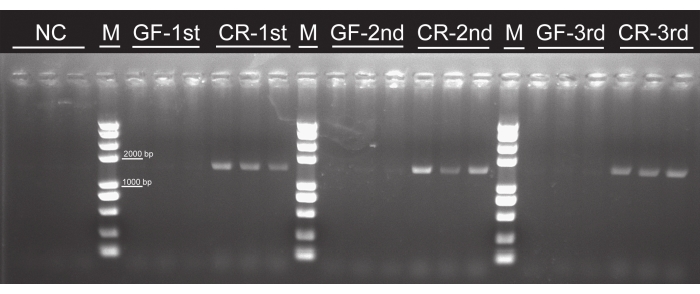
Figura 5: Conferma dell'efficacia dell'eliminazione dei batteri intestinali mediante test PCR utilizzando primer universali del gene rRNA 16S. La banda target del gene rRNA 16S è ~ 1.500 bp. 1st, 2nd e3nd instar larvae sono state utilizzate per il test. Nessuna banda bersaglio è stata osservata nei gruppi GF. Abbreviazioni: NC = controllo negativo; GF = privo di germi; CR = allevato convenzionalmente. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La preparazione di larve prive di germi e l'ottenimento di larve gnotobiotiche reintroducendo specifici ceppi batterici sono metodi potenti per chiarire i meccanismi alla base delle interazioni ospite-microbo. Le larve appena nate ottengono il microbiota intestinale in due modi principali: trasmissione verticale dalla madre alla prole o acquisizione orizzontale dai fratelli e dall'ambiente34. Il primo può essere soddisfatto dal trasferimento dei genitori alla prole attraverso la contaminazione della superficie dell'uovo35. Pertanto, è altamente fattibile ottenere larve axeniche sterilizzando le superfici delle uova di insetto 27,28,29. La somministrazione di un cocktail di diversi antibiotici è un altro modo per sviluppare insetti astonici, ma presenta diversi svantaggi28. Al contrario, la sterilizzazione della superficie dell'uovo seguita da una dieta axenica è migliore per lo sviluppo di insetti axenici 23,28,29.
Le uova della maggior parte dei coleotteri che consumano foglie sono visibili, facilmente acquisibili e semplici da disinfettare. Questo è il motivo principale per cui un reagente semplice (75% di etanolo) e un tempo più breve (8 min) sono stati utilizzati per la disinfezione rispetto a studi simili (ad esempio, 40 minuti di disinfezione delle uova per lo stinkbug Plautia stali con il 75% di etanolo e formaldeide per ottenere insetti astonici; 6 minuti di sterilizzazione superficiale dell'uovo di Drosophila con 1% di cloro attivo e 75% di etanolo; e 10 minuti di sterilizzazione superficiale dell'uovo del punteruolo rosso Rhynchophorus ferrugineus con il 10% di ipoclorito di sodio soluzione)23,29,36. Per le specie di insetti con uova minuscole, l'uso di disinfettanti e la durata della sterilizzazione devono essere ottimizzati in quanto il trattamento può avere un impatto significativo sui risultati.
In alcuni casi, le diete artificiali prive di germi sono impiegate per l'allevamento di insetti axenici dopo la sterilizzazione della superficie delle uova29,37. Tuttavia, lo sviluppo di una dieta artificiale adatta per gli insetti è un processo noioso e laborioso. I nutrienti nella dieta influenzano ampiamente la fisiologia degli insetti (ad esempio, tempo di sviluppo, immunità) e il microbiota intestinale 6,35. Pertanto, una dieta artificiale qualificata per un insetto dovrebbe contenere una composizione nutrizionale simile al cibo naturale, che è difficile da raggiungere, specialmente per gli insetti fitofagi. In questo protocollo, abbiamo nutrito gli insetti con piante ospiti axeniche, che superano le carenze di una dieta artificiale. È importante sottolineare che, come con la pianta di pioppo utilizzata qui, non è nemmeno difficile ottenere piantine coltivate con tessuti da molte colture economicamente importanti come tabacco, patate, pomodori, grano e riso mediante sterilizzazione superficiale dei semi o disinfezione della sezione dello stelo38. Da notare, le endofite nelle piante possono esistere nelle piantine coltivate con tessuti39 e possono essere eliminate attraverso la tecnologia di coltura del meristema della punta del germoglio40. In conclusione, questo protocollo fornisce un nuovo metodo per mantenere gli insetti privi di germi, che è uno strumento utile per facilitare gli studi di interazione insetto-batteri intestinali.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo lavoro è stato finanziato dalla National Natural Science Foundation of China (31971663) e dal Young Elite Scientists Sponsorship Program di CAST (2020QNRC001).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filters | Millipore | SLGP033RB | |
| 1 mg/mL NAA stock solution | a. Prepare 0.1 M NaOH solution (dissolve 0.8 g NaOH in 200 mL of distilled water). b. Add 0.2 g NAA in a 250 mL beaker, add little 0.1 M NaOH solution until NAA dissolved, and adjust the final volume to 200 mL with distilled water. c. Filter the solution to remove bacteria with a 0.22 µm syringe filter and a 50 mL sterile syringe, subpackage the solution in 1.5 mL centrifuge tubes and restore at -20 °C. | ||
| 1.5 mL microcentrifuge tubes | Sangon Biotech | F600620 | |
| 10x PBS stock solution | Biosharp Life Sciences | BL302A | |
| 2 M KOH solution | Dissolve 22.44 g KOH (molecular weight: 56.1) in 200 mL of distilled water and autoclave it for 20 min at 121 °C. | ||
| 250 mL and 2,000 mL beakers | Shubo | sb16455 | |
| 50 mL sterile syringes | Jinta | JT0125789 | |
| 500 mL measuring cylinder | Shubo | sb1601 | |
| 50x TAE stock solution | a. Dissolve 242 g Tris and 18.612 g EDTA in 700 mL of distilled water. b. Adjust pH to 7.8 with about 57.1 mL of acetic acid. c. Adjust the final volume to 1,000 mL. d. The stock solution was diluted to 1x TAE buffer when used. | ||
| 75% ethanol | Xingheda trade | ||
| α-naphthalene acetic acid (NAA) | Solarbio Life Sciences | 86-87-3 | |
| Absorbing paper | 22.3 cm x 15.3 cm x 9 cm | ||
| Acetic acid | Sinopharm Chemical Reagent Co. Ltd | ||
| Agar | Coolaber | 9002-18-0 | |
| Agarose | Biowest | 111860 | |
| Autoclave | Panasonic | MLS-3781L-PC | |
| Bead-beating homogenizer | Jing Xin | XM-GTL64 | |
| DNA extraction kit | MP Biomedicals | 116560200 | |
| EDTA | Saiguo Biotech | 1340 | |
| Filter paper | Jiaojie | 70 mm diameter | |
| Gel electrophoresis unit | Bio-rad | 164-5052 | |
| Gel Signal Green nucleic acid dye | TsingKe | TSJ003 | |
| Germ-free poplar seedlings | Shan Xin poplar from Ludong University in Shandong Province | ||
| Golden Star Super PCR Master Mix (1.1×) | TsingKe | TSE101 | |
| Growth chamber | Ruihua | HP400GS-C | |
| LB agar medium | a. Dissolve 5 g tryptone, 5 g NaCl, 2.5 g yeast extract in 300 mL of distilled water. b. Adjust the final volume to 500 mL, transfer the solution to a 1,000 mL conical flask, and add 7.5 g agar. c. Autoclave the medium for 20 min at 121 °C. | ||
| Mini centrifuge | DRAGONLAB | D1008 | |
| MS basic medium | Coolaber | PM1121-50L | M0245 |
| MS solid medium for germ-free poplar seedling culture | a. Dissolve 4.43 g MS basic medium powder and 30 g sucrose in 800 mL of distilled water. b. Adjust the pH to about 5.8 with 2 M KOH by a pH meter. c. Adjust the final volume to 1,000 mL, separate into two parts, transfer into two 1,000 mL conical flasks, and add 2.6 g agar per 500 mL. d. Autoclave for 20 min at 121 °C. | ||
| NanoDrop 1000 spectrophotometer | Thermo Fisher Scientific | ||
| Paintbrush | 1 cm width, used to collect the eggs | ||
| Parafilm | Bemis | PM-996 | |
| PCR Thermal Cyclers | Eppendorf | 6331000076 | |
| Petri dishes | Supin | 90 mm diameter | |
| pH meter | METTLER TOLEDO | FE20 | |
| Pipettes 0.2-2 µL | Gilson | ECS000699 | |
| Pipettes 100-1,000 µL | Eppendorf | 3120000267 | |
| Pipettes 20-200 µL | Eppendorf | 3120000259 | |
| Pipettes 2-20 µL | Eppendorf | 3120000232 | |
| Plant tissue culture container | Chembase | ZP21 | 240 mL |
| Plastic box | 2.35 L | ||
| Potassium hydroxide (KOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Primers for amplifying the bacterial 16S rRNA gene | Sangon Biotech | 27-F: 5’-ACGGATACCTTGTTACGAC-3’, 1492R: 5’-ACGGATACCTTGTTACGAC-3’ | |
| Sodium chloride (NaCl) | Sinopharm Chemical Reagent Co. Ltd | ||
| Sodium hydroxide (NaOH) | Sinopharm Chemical Reagent Co. Ltd | ||
| Steel balls | 0.25 mm | used to grind tissues | |
| Stereomicroscope | OLYMPUS | SZ61 | |
| Sucrose | Sinopharm Chemical Reagent Co. Ltd | ||
| Trans2K plus II DNA marker | Transgene Biotech | BM121-01 | |
| Tris base | Biosharp Life Sciences | 1115 | |
| Tryptone | Thermo Fisher Scientific | LP0037 | |
| UV transilluminator | Monad Biotech | QuickGel 6100 | |
| Vortexer | Scilogex | MX-S | |
| Willow branches | Sha Lake Park, Wuhan, China | ||
| Willow leaf beetle | Huazhong Agricultural University, Wuhan, China | ||
| Yeast extract | Thermo Fisher Scientific | LP0021 |
Riferimenti
- Moran, N. A., Ochman, H., Hammer, T. J. Evolutionary and ecological consequences of gut microbial communities. Annual Review of Ecology, Evolution, and Systematics. 50 (1), 451-475 (2019).
- Warnecke, F., et al. Metagenomic and functional analysis of hindgut microbiota of a wood-feeding higher termite. Nature. 450 (7169), 560-565 (2007).
- Tokuda, G., et al. Fiber-associated spirochetes are major agents of hemicellulose degradation in the hindgut of wood-feeding higher termites. Proceedings of the National Academy of Sciences of the United States of America. 115 (51), 11996-12004 (2018).
- Wang, G. H., et al. Changes in microbiome confer multigenerational host resistance after sub-toxic pesticide exposure. Cell Host & Microbe. 27 (2), 213-224 (2020).
- Shin, S. C., et al. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science. 334 (6056), 670-674 (2011).
- Storelli, G., et al. Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing. Cell Metabolism. 14 (3), 403-414 (2011).
- Salem, H., et al. Vitamin supplementation by gut symbionts ensures metabolic homeostasis in an insect host. Proceedings. Biological Sciences. 281 (1796), 20141838 (2014).
- Koch, H., Schmid-Hempel, P. Socially transmitted gut microbiota protect bumble bees against an intestinal parasite. Proceedings of the National Academy of Sciences of the United States of America. 108 (48), 19288-19292 (2011).
- Cirimotich, C. M., et al. Natural microbe-mediated refractoriness to Plasmodium infection in Anopheles gambiae. Science. 332 (6031), 855-858 (2011).
- Kaltenpoth, M., Gottler, W., Herzner, G., Strohm, E. Symbiotic bacteria protect wasp larvae from fungal infestation. Current Biology. 15 (5), 475-479 (2005).
- Yuan, C., Xing, L., Wang, M., Hu, Z., Zou, Z. Microbiota modulates gut immunity and promotes baculovirus infection in Helicoverpa armigera. Insect Science. , (2021).
- Dillon, R. J., Vennard, C. T., Charnley, A. K. Pheromones - Exploitation of gut bacteria in the locust. Nature. 403 (6772), 851 (2000).
- Xu, L. T., Lou, Q. Z., Cheng, C. H., Lu, M., Sun, J. H. Gut-associated bacteria of Dendroctonus valens and their involvement in verbenone production. Microbial Ecology. 70 (4), 1012-1023 (2015).
- Schretter, C. E., et al. A gut microbial factor modulates locomotor behaviour in Drosophila. Nature. 563 (7731), 402-406 (2018).
- Jia, Y., et al. Gut microbiome modulates Drosophila aggression through octopamine signaling. Nature Communications. 12 (1), 2698 (2021).
- Ma, M., et al. Metabolic and immunological effects of gut microbiota in leaf beetles at the local and systemic levels. Integrative Zoology. 16 (3), 313-323 (2021).
- Xu, L., et al. Synergistic action of the gut microbiota in environmental RNA interference in a leaf beetle. Microbiome. 9 (1), 98 (2021).
- Xu, L., et al. Gut microbiota in an invasive bark beetle infected by a pathogenic fungus accelerates beetle mortality. Journal of Pest Science. 92, 343-351 (2019).
- Berasategui, A., Shukla, S., Salem, H., Kaltenpoth, M. Potential applications of insect symbionts in biotechnology. Applied Microbiology and Biotechnology. 100 (4), 1567-1577 (2016).
- Tikhe, C. V., Martin, T. M., Howells, A., Delatte, J., Husseneder, C. Assessment of genetically engineered Trabulsiella odontotermitis as a 'Trojan Horse' for paratransgenesis in termites. BMC Microbiology. 16 (1), 202 (2016).
- Wang, S., et al. Fighting malaria with engineered symbiotic bacteria from vector mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12734-12739 (2012).
- Leonard, S. P., et al. Engineered symbionts activate honey bee immunity and limit pathogens. Science. 367 (6477), 573-576 (2020).
- Kietz, C., Pollari, V., Meinander, A. Generating germ-free Drosophila to study gut-microbe interactions: protocol to rear Drosophila under axenic conditions. Current Protocols in Toxicology. 77 (1), 52 (2018).
- Brummel, T., Ching, A., Seroude, L., Simon, A. F., Benzer, S. Drosophila lifespan enhancement by exogenous bacteria. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12974-12979 (2004).
- Correa, M. A., Matusovsky, B., Brackney, D. E., Steven, B. Generation of axenic Aedes aegypti demonstrate live bacteria are not required for mosquito development. Nature Communications. 9 (1), 4464 (2018).
- Romoli, O., Schonbeck, J. C., Hapfelmeier, S., Gendrin, M. Production of germ-free mosquitoes via transient colonisation allows stage-specific investigation of host-microbiota interactions. Nature Communications. 12 (1), 942 (2021).
- Berasategui, A., et al. Gut microbiota of the pine weevil degrades conifer diterpenes and increases insect fitness. Molecular Ecology. 26 (15), 4099-4110 (2017).
- Lin, X. L., Kang, Z. W., Pan, Q. J., Liu, T. X. Evaluation of five antibiotics on larval gut bacterial diversity of Plutella xylostella (Lepidoptera: Plutellidae). Insect Science. 22 (5), 619-628 (2015).
- Muhammad, A., Habineza, P., Hou, Y., Shi, Z. Preparation of red palm weevil Rhynchophorus Ferrugineus (Olivier) (Coleoptera: Dryophthoridae) germ-free larvae for host-gut microbes interaction studies. Bio-protocol. 9 (24), 3456 (2019).
- Gelman, D. B., Bell, R. A., Liska, L. J., Hu, J. S. Artificial diets for rearing the Colorado potato beetle, Leptinotarsa decemlineata. Journal of Insect Science. 1, 7 (2001).
- Bengtson, D. A. A comprehensive program for the evaluation of artificial diets. Journal of the World Aquaculture Society. 24 (2), 285-293 (2007).
- Utsumi, S., Ando, Y., Ohgushi, T. Evolution of feeding preference in a leaf beetle: the importance of phenotypic plasticity of a host plant. Ecology Letters. 12 (9), 920-929 (2009).
- Ishihara, M., Ohgushi, T. Reproductive inactivity and prolonged developmental time induced by seasonal decline in host plant quality in the willow leaf beetle Plagiodera versicolora (Coleoptera: Chrysomelidae). Environmental Entomology. 35 (2), 524-530 (2006).
- Bright, M., Bulgheresi, S. A complex journey: transmission of microbial symbionts. Nature Reviews: Microbiology. 8 (3), 218-230 (2010).
- Hassan, B., Siddiqui, J. A., Xu, Y. Vertically transmitted gut bacteria and nutrition influence the immunity and fitness of Bactrocera dorsalis larvae. Frontiers in Microbiology. 11, 596352 (2020).
- Hosokawa, T., et al. Obligate bacterial mutualists evolving from environmental bacteria in natural insect populations. Nature Microbiology. 1, 15011 (2016).
- Habineza, P., et al. The promoting effect of gut microbiota on growth and development of red palm weevil, Rhynchophorus ferrugineus (Olivier) (Coleoptera: Dryophthoridae) by modulating its nutritional metabolism. Frontiers in Microbiology. 10, 1212 (2019).
- Meilan, R., Ma, C. Poplar (Populus spp.). Methods in Molecular Biology. 344, 143-151 (2006).
- Wani, Z. A., Ashraf, N., Mohiuddin, T., Riyaz-Ul-Hassan, S. Plant-endophyte symbiosis, an ecological perspective. Applied Microbiology and Biotechnology. 99 (7), 2955-2965 (2015).
- Grout, B. W. Meristem-tip culture. Methods in Molecular Biology. 6, 81-91 (1990).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon